Method Article
Drosophila melanogasterにおける神経回路の光遺伝学的操作のための行動アッセイ
* これらの著者は同等に貢献しました
要約
この論文では、 Drosophila melanogasterにおける光遺伝学的操作の方法を提示し、CsChrimsonとGtACR2を利用して特定のニューロンを活性化および沈黙させます。オプトジェネティクスを利用してサーモタクティックおよび味覚行動を探索するための4つの実験が説明されており、これらのプロセスを支配する根底にある神経メカニズムについての洞察が得られます。
要約
光遺伝学は神経科学の基本的な技術となり、光刺激による神経細胞の活動の精密な制御を可能にしています。この研究では、 Drosophila melanogasterに光遺伝学的手法を適用するための実装が容易なセットアップを紹介します。2つの光遺伝学的ツール、CsChrimson(赤色光活性化陽イオンチャネル)とGtACR2(青色光活性化陰イオンチャネル)を4つの実験的アプローチで使用しました。これらのアプローチのうちの3つは、シングルフライ実験を含みます:(1)温度感受性加熱細胞を標的とする青色光光光学的熱硬化性位置選好アッセイ、(2)苦味感知ニューロンを活性化する赤色光光遺伝学的位置選好アッセイ、および(3)甘味感知ニューロンを活性化する吻延長応答アッセイ。4番目のアプローチ(4)は、複数のハエを使用して回避行動を評価するためのハエの迷路のセットアップです。神経活動を時間的および空間的に操作する能力は、感覚処理と意思決定に関する強力な洞察を提供し、神経機能に関する知識を進歩させるオプトジェネティクスの可能性を強調しています。これらの方法は、特定の神経経路とその行動結果の理解を深めるための神経科学の将来の研究のためのアクセス可能で堅牢なフレームワークを提供します。
概要
オプトジェネティクスは、神経科学における光学と遺伝学を組み合わせた強力な技術として登場し、光刺激1を通じて神経活動を正確かつ非侵襲的に制御することを可能にします。広く使用されているモデル生物であるDrosophila melanogasterでは、光遺伝学ツールにより特定のニューロンの活性化と阻害が可能になり、研究者は神経回路を調節することができます。使用されるツールの中で、CsChrimsonとGtACR(Guillardia theta anion channel rhodopsins)は、ニューロンターゲティングのための補完的なアプローチを提供します。緑藻類由来の赤色光感受性陽イオンチャネルであるCsChrimsonチャネルロドプシンは、赤色光にさらされると脱分極を通じてニューロンの活性化を促進し、ピークは約590 nm2で活性化します。CsChrimsonは、以前のチャネルロドプシンよりも優れた組織浸透を提供し、ショウジョウバエの研究における光誘発性行動アーチファクトを低減します2。対照的に、GtACR2などの変異体を含むGtACRは、過分極を通じてニューロンを沈黙させる光依存性塩化物チャネルである3,4。GtACR2は陰イオンを伝導し、青色光によって活性化され、約470nmのピーク活性化を示します4。CsChrimsonとGtACR2は、異なる波長の光によって活性化され、交差活性化なしにニューロン活動を正確かつ独立して制御することができます5。
ショウジョウバエは、その費用対効果、飼育の容易さ、および環境刺激に対する堅牢な行動反応(誘引行動や回避行動など)により、神経科学研究の効果的なモデルです6。その小さなサイズと半透明のキューティクルは、光、特に長波長の赤色光の透過性を高め、効率的な光遺伝学的操作を可能にします7,8。ショウジョウバエ細胞は、チャネルロドプシンの機能にとって重要な補因子である十分なレチナールを産生することができないが、レチナールを食事に加えることでこの制限を補い、光遺伝学的ツールの効果的な活性化を確保する9。
ショウジョウバエにおける光遺伝学的操作の影響を調査するために、異なる神経回路と行動を対象とした4つの実験について説明し、それぞれが回避または吸引反応を評価するための異なるモダリティを利用しています。ショウジョウバエの加熱セル(HC)は、アリスタに位置する熱感覚ニューロンであり、温度上昇に応答します10。これらのニューロンは、回避行動を引き起こす温暖感受性イオンチャネルを発現し、ハエを熱源から遠ざけるように誘導する10,11。アプローチ1では、HCニューロンを操作するために、シングルフライブルーライト光遺伝学的サーモタクティック位置選好アッセイを採用しました。これらのニューロンでGtACR2を発現させることで、青色光曝露時の神経細胞の活動を抑制しました。ハエは、25°Cと31°Cの2つの温度オプションに曝露されました。 室内の光の下では、ハエは31°C側を避け、典型的なサーモタクティクス反応を示しました。しかし、GtACR2の青色光活性化により、HCニューロンは沈黙しました。その結果、ハエは有意な温度選好を示さず、光遺伝学的阻害が成功したことを示唆しています。感覚ニューロンの機能を評価するだけでなく、下流の感覚ニューロンにおけるGtACR2の発現は、特定の感覚モダリティに必要な神経回路を研究するための同様の光遺伝学的操作を可能にする5。
ショウジョウバエの味覚受容体GR66aは、吻の遠位端にある唇触手唇と脚に発現し、苦味検出を媒介します12,13。これらのニューロンは、苦い物質に応答して回避行動を引き起こします。アプローチ2では、シングルフライ赤色光光遺伝学的位置選好アッセイを使用して、GR66a発現ニューロンを操作しました。これらのニューロンにCsChrimsonを発現させることで、赤色光曝露時にCsChrimsonを活性化しました。ハエは、半分が赤色光にさらされ、もう半分が赤色光をフィルタリングするアリーナに配置されました。赤い光がない場合、ハエは好みを示さなかった。しかし、CsChrimsonの赤色光による活性化は、苦味感知ニューロンを刺激し、その結果、照らされた領域が大幅に回避され、GR66aニューロンの光遺伝学的活性化が成功したことが確認されました。同様のアプローチを使用して、回避動作5に十分な加熱セルの下流回路を特定しています。
アプローチ3では、食欲行動の光遺伝学的活性化に着目した。GR5aを発現するニューロンは、ラベルと脚の味覚センシラに位置し、糖を検出し、摂食行動を促進します。これらのニューロンの活性化は、吻拡張応答(PER)14をトリガーします。GR5aニューロンを活性化するために、赤色光光遺伝学的テング伸長応答アッセイを使用しました。これらのニューロンにCsChrimsonを発現させることで、赤色光でニューロンを刺激しました。ハエは、室温が明るい条件下では吻を伸ばしませんでした。しかし、CsChrimsonの赤色光活性化は、甘い刺激なしで吻の広がりをもたらし、GR5aニューロンの光遺伝学的活性化が成功したことを示しています。このアプローチは、味覚感覚ニューロン、味覚投影ニューロン、およびテング運動ニューロン15,16を含む神経回路を調査するために使用されてきた。
アプローチ4では、GR66aニューロンを標的とした赤色光光遺伝学的ハエ迷路アッセイを用いて、ハエの群れにおける回避行動の光遺伝学的活性化を調査しました。ハエは2つのチューブの交点に配置されました:1つは赤色光で照らされ、もう1つは影付きです。GR66aニューロンにおけるCsChrimson発現は回避を引き起こした。赤色光がない場合、ハエは好ましくありませんでしたが、赤色光の活性化により、GR66aを発現するハエは赤色光を避けるようになり、経路の活性化が成功したことが示唆されました。フライ迷路アッセイは、温度、湿度、嗅覚など、さまざまな感覚モダリティの研究に広く使用されています。光遺伝学と組み合わせると、このアプローチは、誘引行動と回避行動の両方を調査するのに強力です17,18,19。
これらの方法は、 ショウジョウバエ の神経回路の光遺伝学的活性化と阻害を研究するための再現性のあるフレームワークを提供します。この概念実証研究は、さまざまなチャネルロドプシンとアクセス可能な行動アッセイの組み合わせを利用することにより、光遺伝学的操作の有効性を実証し、神経回路機能を操作する簡単な方法を提供し、神経科学研究におけるより広範な応用の可能性を提供します。
プロトコル
1.ひずみ、フライ飼育、フライアスピレーター
- ひずみとメンテナンス
- 実験に用いた菌株は、 HC-Gal410、 Gr5a-Gal420 (ブルーミントン ショウジョウバエ ストックセンター(BDSC):57592)、 Gr66a-Gal421 (BDSC:57670)、 UAS-GtACR23、 UAS-CsChrimson2 (BDSC:55136)です。リアは、標準的なコーンミール培地で25°Cで12時間のライト:12時間のダークサイクルで飛行します。
注:1 Lのコーンミール培地には、1 L dH2O、79 gのデキストロース、7.5 gの寒天、24 gのフレーク酵母、57 gのコーンミール、2.1 gのメチル-4-ヒドロキシ安息香酸(11.1 mLのエタノールに溶解)、6 gの酒石酸カリウム四水和物ナトリウム、および0.9 gの塩化カルシウムが含まれています。
- 実験に用いた菌株は、 HC-Gal410、 Gr5a-Gal420 (ブルーミントン ショウジョウバエ ストックセンター(BDSC):57592)、 Gr66a-Gal421 (BDSC:57670)、 UAS-GtACR23、 UAS-CsChrimson2 (BDSC:55136)です。リアは、標準的なコーンミール培地で25°Cで12時間のライト:12時間のダークサイクルで飛行します。
- ハエの飼育と実験準備
- 0〜3日齢のハエを並べ替えます。実験時までに、ハエは3〜6日齢になり、年齢に応じた一貫性が確保されます(図1A)。
- 実験を行う3日前に、各遺伝子型を4つのグループに分けます:ルームライトATR -、ルームライトATR +、レッドまたはブルーライトATR -、およびレッドまたはブルーライトATR +。
- ATRを100%エタノールに溶解して、80 mM ATRストック溶液を調製します。ATR +グループに400μM ATRを食品に補給します。
- ATRグループには、同じ濃度のエタノールをATRなしで食品に補給します。
- 暗闇の中ですべてのグループを22に後退させます。
- Starve Gr5a>CsChrimson は、湿った組織のみを含むバイアルで16〜24時間飛んでいきます。ATR +バイアルには400μMのATRが水と混合されており、ATR -バイアルには同濃度のエタノールと混合されたdH2Oが含まれています。
- フライアスピレーター
- プラスチックチューブ、防虫ネット、および2つの3 mLトランスファーピペットを使用して、フライアスピレーター(図1B)を組み立てます。
- トランスファーピペットの先端と球根をカットし、フライサクションチップがフライを快適に通過できるようにします。この設計により、吸入によるハエの穏やかな吸引が可能になり、害を最小限に抑え、個々のハエの効率的な収集と移動が容易になります。
- プラスチックチューブに防虫ネットをかぶせ、パラフィルムを使用してピペットの電球端をチューブに固定します。
2. シングルフライブルーライト光遺伝学的サーモタクティクス位置選好アッセイ
- ショウジョウバエ の系統とハエの飼育
- HC-Gal410 ドライバー ラインを UAS-GtACR23 に交差させると、実験的な遺伝子型 HC>GtACR2 が得られます。HC>GtACR2は、加熱セル内でGtACR2を発現します。
注:各条件でオスとメスのハエが同数であることを確認してください。
- HC-Gal410 ドライバー ラインを UAS-GtACR23 に交差させると、実験的な遺伝子型 HC>GtACR2 が得られます。HC>GtACR2は、加熱セル内でGtACR2を発現します。
- 実験アッセイのセットアップと実行
- 2つの鋼板を別々のホットプレートに揃えて、端が合うようにします。プラスチックシートプロテクターを上に置き、動きを最小限に抑えるためにテープで固定します。シートプロテクターに白い紙をセットして、バックグラウンドノイズ信号を低減します(図1C)。
注意: 各実験の開始時または汚れた場合は、ホワイトペーパーを交換してください。 - 白い紙の上に透明なプラスチックカバー(高さ2mm×幅58mm×長さ83mm)を置きます。このカバーにより、フライが飛ぶのを防ぎながら自由に歩くことができます。
- 発泡スチロール製の箱(高さ27cm×幅22cm×、長さ16cm)の底に穴を開けてカメラに付着させ、実験面から約12cm上の青色光(1,000mA)を付着させます。
- カメラとブルーライトを配置して、アクティベーションを有効にしながらまぶしさを最小限に抑えます。
注意: ブルーライトの活性化範囲を決定するために、事前テストが必要になる場合があります。 - カメラを次の設定で記録するように設定します:1秒のタイムラプス、ナローフィールド、4000×3000ピクセル。
- ホットプレートの設定を調整して、それぞれの鋼板の表面温度を25±1°Cおよび31±1°Cに保ちます。
注意: 25°C未満の温度を必要とする条件では、ペルチェ素子や氷などの代替冷却方法が必要です。鋼板の温度が目的のレベルを超える場合は、必要な条件を達成および維持するために、表面に蒸留水をスプレーします。次に、ナプキンを使用して、プラスチックシートプロテクターから余分な水分を吸収します。 - 各試行の前後に、表面温度プローブを使用して温度を監視します。
注:変動が結果に影響を与える可能性があるため、正確な温度制御は非常に重要です。 - プラスチックカバーを25°C側に置きます。ハエ吸引器を使用して、カバーの下に1つのハエをそっと放出します。ボックスを実験エリアの上に置いて薄暗い光(<10ルクス)を作り出し、ハエが1分間順応するのを待ちます。
- 順応期間が経過すると、ボックスを持ち上げてプラスチックカバーをすばやく調整し、カバーの中心を鋼板の境界に合わせるように配置して、25°Cと31°Cの側面を均一にカバーできるようにします。
注:このプロセス中に、気温と31°C側のカバー内の温度は、27秒以内に約5°Cに上昇し(補足図1)、加熱セル11を活性化するのに十分です。 - カメラとブルーライト(20 kLux)をオンにして、試用を開始します。
注意: 部屋の明るい場所では、青色のライトを点灯しないでください。カメラの電源を入れ、動きがある場合は青色のライトをオンにする前に、数フレームを記録してください。 - 2分以上経ったら、カメラとライトをオフにして試用期間を終了します。ハエは吸引器を使用して処分します。
注意: カメラの電源を切るときに動きが発生した場合に備えて、いくつかの追加のフレームを記録します。
- 2つの鋼板を別々のホットプレートに揃えて、端が合うようにします。プラスチックシートプロテクターを上に置き、動きを最小限に抑えるためにテープで固定します。シートプロテクターに白い紙をセットして、バックグラウンドノイズ信号を低減します(図1C)。
- 行動分析と統計分析
- 試験開始時に25°C側に留まったハエのデータのみを解析してください。
注:31°C側で試験を開始するハエからのデータを破棄します。これは、多くの場合、好みの変化を示します23。31°C側の端に近づかないハエを含む試験を破棄し、温度の選択を行ったことを確認します。30 秒以上静止しているフライのデータを破棄します。 - 前述の手順を使用して結果を分析します 23.次の式に示すように、フライが各温度ゾーンで費やした時間の差と合計時間の比率として、選好指数(PI)を計算します。
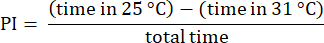
注:実験の統計的な詳細は、図の凡例に記載されています。データ解析は、適切なデータ解析ソフトウェアを使用して行います。
- 試験開始時に25°C側に留まったハエのデータのみを解析してください。
3. シングルフライ赤色光光遺伝学的位置選好アッセイ
- ショウジョウバエ の系統とハエの飼育
- Gr66a-Gal421ドライバーラインをUAS-CsChrimson2に交差させると、実験的な遺伝子型Gr66a>CsChrimsonが得られます。Gr66a>CsChrimsonフライは、苦味ニューロンでCsChrimsonを発現します。
注:各条件でオスとメスのハエが同数であることを確認してください。
- Gr66a-Gal421ドライバーラインをUAS-CsChrimson2に交差させると、実験的な遺伝子型Gr66a>CsChrimsonが得られます。Gr66a>CsChrimsonフライは、苦味ニューロンでCsChrimsonを発現します。
- 実験アッセイのセットアップと実行
- CsChrimsonの制御された活性化を確保するために、暗い部屋または暗い環境でアッセイを実施します(図1D)。
- 実験面から約45cm上にビデオカメラを配置します。
- 赤外線フィルターのないビデオカメラを使用してください。ビデオカメラに 700 nm を超える波長を遮断するショートパス赤外線フィルターが内蔵されている場合は、取り外します。
- 瞬間接着剤を使用してレンズに830nmのロングパスフィルターを接着し、赤外線波長を捕捉します。この調整は、赤外線条件下でのフライの動きを記録するために不可欠です。
- 赤色光源24 を実験面から約45cm上に配置して、約2.5kLux(1,000mA)の光強度を確保します。
注意: 赤色レーザー/光をカットできる適切な目の保護具をお勧めします。レーザー安全ゴーグルは、強い赤色光に直接さらされることによる目の損傷を防ぐのに役立ちます。 - 赤外線を使用して、セットアップ内のハエを視覚化します。実験中はオンのままにします。
注:赤外線による実験領域のまぶしさは避けてください。グレアはデータ分析を複雑にする可能性があります。 - 接着剤を使用して、780nmの赤外線ロングパスフィルターをプラスチックカバーの半分に取り付けます。
注意: 780nm未満の波長を遮断するロングパスフィルターを使用してください。フィルタリングされていない側は赤色光と赤外線を通過させますが、フィルタリングされた側は赤外線のみを通過させます。 - 実験領域の下に黒いつや消し材料を配置して、バックグラウンドノイズを最小限に抑えます。
- ハエ吸引器を使用して、透明なプラスチックカバー(高さ2 mm×幅58 mm×、長さ83 mm)の下に1匹のフライを置き、1分間順応させます。
- フィルターされていない側にフライが表示されるまで待ちます。ビデオカメラと赤色のライトをオンにして、試用版を開始します。
注意: ビデオカメラは、起動直後は動きやすいです。録画中はカメラをしっかりと固定し、分析を複雑にする可能性のある異常な動きを避けるために、録画の数秒前にカメラの電源を入れてください。試用期間が始まるまで、赤信号をつけないでください。 - ハエの動きを1分間記録します。
注:フライが正中線に近づかない、または15秒以上動かないトライアルは破棄します。 - 1 分後、ビデオカメラとライトをオフにして試用を終了します。ハエは吸引器を使用して処分します。
注意: カメラの電源を切るときの動きの影響を避けるために、いくつかの余分なフレームを記録します。
- 行動分析と統計分析
- 前述の手順を使用して結果を分析します 23.次の式に示すように、フライがフィルターなしのエリアとフィルター付きのエリアで過ごした時間の合計時間に対する差の比率として、選好指数(PI)を計算します。
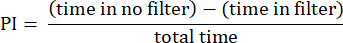
注:実験の統計的な詳細は、図の凡例に記載されています。データ解析は、適切なデータ解析ソフトウェアを使用して行います。
- 前述の手順を使用して結果を分析します 23.次の式に示すように、フライがフィルターなしのエリアとフィルター付きのエリアで過ごした時間の合計時間に対する差の比率として、選好指数(PI)を計算します。
4. 赤色光光遺伝学的吻拡張応答
- ショウジョウバエ の系統とハエの飼育
- Gr5a-Gal420ドライバーラインをUAS-CsChrimson2に交差させると、Gr5a>CsChrimsonと呼ばれる実験遺伝子型が得られます。Gr5a>CsChrimsonフライは、甘味受容体ニューロンでCsChrimsonを発現します。
注:各条件でオスとメスのハエが同数であることを確認してください。 - 飢餓は、テスト前にATR(ATR +)またはATR-なしで16〜24時間飛行します。
注:強い反応を引き出すには、より長い飢餓期間が必要になる場合があります。
- Gr5a-Gal420ドライバーラインをUAS-CsChrimson2に交差させると、Gr5a>CsChrimsonと呼ばれる実験遺伝子型が得られます。Gr5a>CsChrimsonフライは、甘味受容体ニューロンでCsChrimsonを発現します。
- 実験アッセイのセットアップと実行
- 麻酔は氷の上で冷却することによって飛行します(図1E)。
注意: ハエと氷が直接接触することは避けてください。冷却時間を約1分に制限します。長時間の冷却は、回復の問題や死亡につながる可能性があります。 - 1000 μLのピペットチップの先端を使用して、スライドガラスに7〜10個の小さなドットの接着剤を塗布します。
注:スライド上の接着剤の小さな滴は、フライが水没しないようにし、接着剤がその吻や脚に付着するのを防ぐのに役立ちます。 - 各接着剤ドットに、腹側を上にして1匹のフライを配置します。動きを最小限に抑えるために、胸部と翼が接着剤に接触していることを確認してください。翼を両側に扇状に広げて、接着表面積を増やします。
注意: ハエを近づけすぎると、光にさらされている間に誤って複数のハエが活性化する可能性があります。 - 接着剤を約10分間乾かします。
- スライドを湿度ボックス(濡れたペーパータオルの入ったプラスチックの箱)に移し、ハエが2時間回復するのを待ちます。
- スライドを顕微鏡下に置きます。注射器を使用して水滴を送達し、ハエを満足させ、喉の渇きによる吻の伸展を防ぎます。
- 顕微鏡を通してPER応答を観察しながら、単一のハエ(700ルクス)の吻/頭に赤色光を照らすために、手動で赤色レーザーポインターを保持します。
注:顕微鏡で赤色光を観察するときは、赤色レーザー/光をカットできる目の保護具が不可欠です。 - 30秒のウィンドウ内で吻の伸びを観察し、記録します。次の記録システムを使用して各フライを採点します:0は延長なし、0.5は1〜2秒の延長、1は延長が3秒以上続くことを示します。
- 光誘発性テング伸展をテストした後、シリンジを使用して4%スクロースに対する応答を調べます。針の端にスクロースの液滴を排出し、ハエの吻に近づけます。
注意: ショ糖液滴に反応しないハエのデータは破棄してください。
- 麻酔は氷の上で冷却することによって飛行します(図1E)。
- 行動分析と統計分析
- 適切なデータ分析ソフトウェアを使用して統計分析を実行します。
注:実験の統計的な詳細は、図の凡例に記載されています。
- 適切なデータ分析ソフトウェアを使用して統計分析を実行します。
5. 赤色光光遺伝学的ハエ迷路アッセイ
- ショウジョウバエ の系統とハエの飼育
- Gr66a-Gal421ドライバーラインをUAS-CsChrimson2に交差させると、実験的な遺伝子型Gr66a>CsChrimsonが得られます。Gr66a>CsChrimsonフライは、苦味ニューロンでCsChrimsonを発現します。
注意: 各グループにオスとメスのハエが同数含まれていることを確認してください。
- Gr66a-Gal421ドライバーラインをUAS-CsChrimson2に交差させると、実験的な遺伝子型Gr66a>CsChrimsonが得られます。Gr66a>CsChrimsonフライは、苦味ニューロンでCsChrimsonを発現します。
- フライ迷路アセンブリ
- 図1Fに示すように、ハエの迷路を作ります。
注:あるいは、フライ迷路のコンポーネントを3Dプリントし、前に詳述した25のように組み立てます。 - 5 mLのプラスチック製培養チューブ3本を適切な長さに切断して、ローディングチューブ、蓋なしの透明試験チューブ、ホイルで覆われた試験チューブを作成します。 図1Fに示すように、フライ迷路にチューブを取り付けます。
- 迷路の材質に応じて、試験管を切断して、各試験条件の距離が等しくなるようにします。保持チャンバーの長さに基づいて、透明な迷路で覆われていない試験管を短くし、迷路が不透明な場合はホイルで覆われた試験管を短くします。
- 図1Fに示すように、ハエの迷路を作ります。
- 実験アッセイのセットアップと実行
- 暗い場所や暗い場所では、10匹のオスと10匹のメスをローディングチューブに入れます。ローディングチューブを保持チャンバーに接続します。エレベーターを傾け、チューブを軽くたたいて、ハエを保持チャンバーに移動します。
注意: エレベータを下げて、保持チャンバーの半分だけが開くようにします。この操作により、ローディングチューブからホールディングチャンバーへのハエの移動が容易になります。 - ハエが保持室に移された後、エレベータを使用して、ローディングチューブと試験管の穴の間にハエを降ろします。次に、ローディングチューブを取り外します。
- ライトをオンにせずに、フライ迷路を赤色光源(1000 mA)から約13 cm離して配置します。
- 保持チャンバーが試験管の穴と揃うまでエレベータを下げ、ホイルで包まれた試験管と覆われていない試験管の間をフライが自由に移動できるようにします。同時に、赤いライトを点灯してCsChrimsonをアクティブにします。覆われていない試験管の表面の赤色光の強度が約40kLuxであることを確認してください。
注意: 保持チャンバーが下がって試験管の穴に位置合わせされるまで、赤色のライトを点灯しないでください。赤色光の強い明るさのため、赤色レーザー/光をフィルタリングできる適切な目の保護が推奨されます。 - ハエは、赤色光にさらされたチューブと影付きのチューブのどちらかを1分間選択します。
- 1分後、ローディングチューブと試験管の穴の間のエレベーターを上げます。各チューブのハエを数えます。
注:アクティブなハエと負傷していないハエのみがカウントされます。 - 各試行後に、dH2Oを使用してフライエレベーターとフライ迷路を清掃します。
- 暗い場所や暗い場所では、10匹のオスと10匹のメスをローディングチューブに入れます。ローディングチューブを保持チャンバーに接続します。エレベーターを傾け、チューブを軽くたたいて、ハエを保持チャンバーに移動します。
- データ分析と統計
- 次の式に示すように、フレーの総数に対するカバーされていないチューブとカバーされたチューブの間のフライ数の差の比として、選好指数(PI)を計算します。
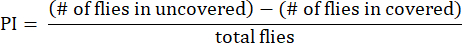
注:実験の統計的な詳細は、図の凡例に記載されています。データ分析は、適切なデータ分析ソフトウェアを使用して実行されます
- 次の式に示すように、フレーの総数に対するカバーされていないチューブとカバーされたチューブの間のフライ数の差の比として、選好指数(PI)を計算します。
結果
シングルフライブルーライト光光学サーモタクティック位置選好アッセイ
ATR補給なしのルームライト(ルームライト、ATR-)、ATR補給ありのルームライト(ルームライト、ATR+)、ATR補給なしのブルーライト(青、ATR-)、ATR補給ありのブルーライト(青、ATR+)の4つの条件がテストされました。最初の 3 つの条件がコントロールとして機能しました。対照実験では、ハエは31°C側を避けました。ATRを添加した青色光では、ハエは25°Cから31°Cの間で選好性を示さず、GtACR2活性化によるHCニューロンの阻害が成功したことを示しています(図2A)。
シングルフライ赤色光光遺伝学的位置選好アッセイ
ATR補給なしのルームライト(ルームライト、ATR -)、ATR補給ありのルームライト(ルームライト、ATR +)、ATR補給なしの赤色ライト(赤、ATR -)、ATR補給ありの赤色ライト(赤、ATR+)の4つの条件がテストされました。最初の 3 つの条件がコントロールとして機能しました。制御条件のハエは選好性を示さず、両側で同様の分布を示しました。ATR補給による赤色光の活性化(赤色、ATR+)は、赤色光の領域を避けるために飛行を誘導し、苦味感知ニューロンがCsChrimsonによって活性化されて回避行動を駆動することを示唆しています(図2B)。我々は、雄と雌の間に僅かではあるが有意な差を観察した(補足図2)が、これは咽頭GR66a陽性味覚細胞が産卵誘引を媒介する役割によるものかもしれない26。
赤色光光遺伝学的吻伸展反応
ATR補給なしのルームライト(ルームライト、ATR -)、ATR補給ありのルームライト(ルームライト、ATR +)、ATR補給なしの赤色ライト(赤、ATR -)、ATR補給ありの赤色ライト(赤、ATR+)の4つの条件がテストされました。最初の 3 つの条件がコントロールとして機能しました。制御条件下でのハエは、食欲刺激がないことと一致する最小限のPERを示しました。しかし、ATR補給による赤色光活性化下のハエにおいて有意なPERが観察され(赤色、ATR+)、CsChrimsonによる甘味感知ニューロンの活性化を示している(図2C)。
赤色光光遺伝学的ハエ迷路アッセイ
ATR補給なしのルームライト(ルームライト、ATR -)、ATR補給ありのルームライト(ルームライト、ATR +)、ATR補給なしの赤色ライト(赤、ATR -)、ATR補給ありの赤色ライト(赤、ATR+)の4つの条件がテストされました。最初の3つのグループは対照群として機能しました。対照群では、ハエはホイルで覆われたチューブと覆われていないチューブの間で好みを示さなかった。赤色光の下で、ATRを補給すると、 Gr66a>CsChrimson フライは赤色光にさらされた覆われていないチューブを避け、苦味感知ニューロンの活性化が回避行動を引き起こすことを示しています(図2D)。

図1:ハエの飼育、実験準備、および行動アッセイの概要。 (A)ハエの飼育と準備。(B)フライアスピレーターの構造。(C)シングルフライブルーライト光遺伝学的サーモタクティック位置選好アッセイのセットアップ。(D)シングルフライ赤色光光遺伝学的位置選好アッセイのセットアップ。(E)赤色光光遺伝学的吻延長応答アッセイのセットアップ。(F)赤色光光遺伝学的ハエ迷路アッセイのセットアップ。 この図の拡大版を表示するには、ここをクリックしてください。
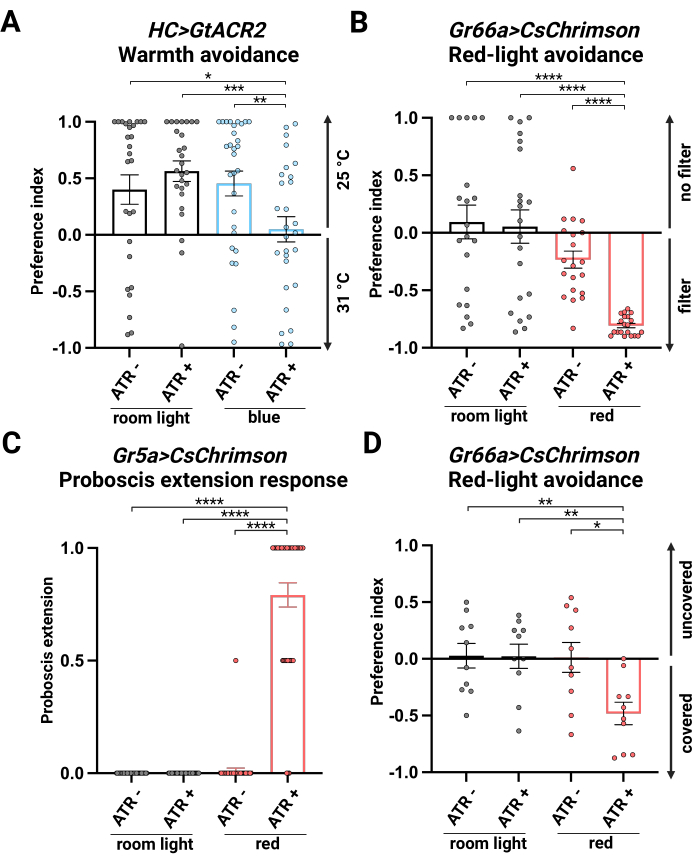
図2:光遺伝学的実験結果 (A)シングルフライブルーライト光走向性位置選好アッセイにおける HC>GtACR2 の選好指数(PI)。n = 26-31、データは平均± S.E.M. を表します。* p < 0.05、** p < 0.01、*** p < 0.001、マンホイットニー検定。(B)シングルフライ赤色光光遺伝学的位置選好アッセイにおける Gr66a>CsChrimson のPI。n = 20-21、データは平均± S.E.M. を表します。 p < 0.0001、マン・ホイットニー検定。(C)赤色光光遺伝学的吻伸長応答における Gr5a>CsChrimson のPI。n = 36-44、データは平均± S.E.M. を表します。 p < 0.0001、マン・ホイットニー検定。(D)赤色光光遺伝学的ハエ迷路アッセイにおける Gr66a>CsChrimson のPI。n = 10、データは平均± S.E.M. を表します。* p < 0.05、** p < 0.01、マンホイットニー検定。 この図の拡大版を表示するには、ここをクリックしてください。
補足図1.シングルフライブルーライト光走温性位置選好アッセイの温度変化。 カバーを25°C側から配置した後、シングルフライブルーライト光遺伝学的サーモタクティック位置選好アッセイでその中心が鋼板の境界と一致するまで、31°C側の温度が変化します。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2: Gr66a>CsChrimson の雄と雌のハエは、シングルフライの赤色光光遺伝学的位置選好アッセイで異なる振る舞いをします。 n = 10、データは平均± S.E.M. を表します。* p < 0.05、マン・ホイットニー検定。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
光遺伝学的操作は、時空間的な精度で神経回路の精密な制御を可能にすることにより、神経科学の分野を変革した27。神経回路には、シナプスによって相互接続されたニューロンの集団が含まれ、活性化すると特定の機能を果たします。ショウジョウバエの全脳コネクトームが完成し、ショウジョウバエの脳内のシナプス経路に関する包括的な洞察を提供しています28,29。コネクトームは、特定の振る舞いの根底にある潜在的な回路メカニズムを予測することができますが、さらなる実験的検証が必要です。遺伝学的ツールと行動アッセイを組み合わせることにより、光遺伝学的操作は、行動機能における神経回路の役割を探求するための強力なアプローチを提供します。例えば、トランスタンゴを光遺伝学的技術と統合することで、下流のニューロンの活性化またはサイレンシングが可能になり、研究者は個々のシナプス後ニューロンの行動的意義を決定することができる5,30。
この研究では、 Drosophila melanogasterの行動アッセイのためのシンプルでアクセスしやすく、再現性のある光遺伝学的プロトコルを確立しました。異なる神経回路を対象とする4つの実験的アプローチを設計することにより、ニューロンの活性化と抑制の両方を効率的に達成する方法を実証します。この結果は、サーモタクシーや味覚反応などの多様な行動を調べるためのCsChrimsonとGtACR2の使用を検証し、 ショウジョウバエ の研究における光遺伝学的手法の多様性を示しています。
ATR−グループは、シングルフライ赤色光光遺伝学的位置選好アッセイにおいてATR+グループと同様の傾向を示した(図2B)。これらの結果は、内因性ATRが低レベルのCsChrimsonタンパク質を活性化するのに十分である可能性があることを示しています。 野生型、 Gal4、UAS制御などの遺伝的制御は、これらの問題を軽減するのに役立ちますが、独自の問題があります。例えば、UAS制御はリーキー発現を示すことがあり、遺伝的背景が行動に影響を与える可能性があります。したがって、遺伝的コントロールやATRコントロールを含む包括的なコントロールセットを組み込むことは、最も堅牢で説得力のある結果を確保するために不可欠です。テング伸展応答を評価するための従来の方法は、ピペットチップ31を通してフライを押すことを含む。接着剤を使用してハエを固定し、スループットを大幅に向上させ、技術的な課題を減らします。回避行動以外にも、赤色光光遺伝学的ハエ迷路アッセイは、例えば、食欲行動を駆動するニューロンを活性化することにより、魅力的な行動をテストするためにも使用できます。 2つの条件の間でフライ選択行動を追跡する必要がある場合は、フォイルの代わりに780nmの赤外線ロングパスフィルターを使用して試験管を覆うことができます。
光遺伝学的操作を確実に成功させるためには、適切な光源を選択することが不可欠です。この選択を行う際には、次の要素を考慮する必要があります:(1)異なるチャネルロドプシンは、特定の波長の光によって活性化されます。例えば、CsChrimsonは590nmのピークを持つ赤色光によって活性化され、GtACR1は515nmのピークを持つ緑色光によって活性化され、GtACR2は470nmのピークを持つ青色光によって活性化されます2,3,4。同じニューロンを活性化およびサイレンシングするために、CsChrimsonとGtACR2を組み合わせて使用することで交差活性化を回避できます5が、GtACR1はCsChrimsonとの同時使用には理想的ではありません。(2)赤色光はハエの組織をより効果的に透過し、ハエの走光性への影響が少ない7。可能な限り、CsChrimsonなどの赤方偏移チャネルロドプシンの使用をお勧めします。(3)光の強さは成功にとって重要です。低強度ではニューロンの活性化に失敗する可能性があり、強度が高すぎると、光走性挙動が変化したり、組織に損傷を与えたりする可能性があります。比較的高い光強度で実験を開始し、必要最小限の時間でハエを露光することをお勧めします。目的の挙動が観察されたら、最適な強度が特定されるまで、光の強度を徐々に下げます(これは、光源とハエの間の距離を長くすることで簡単に達成できます)。
この研究の重要な目標は、ほとんどのショウジョウバエの研究室で簡単に実施できるプロトコルを開発することです。各セットアップは、一般的に入手可能な材料と機器を使用しているため、リソースが限られているラボに適した方法となっています。記載されているアッセイは、費用対効果が高く、ユーザーフレンドリーで、技術的な課題を最小限に抑え、再現性を確保しています。各セットアップのコストは、赤色光光遺伝学的吻延長応答アッセイ(解剖顕微鏡を除く)の10ドル未満から、赤色光光遺伝学的フライ迷路アッセイおよびシングルフライ赤色光光遺伝学的位置選好アッセイの約100ドルから、表面温度プローブを必要とするシングルフライ青色光光光学的サーモタクティクス位置選好アッセイの数百ドルまでの範囲です。 互換性のある温度計と2つのホットプレート(記録機器は、コストが大きく異なり、多くのラボがすでに所有している可能性があるため、これらの見積もりには含まれていません)。このシンプルさが、教育現場での光遺伝学的ツールの採用を支えています。いくつかの報告は、ショウジョウバエの光遺伝学の教育実験室への応用を実証しており、学部生が光遺伝学の原理を探求し、感覚ニューロンとその下流の神経回路がどのように行動を調節するかを理解することを可能にします25,32,33。
結論として、私たちは理解しやすく、リソースに優しい光遺伝学的プロトコルを提供します。この研究は、明確な方法論と再現性のある結果に焦点を当てることにより、光遺伝学を神経科学の標準的なツールとして推進し、容易に実装可能な技術を通じて神経機能の理解を深めます。
開示事項
著者は、この記事の公開に関して利益相反がないことを宣言します。すべての著者は、潜在的な対立を開示し、この研究で提示された研究に影響を与える可能性のある金銭的または個人的な関係がないことを確認しています。
謝辞
すべての図の概略図は Biorender.com で作成されました。この研究は、NIH R01GM140130 (https://www.nigms.nih.gov/) to L.N. の支援を受けました。資金提供者は、研究デザイン、データ収集と分析、出版決定、または原稿の準備に関与していませんでした。
資料
| Name | Company | Catalog Number | Comments |
| 1000 mA LED driver | Luxeon Star | 3021-D-E-1000 | |
| 5 mL VWR Culture Tubes, Plastic, with Dual-Position Caps | VWR | 60818-664 | |
| 780 Longpass Filter / IR 780 nm 100 mm x 100 mm | Lee Filters | BH #LE8744 | Cut to approximately 47 x 100 fit the plastic cover |
| Agfabric 6.5 ft. x 15 ft. Insect Bug Netting Garden Net for Protecting Plants Vegetables Flowers Fruits | The Home Depot | EIBNW6515 | |
| All trans retinal | Sigma-Aldrich | 116-31-4 | |
| Aluminum Plate (30.5 cm x 30.5 cm x 0.6 cm) | Amazon | purchased from Amazon | |
| Black Plastic Box | LI-COR | 929-97101 | |
| CALCIUM CHLORIDE ANHYDRO 25GR | Thermo Fisher Scientific | AC297150250 | |
| CX405 Handycam with Exmor R CMOS sensor | SONY | HDR-CX405 | |
| Elmer’s “School Glue” | Elmer | ||
| Ethyl alcohol, Pure (200 Proof) | Sigma-Aldrich | E7023 | |
| Fisherbrand Isotemp Hot Plate Stirrer | Fisher Scientific | SP88850200 | |
| Fly line: Gr5a-Gal4 | Bloomington Drosophila Stock Center | 57592 | |
| Fly line: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | |
| Fly line: HC-Gal4 (II) | Dr. Marco Gallio Lab | A kind gift | |
| Fly line: UAS-CsChrimson | Bloomington Drosophila Stock Center | 55136 | |
| Fly line: UAS-GtACR2/TM6B | Dr. Quentin Gaudry Lab | A kind gift | |
| Flystuff 62-101 Yellow Cornmeal (11.3 Kg), Yellow, 11.3 Kg/Unit | Genesee Scientific | 62-101 | |
| Flystuff 62-107 Inactive Dry Yeast, 10 Kg, Nutritional Flake, 10 Kg/Unit | Genesee Scientific | 62-107 | |
| Flystuff 66-103 Nutri-Fly Drosophila Agar, Gelidium, 100 Mesh, 5 Kg (11.02 lbs)/Unit | Genesee Scientific | 66-103 | |
| FreeMascot OD 8+ 190 nm–420 nm / 600 nm–1100 nm Wavelength Violet/Red/Infrared Laser Safety Glasses | FreeMascot | B08LGMQ65S | purchased from Amazon |
| GoPro Hero8 Black | GoPro | 6365359 | |
| LEE Filters 100×100 mm Infra Red #87 Infrared Polyester Filter | B&H Photo | LE8744 | |
| Longpass Filter, Colored Glass, 50.8 x 50.8 mm, 830 nm Cut-on, RG830 | Newport | FSQ-RG830 | |
| Methyl 4-hydroxybenzoate, 99%, Thermo Scientific Chemicals | Thermo Fisher Scientific | 126960025 | |
| MicroWell Mini Tray 60 Well, Low Profile NS PS | Thermal Scientific | NUNC 439225 | The lids are used as the "plastic cover" |
| Olympus Plastics 24-160RS, 1000 µL Olympus Ergonomic Pipet Tips Low Binding, Racked, Sterile, 8 Racks of 96 Tips/Unit | Eppendorf | 24-160RS | |
| Parafilm M Sealing Film | Heathrow Scientific | HS234526B | 4 in x 125 feet |
| Potassium chloride, ACS, 99.0-100.5%, | Thermo Fisher Scientific | AA1159530 | |
| Prism | GraphPad | Version 9 | data analysis software |
| Samco Graduated Transfer Pipettes | Thermo Fisher Scientific | 225 | 3 mL |
| Slides | Fisher Scientific | 12-544-2 | 5 mm x 75 mm x 1.0 mm |
| Stereo microscope | OLYMPUS | CZ61 | |
| Styrofoam box (27 cm height × 22 cm width × 16 cm length) | |||
| Sucrose | Fisher Scientific | 225911 | |
| Surface temperature probe | Fluke | 80PK-3A | |
| Syringe | BD Integra | 305270 | |
| Tate & Lyle 457 Dextrose, Tate & Lyle, Pow, Tate & Lyle 457 Dextrose, Tate & Lyle, Powder, 50 lbs/Unit | Genesee Scientific | 62-113 | |
| Traceable Calibrated Big-Digit Thermocouple Thermometer | Traceable by cple-parmer | UX-91210-07 | Fisherbrand Traceable BigDigit Type K Thermometer |
| Triple blue LED starboard | LEDSupply | 07007-PB000-D | 470 nm |
| Triple red LED starboard | LEDSupply | 07007-PD000-F | 627 nm |
| Tygon PVC Clear Tubing 1/4" ID, 3/8" OD, 5 ft. Length | McMaster Carr Supply Company | 6516T21 | |
| Univivi IR Illuminator, 850nm 12 LEDs Wide Angle IR Illuminator for Night Vision | Univivi | 4331910725 | |
| Wakefield Thermal 25.4 mm Round Heatsink Star LED Board - 882-100AB | Wakefield-Vette | 882-100AB | |
| Wireless Presenter | DinoFire Store | B01410YNAM | purchased from Amazon |
参考文献
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in neural systems. Neuron. 71 (1), 9-34 (2011).
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nat Methods. 11 (3), 338-346 (2014).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic neuronal silencing in drosophila during visual processing. Sci Rep. 7 (1), 13823 (2017).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Neuroscience. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Castaneda, A. N., et al. Functional labeling of individualized postsynaptic neurons using optogenetics and trans-tango in drosophila (flipsot). PLoS Genet. 20 (3), e1011190 (2024).
- Fischer, F. P., et al. Drosophila melanogaster as a versatile model organism to study genetic epilepsies: An overview. Front Mol Neurosci. 16, 1116000 (2023).
- Aragon, M. J., et al. Multiphoton imaging of neural structure and activity in drosophila through the intact cuticle. Elife. 11, e69094 (2022).
- Zhang, W., Ge, W., Wang, Z. A toolbox for light control of drosophila behaviors through channelrhodopsin 2-mediated photoactivation of targeted neurons. Eur J Neurosci. 26 (9), 2405-2416 (2007).
- Kono, M., Goletz, P. W., Crouch, R. K. 11-cis- and all-trans-retinols can activate rod opsin: Rational design of the visual cycle. Biochemistry. 47 (28), 7567-7571 (2008).
- Gallio, M., Ofstad, T. A., Macpherson, L. J., Wang, J. W., Zuker, C. S. The coding of temperature in the drosophila brain. Cell. 144 (4), 614-624 (2011).
- Ni, L., et al. A gustatory receptor paralogue controls rapid warmth avoidance in drosophila. Nature. 500 (7464), 580-584 (2013).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in drosophila. Neuron. 69 (2), 258-272 (2011).
- Ling, F., Dahanukar, A., Weiss, L. A., Kwon, J. Y., Carlson, J. R. The molecular and cellular basis of taste coding in the legs of drosophila. J Neurosci. 34 (21), 7148-7164 (2014).
- Dethier, V. G. . The Hungry Fly: A Physiological Study of the Behavior Associated with Feeding. , (1976).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of drosophila. Elife. 6, e23386 (2017).
- Sayeed, O., Benzer, S. Behavioral genetics of thermosensation and hygrosensation in drosophila. Proc Natl Acad Sci U S A. 93 (12), 6079-6084 (1996).
- Coya, R., Martin, F., Calvin-Cejudo, L., Gomez-Diaz, C., Alcorta, E. Validation of an optogenetic approach to the study of olfactory behavior in the t-maze of drosophila melanogaster adults. Insects. 13 (8), 662 (2022).
- Chu, L. A., Tai, C. Y., Chiang, A. S. Thirst-driven hygrosensory suppression promotes water seeking in drosophila. Proc Natl Acad Sci U S A. 121 (34), e2404454121 (2024).
- Chyb, S., Dahanukar, A., Wickens, A., Carlson, J. R. Drosophila gr5a encodes a taste receptor tuned to trehalose. Proc Natl Acad Sci U S A. 100 (Suppl 2), 14526-14530 (2003).
- Dunipace, L., Meister, S., Mcnealy, C., Amrein, H. Spatially restricted expression of candidate taste receptors in the drosophila gustatory system. Curr Biol. 11 (11), 822-835 (2001).
- Ratnayake, K., et al. Blue light excited retinal intercepts cellular signaling. Sci Rep. 8 (1), 10207 (2018).
- Huda, A., Omelchenko, A. A., Vaden, T. J., Castaneda, A. N., Ni, L. Responses of different drosophila species to temperature changes. J Exp Biol. 225 (11), jeb243708 (2022).
- Tyrrell, J. J., Wilbourne, J. T., Omelchenko, A. A., Yoon, J., Ni, L. Ionotropic receptor-dependent cool cells control the transition of temperature preference in drosophila larvae. PLoS Genet. 17 (4), e1009499 (2021).
- Fu, Z., Huda, A., Kimbrough, I. F., Ni, L. Using drosophila two-choice assay to study optogenetics in hands-on neurobiology laboratory activities. J Undergrad Neurosci Educ. 22 (1), A45-A50 (2023).
- Joseph, R. M., Heberlein, U. Tissue-specific activation of a single gustatory receptor produces opposing behavioral responses in drosophila. Genetics. 192 (2), 521-532 (2012).
- Riemensperger, T., Kittel, R. J., Fiala, A. Optogenetics in drosophila neuroscience. Methods Mol Biol. 1408, 167-175 (2016).
- Dorkenwald, S., et al. Neuronal wiring diagram of an adult brain. Nature. 634 (8032), 124-138 (2024).
- Schlegel, P., et al. Whole-brain annotation and multi-connectome cell typing of drosophila. Nature. 634 (8032), 139-152 (2024).
- Talay, M., et al. Transsynaptic mapping of second-order taste neurons in flies by trans-tango. Neuron. 96 (4), 783-795.e4 (2017).
- Shiraiwa, T., Carlson, J. R. Proboscis extension response (per) assay in drosophila. J Vis Exp. (3), e193 (2007).
- Pulver, S. R., Hornstein, N. J., Land, B. L., Johnson, B. R. Optogenetics in the teaching laboratory: Using channelrhodopsin-2 to study the neural basis of behavior and synaptic physiology in drosophila. Adv Physiol Educ. 35 (1), 82-91 (2011).
- Titlow, J. S., Johnson, B. R., Pulver, S. R. Light activated escape circuits: A behavior and neurophysiology lab module using drosophila optogenetics. J Undergrad Neurosci Educ. 13 (3), A166-A173 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved