Method Article
黑腹果蝇神经回路光遗传学作的行为测定
* 这些作者具有相同的贡献
摘要
本文介绍了黑 腹果蝇的光遗传学作方法,利用 CsChrimson 和 GtACR2 激活和沉默特定神经元。描述了四个实验,以利用光遗传学来探索趋热和味觉行为,从而深入了解控制这些过程的潜在神经机制。
摘要
光遗传学已成为神经科学的一项基本技术,能够通过光刺激精确控制神经元活动。本研究介绍了在 黑腹果蝇中应用光遗传学方法的易于实施的设置。在四种实验方法中采用了两种光遗传学工具,CsChrimson,一个红光激活的阳离子通道,和 GtACR2,一个蓝光激活的阴离子通道。其中三种方法涉及单蝇实验:(1) 针对温度敏感加热细胞的蓝光光遗传学趋热位置偏好测定,(2) 激活苦感神经元的红光光遗传学位置偏好测定,以及 (3) 激活甜味感应神经元的长鼻延伸反应测定。第四种方法 (4) 是苍蝇迷宫设置,使用多个苍蝇评估避让行为。在时间和空间上纵神经活动的能力为感觉处理和决策提供了强大的见解,强调了光遗传学在推进我们对神经功能的认识方面的潜力。这些方法为神经科学的未来研究提供了一个可访问且强大的框架,以增强对特定神经通路及其行为结果的理解。
引言
光遗传学已成为神经科学中结合光学和遗传学的强大技术,通过光刺激提供对神经活动的精确、非侵入性控制1。在黑腹果蝇(一种广泛使用的模式生物)中,光遗传学工具能够激活和抑制特定神经元,使研究人员能够调节神经回路。在使用的工具中,CsChrimson 和 GtACR (Guillardia theta 阴离子通道视紫红质) 为神经元靶向提供了互补的方法。CsChrimson 通道视紫红质是来自绿藻的红光敏感阳离子通道,当暴露于红光时,可通过去极化促进神经元激活,峰值激活约为 590 nm2。CsChrimson 在果蝇研究中提供比以前的通道视紫红质更好的组织渗透性,并减少光诱导的行为伪影2。相比之下,包括 GtACR2 等变体的 GtACR 是一种光门控氯离子通道,可通过超极化使神经元沉默 3,4。GtACR2 传导阴离子并被蓝光激活,峰值激活波长约为 470nm4。CsChrimson 和 GtACR2 被不同波长的光激活,确保精确和独立地控制神经元活动,而不会发生交叉激活5。
果蝇是一种有效的神经科学研究模型,因为它具有成本效益、易于饲养以及对环境刺激的强烈行为反应,包括吸引和回避行为6。其小尺寸和半透明角质层增强了光的穿透性,尤其是长波长红光,从而实现高效的光遗传学作 7,8。虽然果蝇细胞不能产生足够的视黄醛,这是通道视紫红质功能的关键辅助因子,但在它们的饮食中添加视黄醛可以补偿这一限制,确保光遗传学工具的有效激活9。
为了探索光遗传学作对果蝇的影响,我们描述了针对不同神经回路和行为的四个实验,每个实验都利用不同的方式来评估回避或有吸引力的反应,范围从单蝇测定到基于组的评估。果蝇中的加热细胞 (HC) 是位于 arista 中的热感应神经元,对温度升高做出反应10。这些神经元表达对温暖敏感的离子通道,触发回避行为,引导苍蝇远离热源10,11。在方法 1 中,我们采用单蝇蓝光光遗传学趋热位置偏好测定来纵 HC 神经元。通过在这些神经元中表达 GtACR2,我们抑制了它们在蓝光照射下的活性。果蝇暴露在两种温度选项下:25 °C 和 31 °C。 在室内光线下,苍蝇避开了 31 °C 的一侧,表现出典型的趋热反应。然而,GtACR2 的蓝光激活使 HC 神经元沉默。结果,果蝇没有表现出显着的温度偏好,表明成功的光遗传学抑制。除了评估感觉神经元的功能外,下游感觉神经元中 GtACR2 的表达还使类似的光遗传学作能够研究特定感觉模式所需的神经回路5。
果蝇中的味觉受体 GR66a 在喙远端的唇触诊和腿部中表达,介导苦味检测12,13。这些神经元会触发对苦味物质的回避行为。在方法 2 中,我们使用单蝇红光光遗传学位置偏好测定来纵表达 GR66a 的神经元。通过在这些神经元中表达 CsChrimson,我们在红光照射下激活了它们。将苍蝇放置在一个竞技场中,一半暴露在红光下,另一半过滤红光。在没有红灯的情况下,苍蝇没有表现出任何偏好。然而,CsChrimson 的红光激活刺激了苦感神经元,导致显着避开了被照亮的区域,证实了 GR66a 神经元的成功光遗传学激活。类似的方法已被用于识别足以实现回避行为的加热单元的下游电路5。
我们在方法 3 中专注于食欲行为的光遗传学激活。表达 GR5a 的神经元位于标签和腿上的味觉敏感器中,检测糖并驱动摄食行为。这些神经元的激活会触发喙扩展反应 (PER)14。我们使用红光光遗传学长鼻延伸反应测定来激活 GR5a 神经元。通过在这些神经元中表达 CsChrimson,我们用红光刺激它们。苍蝇在室内光线条件下不会伸出它们的喙。然而,CsChrimson 的红光激活导致喙延伸而没有甜刺激,表明 GR5a 神经元的光遗传学激活成功。这种方法已被用于研究神经回路,包括味觉感觉神经元、味觉投射神经元和长鼻运动神经元15,16。
在方法 4 中,我们使用针对 GR66a 神经元的红光光遗传学苍蝇迷宫测定法研究了果蝇群体中回避行为的光遗传学激活。苍蝇被放置在两根管子的交叉处:一根用红光照射,另一根用阴影照射。CsChrimson 在 GR66a 神经元中的表达触发了回避。在没有红光的情况下,果蝇没有表现出偏好,但红光激活导致表达 GR66a 的果蝇避开红光,表明该通路成功激活。苍蝇迷宫测定已广泛用于研究各种感觉模式,包括温度、湿度和嗅觉。当与光遗传学相结合时,这种方法对于研究吸引力和回避行为都非常有效 17,18,19。
这些方法为研究 果蝇 神经回路的光遗传学激活和抑制提供了一个可重复的框架。通过利用不同的通道视紫红质和可访问的行为测定的组合,这项概念验证研究证明了光遗传学作的有效性,提供了纵神经回路功能的直接方法,在神经科学研究中具有潜在的更广泛应用。
研究方案
1. 拉绳、苍蝇饲养和苍蝇吸气器
- 应变和维护
- 实验中使用的菌株包括 HC-Gal410、 Gr5a-Gal420 (布卢明顿 果蝇 库存中心 (BDSC):57592)、 Gr66a-gal421 (BDSC:57670)、 UAS-GtACR23、 UAS-CsChrimson2 ( BDSC:55136)。在 25 °C 下在标准玉米粉培养基上在 12 小时光照:12 小时黑暗循环下进行后蝇。
注:1 L 玉米粉培养基含有 1 L dH2O、79 g 葡萄糖、7.5 g 琼脂、24 g 片状酵母、57 g 玉米粉、2.1 g 4-羟基苯甲酸甲酯(溶于 11.1 mL 乙醇)、6 g 酒石酸钾钠四水合物和 0.9 g 氯化钙。
- 实验中使用的菌株包括 HC-Gal410、 Gr5a-Gal420 (布卢明顿 果蝇 库存中心 (BDSC):57592)、 Gr66a-gal421 (BDSC:57670)、 UAS-GtACR23、 UAS-CsChrimson2 ( BDSC:55136)。在 25 °C 下在标准玉米粉培养基上在 12 小时光照:12 小时黑暗循环下进行后蝇。
- 苍蝇饲养和实验准备
- 对 0 到 3 天龄的果蝇进行分类。到实验时,果蝇将达到 3 到 6 天大,确保与年龄相关的一致性(图 1A)。
- 在进行实验前 3 天将每种基因型分为四组:室内光照 ATR -、室内光照 ATR +、红光或蓝光 ATR - 以及红光或蓝光 ATR +。
- 通过将 ATR 溶解在 100% 乙醇中来制备 80 mM ATR 储备液。在食物中补充 400 μM ATR 到 ATR + 组。
- 用相同浓度的乙醇补充食物,但不含 ATR - 组。
- 在黑暗中饲养所有组22.
- 饥饿 Gr5a>CsChrimson 在仅包含潮湿组织的小瓶中飞行 16-24 小时。ATR + 样品瓶含有 400 μM ATR 与水的混合物,而 ATR - 样品瓶含有 dH2O 与相同浓度的乙醇混合。
- 飞翔吸气器
- 使用塑料管、防虫网和两个 3 mL 移液管组装飞吸器(图 1B)。
- 剪断移液管的吸头和球,确保苍蝇吸吸头允许苍蝇舒适地通过。这种设计能够通过吸入轻柔地吸取果蝇,最大限度地减少危害并促进个体果蝇的高效收集和转移。
- 将防虫网悬垂在塑料管上,并使用 Parafilm 将移液器的球端固定到管子上。
2. 单蝇蓝光光遗传学趋热位置偏好测定
- 果蝇 菌株和苍蝇饲养
- 将 HC-Gal410 驱动线与 UAS-GtACR23 交叉,产生实验基因型 HC>GtACR2。 HC>GtACR2 果蝇在加热细胞中表达 GtACR2。
注意:确保每种条件使用相同数量的雄性和雌性苍蝇。
- 将 HC-Gal410 驱动线与 UAS-GtACR23 交叉,产生实验基因型 HC>GtACR2。 HC>GtACR2 果蝇在加热细胞中表达 GtACR2。
- 实验检测设置和执行
- 将两块钢板对准单独的热板上,使它们的边缘相交。将塑料片保护膜放在顶部,用胶带固定以尽量减少移动。将一张白纸放在纸张保护膜上以减少背景噪声信号(图 1C)。
注意:在每次实验开始时或弄脏时更换白纸。 - 在白纸上放置一个透明塑料盖(2 mm 高× 58 mm 宽 × 83 mm 长)。这个盖子可以让苍蝇自由行走,同时防止它飞行。
- 在聚苯乙烯泡沫盒(高 27 厘米×宽 22 厘米×长 16 厘米)的底部切一个孔,以粘附在相机和实验表面上方约 12 厘米处的蓝光 (1,000 mA) 上。
- 放置摄像头和蓝光,以在启用激活时最大限度地减少眩光。
注意:可能需要进行预测试以确定蓝光的激活范围。 - 使用以下设置将相机设置为拍摄:1 秒延时摄影、窄视场、4000 × 3000 像素。
- 调整热板设置,以保持相应钢板的表面温度为 25 ± 1 °C 和 31 ± 1 °C。
注:对于需要低于 25 °C 温度的条件,需要其他冷却方法,例如 Peltier 装置或冰。如果钢板的温度超过所需水平,请用蒸馏水喷洒表面以达到并保持所需的条件。然后,使用餐巾纸从塑料板保护膜中吸收多余的水分。 - 在每次试验之前和之后,使用表面温度探头监测温度。
注意:精确的温度控制至关重要,因为波动会影响结果。 - 将塑料盖放在 25 °C 的一侧。使用苍蝇吸吸器,轻轻释放盖下的一只苍蝇。将盒子放在实验区域上方以产生昏暗的光线 (<10 lux) 并让果蝇适应 1 分钟。
- 驯化期结束后,提起箱体并快速调整塑料盖,使其定位在盖板中心对准钢板边界的位置,以确保 25 °C 和 31 °C 侧面均匀覆盖。
注意:在此过程中,空气温度和 31 °C 侧盖子内的温度在 5 秒内升高到约 27 °C(补充图 1),足以激活加热单元11。 - 通过打开相机和蓝光 (20 kLux) 来启动试用。
注意: 请勿在室内光线条件下打开蓝光。打开相机并录制几帧,然后在移动时打开蓝光。 - 超过 2 分钟后,通过关闭相机和灯结束试用。使用吸气器处理苍蝇。
注意:在关闭相机时,请额外录制一些帧,以防移动。
- 将两块钢板对准单独的热板上,使它们的边缘相交。将塑料片保护膜放在顶部,用胶带固定以尽量减少移动。将一张白纸放在纸张保护膜上以减少背景噪声信号(图 1C)。
- 行为和统计分析
- 仅分析在试验开始时停留在 25 °C 一侧的果蝇的数据。
注意:丢弃在 31 °C 一侧开始试验的果蝇的数据,这些果蝇通常表现出偏好改变23。丢弃涉及不接近 31 °C 侧边缘的果蝇的试验,确保它们在温度之间做出选择。丢弃保持静止超过 30 秒的果蝇的数据。 - 使用前面描述的过程分析结果23.将偏好指数 (PI) 计算为果蝇在每个温度区停留的时间差与总时间的比率,如以下公式所示:
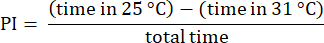
注:图例中提供了实验的统计详细信息。使用适当的数据分析软件进行数据分析。
- 仅分析在试验开始时停留在 25 °C 一侧的果蝇的数据。
3. 单蝇红光光遗传学位置偏好测定
- 果蝇 菌株和苍蝇饲养
- 将 Gr66a-Gal421 驱动程序线交叉到 UAS-CsChrimson2,得到实验基因型 Gr66a>CsChrimson。 Gr66a>CsChrimson 果蝇在苦味神经元中表达 CsChrimson。
注意:确保每种条件使用相同数量的雄性和雌性苍蝇。
- 将 Gr66a-Gal421 驱动程序线交叉到 UAS-CsChrimson2,得到实验基因型 Gr66a>CsChrimson。 Gr66a>CsChrimson 果蝇在苦味神经元中表达 CsChrimson。
- 实验检测设置和执行
- 在暗室或黑暗环境中进行测定,以确保 CsChrimson 的受控激活(图 1D)。
- 将摄像机放置在实验表面上方约 45 厘米处。
- 使用不带红外滤镜的摄像机。如果摄像机具有内部短通红外滤镜,可阻挡超过 700 nm 的波长,请将其移除。
- 使用强力胶将 830 nm 长通滤光片贴在镜头上以捕获红外波长。这种调整对于在红外光条件下记录苍蝇的运动至关重要。
- 将红光源24 放置在实验表面上方约 45 cm 处,确保光强度约为 2.5 kLux (1,000 mA)。
注意: 建议使用适当的护目镜,以过滤掉红色激光/光线。激光护目镜有助于防止直接暴露在强红光下对眼睛造成潜在伤害。 - 使用红外光观察设置中的果蝇。在整个实验过程中保持开启状态。
注意:避免红外光在实验区域造成眩光;眩光会使数据分析复杂化。 - 使用胶水将 780 nm 红外长通滤光片连接到塑料盖的一半。
注:使用任何阻挡 780 nm 以下波长的长通滤光片。未过滤的一面允许红光和红外线通过,而过滤面只允许红外线通过。 - 在实验区域下方放置黑色遮罩材料,以最大程度地减少背景杂色。
- 使用苍蝇吸气器将一只苍蝇放在透明塑料盖(2 毫米高× 58 毫米宽× 83 毫米长)下,并让它适应 1 分钟。
- 等到苍蝇在未过滤的一侧可见。通过打开摄像机和红灯开始试用。
注意:摄像机在启动后立即容易受到运动的影响。录制时请彻底固定摄像机,并在录制前几秒钟开启摄像机,以避免可能使分析复杂化的异常移动。在试用开始之前不要打开红灯。 - 记录苍蝇的运动 1 分钟。
注意:丢弃果蝇不接近中线或超过 15 秒不移动的试验。 - 1 分钟后,通过关闭摄像机和灯光结束试用。使用吸气器处理苍蝇。
注意:在关闭相机时,请额外录制几帧,以避免移动的影响。
- 行为和统计分析
- 使用前面描述的过程分析结果23.将偏好指数 (PI) 计算为苍蝇在没有过滤器的区域和有过滤器的区域停留的时间之差与总时间的比率,如以下公式所示:
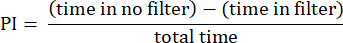
注:图例中提供了实验的统计详细信息。使用适当的数据分析软件进行数据分析。
- 使用前面描述的过程分析结果23.将偏好指数 (PI) 计算为苍蝇在没有过滤器的区域和有过滤器的区域停留的时间之差与总时间的比率,如以下公式所示:
4. 红光光遗传学长鼻延伸反应
- 果蝇 菌株和苍蝇饲养
- 将 Gr5a-Gal420 驱动程序线交叉到 UAS-CsChrimson2,产生称为 Gr5a>CsChrimson 的实验基因型。 Gr5a>CsChrimson 果蝇在甜味受体神经元中表达 CsChrimson。
注意:确保每种条件使用相同数量的雄性和雌性苍蝇。 - 测试前,用 ATR (ATR +) 或不使用 (ATR -) 饥饿飞行 16-24 小时。
注意:可能需要更长的饥饿期才能引起强烈的反应。
- 将 Gr5a-Gal420 驱动程序线交叉到 UAS-CsChrimson2,产生称为 Gr5a>CsChrimson 的实验基因型。 Gr5a>CsChrimson 果蝇在甜味受体神经元中表达 CsChrimson。
- 实验检测设置和执行
- 通过在冰上冷却来麻醉苍蝇(图 1E)。
注意:避免苍蝇与冰块的直接接触。将冷却时间限制在约 1 分钟;长时间冷却会导致恢复问题和死亡。 - 使用 1000 μL 移液器吸头的尖端在载玻片上涂抹 7-10 小点胶水。
注意:载玻片上的小滴胶水可确保苍蝇不会被淹没,并有助于防止胶水粘在喙或腿上。 - 将一只苍蝇腹侧朝上放在每个胶点上。确保胸部和翅膀接触胶水,以尽量减少移动。将机翼向两侧扇出,以增加粘合表面积。
注意: 避免将苍蝇放置得太近,这可能会在光照期间无意中激活多个苍蝇。 - 让胶水干燥约 10 分钟。
- 将载玻片转移到湿度箱(带有湿纸巾的塑料盒)中,让果蝇恢复 2 小时。
- 将载玻片置于显微镜下。使用注射器输送一滴水来满足苍蝇,防止口渴引起的长鼻伸展。
- 手动握住红色激光指示器,将红光照射到单只苍蝇的长鼻/头部 (700 lux),同时通过显微镜观察 PER 响应。
注意:通过显微镜观察红光时,可以过滤掉红色激光/光的护目镜是必不可少的。 - 在 30 秒窗口内观察并记录长鼻伸展。使用以下记录系统对每只苍蝇进行评分:0 表示没有延伸,0.5 表示 1-2 秒延长,1 表示延长持续超过 3 秒。
- 测试光诱导的喙伸展后,使用注射器检查对 4% 蔗糖的反应。在针头末端排出一滴蔗糖,并将其靠近苍蝇长鼻。
注意:丢弃对蔗糖液滴没有反应的果蝇的数据。
- 通过在冰上冷却来麻醉苍蝇(图 1E)。
- 行为和统计分析
- 使用适当的数据分析软件进行统计分析。
注:图例中提供了实验的统计详细信息。
- 使用适当的数据分析软件进行统计分析。
5. 红光光遗传学苍蝇迷宫测定
- 果蝇 菌株和苍蝇饲养
- 将 Gr66a-Gal421 驱动程序线交叉到 UAS-CsChrimson2,得到实验基因型 Gr66a>CsChrimson。 Gr66a>CsChrimson 果蝇在苦味神经元中表达 CsChrimson。
注意:确保每组包含相同数量的雄性和雌性苍蝇。
- 将 Gr66a-Gal421 驱动程序线交叉到 UAS-CsChrimson2,得到实验基因型 Gr66a>CsChrimson。 Gr66a>CsChrimson 果蝇在苦味神经元中表达 CsChrimson。
- Fly-maze 组装
- 如图 1F 所示制作苍蝇迷宫。
注意:或者,3D 打印飞行迷宫组件,如前所述组装25。 - 将三个 5 mL 塑料培养管剪成合适的长度,制成一个上样管、一个未覆盖的透明试管和一个覆盖铝箔的试管。如图 1F 所示,将管子连接到苍蝇迷宫。
- 根据迷宫材料,切割试管以确保每个测试条件的距离相等。根据保持室的长度,在透明迷宫中缩短未覆盖的试管,如果迷宫不透明,则缩短铝箔覆盖的试管。
- 如图 1F 所示制作苍蝇迷宫。
- 实验检测设置和执行
- 在黑暗或弱光条件下,将 10 只雄性和 10 只雌性放入加载管中。将加载管连接到保持室。倾斜电梯并轻轻敲击管子,将果蝇移入收容室。
注意: 降低电梯,使只有一半的保温室打开。这种作有助于将果蝇从装载管转移到保持室中。 - 将果蝇转移到暂存室后,使用电梯将果蝇降低到装载管和试管孔之间。然后,取下加载管。
- 将迷宫放置在距离红光源 (13 mA) 约 1000 厘米的位置,不要打开灯。
- 降低升降装置,直到固定室与试管孔对齐,让果蝇在铝箔包裹和未覆盖的试管之间自由移动。同时,打开红灯以激活 CsChrimson。确保未覆盖的试管表面的红光强度约为 40 kLux。
注意:在保持室降低并与试管孔对齐之前,不要打开红灯。由于红光的强烈亮度,建议使用可以过滤掉红色激光/光的适当护目镜。 - 苍蝇在红光暴露管和阴凉管之间选择一分钟。
- 1 分钟后,在装载管和测试管孔之间升起电梯。数一数每个试管里的苍蝇。
注意:仅计算活跃和未受伤的苍蝇。 - 每次试验后使用 dH2O 清洁飞蝇电梯和飞迷宫。
- 在黑暗或弱光条件下,将 10 只雄性和 10 只雌性放入加载管中。将加载管连接到保持室。倾斜电梯并轻轻敲击管子,将果蝇移入收容室。
- 数据分析与统计
- 将偏好指数 (PI) 计算为未覆盖管和覆盖管之间的果蝇数量之差与果蝇总数的比率,如以下公式所示:
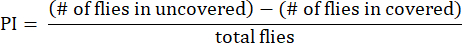
注:图例中提供了实验的统计详细信息。使用适当的数据分析软件进行数据分析
- 将偏好指数 (PI) 计算为未覆盖管和覆盖管之间的果蝇数量之差与果蝇总数的比率,如以下公式所示:
结果
单蝇蓝光光遗传学趋热位置偏好测定
测试了四种情况:无 ATR 补充的室内灯(室内灯,ATR -)、有 ATR 补充的室内灯(室内灯,ATR +)、无 ATR 补充的蓝光(蓝色,ATR -)和有 ATR 补充的蓝光(蓝色,ATR +)。前三个条件用作对照。在对照实验中,果蝇避开了 31 °C 的一侧。在补充 ATR 的蓝光下,果蝇在 25 °C 和 31 °C 之间没有表现出偏好,表明 GtACR2 激活成功抑制了 HC 神经元(图 2A)。
单蝇红光光遗传学位置偏好测定
测试了四种情况:无 ATR 补充的室内灯(室内灯,ATR -)、有 ATR 补充的室内灯(室内灯,ATR +)、无 ATR 补充的红灯(红色,ATR -)和有 ATR 补充的红灯(红色,ATR +)。前三个条件用作对照。在对照条件下的果蝇没有表现出偏好,双方的分布相似。补充 ATR 的红光激活 (红色,ATR +) 引导果蝇避开红光区域,表明苦感神经元被 CsChrimson 激活以驱动回避行为(图 2B)。我们观察到雄性和雌性之间存在细微但显着的差异(补充图 2),这可能是由于咽部 GR66a 阳性味觉细胞在介导产卵吸引力中的作用26。
红光光遗传学喙延伸反应
测试了四种情况:无 ATR 补充的室内灯(室内灯,ATR -)、有 ATR 补充的室内灯(室内灯,ATR +)、无 ATR 补充的红灯(红色,ATR -)和有 ATR 补充的红灯(红色,ATR +)。前三个条件用作对照。在对照条件下,果蝇显示出最小的 PER,与没有食欲刺激一致。然而,在补充 ATR 的红光激活下,在果蝇中观察到显着的 PER(红色,ATR +),表明 CsChrimson 激活了甜味感应神经元(图 2C)。
红光光遗传学苍蝇迷宫测定
测试了四种情况:无 ATR 补充的室内灯(室内灯,ATR -)、有 ATR 补充的室内灯(室内灯,ATR +)、无 ATR 补充的红灯(红色,ATR -)和有 ATR 补充的红灯(红色,ATR +)。前三组用作对照。在对照组中,果蝇在铝箔覆盖和未覆盖的管子之间没有表现出偏好。在红光下,在补充 ATR 的情况下, Gr66a>CsChrimson 果蝇避开了暴露在红光下的裸露管,表明苦感神经元的激活驱动了回避行为(图 2D)。

图 1:苍蝇饲养、实验准备和行为测定概述。 (A) 苍蝇饲养和准备。(B) 飞行吸气器结构。(C) 单蝇蓝光光遗传学趋热位置偏好测定的设置。(D) 单蝇红光光遗传学位置偏好测定的设置。(E) 红光光遗传学喙延伸反应测定的设置。(F) 红光光遗传学苍蝇迷宫测定的设置。 请单击此处查看此图的较大版本。
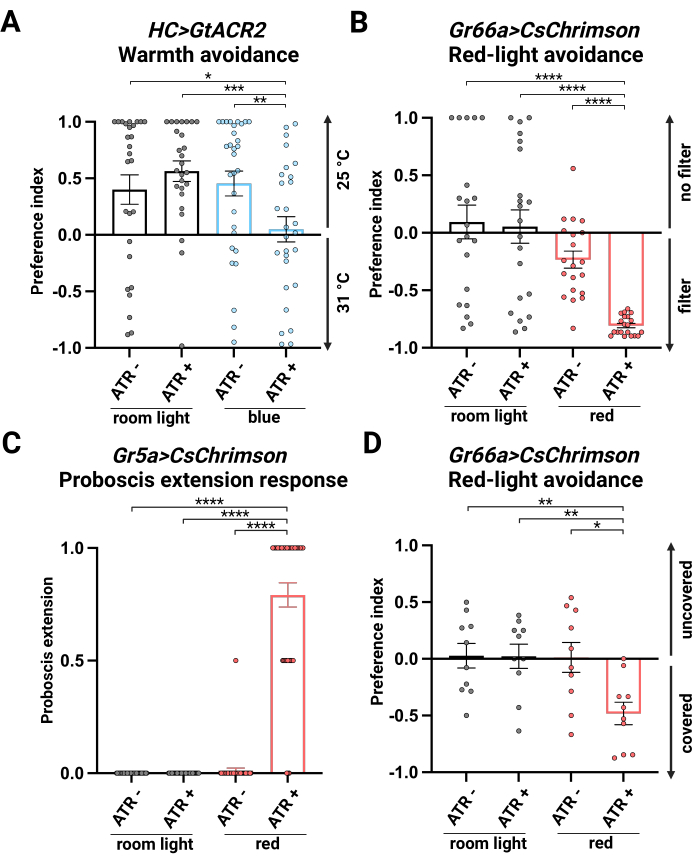
图 2:光遗传学实验结果。 (A) HC>GtACR2 在单蝇蓝光光遗传学趋热位置偏好测定中的偏好指数 (PI)。n = 26-31,数据表示 S.E.M. ±平均值;* p < 0.05,** p < 0.01,*** p < 0.001,Mann-Whitney 检验。(B) Gr66a>CsChrimson 在单蝇红光光遗传学位置偏好测定中的 PI。n = 20-21,数据表示 S.E.M. ±平均值; p < 0.0001,Mann-Whitney 检验。(C) Gr5a>CsChrimson 在红光光遗传学长鼻延伸反应中的 PI。n = 36-44,数据表示 S.E.M. ±平均值; p < 0.0001,Mann-Whitney 检验。(D) Gr66a>CsChrimson 在红光光遗传学苍蝇迷宫测定中的 PI。n = 10,数据表示 S.E.M. ±平均值;* p < 0.05,** p < 0.01,Mann-Whitney 检验。 请单击此处查看此图的较大版本。
补充图 1.单蝇蓝光光遗传学趋热位置偏好测定中的温度变化。 在单蝇蓝光光遗传学趋热位置偏好测定中,从 25 °C 侧定位盖子直至其中心与钢板边界对齐后,31 °C 侧的温度发生变化。 请点击此处下载此文件。
补充图 2:雄性和雌性 Gr66a>CsChrimson 果蝇在单蝇红光光遗传学位置偏好测定中的行为不同。 n = 10,数据表示 S.E.M. ±平均值;* p < 0.05,Mann-Whitney 检验。 请点击此处下载此文件。
讨论
光遗传学作通过能够以时空准确性精确控制神经回路,改变了神经科学领域27。神经回路包括通过突触互连的神经元群,在激活时执行特定功能。果蝇全脑连接组已经完成,为果蝇大脑内的突触通路提供了全面的见解28,29。虽然连接组可以预测某些行为背后的潜在电路机制,但还需要进一步的实验验证。通过结合遗传工具和行为检测,光遗传学作提供了一种强大的方法来探索神经回路在行为功能中的作用。例如,将 trans-Tango 与光遗传学技术相结合可以激活或沉默下游神经元,使研究人员能够确定单个突触后神经元的行为意义 5,30。
本研究为 黑腹果蝇的行为测定建立了简单、可访问且可重复的光遗传学方案。通过设计针对不同神经回路的四种实验方法,我们展示了如何有效地实现神经元的激活和抑制。结果验证了 CsChrimson 和 GtACR2 在研究趋热性和味觉反应等不同行为中的使用,显示了光遗传学技术在 果蝇 研究中的多功能性。
ATR - 组在单蝇红光光遗传学位置偏好测定中表现出与 ATR + 组相似的趋势(图 2B)。这些结果表明,内源性 ATR 可能足以激活低水平的 CsChrimson 蛋白。虽然 野生型、 Gal4 和 UAS 对照等基因对照可以帮助缓解这些问题,但它们也有自己的问题。例如,UAS 对照可能会表现出泄漏的表达,遗传背景可能会影响行为。因此,结合一套全面的对照,包括遗传和 ATR 对照,对于确保最稳健和令人信服的结果至关重要。评估长鼻伸展反应的传统方法包括将苍蝇推过移液器吸头31。我们使用胶水固定果蝇,显著提高产量并降低技术挑战。除了回避行为外,红光光遗传学苍蝇迷宫测定还可用于测试有吸引力的行为,例如,通过激活驱动食欲行为的神经元。 如果需要跟踪两种条件之间的蝇选择行为,可以使用 780 nm 红外长通滤光片代替箔片覆盖试管。
为了确保光遗传学作的成功,选择合适的光源至关重要。在做出这种选择时,应考虑以下因素:(1) 不同的通道视紫红质被特定波长的光激活。例如,CsChrimson 被 590 nm 处峰的红光激活,GtACR1 被 515 nm 处处峰的绿光激活,GtACR2 被 470 nm 处处峰的蓝光激活 2,3,4。为了激活和沉默相同的神经元,CsChrimson 和 GtACR2 可以联合使用以避免交叉激活5,而 GtACR1 不适合与 CsChrimson 同时使用。(2) 红光更有效地穿透果蝇组织,对果蝇趋光性的影响较小7。我们建议尽可能使用红移通道视紫红质,例如 CsChrimson。(3) 光的强度对于成功至关重要。低强度可能无法激活神经元,而强度过高可能会改变趋光行为或损伤组织。我们建议以相对较高的光照强度开始实验,并在所需的最短持续时间内暴露果蝇。一旦观察到所需的行为,逐渐降低光强度 - 这可以通过增加光源和苍蝇之间的距离来轻松实现 - 直到确定最佳强度。
这项工作的一个关键目标是开发易于在大多数果蝇实验室中实施的方案。每种设置都使用常用的材料和设备,因此该方法适用于资源有限的实验室。所描述的分析具有成本效益且用户友好,可最大限度地减少技术挑战并确保可重复性。每次设置的成本从红光光遗传学长鼻延伸反应测定(不包括解剖显微镜)不到 10 美元到红光光遗传学苍蝇迷宫测定和单蝇红光遗传学位置偏好测定的大约 100 美元,再到单蝇蓝光光遗传学趋热位置偏好测定的几百美元,这需要表面温度探针, 一个兼容的温度计和两个加热板(记录设备不包括在这些估计中,因为它的成本差异很大,而且许多实验室可能已经拥有它。这种简单性支持在教育环境中采用光遗传学工具。几篇报告证明了果蝇光遗传学在教学实验室中的应用,使本科生能够探索光遗传学的原理并了解感觉神经元及其下游神经回路如何调节行为 25,32,33。
总之,我们提供了易于遵循、资源友好的光遗传学方案。通过专注于清晰的方法和可重复的结果,本研究将光遗传学推广为神经科学的标准工具,通过易于实施的技术增强我们对神经功能的理解。
披露声明
作者声明,本文的发布不存在利益冲突。所有作者都披露了任何潜在的冲突,并确认他们没有可能影响本研究中介绍的工作的财务或个人关系。
致谢
所有图物的示意图均使用 Biorender.com 创建。这项工作得到了 NIH R01GM140130 (https://www.nigms.nih.gov/) 到 LN 的支持。资助者在研究设计、数据收集和分析、出版决定或手稿准备方面没有任何作用。
材料
| Name | Company | Catalog Number | Comments |
| 1000 mA LED driver | Luxeon Star | 3021-D-E-1000 | |
| 5 mL VWR Culture Tubes, Plastic, with Dual-Position Caps | VWR | 60818-664 | |
| 780 Longpass Filter / IR 780 nm 100 mm x 100 mm | Lee Filters | BH #LE8744 | Cut to approximately 47 x 100 fit the plastic cover |
| Agfabric 6.5 ft. x 15 ft. Insect Bug Netting Garden Net for Protecting Plants Vegetables Flowers Fruits | The Home Depot | EIBNW6515 | |
| All trans retinal | Sigma-Aldrich | 116-31-4 | |
| Aluminum Plate (30.5 cm x 30.5 cm x 0.6 cm) | Amazon | purchased from Amazon | |
| Black Plastic Box | LI-COR | 929-97101 | |
| CALCIUM CHLORIDE ANHYDRO 25GR | Thermo Fisher Scientific | AC297150250 | |
| CX405 Handycam with Exmor R CMOS sensor | SONY | HDR-CX405 | |
| Elmer’s “School Glue” | Elmer | ||
| Ethyl alcohol, Pure (200 Proof) | Sigma-Aldrich | E7023 | |
| Fisherbrand Isotemp Hot Plate Stirrer | Fisher Scientific | SP88850200 | |
| Fly line: Gr5a-Gal4 | Bloomington Drosophila Stock Center | 57592 | |
| Fly line: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | |
| Fly line: HC-Gal4 (II) | Dr. Marco Gallio Lab | A kind gift | |
| Fly line: UAS-CsChrimson | Bloomington Drosophila Stock Center | 55136 | |
| Fly line: UAS-GtACR2/TM6B | Dr. Quentin Gaudry Lab | A kind gift | |
| Flystuff 62-101 Yellow Cornmeal (11.3 Kg), Yellow, 11.3 Kg/Unit | Genesee Scientific | 62-101 | |
| Flystuff 62-107 Inactive Dry Yeast, 10 Kg, Nutritional Flake, 10 Kg/Unit | Genesee Scientific | 62-107 | |
| Flystuff 66-103 Nutri-Fly Drosophila Agar, Gelidium, 100 Mesh, 5 Kg (11.02 lbs)/Unit | Genesee Scientific | 66-103 | |
| FreeMascot OD 8+ 190 nm–420 nm / 600 nm–1100 nm Wavelength Violet/Red/Infrared Laser Safety Glasses | FreeMascot | B08LGMQ65S | purchased from Amazon |
| GoPro Hero8 Black | GoPro | 6365359 | |
| LEE Filters 100×100 mm Infra Red #87 Infrared Polyester Filter | B&H Photo | LE8744 | |
| Longpass Filter, Colored Glass, 50.8 x 50.8 mm, 830 nm Cut-on, RG830 | Newport | FSQ-RG830 | |
| Methyl 4-hydroxybenzoate, 99%, Thermo Scientific Chemicals | Thermo Fisher Scientific | 126960025 | |
| MicroWell Mini Tray 60 Well, Low Profile NS PS | Thermal Scientific | NUNC 439225 | The lids are used as the "plastic cover" |
| Olympus Plastics 24-160RS, 1000 µL Olympus Ergonomic Pipet Tips Low Binding, Racked, Sterile, 8 Racks of 96 Tips/Unit | Eppendorf | 24-160RS | |
| Parafilm M Sealing Film | Heathrow Scientific | HS234526B | 4 in x 125 feet |
| Potassium chloride, ACS, 99.0-100.5%, | Thermo Fisher Scientific | AA1159530 | |
| Prism | GraphPad | Version 9 | data analysis software |
| Samco Graduated Transfer Pipettes | Thermo Fisher Scientific | 225 | 3 mL |
| Slides | Fisher Scientific | 12-544-2 | 5 mm x 75 mm x 1.0 mm |
| Stereo microscope | OLYMPUS | CZ61 | |
| Styrofoam box (27 cm height × 22 cm width × 16 cm length) | |||
| Sucrose | Fisher Scientific | 225911 | |
| Surface temperature probe | Fluke | 80PK-3A | |
| Syringe | BD Integra | 305270 | |
| Tate & Lyle 457 Dextrose, Tate & Lyle, Pow, Tate & Lyle 457 Dextrose, Tate & Lyle, Powder, 50 lbs/Unit | Genesee Scientific | 62-113 | |
| Traceable Calibrated Big-Digit Thermocouple Thermometer | Traceable by cple-parmer | UX-91210-07 | Fisherbrand Traceable BigDigit Type K Thermometer |
| Triple blue LED starboard | LEDSupply | 07007-PB000-D | 470 nm |
| Triple red LED starboard | LEDSupply | 07007-PD000-F | 627 nm |
| Tygon PVC Clear Tubing 1/4" ID, 3/8" OD, 5 ft. Length | McMaster Carr Supply Company | 6516T21 | |
| Univivi IR Illuminator, 850nm 12 LEDs Wide Angle IR Illuminator for Night Vision | Univivi | 4331910725 | |
| Wakefield Thermal 25.4 mm Round Heatsink Star LED Board - 882-100AB | Wakefield-Vette | 882-100AB | |
| Wireless Presenter | DinoFire Store | B01410YNAM | purchased from Amazon |
参考文献
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in neural systems. Neuron. 71 (1), 9-34 (2011).
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nat Methods. 11 (3), 338-346 (2014).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic neuronal silencing in drosophila during visual processing. Sci Rep. 7 (1), 13823 (2017).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Neuroscience. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Castaneda, A. N., et al. Functional labeling of individualized postsynaptic neurons using optogenetics and trans-tango in drosophila (flipsot). PLoS Genet. 20 (3), e1011190 (2024).
- Fischer, F. P., et al. Drosophila melanogaster as a versatile model organism to study genetic epilepsies: An overview. Front Mol Neurosci. 16, 1116000 (2023).
- Aragon, M. J., et al. Multiphoton imaging of neural structure and activity in drosophila through the intact cuticle. Elife. 11, e69094 (2022).
- Zhang, W., Ge, W., Wang, Z. A toolbox for light control of drosophila behaviors through channelrhodopsin 2-mediated photoactivation of targeted neurons. Eur J Neurosci. 26 (9), 2405-2416 (2007).
- Kono, M., Goletz, P. W., Crouch, R. K. 11-cis- and all-trans-retinols can activate rod opsin: Rational design of the visual cycle. Biochemistry. 47 (28), 7567-7571 (2008).
- Gallio, M., Ofstad, T. A., Macpherson, L. J., Wang, J. W., Zuker, C. S. The coding of temperature in the drosophila brain. Cell. 144 (4), 614-624 (2011).
- Ni, L., et al. A gustatory receptor paralogue controls rapid warmth avoidance in drosophila. Nature. 500 (7464), 580-584 (2013).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in drosophila. Neuron. 69 (2), 258-272 (2011).
- Ling, F., Dahanukar, A., Weiss, L. A., Kwon, J. Y., Carlson, J. R. The molecular and cellular basis of taste coding in the legs of drosophila. J Neurosci. 34 (21), 7148-7164 (2014).
- Dethier, V. G. . The Hungry Fly: A Physiological Study of the Behavior Associated with Feeding. , (1976).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of drosophila. Elife. 6, e23386 (2017).
- Sayeed, O., Benzer, S. Behavioral genetics of thermosensation and hygrosensation in drosophila. Proc Natl Acad Sci U S A. 93 (12), 6079-6084 (1996).
- Coya, R., Martin, F., Calvin-Cejudo, L., Gomez-Diaz, C., Alcorta, E. Validation of an optogenetic approach to the study of olfactory behavior in the t-maze of drosophila melanogaster adults. Insects. 13 (8), 662 (2022).
- Chu, L. A., Tai, C. Y., Chiang, A. S. Thirst-driven hygrosensory suppression promotes water seeking in drosophila. Proc Natl Acad Sci U S A. 121 (34), e2404454121 (2024).
- Chyb, S., Dahanukar, A., Wickens, A., Carlson, J. R. Drosophila gr5a encodes a taste receptor tuned to trehalose. Proc Natl Acad Sci U S A. 100 (Suppl 2), 14526-14530 (2003).
- Dunipace, L., Meister, S., Mcnealy, C., Amrein, H. Spatially restricted expression of candidate taste receptors in the drosophila gustatory system. Curr Biol. 11 (11), 822-835 (2001).
- Ratnayake, K., et al. Blue light excited retinal intercepts cellular signaling. Sci Rep. 8 (1), 10207 (2018).
- Huda, A., Omelchenko, A. A., Vaden, T. J., Castaneda, A. N., Ni, L. Responses of different drosophila species to temperature changes. J Exp Biol. 225 (11), jeb243708 (2022).
- Tyrrell, J. J., Wilbourne, J. T., Omelchenko, A. A., Yoon, J., Ni, L. Ionotropic receptor-dependent cool cells control the transition of temperature preference in drosophila larvae. PLoS Genet. 17 (4), e1009499 (2021).
- Fu, Z., Huda, A., Kimbrough, I. F., Ni, L. Using drosophila two-choice assay to study optogenetics in hands-on neurobiology laboratory activities. J Undergrad Neurosci Educ. 22 (1), A45-A50 (2023).
- Joseph, R. M., Heberlein, U. Tissue-specific activation of a single gustatory receptor produces opposing behavioral responses in drosophila. Genetics. 192 (2), 521-532 (2012).
- Riemensperger, T., Kittel, R. J., Fiala, A. Optogenetics in drosophila neuroscience. Methods Mol Biol. 1408, 167-175 (2016).
- Dorkenwald, S., et al. Neuronal wiring diagram of an adult brain. Nature. 634 (8032), 124-138 (2024).
- Schlegel, P., et al. Whole-brain annotation and multi-connectome cell typing of drosophila. Nature. 634 (8032), 139-152 (2024).
- Talay, M., et al. Transsynaptic mapping of second-order taste neurons in flies by trans-tango. Neuron. 96 (4), 783-795.e4 (2017).
- Shiraiwa, T., Carlson, J. R. Proboscis extension response (per) assay in drosophila. J Vis Exp. (3), e193 (2007).
- Pulver, S. R., Hornstein, N. J., Land, B. L., Johnson, B. R. Optogenetics in the teaching laboratory: Using channelrhodopsin-2 to study the neural basis of behavior and synaptic physiology in drosophila. Adv Physiol Educ. 35 (1), 82-91 (2011).
- Titlow, J. S., Johnson, B. R., Pulver, S. R. Light activated escape circuits: A behavior and neurophysiology lab module using drosophila optogenetics. J Undergrad Neurosci Educ. 13 (3), A166-A173 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。