Method Article
Saggi comportamentali per la manipolazione optogenetica dei circuiti neurali in Drosophila melanogaster
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo articolo presenta metodi per la manipolazione optogenetica in Drosophila melanogaster, utilizzando CsChrimson e GtACR2 per attivare e silenziare neuroni specifici. Vengono descritti quattro esperimenti che utilizzano l'optogenetica per esplorare i comportamenti termotattici e gustativi, fornendo informazioni sui meccanismi neurali sottostanti che governano questi processi.
Abstract
L'optogenetica è diventata una tecnica fondamentale nelle neuroscienze, consentendo un controllo preciso dell'attività neuronale attraverso la stimolazione della luce. Questo studio introduce configurazioni facili da implementare per l'applicazione di metodi optogenetici in Drosophila melanogaster. Due strumenti optogenetici, CsChrimson, un canale cationico attivato dalla luce rossa, e GtACR2, un canale anionico attivato dalla luce blu, sono stati impiegati in quattro approcci sperimentali. Tre di questi approcci prevedono esperimenti a mosca singola: (1) un saggio optogenetico di preferenza posizionale termotattica optogenetica a luce blu mirato a celle riscaldanti sensibili alla temperatura, (2) un saggio di preferenza posizionale optogenetica a luce rossa che attiva i neuroni sensibili all'amaro e (3) un saggio di risposta all'estensione della proboscide che attiva i neuroni sensibili al dolce. Il quarto approccio (4) è una configurazione di labirinto di mosche per valutare i comportamenti di evitamento utilizzando più mosche. La capacità di manipolare l'attività neurale temporalmente e spazialmente offre potenti intuizioni sull'elaborazione sensoriale e sul processo decisionale, sottolineando il potenziale dell'optogenetica per far progredire la nostra conoscenza della funzione neurale. Questi metodi forniscono un quadro accessibile e robusto per la ricerca futura nelle neuroscienze per migliorare la comprensione di specifici percorsi neurali e dei loro esiti comportamentali.
Introduzione
L'optogenetica è emersa come una potente tecnica che combina l'ottica e la genetica nelle neuroscienze, fornendo un controllo preciso e non invasivo sull'attività neurale attraverso la stimolazione dellaluce. In Drosophila melanogaster, un organismo modello ampiamente utilizzato, gli strumenti optogenetici consentono l'attivazione e l'inibizione di neuroni specifici, consentendo ai ricercatori di modulare i circuiti neurali. Tra gli strumenti utilizzati, CsChrimson e GtACR (Rodopsine canale anionico Guillardia theta) forniscono approcci complementari per il targeting neuronale. CsChrimson channelrhodopsin, un canale cationico sensibile alla luce rossa delle alghe verdi, facilita l'attivazione neuronale attraverso la depolarizzazione quando esposto alla luce rossa, con picco di attivazione a circa 590 nm2. CsChrimson offre una migliore penetrazione nei tessuti rispetto alle precedenti canalrodopsine e riduce gli artefatti comportamentali indotti dalla luce negli studi su Drosophila 2. Al contrario, GtACR, che include varianti come GtACR2, è un canale del cloruro dipendente dalla luce che silenzia i neuroni attraverso l'iperpolarizzazione 3,4. GtACR2 conduce anioni ed è attivato dalla luce blu con un picco di attivazione intorno a 470 nm4. CsChrimson e GtACR2 sono attivati da lunghezze d'onda distinte della luce, garantendo un controllo preciso e indipendente dell'attività neuronale senza attivazione crociata5.
La Drosophila è un modello efficace per la ricerca neuroscientifica grazie al suo rapporto costo-efficacia, alla facilità di allevamento e alle robuste risposte comportamentali agli stimoli ambientali, compresi i comportamenti attrattivi e di evitamento6. Le sue dimensioni ridotte e la cuticola semitrasparente migliorano la penetrazione della luce, in particolare della luce rossa a lunghezza d'onda lunga, consentendo un'efficiente manipolazione optogenetica 7,8. Sebbene le cellule di Drosophila non siano in grado di produrre una quantità sufficiente di retina, un cofattore cruciale per la funzionalità delle canalrodopsine, l'aggiunta di retinale alla loro dieta compensa questa limitazione, garantendo un'efficace attivazione degli strumenti optogenetici9.
Per esplorare gli effetti della manipolazione optogenetica in Drosophila, descriviamo quattro esperimenti mirati a diversi circuiti neurali e comportamenti, ciascuno dei quali utilizza modalità distinte per valutare l'evitamento o le risposte attrattive, che vanno dai saggi su una singola mosca alle valutazioni basate su gruppi. Le cellule riscaldanti (HC) in Drosophila sono neuroni termosensoriali situati nell'arista, che rispondono agli aumenti di temperatura10. Questi neuroni esprimono canali ionici sensibili al calore che innescano il comportamento di evitamento, guidando le mosche lontano dalle fonti di calore10,11. Nell'approccio 1, abbiamo impiegato un saggio optogenetico di preferenza posizionale termotattica termotattica a luce blu a mosca singola per manipolare i neuroni HC. Esprimendo GtACR2 in questi neuroni, abbiamo inibito la loro attività in seguito all'esposizione alla luce blu. Le mosche sono state esposte a due opzioni di temperatura: 25 °C e 31 °C. Sotto la luce della stanza, le mosche hanno evitato il lato a 31 °C, dimostrando una tipica risposta termotattica. Tuttavia, l'attivazione della luce blu di GtACR2 ha silenziato i neuroni HC. Di conseguenza, i moscerini non hanno mostrato una preferenza di temperatura significativa, suggerendo un'inibizione optogenetica di successo. Oltre a valutare la funzione dei neuroni sensoriali, l'espressione di GtACR2 nei neuroni sensoriali a valle consente manipolazioni optogenetiche simili per studiare i circuiti neurali necessari per specifiche modalità sensoriali5.
Il recettore gustativo GR66a in Drosophila è espresso nei palpi labiali all'estremità distale della proboscide e nelle zampe, mediando la rilevazione del gusto amaro12,13. Questi neuroni innescano comportamenti di evitamento in risposta a sostanze amare. Nell'approccio 2, abbiamo utilizzato un saggio di preferenza posizionale optogenetica a luce rossa a mosca singola per manipolare i neuroni che esprimono GR66a. Esprimendo CsChrimson in questi neuroni, li abbiamo attivati in seguito all'esposizione alla luce rossa. Le mosche sono state collocate in un'arena con una metà esposta alla luce rossa e l'altra metà che filtrava la luce rossa. In assenza di semaforo rosso, le mosche non hanno mostrato alcuna preferenza. Tuttavia, l'attivazione della luce rossa di CsChrimson ha stimolato i neuroni sensibili all'amarezza, con conseguente significativo evitamento dell'area illuminata, confermando il successo dell'attivazione optogenetica dei neuroni GR66a. Approcci simili sono stati utilizzati per identificare i circuiti a valle delle celle di riscaldamento sufficienti per il comportamento di evitamento5.
Ci siamo concentrati sull'attivazione optogenetica del comportamento appetitivo nell'approccio 3. I neuroni che esprimono GR5a, situati nei sensilli del gusto sul labello e sulle zampe, rilevano gli zuccheri e guidano il comportamento alimentare. L'attivazione di questi neuroni innesca la risposta di estensione della proboscide (PER)14. Abbiamo utilizzato un saggio optogenetico di risposta all'estensione della proboscide a luci rosse per attivare i neuroni GR5a. Esprimendo CsChrimson in questi neuroni, li abbiamo stimolati con luce rossa. Le mosche non estendevano la loro proboscide in condizioni di luce ambientale. Tuttavia, l'attivazione della luce rossa di CsChrimson ha portato all'estensione della proboscide senza uno stimolo dolce, dimostrando il successo dell'attivazione optogenetica dei neuroni GR5a. Questo approccio è stato utilizzato per studiare il circuito neurale, inclusi i neuroni sensoriali gustativi, i neuroni di proiezione del gusto e i motoneuroni della proboscide15,16.
Nell'approccio 4, abbiamo studiato l'attivazione optogenetica dei comportamenti di evitamento in gruppi di mosche, utilizzando un test optogenetico del labirinto di mosche a luci rosse mirato ai neuroni GR66a. Le mosche sono state posizionate all'intersezione di due tubi: uno illuminato con luce rossa e l'altro ombreggiato. L'espressione di CsChrimson nei neuroni GR66a ha innescato l'evitamento. In assenza di luce rossa, le mosche non hanno mostrato preferenze, ma l'attivazione della luce rossa ha portato a esprimere mosche GR66a per evitare la luce rossa, suggerendo l'attivazione riuscita del percorso. I saggi del labirinto di mosche sono stati ampiamente utilizzati per studiare varie modalità sensoriali, tra cui temperatura, umidità e olfatto. Se combinato con l'optogenetica, questo approccio è potente per studiare sia i comportamenti attraenti che quelli di evitamento 17,18,19.
Questi metodi forniscono un quadro riproducibile per lo studio dell'attivazione optogenetica e dell'inibizione dei circuiti neurali della Drosophila . Utilizzando una combinazione di diverse canalrodopsine e saggi comportamentali accessibili, questo studio proof-of-concept dimostra l'efficacia della manipolazione optogenetica, fornendo metodi semplici per manipolare le funzioni dei circuiti neurali con potenziali applicazioni più ampie nella ricerca neuroscientifica.
Protocollo
1. Ceppi, allevamento di mosche e aspiratore di mosche
- Stiramenti e manutenzione
- I ceppi utilizzati negli esperimenti includono HC-Gal410, Gr5a-Gal420 (Bloomington Drosophila Stock Center (BDSC): 57592), Gr66a-Gal421 (BDSC: 57670), UAS-GtACR23, UAS-CsChrimson2 (BDSC: 55136). La parte posteriore vola a 25 °C su un mezzo di farina di mais standard con un ciclo di luce di 12 ore:12 ore di buio.
NOTA: 1 L di terreno di farina di mais contiene 1 L dH2O, 79 g di destrosio, 7,5 g di agar, 24 g di lievito in fiocchi, 57 g di farina di mais, 2,1 g di metil-4-idrossibenzoato (disciolto in 11,1 mL di etanolo), 6 g di tartrato di sodio e potassio tetraidrato e 0,9 g di cloruro di calcio.
- I ceppi utilizzati negli esperimenti includono HC-Gal410, Gr5a-Gal420 (Bloomington Drosophila Stock Center (BDSC): 57592), Gr66a-Gal421 (BDSC: 57670), UAS-GtACR23, UAS-CsChrimson2 (BDSC: 55136). La parte posteriore vola a 25 °C su un mezzo di farina di mais standard con un ciclo di luce di 12 ore:12 ore di buio.
- Allevamento di mosche e preparazione sperimentale
- Smistamento delle mosche da 0 a 3 giorni. Al momento della sperimentazione, le mosche avranno un'età compresa tra 3 e 6 giorni, garantendo la coerenza legata all'età (Figura 1A).
- Dividi ogni genotipo in quattro gruppi 3 giorni prima di condurre gli esperimenti: ATR con luce da stanza -, ATR con luce da stanza +, ATR con luce rossa o blu -, e ATR con luce rossa o blu +.
- Preparare 80 mM di soluzione madre ATR sciogliendo ATR in etanolo al 100%. Integrare il cibo con 400 μM di ATR ai gruppi ATR+.
- Integrare il cibo con la stessa concentrazione di etanolo ma senza ATR ai gruppi ATR.
- Retrocedere tutti i gruppi al buio22.
- Starve Gr5a>CsChrimson vola per 16-24 ore in fiale contenenti solo tessuto umido. I flaconcini ATR + contengono 400 μM di ATR miscelati con acqua, mentre i flaconcini ATR - contengono dH2O miscelati con la stessa concentrazione di etanolo.
- Aspiratore di mosche
- Assemblare l'aspiratore di mosche (Figura 1B) utilizzando un tubo di plastica, una rete per insetti e due pipette di trasferimento da 3 ml.
- Tagliare i puntali e i bulbi delle pipette di trasferimento, assicurandosi che il puntale di aspirazione della mosca consenta un comodo passaggio di una mosca. Questo design consente un'aspirazione delicata delle mosche attraverso l'inalazione, riducendo al minimo i danni e facilitando la raccolta e il trasferimento efficienti delle singole mosche.
- Stendere la rete anti-insetti sul tubo di plastica e fissare le estremità del bulbo della pipetta al tubo utilizzando Parafilm.
2. Saggio optogenetico di preferenza posizionale termotattica termotattica optogenetica a mosca singola
- Ceppi di Drosophila e allevamento di mosche
- Incrocia la linea di driver HC-Gal410 con UAS-GtACR23, ottenendo il genotipo sperimentale HC>GtACR2. I moscerini HC>GtACR2 esprimono GtACR2 nelle celle riscaldanti.
NOTA: Assicurarsi che venga utilizzato un numero uguale di mosche maschi e femmine per ogni condizione.
- Incrocia la linea di driver HC-Gal410 con UAS-GtACR23, ottenendo il genotipo sperimentale HC>GtACR2. I moscerini HC>GtACR2 esprimono GtACR2 nelle celle riscaldanti.
- Impostazione ed esecuzione del saggio sperimentale
- Allineare due piastre di acciaio su piastre riscaldanti separate in modo che i loro bordi si incontrino. Posiziona una protezione per fogli di plastica sopra, fissandola con del nastro adesivo per ridurre al minimo i movimenti. Posizionare un foglio di carta bianca sulla protezione del foglio per ridurre i segnali di rumore di fondo (Figura 1C).
NOTA: Sostituire la carta bianca all'inizio di ogni esperimento o quando è sporca. - Posizionare un coperchio di plastica trasparente (2 mm di altezza × 58 mm di larghezza × 83 mm di lunghezza) sopra la carta bianca. Questa copertura consente alla mosca di camminare liberamente impedendole di volare.
- Praticare un foro sul fondo di una scatola di polistirene espanso (27 cm di altezza × 22 cm di larghezza × 16 cm di lunghezza) in modo che aderisca alla telecamera e alla luce blu (1.000 mA) a circa 12 cm sopra la superficie sperimentale.
- Posizionare la fotocamera e la luce blu per ridurre al minimo l'abbagliamento e abilitare l'attivazione.
NOTA: Potrebbe essere necessario un pretest per determinare il raggio di attivazione della luce blu. - Impostare la fotocamera per la registrazione con le seguenti impostazioni: timelapse di 1 s, campo stretto, 4000 × 3000 pixel.
- Regolare le impostazioni della piastra riscaldante per mantenere una temperatura superficiale di 25 ± 1 °C e 31 ± 1 °C sulle rispettive piastre in acciaio.
NOTA: Per le condizioni che richiedono temperature inferiori a 25 °C, sono necessari metodi di raffreddamento alternativi, come i dispositivi Peltier o il ghiaccio. Se le temperature delle piastre di acciaio superano i livelli desiderati, spruzzare la superficie con acqua distillata per raggiungere e mantenere le condizioni richieste. Quindi, usa un tovagliolo per assorbire l'umidità in eccesso dalla protezione del foglio di plastica. - Prima e dopo ogni prova, monitorare le temperature utilizzando una sonda di temperatura superficiale.
NOTA: Un controllo preciso della temperatura è fondamentale, poiché le fluttuazioni possono influire sui risultati. - Posizionare il coperchio di plastica sul lato a 25 °C. Utilizzando un aspiratore di mosche, rilasciare delicatamente una singola mosca sotto il coperchio. Posiziona la scatola sopra l'area sperimentale per creare una luce fioca (<10 lux) e lascia che la mosca si acclimati per 1 minuto.
- Trascorso il periodo di acclimatazione, sollevare la scatola e regolare rapidamente il coperchio in plastica, posizionandolo con il centro del coperchio allineato con il bordo della piastra in acciaio per garantire una copertura uniforme dei lati a 25 °C e 31 °C.
NOTA: Durante questo processo, la temperatura dell'aria e la temperatura all'interno del coperchio sul lato a 31 °C aumentano a circa 27 °C entro 5 s (Figura supplementare 1), sufficienti per attivare le celle di riscaldamento11. - Avvia la prova accendendo la fotocamera e la luce blu (20 kLux).
NOTA: Non accendere la luce blu in condizioni di luce ambientale. Accendi la fotocamera e registra alcuni fotogrammi prima di accendere la luce blu in caso di movimento. - Dopo più di 2 minuti, terminare la prova spegnendo la fotocamera e la luce. Smaltire le mosche utilizzando l'aspiratore.
NOTA: Registrare alcuni fotogrammi in più in caso di movimento quando si spegne la fotocamera.
- Allineare due piastre di acciaio su piastre riscaldanti separate in modo che i loro bordi si incontrino. Posiziona una protezione per fogli di plastica sopra, fissandola con del nastro adesivo per ridurre al minimo i movimenti. Posizionare un foglio di carta bianca sulla protezione del foglio per ridurre i segnali di rumore di fondo (Figura 1C).
- Analisi comportamentale e statistica
- All'inizio della prova, analizza solo i dati delle mosche che rimangono sul lato dei 25 °C.
NOTA: Scartare i dati dei moscerini che iniziano le prove sul lato a 31 °C, che spesso mostrano preferenze alterate23. Scartare le prove che coinvolgono mosche che non si avvicinano al bordo del lato di 31 °C, assicurandosi che abbiano fatto una scelta tra le temperature. Scartare i dati dalle mosche che rimangono ferme per oltre 30 s. - Analizzare i risultati utilizzando le procedure descritte in precedenza23. Calcola l'indice di preferenza (PI) come il rapporto tra la differenza di tempo che la mosca ha trascorso in ciascuna zona di temperatura e il tempo totale, come mostrato nella seguente formula:
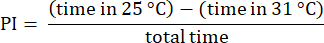
NOTA: I dettagli statistici per gli esperimenti sono forniti nelle legende delle figure. L'analisi dei dati viene eseguita utilizzando un software di analisi dei dati appropriato.
- All'inizio della prova, analizza solo i dati delle mosche che rimangono sul lato dei 25 °C.
3. Saggio di preferenza posizionale optogenetica a luce rossa a mosca singola
- Ceppi di Drosophila e allevamento di mosche
- Incrocia la linea del driver Gr66a-Gal421 con UAS-CsChrimson2, ottenendo il genotipo sperimentale Gr66a>CsChrimson. Le mosche Gr66a>CsChrimson esprimono CsChrimson nei neuroni del gusto amaro.
NOTA: Assicurarsi che venga utilizzato un numero uguale di mosche maschi e femmine per ogni condizione.
- Incrocia la linea del driver Gr66a-Gal421 con UAS-CsChrimson2, ottenendo il genotipo sperimentale Gr66a>CsChrimson. Le mosche Gr66a>CsChrimson esprimono CsChrimson nei neuroni del gusto amaro.
- Impostazione ed esecuzione del saggio sperimentale
- Condurre il test in una stanza buia o in un ambiente buio per garantire un'attivazione controllata di CsChrimson (Figura 1D).
- Posizionare una videocamera a circa 45 cm sopra la superficie sperimentale.
- Utilizzare una videocamera senza filtro a infrarossi. Se una videocamera è dotata di un filtro interno a infrarossi passa-corto che blocca lunghezze d'onda superiori a 700 nm, rimuoverlo.
- Far aderire un filtro passa-lungo da 830 nm sull'obiettivo utilizzando la super colla per catturare le lunghezze d'onda dell'infrarosso. Questa regolazione è essenziale per registrare il movimento della mosca in condizioni di luce infrarossa.
- Posizionare una sorgente di luce rossa24 a circa 45 cm sopra la superficie sperimentale, garantendo un'intensità luminosa di circa 2,5 kLux (1.000 mA).
NOTA: Si consiglia un'adeguata protezione per gli occhi in grado di filtrare il laser/la luce rossa. Gli occhiali di sicurezza laser aiutano a prevenire potenziali danni agli occhi dovuti all'esposizione diretta a un'intensa luce rossa. - Usa una luce a infrarossi per visualizzare le mosche all'interno della configurazione. Tienilo acceso per tutta la durata dell'esperimento.
NOTA: Evitare l'abbagliamento nell'area sperimentale causato dalla luce infrarossa; L'abbagliamento può complicare l'analisi dei dati. - Utilizzare la colla per collegare un filtro passa-lungo a infrarossi da 780 nm a metà del coperchio di plastica.
NOTA: Utilizzare qualsiasi filtro passa-lungo che blocchi le lunghezze d'onda inferiori a 780 nm. Il lato non filtrato consente il passaggio della luce rossa e degli infrarossi, mentre il lato filtrato consente il passaggio solo della luce infrarossa. - Posiziona un materiale nero opaco sotto l'area sperimentale per ridurre al minimo il rumore di fondo.
- Posizionare una singola mosca sotto una copertura di plastica trasparente (2 mm di altezza × 58 mm di larghezza × 83 mm di lunghezza) utilizzando un aspiratore a mosca e lasciarla acclimatare per 1 minuto.
- Attendi che la mosca sia visibile sul lato non filtrato. Inizia la prova accendendo la videocamera e la luce rossa.
NOTA: La videocamera è soggetta a movimenti subito dopo l'avvio. Fissare accuratamente la fotocamera durante la registrazione e accenderla alcuni secondi prima della registrazione per evitare movimenti aberranti che potrebbero complicare l'analisi. Non accendere la luce rossa fino all'inizio della prova. - Registra il movimento della mosca per 1 minuto.
NOTA: Scartare le prove in cui la mosca non si avvicina alla linea mediana o non si muove per più di 15 s. - Dopo 1 minuto, terminare la prova spegnendo la videocamera e la luce. Smaltire le mosche utilizzando l'aspiratore.
NOTA: Registrare alcuni fotogrammi in più per evitare gli effetti del movimento quando si spegne la fotocamera.
- Analisi comportamentale e statistica
- Analizzare i risultati utilizzando le procedure descritte in precedenza23. Calcola l'indice di preferenza (PI) come il rapporto tra la differenza tra il tempo trascorso dalla mosca nell'area senza filtro e l'area con il filtro e il tempo totale, come mostrato nella seguente formula:
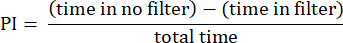
NOTA: I dettagli statistici per gli esperimenti sono forniti nelle legende delle figure. L'analisi dei dati viene eseguita utilizzando un software di analisi dei dati appropriato.
- Analizzare i risultati utilizzando le procedure descritte in precedenza23. Calcola l'indice di preferenza (PI) come il rapporto tra la differenza tra il tempo trascorso dalla mosca nell'area senza filtro e l'area con il filtro e il tempo totale, come mostrato nella seguente formula:
4. Risposta all'estensione della proboscide optogenetica a luci rosse
- Ceppi di Drosophila e allevamento di mosche
- Incrocia la linea del driver Gr5a-Gal420 con UAS-CsChrimson2, ottenendo il genotipo sperimentale denominato Gr5a>CsChrimson. Le mosche Gr5a>CsChrimson esprimono CsChrimson nei neuroni del recettore del gusto dolce.
NOTA: Assicurarsi che venga utilizzato un numero uguale di mosche maschi e femmine per ogni condizione. - Affamare le mosche per 16-24 ore con ATR (ATR +) o senza (ATR -) prima del test.
NOTA: Potrebbero essere necessari periodi di fame più lunghi per suscitare una risposta forte.
- Incrocia la linea del driver Gr5a-Gal420 con UAS-CsChrimson2, ottenendo il genotipo sperimentale denominato Gr5a>CsChrimson. Le mosche Gr5a>CsChrimson esprimono CsChrimson nei neuroni del recettore del gusto dolce.
- Impostazione ed esecuzione del saggio sperimentale
- Anestetizzare le mosche raffreddandole sul ghiaccio (Figura 1E).
NOTA: Evitare il contatto diretto tra mosche e ghiaccio. Limitare il tempo di raffreddamento a circa 1 minuto; Il raffreddamento prolungato può causare problemi di recupero e mortalità. - Utilizzare la punta di una punta per pipetta da 1000 μl per applicare 7-10 piccoli punti di colla sui vetrini.
NOTA: Piccole gocce di colla sul vetrino assicurano che la mosca non venga sommersa e aiutano a evitare che la colla si attacchi alla proboscide o alle zampe. - Posiziona una mosca, con il lato ventrale rivolto verso l'alto, su ogni punto di colla. Assicurarsi che il torace e le ali entrino in contatto con la colla per ridurre al minimo il movimento. Aprire le ali a ventaglio su ciascun lato per aumentare la superficie adesiva.
NOTA: Evitare di posizionare le mosche troppo vicine tra loro, che potrebbero inavvertitamente attivare più mosche durante l'esposizione alla luce. - Lasciare asciugare la colla per circa 10 minuti.
- Trasferire i vetrini in una scatola per l'umidità (una scatola di plastica con tovaglioli di carta bagnati) e lasciare che le mosche si riprendano per 2 ore.
- Posizionare il vetrino sotto il microscopio. Usa una siringa per erogare una goccia d'acqua per saziare le mosche, prevenendo le estensioni della proboscide indotte dalla sete.
- Tenere premuto manualmente un puntatore laser rosso per emettere luce rossa sulla proboscide/testa di una singola mosca (700 lux) mentre si osserva la risposta PER attraverso il microscopio.
NOTA: Una protezione per gli occhi in grado di filtrare il laser/luce rossa è essenziale quando si osserva la luce rossa attraverso il microscopio. - Osserva e registra l'estensione della proboscide entro una finestra di 30 secondi. Segna ogni mosca utilizzando il seguente sistema di registrazione: 0 indica nessuna estensione, 0,5 indica 1-2 s di estensione, 1 indica che l'estensione dura oltre 3 s.
- Dopo aver testato l'estensione della proboscide indotta dalla luce, esaminare la risposta al saccarosio al 4% utilizzando una siringa. Espellere una gocciolina di saccarosio all'estremità dell'ago e avvicinarla alla proboscide della mosca.
NOTA: Scartare i dati dei moscerini che non rispondono alla gocciolina di saccarosio.
- Anestetizzare le mosche raffreddandole sul ghiaccio (Figura 1E).
- Analisi comportamentale e statistica
- Eseguire analisi statistiche utilizzando un software di analisi dei dati appropriato.
NOTA: I dettagli statistici per gli esperimenti sono forniti nelle legende delle figure.
- Eseguire analisi statistiche utilizzando un software di analisi dei dati appropriato.
5. Saggio optogenetico del labirinto di mosche a luci rosse
- Ceppi di Drosophila e allevamento di mosche
- Incrocia la linea del driver Gr66a-Gal421 con UAS-CsChrimson2, ottenendo il genotipo sperimentale Gr66a>CsChrimson. Le mosche Gr66a>CsChrimson esprimono CsChrimson nei neuroni del gusto amaro.
NOTA: Assicurati che ogni gruppo contenga un numero uguale di mosche maschi e femmine.
- Incrocia la linea del driver Gr66a-Gal421 con UAS-CsChrimson2, ottenendo il genotipo sperimentale Gr66a>CsChrimson. Le mosche Gr66a>CsChrimson esprimono CsChrimson nei neuroni del gusto amaro.
- Assemblaggio del labirinto di mosche
- Crea il labirinto di mosche come mostrato nella Figura 1F.
NOTA: In alternativa, stampare in 3D i componenti del labirinto di mosche, assemblandoli come precedentemente descritto25. - Tagliare tre provette di coltura in plastica da 5 mL alla lunghezza corretta per ottenere una provetta di caricamento, una provetta trasparente scoperta e una provetta ricoperta di alluminio. Fissare i tubi al labirinto di mosche come mostrato nella Figura 1F.
- A seconda del materiale del labirinto, tagliare i tubi di prova per garantire la stessa distanza per ogni condizione di prova. In base alla lunghezza della camera di contenimento, accorciare la provetta scoperta in un labirinto trasparente, accorciando la provetta ricoperta di pellicola se il labirinto è opaco.
- Crea il labirinto di mosche come mostrato nella Figura 1F.
- Impostazione ed esecuzione del saggio sperimentale
- In condizioni di oscurità o scarsa illuminazione, posizionare 10 maschi e 10 femmine nel tubo di caricamento. Collegare il tubo di caricamento alla camera di supporto. Inclinare l'elevatore e picchiettare delicatamente il tubo per spostare le mosche nella camera di contenimento.
NOTA: Abbassare l'elevatore in modo che solo metà della camera di contenimento sia aperta. Questa manipolazione facilita il trasferimento delle mosche dal tubo di carico alla camera di contenimento. - Dopo che le mosche sono state trasferite nella camera di contenimento, utilizzare l'elevatore per abbassare le mosche tra il tubo di caricamento e i fori del tubo di prova. Quindi, rimuovere il tubo di caricamento.
- Posizionare il labirinto di mosche a circa 13 cm di distanza dalla fonte di luce rossa (1000 mA) senza accendere la luce.
- Abbassare l'elevatore fino a quando la camera di supporto non si allinea con i fori del tubo di prova, consentendo alle mosche di muoversi liberamente tra le provette avvolte nella pellicola e quelle scoperte. Contemporaneamente, accendi la luce rossa per attivare CsChrimson. Assicurarsi che l'intensità della luce rossa sulla superficie della provetta scoperta sia di circa 40 kLux.
NOTA: Non accendere la luce rossa finché la camera di supporto non è abbassata e allineata con i fori della provetta. Si consiglia un'adeguata protezione per gli occhi in grado di filtrare il laser/luce rossa a causa dell'intensa luminosità della luce rossa. - Le mosche scelgono tra il tubo esposto alla luce rossa e il tubo ombreggiato per un minuto.
- Dopo 1 minuto, sollevare l'elevatore tra il tubo di carico e i fori del tubo di prova. Conta le mosche in ogni tubo.
NOTA: Vengono conteggiate solo le mosche attive e non ferite. - Pulisci l'elevatore e il labirinto di mosche usando dH2O dopo ogni prova.
- In condizioni di oscurità o scarsa illuminazione, posizionare 10 maschi e 10 femmine nel tubo di caricamento. Collegare il tubo di caricamento alla camera di supporto. Inclinare l'elevatore e picchiettare delicatamente il tubo per spostare le mosche nella camera di contenimento.
- Analisi dei dati e statistiche
- Calcola l'indice di preferenza (PI) come il rapporto tra la differenza nel numero di mosche tra i tubi scoperti e coperti e il numero totale di mosche, come mostrato nella seguente formula:
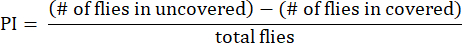
NOTA: I dettagli statistici per gli esperimenti sono forniti nelle legende delle figure. L'analisi dei dati viene eseguita utilizzando un software di analisi dei dati appropriato
- Calcola l'indice di preferenza (PI) come il rapporto tra la differenza nel numero di mosche tra i tubi scoperti e coperti e il numero totale di mosche, come mostrato nella seguente formula:
Risultati
Saggio di preferenza posizionale termotattica termotattica optogenetica a luce blu a mosca singola
Sono state testate quattro condizioni: luce della stanza senza integrazione di ATR (luce della stanza, ATR -), luce della stanza con integrazione di ATR (luce della stanza, ATR+), luce blu senza integrazione di ATR (blu, ATR -) e luce blu con integrazione di ATR (blu, ATR+). Le prime tre condizioni servivano da controlli. Negli esperimenti di controllo, le mosche hanno evitato il lato a 31 °C. Nella luce blu con integrazione di ATR, i moscerini non hanno mostrato alcuna preferenza tra 25 °C e 31 °C, indicando una corretta inibizione dei neuroni HC mediante l'attivazione di GtACR2 (Figura 2A).
Saggio di preferenza posizionale optogenetica a luce rossa a mosca singola
Sono state testate quattro condizioni: luce della stanza senza integrazione di ATR (luce della stanza, ATR -), luce della stanza con integrazione di ATR (luce della stanza, ATR+), luce rossa senza integrazione di ATR (rosso, ATR -) e luce rossa con integrazione di ATR (rosso, ATR+). Le prime tre condizioni servivano da controlli. Le mosche in condizioni di controllo non hanno mostrato alcuna preferenza, con una distribuzione simile tra i due lati. L'attivazione della luce rossa con l'integrazione di ATR (rosso, ATR +) guida i mosche per evitare l'area della luce rossa, suggerendo che i neuroni sensibili all'amaro sono attivati da CsChrimson per guidare il comportamento di evitamento (Figura 2B). Abbiamo osservato una leggera ma significativa differenza tra maschi e femmine (Figura supplementare 2), che potrebbe essere dovuta al ruolo delle cellule gustative faringee GR66a-positive nel mediare l'attrazione per la deposizione delle uova26.
Risposta all'estensione della proboscide optogenetica a luci rosse
Sono state testate quattro condizioni: luce della stanza senza integrazione di ATR (luce della stanza, ATR -), luce della stanza con integrazione di ATR (luce della stanza, ATR+), luce rossa senza integrazione di ATR (rosso, ATR -) e luce rossa con integrazione di ATR (rosso, ATR+). Le prime tre condizioni servivano da controlli. I moscerini in condizioni di controllo hanno mostrato un PER minimo, coerente con l'assenza di uno stimolo appetitivo. Tuttavia, un PER significativo è stato osservato nei moscerini sotto attivazione della luce rossa con l'integrazione di ATR (rosso, ATR +), indicando l'attivazione dei neuroni sensibili al dolce da parte di CsChrimson (Figura 2C).
Saggio optogenetico del labirinto di mosche a luci rosse
Sono state testate quattro condizioni: luce della stanza senza integrazione di ATR (luce della stanza, ATR -), luce della stanza con integrazione di ATR (luce della stanza, ATR+), luce rossa senza integrazione di ATR (rosso, ATR -) e luce rossa con integrazione di ATR (rosso, ATR+). I primi tre gruppi fungevano da controlli. Nei gruppi di controllo, i moscerini non hanno mostrato una preferenza tra i tubi ricoperti di pellicola e quelli scoperti. Sotto la luce rossa, con l'integrazione di ATR, le mosche Gr66a>CsChrimson hanno evitato il tubo scoperto esposto alla luce rossa, indicando che l'attivazione dei neuroni sensibili all'amaro guida il comportamento di evitamento (Figura 2D).

Figura 1: Panoramica sull'allevamento delle mosche, preparazioni sperimentali e saggi comportamentali. (A) Allevamento e preparazione della mosca. (B) Costruzione di aspiratori al volo. (C) Impostazione per il saggio di preferenza posizionale termotattica termotattica optogenetica a luce blu a mosca singola. (D) Preparazione per il saggio optogenetico di preferenza posizionale a luce rossa a mosca singola. (E) Preparazione per il saggio di risposta optogenetica alla risposta all'estensione della proboscide a luci rosse. (F) Preparazione per il saggio optogenetico del labirinto di mosche a luci rosse. Clicca qui per visualizzare una versione più grande di questa figura.
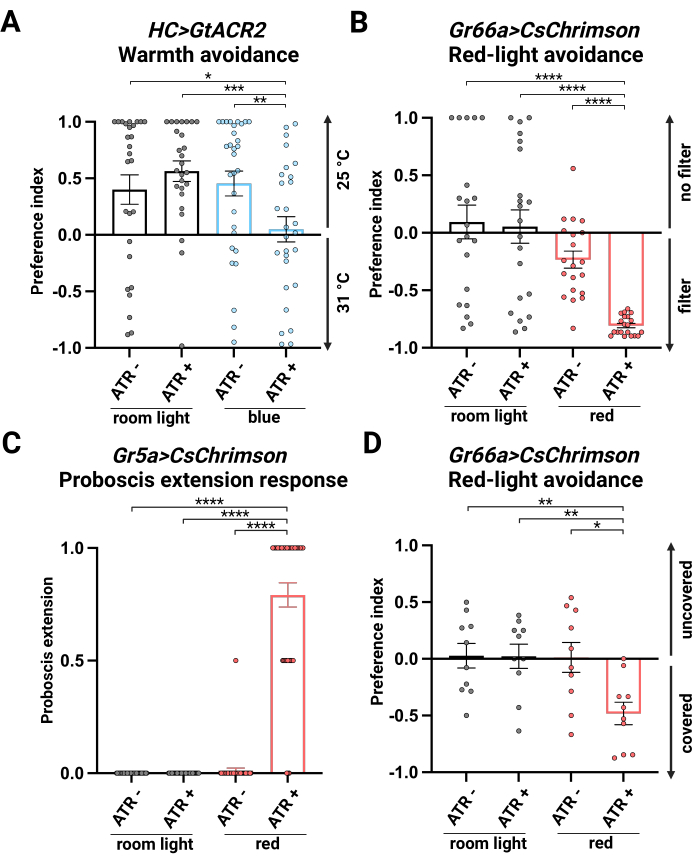
Figura 2: Risultati dell'esperimento optogenetico. (A) Indice di preferenza (PI) di HC>GtACR2 nel saggio di preferenza posizionale termotattica termotattica optogenetica a luce blu a mosca singola. n = 26-31, i dati rappresentano la media ± S.E.M.; * p < 0,05, ** p < 0,01, *** p < 0,001, test di Mann-Whitney. (B) PI di Gr66a>CsChrimson nel saggio di preferenza posizionale optogenetica a luce rossa a mosca singola. n = 20-21, i dati rappresentano la media ± S.E.M.; p < 0,0001, test di Mann-Whitney. (C) PI di Gr5a>CsChrimson nella risposta di estensione della proboscide optogenetica a luci rosse. n = 36-44, i dati rappresentano la media ± S.E.M.; p < 0,0001, test di Mann-Whitney. (D) PI di Gr66a>CsChrimson nel saggio optogenetico del labirinto di mosche a luci rosse. n = 10, i dati rappresentano la media ± S.E.M.; * p < 0,05, ** p < 0,01, test di Mann-Whitney. Clicca qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1. Le variazioni di temperatura nel saggio di preferenza posizionale termotattica termotattica optogenetica a luce blu a mosca singola. La temperatura cambia sul lato a 31 °C dopo aver posizionato il coperchio dal lato a 25 °C fino a quando il suo centro non si allinea con il bordo della piastra d'acciaio nel saggio di preferenza posizionale termotattica termotattica optogenetica a luce blu a mosca singola. Clicca qui per scaricare questo file.
Figura 2 supplementare: I moscerini Gr66a>CsChrimson maschi e femmine si comportano in modo diverso nel saggio di preferenza posizionale optogenetica a luce rossa a mosca singola. n = 10, i dati rappresentano la media ± S.E.M.; * p < 0,05, test di Mann-Whitney. Clicca qui per scaricare questo file.
Discussione
La manipolazione optogenetica ha trasformato il campo delle neuroscienze consentendo un controllo preciso dei circuiti neurali con accuratezza spazio-temporale27. Un circuito neurale comprende popolazioni di neuroni interconnessi da sinapsi, che svolgono funzioni specifiche dopo l'attivazione. Il connettoma dell'intero cervello di Drosophila è stato completato, offrendo una visione completa delle vie sinaptiche all'interno del cervello di Drosophila 28,29. Sebbene il connettoma sia in grado di prevedere potenziali meccanismi circuitali alla base di determinati comportamenti, è necessaria un'ulteriore convalida sperimentale. Combinando strumenti genetici e saggi comportamentali, la manipolazione optogenetica fornisce un approccio potente per esplorare il ruolo dei circuiti neurali nelle funzioni comportamentali. Ad esempio, l'integrazione del trans-Tango con tecniche optogenetiche consente l'attivazione o il silenziamento dei neuroni a valle, consentendo ai ricercatori di determinare il significato comportamentale dei singoli neuroni postsinaptici 5,30.
Questo studio ha stabilito protocolli optogenetici semplici, accessibili e riproducibili per i saggi comportamentali in Drosophila melanogaster. Progettando quattro approcci sperimentali che prendono di mira circuiti neurali distinti, dimostriamo come sia l'attivazione che l'inibizione dei neuroni possano essere raggiunte in modo efficiente. I risultati convalidano l'uso di CsChrimson e GtACR2 nello studio di diversi comportamenti come la termotassi e le risposte gustative, mostrando la versatilità delle tecniche optogenetiche nella ricerca sulla Drosophila .
Il gruppo ATR - ha mostrato un andamento simile al gruppo ATR+ nel saggio di preferenza posizionale optogenetica a luce rossa a mosca singola (Figura 2B). Questi risultati indicano che l'ATR endogeno può essere sufficiente per attivare un basso livello di proteine CsChrimson. Sebbene i controlli genetici, come i controlli wildtype, Gal4 e UAS, possano aiutare a mitigare questi problemi, hanno i loro problemi. Ad esempio, i controlli UAS possono mostrare un'espressione permeabile e il background genetico può influenzare il comportamento. Pertanto, l'integrazione di una serie completa di controlli, compresi i controlli genetici e ATR, è essenziale per garantire i risultati più solidi e convincenti. Il metodo tradizionale per valutare la risposta all'estensione della proboscide consiste nell'spingere una mosca attraverso un puntale di pipetta31. Usiamo la colla per immobilizzare le mosche, migliorando significativamente la produttività e diminuendo le sfide tecniche. Oltre al comportamento di evitamento, il test optogenetico del labirinto di mosche a luci rosse può essere utilizzato anche per testare comportamenti attraenti, ad esempio attivando i neuroni che guidano i comportamenti appetitivi. Se è necessario tracciare il comportamento di scelta della mosca tra le due condizioni, la provetta può essere coperta utilizzando un filtro a infrarossi passa-lungo da 780 nm invece della pellicola.
Per garantire il successo della manipolazione optogenetica, è essenziale selezionare una fonte di luce appropriata. Quando si effettua questa scelta, è necessario considerare i seguenti fattori: (1) Diverse canalrodopsine sono attivate da specifiche lunghezze d'onda della luce. Ad esempio, CsChrimson è attivato dalla luce rossa con un picco a 590 nm, GtACR1 è attivato dalla luce verde con un picco a 515 nm e GtACR2 è attivato dalla luce blu con un picco a 470 nm 2,3,4. Per attivare e silenziare gli stessi neuroni, CsChrimson e GtACR2 possono essere utilizzati in combinazione per evitare l'attivazione crociata5, mentre GtACR1 non è l'ideale per l'uso concomitante con CsChrimson. (2) La luce rossa penetra nei tessuti delle mosche in modo più efficace e ha un impatto minore sulla fototassi delle mosche7. Quando possibile, si consiglia di utilizzare canalrodopsine spostate verso il rosso, come CsChrimson. (3) L'intensità della luce è fondamentale per il successo. Una bassa intensità potrebbe non riuscire ad attivare i neuroni, mentre un'intensità eccessiva potrebbe alterare il comportamento fototattico o danneggiare i tessuti. Suggeriamo di iniziare gli esperimenti con un'intensità luminosa relativamente alta ed esporre le mosche per la durata minima richiesta. Una volta osservato il comportamento desiderato, ridurre gradualmente l'intensità della luce - questo può essere facilmente ottenuto aumentando la distanza tra la fonte di luce e le mosche - fino a identificare l'intensità ottimale.
Un obiettivo fondamentale di questo lavoro è quello di sviluppare protocolli che siano semplici da implementare nella maggior parte dei laboratori di Drosophila. Ogni configurazione utilizza materiali e attrezzature comunemente disponibili, rendendo i metodi adatti ai laboratori con risorse limitate. I saggi descritti sono convenienti e di facile utilizzo, riducendo al minimo le sfide tecniche e garantendo la riproducibilità. Il costo per ogni configurazione varia da meno di $ 10 per il saggio di risposta optogenetica della risposta all'estensione della proboscide a luce rossa (escluso il microscopio da dissezione) a circa $ 100 per il test del labirinto optogenetico a luce rossa e il saggio di preferenza posizionale optogenetica a luce rossa a mosca singola, a diverse centinaia di dollari per il saggio di preferenza posizionale termotattica termotattica optogenetica a luce blu a mosca singola, che richiede una sonda di temperatura superficiale, un termometro compatibile e due piastre riscaldanti (l'apparecchiatura di registrazione non è inclusa in queste stime, poiché i suoi costi variano notevolmente e molti laboratori potrebbero già possederla). Questa semplicità supporta l'adozione di strumenti optogenetici in contesti educativi. Diversi rapporti hanno dimostrato l'applicazione dell'optogenetica di Drosophila nei laboratori didattici, consentendo agli studenti universitari di esplorare i principi dell'optogenetica e capire come i neuroni sensoriali e i loro circuiti neurali a valle regolano i comportamenti 25,32,33.
In conclusione, forniamo protocolli optogenetici facili da seguire e rispettosi delle risorse. Concentrandosi su metodologie chiare e risultati riproducibili, questo studio promuove l'optogenetica come strumento standard per le neuroscienze, migliorando la nostra comprensione della funzione neurale attraverso tecniche prontamente implementabili.
Divulgazioni
Gli autori dichiarano che non sussistono conflitti di interesse in merito alla pubblicazione di questo articolo. Tutti gli autori hanno rivelato eventuali conflitti potenziali e affermano di non avere relazioni finanziarie o personali che potrebbero influenzare il lavoro presentato in questo studio.
Riconoscimenti
I diagrammi schematici per tutte le figure sono stati creati con Biorender.com. Questo lavoro è stato sostenuto da NIH R01GM140130 (https://www.nigms.nih.gov/) a L.N. I finanziatori non hanno avuto alcun ruolo nella progettazione dello studio, nella raccolta e nell'analisi dei dati, nella decisione di pubblicazione o nella preparazione del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 1000 mA LED driver | Luxeon Star | 3021-D-E-1000 | |
| 5 mL VWR Culture Tubes, Plastic, with Dual-Position Caps | VWR | 60818-664 | |
| 780 Longpass Filter / IR 780 nm 100 mm x 100 mm | Lee Filters | BH #LE8744 | Cut to approximately 47 x 100 fit the plastic cover |
| Agfabric 6.5 ft. x 15 ft. Insect Bug Netting Garden Net for Protecting Plants Vegetables Flowers Fruits | The Home Depot | EIBNW6515 | |
| All trans retinal | Sigma-Aldrich | 116-31-4 | |
| Aluminum Plate (30.5 cm x 30.5 cm x 0.6 cm) | Amazon | purchased from Amazon | |
| Black Plastic Box | LI-COR | 929-97101 | |
| CALCIUM CHLORIDE ANHYDRO 25GR | Thermo Fisher Scientific | AC297150250 | |
| CX405 Handycam with Exmor R CMOS sensor | SONY | HDR-CX405 | |
| Elmer’s “School Glue” | Elmer | ||
| Ethyl alcohol, Pure (200 Proof) | Sigma-Aldrich | E7023 | |
| Fisherbrand Isotemp Hot Plate Stirrer | Fisher Scientific | SP88850200 | |
| Fly line: Gr5a-Gal4 | Bloomington Drosophila Stock Center | 57592 | |
| Fly line: Gr66a-Gal4 | Bloomington Drosophila Stock Center | 57670 | |
| Fly line: HC-Gal4 (II) | Dr. Marco Gallio Lab | A kind gift | |
| Fly line: UAS-CsChrimson | Bloomington Drosophila Stock Center | 55136 | |
| Fly line: UAS-GtACR2/TM6B | Dr. Quentin Gaudry Lab | A kind gift | |
| Flystuff 62-101 Yellow Cornmeal (11.3 Kg), Yellow, 11.3 Kg/Unit | Genesee Scientific | 62-101 | |
| Flystuff 62-107 Inactive Dry Yeast, 10 Kg, Nutritional Flake, 10 Kg/Unit | Genesee Scientific | 62-107 | |
| Flystuff 66-103 Nutri-Fly Drosophila Agar, Gelidium, 100 Mesh, 5 Kg (11.02 lbs)/Unit | Genesee Scientific | 66-103 | |
| FreeMascot OD 8+ 190 nm–420 nm / 600 nm–1100 nm Wavelength Violet/Red/Infrared Laser Safety Glasses | FreeMascot | B08LGMQ65S | purchased from Amazon |
| GoPro Hero8 Black | GoPro | 6365359 | |
| LEE Filters 100×100 mm Infra Red #87 Infrared Polyester Filter | B&H Photo | LE8744 | |
| Longpass Filter, Colored Glass, 50.8 x 50.8 mm, 830 nm Cut-on, RG830 | Newport | FSQ-RG830 | |
| Methyl 4-hydroxybenzoate, 99%, Thermo Scientific Chemicals | Thermo Fisher Scientific | 126960025 | |
| MicroWell Mini Tray 60 Well, Low Profile NS PS | Thermal Scientific | NUNC 439225 | The lids are used as the "plastic cover" |
| Olympus Plastics 24-160RS, 1000 µL Olympus Ergonomic Pipet Tips Low Binding, Racked, Sterile, 8 Racks of 96 Tips/Unit | Eppendorf | 24-160RS | |
| Parafilm M Sealing Film | Heathrow Scientific | HS234526B | 4 in x 125 feet |
| Potassium chloride, ACS, 99.0-100.5%, | Thermo Fisher Scientific | AA1159530 | |
| Prism | GraphPad | Version 9 | data analysis software |
| Samco Graduated Transfer Pipettes | Thermo Fisher Scientific | 225 | 3 mL |
| Slides | Fisher Scientific | 12-544-2 | 5 mm x 75 mm x 1.0 mm |
| Stereo microscope | OLYMPUS | CZ61 | |
| Styrofoam box (27 cm height × 22 cm width × 16 cm length) | |||
| Sucrose | Fisher Scientific | 225911 | |
| Surface temperature probe | Fluke | 80PK-3A | |
| Syringe | BD Integra | 305270 | |
| Tate & Lyle 457 Dextrose, Tate & Lyle, Pow, Tate & Lyle 457 Dextrose, Tate & Lyle, Powder, 50 lbs/Unit | Genesee Scientific | 62-113 | |
| Traceable Calibrated Big-Digit Thermocouple Thermometer | Traceable by cple-parmer | UX-91210-07 | Fisherbrand Traceable BigDigit Type K Thermometer |
| Triple blue LED starboard | LEDSupply | 07007-PB000-D | 470 nm |
| Triple red LED starboard | LEDSupply | 07007-PD000-F | 627 nm |
| Tygon PVC Clear Tubing 1/4" ID, 3/8" OD, 5 ft. Length | McMaster Carr Supply Company | 6516T21 | |
| Univivi IR Illuminator, 850nm 12 LEDs Wide Angle IR Illuminator for Night Vision | Univivi | 4331910725 | |
| Wakefield Thermal 25.4 mm Round Heatsink Star LED Board - 882-100AB | Wakefield-Vette | 882-100AB | |
| Wireless Presenter | DinoFire Store | B01410YNAM | purchased from Amazon |
Riferimenti
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in neural systems. Neuron. 71 (1), 9-34 (2011).
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nat Methods. 11 (3), 338-346 (2014).
- Mauss, A. S., Busch, C., Borst, A. Optogenetic neuronal silencing in drosophila during visual processing. Sci Rep. 7 (1), 13823 (2017).
- Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X., Spudich, J. L. Neuroscience. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349 (6248), 647-650 (2015).
- Castaneda, A. N., et al. Functional labeling of individualized postsynaptic neurons using optogenetics and trans-tango in drosophila (flipsot). PLoS Genet. 20 (3), e1011190 (2024).
- Fischer, F. P., et al. Drosophila melanogaster as a versatile model organism to study genetic epilepsies: An overview. Front Mol Neurosci. 16, 1116000 (2023).
- Aragon, M. J., et al. Multiphoton imaging of neural structure and activity in drosophila through the intact cuticle. Elife. 11, e69094 (2022).
- Zhang, W., Ge, W., Wang, Z. A toolbox for light control of drosophila behaviors through channelrhodopsin 2-mediated photoactivation of targeted neurons. Eur J Neurosci. 26 (9), 2405-2416 (2007).
- Kono, M., Goletz, P. W., Crouch, R. K. 11-cis- and all-trans-retinols can activate rod opsin: Rational design of the visual cycle. Biochemistry. 47 (28), 7567-7571 (2008).
- Gallio, M., Ofstad, T. A., Macpherson, L. J., Wang, J. W., Zuker, C. S. The coding of temperature in the drosophila brain. Cell. 144 (4), 614-624 (2011).
- Ni, L., et al. A gustatory receptor paralogue controls rapid warmth avoidance in drosophila. Nature. 500 (7464), 580-584 (2013).
- Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D., Carlson, J. R. The molecular and cellular basis of bitter taste in drosophila. Neuron. 69 (2), 258-272 (2011).
- Ling, F., Dahanukar, A., Weiss, L. A., Kwon, J. Y., Carlson, J. R. The molecular and cellular basis of taste coding in the legs of drosophila. J Neurosci. 34 (21), 7148-7164 (2014).
- Dethier, V. G. . The Hungry Fly: A Physiological Study of the Behavior Associated with Feeding. , (1976).
- Shiu, P. K., Sterne, G. R., Engert, S., Dickson, B. J., Scott, K. Taste quality and hunger interactions in a feeding sensorimotor circuit. Elife. 11, e79887 (2022).
- Kim, H., Kirkhart, C., Scott, K. Long-range projection neurons in the taste circuit of drosophila. Elife. 6, e23386 (2017).
- Sayeed, O., Benzer, S. Behavioral genetics of thermosensation and hygrosensation in drosophila. Proc Natl Acad Sci U S A. 93 (12), 6079-6084 (1996).
- Coya, R., Martin, F., Calvin-Cejudo, L., Gomez-Diaz, C., Alcorta, E. Validation of an optogenetic approach to the study of olfactory behavior in the t-maze of drosophila melanogaster adults. Insects. 13 (8), 662 (2022).
- Chu, L. A., Tai, C. Y., Chiang, A. S. Thirst-driven hygrosensory suppression promotes water seeking in drosophila. Proc Natl Acad Sci U S A. 121 (34), e2404454121 (2024).
- Chyb, S., Dahanukar, A., Wickens, A., Carlson, J. R. Drosophila gr5a encodes a taste receptor tuned to trehalose. Proc Natl Acad Sci U S A. 100 (Suppl 2), 14526-14530 (2003).
- Dunipace, L., Meister, S., Mcnealy, C., Amrein, H. Spatially restricted expression of candidate taste receptors in the drosophila gustatory system. Curr Biol. 11 (11), 822-835 (2001).
- Ratnayake, K., et al. Blue light excited retinal intercepts cellular signaling. Sci Rep. 8 (1), 10207 (2018).
- Huda, A., Omelchenko, A. A., Vaden, T. J., Castaneda, A. N., Ni, L. Responses of different drosophila species to temperature changes. J Exp Biol. 225 (11), jeb243708 (2022).
- Tyrrell, J. J., Wilbourne, J. T., Omelchenko, A. A., Yoon, J., Ni, L. Ionotropic receptor-dependent cool cells control the transition of temperature preference in drosophila larvae. PLoS Genet. 17 (4), e1009499 (2021).
- Fu, Z., Huda, A., Kimbrough, I. F., Ni, L. Using drosophila two-choice assay to study optogenetics in hands-on neurobiology laboratory activities. J Undergrad Neurosci Educ. 22 (1), A45-A50 (2023).
- Joseph, R. M., Heberlein, U. Tissue-specific activation of a single gustatory receptor produces opposing behavioral responses in drosophila. Genetics. 192 (2), 521-532 (2012).
- Riemensperger, T., Kittel, R. J., Fiala, A. Optogenetics in drosophila neuroscience. Methods Mol Biol. 1408, 167-175 (2016).
- Dorkenwald, S., et al. Neuronal wiring diagram of an adult brain. Nature. 634 (8032), 124-138 (2024).
- Schlegel, P., et al. Whole-brain annotation and multi-connectome cell typing of drosophila. Nature. 634 (8032), 139-152 (2024).
- Talay, M., et al. Transsynaptic mapping of second-order taste neurons in flies by trans-tango. Neuron. 96 (4), 783-795.e4 (2017).
- Shiraiwa, T., Carlson, J. R. Proboscis extension response (per) assay in drosophila. J Vis Exp. (3), e193 (2007).
- Pulver, S. R., Hornstein, N. J., Land, B. L., Johnson, B. R. Optogenetics in the teaching laboratory: Using channelrhodopsin-2 to study the neural basis of behavior and synaptic physiology in drosophila. Adv Physiol Educ. 35 (1), 82-91 (2011).
- Titlow, J. S., Johnson, B. R., Pulver, S. R. Light activated escape circuits: A behavior and neurophysiology lab module using drosophila optogenetics. J Undergrad Neurosci Educ. 13 (3), A166-A173 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon