Method Article
黄色ブドウ球菌の細胞内感染モデルの開発と評価
要約
黄色ブドウ球菌 (S. aureus)は、全身に広がる能力があり、持続性および再発性の感染症を引き起こします。これらのプロセスをよりよく理解するために、この研究では、 黄色ブドウ球菌の細胞内感染モデルを確立します。このモデルは、細胞内感染の背後にあるメカニズムを調査するための重要な基盤を提供します。
要約
黄色ブドウ球菌は、免疫細胞を含む宿主細胞内に侵入して持続することができるため、免疫の検出とクリアランスを回避できます。この細胞内持続性は、慢性感染症や再発性感染症の原因となり、治療を複雑にし、病気を長引かせます。したがって、黄色ブドウ球菌によって引き起こされる感染症をよりよく理解し、予防し、治療するための細胞内感染モデルが急務となっています。この研究は、抗生物質が細胞外細菌を効果的に排除するが、細胞に侵入した細菌を根絶することはできなかったことを示しました。したがって、黄色ブドウ球菌にRAW264.7を感染させ、それらを抗生物質と共培養することにより、in vitroで安定した細胞内感染が確立されました。その後、細胞内感染を含む腹膜マクロファージをマウスに注入することにより、マウスの細胞内感染モデルを確立しました。バンコマイシンは、プランクトン性黄色ブドウ球菌に挑戦されたマウスの細菌負荷を効果的に除去しました。しかし、腹膜マクロファージ内の細胞内細菌が同等またはそれ以下のレベルで感染したマウスに対しては効果がありませんでした。これは、黄色ブドウ球菌の細胞内感染モデルが成功裏に確立されたことを示しており、細胞内感染の予防と治療のための潜在的な洞察を提供します。
概要
黄色ブドウ球菌 は、皮膚や軟部組織の感染症、敗血症、髄膜炎、肺炎、心内膜炎など、さまざまな感染症を引き起こす可能性のある伝染性の高い病原体です1。抗生物質の臨床的誤用は、 黄色ブドウ球菌 の耐性の増加とメチシリン耐性黄色ブドウ 球 菌(MRSA)の出現につながり、これは多くの国で重大な公衆衛生上の脅威をもたらしています2。
黄色ブドウ球菌は伝統的に細胞内病原体として分類されていませんが、新たな証拠は、侵入後も宿主細胞に持続的にコロニーを形成する可能性があることを示唆しています3。黄色ブドウ球菌が宿主食細胞内で細胞内で生存する能力は、宿主4,5,6への転移感染と播種を促進するメカニズムとしてますます認識されています。 黄色ブドウ球菌はさまざまな病原性因子を分泌し、それがその生存を促進し、宿主がそれを完全に排除する能力を複雑にする免疫環境を作り出します7。アクセサリー遺伝子調節因子(agr)とブドウ球菌ヘルパーエレメント(Sae)は、食細胞8,9における黄色ブドウ球菌の生存に密接に関連する2つの重要な病原性調節因子です。agrシステムは、黄色ブドウ球菌の多数の病原性因子の発現を調節するクオラムセンシングメカニズムです。それは、細菌の生存と播種を促進する毒素やその他の要因の産生を制御します。細胞内感染中、agrシステムは、細菌が宿主の免疫応答を回避し、宿主細胞内で生存する能力に不可欠な病原性因子の調節に重要な役割を果たします。研究によると、agrシステムは、細菌がファゴソームから逃げ出し、マクロファージ内で持続する能力に影響を与えることが示されています。agrの不在は、宿主細胞内の細菌生存率の低下および病原性の低下につながる可能性がある10,11。Saeシステムは、黄色ブドウ球菌のいくつかの病原性因子の発現を制御する2成分の調節システムです。これは、細菌が宿主組織に侵入して損傷を与える能力に寄与する毒素と酵素の調節に関与しています。Saeシステムは、黄色ブドウ球菌の細胞内生存にも重要な役割を果たしています。これは、宿主食細胞による死滅に抵抗し、オートファジー分解を回避する細菌の能力に影響を与える12,13。
病原体が侵入すると、マクロファージは食作用機能を持ち、外来病原体を飲み込んで死滅させ、適応免疫応答を活性化することができる14。侵入する細菌のほとんどは、マクロファージによって食作用され、マクロファージがさまざまな殺傷メカニズムを活性化してマクロファージを排除します。しかし、一部の黄色ブドウ球菌はマクロファージ内で生存することができ、宿主の持続的な感染につながります。細菌タンパク質に加えて、宿主はサイトカイン15,16,17を分泌することにより、マクロファージ内の黄色ブドウ球菌の生存と増殖にも影響を与えます。いくつかの研究は、黄色ブドウ球菌がオートファゴソームに存在することにより分解を回避でき、播種を促進する細胞内ニッチを作り出すことができることを示しています18。黄色ブドウ球菌は、オートファジーフラックス(LC3-II、p62など)をブロックし、マクロファージ浸潤後にオートリソソーム内のpHを上昇させることにより、オートファジー分解を免れる19。この免疫回避は、黄色ブドウ球菌の病原性因子とオートファジーの調節によって達成され、持続的な隠れた感染を引き起こします。
黄色ブドウ球菌の細胞内感染を解消することは、臨床診療における持続性および潜伏性感染を管理するために重要です。現在、黄色ブドウ球菌感染症の主な治療法は抗生物質であり、バンコマイシンはMRSA感染症20,21の最後の防御線として機能しています。しかし、多くの研究により、既存の抗生物質は、invivoおよびin vitroの両方で、細胞内黄色ブドウ球菌の排除に効果がないことが示されています22,23,24。
現在、黄色ブドウ球菌25,26,27のさまざまな細胞内感染モデルについて統一された標準はなく、各モデルの条件は大きく異なります。したがって、これらのモデルの有効性を評価するために同じ基準を適用することはできません。本研究では、実験条件を最適化することにより、黄色ブドウ球菌の普遍的な細胞内感染モデルを確立しました。このモデルは、in vitroで細菌を細胞に最初に感染させ、その後、これらの感染細胞を体内に送達することができるため、他のモデルと比較して利便性が高くなります。
黄色ブドウ球菌の細胞内感染メカニズムの解明と関連薬の開発を目的として、in vitroモデルとin vivoモデルの両方を確立しました。RAW264.7に感染させ、抗生物質と共培養することにより、in vitroで安定した細胞内感染モデルを作成することに成功しました。その後、腹膜マクロファージを抽出し、細胞内感染に形成しました。マウスの細胞内感染モデルは、これらの腹膜マクロファージを注入することにより確立されました。
プロトコル
実験動物、6-8週齢の特異的病原体を含まない(SPF)雌BALB/cマウスをBeijing HFK Bioscience Co., Ltd.(中国、北京)から購入しました。すべての動物実験は、第三軍事医科大学の実験動物福祉および倫理委員会によって承認され、実験動物の使用に関する制度的および国家的な方針およびガイドラインに従って実施されました。マウスはSPFの施設で飼育され、ワクチン接種を受け、無菌の餌と水を無料で入手することができました。動物は無作為にグループに分けられ、実験開始の少なくとも7日前に適応時間を認めました。
1. 黄色ブドウ球菌の準備
- 菌株回収:凍結MRSA252のチューブを入手し、接種リングを焼灼して冷却して細菌溶液のリングを取得し、ストリークプレート法28でトリプシン大豆寒天(TSA)プレート(材料の表を参照)に細菌を接種し、37°Cで一晩培養します。
- 細菌の活性化:翌日、50 mLのシェーカーフラスコを1つ取り、20 mLのトリプシン大豆ブロス(TSB)培地を追加します( 材料の表を参照)。10 μLのピペットチップを持つコロニーを1つ選択し、シェーカーに加えます。コロニーを220rpm、37°Cで一晩インキュベートします。
- 二次活性化:翌日、15 mLのTSB培地が入った50 mLのシェーカーフラスコを1つ取ります。最初の活性化細菌を含むシェーカーから200 μLの細菌溶液を取り出し、20 mLのTSB培地が入った新しいフラスコ1つに加え、220 rpm、37°Cで4時間インキュベートします。
- 二次活性化細菌溶液を50mLの遠心チューブに回収し、3,000 x g で10分間遠心分離し、上清を捨てます。
- 沈殿した細菌を生理食塩水10mLに再懸濁し、3,000 x g で10分間遠心分離します。この手順を 2 回繰り返します。
- 細菌溶液のOD600値を測定し、生理食塩水で1.0に調整します。このとき、この実験の細菌MRSA252量は1.0 x 109 CFU/mLでした。
注:細菌溶液を抗生物質を含まない培地に加え、所望の濃度に希釈します。この実験で使用したすべての細菌は、上記の方法で調製しました。
2. in vitroでの細胞内感染モデルの確立
- RAW264.7細胞の調製
注:この研究で使用した細胞株はATCCから入手しました。すべての細胞株でマイコプラズマ汚染が陰性でした。すべての実験は、対数成長期の細胞で行いました。- 液体窒素から細胞を取り出し、37°Cの水浴で解凍します。
- RAW264.7細胞を15 mLの遠心チューブに入れ、2 mLのダルベッコ改変イーグル培地(DMEM; 表を参照)に10%ウシ胎児血清( 表の材料を参照)、ペニシリン(100単位/mL)、ストレプトマイシン(100 μg/mL; 表の材料;完全培地を参照)を37°Cで5% CO2で加えます。300 x g で5分間遠心分離します。
- 100 mmの皿に3 x 106 RAW264.7細胞を播種し、10 mLの完全培地を含ませます。細胞のコンフルエンスが50%〜60%になるように、細胞培養インキュベーターで57°Cの57°Cに12時間保存します。
- 体外 細胞内感染
- 10 μLの細胞懸濁液を取り、セルカウンターに加えて細胞濃度を計算します。24ウェルプレート(材料表を参照)で2 x 105 RAW264.7細胞をカウントし、各ウェルに1 mLの完全培地を使用してシードし、細胞培養インキュベーターで10〜12時間保持します。
- 上清を取り除き、2 x 106 CFU細菌溶液を含む1 mLの完全培地(ステップ1.6)を各ウェルに加えます。それを細胞培養インキュベーターに2時間置く。感染MRSA252の多重度
(MOI)は10です。(様々な感染の多重度(MOI)値と細胞による細菌の食作用との相関性を検証するため、MOI値が20、30、40、50の実験グループを樹立しました。
注:細胞に感染するときに使用される完全な培地には、ペニシリンとストレプトマイシンは含まれていません。 - 上清を取り除き、細胞をPBSで2回洗浄します( 材料の表を参照)。DMEMのウェルあたり800 μLを100 μg/mLのゲンタマイシン( 材料表を参照)を加え、37°Cのセルインキュベーターに5% CO2 で2時間置く。
- in vitro細胞内感染モデルの評価
- 細胞内黄色ブドウ球菌殺傷アッセイ
- RAW264.7細胞(ステップ2.2.2および2.2.3)を別々に遠心分離チューブに集めます。細胞をPBSで2回洗浄し、0.1% Triton X-100( 材料表を参照)溶液を各チューブに5分間加え、ライセートを遠心分離チューブに集めます。
- PBSを使用して、ライセートを連続希釈します。20 μLのライセートを180 μLのPBSが入った微量遠心チューブに加え、ピペッティングで十分に混合します。この手順に従って段階的に希釈します。ライセートの各希釈液をTSAプレート上にスポットし、37°Cで一晩インキュベートします。 TSAプレート上のライセートのコロニーをカウントします(図1A)。
注:さらに、腹膜マクロファージにおけるMRSA252の細胞内感染の最適な実験条件を調査しました。MRSA252に感染し、さまざまな濃度のゲンタマイシンで処理した腹膜マクロファージの細菌負荷を 図1Bに示します。一方、100 μg/mLゲンタマイシンをさまざまな期間で処理した後の細菌負荷を 図1Cに示します。 - セクション2.3.1.2で説明されているように、上清とライセートをPBSで連続希釈し、上清とライセートのTSAプレート上のコロニーを観察します(図2A)。
- 共焦点レーザー走査型顕微鏡(CLSM)
- RAW264.7細胞(ステップ2.2)を共焦点ペトリ皿(材料表を参照)で2 x 105細胞/mLに希釈し、細胞インキュベーターに入れて5%CO2中で37°Cで一晩接着します。2 x 106 CFUおよび4 x 106細菌溶液を含む1 mLの完全培地(ステップ1.6)を各共焦点ペトリ皿に加え、細胞インキュベーターに2時間置き、それぞれMOI 10および20にします。
- 上清を取り除き、細胞をPBSで3回洗浄し、100 μg/mLのゲンタマイシンDMEMを2時間加え、細胞外細菌を除去します。次に、上清を取り除き、細胞をPBSで2回洗浄し、DIL作動流体( 材料表を参照)を加え、暗所で37°Cで5分間インキュベートします。
- DIL作動流体を取り出し、PBSで3回洗浄し、4%パラホルムアルデヒド溶液( 材料表を参照)で20分間固定します。
- パラホルムアルデヒド溶液を取り出し、PBSで3回洗浄し、DAPI色素( 材料表を参照)を加え、暗所で5分間インキュベートします。DAPI染料溶液を取り出し、PBSで5回洗浄します。CLSMを使用して細胞を観察します(図2B)。
注:この研究は、相同組換え法29を用いて構築された緑色蛍光タンパク質(GFP)を用いてMRSA252操作された。
- 細胞内黄色ブドウ球菌殺傷アッセイ
3. in vivo 細胞内感染モデルの確立
- マウスにおける腹膜マクロファージの獲得
- 6%のでんぷんスープを準備します。質量比3:10:5(w / w)に従って、ガラス容器に3種類の賦形剤(牛肉抽出物粉末、トリプトン、塩化ナトリウム、 材料表を参照)を連続して追加します。ガラス容器に1LのddH2Oを加え、かき混ぜて溶かし、電子レンジで加熱します。でんぷん可溶性( 材料表を参照)を質量比6で加え、攪拌して溶融させ、ガラス容器を121°Cで30分間オートクレーブします。ペースト状になるまで4°Cで冷蔵庫に保管してください。
- マウス腹膜マクロファージを以下の手順に従って採取します。
- Balb/cマウスを2匹選びます。左手でマウスの首をつかみ、尻尾をコントロールします。マウスを裏返し、頭を下にして腹部を上にします(図3A)。マウスあたり3 mLの6%デンプンブロスの腹腔内注射を行います(図3B)。
注:重力により、腹腔内の臓器が胸部まで後方に落下し、注射器が他の臓器を傷つけるのを防ぎます。 - 72時間後、マウスに3%イソフルランで麻酔をかけ、子宮頸部脱臼によってマウスを犠牲にします。75%エチルアルコールで消毒します。眼科用ハサミを使用してマウスの腹部を切り開き、腹膜を完全に露出させます(図4A-C)。
- 10 mLのDMEM培地をマウスに注入し、腹腔内注射により腹腔内洗浄します(図4D)。マウスの腹腔内にDMEMを注入した後、マウスの腹部を約1分間優しく揉み、腹部をより徹底的に洗浄します。シリンジを使用して、洗浄液を50 mLの遠心分離チューブに集めます(図4E)。
- 洗浄液を300 x g で5分間遠心分離し、上清を捨てます。
- 10 mL DMEM に 10% ウシ胎児血清、ペニシリン (100 units/mL)、およびストレプトマイシン (100 μg/mL; 完全培地) を添加して、採取した細胞をブローして吸引し、カウントし、細胞濃度を 2 x 106/mL に希釈し、6 ウェルプレート ( 材料表を参照) に 1 ウェルあたり 1 mL の厚板に希釈します。
- 6ウェルプレートを5% CO2中37°Cに置き、4時間インキュベートした後、上清を除去します。滅菌PBSで細胞を2回洗浄し、ウェルあたり1 mLのDMEMを37°C、5% CO2で一晩培養します。
- Balb/cマウスを2匹選びます。左手でマウスの首をつかみ、尻尾をコントロールします。マウスを裏返し、頭を下にして腹部を上にします(図3A)。マウスあたり3 mLの6%デンプンブロスの腹腔内注射を行います(図3B)。
- 細胞内細菌の調製
- 腹膜マクロファージ(ステップ3.1.2)をMRSA252で2時間インキュベートします。上清を取り除き、細胞をPBSで2回洗浄します。DMEM完全培地に100 μg/mLのゲンタマイシン(1ウェルあたり1 mL)を加え、5% CO2で37°Cで2時間インキュベートします。
- 上清を取り除き、細胞をPBSで3回洗浄します。細胞スクレーパーを使用して、マウス腹膜マクロファージを50 mLの遠心分離チューブに収集し、300 x g で5分間遠心分離します。MRSA252の細胞内細菌は、腹膜マクロファージでうまく調製されました。
- 細胞内細菌の計算には、細胞内MRSA252に感染した腹膜マクロファージにリゾチーム(10 μg/mL、 材料表参照)を37°Cで10分間添加し、PBS 2xで洗浄します。次に、PBSを1 mL添加して細胞を再懸濁します。0.1%Triton X-100を5分間添加して細胞を溶解します。
- 溶解液を直列希釈液で希釈し、TSAプレートに滴下します。37°Cで一晩培養します。 腹膜マクロファージのMRSA252の細胞内細菌を、マウスあたり1.8 x 106 CFUで、細菌コロニーをカウントして計算します。
注:セルスクレーパーが細胞を収集するとき、動作は穏やかでなければなりません。細胞は一方向に削り取られ、その後の実験に影響を与える可能性のある細胞の破損を防ぎます。
- マウスにおける細胞内細菌感染
- 20匹のBalb/cマウスをランダムに4つのグループに分けます(n = 5、 図5A)。
- グループ I の場合、マウスごとに 3 x 106 CFU プランクトン MRSA252を静脈内注射で注入します。グループIIの場合、マウス1匹あたり3 x 106 CFUプランクトンMRSA252とバンコマイシン(110 mg / kg; 材料表を参照)を静脈内注射で注入します。.グループIIIの場合、細胞内細菌(ステップ3.2で調製)を静脈注射で注入します。グループIVの場合、マウスごとに細胞内細菌(ステップ3.2で調製)とバンコマイシン(110 mg / kg)を静脈内注射で注入します。
- マウスを尾静脈が拡張するまで赤外線理学療法ランプの下に置きます。
- グループ I およびグループ II のマウスごとに 3 x 106 CFU プランクトン MRSA252を静脈内注射します。グループIIIおよびグループIVのマウスごとに細胞内細菌(ステップ3.2で調製)を静脈内注射します。
注:シリンジを使用して細胞内細菌を含む液体を収集する場合は、最初にピペットで液体を均一に混合して、すべてのマウスで一貫した感染レベルを確保することをお勧めします。 - 30分後、マウスごとにバンコマイシンをグループIIおよびグループIVに静脈内注射します。
- in vivo細胞内感染モデルの評価
- 腎臓内の細菌のコロニー形成をカウントすることにより、マウスの細胞内感染モデルを評価します。注射の24時間後、マウスに3%イソフルランで麻酔をかけ、子宮頸部脱臼によってマウスを犠牲にします。.75%エチルアルコールで消毒します。
- マウスを固定し、片手でピンセットで腹部の皮膚を持ち上げ、もう一方の手でマウスの腹部の皮膚を眼科用ハサミで切り、腹腔内の腎臓を見つけて、腎臓を完全に剥ぎ取ります。それらをPBSに入れます。
- ティッシュグラインディングチューブにPBS1mLを加えます。各マウスの腎臓を別々の粉砕チューブに移し、固形組織が残らなくなるまで粉砕します。均質化された組織を個々のEPチューブに注ぎ、各チューブに対応するマウス識別をラベル付けします。
- PBSを使用して、組織ホモジネートを段階的に希釈します。各希釈液を別々のTSAプレートにスポットし、37°Cで一晩インキュベートします。 コロニーをカウントし、データを分析します(図5B)。
結果
黄色ブドウ球菌の細胞内感染モデルは、in vitroおよびin vivoの両方で成功裏に確立されました。食作用の実験条件を最適化し、抗生物質治療の濃度と期間の両方を延長することにより、一部の黄色ブドウ球菌はマクロファージ内で生き残りました(図1)。黄色ブドウ球菌の抗生物質耐性をさらに評価するために、MRSA252に感染したマクロファージを抗生物質で2時間処理し、細胞上清に黄色ブドウ球菌が含まれなくなるまで、一部の細菌はマクロファージ内に持続しました(図2A)。共焦点レーザー走査型顕微鏡により、抗生物質は細胞内の黄色ブドウ球菌を殺すことができないことが明らかになりました(図2B)。さらに、マウスの細菌コロニー形成アッセイでは、バンコマイシンはプランクトン性黄色ブドウ球菌を排除できる一方で、細胞内に存在する細菌に対しては効果がないことが示されました(図5B)。これにより、黄色ブドウ球菌の細胞内感染モデルを確立することに成功しました。
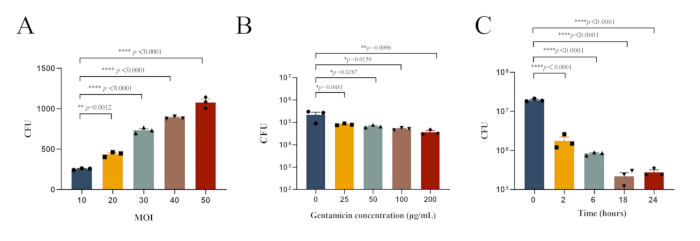
図1:腹膜マクロファージにおけるMRSA252の細胞内感染の最適な実験条件( A)異なるMOI値でMRSA252に感染した腹膜マクロファージの細菌負荷。(B)MRSA252に感染し、さまざまな濃度のゲンタマイシンで治療された腹膜マクロファージの細菌負荷。.(C)100μg/mLゲンタマイシンによる治療後のMRSA252に感染した腹膜マクロファージの細菌負荷。データは平均±SEM(n = 3)として表され、ダネットの事後検定による一元配置ANOVAを使用して有意性を決定しました(**** p < 0.0001、** p < 0.01、* p <0.05)。 この図の拡大版を表示するには、ここをクリックしてください。
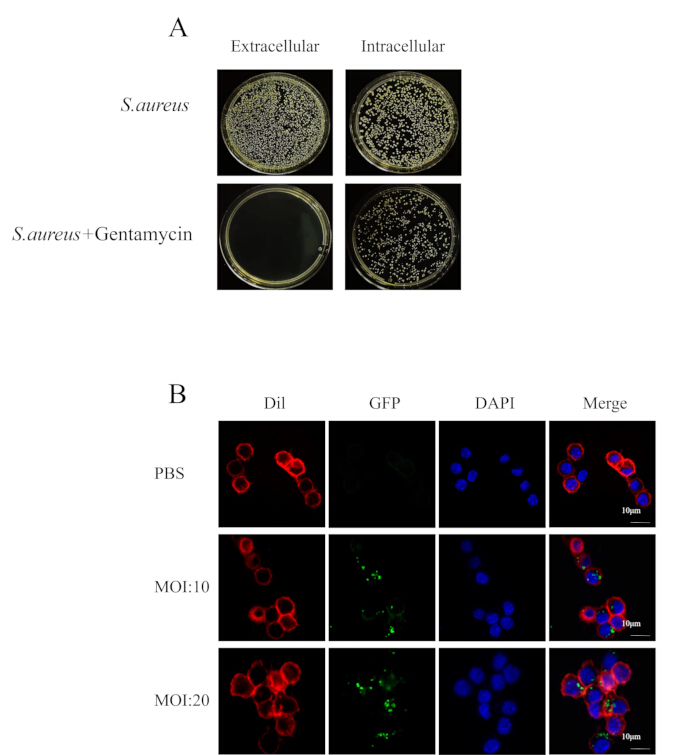
図2:細胞内黄色ブドウ球菌は抗生物質治療に耐性を持つ(A)細胞懸濁液と細胞質の細菌プレートコーティングの画像。(B)共焦点顕微鏡法は、抗生物質の存在下(スケールバー= 10μm)の4時間ポイントでMRSA252(緑)に感染したRAW264.7(赤)の細菌の増殖を示しました。この図の拡大版を表示するには、ここをクリックしてください。
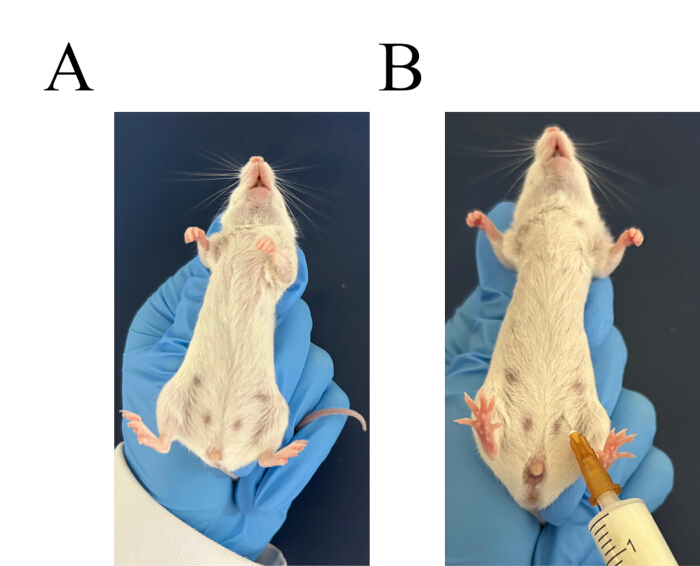
図3:腹腔内注射の手順(A)マウスをしっかりとつかみます。(B)腹腔内注射の注射部位を特定します。この図の拡大版を表示するには、ここをクリックしてください。

図4:腹膜マクロファージ抽出の手順(A)腹部の表面皮膚を切断します。(B)皮膚の鈍器分離を行います。(C)皮膚の分離により腹膜が露出します。(D)腹腔内洗浄。(E)腹腔を採取し、さらに洗浄します。この図の拡大版を表示するには、ここをクリックしてください。

図5:MRSA252による細胞内感染はバンコマイシンの死滅に耐性がある(A)プランクトン性細菌と細胞内細菌の感染モデルを確立するための実験デザインを示す図の要約。グラフィカルなアブストラクトはFigdrawによって描かれました。(B)腎臓内の細菌負荷:感染の1日後に細菌負荷が検出されました。CFU、コロニー形成ユニット。バンコはバンコマイシンの代表です。データは平均±SEM(n = 5生物学的に独立したサンプル)として表され、ダネットの事後検定による一元配置ANOVAを使用して有意性を決定しました(****p < 0.0001、nsは有意性を表しません)。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
黄色ブドウ球菌は、通性細胞内病原体として、さまざまな細胞タイプに侵入して生存することができ、この能力を使用して感染中の抗生物質と免疫応答を回避します30。この研究は、 S. aureusin vivo の細胞内感染モデルを確立し、病原体の細胞内感染メカニズムを調査するための基盤を提供しました。 黄色ブドウ球菌のマクロファージ食作用に対するさまざまなMOI値の影響、およびさまざまな抗生物質濃度と治療期間の有効性を調査することにより、細胞内感染モデルを確立するための最適な条件が決定されました(図1)。
黄色ブドウ球菌の細胞内感染のin vitroモデルを構築する際には、対数増殖期の黄色ブドウ球菌を所望の濃度に調整し、細胞培養プレートに添加してください。抗生物質の存在は病原体の細胞への侵入能力を妨げる可能性があるため、培地に抗生物質が含まれていないことを確認してください。感染の2時間後、感染細胞を治療するために、100 μg/mLの濃度のゲンタマイシンを含む培地を添加しました。細胞コロニー形成実験(図2A)では、ゲンタマイシンが細胞外細菌を効果的に排除し、残りの細菌が細胞によって取り込まれることが示されました。共焦点顕微鏡法は、このアプローチが細胞内細菌の侵入を促進し、細胞内感染を確立することをさらに確認しました(図2B)。
この研究では、マウスにデンプンブロスで刺激して腹膜マクロファージを作製し、それを抽出してin vitroでMRSA252に感染させました。これらの感染した腹膜マクロファージは、その後マウスに注射されました。コントロールのために、マウスに3×106CFU のプランクトンMRSA252も注入した。これらの注射後、バンコマイシン治療をすべてのマウスに投与しました。
バンコマイシンは、細菌レベルを評価する24時間前にマウスに投与され、細胞内細菌感染の重要な時間枠を確立しました。プランクトン性MRSA252で治療したマウスでは、バンコマイシンは腎臓の細菌負荷をほぼ根絶しました。.しかし、細胞内感染群は、プランクトン群と比較して1.8 x 106 CFUの低負荷用量を投与されたにもかかわらず、依然として有意な細菌の存在を示しました (図5B)。したがって、モデルは成功裏に確立されたと結論付けます。他のモデル25と比較して、我々は最初にマウス腹膜マクロファージを in vitro 感染のために刺激し、その結果、これらの細胞の回復率が増加した。
要約すると、細胞への細菌の侵入とコロニー形成は、緑色蛍光タンパク質で操作されたMRSA252を使用して、より直接的に観察できます。この株は、 黄色ブドウ球菌 と宿主との間の相互作用、例えば、 黄色ブドウ球菌 の宿主への浸潤および付着を評価するためにも使用できます。さらに、このモデルは、 in vitro 細胞内感染の条件を使用して、 in vivo モデルを改良および最適化します。ただし、細胞内感染後の他の臓器での細菌のコロニー形成を完全には調査しておらず、臨床感染シナリオを完全に反映していない可能性があります。細胞内感染パターンのより詳細な調査により、モデルの臨床状況のシミュレーションが改善される可能性があります。
細胞への細菌の侵入とコロニー形成は、緑色蛍光タンパク質で操作されたMRSA252を使用して直接観察できます。また、この株は、 黄色ブドウ球菌 と宿主との間の相互作用(浸潤過程や接着過程など)の評価を容易にします。さらに、このモデルは、 in vitro 細胞内感染の条件を活用して 、in vivo モデルを改良します。ただし、この研究では、細胞内感染後の他の臓器における細菌のコロニー形成を完全に調査するには不十分であり、臨床感染シナリオを正確に表していない可能性があります。モデルの臨床状況のシミュレーションを強化するには、細胞内感染パターンのより詳細な調査が必要です。
開示事項
著者は、競合する利益がないことを宣言します。
謝辞
本研究は、中国国家自然科学基金会(NSFC、Grant No.32300779, NO.32270989)、重慶自然科学基金会(CSTB2022NSCQ-MSX0156)、重慶教育委員会科学技術研究プロジェクト(KJQN202312802)、中国ポスドク科学基金会(2024M754250)の支援を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| 24-well plate | Corning Incorporated, USA | 3524 | |
| 4 % paraformaldehyde solutione | BBI, UK | E672002-0500 | |
| 6-well plate | Corning Incorporated, USA | 3516 | |
| Beef extract powder | BBI, UK | A600114-0500 | |
| Biohazard safety equipment | Heal force, China | VS-1300L-u | |
| Cell incubator | ESCO, Singapore | CCL-170B-8 | |
| Cell scraper | Nest | 710001 | |
| Centrifuge M1416R | RWD, China | M1416R | |
| Centrifuge tube | Guanghou Labselect, China | CT-002-50A | |
| Confocal laser scanning microscope (CLSM) | Zeiss, Germany | 880 | |
| Confocal petri dish | Biosharp, China | BS-20-GJM | |
| DAPI dye | Shanghai Beyotime, China | C1006 | |
| DIL working fluid | Shanghai Beyotime, China | C1991S | |
| Dulbecco’s Modified Eagle Medium | Thermo Gibco, USA | C11995500BT | |
| Fetal Bovine Serum | Hyclone | SV30208.02 | |
| Gentamycin | Shanghai Sangon, China | B540724-0010 | |
| Incubator | Shanghai Hengzi, China | HDPF-150 | |
| Lysozyme | Beijing Solarbio, China | L9070 | |
| MRSA252 | Third Military Medical University, China | null | |
| MRSA252(GPF) | Third Military Medical University, China | null | |
| Penicillin and Streptomycin | Shanghai Beyotime, China | C0222 | |
| Phosphate Buffer Solution | Shanghai Beyotime, China | ST476 | |
| Saline | Sichuan Kelun, China | null | |
| Sodium chloride | Shanghai Macklin, China | S805275 | |
| Starch soluble | Shanghai Sangon, China | A500904-0500 | |
| Triton X-100 | Shanghai Beyotime, China | P0096-100ml | |
| Tryptic Soy Agar (TSA) plates | Beijing AOBOX Biotechnology Co., LTD,China | 02-130 | |
| Tryptic Soy Broth (TSB) medium | Beijing AOBOX Biotechnology Co., LTD,China | 02-102K | |
| Tryptone | OXOID, UK | LP0042B | |
| Vancomycin | Shanghai Beyotime, China | ST2807-250mg | |
| RAW264.7 cell | USA, ATCC | null |
参考文献
- Sutton, J. A. F., et al. Staphylococcus aureus cell wall structure and dynamics during host-pathogen interaction. PLoS Pathog. 17 (3), e1009468 (2021).
- Yang, H., et al. Lateral flow assay of methicillin-resistant Staphylococcus aureus using bacteriophage cellular wall-binding domain as recognition agent. Biosens Bioelectron. 182, 113189 (2021).
- Howden, B. P., et al. Staphylococcus aureus host interactions and adaptation. Nat Rev Microbiol. 21 (6), 380-395 (2023).
- Guo, H., et al. Biofilm and small colony variants-an update on Staphylococcus aureus strategies toward drug resistance. Int J Mol Sci. 23 (3), 1241 (2022).
- Huitema, L., et al. Intracellular escape strategies of Staphylococcus aureus in persistent cutaneous infections. Exp Dermatol. 30 (10), 1428-1439 (2021).
- Pidwill, G. R., et al. Clonal population expansion of Staphylococcus aureus occurs due to escape from a finite number of intraphagocyte niches. Sci Rep. 13 (1), 1188 (2023).
- Wang, M., et al. Autophagy in Staphylococcus aureus infection. Front Cell Infect Microbiol. 11, 750222 (2021).
- Arya, R., et al. Identification of an antivirulence agent targeting the master regulator of virulence genes in Staphylococcus aureus. Front Cell Infect Microbiol. 13, 1268044 (2023).
- Münzenmayer, L., et al. Influence of sae-regulated and agr-regulated factors on the escape of Staphylococcus aureus from human macrophages. Cell Microbiol. 18 (8), 1172-1183 (2016).
- Chin, D., et al. Staphylococcus lugdunensis uses the agr regulatory system to resist killing by host innate immune effectors. Infect Immun. 90 (10), e0009922 (2022).
- Podkowik, M., et al. Quorum-sensing agr system of Staphylococcus aureus primes gene expression for protection from lethal oxidative stress. Elife. 12, RP89098 (2024).
- Purves, J., et al. Air pollution induces Staphylococcus aureus usa300 respiratory tract colonization mediated by specific bacterial genetic responses involving the global virulence gene regulators agr and sae. Environ Microbiol. 24 (9), 4449-4465 (2022).
- Wittekind, M. A., et al. The novel protein scra acts through the saers two-component system to regulate virulence gene expression in Staphylococcus aureus. Mol Microbiol. 117 (5), 1196-1212 (2022).
- Pidwill, G. R., et al. The role of macrophages in Staphylococcus aureus infection. Front Immunol. 11, 620339 (2020).
- Lang, J. C., et al. A photoconvertible reporter system for bacterial metabolic activity reveals that Staphylococcus aureus enters a dormant-like state to persist within macrophages. mBio. 13 (5), e0231622 (2022).
- Li, M., et al. Interactions between macrophages and biofilm during Staphylococcus aureus-associated implant infection: Difficulties and solutions. J Innate Immun. 15 (1), 499-515 (2023).
- Sun, L., et al. Staphylococcal virulence factor hlgb targets the endoplasmic-reticulum-resident e3 ubiquitin ligase amfr to promote pneumonia. Nat Microbiol. 8 (1), 107-120 (2023).
- Mulcahy, M. E., et al. Manipulation of autophagy and apoptosis facilitates intracellular survival of Staphylococcus aureus in human neutrophils. Front Immunol. 11, 565545 (2020).
- Cai, J., et al. Staphylococcus aureus facilitates its survival in bovine macrophages by blocking autophagic flux. J Cell Mol Med. 24 (6), 3460-3468 (2020).
- Ahmad-Mansour, N., et al. Staphylococcus aureus toxins: An update on their pathogenic properties and potential treatments. Toxins. 13 (10), 677 (2021).
- Davis, J. S., et al. How I manage a patient with MRSA bacteremia. Clin Microbiol Infect. 28 (2), 190-194 (2022).
- Fait, A., et al. Staphylococcus aureus response and adaptation to vancomycin. Adv Microb Physiol. 85, 201-258 (2024).
- Kelly, J. J., et al. Measurement of accumulation of antibiotics to Staphylococcus aureus in phagosomes of live macrophages. Angew Chem Int Ed Engl. 63 (3), e202313870 (2024).
- Rowe, S. E., et al. Recalcitrant Staphylococcus aureus infections: Obstacles and solutions. Infect Immun. 89 (4), e00694-e00720 (2021).
- Lehar, S. M., et al. Novel antibody-antibiotic conjugate eliminates intracellular S. aureus. Nature. 527 (7578), 323-328 (2015).
- Peyrusson, F., et al. Intracellular Staphylococcus aureus persisters upon antibiotic exposure. Nat Commun. 11 (1), 2200 (2020).
- Pollitt, E. J. G., et al. Staphylococcus aureus infection dynamics. PLoS Pathog. 14 (6), e1007112 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. J Vis Exp. 11 (63), e3064 (2012).
- Qin, L., et al. Antibody-antibiotic conjugate targeted therapy for orthopedic implant-associated intracellular S. aureus infections. J Adv Res. 65, 239-255 (2024).
- Andie, S. L., et al. Methicillin-resistant Staphylococcus aureus. Nat Rev Dis Primers. 31 (4), 18034 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
ISSN 2689-3649
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。
