Method Article
פיתוח והערכה של מודלים של זיהום תוך-תאי לסטפילוקוקוס זהוב
In This Article
Summary
לסטפילוקוקוס זהוב (S. aureus) יש יכולת להתפשט בכל הגוף, ולגרום לזיהומים מתמשכים וחוזרים. כדי להבין טוב יותר את התהליכים הללו, מחקר זה מבסס מודל זיהום תוך-תאי עבור S. aureus. מודל זה יספק בסיס מכריע לחקירת המנגנונים העומדים מאחורי זיהומים תוך-תאיים.
Abstract
S. aureus יכול לפלוש ולהתקיים בתוך תאים מארחים, כולל תאי חיסון, מה שמאפשר לו להתחמק מזיהוי ופינוי חיסוני. התמדה תוך-תאית זו תורמת לזיהומים כרוניים וחוזרים, מסבכת את הטיפול ומאריכה את המחלה. כתוצאה מכך, יש צורך קריטי במודל זיהום תוך-תאי כדי להבין, למנוע ולטפל טוב יותר בזיהומים הנגרמים על ידי S. aureus. מחקר זה הצביע על כך שאנטיביוטיקה חיסלה ביעילות חיידקים חוץ-תאיים אך לא הצליחה למגר את אלה שנכנסו לתאים. לפיכך, זיהום תוך-תאי יציב במבחנה נוצר על ידי RAW264.7 נגוע ב-S. aureus ותרבית משותפת שלהם עם אנטיביוטיקה. לאחר מכן, הוקם מודל זיהום תוך תאי בעכברים על ידי הזרקת מקרופאגים צפקיים המכילים את הזיהום התוך תאי. ונקומיצין סילק ביעילות עומסי חיידקים בעכברים שאותגרו עם S. aureus פלנקטונית; עם זאת, הוא לא היה יעיל נגד עכברים שנדבקו ברמות שוות או נמוכות יותר של חיידקים תוך-תאיים בתוך המקרופאגים הצפקיים. זה מצביע על כך שמודל הזיהום התוך-תאי של S. aureus הוקם בהצלחה, ומציע תובנות פוטנציאליות למניעה וטיפול בזיהומים תוך-תאיים.
Introduction
S. aureus הוא פתוגן מדבק מאוד שיכול לגרום למגוון זיהומים, כולל זיהומי עור ורקמות רכות, אלח דם, דלקת קרום המוח, דלקת ריאות ואנדוקרדיטיס1. שימוש לרעה קליני באנטיביוטיקה הוביל לעמידות מוגברת ב-S. aureus ולהופעתו של סטפילוקוקוס זהוב עמיד למתיצילין (MRSA), המהווה איום משמעותי על בריאות הציבור במדינות רבות2.
למרות ש-S. aureus אינו מסווג באופן מסורתי כפתוגן תוך-תאי, עדויות מתפתחות מצביעות על כך שהוא יכול ליישב בהתמדה תאי מארח לאחר פלישה3. היכולת של S. aureus לשרוד תוך תאית בתוך פגוציטים מארחים מוכרת יותר ויותר כמנגנון המאפשר זיהום גרורתי והתפשטות ברחבי המארח 4,5,6. S. aureus מפריש גורמי אלימות שונים, היוצרים סביבה חיסונית המקדמת את הישרדותו ומסבכת את יכולתו של המארח לחסל אותו לחלוטין7. מווסת הגנים האביזרי (agr) ואלמנטים מסייעים סטפילוקוקליים (Sae) הם שני מווסתי אלימות חשובים הקשורים קשר הדוק להישרדותו של סטפילוקוקוס זהוב בפגוציטים 8,9. מערכת ה-agr היא מנגנון חישת מניין המווסת את הביטוי של גורמי אלימות רבים ב-S. aureus. הוא שולט בייצור רעלים וגורמים אחרים המאפשרים הישרדות והפצה של חיידקים. במהלך זיהום תוך-תאי, מערכת ה-agr ממלאת תפקיד קריטי בוויסות גורמי האלימות החיוניים ליכולתו של החיידק להתחמק מתגובות חיסוניות של המארח ולשרוד בתוך תאי המארח. מחקרים הראו שמערכת החקלאות משפיעה על יכולתו של החיידק לברוח מפאגוזומים ולהישאר בתוך מקרופאגים. היעדר agr יכול להוביל להפחתת הישרדות החיידקים בתוך תאי המארח ולהפחתת האלימות10,11. מערכת Sae היא מערכת ויסות דו-רכיבית השולטת בביטוי של מספר גורמי אלימות ב-S. aureus. הוא מעורב בוויסות רעלים ואנזימים התורמים ליכולתו של החיידק לפלוש ולפגוע ברקמות המארח. מערכת Sae ממלאת גם תפקיד מכריע בהישרדות התוך-תאית של S. aureus. הוא משפיע על יכולתו של החיידק להתנגד להרג על ידי פגוציטים מארחים ולהתחמק מפירוק אוטופאגי12,13.
כאשר פתוגנים פולשים, למקרופאגים יש פונקציות פגוציטיות, שיכולות לבלוע ולהרוג פתוגנים זרים ולהפעילתגובה חיסונית נרכשת. רוב החיידקים הפולשים עוברים פגוציטוזציה על ידי מקרופאגים, אשר לאחר מכן מפעילים מנגנוני הרג שונים כדי לחסל אותם. עם זאת, חלק מחיידקי S. aureus יכולים לשרוד בתוך מקרופאגים, מה שמוביל לזיהום מתמשך של המארח. בנוסף לחלבוני חיידקים, המארח משפיע גם על ההישרדות וההתפשטות של S. aureus בתוך מקרופאגים על ידי הפרשת ציטוקינים 15,16,17. מחקרים מסוימים מצביעים על כך ש-S. aureus יכול להתחמק מהשפלה על ידי מגורים באוטופאגוזומים, ויוצר נישה תוך-תאית המקדמת הפצה18. S. aureus נמלט מפירוק אוטופאגי על ידי חסימת שטף אוטופגיה (למשל, LC3-II, p62) והגדלת ה-pH בתוך אוטוליזוזומים לאחר פלישת מקרופאגים19. התחמקות חיסונית זו מושגת באמצעות ויסות גורמי אלימות של S. aureus ואוטופגיה, מה שמוביל לזיהומים מתמשכים ונסתרים.
ניקוי זיהומים תוך תאיים של S. aureus הוא חיוני לניהול זיהומים מתמשכים וסמויים בפרקטיקה הקלינית. נכון לעכשיו, אנטיביוטיקה היא הטיפול העיקרי בזיהומי S. aureus, כאשר ונקומיצין משמש כקו ההגנה האחרון לזיהומי MRSA20,21. עם זאת, מחקרים רבים הראו כי האנטיביוטיקה הקיימת אינה יעילה בחיסול S. aureus תוך תאי, הן invivo והן במבחנה 22,23,24.
כיום אין תקן אחיד למודלים השונים של זיהום תוך תאי של S. aureus 25,26,27, מכיוון שהתנאים של כל מודל שונים באופן משמעותי. כתוצאה מכך, לא ניתן ליישם את אותם קריטריונים כדי להעריך את יעילותם של מודלים אלה. במחקר זה, הקמנו מודל זיהום תוך-תאי אוניברסלי של Staphylococcus aureus על ידי אופטימיזציה של תנאי הניסוי. מודל זה מציע נוחות רבה יותר בהשוואה לאחרים, מכיוון שהוא מאפשר הדבקה ראשונית של חיידקים לתאים במבחנה, ולאחר מכן העברת תאים נגועים אלה לגוף.
כדי להבין טוב יותר את המנגנונים של זיהום תוך תאי S. aureus ולפתח תרופות קשורות, הקמנו מודלים הן במבחנה והן ב-vivo . מודל זיהום תוך-תאי יציב נוצר בהצלחה במבחנה על ידי הדבקת RAW264.7 ותרבית משותפת שלהם עם אנטיביוטיקה. לאחר מכן, מקרופאגים צפקיים חולצו ונוצרו לזיהומים תוך-תאיים. מודל זיהום תוך-תאי בעכברים הוקם על ידי הזרקת מקרופאגים צפקיים אלה.
Protocol
חיות ניסוי, עכברי BALB/c נקבות בנות 6-8 שבועות ללא פתוגן ספציפי (SPF), נרכשו מבייג'ינג HFK Bioscience Co., Ltd (בייג'ינג, סין). כל המחקרים בבעלי חיים אושרו על ידי הוועדה לרווחת חיות מעבדה ואתיקה של האוניברסיטה הצבאית השלישית לרפואה ובוצעו בהתאם למדיניות ולהנחיות המוסדיות והלאומיות לשימוש בחיות מעבדה. העכברים הוחזקו וחוסנו במתקני SPF וסיפקו גישה חופשית למזון ומים סטריליים. בעלי החיים חולקו באופן אקראי לקבוצות וקיבלו זמן הסתגלות של לפחות 7 ימים לפני תחילת הניסויים.
1. הכנה ל-S. aureus
- התאוששות זן: השג שפופרת של MRSA252 קפוא, צריבה וקירור של טבעת החיסון לקבלת טבעת של תמיסת חיידקים, חסן את החיידקים על צלחות אגר סויה טריפטית (TSA) (ראה טבלת חומרים) בשיטת צלחת הפסים28, ותרבית לילה ב-37 מעלות צלזיוס.
- הפעלת חיידקים: למחרת, קחו בקבוק שייקר אחד של 50 מ"ל והוסיפו 20 מ"ל של מדיום מרק סויה טריפטי (TSB) (ראו טבלת חומרים). בחר מושבה אחת בודדת עם קצה פיפטה של 10 מיקרוליטר והוסף אותה לשייקר. דגרו על המושבות למשך הלילה ב-220 סל"ד, 37 מעלות צלזיוס.
- הפעלה משנית: למחרת, קח בקבוק שייקר אחד של 50 מ"ל המכיל 15 מ"ל של מדיום TSB. הסר 200 מיקרוליטר של תמיסת חיידקים מהשייקר המכיל את החיידקים המופעלים הראשונים, הוסף לבקבוק החדש האחד המכיל 20 מ"ל של מדיום TSB, ודגר ב-220 סל"ד, 37 מעלות צלזיוס למשך 4 שעות.
- אוספים את תמיסת החיידקים המופעלת המשנית בצינור צנטריפוגה של 50 מ"ל, צנטריפוגה ב-3,000 x גרם למשך 10 דקות, וזורקים את הסופרנטנט.
- השעו מחדש את החיידקים המשקעים ב-10 מ"ל של מי מלח וצנטריפוגה ב-3,000 x גרם למשך 10 דקות. חזור על שלב זה פעמיים.
- מדוד את ערך ה-OD600 של תמיסת החיידקים והתאם אותו ל-1.0 עם מי מלח. בשלב זה, כמות החיידקים של MRSA252 בניסוי זה הייתה 1.0 x 109 CFU/mL.
הערה: תמיסת החיידקים מתווספת למדיום ללא אנטיביוטיקה ומדוללת לריכוז הרצוי; כל החיידקים ששימשו בניסוי הזה הוכנו בשיטה הנ"ל.
2. הקמת מודל זיהום תוך-תאי במבחנה
- הכנת תאי RAW264.7
הערה: קווי התאים ששימשו במחקר זה התקבלו מ-ATCC. כל קווי התאים נבדקו שליליים לזיהום מיקופלזמה. כל הניסויים בוצעו על תאים בשלב הגידול הלוגריתמי.- מוציאים את התאים מהחנקן הנוזלי ומפשירים אותם באמבט מים של 37 מעלות צלזיוס.
- הכניסו תאי RAW264.7 לתוך צינור צנטריפוגה של 15 מ"ל, הוסיפו 2 מ"ל של מדיום הנשר המותאם של דולבקו (DMEM; ראה טבלת חומרים) בתוספת 10% סרום בקר עוברי (ראה טבלת חומרים), פניצילין (100 יחידות/מ"ל) וסטרפטומיצין (100 מיקרוגרם/מ"ל; ראה טבלת חומרים; מדיום שלם) ב-37 מעלות צלזיוס ב-5% CO2. צנטריפוגה ב -300 x גרם למשך 5 דקות.
- זרעים 3 x 106 תאים RAW264.7 בכלים של 100 מ"מ עם 10 מ"ל של מדיום שלם. יש לשמור למשך 12 שעות בחממת תרבית תאים בטמפרטורה של 37 מעלות צלזיוס ב-5% CO2 כך שמפגש התאים הוא בין 50%-60%.
- זיהום תוך-תאי במבחנה
- קח 10 מיקרוליטר של תרחיף תאים והוסף אותו למונה התאים כדי לחשב את ריכוז התא. ספרו וזרעו 2 x 105 תאים RAW264.7 בצלחת של 24 בארות (ראו טבלת חומרים) תוך שימוש ב-1 מ"ל של מדיום שלם לכל באר ושמרו אותו בחממת תרבית תאים למשך 10-12 שעות.
- הסר את הסופרנטנט והוסף 1 מ"ל של מדיום שלם המכיל 2 x 106 CFU תמיסת חיידקים (שלב 1.6) לכל באר. הניחו אותו בחממת תרבית התאים למשך שעתיים. MRSA252 ריבוי זיהומים נגוע
(MOI) הוא 10. (כדי לאמת את המתאם בין ערכי ריבוי זיהום שונים (MOI) לבין פגוציטוזיס של חיידקים לפי תאים, הקמנו קבוצות ניסוי עם ערכי MOI של 20, 30, 40 ו-50).
הערה: המדיום השלם המשמש בעת הדבקת תאים אינו מכיל פניצילין וסטרפטומיצין. - הסר את הסופרנטנט ושטוף את התאים פעמיים עם PBS (ראה טבלת חומרים). הוסף 800 מיקרוליטר לבאר של DMEM עם 100 מיקרוגרם/מ"ל גנטמיצין (ראה טבלת חומרים) והניח בחממת התאים ב-37 מעלות צלזיוס ב-5% CO2 למשך שעתיים.
- הערכת מודל זיהום תוך תאי במבחנה
- בדיקת הרג תוך-תאית של S. aureus
- אוספים את תאי RAW264.7 (שלבים 2.2.2 ו-2.2.3) בנפרד לצינורות צנטריפוגה. שטפו את התאים פעמיים עם PBS, הוסיפו תמיסת טריטון X-100 0.1% (ראו טבלת חומרים) לכל צינור למשך 5 דקות, ואספו את הליזאט בצינורות הצנטריפוגה.
- השתמש ב-PBS כדי לדלל את הליזט באופן סדרתי. קח 20 מיקרוליטר ליזאט והוסף אותו לצינור מיקרו-צנטריפוגה המכיל 180 מיקרוליטר PBS, ואז ערבב היטב על ידי פיפטינג. לדלל צעד אחר צעד לפי הליך זה. זהו כל דילול של הליזאט על צלחות TSA ודגרו למשך הלילה בטמפרטורה של 37 מעלות צלזיוס. ספרו את המושבות על לוחות ה-TSA עבור ליזאט (איור 1A).
הערה: יתר על כן, חקרנו את תנאי הניסוי האופטימליים לזיהום תוך-תאי של MRSA252 במקרופאגים צפקיים. העומס החיידקי במקרופאגים צפקיים הנגועים MRSA252 ומטופלים בריכוזים משתנים של גנטמיצין מוצג באיור 1B, בעוד שהעומס החיידקי לאחר טיפול ב-100 מיקרוגרם/מ"ל גנטמיצין לפרקי זמן שונים מוצג באיור 1C. - לדלל את הסופרנטנט והליזאט באופן סדרתי עם PBS כמתואר בסעיף 2.3.1.2, ולהתבונן במושבות על לוחות ה-TSA עבור הסופרנטנט והליזאט (איור 2A).
- מיקרוסקופ סריקת לייזר קונפוקלי (CLSM)
- יש לדלל תאי RAW264.7 (שלב 2.2) ל-2 x 105 תאים/מ"ל על צלחת פטרי קונפוקלית (ראה טבלת חומרים) ולהניח אותם בחממת תאים להדבקה למשך הלילה ב-37 מעלות צלזיוס ב-5% CO2. הוסף 1 מ"ל של מדיום שלם המכיל 2 x 106 CFU ו-4 x 106 תמיסת חיידקים (שלב 1.6) לכל צלחת פטרי קונפוקלית והנח אותה בחממת התאים למשך שעתיים, מה שהופך את ה-MOI ל-10 ו-20, בהתאמה.
- הסר את הסופרנטנט ושטוף את התאים פי 3 עם PBS, הוסף 100 מיקרוגרם/מ"ל גנטמיצין DMEM למשך שעתיים והסר את החיידקים החוץ-תאיים. לאחר מכן הסר את הסופרנטנט ושטוף את התאים פעמיים עם PBS, הוסף נוזל עבודה DIL (ראה טבלת חומרים), ודגר בטמפרטורה של 37 מעלות צלזיוס למשך 5 דקות בחושך.
- הסר את נוזל העבודה DIL ושטוף 3 פעמים עם PBS, ותקן עם תמיסת פרפורמלדהיד 4% (ראה טבלת חומרים) למשך 20 דקות.
- הסר את תמיסת הפרפורמלדהיד ושטוף 3 פעמים עם PBS, הוסף צבע DAPI (ראה טבלת חומרים) ודגירה למשך 5 דקות בחושך. הסר את תמיסת הצבע DAPI ושטוף פי 5 עם PBS. השתמשו ב-CLSM כדי לצפות בתאים (איור 2B).
הערה: בעבודה זו נעשה שימוש MRSA252 מהונדס עם חלבון פלואורסצנטי ירוק (GFP), שנבנה בשיטת רקומבינציה הומולוגית29.
- בדיקת הרג תוך-תאית של S. aureus
3. הקמת מודל זיהום תוך-תאי in vivo
- רכישת מקרופאגים צפקיים בעכברים
- הכינו מרק עמילן 6%. על פי יחס המסה 3:10:5 (w/w), הוסף שלושה סוגים של חומרי עזר (אבקת תמצית בקר, טריפטון, נתרן כלורי; ראה טבלת חומרים) ברצף במיכל הזכוכית. הוסיפו 1 ליטר של ddH2O למיכל זכוכית, ערבבו עד להמסה וחממו במיקרוגל. הוסף מסיס עמילן (ראה טבלת חומרים) עם יחס מסה של 6, מערבב להמסה ומקפיד לחטוף את מיכל הזכוכית ב-121 מעלות צלזיוס למשך 30 דקות. שומרים במקרר בחום של 4 מעלות צלזיוס עד שהוא הופך לעיסה.
- אסוף מקרופאגים צפקים של עכבר לפי השלבים המתוארים להלן.
- בחר שני עכברי Balb/c. השתמש ביד שמאל כדי לתפוס את צוואר העכבר ולשלוט בזנב. הפכו את העכבר והניחו לראש למטה ולבטן למעלה (איור 3A). מתן הזרקה תוך-צפקית של מרק עמילן 6%, 3 מ"ל לעכבר (איור 3B).
הערה: עקב כוח הכבידה, האיברים בחלל הבטן ייפלו לאחור לחזה, וימנעו מהמזרק לפגוע באיברים אחרים. - לאחר 72 שעות, יש להרדים את העכברים עם איזופלורן 3% ואז להקריב אותם על ידי פריקת צוואר הרחם. חיטוי אותם עם 75% אלכוהול אתילי. השתמשו במספריים עיניים כדי לחתוך את בטן העכבר כדי לחשוף את הצפק שלו באופן מלא (איור 4A-C).
- הזרקת 10 מ"ל של מדיום DMEM לעכברים כדי לשטוף את חלל הבטן על ידי הזרקה תוך-צפקית (איור 4D). לאחר הזרקת DMEM לחלל הבטן של העכברים, שפשפו את בטן העכברים בעדינות למשך כדקה אחת כדי לשטוף את הבטן בצורה יסודית יותר. השתמשו במזרק כדי לאסוף נוזל שטיפה לתוך צינור צנטריפוגה של 50 מ"ל (איור 4E).
- צנטריפוגה של נוזל השטיפה ב-300 x גרם למשך 5 דקות והשליכו את הסופרנטנט.
- השתמש ב-10 מ"ל DMEM בתוספת 10% סרום בקר עוברי, פניצילין (100 יחידות/מ"ל) וסטרפטומיצין (100 מיקרוגרם/מ"ל; מדיום שלם) כדי לנשוף ולשאוב את התאים שנאספו, לספור אותם ולדלל את ריכוז התאים ל-2 x 106/מ"ל וקרש על צלחות של 6 בארות (ראה טבלת חומרים), 1 מ"ל לבאר.
- מניחים את צלחת 6 הבארות ב-37 מעלות צלזיוס ב-5% CO2, מדגרים למשך 4 שעות ולאחר מכן מסירים את הסופרנטנט. שטפו תאים פי 2 עם PBS סטרילי ותרבית למשך הלילה עם 1 מ"ל DMEM לבאר ב-37 מעלות צלזיוס ב-5% CO2.
- בחר שני עכברי Balb/c. השתמש ביד שמאל כדי לתפוס את צוואר העכבר ולשלוט בזנב. הפכו את העכבר והניחו לראש למטה ולבטן למעלה (איור 3A). מתן הזרקה תוך-צפקית של מרק עמילן 6%, 3 מ"ל לעכבר (איור 3B).
- הכנת חיידקים תוך תאיים
- דגרו על המקרופאגים הצפק (שלב 3.1.2) עם MRSA252 למשך שעתיים. הסר את הסופרנטנט ושטוף את התאים פעמיים עם PBS. הוסף מדיום שלם DMEM עם 100 מיקרוגרם/מ"ל גנטמיצין (1 מ"ל לבאר) ודגירה למשך שעתיים ב-37 מעלות צלזיוס ב-5% CO2.
- הסר את הסופרנטנט ושטוף את התאים 3 פעמים עם PBS. השתמש במגרד תאים כדי לאסוף מקרופאגים צפקיים של עכבר בצינורות צנטריפוגה של 50 מ"ל, צנטריפוגה ב -300 x גרם למשך 5 דקות. החיידקים התוך-תאיים של MRSA252 הוכנו בהצלחה במקרופאגים צפקיים.
- לחישוב חיידקים תוך-תאיים, למקרופאגים הצפק הנגועים MRSA252 תוך-תאי, הוסף ליזוזים (10 מיקרוגרם/מ"ל, ראה טבלת חומרים) ב-37 מעלות צלזיוס למשך 10 דקות ולאחר מכן שטוף עם PBS 2x. לאחר מכן, הוסף 1 מ"ל של PBS כדי להשעות מחדש את התאים. לייז את התאים על ידי הוספת 0.1% טריטון X-100 למשך 5 דקות.
- מדללים את הליזיס בדילולים סדרתיים וזורקים אותו על צלחת TSA. תרבית לילה ב-37 מעלות צלזיוס. חשב את החיידקים התוך-תאיים של MRSA252 במקרופאגים צפקיים, שהיו 1.8 x 106 CFU לעכבר, על ידי ספירת מושבות החיידקים.
הערה: כאשר מגרד התאים אוסף תאים, הפעולה צריכה להיות עדינה. התאים מגרדים בכיוון אחד כדי למנוע שבירת תאים, מה שעלול להשפיע על הניסוי הבא.
- זיהום חיידקי תוך תאי בעכברים
- חלקו באופן אקראי 20 עכברי Balb/c לארבע קבוצות (n=5, איור 5A).
- עבור קבוצה I, יש להזריק 3 x 106 CFU פלנקטוניות MRSA252 לכל עכבר בהזרקה תוך ורידית. עבור קבוצה II, יש להזריק 3 x 106 CFU MRSA252 פלנקטוניות וונקומיצין (110 מ"ג/ק"ג; ראה טבלת חומרים) לכל עכבר בהזרקה תוך ורידית. עבור קבוצה III, יש להזריק את החיידקים התוך תאיים (שהוכנו בשלב 3.2) בהזרקה תוך ורידית. עבור קבוצה IV, יש להזריק את החיידקים התוך תאיים (שהוכנו בשלב 3.2) ואת הוונקומיצין (110 מ"ג/ק"ג) לכל עכבר בהזרקה תוך ורידית.
- הנח את העכברים מתחת למנורת הפיזיותרפיה האינפרא אדום עד שוורידי הזנב שלהם מתרחבים.
- הזרקה תוך ורידית של 3 x 106 CFU פלנקטוניות MRSA252 לכל עכבר מקבוצה I וקבוצה II. הזרקה תוך ורידית של החיידקים התוך תאיים (שהוכנו בשלב 3.2) לכל עכבר מקבוצה III וקבוצה IV.
הערה: בעת שימוש במזרק לאיסוף נוזל המכיל חיידקים תוך תאיים, מומלץ תחילה לערבב בעדינות את הנוזל באופן שווה עם פיפטה כדי להבטיח רמות זיהום עקביות בכל העכברים. - לאחר 30 דקות, יש להזריק ונקומיצין תוך ורידי לקבוצה II וקבוצה IV לכל עכבר.
- הערכת מודל זיהום תוך-תאי in vivo
- להעריך את מודל הזיהום התוך תאי של עכברים על ידי ספירת קולוניזציה של חיידקים בכליות. לאחר 24 שעות של הזרקה יש להרדים את העכברים באיזופלורן 3% ולהקריב אותם על ידי פריקת צוואר הרחם. לחטא אותם ב-75% אלכוהול אתילי.
- לשתק את העכברים, להרים את עור הבטן בפינצטה ביד אחת, לחתוך את עור הבטן של העכבר במספריים עיניים ביד השנייה, למצוא את הכליות בחלל הבטן ולהפשיט לחלוטין את הכליות. הכניסו אותם ל-PBS.
- הוסף 1 מ"ל PBS לצינור טחינת הרקמות. מעבירים את הכליות מכל עכבר לצינורות טחינה נפרדים וטוחנים עד שלא נשארת רקמה מוצקה. יוצקים את הרקמה ההומוגנית לצינורות EP בודדים ומסמנים כל צינור בזיהוי העכבר המתאים.
- השתמש ב-PBS כדי לדלל באופן סדרתי את הרקמה ההומוגנית. הבחין בכל דילול על צלחות TSA נפרדות ודגר למשך הלילה ב-37 מעלות צלזיוס. ספרו את המושבות ונתחו את הנתונים (איור 5B).
תוצאות
מודלים של זיהום תוך-תאי של S. aureus הוקמו בהצלחה הן במבחנה והן ב-vivo. על ידי אופטימיזציה של תנאי הניסוי לפגוציטוזיס והארכת הריכוז ומשך הטיפול האנטיביוטי, חלק מ-S. aureus שרד בתוך המקרופאגים (איור 1). כדי להעריך עוד יותר את העמידות לאנטיביוטיקה של S. aureus, מקרופאגים שנדבקו ב-MRSA252 טופלו באנטיביוטיקה במשך שעתיים עד שהסופרנטנט של התא כבר לא הכיל S. aureus, בעוד שחלק מהחיידקים המשיכו להתקיים בתוך המקרופאגים (איור 2A). מיקרוסקופ סריקת לייזר קונפוקלי גילה שאנטיביוטיקה לא יכולה להרוג S. aureus בתוך התאים (איור 2B). נוסף על כך, מבחני קולוניזציה של חיידקים בעכברים הראו שבעוד שוונקומיצין יכול לחסל S . aureus פלנקטוני, הוא לא היה יעיל כנגד חיידקים שחיים בתוך תאים (איור 5B). לפיכך, מודל הזיהום התוך-תאי של S. aureus הוקם בהצלחה.
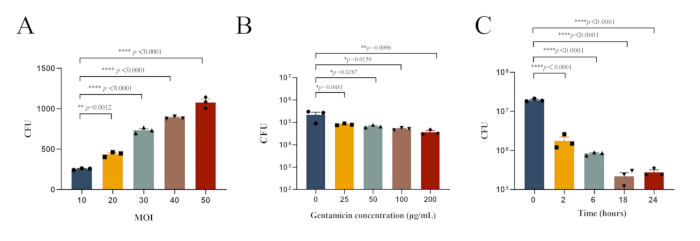
איור 1: תנאי ניסוי אופטימליים לזיהום תוך-תאי של MRSA252 במקרופאגים צפקיים. (A) עומס חיידקי במקרופאגים צפקיים הנגועים ב-MRSA252 בערכי MOI שונים. (B) עומס חיידקי במקרופאגים צפקיים שנדבקו MRSA252 וטופלו בריכוזים משתנים של גנטמיצין. (C) עומס חיידקי במקרופאגים צפקיים שנדבקו ב-MRSA252 לאחר טיפול ב-100 מיקרוגרם/מ"ל גנטמיצין לפרקי זמן שונים. הנתונים מבוטאים כממוצע ± SEM (n=3), ונעשה שימוש ב-ANOVA חד-כיווני עם מבחן הפוסט-הוק של דונט לקביעת מובהקות (**** p < 0.0001, ** p < 0.01, * p < 0.05). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
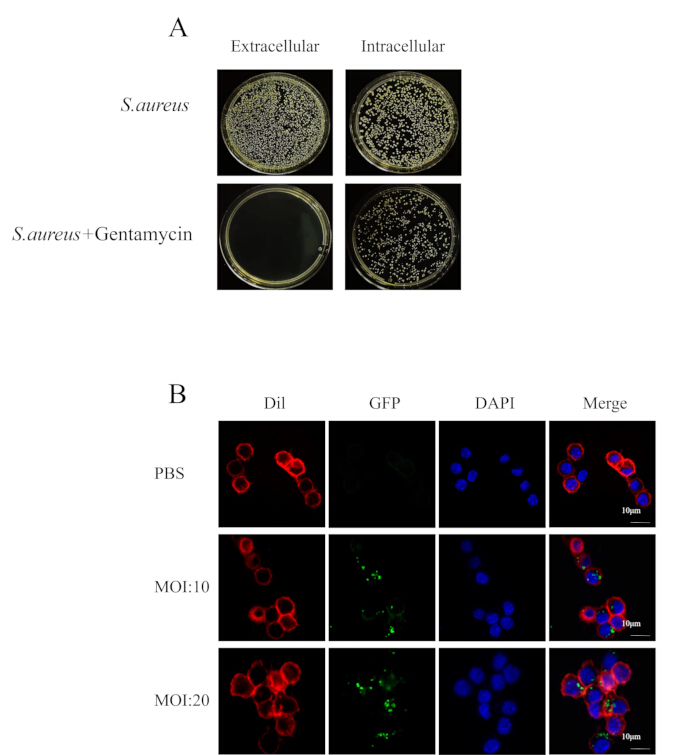
איור 2: S. aureus תוך-תאי מתנגד לטיפול אנטיביוטי. (A) תמונה של ציפוי צלחת חיידקים של תרחיף תאים וציטופלזמה. (B) מיקרוסקופיה קונפוקלית הראתה גדילה של חיידקים ב-RAW264.7 (אדום) שנדבקו על ידי MRSA252 (ירוק) בנקודות של 4 שעות בנוכחות אנטיביוטיקה (סרגל קנה מידה = 10 מיקרומטר). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
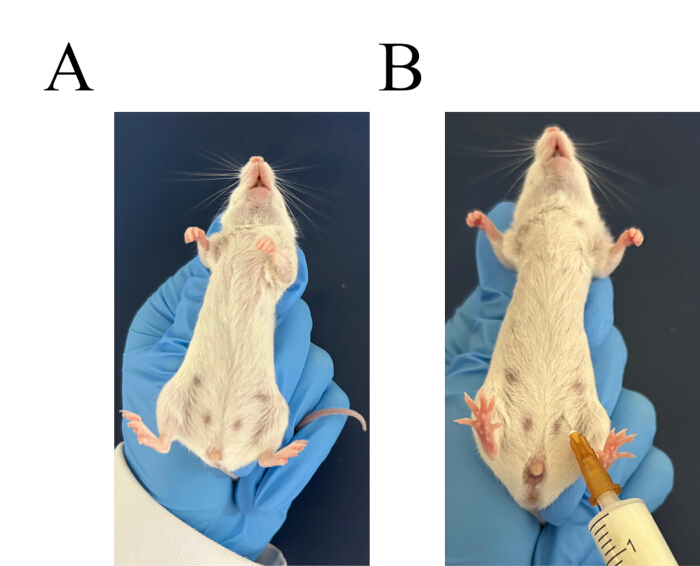
איור 3: נוהל להזרקה תוך-צפקית. (A) אחוז היטב בעכבר. (B) זהה את מקום ההזרקה עבור ההזרקה התוך-צפקית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: הליך למיצוי מקרופאגים צפקיים. (A) חתכו את פני העור של הבטן. (B) לבצע הפרדה קהה של העור. (C) היפרדות העור חושפת את הצפק. (D) לשטוף את חלל הבטן. (E) לאסוף ולשטוף עוד יותר את חלל הבטן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: זיהום תוך-תאי MRSA252 עמיד בפני הריגת ונקומיצין. (A) תקציר גרפי הממחיש את התכנון הניסיוני להקמת מודלים של זיהום עם חיידקים פלנקטוניים לעומת חיידקים תוך-תאיים. התקציר הגרפי צויר על ידי Figdraw. (B) עומסים חיידקיים בכליות: עומסים חיידקיים זוהו יום אחד אחרי ההדבקה. CFU, יחידות יוצרות מושבה. ונקו מייצג את ונקומיצין. הנתונים בוטאו כממוצע ±SEM (n=5 דגימות בלתי תלויות ביולוגית), ונעשה שימוש ב-ANOVA חד-כיווני עם מבחן הפוסט-הוק של דונט לקביעת מובהקות (****p < 0.0001, ns אינו מייצג מובהקות). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
S. aureus, כפתוגן תוך-תאי פקולטטיבי, יכול לפלוש ולשרוד בסוגי תאים שונים, תוך שימוש ביכולת זו כדי להתחמק מאנטיביוטיקה ותגובות חיסוניות במהלך זיהום30. מחקר זה ביסס מודל זיהום תוך-תאי של S. aureusin vivo כדי לספק בסיס לחקירת מנגנוני הזיהום התוך-תאיים של הפתוגן. על ידי בחינת ההשפעה של ערכי MOI שונים על פגוציטוזיס מקרופאגים של S. aureus, כמו גם היעילות של ריכוזים שונים של אנטיביוטיקה ומשכי טיפול, נקבעו התנאים האופטימליים לביסוס מודל זיהום תוך-תאי (איור 1).
בעת בניית מודל המבחנה של זיהום תוך-תאי S. aureus, התאם את S. aureus בשלב הגידול הלוגריתמי לריכוז הרצוי והוסף אותו לצלחת תרבית התאים. ודא שהמדיום אינו מכיל אנטיביוטיקה, מכיוון שנוכחותם עלולה לעכב את יכולתו של הפתוגן להיכנס לתאים. לאחר שעתיים של הדבקה, נוסף מדיום המכיל ריכוז של 100 מיקרוגרם/מ"ל של גנטמיצין לטיפול בתאים הנגועים. ניסויי קולוניזציה של תאים (איור 2A) הראו שגנטמיצין חיסל ביעילות חיידקים חוץ-תאיים בעוד שהחיידקים הנותרים הופנמו על ידי התאים. מיקרוסקופיה קונפוקלית אישרה עוד כי גישה זו הקלה על כניסת חיידקים לתאים, ויצרה זיהום תוך תאי (איור 2B).
במחקר זה, עכברים עוררו עם מרק עמילן כדי לייצר מקרופאגים צפקיים, אשר לאחר מכן חולצו ונדבקו MRSA252 במבחנה. מקרופאגים צפקים נגועים אלה הוזרקו לאחר מכן לעכברים. לצורך הביקורת, העכברים הוזרקו גם 3 x 106 CFU של MRSA252 פלנקטונית. לאחר זריקות אלה, ניתן טיפול בוונקומיצין לכל העכברים.
ונקומיצין ניתן לעכברים 24 שעות לפני הערכת רמות החיידקים, וקבע מסגרת זמן קריטית לזיהום חיידקי תוך תאי. בעכברים שטופלו MRSA252 פלנקטונית, ונקומיצין כמעט חיסל את העומס החיידקי בכליות. עם זאת, קבוצת הזיהום התוך-תאי עדיין הראתה נוכחות חיידקית משמעותית למרות שקיבלה מינון אתגר נמוך יותר של 1.8 x 106 CFU בהשוואה לקבוצת הפלנקטון (איור 5B). לפיכך, אנו מסיקים כי המודל הוקם בהצלחה. בהשוואה למודלים אחרים25, גירינו תחילה מקרופאגים צפקיים של עכברים לזיהום במבחנה , וכתוצאה מכך התאוששות מוגברת של תאים אלה.
לסיכום, ניתן לראות את פלישת החיידקים והקולוניזציה של תאים באופן ישיר יותר באמצעות MRSA252 מהונדסים עם חלבון פלואורסצנטי ירוק. הזן יכול לשמש גם כדי להעריך את האינטראקציה בין S. aureus למארח, למשל, הפלישה וההידבקות של S. aureus לפונדקאי. בנוסף, המודל משתמש בתנאים מזיהום תוך תאי במבחנה כדי לחדד ולייעל את מודל in vivo . עם זאת, הוא אינו חוקר באופן מלא קולוניזציה של חיידקים באיברים אחרים לאחר זיהום תוך-תאי וייתכן שאינו משקף לחלוטין תרחישי זיהום קליניים. חקירה מעמיקה יותר של דפוסי זיהום תוך-תאיים יכולה לשפר את הסימולציה של המודל של מצבים קליניים.
ניתן לצפות ישירות בפלישת החיידקים והקולוניזציה של תאים באמצעות MRSA252 מהונדסים עם חלבון פלואורסצנטי ירוק. זן זה גם מקל על הערכת האינטראקציות בין S. aureus לפונדקאי, כולל תהליכי הפלישה וההידבקות. בנוסף, המודל ממנף תנאים מזיהום תוך תאי במבחנה כדי לחדד את מודל in vivo . עם זאת, הוא אינו מחקר מלא של קולוניזציה של חיידקים באיברים אחרים לאחר זיהום תוך תאי בעבודה זו וייתכן שלא ייצג במדויק תרחישי זיהום קליניים. יש צורך בחקירה מעמיקה יותר של דפוסי זיהום תוך תאיים כדי לשפר את הסימולציה של המודל של מצבים קליניים.
Disclosures
המחברים מצהירים שאין להם אינטרסים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הלאומית למדעי הטבע של סין (NSFC, מענק מס' 32300779, מס' 32270989), קרן מדעי הטבע של צ'ונגצ'ינג (CSTB2022NSCQ-MSX0156), פרויקט המחקר המדעי והטכנולוגי של ועדת החינוך של צ'ונגצ'ינג (KJQN202312802) וקרן הפוסט-דוקטורט למדע של סין (2024M754250).
Materials
| Name | Company | Catalog Number | Comments |
| 24-well plate | Corning Incorporated, USA | 3524 | |
| 4 % paraformaldehyde solutione | BBI, UK | E672002-0500 | |
| 6-well plate | Corning Incorporated, USA | 3516 | |
| Beef extract powder | BBI, UK | A600114-0500 | |
| Biohazard safety equipment | Heal force, China | VS-1300L-u | |
| Cell incubator | ESCO, Singapore | CCL-170B-8 | |
| Cell scraper | Nest | 710001 | |
| Centrifuge M1416R | RWD, China | M1416R | |
| Centrifuge tube | Guanghou Labselect, China | CT-002-50A | |
| Confocal laser scanning microscope (CLSM) | Zeiss, Germany | 880 | |
| Confocal petri dish | Biosharp, China | BS-20-GJM | |
| DAPI dye | Shanghai Beyotime, China | C1006 | |
| DIL working fluid | Shanghai Beyotime, China | C1991S | |
| Dulbecco’s Modified Eagle Medium | Thermo Gibco, USA | C11995500BT | |
| Fetal Bovine Serum | Hyclone | SV30208.02 | |
| Gentamycin | Shanghai Sangon, China | B540724-0010 | |
| Incubator | Shanghai Hengzi, China | HDPF-150 | |
| Lysozyme | Beijing Solarbio, China | L9070 | |
| MRSA252 | Third Military Medical University, China | null | |
| MRSA252(GPF) | Third Military Medical University, China | null | |
| Penicillin and Streptomycin | Shanghai Beyotime, China | C0222 | |
| Phosphate Buffer Solution | Shanghai Beyotime, China | ST476 | |
| Saline | Sichuan Kelun, China | null | |
| Sodium chloride | Shanghai Macklin, China | S805275 | |
| Starch soluble | Shanghai Sangon, China | A500904-0500 | |
| Triton X-100 | Shanghai Beyotime, China | P0096-100ml | |
| Tryptic Soy Agar (TSA) plates | Beijing AOBOX Biotechnology Co., LTD,China | 02-130 | |
| Tryptic Soy Broth (TSB) medium | Beijing AOBOX Biotechnology Co., LTD,China | 02-102K | |
| Tryptone | OXOID, UK | LP0042B | |
| Vancomycin | Shanghai Beyotime, China | ST2807-250mg | |
| RAW264.7 cell | USA, ATCC | null |
References
- Sutton, J. A. F., et al. Staphylococcus aureus cell wall structure and dynamics during host-pathogen interaction. PLoS Pathog. 17 (3), e1009468 (2021).
- Yang, H., et al. Lateral flow assay of methicillin-resistant Staphylococcus aureus using bacteriophage cellular wall-binding domain as recognition agent. Biosens Bioelectron. 182, 113189 (2021).
- Howden, B. P., et al. Staphylococcus aureus host interactions and adaptation. Nat Rev Microbiol. 21 (6), 380-395 (2023).
- Guo, H., et al. Biofilm and small colony variants-an update on Staphylococcus aureus strategies toward drug resistance. Int J Mol Sci. 23 (3), 1241 (2022).
- Huitema, L., et al. Intracellular escape strategies of Staphylococcus aureus in persistent cutaneous infections. Exp Dermatol. 30 (10), 1428-1439 (2021).
- Pidwill, G. R., et al. Clonal population expansion of Staphylococcus aureus occurs due to escape from a finite number of intraphagocyte niches. Sci Rep. 13 (1), 1188 (2023).
- Wang, M., et al. Autophagy in Staphylococcus aureus infection. Front Cell Infect Microbiol. 11, 750222 (2021).
- Arya, R., et al. Identification of an antivirulence agent targeting the master regulator of virulence genes in Staphylococcus aureus. Front Cell Infect Microbiol. 13, 1268044 (2023).
- Münzenmayer, L., et al. Influence of sae-regulated and agr-regulated factors on the escape of Staphylococcus aureus from human macrophages. Cell Microbiol. 18 (8), 1172-1183 (2016).
- Chin, D., et al. Staphylococcus lugdunensis uses the agr regulatory system to resist killing by host innate immune effectors. Infect Immun. 90 (10), e0009922 (2022).
- Podkowik, M., et al. Quorum-sensing agr system of Staphylococcus aureus primes gene expression for protection from lethal oxidative stress. Elife. 12, RP89098 (2024).
- Purves, J., et al. Air pollution induces Staphylococcus aureus usa300 respiratory tract colonization mediated by specific bacterial genetic responses involving the global virulence gene regulators agr and sae. Environ Microbiol. 24 (9), 4449-4465 (2022).
- Wittekind, M. A., et al. The novel protein scra acts through the saers two-component system to regulate virulence gene expression in Staphylococcus aureus. Mol Microbiol. 117 (5), 1196-1212 (2022).
- Pidwill, G. R., et al. The role of macrophages in Staphylococcus aureus infection. Front Immunol. 11, 620339 (2020).
- Lang, J. C., et al. A photoconvertible reporter system for bacterial metabolic activity reveals that Staphylococcus aureus enters a dormant-like state to persist within macrophages. mBio. 13 (5), e0231622 (2022).
- Li, M., et al. Interactions between macrophages and biofilm during Staphylococcus aureus-associated implant infection: Difficulties and solutions. J Innate Immun. 15 (1), 499-515 (2023).
- Sun, L., et al. Staphylococcal virulence factor hlgb targets the endoplasmic-reticulum-resident e3 ubiquitin ligase amfr to promote pneumonia. Nat Microbiol. 8 (1), 107-120 (2023).
- Mulcahy, M. E., et al. Manipulation of autophagy and apoptosis facilitates intracellular survival of Staphylococcus aureus in human neutrophils. Front Immunol. 11, 565545 (2020).
- Cai, J., et al. Staphylococcus aureus facilitates its survival in bovine macrophages by blocking autophagic flux. J Cell Mol Med. 24 (6), 3460-3468 (2020).
- Ahmad-Mansour, N., et al. Staphylococcus aureus toxins: An update on their pathogenic properties and potential treatments. Toxins. 13 (10), 677 (2021).
- Davis, J. S., et al. How I manage a patient with MRSA bacteremia. Clin Microbiol Infect. 28 (2), 190-194 (2022).
- Fait, A., et al. Staphylococcus aureus response and adaptation to vancomycin. Adv Microb Physiol. 85, 201-258 (2024).
- Kelly, J. J., et al. Measurement of accumulation of antibiotics to Staphylococcus aureus in phagosomes of live macrophages. Angew Chem Int Ed Engl. 63 (3), e202313870 (2024).
- Rowe, S. E., et al. Recalcitrant Staphylococcus aureus infections: Obstacles and solutions. Infect Immun. 89 (4), e00694-e00720 (2021).
- Lehar, S. M., et al. Novel antibody-antibiotic conjugate eliminates intracellular S. aureus. Nature. 527 (7578), 323-328 (2015).
- Peyrusson, F., et al. Intracellular Staphylococcus aureus persisters upon antibiotic exposure. Nat Commun. 11 (1), 2200 (2020).
- Pollitt, E. J. G., et al. Staphylococcus aureus infection dynamics. PLoS Pathog. 14 (6), e1007112 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. J Vis Exp. 11 (63), e3064 (2012).
- Qin, L., et al. Antibody-antibiotic conjugate targeted therapy for orthopedic implant-associated intracellular S. aureus infections. J Adv Res. 65, 239-255 (2024).
- Andie, S. L., et al. Methicillin-resistant Staphylococcus aureus. Nat Rev Dis Primers. 31 (4), 18034 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ISSN 2689-3649
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.