Method Article
Sviluppo e valutazione di modelli di infezione intracellulare per Staphylococcus aureus
In questo articolo
Riepilogo
Lo Staphylococcus aureus (S. aureus) ha la capacità di diffondersi in tutto il corpo, causando infezioni persistenti e ricorrenti. Per comprendere meglio questi processi, questo studio stabilisce un modello di infezione intracellulare per S. aureus. Questo modello fornirà una base cruciale per studiare i meccanismi alla base delle infezioni intracellulari.
Abstract
S. aureus può invadere e persistere all'interno delle cellule ospiti, comprese le cellule immunitarie, il che gli consente di eludere il rilevamento e l'eliminazione immunitaria. Questa persistenza intracellulare contribuisce alle infezioni croniche e ricorrenti, complicando il trattamento e prolungando la malattia. Di conseguenza, c'è un bisogno critico di un modello di infezione intracellulare per comprendere, prevenire e trattare meglio le infezioni causate da S. aureus. Questo studio ha indicato che gli antibiotici eliminano efficacemente i batteri extracellulari ma non riescono a sradicare quelli che sono entrati nelle cellule. Pertanto, RAW264.7 ha infettato con S. aureus un'infezione intracellulare stabile in vitro e li ha co-coltivati con antibiotici. Successivamente, è stato stabilito un modello di infezione intracellulare nei topi iniettando macrofagi peritoneali contenenti l'infezione intracellulare. La vancomicina ha eliminato efficacemente le cariche batteriche nei topi sfidati con S. aureus planctonico; Tuttavia, è risultato inefficace contro i topi infettati con livelli uguali o inferiori di batteri intracellulari all'interno dei macrofagi peritoneali. Ciò indica che il modello di infezione intracellulare di S. aureus è stato stabilito con successo, offrendo potenziali intuizioni per la prevenzione e il trattamento delle infezioni intracellulari.
Introduzione
S. aureus è un agente patogeno altamente contagioso che può causare una serie di infezioni, tra cui infezioni della pelle e dei tessuti molli, sepsi, meningite, polmonite ed endocardite1. L'uso clinico improprio di antibiotici ha portato a un aumento della resistenza in S. aureus e all'emergere di Staphylococcus aureus resistente alla meticillina (MRSA), che rappresenta una significativa minaccia per la salute pubblica in molti paesi2.
Sebbene S. aureus non sia tradizionalmente classificato come patogeno intracellulare, prove emergenti suggeriscono che può colonizzare in modo persistente le cellule ospiti dopo l'invasione3. La capacità di S. aureus di sopravvivere intracellulare all'interno dei fagociti dell'ospite è sempre più riconosciuta come un meccanismo che facilita l'infezione metastatica e la disseminazione in tutto l'ospite 4,5,6. S. aureus secerne vari fattori di virulenza, che creano un ambiente immunitario che ne favorisce la sopravvivenza e complica la capacità dell'ospite di eliminarlo completamente7. Il regolatore genico accessorio (agr) e gli elementi helper dello stafilococco (Sae) sono due importanti regolatori di virulenza strettamente correlati alla sopravvivenza dello Staphylococcus aureus nei fagociti 8,9. Il sistema agr è un meccanismo di quorum-sensing che regola l'espressione di numerosi fattori di virulenza in S. aureus. Controlla la produzione di tossine e altri fattori che facilitano la sopravvivenza e la diffusione batterica. Durante l'infezione intracellulare, il sistema agr svolge un ruolo critico nella regolazione dei fattori di virulenza che sono essenziali per la capacità del batterio di eludere le risposte immunitarie dell'ospite e sopravvivere all'interno delle cellule ospiti. Gli studi hanno dimostrato che il sistema agr influenza la capacità del batterio di sfuggire ai fagosomi e persistere all'interno dei macrofagi. L'assenza di agr può portare a una ridotta sopravvivenza batterica all'interno delle cellule ospiti e a una diminuzione della virulenza10,11. Il sistema Sae è un sistema regolatorio a due componenti che controlla l'espressione di diversi fattori di virulenza in S. aureus. È coinvolto nella regolazione delle tossine e degli enzimi che contribuiscono alla capacità del batterio di invadere e danneggiare i tessuti ospiti. Il sistema Sae svolge anche un ruolo cruciale nella sopravvivenza intracellulare di S. aureus. Influenza la capacità del batterio di resistere all'uccisione da parte dei fagociti ospiti e di eludere la degradazione autofagica12,13.
Quando i patogeni invadono, i macrofagi hanno funzioni fagocitarie, che possono inghiottire e uccidere i patogeni estranei e attivare la risposta immunitaria adattativa14. La maggior parte dei batteri invasori viene fagocitata dai macrofagi, che quindi attivano vari meccanismi di uccisione per eliminarli. Tuttavia, alcuni batteri S. aureus possono sopravvivere all'interno dei macrofagi, portando a un'infezione persistente dell'ospite. Oltre alle proteine batteriche, l'ospite influisce anche sulla sopravvivenza e sulla proliferazione di S. aureus all'interno dei macrofagi secernendo citochine 15,16,17. Alcuni studi indicano che S. aureus può eludere la degradazione risiedendo negli autofagosomi, creando una nicchia intracellulare che promuove la disseminazione18. S. aureus sfugge alla degradazione autofagica bloccando il flusso autofagico (ad esempio, LC3-II, p62) e aumentando il pH all'interno degli autolisosomi dopo l'invasione dei macrofagi19. Questa evasione immunitaria si ottiene attraverso la regolazione dei fattori di virulenza e dell'autofagia di S. aureus, portando a infezioni persistenti e nascoste.
L'eliminazione delle infezioni intracellulari di S. aureus è fondamentale per la gestione delle infezioni persistenti e latenti nella pratica clinica. Attualmente, gli antibiotici sono il trattamento principale per le infezioni da S. aureus, con la vancomicina che funge da ultima linea di difesa per le infezioni da MRSA20,21. Tuttavia, numerosi studi hanno dimostrato che gli antibiotici esistenti sono inefficaci nell'eliminare S. aureus intracellulare, sia in vivo che in vitro 22,23,24.
Attualmente non esiste uno standard unificato per i vari modelli di infezione intracellulare di S. aureus 25,26,27, poiché le condizioni di ciascun modello differiscono in modo significativo. Di conseguenza, gli stessi criteri non possono essere applicati per valutare l'efficacia di tali modelli. In questo studio, abbiamo stabilito un modello di infezione intracellulare universale di Staphylococcus aureus ottimizzando le condizioni sperimentali. Questo modello offre una maggiore comodità rispetto ad altri, in quanto consente l'infezione iniziale dei batteri in cellule in vitro, seguita dalla consegna di queste cellule infette nel corpo.
Per comprendere meglio i meccanismi dell'infezione intracellulare da S. aureus e sviluppare farmaci correlati, abbiamo stabilito modelli sia in vitro che in vivo . Un modello stabile di infezione intracellulare è stato creato con successo in vitro infettando RAW264.7 e co-coltivandolo con antibiotici. Quindi, i macrofagi peritoneali sono stati estratti e formati in infezioni intracellulari. Un modello di infezione intracellulare nei topi è stato stabilito iniettando questi macrofagi peritoneali.
Protocollo
Gli animali da esperimento, topi femmina BALB/c di 6-8 settimane privi di patogeni specifici (SPF), sono stati acquistati dalla Beijing HFK Bioscience Co., Ltd (Pechino, Cina). Tutti gli studi sugli animali sono stati approvati dal Comitato per il Benessere e l'Etica degli Animali da Laboratorio della Terza Università Medica Militare e sono stati eseguiti in conformità con le politiche e le linee guida istituzionali e nazionali per l'uso degli animali da laboratorio. I topi sono stati tenuti e vaccinati in strutture SPF e hanno avuto libero accesso a cibo e acqua sterili. Gli animali sono stati divisi in modo casuale in gruppi e hanno avuto un tempo di adattamento di almeno 7 giorni prima dell'inizio degli esperimenti.
1. Preparazione per S. aureus
- Recupero del ceppo: Procurarsi una provetta di MRSA252 congelata, cauterizzare e raffreddare l'anello di inoculazione per ottenere un anello di soluzione batterica, inoculare i batteri su piastre di Tryptic Soy Agar (TSA) (vedi Tabella dei materiali) con il metodo28 della piastra di striatura e coltura per una notte a 37 °C.
- Attivazione batterica: il giorno successivo, prendere un pallone shaker da 50 ml e aggiungere 20 ml di terreno di brodo di soia triptico (TSB) (vedi Tabella dei materiali). Prelevare una singola colonia con un puntale per pipetta da 10 μl e aggiungerla allo shaker. Incubare le colonie durante la notte a 220 giri/min, 37 °C.
- Attivazione secondaria: il giorno successivo, assumere un pallone shaker da 50 ml contenente 15 ml di terreno TSB. Rimuovere 200 μL di soluzione batterica dall'agitatore contenente i primi batteri attivati, aggiungerli all'unico nuovo pallone contenente 20 mL di terreno TSB e incubare a 220 giri/min, 37 °C per 4 ore.
- Raccogliere la soluzione batterica attivata secondaria in una provetta da centrifuga da 50 mL, centrifugare a 3.000 x g per 10 minuti ed eliminare il surnatante.
- Risospendere i batteri precipitati in 10 mL di soluzione fisiologica e centrifugare a 3.000 x g per 10 min. Ripetere questo passaggio 2 volte.
- Misurare il valore OD600 della soluzione batterica e regolarlo a 1,0 con soluzione fisiologica. A quel tempo, la quantità batterica di MRSA252 in questo esperimento era di 1,0 x 109 CFU/mL.
NOTA: La soluzione batterica viene aggiunta a un terreno privo di antibiotici e diluita alla concentrazione desiderata; Tutti i batteri utilizzati in questo esperimento sono stati preparati con il metodo di cui sopra.
2. Definizione di un modello di infezione intracellulare in vitro
- Preparazione delle celle RAW264.7
NOTA: Le linee cellulari utilizzate in questo studio sono state ottenute da ATCC. Tutte le linee cellulari sono risultate negative per la contaminazione da micoplasma. Tutti gli esperimenti sono stati eseguiti su cellule in fase di crescita logaritmica.- Togliere le cellule dall'azoto liquido e scongelarle a bagnomaria a 37 °C.
- Mettere le cellule RAW264.7 in una provetta da centrifuga da 15 mL, aggiungere 2 mL di terreno eagle modificato di Dulbecco (DMEM; vedere Tabella dei materiali) integrato con il 10% di siero fetale bovino (vedere Tabella dei materiali), penicillina (100 unità/mL) e streptomicina (100 μg/mL; vedere Tabella dei materiali; terreno completo) a 37 °C in CO2 al 5%. Centrifugare a 300 x g per 5 min.
- Seminare 3 x 106 cellule RAW264.7 in piastre da 100 mm con 10 mL di terreno completo. Conservare per 12 ore in un incubatore per colture cellulari a 37 °C in CO2 al 5% in modo che la confluenza delle cellule sia compresa tra il 50% e il 60%.
- Infezione intracellulare in vitro
- Prelevare 10 μl di sospensione cellulare e aggiungerla al contatore di cellule per calcolare la concentrazione cellulare. Contare e seminare 2 x 105 cellule RAW264.7 in una piastra da 24 pozzetti (vedere la Tabella dei materiali) utilizzando 1 mL di terreno completo per ogni pozzetto e conservarlo in un incubatore per colture cellulari per 10-12 ore.
- Rimuovere il surnatante e aggiungere 1 mL di terreno completo contenente 2 x 106 CFU di soluzione batterica (fase 1.6) in ciascun pozzetto. Metterlo nell'incubatore per colture cellulari per 2 ore. La molteplicità di infezioni MRSA252 infette
(MOI) è 10. (Per verificare la correlazione tra i vari valori di molteplicità di infezione (MOI) e la fagocitosi dei batteri da parte delle cellule, abbiamo stabilito gruppi sperimentali con valori MOI di 20, 30, 40 e 50.).
NOTA: Il mezzo completo utilizzato per infettare le cellule non contiene penicillina e streptomicina. - Rimuovere il surnatante e lavare le celle 2 volte con PBS (vedere la tabella dei materiali). Aggiungere 800 μL per pozzetto di DMEM con 100 μg/mL di gentamicina (vedere la Tabella dei materiali) e porre nell'incubatore cellulare a 37 °C in CO2 al 5% per 2 ore.
- Valutazione di un modello di infezione intracellulare in vitro
- Saggio intracellulare di uccisione di S. aureus
- Raccogliere le celle RAW264.7 (passaggi 2.2.2 e 2.2.3) separatamente in provette da centrifuga. Lavare le cellule 2 volte con PBS, aggiungere la soluzione di Triton X-100 allo 0,1% (vedere Tabella dei materiali) in ciascuna provetta per 5 minuti e raccogliere il lisato nelle provette da centrifuga.
- Usa PBS per diluire il lisato in serie. Prelevare 20 μl di lisato e aggiungerli a una provetta da microcentrifuga contenente 180 μl di PBS, quindi miscelare accuratamente mediante pipettaggio. Diluire passo dopo passo seguendo questa procedura. Individuare ogni diluizione del lisato sulle piastre TSA e incubare per una notte a 37 °C. Contare le colonie sulle piastre TSA per il lisato (Figura 1A).
NOTA: Inoltre, abbiamo studiato le condizioni sperimentali ottimali per l'infezione intracellulare di MRSA252 nei macrofagi peritoneali. La carica batterica nei macrofagi peritoneali infettati con MRSA252 e trattati con concentrazioni variabili di gentamicina è mostrata nella Figura 1B, mentre la carica batterica dopo il trattamento con 100 μg/mL di gentamicina per durate diverse è mostrata nella Figura 1C. - Diluire il surnatante e lisato in serie con PBS come descritto nella sezione 2.3.1.2 e osservare le colonie sulle piastre TSA per il surnatante e il lisato (Figura 2A).
- Microscopio confocale a scansione laser (CLSM)
- Diluire le cellule RAW264.7 (fase 2.2) in 2 x 105 cellule/mL su una piastra di Petri confocale (vedere la Tabella dei materiali) e porle in un incubatore cellulare per l'adesione per una notte a 37 °C in CO2 al 5%. Aggiungere 1 mL di terreno completo contenente 2 x 106 CFU e 4 x 106 soluzione batterica (fase 1.6) a ciascuna capsula di Petri confocale e metterla nell'incubatore cellulare per 2 ore, rendendo il MOI rispettivamente 10 e 20.
- Rimuovere il surnatante e lavare le cellule 3 volte con PBS, aggiungere 100 μg/mL di gentamicina DMEM per 2 ore e rimuovere i batteri extracellulari. Quindi rimuovere il surnatante e lavare le celle 2 volte con PBS, aggiungere il fluido di lavoro DIL (vedere la Tabella dei materiali) e incubare a 37 °C per 5 minuti al buio.
- Rimuovere il fluido di lavoro DIL e lavare 3 volte con PBS e fissare con una soluzione di paraformaldeide al 4% (vedi Tabella dei materiali) per 20 minuti.
- Rimuovere la soluzione di paraformaldeide e lavare 3 volte con PBS, aggiungere il colorante DAPI (vedi Tabella dei materiali) e incubare per 5 minuti al buio. Rimuovere la soluzione colorante DAPI e lavare 5 volte con PBS. Utilizzare CLSM per osservare le celle (Figura 2B).
NOTA: Questo lavoro utilizzato MRSA252 ingegnerizzato con una proteina fluorescente verde (GFP), che è stata costruita utilizzando il metodo di ricombinazione omologa29.
- Saggio intracellulare di uccisione di S. aureus
3. Definizione di un modello di infezione intracellulare in vivo
- Acquisizione di macrofagi peritoneali nei topi
- Preparare il brodo di amido al 6%. In base al rapporto di massa 3:10:5 (p/p), aggiungere tre tipi di eccipienti (estratto di manzo in polvere, triptone, cloruro di sodio; vedi Tabella dei materiali) in successione nel contenitore di vetro. Aggiungere 1 L di ddH2O in un contenitore di vetro, mescolare per farlo sciogliere e scaldare nel microonde. Aggiungere l'amido solubile (vedi Tabella dei materiali) con un rapporto di massa di 6, mescolare per sciogliere e assicurarsi di sterilizzare in autoclave il contenitore di vetro a 121 °C per 30 minuti. Conservare in frigorifero a 4 °C fino a quando non diventa una pasta.
- Raccogliere i macrofagi peritoneali di topo seguendo i passaggi descritti di seguito.
- Scegli due mouse Balb/c. Usa la mano sinistra per afferrare il collo del mouse e controllare la coda. Capovolgi il mouse e abbassa la testa e alza l'addome (Figura 3A). Somministrare un'iniezione intraperitoneale di brodo di amido al 6%, 3 ml per topo (Figura 3B).
NOTA: A causa della gravità, gli organi nella cavità addominale cadranno all'indietro verso il torace, impedendo alla siringa di ferire altri organi. - Dopo 72 ore, anestetizzare i topi con isoflurano al 3% e poi sacrificarli per lussazione cervicale. Disinfettarli con alcool etilico al 75%. Utilizzare una forbice oftalmica per aprire l'addome del topo per esporre completamente il suo peritoneo (Figura 4A-C).
- Iniettare 10 mL di terreno DMEM nei topi per lavare la cavità addominale mediante iniezione intraperitoneale (Figura 4D). Dopo aver iniettato il DMEM nella cavità addominale dei topi, strofinare delicatamente l'addome dei topi per circa 1 minuto per lavare l'addome più a fondo. Utilizzare una siringa per raccogliere il liquido di lavaggio in una provetta da centrifuga da 50 ml (Figura 4E).
- Centrifugare il liquido di lavaggio a 300 x g per 5 minuti ed eliminare il surnatante.
- Utilizzare 10 ml di DMEM integrati con il 10% di siero fetale bovino, penicillina (100 unità/mL) e streptomicina (100 μg/mL; terreno completo) per soffiare e aspirare le cellule raccolte, contarle e diluire la concentrazione cellulare a 2 x 106/mL e plank su piastre a 6 pozzetti (vedere la Tabella dei materiali), 1 mL per pozzetto.
- Posizionare la piastra a 6 pozzetti a 37 °C in CO2 al 5%, incubare per 4 ore e quindi rimuovere il surnatante. Lavare le cellule 2 volte con PBS sterile e colturarle per una notte con 1 mL di DMEM per pozzetto a 37 °C in CO2 al 5%.
- Scegli due mouse Balb/c. Usa la mano sinistra per afferrare il collo del mouse e controllare la coda. Capovolgi il mouse e abbassa la testa e alza l'addome (Figura 3A). Somministrare un'iniezione intraperitoneale di brodo di amido al 6%, 3 ml per topo (Figura 3B).
- Preparazione di batteri intracellulari
- Incubare i macrofagi peritoneali (passaggio 3.1.2) con MRSA252 per 2 ore. Rimuovere il surnatante e lavare le celle 2 volte con PBS. Aggiungere DMEM terreno completo con 100 μg/mL di gentamicina (1 mL per pozzetto) e incubare per 2 ore a 37 °C in CO2 al 5%.
- Rimuovere il surnatante e lavare le celle 3 volte con PBS. Utilizzare un raschietto cellulare per raccogliere i macrofagi peritoneali di topo in provette da centrifuga da 50 mL, centrifugare a 300 x g per 5 minuti. I batteri intracellulari di MRSA252 sono stati preparati con successo nei macrofagi peritoneali.
- Per il calcolo dei batteri intracellulari, ai macrofagi peritoneali infettati da MRSA252 intracellulari, aggiungere lisozima (10 μg/mL, vedi Tabella dei Materiali) a 37 °C per 10 min e quindi lavare con PBS 2x. Quindi, aggiungere 1 ml di PBS per risospendere le cellule. Liare le cellule aggiungendo lo 0,1% di Triton X-100 per 5 minuti.
- Diluire la lisi con diluizioni in serie e farla cadere su una piastra TSA. Coltura notturna a 37 °C. Calcolare i batteri intracellulari di MRSA252 nei macrofagi peritoneali, che erano 1,8 x 106 CFU per topo, contando le colonie batteriche.
NOTA: Quando il raschietto per celle raccoglie le cellule, l'azione deve essere delicata. Le cellule vengono raschiate in una direzione per evitare la rottura delle cellule, che potrebbe influire sull'esperimento successivo.
- Infezione batterica intracellulare nei topi
- Dividi casualmente 20 topi Balb/c in quattro gruppi (n=5, Figura 5A).
- Per il Gruppo I, iniettare 3 x 106 CFU di MRSA252 planctonico per topo mediante iniezione endovenosa. Per il Gruppo II, iniettare 3 x 106 CFU di MRSA252 planctonica e vancomicina (110 mg/kg; vedere Tabella dei materiali) per topo mediante iniezione endovenosa. Per il Gruppo III, iniettare i batteri intracellulari (preparati al punto 3.2) mediante iniezione endovenosa. Per il Gruppo IV, iniettare i batteri intracellulari (preparati al punto 3.2) e la vancomicina (110 mg/kg) per topo mediante iniezione endovenosa.
- Posiziona i topi sotto la lampada fisioterapica a infrarossi fino a quando le vene della coda non si dilatano.
- Iniettare per via endovenosa 3 x 106 CFU MRSA252 planctonico per topo del Gruppo I e del Gruppo II. Iniettare per via endovenosa i batteri intracellulari (preparati al punto 3.2) per topo del Gruppo III e del Gruppo IV.
NOTA: Quando si utilizza una siringa per raccogliere un liquido contenente batteri intracellulari, si consiglia di mescolare delicatamente il liquido in modo uniforme con una pipetta per garantire livelli di infezione costanti in tutti i topi. - Dopo 30 minuti, iniettare per via endovenosa la vancomicina al Gruppo II e al Gruppo IV per topo.
- Valutazione di un modello di infezione intracellulare in vivo
- Valutare il modello di infezione intracellulare dei topi contando la colonizzazione dei batteri nei reni. Dopo 24 ore di iniezione, anestetizzare i topi con isoflurano al 3% e sacrificarli per lussazione cervicale. Disinfettarli in alcool etilico al 75%.
- Immobilizzare i topi, sollevare la pelle addominale con una pinzetta con una mano, tagliare la pelle addominale del topo con le forbici oftalmiche con l'altra mano, trovare i reni nella cavità addominale e spogliare completamente i reni. Mettili in PBS.
- Aggiungere 1 mL di PBS alla provetta per la macinazione dei tessuti. Trasferire i reni di ciascun topo in tubi di macinazione separati e macinare fino a quando non rimane tessuto solido. Versare il tessuto omogeneizzato nelle singole provette EP ed etichettare ciascuna provetta con la corrispondente identificazione del topo.
- Utilizzare PBS per diluire in serie l'omogeneizzato tissutale. Individuare ogni diluizione su piastre TSA separate e incubare per una notte a 37 °C. Contare le colonie e analizzare i dati (Figura 5B).
Risultati
I modelli di infezione intracellulare di S. aureus sono stati stabiliti con successo sia in vitro che in vivo. Ottimizzando le condizioni sperimentali per la fagocitosi ed estendendo sia la concentrazione che la durata del trattamento antibiotico, alcuni S. aureus sono sopravvissuti all'interno dei macrofagi (Figura 1). Per valutare ulteriormente la resistenza agli antibiotici di S. aureus, i macrofagi infettati con il MRSA252 sono stati trattati con antibiotici per 2 ore fino a quando il surnatante cellulare non conteneva più S. aureus, mentre alcuni batteri persistevano all'interno dei macrofagi (Figura 2A). Un microscopio confocale a scansione laser ha rivelato che gli antibiotici non possono uccidere S. aureus all'interno delle cellule (Figura 2B). Inoltre, i saggi di colonizzazione batterica nei topi hanno dimostrato che, sebbene la vancomicina potesse eliminare lo S. aureus planctonico, era inefficace contro i batteri che risiedono all'interno delle cellule (Figura 5B). Pertanto, il modello di infezione intracellulare di S. aureus è stato stabilito con successo.
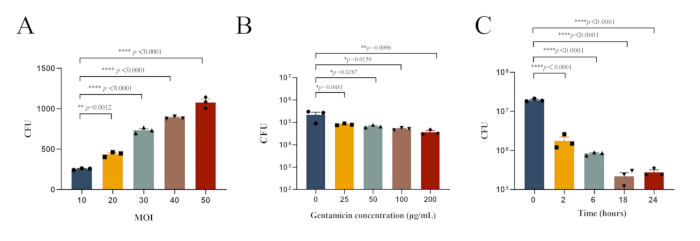
Figura 1: Condizioni sperimentali ottimali per l'infezione intracellulare di MRSA252 nei macrofagi peritoneali. (A) Carica batterica nei macrofagi peritoneali infettati da MRSA252 a diversi valori di MOI. (B) Carica batterica nei macrofagi peritoneali infettati con MRSA252 e trattati con concentrazioni variabili di gentamicina. (C) Carica batterica nei macrofagi peritoneali infettati con MRSA252 dopo trattamento con 100 μg/mL di gentamicina per durate diverse. I dati sono espressi come media ± SEM (n=3) e l'ANOVA unidirezionale con il test post-hoc di Dunnett è stata utilizzata per determinare la significatività (**** p < 0,0001, ** p < 0,01, * p < 0,05). Clicca qui per visualizzare una versione più grande di questa figura.
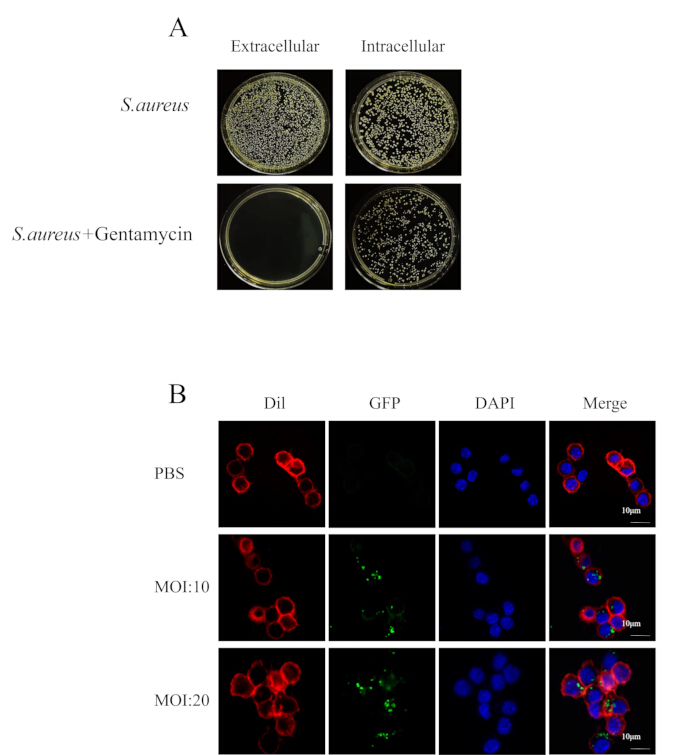
Figura 2: S. aureus intracellulare resiste al trattamento antibiotico. (A) Immagine del rivestimento della piastra batterica della sospensione cellulare e del citoplasma. (B) La microscopia confocale ha mostrato la crescita di batteri in RAW264.7 (rosso) infettati da MRSA252 (verde) a punti di 4 ore in presenza di antibiotici (barra della scala = 10 μm). Clicca qui per visualizzare una versione più grande di questa figura.
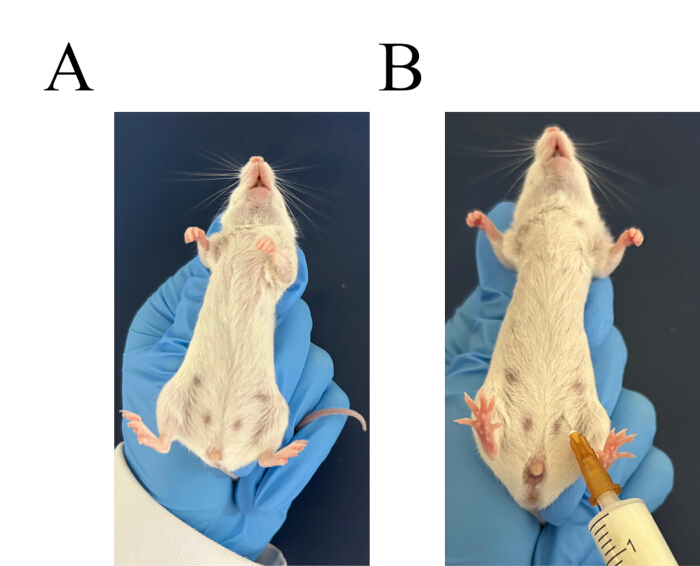
Figura 3: Procedura per l'iniezione intraperitoneale. (A) Afferrare saldamente il topo. (B) Identificare il sito di iniezione per l'iniezione intraperitoneale. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Procedura per l'estrazione dei macrofagi peritoneali. (A) Tagliare la pelle superficiale dell'addome. (B) Eseguire la separazione smussata della pelle. (C) La separazione della pelle espone il peritoneo. (D) Lavare la cavità addominale. (E) Raccogliere e lavare ulteriormente la cavità addominale. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: L'infezione intracellulare con MRSA252 è resistente all'uccisione della vancomicina. (A) Abstract grafico che illustra il disegno sperimentale per stabilire modelli di infezione con batteri planctonici rispetto a quelli intracellulari. L'abstract grafico è stato disegnato da Figdraw. (B) Cariche batteriche nel rene: le cariche batteriche sono state rilevate 1 giorno dopo l'infezione. CFU, unità formanti colonie. Vanco rappresenta la vancomicina. I dati sono stati espressi come media ±SEM (n=5 campioni biologicamente indipendenti) e l'ANOVA unidirezionale con il test post-hoc di Dunnett è stata utilizzata per determinare la significatività (****p < 0,0001, ns rappresenta nessuna significatività). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
S. aureus, come patogeno intracellulare facoltativo, può invadere e sopravvivere in vari tipi di cellule, utilizzando questa capacità di eludere gli antibiotici e le risposte immunitarie durante l'infezione30. Questo studio ha stabilito un modello di infezione intracellulare di S. aureus in vivo per fornire una base per lo studio dei meccanismi di infezione intracellulare del patogeno. Esplorando l'impatto di vari valori di MOI sulla fagocitosi macrofagica di S. aureus, nonché l'efficacia di diverse concentrazioni di antibiotici e durate del trattamento, sono state determinate le condizioni ottimali per stabilire un modello di infezione intracellulare (Figura 1).
Quando si costruisce il modello in vitro dell'infezione intracellulare da S. aureus, regolare lo S. aureus nella fase di crescita logaritmica alla concentrazione desiderata e aggiungerlo alla piastra di coltura cellulare. Assicurarsi che il terreno non contenga antibiotici, poiché la loro presenza può ostacolare la capacità dell'agente patogeno di entrare nelle cellule. Dopo 2 ore di infezione, è stato aggiunto un terreno contenente una concentrazione di 100 μg/mL di gentamicina per trattare le cellule infette. Gli esperimenti di colonizzazione cellulare (Figura 2A) hanno dimostrato che la gentamicina ha eliminato efficacemente i batteri extracellulari mentre i batteri rimanenti sono stati internalizzati dalle cellule. La microscopia confocale ha ulteriormente confermato che questo approccio facilita l'ingresso dei batteri nelle cellule, stabilendo un'infezione intracellulare (Figura 2B).
In questo studio, i topi sono stati stimolati con brodo di amido per produrre macrofagi peritoneali, che sono stati poi estratti e infettati con MRSA252 in vitro. Questi macrofagi peritoneali infetti sono stati successivamente iniettati nei topi. Per il controllo, ai topi sono stati iniettati anche 3 x 106 CFU di MRSA252 planctonica. Dopo queste iniezioni, il trattamento con vancomicina è stato somministrato a tutti i topi.
La vancomicina è stata somministrata ai topi 24 ore prima della valutazione dei livelli batterici, stabilendo un periodo di tempo critico per l'infezione batterica intracellulare. Nei topi trattati con MRSA252 planctonica, la vancomicina ha quasi sradicato la carica batterica nei reni. Tuttavia, il gruppo con infezione intracellulare mostrava ancora una presenza batterica significativa nonostante avesse ricevuto una dose di provocazione inferiore di 1,8 x 106 CFU rispetto al gruppo planctonico (Figura 5B). Pertanto, concludiamo che il modello è stato stabilito con successo. Rispetto ad altri modelli25, abbiamo prima stimolato i macrofagi peritoneali di topo per l'infezione in vitro , con conseguente aumento del recupero di queste cellule.
In sintesi, l'invasione batterica e la colonizzazione delle cellule possono essere osservate più direttamente utilizzando MRSA252 ingegnerizzate con proteina fluorescente verde. Il ceppo può anche essere utilizzato per valutare l'interazione tra S. aureus e l'ospite, ad esempio l'invasione e l'adesione di S. aureus all'ospite. Inoltre, il modello utilizza le condizioni dell'infezione intracellulare in vitro per perfezionare e ottimizzare il modello in vivo . Tuttavia, non esplora completamente la colonizzazione batterica in altri organi dopo l'infezione intracellulare e potrebbe non riflettere interamente gli scenari clinici di infezione. Un'indagine più approfondita dei modelli di infezione intracellulare potrebbe migliorare la simulazione delle situazioni cliniche del modello.
L'invasione batterica e la colonizzazione delle cellule possono essere osservate direttamente utilizzando MRSA252 ingegnerizzati con proteina fluorescente verde. Questo ceppo facilita anche la valutazione delle interazioni tra S. aureus e l'ospite, compresi i processi di invasione e adesione. Inoltre, il modello sfrutta le condizioni dell'infezione intracellulare in vitro per perfezionare il modello in vivo . Tuttavia, in questo lavoro non è possibile esplorare completamente la colonizzazione batterica in altri organi dopo l'infezione intracellulare e potrebbe non rappresentare accuratamente gli scenari di infezione clinica. È necessaria un'indagine più approfondita sui modelli di infezione intracellulare per migliorare la simulazione delle situazioni cliniche del modello.
Divulgazioni
Gli autori dichiarano di non avere interessi concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China (NSFC, Grant No.32300779, NO.32270989), dalla Natural Science Foundation di Chongqing (CSTB2022NSCQ-MSX0156), dal Science and Technology Research Project della Chongqing Education Commission (KJQN202312802) e dalla China Postdoctoral Science Foundation (2024M754250).
Materiali
| Name | Company | Catalog Number | Comments |
| 24-well plate | Corning Incorporated, USA | 3524 | |
| 4 % paraformaldehyde solutione | BBI, UK | E672002-0500 | |
| 6-well plate | Corning Incorporated, USA | 3516 | |
| Beef extract powder | BBI, UK | A600114-0500 | |
| Biohazard safety equipment | Heal force, China | VS-1300L-u | |
| Cell incubator | ESCO, Singapore | CCL-170B-8 | |
| Cell scraper | Nest | 710001 | |
| Centrifuge M1416R | RWD, China | M1416R | |
| Centrifuge tube | Guanghou Labselect, China | CT-002-50A | |
| Confocal laser scanning microscope (CLSM) | Zeiss, Germany | 880 | |
| Confocal petri dish | Biosharp, China | BS-20-GJM | |
| DAPI dye | Shanghai Beyotime, China | C1006 | |
| DIL working fluid | Shanghai Beyotime, China | C1991S | |
| Dulbecco’s Modified Eagle Medium | Thermo Gibco, USA | C11995500BT | |
| Fetal Bovine Serum | Hyclone | SV30208.02 | |
| Gentamycin | Shanghai Sangon, China | B540724-0010 | |
| Incubator | Shanghai Hengzi, China | HDPF-150 | |
| Lysozyme | Beijing Solarbio, China | L9070 | |
| MRSA252 | Third Military Medical University, China | null | |
| MRSA252(GPF) | Third Military Medical University, China | null | |
| Penicillin and Streptomycin | Shanghai Beyotime, China | C0222 | |
| Phosphate Buffer Solution | Shanghai Beyotime, China | ST476 | |
| Saline | Sichuan Kelun, China | null | |
| Sodium chloride | Shanghai Macklin, China | S805275 | |
| Starch soluble | Shanghai Sangon, China | A500904-0500 | |
| Triton X-100 | Shanghai Beyotime, China | P0096-100ml | |
| Tryptic Soy Agar (TSA) plates | Beijing AOBOX Biotechnology Co., LTD,China | 02-130 | |
| Tryptic Soy Broth (TSB) medium | Beijing AOBOX Biotechnology Co., LTD,China | 02-102K | |
| Tryptone | OXOID, UK | LP0042B | |
| Vancomycin | Shanghai Beyotime, China | ST2807-250mg | |
| RAW264.7 cell | USA, ATCC | null |
Riferimenti
- Sutton, J. A. F., et al. Staphylococcus aureus cell wall structure and dynamics during host-pathogen interaction. PLoS Pathog. 17 (3), e1009468 (2021).
- Yang, H., et al. Lateral flow assay of methicillin-resistant Staphylococcus aureus using bacteriophage cellular wall-binding domain as recognition agent. Biosens Bioelectron. 182, 113189 (2021).
- Howden, B. P., et al. Staphylococcus aureus host interactions and adaptation. Nat Rev Microbiol. 21 (6), 380-395 (2023).
- Guo, H., et al. Biofilm and small colony variants-an update on Staphylococcus aureus strategies toward drug resistance. Int J Mol Sci. 23 (3), 1241 (2022).
- Huitema, L., et al. Intracellular escape strategies of Staphylococcus aureus in persistent cutaneous infections. Exp Dermatol. 30 (10), 1428-1439 (2021).
- Pidwill, G. R., et al. Clonal population expansion of Staphylococcus aureus occurs due to escape from a finite number of intraphagocyte niches. Sci Rep. 13 (1), 1188 (2023).
- Wang, M., et al. Autophagy in Staphylococcus aureus infection. Front Cell Infect Microbiol. 11, 750222 (2021).
- Arya, R., et al. Identification of an antivirulence agent targeting the master regulator of virulence genes in Staphylococcus aureus. Front Cell Infect Microbiol. 13, 1268044 (2023).
- Münzenmayer, L., et al. Influence of sae-regulated and agr-regulated factors on the escape of Staphylococcus aureus from human macrophages. Cell Microbiol. 18 (8), 1172-1183 (2016).
- Chin, D., et al. Staphylococcus lugdunensis uses the agr regulatory system to resist killing by host innate immune effectors. Infect Immun. 90 (10), e0009922 (2022).
- Podkowik, M., et al. Quorum-sensing agr system of Staphylococcus aureus primes gene expression for protection from lethal oxidative stress. Elife. 12, RP89098 (2024).
- Purves, J., et al. Air pollution induces Staphylococcus aureus usa300 respiratory tract colonization mediated by specific bacterial genetic responses involving the global virulence gene regulators agr and sae. Environ Microbiol. 24 (9), 4449-4465 (2022).
- Wittekind, M. A., et al. The novel protein scra acts through the saers two-component system to regulate virulence gene expression in Staphylococcus aureus. Mol Microbiol. 117 (5), 1196-1212 (2022).
- Pidwill, G. R., et al. The role of macrophages in Staphylococcus aureus infection. Front Immunol. 11, 620339 (2020).
- Lang, J. C., et al. A photoconvertible reporter system for bacterial metabolic activity reveals that Staphylococcus aureus enters a dormant-like state to persist within macrophages. mBio. 13 (5), e0231622 (2022).
- Li, M., et al. Interactions between macrophages and biofilm during Staphylococcus aureus-associated implant infection: Difficulties and solutions. J Innate Immun. 15 (1), 499-515 (2023).
- Sun, L., et al. Staphylococcal virulence factor hlgb targets the endoplasmic-reticulum-resident e3 ubiquitin ligase amfr to promote pneumonia. Nat Microbiol. 8 (1), 107-120 (2023).
- Mulcahy, M. E., et al. Manipulation of autophagy and apoptosis facilitates intracellular survival of Staphylococcus aureus in human neutrophils. Front Immunol. 11, 565545 (2020).
- Cai, J., et al. Staphylococcus aureus facilitates its survival in bovine macrophages by blocking autophagic flux. J Cell Mol Med. 24 (6), 3460-3468 (2020).
- Ahmad-Mansour, N., et al. Staphylococcus aureus toxins: An update on their pathogenic properties and potential treatments. Toxins. 13 (10), 677 (2021).
- Davis, J. S., et al. How I manage a patient with MRSA bacteremia. Clin Microbiol Infect. 28 (2), 190-194 (2022).
- Fait, A., et al. Staphylococcus aureus response and adaptation to vancomycin. Adv Microb Physiol. 85, 201-258 (2024).
- Kelly, J. J., et al. Measurement of accumulation of antibiotics to Staphylococcus aureus in phagosomes of live macrophages. Angew Chem Int Ed Engl. 63 (3), e202313870 (2024).
- Rowe, S. E., et al. Recalcitrant Staphylococcus aureus infections: Obstacles and solutions. Infect Immun. 89 (4), e00694-e00720 (2021).
- Lehar, S. M., et al. Novel antibody-antibiotic conjugate eliminates intracellular S. aureus. Nature. 527 (7578), 323-328 (2015).
- Peyrusson, F., et al. Intracellular Staphylococcus aureus persisters upon antibiotic exposure. Nat Commun. 11 (1), 2200 (2020).
- Pollitt, E. J. G., et al. Staphylococcus aureus infection dynamics. PLoS Pathog. 14 (6), e1007112 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. J Vis Exp. 11 (63), e3064 (2012).
- Qin, L., et al. Antibody-antibiotic conjugate targeted therapy for orthopedic implant-associated intracellular S. aureus infections. J Adv Res. 65, 239-255 (2024).
- Andie, S. L., et al. Methicillin-resistant Staphylococcus aureus. Nat Rev Dis Primers. 31 (4), 18034 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon