Method Article
تطوير وتقييم نماذج العدوى داخل الخلايا للمكورات العنقودية الذهبية
In This Article
Summary
المكورات العنقودية الذهبية (S. aureus) لديها القدرة على الانتشار في جميع أنحاء الجسم ، مما يتسبب في التهابات مستمرة ومتكررة. لفهم هذه العمليات بشكل أفضل ، تؤسس هذه الدراسة نموذجا للعدوى داخل الخلايا للمكورات العنقودية الذهبية. سيوفر هذا النموذج أساسا حاسما للتحقيق في الآليات الكامنة وراء العدوى داخل الخلايا.
Abstract
يمكن أن تغزو المكورات العنقودية الذهبية وتستمر داخل الخلايا المضيفة ، بما في ذلك الخلايا المناعية ، مما يسمح لها بالتهرب من الكشف عن المناعة وإزالتها. يساهم هذا الثبات داخل الخلايا في الإصابة بالعدوى المزمنة والمتكررة ، مما يعقد العلاج ويطيل أمد المرض. وبالتالي ، هناك حاجة ماسة لنموذج عدوى داخل الخلايا لفهم العدوى التي تسببها المكورات العنقودية الذهبية والوقاية منها وعلاجها بشكل أفضل. أشارت هذه الدراسة إلى أن المضادات الحيوية تقضي بشكل فعال على البكتيريا خارج الخلية ولكنها لا تستطيع القضاء على تلك التي دخلت الخلايا. وهكذا ، تم إنشاء عدوى مستقرة داخل الخلايا في المختبر بواسطة RAW264.7 المصاب بالمكورات العنقودية الذهبية وزراعتها بالمضادات الحيوية. بعد ذلك ، تم إنشاء نموذج عدوى داخل الخلايا في الفئران عن طريق حقن الضامة البريتونية التي تحتوي على العدوى داخل الخلايا. قام الفانكومايسين بإزالة الأحمال البكتيرية بشكل فعال في الفئران التي تواجه تحديا مع العوالق المكورات العوقرية الذهبية. ومع ذلك ، فقد كان غير فعال ضد الفئران المصابة بمستويات متساوية أو أقل من البكتيريا داخل الخلايا داخل الضامة الصفاقية. يشير هذا إلى أن نموذج العدوى داخل الخلايا للمكورات العنقودية الذهبية قد تم إنشاؤه بنجاح ، مما يوفر رؤى محتملة للوقاية من العدوى داخل الخلايا وعلاجها.
Introduction
المكورات العنقودية الذهبية هي مسببات الأمراض شديدة العدوى يمكن أن تسبب مجموعة من الالتهابات ، بما في ذلك التهابات الجلد والأنسجة الرخوة والإنتان والتهاب السحايا والالتهاب الرئوي والتهاب الشغاف1. أدى إساءة الاستخدام السريري للمضادات الحيوية إلى زيادة المقاومة في المكورات العنقودية الذهبية وظهور المكورات العنقودية الذهبية المقاومة للميثيسيلين (MRSA) ، والتي تشكل تهديدا كبيرا للصحة العمومية في العديد من البلدان2.
على الرغم من أن المكورات العنقودية الذهبية لا تصنف تقليديا على أنها مسببات الأمراض داخل الخلايا ، إلا أن الأدلة الناشئة تشير إلى أنه يمكن أن يستعمر الخلايا المضيفة باستمرار بعد الغزو3. يتم التعرف بشكل متزايد على قدرة المكورات العنقودية الذهبية على البقاء داخل الخلايا داخل الخلايا البلعمية المضيفة كآلية تسهل العدوى النقيلية والانتشار في جميع أنحاء المضيف4،5،6. تفرز المكورات العنقودية الذهبية عوامل الفوعة المختلفة ، والتي تخلق بيئة مناعية تعزز بقائها وتعقد قدرة المضيف على التخلص منه تماما7. منظم الجينات الملحقة (agr) والعناصر المساعدة للمكورات العنقودية (Sae) هما منظمان مهمان للضراوة يرتبطان ارتباطا وثيقا ببقاء المكورات العنقودية الذهبية في الخلايا البلعمية8،9. نظام agr هو آلية استشعار النصاب التي تنظم التعبير عن العديد من عوامل الفوعة في المكورات العنقودية الذهبية. يتحكم في إنتاج السموم والعوامل الأخرى التي تسهل بقاء البكتيريا وانتشارها. أثناء العدوى داخل الخلايا ، يلعب نظام agr دورا مهما في تنظيم عوامل الفوعة الضرورية لقدرة البكتيريا على التهرب من الاستجابات المناعية للمضيف والبقاء على قيد الحياة داخل الخلايا المضيفة. أظهرت الدراسات أن نظام agr يؤثر على قدرة البكتيريا على الهروب من البلعمة والاستمرار داخل البلاعم. يمكن أن يؤدي غياب agr إلى تقليل بقاء البكتيريا داخل الخلايا المضيفة وتقليل الفوعة10،11. نظام Sae هو نظام تنظيمي مكون من عنصرين يتحكم في التعبير عن العديد من عوامل الفوعة في المكورات العنقودية الذهبية. وهي تشارك في تنظيم السموم والإنزيمات التي تساهم في قدرة البكتيريا على غزو وإتلاف الأنسجة المضيفة. يلعب نظام Sae أيضا دورا مهما في بقاء المكورات العنقودية الذهبية داخل الخلايا. إنه يؤثر على قدرة البكتيريا على مقاومة القتل بواسطة الخلايا البلعمية المضيفة والتهرب من تدهور البلعمةالذاتية 12،13.
عندما تغزو مسببات الأمراض ، يكون للبلاعم وظائف البلعمة ، والتي يمكن أن تبتلع وتقتل مسببات الأمراض الأجنبية وتنشط الاستجابة المناعية التكيفية14. يتم إبحارة معظم البكتيريا الغازية بواسطة الضامة ، والتي تنشط بعد ذلك آليات القتل المختلفة للقضاء عليها. ومع ذلك ، يمكن لبعض بكتيريا المكورات العنقودية الذهبية البقاء على قيد الحياة داخل البلاعم ، مما يؤدي إلى عدوى مستمرة للمضيف. بالإضافة إلى البروتينات البكتيرية ، يؤثر المضيف أيضا على بقاء وتكاثر المكورات العنقودية الذهبية داخل البلاعم عن طريق إفراز السيتوكينات15،16،17. تشير بعض الدراسات إلى أن المكورات العنقودية الذهبية يمكن أن تتجنب التدهور من خلال الإقامة في الجسيمات الذاتية ، مما يخلق مكانة داخل الخلايا تعزز الانتشار18. المكورات العنقودية الذهبية يهرب من التحلل الذاتي عن طريق منع تدفق الالتهام الذاتي (على سبيل المثال ، LC3-II ، ص 62) وزيادة الأس الهيدروجيني داخل الجسيمات التحللية الذاتية بعد غزو البلاعم19. يتم تحقيق هذا التهرب المناعي من خلال تنظيم عوامل الفوعة المكورويات الذهبية والالتهام الذاتي ، مما يؤدي إلى التهابات مستمرة وخفية.
يعد التخلص من العدوى داخل الخلايا من المكورات العنقودية الذهبية أمرا بالغ الأهمية لإدارة العدوى المستمرة والكامنة في الممارسة السريرية. حاليا ، المضادات الحيوية هي العلاج الأساسي لعدوى المكورات العنقودية الذهبية ، حيث يعمل الفانكومايسين كخط دفاع أخير لعدوى MRSA20،21. ومع ذلك ، فقد أظهرت العديد من الدراسات أن المضادات الحيوية الموجودة غير فعالة في القضاء على المكورات العنقودية الذهبية داخل الخلايا ، سواء في الحياة الحية أو في المختبر22،23،24.
لا يوجد حاليا معيار موحد لنماذج العدوى داخل الخلايا المختلفة للمكورات العنقودية الذهبية25،26،27 ، حيث تختلف ظروف كل نموذج اختلافا كبيرا. وبالتالي ، لا يمكن تطبيق نفس المعايير لتقييم فعالية هذه النماذج. في هذه الدراسة ، أنشأنا نموذجا عالميا للعدوى داخل الخلايا للمكورات العنقودية الذهبية من خلال تحسين الظروف التجريبية. يوفر هذا النموذج راحة أكبر مقارنة بالآخرين ، لأنه يسمح بالعدوى الأولية للبكتيريا في الخلايا في المختبر ، متبوعا بتوصيل هذه الخلايا المصابة إلى الجسم.
لفهم آليات عدوى المكورات العنقودية الذهبية داخل الخلايا بشكل أفضل وتطوير الأدوية ذات الصلة ، أنشأنا نماذج في المختبر وفي الجسم الحي . تم إنشاء نموذج عدوى مستقرة داخل الخلايا بنجاح في المختبر عن طريق إصابة RAW264.7 وزراعتها بالمضادات الحيوية. بعد ذلك ، تم استخراج البلاعم البريتونية وتشكيلها في التهابات داخل الخلايا. تم إنشاء نموذج عدوى داخل الخلايا في الفئران عن طريق حقن هذه الضامة الصفاقية.
Protocol
تم شراء التجارب ، التي يبلغ عمرها 6-8 أسابيع من إناث الفئران BALB / c الخالية من مسببات الأمراض (SPF) ، من شركة Beijing HFK Bioscience Co.، Ltd (بكين ، الصين). تمت الموافقة على جميع الدراسات على من قبل لجنة رعاية وأخلاقيات رعاية المختبر التابعة للجامعة الطبية العسكرية الثالثة وتم إجراؤها وفقا للسياسات والمبادئ التوجيهية المؤسسية والوطنية لاستخدام المختبر. تم الاحتفاظ بالفئران وتطعيمها في مرافق SPF وتم توفير الوصول المجاني إلى الطعام والماء المعقم. تم تقسيم بشكل عشوائي إلى مجموعات واعترفت بوقت تكيف لا يقل عن 7 أيام قبل بدء التجارب.
1. التحضير للمكورات العنقودية الذهبية
- استعادة الإجهاد: احصل على أنبوب من MRSA252 المجمدة ، وقم بالكي وتبريد حلقة التلقيح للحصول على حلقة من المحلول البكتيري ، وتلقيح البكتيريا على ألواح Tryptic Soy Agar (TSA) (انظر جدول المواد) بطريقة لوحة الخطوط28 ، وزراعتها طوال الليل عند 37 درجة مئوية.
- التنشيط البكتيري: في اليوم التالي ، خذ قارورة شاكر سعة 50 مل وأضف 20 مل من وسط مرق الصويا Tryptic (TSB) (انظر جدول المواد). اختر مستعمرة واحدة برأس ماصة سعة 10 ميكرولتر وأضفها إلى الخلاط. احتضان المستعمرات بين عشية وضحاها عند 220 دورة في الدقيقة ، 37 درجة مئوية.
- التنشيط الثانوي: في اليوم التالي ، خذ قارورة شاكر سعة 50 مل تحتوي على 15 مل من وسط TSB. قم بإزالة 200 ميكرولتر من المحلول البكتيري من الخلاط الذي يحتوي على البكتيريا المنشطة الأولى ، وأضفه إلى قارورة جديدة تحتوي على 20 مل من وسط TSB ، واحتضانه عند 220 دورة في الدقيقة ، 37 درجة مئوية لمدة 4 ساعات.
- اجمع المحلول البكتيري المنشط الثانوي في أنبوب طرد مركزي سعة 50 مل ، وجهاز طرد مركزي عند 3,000 × جم لمدة 10 دقائق ، وتخلص من المادة الطافية.
- أعد تعليق البكتيريا المترسبة في 10 مل من المحلول الملحي وأجهزة الطرد المركزي عند 3,000 × جم لمدة 10 دقائق. كرر هذه الخطوة 2X.
- قم بقياس قيمة OD600 للمحلول البكتيري واضبطه على 1.0 باستخدام المحلول الملحي. في هذا الوقت ، كانت الكمية البكتيرية من MRSA252 في هذه التجربة 1.0 × 109 CFU / mL.
ملاحظة: يضاف المحلول البكتيري إلى وسط بدون مضادات حيوية ويخفف إلى التركيز المطلوب ؛ تم تحضير جميع البكتيريا المستخدمة في هذه التجربة بالطريقة المذكورة أعلاه.
2. إنشاء نموذج العدوى داخل الخلايا في المختبر
- تحضير خلايا RAW264.7
ملاحظة: تم الحصول على خطوط الخلايا المستخدمة في هذه الدراسة من ATCC. تم اختبار جميع خطوط الخلايا سلبية لتلوث الميكوبلازما. تم إجراء جميع التجارب على الخلايا في مرحلة النمو اللوغاريتمي.- قم بإزالة الخلايا من النيتروجين السائل وإذابة الثلج في حمام مائي 37 درجة مئوية.
- ضع خلايا RAW264.7 في أنبوب طرد مركزي سعة 15 مل ، وأضف 2 مل من وسط النسر المعدل من Dulbecco (DMEM ؛ انظر جدول المواد) مكملا بمصل بقري الجنين بنسبة 10٪ (انظر جدول المواد) ، والبنسلين (100 وحدة / مل) والستربتومايسين (100 ميكروغرام / مل ؛ انظر جدول المواد ؛ وسط كامل) عند 37 درجة مئوية في 5٪ ثاني أكسيد الكربون2. جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق.
- بذور 3 × 106 خلايا RAW264.7 في أطباق 100 مم مع 10 مل من الوسط الكامل. يحفظ لمدة 12 ساعة في حاضنة زراعة الخلايا عند 37 درجة مئوية في 5٪ ثاني أكسيد الكربون2 بحيث يكون التقاء الخلايا بين 50٪ -60٪.
- عدوى داخل الخلايا في المختبر
- خذ 10 ميكرولتر من معلق الخلية وأضفه إلى عداد الخلية لحساب تركيز الخلية. عد وبذر 2 × 105 خلايا RAW264.7 في صفيحة 24 بئرا (انظر جدول المواد) باستخدام 1 مل من الوسط الكامل لكل بئر واحتفظ بها في حاضنة زراعة الخلايا لمدة 10-12 ساعة.
- قم بإزالة المادة الطافية وأضف 1 مل من الوسط الكامل الذي يحتوي على محلول بكتيري 2 × 106 CFU (الخطوة 1.6) لكل بئر. ضعه في حاضنة زراعة الخلايا لمدة 2 ساعة. MRSA252 تعدد العدوى
(وزارة الداخلية) هي 10. (للتحقق من العلاقة بين قيم تعدد العدوى المختلفة (MOI) وبلعمة البكتيريا بواسطة الخلايا ، أنشأنا مجموعات تجريبية بقيم وزارة الداخلية 20 و 30 و 40 و 50.).
ملاحظة: لا يحتوي الوسط الكامل المستخدم عند إصابة الخلايا على البنسلين والستربتومايسين. - قم بإزالة المادة الطافية واغسل الخلايا 2x باستخدام PBS (انظر جدول المواد). أضف 800 ميكرولتر لكل بئر من DMEM مع 100 ميكروغرام / مل من الجنتاميسين (انظر جدول المواد) وضعها في حاضنة الخلية عند 37 درجة مئوية في 5٪ ثاني أكسيد الكربون2 لمدة ساعتين.
- تقييم نموذج العدوى داخل الخلايا في المختبر
- مقايسة قتل المكورات العنقودية الذهبية داخل الخلايا
- اجمع خلايا RAW264.7 (الخطوتان 2.2.2 و 2.2.3) بشكل منفصل في أنابيب أجهزة الطرد المركزي. اغسل الخلايا 2x باستخدام PBS ، وأضف محلول Triton X-100 بنسبة 0.1٪ (انظر جدول المواد) لكل أنبوب لمدة 5 دقائق ، واجمع المحللة في أنابيب الطرد المركزي.
- استخدم PBS لتخفيف المحللة بشكل متسلسل. خذ 20 ميكرولتر من المحللة وأضفها إلى أنبوب طرد مركزي دقيق يحتوي على 180 ميكرولتر من PBS ، ثم اخلطه جيدا عن طريق سحب العينات. تمييع خطوة بخطوة باتباع هذا الإجراء. ضع كل تخفيف من المحللة على ألواح TSA واحتضنه طوال الليل عند 37 درجة مئوية. عد المستعمرات الموجودة على لوحات TSA للمحللات (الشكل 1 أ).
ملاحظة: علاوة على ذلك ، قمنا بالتحقيق في الظروف التجريبية المثلى للعدوى داخل الخلايا من MRSA252 في البلاعم الصفاقية. يظهر الحمل البكتيري في البلاعم البريتونية المصابة ب MRSA252 والمعالجة بتركيزات متفاوتة من الجنتاميسين في الشكل 1 ب ، بينما يظهر الحمل البكتيري بعد العلاج ب 100 ميكروغرام / مل جنتاميسين لفترات مختلفة في الشكل 1 ج. - قم بتخفيف المادة الطافية والتحلل بشكل متسلسل باستخدام PBS كما هو موضح في القسم 2.3.1.2 ، وراقب المستعمرات الموجودة على ألواح TSA للطافي والمحلل (الشكل 2 أ).
- مجهر المسح الضوئي بالليزر متحد البؤر (CLSM)
- قم بتخفيف خلايا RAW264.7 (الخطوة 2.2) إلى 2 × 105 خلايا / مل على طبق بتري متحد البؤر (انظر جدول المواد) ووضعها في حاضنة خلية للالتصاق طوال الليل عند 37 درجة مئوية في 5٪ ثاني أكسيدالكربون 2. أضف 1 مل من الوسط الكامل الذي يحتوي على 2 × 106 CFU و 4 × 106 محلول بكتيري (الخطوة 1.6) إلى كل طبق بتري متحد البؤر وضعه في حاضنة الخلية لمدة ساعتين ، مما يجعل وزارة الداخلية 10 و 20 ، على التوالي.
- قم بإزالة المادة الطافية واغسل الخلايا 3 مرات باستخدام PBS ، وأضف 100 ميكروغرام / مل من الجنتاميسين DMEM لمدة ساعتين ، وقم بإزالة البكتيريا خارج الخلية. ثم قم بإزالة المادة الطافية واغسل الخلايا 2x باستخدام PBS ، وأضف سائل العمل DIL (انظر جدول المواد) ، واحتضن عند 37 درجة مئوية لمدة 5 دقائق في الظلام.
- قم بإزالة سائل العمل DIL واغسله 3 مرات باستخدام PBS ، وثبته بمحلول بارافورمالدهيد بنسبة 4٪ (انظر جدول المواد) لمدة 20 دقيقة.
- قم بإزالة محلول بارافورمالدهيد واغسله 3 مرات باستخدام PBS ، وأضف صبغة DAPI (انظر جدول المواد) واحتضنه لمدة 5 دقائق في الظلام. قم بإزالة محلول صبغة DAPI واغسله 5x باستخدام PBS. استخدم CLSM لمراقبة الخلايا (الشكل 2 ب).
ملاحظة: استخدم هذا العمل MRSA252 تم تصميمه باستخدام بروتين فلوري أخضر (GFP) ، والذي تم إنشاؤه باستخدام طريقة إعادة التركيب المتماثل29.
- مقايسة قتل المكورات العنقودية الذهبية داخل الخلايا
3. إنشاء نموذج العدوى داخل الخلايا في الجسم الحي
- اكتساب البلاعم البريتونية في الفئران
- تحضير مرق النشا 6٪. وفقا لنسبة الكتلة 3:10:5 (وزن / وزن) ، أضف ثلاثة أنواع من السواغات (مسحوق مستخلص لحم البقر ، التربتون ، كلوريد الصوديوم ؛ انظر جدول المواد) على التوالي في الحاوية الزجاجية. أضف 1 لتر من ddH2O إلى وعاء زجاجي ، وحركه حتى يذوب ، وسخنه في الميكروويف. أضف النشا القابل للذوبان (انظر جدول المواد) بنسبة كتلة 6 ، وحركها حتى تذوب ، وتأكد من تعقيم الحاوية الزجاجية عند 121 درجة مئوية لمدة 30 دقيقة. يحفظ في الثلاجة على حرارة 4 درجات مئوية حتى يصبح عجينة.
- اجمع الضامة البريتونية للفأر باتباع الخطوات الموضحة أدناه.
- اختر اثنين من الفئران Balb / c. استخدم اليد اليسرى للإمساك بعنق الماوس والتحكم في الذيل. اقلب الماوس واترك الرأس لأسفل والبطن لأعلى (الشكل 3 أ). إدارة الحقن داخل الصفاق من مرق النشا 6٪ ، 3 مل لكل فأر (الشكل 3 ب).
ملاحظة: بسبب الجاذبية ، ستسقط الأعضاء الموجودة في تجويف البطن للخلف إلى الصدر ، مما يمنع المحقنة من إصابة الأعضاء الأخرى. - بعد 72 ساعة ، قم بتخدير الفئران بنسبة 3٪ من الأيزوفلوران ثم التضحية بها عن طريق خلع عنق الرحم. تطهيرها بالكحول الإيثيلي بنسبة 75٪. استخدم مقص للعيون لفتح بطن الفأر لكشف الصفاق بالكامل (الشكل 4A-C).
- حقن 10 مل من وسط DMEM في الفئران لغسل تجويف البطن عن طريق الحقن داخل الصفاق (الشكل 4 د). بعد حقن DMEM في تجويف بطن الفئران ، افرك بطن الفئران برفق لمدة دقيقة واحدة تقريبا لغسل البطن بشكل أكثر شمولا. استخدم حقنة لتجميع سائل الغسيل في أنبوب طرد مركزي سعة 50 مل (الشكل 4E).
- قم بالطرد المركزي لسائل الغسيل عند 300 × جم لمدة 5 دقائق وتخلص من المادة الطافية.
- استخدم 10 مل DMEM مكملا بمصل بقري جنيني بنسبة 10٪ ، والبنسلين (100 وحدة / مل) ، والستربتومايسين (100 ميكروغرام / مل ؛ وسط كامل) لنفخ وشفط الخلايا المجمعة ، وعدها ، وتخفيف تركيز الخلايا إلى 2 × 106 / مل واللوح الخشبي على ألواح 6 آبار (انظر جدول المواد) ، 1 مل لكل بئر.
- ضع اللوحة المكونة من 6 آبار عند 37 درجة مئوية في 5٪ ثاني أكسيدالكربون 2 ، واحتضنها لمدة 4 ساعات ثم قم بإزالة المادة الطافية. اغسل الخلايا 2x باستخدام PBS المعقم وزراعته طوال الليل باستخدام 1 مل من DMEM لكل بئر عند 37 درجة مئوية في 5٪ CO2.
- اختر اثنين من الفئران Balb / c. استخدم اليد اليسرى للإمساك بعنق الماوس والتحكم في الذيل. اقلب الماوس واترك الرأس لأسفل والبطن لأعلى (الشكل 3 أ). إدارة الحقن داخل الصفاق من مرق النشا 6٪ ، 3 مل لكل فأر (الشكل 3 ب).
- تحضير البكتيريا داخل الخلايا
- احتضان البلاعم البريتونية (الخطوة 3.1.2) مع MRSA252 لمدة ساعتين. قم بإزالة المادة الطافية واغسل الخلايا 2x باستخدام PBS. أضف DMEM وسيطا كاملا مع 100 ميكروغرام / مل جنتاميسين (1 مل لكل بئر) واحتضانه لمدة ساعتين عند 37 درجة مئوية في 5٪ ثاني أكسيدالكربون 2.
- قم بإزالة المادة الطافية واغسل الخلايا 3x باستخدام PBS. استخدم مكشطة خلية لجمع البلاعم البريتونية للفأر في أنابيب الطرد المركزي سعة 50 مل ، وأجهزة الطرد المركزي عند 300 × جم لمدة 5 دقائق. تم تحضير البكتيريا داخل الخلايا MRSA252 بنجاح في البلاعم الصفاقية.
- لحساب البكتيريا داخل الخلايا ، إلى الضامة البريتونية المصابة MRSA252 داخل الخلايا ، أضف الليزوزيم (10 ميكروغرام / مل ، انظر جدول المواد) عند 37 درجة مئوية لمدة 10 دقائق ثم اغسلها باستخدام PBS 2x. ثم أضف 1 مل من PBS لإعادة تعليق الخلايا. قم بتحليل الخلايا عن طريق إضافة 0.1٪ Triton X-100 لمدة 5 دقائق.
- خفف التحلل بتخفيفات متسلسلة وقم بإسقاطه على لوحة TSA. استزراع بين عشية وضحاها عند 37 درجة مئوية. احسب البكتيريا داخل الخلايا MRSA252 في الضامة البريتونية ، والتي كانت 1.8 × 106 CFU لكل فأر ، عن طريق حساب المستعمرات البكتيرية.
ملاحظة: عندما تجمع مكشطة الخلية الخلايا ، يجب أن يكون الإجراء لطيفا. يتم كشط الخلايا في اتجاه واحد لتجنب كسر الخلايا ، مما قد يؤثر على التجربة اللاحقة.
- العدوى البكتيرية داخل الخلايا في الفئران
- قسم بشكل عشوائي 20 فأرا من Balb / c إلى أربع مجموعات (ن = 5 ، الشكل 5 أ).
- بالنسبة للمجموعة الأولى ، قم بحقن 3 × 106 CFU MRSA252 العوالق لكل فأر عن طريق الحقن في الوريد. بالنسبة للمجموعة الثانية ، قم بحقن 3 × 106 CFU MRSA252 العوالق والفانكومايسين (110 مجم / كجم ؛ انظر جدول المواد) لكل فأر عن طريق الحقن في الوريد. بالنسبة للمجموعة الثالثة ، قم بحقن البكتيريا داخل الخلايا (المحضرة في الخطوة 3.2) عن طريق الحقن في الوريد. بالنسبة للمجموعة الرابعة ، حقن البكتيريا داخل الخلايا (المحضرة في الخطوة 3.2) والفانكومايسين (110 مجم / كغ) لكل فأر عن طريق الحقن الوريدي.
- ضع الفئران تحت مصباح العلاج الطبيعي بالأشعة تحت الحمراء حتى تتمدد أوردة الذيل.
- حقن في الوريد 3 × 106 CFU MRSA252 العوالق لكل فأر من المجموعة الأولى والمجموعة الثانية. حقن البكتيريا داخل الخلايا عن طريق الوريد (المحضرة في الخطوة 3.2) لكل فأر من المجموعة الثالثة والمجموعة الرابعة.
ملاحظة: عند استخدام حقنة لتجميع السائل الذي يحتوي على بكتيريا داخل الخلايا، يوصى أولا بخلط السائل برفق بالتساوي باستخدام ماصة لضمان مستويات عدوى متسقة عبر جميع الفئران. - بعد 30 دقيقة ، قم بحقن الفانكومايسين عن طريق الوريد في المجموعة الثانية والمجموعة الرابعة لكل فأر.
- تقييم نموذج العدوى داخل الخلايا في الجسم الحي
- تقييم نموذج العدوى داخل الخلايا للفئران عن طريق حساب استعمار البكتيريا في الكلى. بعد 24 ساعة من الحقن ، قم بتخدير الفئران بنسبة 3٪ من الأيزوفلوران والتضحية بها عن طريق خلع عنق الرحم. تطهيرها بالكحول الإيثيلي بنسبة 75٪.
- شل حركة الفئران ، ورفع جلد البطن بالملاقط بيد واحدة ، وقطع جلد البطن للفأر بمقص العيون باليد الأخرى ، وابحث عن الكلى في تجويف البطن ، وقم بتجريد الكلى تماما. ضعهم في PBS.
- أضف 1 مل من PBS إلى أنبوب طحن الأنسجة. انقل الكلى من كل فأر إلى أنابيب طحن منفصلة وطحنها حتى لا تبقى أنسجة صلبة. صب الأنسجة المتجانسة في أنابيب EP فردية وقم بتسمية كل أنبوب بتحديد الفأر المقابل.
- استخدم PBS لتخفيف الأنسجة بشكل متسلسل. ضع كل تخفيف على ألواح TSA منفصلة واحتضنه طوال الليل عند 37 درجة مئوية. عد المستعمرات وحلل البيانات (الشكل 5 ب).
النتائج
تم إنشاء نماذج العدوى داخل الخلايا للمكورات العنقودية الذهبية بنجاح في كل من المختبر وفي الجسم الحي. من خلال تحسين الظروف التجريبية للبلعمة وإطالة تركيز ومدة العلاج بالمضادات الحيوية ، نجا بعض المكورات العنقودية الذهبية داخل البلاعم (الشكل 1). لمزيد من التقييم لمقاومة المضادات الحيوية للمكورات العنقودية الذهبية ، عولجت البلاعم المصابة ب MRSA252 بالمضادات الحيوية لمدة ساعتين حتى لم يعد الطافي الطافي للخلية يحتوي على المكورات العنقودية الذهبية ، بينما استمرت بعض البكتيريا داخل البلاعم (الشكل 2 أ). كشف مجهر المسح بالليزر متحد البؤر أن المضادات الحيوية لا يمكن أن تقتل المكورات العنقودية الذهبية داخل الخلايا (الشكل 2 ب). بالإضافة إلى ذلك ، أظهرت فحوصات الاستعمار البكتيري في الفئران أنه في حين أن الفانكومايسين يمكن أن يقضي على العوالق المكورات العوشدية الذهبية ، إلا أنه كان غير فعال ضد البكتيريا الموجودة داخل الخلايا (الشكل 5 ب). وهكذا ، تم إنشاء نموذج العدوى داخل الخلايا للمكورات العنقودية الذهبية بنجاح.
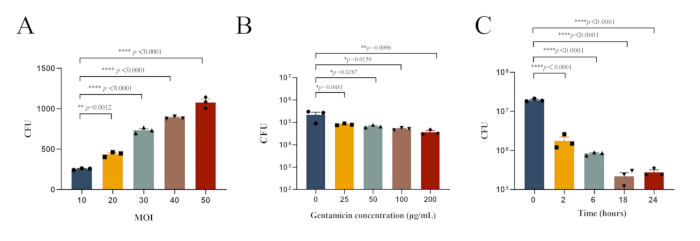
الشكل 1: الظروف التجريبية المثلى للعدوى داخل الخلايا MRSA252 في الضامة الصفاقية. (أ) الحمل البكتيري في البلاعم البريتونية المصابة ب MRSA252 بقيم مختلفة لوزارة الداخلية. (ب) الحمل البكتيري في البلاعم البريتونية المصابة ب MRSA252 والمعالجة بتركيزات متفاوتة من الجنتاميسين. (ج) الحمل الجرثومي في الضامة البريتونية المصابة ب MRSA252 بعد المعالجة ب 100 ميكروغرام / مل جنتاميسين لفترات مختلفة. يتم التعبير عن البيانات كمتوسط ± SEM (ن = 3) ، وتم استخدام ANOVA أحادي الاتجاه مع اختبار Dunnett اللاحق لتحديد الأهمية (**** ص < 0.0001 ، ** ص < 0.01 ، * ص <0.05). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
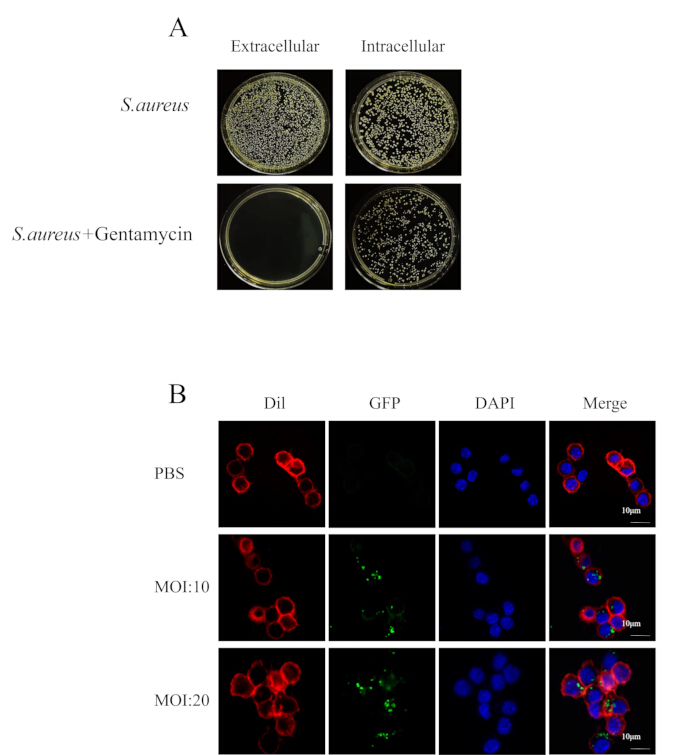
الشكل 2: المكورات العنقودية الذهبية داخل الخلايا تقاوم العلاج بالمضادات الحيوية. (أ) صورة لطلاء الصفيحة البكتيرية لتعليق الخلية والسيتوبلازم. (ب) أظهر الفحص المجهري متحد البؤر نمو البكتيريا في RAW264.7 (أحمر) مصابة ب MRSA252 (أخضر) عند 4 ساعات في وجود المضادات الحيوية (شريط المقياس = 10 ميكرومتر). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
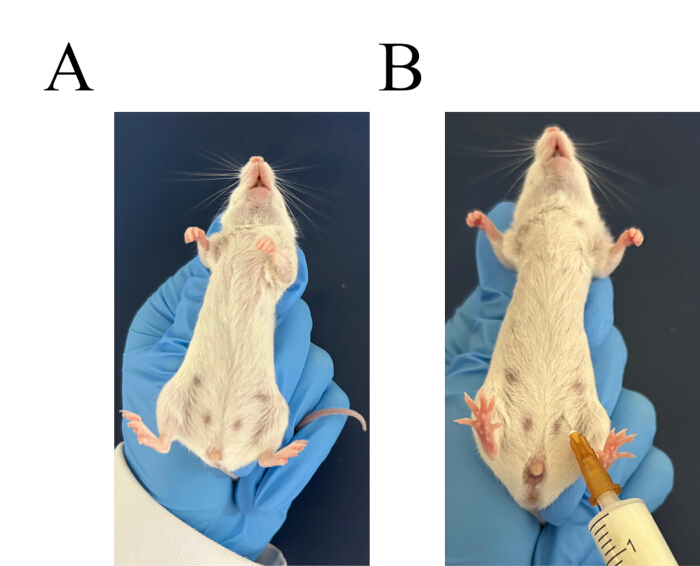
الشكل 3: إجراء الحقن داخل الصفاق. (أ) أمسك الفأر بإحكام. (ب) تحديد موقع الحقن للحقن داخل الصفاق. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: إجراء استخراج البلاعم البريتوني. (أ) قطع الجلد السطحي للبطن. (ب) إجراء فصل حاد للجلد. (ج) انفصال الجلد يكشف الصفاق. (د) غسل تجويف البطن. (ه) جمع تجويف البطن وغسله. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: العدوى داخل الخلايا ب MRSA252 مقاومة لقتل الفانكومايسين. (أ) ملخص رسومي يوضح التصميم التجريبي لإنشاء نماذج عدوى بالعوالق مقابل البكتيريا داخل الخلايا. تم رسم الملخص الرسومي بواسطة Figdraw. (ب) الأحمال البكتيرية في الكلى: تم الكشف عن الأحمال البكتيرية بعد يوم واحد من الإصابة. CFU ، وحدات تشكيل المستعمرة. فانكو يمثل فانكومايسين. تم التعبير عن البيانات كمتوسط ±SEM (ن = 5 عينات مستقلة بيولوجيا) ، وتم استخدام ANOVA أحادي الاتجاه مع اختبار Dunnett اللاحق لتحديد الأهمية (**** p < 0.0001 ، ns لا يمثل أي أهمية). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
المكورات العنقودية الذهبية ، كممرض اختياري داخل الخلايا ، يمكن أن تغزو وتعيش في أنواع مختلفة من الخلايا ، باستخدام هذه القدرة على التهرب من المضادات الحيوية والاستجابات المناعية أثناء الإصابة30. أنشأت هذه الدراسة نموذجا للعدوى داخل الخلايا للمكورات العنقودية الذهبية في الجسم الحي لتوفير أساس للتحقيق في آليات العدوى داخل الخلايا للممرض. من خلال استكشاف تأثير قيم وزارة الداخلية المختلفة على البلعمة الضامة من المكورات العنقودية الذهبية ، بالإضافة إلى فعالية تركيزات المضادات الحيوية المختلفة ومدد العلاج ، تم تحديد الظروف المثلى لإنشاء نموذج عدوى داخل الخلايا (الشكل 1).
عند إنشاء النموذج المختبري للعدوى داخل الخلايا المكورات العنقودية الذهبية ، اضبط المكورات العنقودية الذهبية في مرحلة النمو اللوغاريتمي إلى التركيز المطلوب وأضفها إلى لوحة زراعة الخلية. تأكد من أن الوسط لا يحتوي على مضادات حيوية ، لأن وجودها يمكن أن يعيق قدرة العامل الممرض على دخول الخلايا. بعد ساعتين من الإصابة ، تمت إضافة وسط يحتوي على تركيز 100 ميكروغرام / مل من الجنتاميسين لعلاج الخلايا المصابة. أظهرت تجارب استعمار الخلايا (الشكل 2 أ) أن الجنتاميسين قضى بشكل فعال على البكتيريا خارج الخلية بينما تم استيعاب البكتيريا المتبقية بواسطة الخلايا. أكد الفحص المجهري متحد البؤر أيضا أن هذا النهج سهل دخول البكتيريا إلى الخلايا ، مما أدى إلى إصابة داخل الخلايا (الشكل 2 ب).
في هذه الدراسة ، تم تحفيز الفئران بمرق النشا لإنتاج البلاعم البريتونية ، والتي تم استخراجها بعد ذلك وإصابتها MRSA252 في المختبر. تم حقن هذه البلاعم البريتونية المصابة لاحقا في الفئران. للتحكم ، تم حقن الفئران أيضا ب 3 × 106 CFU من MRSA252 العوالق. بعد هذه الحقن ، تم إعطاء علاج الفانكومايسين لجميع الفئران.
تم إعطاء فانكومايسين للفئران قبل 24 ساعة من تقييم مستويات البكتيريا ، مما يحدد إطارا زمنيا حرجا للعدوى البكتيرية داخل الخلايا. في الفئران التي عولجت بالعوالق MRSA252 ، قضى الفانكومايسين تقريبا على الحمل البكتيري في الكلى. ومع ذلك ، لا تزال مجموعة العدوى داخل الخلايا تظهر وجودا بكتيريا كبيرا على الرغم من تلقي جرعة تحدي أقل تبلغ 1.8 × 106 CFU مقارنة بمجموعة العوالق (الشكل 5 ب). وبالتالي ، نستنتج أن النموذج قد تم إنشاؤه بنجاح. بالمقارنة مع النماذجالأخرى 25 ، قمنا أولا بتحفيز البلاعم البريتونية للفأر للعدوى في المختبر ، مما أدى إلى زيادة تعافي هذه الخلايا.
باختصار ، يمكن ملاحظة الغزو البكتيري واستعمار الخلايا بشكل مباشر باستخدام MRSA252 المصممة ببروتين الفلورسنت الأخضر. يمكن أيضا استخدام السلالة لتقييم التفاعل بين المكورات العنقودية الذهبية والمضيف ، على سبيل المثال ، غزو وتصاق المكورات العنقودية الذهبية بالمضيف. بالإضافة إلى ذلك ، يستخدم النموذج ظروفا من العدوى داخل الخلايا في المختبر لتحسين وتحسين نموذج in vivo . ومع ذلك ، فإنه لا يستكشف بشكل كامل الاستعمار البكتيري في الأعضاء الأخرى بعد العدوى داخل الخلايا وقد لا يعكس تماما سيناريوهات العدوى السريرية. يمكن أن يؤدي التحقيق الأكثر تعمقا لأنماط العدوى داخل الخلايا إلى تحسين محاكاة النموذج للحالات السريرية.
يمكن ملاحظة الغزو البكتيري واستعمار الخلايا مباشرة باستخدام MRSA252 المصممة ببروتين الفلورسنت الأخضر. تسهل هذه السلالة أيضا تقييم التفاعلات بين المكورات العنقودية الذهبية والمضيف ، بما في ذلك عمليات الغزو والالتصاق. بالإضافة إلى ذلك ، يستفيد النموذج من الظروف من العدوى داخل الخلايا في المختبر لتحسين نموذج in vivo . ومع ذلك ، فإنه لا يرقى إلى مستوى الاستكشاف الكامل للاستعمار البكتيري في الأعضاء الأخرى بعد العدوى داخل الخلايا في هذا العمل وقد لا يمثل بدقة سيناريوهات العدوى السريرية. هناك حاجة إلى تحقيق أكثر تعمقا لأنماط العدوى داخل الخلايا لتعزيز محاكاة النموذج للحالات السريرية.
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم مصالح متنافسة.
Acknowledgements
تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (NSFC ، المنحة رقم 32300779 ، رقم 32270989) ، ومؤسسة العلوم الطبيعية في تشونغتشينغ (CSTB2022NSCQ-MSX0156) ، ومشروع أبحاث العلوم والتكنولوجيا التابع للجنة التعليم في تشونغتشينغ (KJQN202312802) ومؤسسة علوم ما بعد الدكتوراه الصينية (2024M754250).
Materials
| Name | Company | Catalog Number | Comments |
| 24-well plate | Corning Incorporated, USA | 3524 | |
| 4 % paraformaldehyde solutione | BBI, UK | E672002-0500 | |
| 6-well plate | Corning Incorporated, USA | 3516 | |
| Beef extract powder | BBI, UK | A600114-0500 | |
| Biohazard safety equipment | Heal force, China | VS-1300L-u | |
| Cell incubator | ESCO, Singapore | CCL-170B-8 | |
| Cell scraper | Nest | 710001 | |
| Centrifuge M1416R | RWD, China | M1416R | |
| Centrifuge tube | Guanghou Labselect, China | CT-002-50A | |
| Confocal laser scanning microscope (CLSM) | Zeiss, Germany | 880 | |
| Confocal petri dish | Biosharp, China | BS-20-GJM | |
| DAPI dye | Shanghai Beyotime, China | C1006 | |
| DIL working fluid | Shanghai Beyotime, China | C1991S | |
| Dulbecco’s Modified Eagle Medium | Thermo Gibco, USA | C11995500BT | |
| Fetal Bovine Serum | Hyclone | SV30208.02 | |
| Gentamycin | Shanghai Sangon, China | B540724-0010 | |
| Incubator | Shanghai Hengzi, China | HDPF-150 | |
| Lysozyme | Beijing Solarbio, China | L9070 | |
| MRSA252 | Third Military Medical University, China | null | |
| MRSA252(GPF) | Third Military Medical University, China | null | |
| Penicillin and Streptomycin | Shanghai Beyotime, China | C0222 | |
| Phosphate Buffer Solution | Shanghai Beyotime, China | ST476 | |
| Saline | Sichuan Kelun, China | null | |
| Sodium chloride | Shanghai Macklin, China | S805275 | |
| Starch soluble | Shanghai Sangon, China | A500904-0500 | |
| Triton X-100 | Shanghai Beyotime, China | P0096-100ml | |
| Tryptic Soy Agar (TSA) plates | Beijing AOBOX Biotechnology Co., LTD,China | 02-130 | |
| Tryptic Soy Broth (TSB) medium | Beijing AOBOX Biotechnology Co., LTD,China | 02-102K | |
| Tryptone | OXOID, UK | LP0042B | |
| Vancomycin | Shanghai Beyotime, China | ST2807-250mg | |
| RAW264.7 cell | USA, ATCC | null |
References
- Sutton, J. A. F., et al. Staphylococcus aureus cell wall structure and dynamics during host-pathogen interaction. PLoS Pathog. 17 (3), e1009468 (2021).
- Yang, H., et al. Lateral flow assay of methicillin-resistant Staphylococcus aureus using bacteriophage cellular wall-binding domain as recognition agent. Biosens Bioelectron. 182, 113189 (2021).
- Howden, B. P., et al. Staphylococcus aureus host interactions and adaptation. Nat Rev Microbiol. 21 (6), 380-395 (2023).
- Guo, H., et al. Biofilm and small colony variants-an update on Staphylococcus aureus strategies toward drug resistance. Int J Mol Sci. 23 (3), 1241 (2022).
- Huitema, L., et al. Intracellular escape strategies of Staphylococcus aureus in persistent cutaneous infections. Exp Dermatol. 30 (10), 1428-1439 (2021).
- Pidwill, G. R., et al. Clonal population expansion of Staphylococcus aureus occurs due to escape from a finite number of intraphagocyte niches. Sci Rep. 13 (1), 1188 (2023).
- Wang, M., et al. Autophagy in Staphylococcus aureus infection. Front Cell Infect Microbiol. 11, 750222 (2021).
- Arya, R., et al. Identification of an antivirulence agent targeting the master regulator of virulence genes in Staphylococcus aureus. Front Cell Infect Microbiol. 13, 1268044 (2023).
- Münzenmayer, L., et al. Influence of sae-regulated and agr-regulated factors on the escape of Staphylococcus aureus from human macrophages. Cell Microbiol. 18 (8), 1172-1183 (2016).
- Chin, D., et al. Staphylococcus lugdunensis uses the agr regulatory system to resist killing by host innate immune effectors. Infect Immun. 90 (10), e0009922 (2022).
- Podkowik, M., et al. Quorum-sensing agr system of Staphylococcus aureus primes gene expression for protection from lethal oxidative stress. Elife. 12, RP89098 (2024).
- Purves, J., et al. Air pollution induces Staphylococcus aureus usa300 respiratory tract colonization mediated by specific bacterial genetic responses involving the global virulence gene regulators agr and sae. Environ Microbiol. 24 (9), 4449-4465 (2022).
- Wittekind, M. A., et al. The novel protein scra acts through the saers two-component system to regulate virulence gene expression in Staphylococcus aureus. Mol Microbiol. 117 (5), 1196-1212 (2022).
- Pidwill, G. R., et al. The role of macrophages in Staphylococcus aureus infection. Front Immunol. 11, 620339 (2020).
- Lang, J. C., et al. A photoconvertible reporter system for bacterial metabolic activity reveals that Staphylococcus aureus enters a dormant-like state to persist within macrophages. mBio. 13 (5), e0231622 (2022).
- Li, M., et al. Interactions between macrophages and biofilm during Staphylococcus aureus-associated implant infection: Difficulties and solutions. J Innate Immun. 15 (1), 499-515 (2023).
- Sun, L., et al. Staphylococcal virulence factor hlgb targets the endoplasmic-reticulum-resident e3 ubiquitin ligase amfr to promote pneumonia. Nat Microbiol. 8 (1), 107-120 (2023).
- Mulcahy, M. E., et al. Manipulation of autophagy and apoptosis facilitates intracellular survival of Staphylococcus aureus in human neutrophils. Front Immunol. 11, 565545 (2020).
- Cai, J., et al. Staphylococcus aureus facilitates its survival in bovine macrophages by blocking autophagic flux. J Cell Mol Med. 24 (6), 3460-3468 (2020).
- Ahmad-Mansour, N., et al. Staphylococcus aureus toxins: An update on their pathogenic properties and potential treatments. Toxins. 13 (10), 677 (2021).
- Davis, J. S., et al. How I manage a patient with MRSA bacteremia. Clin Microbiol Infect. 28 (2), 190-194 (2022).
- Fait, A., et al. Staphylococcus aureus response and adaptation to vancomycin. Adv Microb Physiol. 85, 201-258 (2024).
- Kelly, J. J., et al. Measurement of accumulation of antibiotics to Staphylococcus aureus in phagosomes of live macrophages. Angew Chem Int Ed Engl. 63 (3), e202313870 (2024).
- Rowe, S. E., et al. Recalcitrant Staphylococcus aureus infections: Obstacles and solutions. Infect Immun. 89 (4), e00694-e00720 (2021).
- Lehar, S. M., et al. Novel antibody-antibiotic conjugate eliminates intracellular S. aureus. Nature. 527 (7578), 323-328 (2015).
- Peyrusson, F., et al. Intracellular Staphylococcus aureus persisters upon antibiotic exposure. Nat Commun. 11 (1), 2200 (2020).
- Pollitt, E. J. G., et al. Staphylococcus aureus infection dynamics. PLoS Pathog. 14 (6), e1007112 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. J Vis Exp. 11 (63), e3064 (2012).
- Qin, L., et al. Antibody-antibiotic conjugate targeted therapy for orthopedic implant-associated intracellular S. aureus infections. J Adv Res. 65, 239-255 (2024).
- Andie, S. L., et al. Methicillin-resistant Staphylococcus aureus. Nat Rev Dis Primers. 31 (4), 18034 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved