Method Article
脳卒中後の認知リハビリテーションのための経頭蓋直流刺激の無作為化、三重盲検、および並行対照試験
* これらの著者は同等に貢献しました
要約
この研究は、脳卒中後の半空間無視に対処するための認知刺激と組み合わせた新しい経頭蓋直流刺激(tDCS)プロトコルを提示します。パイロット患者からの初期データにより、手技の実現可能性が確保され、潜在的な有効性が示唆され、将来の並行三重盲検対照臨床試験の基盤となります。
要約
右半球の脳卒中は、回復プロセスを著しく妨げる可能性のある障害状態である半空間無視を頻繁にもたらします。ネグレクトの慢性的な存在は、認知領域と運動領域の両方で転帰不良と関連しています。従来の神経心理学的介入の補助として、低強度の電流によって神経興奮性を調節する非侵襲的技術である経頭蓋直流刺激(tDCS)は、皮質の可塑性を高め、罹患者の機能改善をサポートする可能性が注目されています。
この研究では、脳卒中後の半空間無視の症状を軽減することを目的とした複合介入プロトコルを提案します。これは、半空間無視のリハビリテーションのために特別に設計されたコンピューター化された神経心理学的リハビリテーションプログラムと組み合わせた陰極tDCSプロトコルで構成されています。
ニューロモデュレーション戦略は、半球間対立モデルに基づいて、損傷を受けていない半球の過活性化を減らすことです。介入は、2 週間、10 セッション (月曜日から金曜日まで)、それぞれ 45 分間の tDCS と従来の認知刺激が同時に適用されることで構成されます。tDCSは、8チャンネルの高精細tDCS(HD-tDCS)デバイスによって20分間、2mAの強度で適用されます。陰極は左後頭頂皮質上に配置され (脳波 [EEG] 電極配置のための 10/20 システムに続く P3)、戻り電極は C3、CP5、CP1、Pz、PO3、PO7、および P7 に配置されます。神経心理学的および機能的評価は、ベースライン時および介入終了後に実施されました。
本研究の主な目的は、並行無作為化三重盲検実験デザインのプロトコルを説明することです。プロトコルの実現可能性とその潜在的な有効性を確保するために、単一のパイロット参加者に適用される手順の包括的な説明が提供されます。
tDCS神経調節戦略を認知リハビリテーションプロセスに組み込むと、介入時間が短縮され、患者の機能状態と生活の質が向上する可能性があります。
概要
脳卒中は、成人の世界で最も多い障害の原因であり、虚血性心疾患に次いで2番目の死因です1。脳卒中を生き延びたほとんどの患者は、非常に不均一な臨床状態とさまざまな程度の障害を発症します。脳卒中患者の55%から75%は、損傷後6か月後も持続する運動制限を持っています2。身体的な影響に加えて、認知の変化は非常に頻繁です3。これらの欠損は、日常生活動作のパフォーマンスに悪影響を及ぼし、患者や親戚の機能的自立と生活の質を制限します4,5。半空間無視は、脳卒中後の最も一般的な注意障害の1つであり、症例の約25%から50%で発生し、6,7,8、右半球脳卒中9,10の個人では80%にも上昇します。
半空間の無視は、この不注意、同種中心(空間の左半分に位置する物体を省略する)または自己中心的(患者が自分の体の左部分に注意を払わない)であるため、負傷した領域への反対側の半球に注意を向けることの困難さを意味します。機能的には、ネグレクトは、基本的な活動(例えば、身だしなみ、衣服、食事など)と日常生活の道具的活動(例えば、お金の管理、公共交通機関、または自立した歩行)の両方で、患者の自立に深刻な困難を引き起こします。さらに、この変化の存在は、入院およびリハビリテーション期間の延長、転倒のリスクの増加、運動回復不良、および退院後の帰宅確率の低下と関連しています11,12。
半空間の無視を治療するために、いくつかの戦略が実施されています。従来のリハビリテーションアプローチでは、トップダウンアプローチとボトムアップアプローチを区別することができます。それらの主な違いは、タスクへの人の積極的な参加と認識のレベルです。これらのアプローチの中で、これまでで最も広く使用されている手順は、それぞれビジュアルスキャントレーニングとプリズム適応でした13。中心的な場所、視運動、カロリー、および前庭の刺激、首の振動、および薬理学的治療を広く使用した半空間無視におけるその他のリハビリテーション技術13,14,15,16。しかし、これらの治療法にはいくつかの制限がある:その結果の期間は非常に限られており、急性期または亜急性期における患者の重症度が実施される活動における彼らの協力を妨げるため、急性期または亜急性期における適用性が低い17。
経頭蓋直流刺激法 (tDCS) は、皮質活動を変化させる脳に微弱な電流を誘導することにより皮質活動を変化させることができる非侵襲的で安全な神経調節技術であり、半空間無視の神経心理学的リハビリテーションを補完するために使用できます。tDCSは、他の脳領域からの入力に応答して自発的なニューロンの活性化を調節します。さらに、tDCSは、長期増強(LTP)または長期抑制(LTD)に類似し、さらには刺激18の持続時間を超えて持続する可塑性シナプス変化を誘発する。
tDCSにより、アノードからカソードに流れる非常に低強度の電流を印加することにより、皮質活動を調節することができます。tDCSは、活動電位の閾値に影響を与え、それを増加または減少させることによって脳活動を調節するが、活動電位18を引き起こすことはない。一般に、アノードはそれが位置する脳領域の興奮性の増加を誘発し、一方、カソードは皮質阻害を誘導する。この手法には高い空間分解能はありませんが、マルチサイトまたは高解像度(HD-tDCS)と呼ばれる新しいtDCSデバイスの登場により、この制限は克服されています。これらのデバイスは、特定の脳領域の皮質興奮性を増減するために、アノードの周りに陰極リングを形成する(またはその逆)など、さまざまな電極構成を可能にします。カソードリングはリターン電極と同様に作用し、刺激領域を制限します。このようにして、より焦点の合った刺激が達成されます。tDCSは、脳卒中19後の運動回復の治療アプローチとして有効であることが証明されており、半空間無視20のリハビリテーションに有望な結果をもたらすいくつかの科学文献があります。
半空間無視の最も受け入れられている仮説は、1977年にキンズボーンによって提案された半球の競争モデルに基づいて説明できると主張しています21,22。このアプローチによれば、基底状態では、両方の半球が常に相互に阻害しています。半空間の無視は、それらの間の不均衡によって引き起こされます。損傷後、損傷した半球は、保存された半球の活動を効果的に阻害することができません。これは、損傷した半球によって発揮される抑制の欠如により、健康な半球の病理学的活動亢進をもたらし、それは、それに対して及ぼされる抑制の増加のために、影響を受けた半球の神経活動をさらに減少させる23。したがって、半空間無視の根底にある機能不全は、損傷した半球の活動低下と無傷の半球の活動亢進の両方によって引き起こされる24。
このモデルを理論的背景として、半空間無視症状の改善を目的としたさまざまな非侵襲的脳刺激戦略が提案されています。これらの戦略は、健康な半球の活動亢進を減らすため、負傷した半球の活動を増やす、または両方の組み合わせに対処するために対処されています25,26。
いくつかの研究は、損傷したまたは損傷していない半球にそれぞれ陽極17,27,28,29と陰極17,29 tDCSを適用することにより、または両方の28,30,31,32の組み合わせを適用することにより、半空間無視の症状を軽減するtDCSの可能性を示しています.有望な結果にもかかわらず、最適な結果を得るためには、tDCSの正確なパラメータを知るためには、より多くの経験的証拠が必要であり、これは、焦点tDCSが従来のtDCSモンタージュよりも効果的であるかどうかを知るために不可欠です。私たちの知る限り、これまでの研究はすべて従来のtDCSを使用して開発されており、本研究は半空間無視リハビリテーションにHD-tDCSを使用した最初の研究です。
非侵襲的脳刺激療法に基づく介入は、最新の結果と、さまざまなメタアナリシスおよびレビュー33,34,35,36,37による限定的な副作用を考慮すると、非常に有望な臨床アプローチを構成する。さらに、tDCSは安全性が高く、移植性が高く、低コストの技術であるため、臨床および研究環境での優先事項としての使用が増えています。また、組み立てが簡単で持ち運びが容易なため、身体活動、認知リハビリテーション、機能的活動など、他の活動のパフォーマンスと同時にデバイスを使用できます。したがって、従来の介入アプローチの効果を高めるtDCSプロトコルを検証するには、より大きなサンプルサイズを使用した、より制御された盲検化された無作為化研究が必要です。
プロトコル
このプロジェクトは、12 de Octubre Hospitalの臨床研究倫理委員会(ref. Nº CEIm: 19/180)によって承認され、www.clinicaltrials.gov(ID:NCT04458974)に登録されています。研究者は、臨床研究とデータ保護に関する確立された現行の法律をすべて尊重することに同意します(WMA Declaration of Helsinki, 2004;個人データ保護に関する規則(EU)2016/679および基本法3/2018。患者の自律性に関する法律41/2002)。個人データ保護に関する規則(EU)2016/679に従い、参加者から収集されたデータは厳重に扱われます。tDCSプロトコルは、tDCS38の国際安全ガイドラインに準拠しています。
注: 本研究の主な目的は、並行無作為化三重盲検臨床試験の tDCS 介入プロトコルを説明することです。これを達成するために、手順の包括的な説明が提供され、パイロット参加者の申請の結果がこのホワイト ペーパーで示されています。介入プロトコルは、陰極 tDCS (20 分、2 mA) と、半空間無視を改善するように設計されたコンピューター化された神経心理学的リハビリテーション プログラムを組み合わせた 10 セッションのプログラムで構成されています。神経心理学的および機能的評価は、ベースライン時および介入終了後に実施されます。 図1 は、プロトコルのタイムラインを示しています。この図は、ベースライン評価、介入の詳細な説明、および研究の介入後の評価を示しています。患者の参加は、研究の目的について知らされ、書面によるインフォームドコンセントフォームに署名した後、自発的でした。参加者はいつでも研究から撤退することができます。この研究の参加者は、 表 1 に概説されているすべての包含基準と除外基準を満たしています。

図1:プロトコルのタイムライン。 研究のすべての段階が説明されています: ベースライン評価、介入の詳細な説明、および介入後の評価。 この図の拡大版を表示するには、ここをクリックしてください。
1. 包含基準と除外基準
- この研究のパイロット参加者が、次の包含および除外基準を満たしていることを確認します (表 1)。
| 包含基準: |
| 右半球の出血性または虚血性脳卒中 |
| 脳卒中発生から3ヶ月以上12ヶ月後(リハビリの有無に関わらず) |
| 18歳から89歳まで |
| ニューロイメージング研究 |
| 以前のストロークがない |
| 患者が 1 時間座って活動したままでいられる機能的能力 (椅子とベッドの間の移動の項目でバーセル指数スコアが 5 を超える、この項目は 0 から 15 まで採点でき、 0 は完全依存 、15 は完全独立)。 |
| 右利きの手動優位 |
| -視空間的無視の評価のために実施されたテストの少なくとも2つでネグレクトスコア |
| 患者またはその法定後見人によるインフォームドコンセントの署名 |
| 除外基準: |
| 皮膚科の問題(乾癬、頭皮や顔面の皮膚炎) |
| 詰め物を除く頭部にインプラントまたは金属部品が存在する。 |
| ペースメーカー、投薬ポンプ、刺激装置(迷走神経、脳、経皮)、心室腹膜シャント、または動脈瘤クリップ。 |
| 以前のストロークの存在 |
| -選択基準に記載されている脳卒中以外の神経疾患 |
| -Mini-mental state examination(MMSE)(Folstein、1975)を使用して評価された重度の認知障害、スコアが24未満の患者を除く(MMSEのスコアは0〜30で、重度の認知障害は0、認知障害は30です) |
| 活動の適切な理解を許さない、または表現を著しく制限する重大な言語障害 |
| アルコールまたは薬物乱用の病歴 |
| 中等度または重度の活動性うつ病 |
| 制御不能な医学的問題(有効性が証明された医学的または薬理学的治療を受けていない急性期の病状、または生命の危険が差し迫った病状) |
| -妊娠または妊娠の疑いがあり、研究の開始時に妊娠検査によってチェックされます 出産可能年齢の患者で、介入が終了するまで避妊方法の使用が推奨されます |
表1:包含基準と除外基準。この研究のパイロット参加者は、この表に記載されているすべての包含および除外基準を満たしています。
2. 素材
注:研究のすべてのフェーズで使用されるすべての材料は、細心の注意を払って説明されています。
- tDCSデバイスキット
- tDCSのアプリケーションには、8チャンネルのHD-tDCSデバイスとその推奨電極を使用します ( 図2を参照)。組み立てを容易にするために、ネオプレンキャップの目的の場所(10/20 EEGシステムに続いて)にプラスチックベースを置きます。配置したら、導電性ゲルを塗布し、続いて電極を組み立てます。
- コンピュータ化されたニューロリハビリテーションプラットフォーム
注:認知刺激を実施するために、オンラインのコンピューター化された神経リハビリテーションプラットフォームが使用されます( 図3を参照)。このプラットフォームでは、介入プログラムのすべてのセッションの設計と適用が可能になり、タスクの難易度を個別に調整できます。- ユーザー管理をクリックして新しいユーザーを追加し、患者ごとに新しいユーザーを作成します。学習コードを使用して名前を付け、認知プログラムを個別にパーソナライズします。
- タスクを設計するには、ワークエリア/セッション/デジタルセッションにアクセスし、セッションが行われる日付をクリックします。
- セッションの名前 (例: session 1) を挿入します。そのセッションのアイコンと色を選択し、[ 作成 ] ボタンをクリックします。
- プログラムに含めるアクティビティをクリックします。
- 各セッションのタスクが画面の左側に表示されていることを確認します。
- それぞれで、次のパラメータをプログラムします:時間(7分)と最後の結果から開始します(セッション3〜10でのみYESを示します)。
- 保存するように指定します。
- 認知刺激プログラムの 10 回のセッションのそれぞれの設計について、手順 2.2.3 から 2.2.7 を繰り返します。

(1)ネオプレンキャップ、(2)tDCSデバイス、(3)電極、(4)ケーブル、(5)イヤークリップ、(6)導電性ゲル。(7)電極の下に導電性ゲルを投与するためのシリンジ。この図の拡大版を表示するには、ここをクリックしてください。

図3:ニューロリハビリテーションプラットフォームのセッションスケジューリング。 各セッションをクリックすると、各タスクの期間やセッションの合計期間など、タスクが表示されます。 この図の拡大版を表示するには、ここをクリックしてください。
3.評価プロトコルの説明:介入前の神経心理学的および機能的評価:
注: 参加者がインフォームド コンセントに署名すると、神経心理学的および機能的評価が行われます。評価は、刺激プログラムの開始前の金曜日に行われ、50分間続きます。このセッションでは、一般的な認知能力が評価され、注意プロセスと半空間無視の評価に焦点を当てた神経心理学的テストが、機能スケールとともに実施されます。最初の評価に先立つ説明会では、参加者には、研究の目的、手順、セッション期間、および潜在的な副作用に関する必要なすべての詳細が提供されます。評価と介入を進める前に、署名された同意が得られます。また、参加者には、いつでも研究から撤退するオプションが通知されます。
- ミニメンタルステートテスト(MMSE)の投与(5分)
注:シンプルな構造化スケール。最大30ポイントを獲得し、アイテムは、オリエンテーション、即時記憶、注意と計算、遅延記憶、言語、および構成を評価する5つのセクションにグループ化されています。スコアの範囲は0〜30ポイントで、カットオフポイントは24です。24未満のスコアは認知障害を示しています。- 参加者にテストを説明し、参加者にテストの指示に従ってもらいます。合計スコアが≥24ポイントになっていることを確認して続行します。
- ライン二分試験の実施 (5分)
注:A4サイズの用紙に18行が入っており、用紙の左側に1セット、中央に1セット、用紙右側に1セットずつ、合計6行ずつの3セットにまとめられています。患者さんには、各線の中心点をマークしていただくようお願いいたします。ラインの真の中心からの患者のマークの偏差は、各ラインで測定され、18ラインで平均化されます。- タスクを参加者の中央に配置し、シート上に参加者の右側と左側を示します。参加者にテストを説明し、参加者にテストの指示に従ってもらいます。
- ベルテストの実施 (5分)
注:気を散らすものの存在下での水平方向のビジュアルスキャンを評価することを目的とした機器。この課題は、半ランダムに配置されたベル型の人物を特定することでした。これらは7つの垂直列に表示され、それぞれに5つの鐘が含まれていました。シート上の配置については、左側に3列、中央に1列、右側に3列が表示されました。- タスクを参加者の中央に配置し、シート上に参加者の右側と左側を示します。参加者にテストを説明し、参加者にテストの指示に従ってもらいます。
- バルセロナテスト実施による絵描きサブテスト(5分)
注:円、正方形、三角形、十字、立方体、家の6つの図のコピーで構成されています。実行時間は制御されます。各数値は次のように採点されます:完全な再現に3ポイント、離散的な変更に2ポイント、中程度の変更に1ポイント、重大な変更に0ポイント。最大スコアは18です。実行に費やした時間に応じて、3ポイント、2ポイント、または1ポイントが与えられます。- タスクの中央にタスクを配置し、表示される画像を指します。参加者にテストを説明し、参加者にテストの指示に従ってもらいます。
- バルセロナテスト管理からのキャンセルサブテスト(5分)
- タスクを参加者の中央に配置し、シート上に参加者の右側と左側を示します。参加者にテストを説明し、参加者にテストの指示に従ってもらいます。
- 数字の前後管理(5分)。
- 参加者にテストを説明し、参加者にテストの指示に従ってもらいます。
- 最初に直接数字のタスクを管理します。次に、逆数字のタスクを管理します。
- 注意力(BTA)投与の簡単なテスト(5分)
- タスクの最初の部分を口頭で管理します(シーケンスに表示される番号を数えます)。直後に、テストの2番目の部分を適用します(シーケンスに表示される文字を数えます)
- 音符の使用や指での数え方は許可しないでください。
- フェイステストの実施 (5分)
- 顔テストシートを提示します。参加者にテストを説明し、参加者にテストの指示に従ってもらいます。
- ストップウォッチをアクティブにして、3分後にタスクを完了します。正しくマークされた刺激の数を数えます。
- モーターフリー視覚検査(MVPT-4)投与(15分)
注:36要素の多肢選択式テストは、視覚空間無視の5つのサブディメンション(視覚識別、図下部識別、空間関係、視覚閉鎖、および視覚記憶)を評価します。左反応の行動(左/右反応行動、グロススコア、左/右パフォーマンス、視覚処理時間)を定量化するために、さまざまなパラメータが使用されます。左側応答のスコアの範囲は 0 から 21 で、値が低いほど視空間無視が深刻であることを示します。- 宿題ノートを患者の前に置きます。参加者にテストを説明し、参加者にテストの指示に従ってもらいます。
- 機能スケール
注:患者の機能状態とネグレクトが日常生活動作に与える影響を知るために、患者と家族/介護者のインタビューを実施します。- バーセル指数(5分)スケールを家族または主な介護者に投与し、回答を解答用紙に記録します。
注:バーセル指数は、人が日常生活の10の基本的な活動を行う能力を測定し、その独立性の程度を定量的に推定します。 - キャサリン・ベルゲゴ・スケール(CBS)(5分)を家族または主介護者に投与し、回答を解答用紙に記録します。
注: このアンケートは、グルーミング、着替え、車椅子の使用などのタスクを含む、臨床的にシミュレートされた 10 の実際の状況での患者のパフォーマンスの直接観察に依存しています。患者の評価は、家族/主介護者の評価と比較されます。このアンケートのスコアは 0 から 30 で、スコアが高いほど視空間無視の重症度が高いことを反映しています。.
- バーセル指数(5分)スケールを家族または主な介護者に投与し、回答を解答用紙に記録します。
4. 介入プロトコルの説明
- 介入デバイスの構成
注:ソフトウェアでHD-tDCS刺激のパラメータを設定します。介入を開始する数日前に、デバイスは、介入に適用されるパラメーター、つまり、持続時間、強度、極性、状態(アクティブ対偽)、モンタージュ、電極の種類、刺激部位、戻された電極の位置、および各電極への電気的復帰の割合でプログラムする必要があります(ポイント5を参照)。デバイスにセッション全体を完了するのに十分なバッテリーがあることを確認します。- ソフトウェアを開き、[ プロトコル エディター] を選択して、新しいプロトコルを追加します。
- プロトコルの名前を入力します。スロープの持続時間を設定します:ステップ:(左)。
- ランプと合計刺激時間を確認します。ランプアップ:30、ランプダウン:30を示します。
- 合計刺激時間セクションで、20分を示します。刺激と電極の設定を設定します:デザイン(右)。
- カソードの刺激の極性を設定します。各電極を個別にセットアップします。まず、アクティブ電極P3から始めます。
- 電極P3を選択し、右側のボックスにドラッグします。刺激と陰極を選択します。2000 μAを選択します。
- 選択して左にドラッグし、残りの電極を1つずつ間隔を空けます。これらの場合、それらはすべてリターン電極であり、同じアクションを実行し、各電極のリターンの割合を示します。
注:リターン率の合計が100になる必要があることに注意することが重要です。この研究では、リターン率はCP1、PO3、PO7、P7、CP5、C3:10%、PZ:40%でした( 図4 および 図5を参照)。このモンタージュは、病変の反対側にある半球の後頭頂葉皮質の病理学的過活性化を減らすように設計されています。 - すべての手順が完了したら、[ 完了 ]ボタンをクリックします。
- 患者の介入前評価
- 一般的な状態評価。
- 各tDCSセッションの前後に、次の質問をして全身状態を評価します:体調は大丈夫ですか?頭痛がしますか?首が痛いですか?昨日か今日、お酒を飲みましたか?昨日、それとも今日、薬物を使用しましたか?過去5時間にコーヒー、紅茶、チョコレートを飲みましたか?昨日の夜はぐっすり眠れましたか?最後に数時間で食事をしたのはいつですか?
- 倦怠感と気分のビジュアルアナログスケール(VAS)を評価します。
- 2つの自己管理型VASを使用して、精神的疲労と気分のレベルを評価します。これらの質問に対して、参加者に1から10までのスコアを提供してもらい、質問に対する彼らの気持ちを参考にしてもらいます:今、どれくらい疲れていますか、1はまったく疲れていないこと、10はとても疲れていること、1はとても悲しいこと、10はとても幸せです。
- 一般的な状態評価。
- 高解像度tDCSモンタージュ
- tDCSデバイスの組み立てを開始する前に、必要なすべての材料が利用可能であること、およびtDCSデバイスに刺激セッションを実行するのに十分なバッテリーがあることを確認してください。
- 電極配置のプラスチック下部
- ネオプレンキャップで次の位置を選択します:アクティブカソード電極をP3に配置します。リターン電極をC3、CP5、CP1、Pz、PO3、PO7、およびP7に配置します( 図5 および 図6を参照)。
- 電極の下部をキャップの選択した各領域に配置します。参加者の頭にキャップをかぶせ、以前に行った測定値に基づいてCzを調整します。
- tDCSネオプレンキャップの配置
- 参加者を椅子に座りやすい位置に座らせます。
- ネオプレンキャップをかぶって( 図6を参照)、被験者の頭に最もフィットするサイズを選択します。大きなキャップは頭にきつくなければならないため、選択しないでください。ヘッドバンドでキャップを頭にぴったりとフィットするまで調整します。
- プロトコルのCzポイントと刺激ゾーンを見つけます。
- メーターを使用して、鼻と内イオンの間、および耳介前点間の距離を測定します。Cz ポイントを両方の位置の中点に配置します。
- 導電性ゲルの配置
- 電極の下にある髪の毛を刺激の場所から分離します。電極と皮膚との良好な接触を確保します。電極の内側から髪の毛を取り除くことができる細長い物体を使用する キャップの配置を変更することなく、以前に測定されています。
- 頭皮が乾燥し、他の追加の準備がされていないことを確認してください。ヘアピンまたはその他の金属要素(ヘッドバンド、バレッタなど)を取り外します。
- tDCSで摩耗を引き起こす可能性があるため、アルコールで皮膚を洗浄しないでください。
- 最終的なプラスチックチップを備えたシリンジを使用して、各電極の基部に十分な量の導電性ゲルを導入します。
注意:導電性ゲルのみを使用できます。このタイプの電極には、摩耗の原因となる可能性があるため、水や生理食塩水を使用しないでください。 - シリンジのプラスチック製の先端を使って、できるだけ多くの髪の毛を取り除きます。
- インピーダンスチェック
注意: インピーダンスチェック ボタンは、刺激の前にすべてのアクティブチャネルとリターンチャネルのインピーダンスを測定します。刺激プロトコルを開始する前に使用する必要があります。インピーダンスレベルは、各スティミュレーションチャネルアイコンの下に色分けされたバーとして表示され、緑は許容値を示します。スティミュレーションプログラムは、すべてのチャンネルが緑色になったときにのみ開始できます。刺激中、インピーダンスは毎秒監視され、電極が20kWを超えると、プロトコルは自動的に中断されます。- デバイスの電源を入れます。コンピュータでtDCSデバイスソフトウェアを開きます。
- デバイスで使用する接続を選択します。デバイスのスキャンオプションを選択します。
- [インピーダンスの確認] を選択します。
- すべての電極が緑色で表示されている場合は、 再生 ボタンを押すと、刺激プログラムが開始されます。
- インピーダンスチェックの完了後、いずれかの電極が赤く表示される場合は、その電極にゲルを再度塗布し、髪の毛を取り除き、すべての電極が緑色のままになるまでインピーダンスを再確認してください。
- コンピュータ化されたニューロリハビリテーションプラットフォーム
注: ニューロリハビリテーション プラットフォームで 10 回の介入セッションを事前に設計し、そのためのプラットフォームを準備します (ポイント 2.2 を参照)。各セッションは4つのタスクで構成され、各タスクは7分間続きます。各セッションに含まれるタスクを 表 2 に示します。各セッションをスケジュールするときは、各タスクのパラメータから選択する必要があります:各タスクの期間:7分、セッションの合計時間(28分)、言語、各アクティビティ後のユーザー評価を含める、各タスクの終了時に各アクティビティの終了の確認を含める、および各タスクに連続ボタンがない、 タスクは次々に実行する必要があるためです(図7)。- コンピュータ化されたニューロリハビリテーションプラットフォームにアクセスします。
- 以前に計画したセッションにアクセスし(手順2.2を参照)、スタートボタンを押します。それぞれ7分間の4つの異なる刺激活動を順番に提示します。
注: 認知刺激セッションの合計時間は 30 分です。合計シミュレーション時間 (30 分) が経過すると、アクティビティは停止します。認知刺激は、tDCS刺激の終了後、さらに5分間続きます。
- tDCS刺激プログラム(20分)
- コンピュータ化されたニューロリハビリテーションタスクの開始から4分20秒後にtDCS制御ソフトウェアの 再生 ボタンを押すことにより、tDCS刺激の開始をアクティブにします。
- 30秒の上昇ランプの後、アクティブスティミュレーションまたはシャムが始まります。tDCS刺激(20分)をコンピューター化されたニューロリハビリテーションタスクに同時に加えます。20分後、下降ランプが始まり、30秒間続きます。この時間の後、tDCSの刺激は停止します。
- 患者の介入後の評価。
- 副作用アンケート。
- 経頭蓋電気刺激に関連する感覚のアンケート39 (表3)の適応を適用し、頭痛、頭皮の灼熱感、電極の下のかゆみやうずきなどのさまざまな症状の存在に関する9つの質問を適用します。
- 各項目で、症状の重症度を1〜4のスケールで評価し、tDCSとの関係を1〜5のスケールで評価します( 表3を参照)。
- 疲労と気分のためのビジュアルアナログスケール
- 刺激セッションの前に使用したのと同じスケールを投与して、介入後の疲労と気分を評価します (ステップ 4.2.2 を参照)。
- 副作用アンケート。
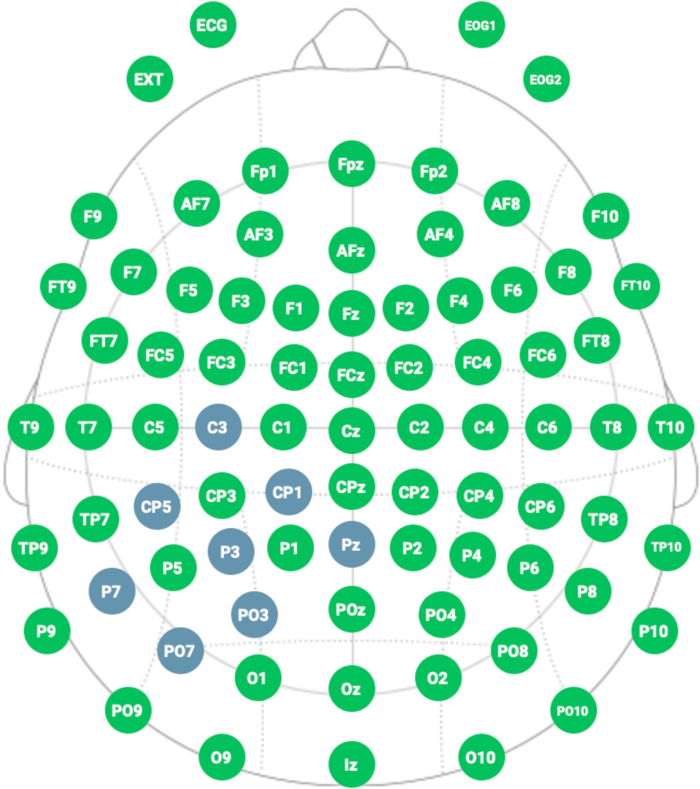
図4:代表的なHD-tDCSモンタージュ。 青色は、電極配置のための国際10-20システムに準拠した電極の位置を示しています。 この図の拡大版を表示するには、ここをクリックしてください。

図5:適用されたHD-tDCSの計算モデル。 電流の分布は中心(アクティブ)電極(P3)に集中し、リターン電極(C3、CP5、CP1、Pz、PO3、PO7、P7)によって特定の領域に刺激を制限します。 この図の拡大版を表示するには、ここをクリックしてください。

図6:HD-tDCS刺激用のネオプレンキャップ。 キャップには、EEGの10/20分類システムに従って電極を配置するための穴があります。 この図の拡大版を表示するには、ここをクリックしてください。
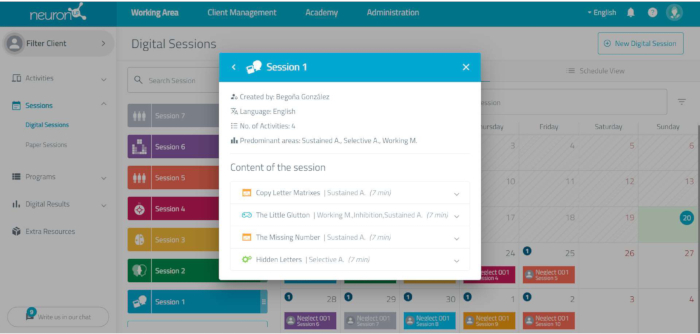
図 7: タスクのスケジュール設定。 コンピュータ化されたニューロリハビリテーションプラットフォームで各タスクをプログラミングする際に選択するパラメータ。 この図の拡大版を表示するには、ここをクリックしてください。
| ブロック | セッション | ニューロリハビリテーションプラットフォームタスク | 期間 |
| 私 | 1、3、6、および 8 | · 隠し文字 | 各タスクは7分。 |
| · 数字の合計 | |||
| · レタースープ | |||
| · 一致する図形を検索する | |||
| II. | 2、4、7、および 9 | · レターマトリックスのコピー | |
| · 小さなクズリ | |||
| · 不足している番号を見つける | |||
| · テキストの比較 | |||
| III. | 5 と 10 | · テキストの比較 | |
| · 数字の合計 | |||
| · 小さな食いしん坊 | |||
| · 連続した刺激の検索 |
表 2: 10 回の介入セッションのそれぞれに含まれるタスク。 すべてのタスクは、コンピューター化されたニューロリハビリテーションプラットフォームに含まれています。
| こんな感じや症状はありませんか? | 深刻度の等級付け (1–4) | 存在する場合:tDCSとの関係? |
| 1-欠席 | 1-なし | |
| 2マイルド | 2-リモート | |
| 3-モデレート | 3-可能 | |
| 4-重度 | 4-可能性 | |
| 5-決定的 | ||
| 頭痛 | ||
| 首や頸部の痛み | ||
| 頭皮の痛み | ||
| 頭皮の火傷 | ||
| 電極の下の感覚(うずき、かゆみ、灼熱感、痛み) | ||
| 肌の赤み | ||
| 痺れ | ||
| 集中力の問題 | ||
| シャープな気分のむら | ||
| その他(具体的に) | ||
| その他のコメント | ||
表3:tDCS副作用アンケート。刺激の適用後に現れる可能性のある副作用のリストが提供されます。これらの各効果の有無は、刺激の適用直後に記録されます。経頭蓋電気刺激に関連する感覚のアンケートの適応39.
5. tDCSの取り外し
- tDCS刺激プログラムとコンピューター化されたニューロリハビリテーションタスクが終了したら、tDCSソフトウェアを閉じます。
- tDCSデバイスを切断します。
- tDCSと電極を接続しているケーブルを取り外します。
- 患者の頭からキャップを外します。
- ネオプレンキャップから電極を取り外します。
- 患者の髪をきれいにします。
- ネオプレンキャップを取り外した後、紙/タオルを使用して残りのジェルを取り除き、水で洗います。
- tDCSネオプレンキャップと電極を清掃します。
- 各セッションの後、キャップを水で洗って残りのゲルを取り除き、乾かします。
- 電極を水で洗い、こすらないようにし、乾いた布でやさしく乾かします。電極の洗浄に石鹸、アルコール、またはその他の製品を使用しないでください。
6.介入後の神経心理学的および機能的評価
- 月曜日に、介入を完了した後、事前評価と同じ手順に従い、同じ評価タスクとアンケートを実施します (セクション 3 を参照)。
結果
本研究の主な目的は、並行無作為化三重盲検臨床試験の tDCS 介入プロトコルを説明することです。介入の実現可能性を研究するために、プロトコルは単一の参加者に適用されました。その結果を本稿に示します。
9か月前に右大脳基底核で脳卒中を患い、研究に参加するためのすべての選択基準を満たした、高い教育レベル(ジャーナリズムの学位)を持つ57歳の男性に完全な介入プロトコルを適用しました。
介入前と介入後の結果 ( 表 4 と 図 8 を参照) は、投与されたすべてのタスクについて示されています。介入後の評価では、測定された13の変数のうち6つで量的変化が観察され、そのうち4つはネグレクトに直接関連しています。
| 評価 | ||
| 介入前 | 介入後 | |
| MMSEテスト | 29 | 29 |
| ベルテスト | 21 | 25* |
| キャンセルテスト | 24 | 28* |
| 図面テスト | 12 | 12 |
| 二分試験 | 19.95 | 3.47* |
| BTAテスト | 11 | 9 |
| フェイセスヒット | 11 | 9 |
| Faces エラー | 3 | 2* |
| Direct Digitsテスト | 11 | 10 |
| 逆桁テスト | 9 | 8 |
| モーターフリー | 26 | 29* |
| バーセルテスト | 25 | 30* |
| CBSの | 20 | 20 |
表4:介入前および介入後の評価の結果。 介入前後の神経心理学的および機能的評価の結果は、直接スコアで示されています。*ベースラインと比較した介入後評価のパフォーマンスの定量的な改善。**スコア0から離れている値は、パフォーマンスが低下し、ネグレクトが大きくなることを示します。

図8:介入前と介入後の評価結果。 値が高いほど正の変化を示しますが、改善が低いスコアで表されるラインバイセクションテストでは例外です。結果は直接スコアで表示されます。*ベースラインと比較した介入後評価のパフォーマンスの定量的な改善。 この図の拡大版を表示するには、ここをクリックしてください。
治療前と治療後の評価の間の改善率を計算しました。特定の半空間無視テストで臨床的改善が観察されました:ベルテスト、キャンセルテスト、ラインバイセクション、視覚運動フリー知覚テスト、およびバーセルインデックススケール。一方、他の注意課題(指テスト、注意の簡易テスト、顔テスト)では否定的な変化が観察されました。最後に、MMSE、図面のコピー、または機能的なCatherine Bergego Scale(CBS)に変更は見られませんでした( 図9を参照)。

図9:ベースライン評価と介入後評価の間の変化率。 結果はパーセンテージで表示されます。正のスコアは、改善が負のスコアで表されるラインバイセクションテストを除き、正の変化を示します。*介入前と介入後の評価を比較した場合の肯定的な改善の割合。 この図の拡大版を表示するには、ここをクリックしてください。
研究手順は、評価および介入セッションを正しく実行し、安全および衛生対策を順守するための設備が整った広々とした部屋で実施されました。
患者に関しては、評価前と評価後のセッションのいずれでも疲労を示さなかったため、どのセッションでも休む必要はありませんでした。この治療法は、患者によって面白くて刺激的であると評価され、治療へのアドヒアランスと手順全体にわたる積極的な協力が改善されました。そのため、プロトコールは実現性が高いと考えられており、定められた手順で検討を続けます。
不快感と副作用に関しては、参加者はtDCSの適用に関連する中等度または重度の副作用を経験していませんでした。
ディスカッション
半空間無視は、脳卒中の頻繁な認知的結果であり、それが持続すると、リハビリテーションプロセスの有効性に悪影響を与える傾向があります。利用可能な治療アプローチの有効性と効率は、非侵襲的な脳刺激技術を神経リハビリテーションに含めることによって改善でき、相乗効果40,41を探しています。したがって、tDCSにより、従来の介入の有効性を高め、脳卒中患者のリハビリテーションにおける回復率の向上、リハビリテーション時間の短縮、および従来の孤立した介入と比較しての機能転帰の向上を達成できます。神経障害および精神障害におけるtDCSの可能性に関する研究は、過去10年間で指数関数的に増加しています42,43,44,45,46,47,48,49。
さらに、tDCSのコストは手頃な価格であり、デバイスはポータブルであるため、非常にスケーラブルであり、必要な専門的なトレーニング50を使用して、外来診療所と病院の両方の環境でのアプリケーションを可能にします。
実施された13の検査のうち4つ(ベルテスト、キャンセルテスト、ラインバイセクション、視覚運動フリー知覚テスト)で治療後に改善が見られました。これらの肯定的な変化が観察されたテストは、半空間無視に関連するパフォーマンスに関連しています。一方、一般的な認知能力、注意プロセス、および/または作業記憶(MMSE、図面、CBS)に関連するいくつかのテストのパフォーマンスでは、安定化が観察されています。他のいくつかのタスク(BTA、面、直数および逆桁)のパフォーマンスの低下が観察されています。
機能スケールに関しては、改善の証拠があり、主たる介護者によって報告され、Barthel Indexスケールによって評価されました。ネグレクトが日常生活に与える影響に直接関連するCBS機能スケールも実施されましたが、この場合、変化は証明されず、以前の評価と比較して安定していました。この研究では、一部の認知領域では併用療法の利点が見つかりましたが、他の認知領域では効果が見られませんでした。これらの知見は、治療が特定の注意領域51,52,53,54,55,56,57に対してより有益であり得るという考えと一致している。いくつかの研究は、特定のtDCSプロトコルが皮質の興奮性と活動の持続的な変化をどのように誘発するかを示しています58。1週間を超えて変更のメンテナンスを分析できるようにするためには、より長い期間53,54,55,56,57の後に新しい評価を実行することをお勧めします。
この研究で使用される高解像度または高解像度のtDCSは、tDCSの技術的に強化されたバージョンであり、アノードまたはカソードの周りの戻り電極のリングを使用して刺激の焦点性を増加または減少させ、それぞれ、皮質の興奮性をはるかに焦点的に増加または減少させることができる59。この高い焦点性と、Borckardt et al.60 による HD-tDCS 研究の以前の忍容性と効果に基づいて、HD-tDCS の使用は近年増加しています。
モデリング研究は、この電極構成が、ターゲット電極の下で最も高い電界(EF)強度を生成し、脳電流の流れが4×1リングセットアップの半径によって制約され、したがって、選択されたターゲットにおいて、従来の電極配置と比較してより大きな電界を生成することを示している60,61,62.リターン電極は、標的領域の分離に貢献し、従来のtDCS63よりも集中的な脳刺激を可能にし、より持続的な効果を生み出します。
さらに、いくつかの研究によると、HD-tDCSは効果が持続する時間が長いとされています。最近、臨床研究はこのプロトコルに注目しています。私たちの知る限り、神経疾患におけるHD-tDCSを用いた研究は6件、ランダム化比較試験は3件、非盲検報告は2件、症例報告は1件のみである(レビュー49参照)。
半空間の無視に関連する解剖学的領域について完全なコンセンサスはありませんが、いくつかの特定の領域についてはある程度の合意があるようです。後頭頂葉皮質は、変化64,65,66の重要な領域であるように思われ、この領域内では、角回64,65,67,68,69、頭頂内溝64,69,70、側頭頭頂接合部69,71、および辺縁上回65、72、73、74。
従来のtDCSと比較したHD-tDCSの利点は、刺激ターゲットの精度を向上させることであり、半空間無視の存在の正確な位置の知識に基づいていることを考えると、より一般的な刺激または拡散刺激と比較して、焦点刺激からより大きな利益を得ることが期待できます。一方、神経学の研究で最も使用されている構成は、4 x 1モンタージュ75,76,77,78,79です。私たちの研究では、刺激の焦点性をさらに高めることを目的として 7 x 1 の構成を使用し、このモンタージュをネグレクトの臨床リハビリテーションに使用した最初の研究です。したがって、このHD-tDCSモンタージュが他のHDモンタージュや従来のtDCSよりも優れているか、または有効性を判断するために、この臨床状態および他の臨床状態に関するさらなる研究を実施する必要があります。
強度に関しては、このプロトコルでは、tDCSを使用したほとんどの研究と同様に、どのモンタージュや構成が使用されるかに関係なく、2mAが適用されます。さらなる研究で同じプロトコルを低強度と高強度で比較し、異なる適用強度の影響を把握することは興味深いでしょう。
安全性と技術的なトラブルシューティングに関するいくつかの有用な推奨事項は、現在のプロトコルで考慮する必要があります。すべての患者、特に脳卒中患者では、安全性の問題を徹底的に評価する必要があります。脳卒中患者のtDCSは安全で忍容性が良好ですが80、患者とその家族は時々それについて疑問を抱いています。したがって、理解可能な情報を事前に手渡し、患者や親族と話し合うことで、患者が手順を理解し、いつでもプロトコルを放棄できるようにする必要があります。
一方、このプロトコルでは、皮質病変(例えば、右中大脳動脈)69 および皮質下病変(例えば、大脳基底核)81の後の半空間的無視に対するプロトコルの影響を比較する用意があるため、病変の正確な位置が考慮され、記録されている。これに関連して、病変部位の不均一性に照らして技術の有効性を評価することが重要です。具体的には、皮質病変と皮質下病変の有効性のばらつきを分析する必要があります。
脳卒中期に関しては、刺激(急性、亜急性、または慢性)を適用するときに、介入が最も有益になる可能性のある瞬間を知ることが重要です。この研究では、選択基準として、損傷から 3 か月から 12 か月 (亜急性期) を使用しました。しかし、以前の系統的レビューでは、脳卒中後の運動面に焦点を当てており、その結果は慢性期では改善を示していたが、急性期(症状の発症から最初の3日以内)では改善が見られなかった82。脳卒中後の認知変化に対するtDCSの利点を調査し、回復のさまざまな段階でその最適な有効性を予測する要因を特定するには、さらなる調査が必要です。
神経疾患の治療アプローチとしてのHD-tDCSに関する現在の知識は、その忍容性と臨床効果を裏付けています。さらに、神経障害およびそれ以降のこの非侵襲的脳刺激技術の有効性を確立するためには、各疾患および各患者の最適なパラメーターを把握するために、さらなるランダム化比較研究が必要です。
開示事項
著者は何も開示していません。
謝辞
このプロジェクトでのNeuronUp(www.neuronup.com)の支援と無私の協力に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 10 electrode cable | Neuroelectrics | NE017 | |
| Barthel Index | N/A | Mahoney, F. I., Barthel, D. W. Functional evaluation: The Barthel Index. Md State Med J. 14, 61–65 (1965). | |
| Copy of drawings subtest | N/A | https://test-barcelona.com/es/tienda.html | J. Peña Casanova, Programa integrado de exploración neuropsicológica: test Barcelona revisado?: TBR. Barcelona: Masson. |
| Curved Syrenge | Neuroelectrics | NE014 | |
| Electrode Gel | Neuroelectrics | NE016a | |
| Line bisection test | N/A | Schenkenberg, T., Bradford, D. C., Ajax, E. T. Line bisection and unilateral visual neglect in patients with neurologic impairment. Neurology. 30 (5) 509–517 (1980). | |
| Mini-mental state examination (MMSE) | N/A | Folstein, M. F., Folstein, S. E., McHugh, P. R. “Mini-mental state”. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res. 12 (3) 189–198 (1975). | |
| Neoprene headcap | Neuroelectrics | NE019-M | |
| Saline Solution | Neuroelectrics | NE033 | |
| Satrstim Necbox | Neuroelectrics | NE012 | |
| Starstim tES-EEG System | Neuroelectrics | ||
| Teastboard Cable | Neuroelectrics | NE039 | |
| Testboard Head | Neuroelectrics | NE038 | |
| The Bell Test | N/A | https://strokengine.ca/en/assessments/bells-test/ | L. Gauthier, F. Deahault and Y. Joanette, The Bells Test: A quantitative and qualitative test for visual neglect (Vol. 11). |
| The Catherine Bergego Scale | N/A | Azouvi, P. et al. Behavioral assessment of unilateral neglect: study of the psychometric properties of the Catherine Bergego Scale. Arch Phys Med Rehabil. 84 (1) 51–57 (2003). | |
| The motor-free visual perception test (MVPT) | N/A | https://www.wpspublish.com/mvpt-4-motor-free-visual-perception-test-4 | Colarusso, R. P., Hammill, D.D. The Motor Free Visual Perception Test (MVPT-3). Navato, CA: Academic Therapy Publications (2003). |
| USB Bluetooth Dongle | Neuroelectrics | NE031 | |
| USB charging Cable | Neuroelectrics | NE043 | |
| USB Power Adapter & Power Supply Plug | Neuroelectrics | NE013 & NE013a, NE013b, NE013c | |
| USB Stick with Manuals & NIC SW | Neuroelectrics | NE015 |
参考文献
- Sun, J. -H., Tan, L., Yu, J. -T. Post-stroke cognitive impairment: epidemiology, mechanisms and management. Ann Transl Med. 2 (8), 80(2014).
- Abo, M., et al. comparative study of NEURO versus CIMT in poststroke patients with upper limb hemiparesis: the neuro-verify study. Int J Stroke. 9 (5), 607-612 (2014).
- Mijajlović, M. D., et al. Post-stroke dementia - a comprehensive review. BMC Med. 15 (1), 11(2017).
- Kerkhoff, G., Schenk, T. Rehabilitation of neglect: an update. Neuropsychologia. 50 (6), 1072-1079 (2012).
- Jehkonen, M., et al. Predictors of discharge to home during the first year after right hemisphere stroke. Acta Neurol Scand. 104 (3), 136-141 (2001).
- Buxbaum, L. J., et al. Hemispatial neglect: subtypes, neuroanatomy, and disability. Neurology. 62 (5), 749-756 (2004).
- Nijboer, T. C. W., Kollen, B. J., Kwakkel, G. Time course of visuospatial neglect early after stroke: a longitudinal cohort study. Cortex. 49 (8), 2021-2027 (2013).
- Ringman, J. M., Saver, J. L., Woolson, R. F., Clarke, W. R., Adams, H. P. Frequency, risk factors, anatomy, and course of unilateral neglect in an acute stroke cohort. Neurology. 63 (3), 468-474 (2004).
- Parton, A., Malhotra, P., Husain, M. Hemispatial neglect. J Neurol Neurosurg Psychiatry. 75 (1), 13-21 (2004).
- Stone, S. P., Patel, P., Greenwood, R. J., Halligan, P. W. Measuring visual neglect in acute stroke and predicting its recovery: the visual neglect recovery index. J Neurol Neurosurg Psychiatry. 55 (6), 431(1992).
- Chen, P., Hreha, K., Kong, Y., Barrett, A. M. Impact of spatial neglect on stroke rehabilitation: evidence from the setting of an inpatient rehabilitation facility. Arch Phys Med Rehabil. 96 (8), 1458-1466 (2015).
- Wilkinson, D., Sakel, M., Camp, S. -J., Hammond, L. Patients with hemispatial neglect are more prone to limb spasticity, but this does not prolong their hospital stay. Arch Phys Med Rehabil. 93 (7), 1191-1195 (2012).
- Gammeri, R., Iacono, C., Ricci, R., Salatino, A. Unilateral spatial neglect after stroke: current insights. Neuropsychiatr Dis Treat. 16, 131-152 (2020).
- Muñoz-Marrón, E., Redolar-Ripoll, D., Zulaica-Cardoso, A. New therapeutic approaches in the treatment of neglect: transcranial magnetic stimulation. Rev Neurol. 55 (5), 297-305 (2012).
- Cicerone, K. D., et al. Evidence-based cognitive rehabilitation: systematic review of the literature from 2009 through 2014. Arch Phys Med Rehabil. 100 (8), 1515-1533 (2009).
- Pizzamiglio, L., et al. Cognitive rehabilitation of the hemineglect disorder in chronic patients with unilateral right brain damage. J Clin Exp Neuropsychol. 14 (6), 901-923 (1992).
- Yi, Y., et al. The effect of transcranial direct current stimulation on neglect syndrome in stroke patients. Ann Rehabil Med. 40 (2), 223-229 (2016).
- Fregni, F., Pascual-Leone, A. Technology insight: noninvasive brain stimulation in neurology-perspectives on the therapeutic potential of rTMS and tDCS. Nat Rev Neurol. 3 (7), 383-393 (2007).
- Lefaucheur, J. -P., et al. Evidence-based guidelines on the therapeutic use of transcranial direct current stimulation (tDCS). Clin Neurophysiol. 128 (1), 56-92 (2017).
- González-Rodriguez, B., Serradell-Ribé, N., Viejo-Sobera, R., Romero-Muñoz, J. P., Marron, E. M. Transcranial direct current stimulation in neglect rehabilitation after stroke: a systematic review. J Neurol. 269 (12), 6310-6329 (2022).
- Kinsbourne, M. A model for the mechanism of unilateral neglect of space. Trans Am Neurol Assoc. 95, 143-146 (1970).
- Kinsbourne, M. Hemi-neglect and hemisphere rivalry. Adv Neurol. 18, 41-49 (1977).
- Koch, I. Instruction effects in task switching. Psychon Bull Rev. 15 (2), 448-452 (2008).
- Corbetta, M., Kincade, M. J., Lewis, C., Snyder, A. Z., Sapir, A. Neural basis and recovery of spatial attention deficits in spatial neglect. Nat Neurosci. 8 (11), 1603-1610 (2005).
- Hummel, F. C., Cohen, L. G. Noninvasive brain stimulation: a new strategy to improve neurorehabilitation after stroke. Lancet Neurol. 5 (8), 708-712 (2006).
- Miniussi, C., et al. Efficacy of repetitive transcranial magnetic stimulation/transcranial direct current stimulation in cognitive neurorehabitation. Brain Stimul. 1 (4), 326-336 (2008).
- Bornheim, S., Maquet, P., Croisier, J., Crielaard, J., Kaux, J. Motor cortex transcranial direct current stimulation (tDCS) improves acute stroke visuo-spatial neglect: a series of four case reports. Brain Stimul. 11 (2), 459-461 (2018).
- Sunwoo, H., et al. Effects of dual transcranial direct current stimulation on post-stroke unilateral visuospatial neglect. Neurosci Lett. 554, 94-98 (2013).
- Ladavas, E., et al. A-tDCS on the ipsilesional parietal cortex boosts the effects of prism adaptation treatment in neglect. Restor Neurol Neurosci. 33 (5), 647-662 (2015).
- Turgut, N., Miranda, M., Kastrup, A., Eling, P., Hildebrandt, H. tDCS combined with optokinetic drift reduces egocentric neglect in severely impaired post-acute patients. Neuropsychol Rehabil. 28 (4), 515-526 (2018).
- Smit, M., et al. Transcranial direct current stimulation to the parietal cortex in hemispatial neglect: a feasibility study. Neuropsychologia. 74, 152-161 (2015).
- Brem, A. -K., Unterburger, E., Speight, I., Jancke, L. Treatment of visuospatial neglect with biparietal tDCS and cognitive training: a single-case study. Front Syst Neurosci. 8, 180-180 (2014).
- Cappon, D., Jahanshahi, M., Bisiacchi, P. Value and efficacy of transcranial direct current stimulation in the cognitive rehabilitation: a critical review since 2000. Front Neurosci. 10, 157(2016).
- Fan, J., Li, Y., Yang, Y., Qu, Y., Li, S. Efficacy of noninvasive brain stimulation on unilateral neglect after stroke: a systematic review and meta-analysis. Am J Phys Med Rehabil. 97 (4), 261-269 (2018).
- Kashiwagi, F. T., et al. Noninvasive brain stimulations for unilateral spatial neglect after stroke: a systematic review and meta-analysis of randomized and nonrandomized controlled trials. Neural Plast. , (2018).
- Salazar, A. P. S., et al. Noninvasive brain stimulation improves hemispatial neglect after stroke: a systematic review and meta-analysis. Arch Phys Med Rehabil. 99 (2), 355-366 (2018).
- Zebhauser, P. T., Vernet, M., Unterburger, E., Brem, A. -K. Visuospatial neglect-a theory-informed overview of current and emerging strategies and a systematic review on the therapeutic use of noninvasive brain stimulation. Neuropsychol Rev. 29 (4), 397-420 (2019).
- Bikson, M., et al. Safety of transcranial direct current stimulation: evidence based update 2016. Brain Stimul. 9 (5), 641-661 (2016).
- Antal, A., et al. Low intensity transcranial electric stimulation: safety, ethical, legal regulatory and application guidelines. Clin Neurophysiol. 128 (9), 1774-1809 (2017).
- Sathappan, A. V., Luber, B. M., Lisanby, S. H. The dynamic duo: combining noninvasive brain stimulation with cognitive interventions. Prog Neuropsychopharmacol Biol Psychiatry. 89, 347-360 (2019).
- Draaisma, L. R., Wessel, M. J., Hummel, F. C. Noninvasive brain stimulation to enhance cognitive rehabilitation after stroke. Neurosci Lett. 719, 133678(2020).
- David, M. C. M. M., Moraes, A. A., de Costa, M. L., da Franco, C. I. F. Transcranial direct current stimulation in the modulation of neuropathic pain: a systematic review. Neurol Res. 40 (7), 557-565 (2018).
- Dondé, C., et al. Transcranial direct-current stimulation (tDCS) for bipolar depression: a systematic review and meta-analysis. Prog Neuropsychopharmacol Biol Psychiatry. 78, 123-131 (2017).
- Gowda, S. M., et al. Efficacy of pre-supplementary motor area transcranial direct current stimulation for treatment resistant obsessive compulsive disorder: a randomized, double blinded, sham controlled trial. Brain Stimul. 12 (4), 922-929 (2019).
- Kang, N., Summers, J. J., Cauraugh, J. H. Transcranial direct current stimulation facilitates motor learning post-stroke: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry. 87 (4), 345-355 (2016).
- Narayanaswamy, J. C., et al. Successful application of add-on transcranial direct current stimulation (tDCS) for treatment of SSRI resistant OCD. Brain Stimul. 8 (3), 655-657 (2015).
- Osoegawa, C., et al. Noninvasive brain stimulation for negative symptoms in schizophrenia: an updated systematic review and meta-analysis. Schizophr Res. 197, 34-44 (2018).
- Vacas,, et al. Noninvasive brain stimulation for behavioural and psychological symptoms of dementia: a systematic review and meta-analysis. Int J Geriatr Psychiatry. 34 (9), 1336-1345 (2019).
- Parlikar, R., et al. High definition transcranial direct current stimulation (HD-tDCS): a systematic review on the treatment of neuropsychiatric disorders. Asian J Psychiatry. 56, 102542(2021).
- Fried, P. J., et al. Training in the practice of noninvasive brain stimulation: recommendations from an IFCN committee. Clin Neurophysiol. 132 (3), 819-837 (2021).
- Cappa, S. F., et al. EFNS guidelines on cognitive rehabilitation: report of an EFNS task force. Eur J Neurol. 12 (9), 665-680 (2005).
- Sturm, W., Willmes, K., Orgass, B., Hartje, W. Do specific attention deficits need specific training. Neuropsychol Rehabil. 7 (2), 81-103 (1997).
- Verveer, I., Remmerswaal, D., Van der Veen, F. M., Franken, I. H. A. Long-term tDCS effects on neurophysiological measures of cognitive control in tobacco smokers. Biol Psychol. 156, 107962(2020).
- Katz, B., et al. Individual differences and long-term consequences of tDCS-augmented cognitive training. J Cogn Neurosci. 29 (9), 1498-1508 (2017).
- Gu, J., et al. The effect and mechanism of transcranial direct current stimulation on episodic memory in patients with mild cognitive impairment. Front Neurosci. 16, 811403(2022).
- Zhou, Y., et al. Efficacy and safety of transcranial direct current stimulation (tDCS) on cognitive function in chronic schizophrenia with tardive dyskinesia (TD): a randomized, double-blind, sham-controlled, clinical trial. BMC Psychiatry. 23 (1), 623(2023).
- Au, J., et al. Enhancing working memory training with transcranial direct current stimulation. J Cogn Neurosci. 28 (9), 1419-1432 (2016).
- Stagg, C. J., Antal, A., Nitsche, M. A. Physiology of transcranial direct current stimulation. J ECT. 34 (3), 144-152 (2018).
- Da Silva Machado, D. G., et al. Acute effect of high-definition and conventional tDCS on exercise performance and psychophysiological responses in endurance athletes: a randomized controlled trial. Sci Rep. 11, 13911(2021).
- Borckardt, J. J., et al. A pilot study of the tolerability and effects of high-definition transcranial direct current stimulation (HD-tDCS) on pain perception. J Pain. 13 (2), 112-120 (2012).
- Villamar, M. F., et al. Technique and considerations in the use of 4x1 ring high-definition transcranial direct current stimulation (HD-tDCS). J Vis Exp. (77), e50309(2013).
- Effects of electrode configurations and injected current intensity on the electrical field of transcranial direct current stimulation: a simulation study. Mackenbach, C., Tian, R., Yang, Y. Annu Int Conf IEEE Eng Med Biol Soc, , 3517-3520 (2020).
- Bikson, M., Datta, A., Rahman, A., Scaturro, J. Electrode montages for tDCS and weak transcranial electrical stimulation: role of "return" electrode's position and size. Clin Neurophysiol. 121 (12), 1976-1978 (2010).
- Chambers, C. D., Stokes, M. G., Mattingley, J. B. Modality-specific control of strategic spatial attention in parietal cortex. Neuron. 44 (6), 925-930 (2004).
- Chambers, C. D., Payne, J. M., Mattingley, J. B. Parietal disruption impairs reflexive spatial attention within and between sensory modalities. Neuropsychologia. 45 (8), 1715-1724 (2007).
- Chambers, C. D., Mattingley, J. B. Neurodisruption of selective attention: insights and implications. Trends Cogn Sci. 9 (11), 542-550 (2005).
- Rushworth, M. F., Ellison, A., Walsh, V. Complementary localization and lateralization of orienting and motor attention. Nat Neurosci. 4 (6), 656-661 (2001).
- Hillis, A. E., et al. Anatomy of spatial attention: insights from perfusion imaging and hemispatial neglect in acute stroke. J Neurosci. 25 (12), 3161-3167 (2005).
- Mort, D. J., et al. The anatomy of visual neglect. Brain. 126 (9), 1986-1997 (2003).
- Mannan, S. K., et al. Revisiting previously searched locations in visual neglect: role of right parietal and frontal lesions in misjudging old locations as new. J Cogn Neurosci. 17 (2), 340-354 (2005).
- Vallar, G. Extrapersonal visual unilateral spatial neglect and its neuroanatomy. Neuroimage. 14 (1 Pt 2), S52-S58 (2001).
- Oliveri, M., Vallar, G. Parietal versus temporal lobe components in spatial cognition: setting the mid-point of a horizontal line. J Neuropsychol. 3 (2), 201-211 (2009).
- Committeri, G., et al. Neural bases of personal and extrapersonal neglect in humans. Brain. 130 (Pt 2), 431-441 (2007).
- Doricchi, F., Tomaiuolo, F. The anatomy of neglect without hemianopia: a key role for parietal-frontal disconnection. Neuroreport. 14 (17), 2239-2243 (2003).
- Fiori, V., Nitsche, M. A., Cucuzza, G., Caltagirone, C., Marangolo, P. High-definition transcranial direct current stimulation improves verb recovery in aphasic patients depending on current intensity. Neuroscience. 406, 159-166 (2019).
- Karvigh, S. A., Motamedi, M., Arzani, M., Roshan, J. H. N. HD-tDCS in refractory lateral frontal lobe epilepsy patients. Seizure. 47, 74-80 (2017).
- Meiron, O., et al. Antiepileptic effects of a novel noninvasive neuromodulation treatment in a subject with early-onset epileptic encephalopathy: case report with 20 sessions of HD-tDCS intervention. Front Neurosci. 13, (2019).
- Reckow, J., et al. Tolerability and blinding of 4x1 high-definition transcranial direct current stimulation (HD-tDCS) at two and three milliamps. Brain Stimul. 11 (5), 991-997 (2018).
- Motes, M. A., et al. High-definition transcranial direct current stimulation to improve verbal retrieval deficits in chronic traumatic brain injury. J Neurotrauma. 37 (1), 170-177 (2020).
- Russo, C., Souza Carneiro, M. I., Bolognini, N., Fregni, F. Safety review of transcranial direct current stimulation in stroke. Neuromodulation. 20 (3), 215-222 (2017).
- Hochstenbach, J., Van Spaendonck, K. P., Cools, A. R., Horstink, M. W., Mulder, T. Cognitive deficits following stroke in the basal ganglia. Clin Rehabil. 12 (6), 514-520 (1998).
- Marquez, J., Van Vliet, P., McElduff, P., Lagopoulos, J., Parsons, M. Transcranial direct current stimulation (tDCS): does it have merit in stroke rehabilitation? A systematic review. Int J Stroke. 10 (3), 306-316 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved