Method Article
Essai randomisé, en triple aveugle et contrôlé en parallèle de la stimulation transcrânienne à courant continu pour la réadaptation cognitive après un AVC
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cette étude présente un nouveau protocole de stimulation transcrânienne à courant continu (tDCS) combiné à une stimulation cognitive pour traiter la négligence hémispatiale post-AVC. Les premières données d’un patient pilote garantissent la faisabilité de la procédure et suggèrent une efficacité potentielle, fournissant ainsi une base pour un futur essai clinique parallèle, en triple aveugle et contrôlé.
Résumé
L’AVC de l’hémisphère droit entraîne souvent une négligence hémispatiale, une condition invalidante qui peut entraver considérablement le processus de rétablissement. La présence chronique de négligence a été associée à de moins bons résultats dans les domaines cognitif et moteur. En complément des interventions neuropsychologiques conventionnelles, la stimulation transcrânienne à courant continu (tDCS) - une technique non invasive qui module l’excitabilité neuronale par des courants électriques de faible intensité - a attiré l’attention pour son potentiel à améliorer la plasticité corticale et à soutenir l’amélioration fonctionnelle chez les personnes touchées.
Dans cette étude, nous proposons un protocole d’intervention combiné visant à réduire les symptômes de négligence hémispatiale post-AVC. Il s’agit d’un protocole cathodal tDCS combiné à un programme informatisé de réadaptation neuropsychologique spécialement conçu pour la réhabilitation de la négligence hémispatiale.
La stratégie de neuromodulation consiste à réduire l’hyperactivation de l’hémisphère non endommagé sur la base du modèle de rivalité interhémisphérique. L’intervention consiste en 2 semaines, 10 séances (du lundi au vendredi), 45 min chacune, de tDCS et de stimulation cognitive conventionnelle appliquées simultanément. La tDCS est appliquée par un dispositif tDCS haute définition à 8 canaux (HD-tDCS) pendant 20 min et à une intensité de 2 mA. La cathode est positionnée sur le cortex pariétal postérieur gauche (P3 suivant le système 10/20 pour le placement des électrodes d’électroencéphalogramme [EEG]), et les électrodes de retour sont placées en C3, CP5, CP1, Pz, PO3, PO7 et P7. Une évaluation neuropsychologique et fonctionnelle a été réalisée au départ et après la fin de l’intervention.
L’objectif principal de la présente étude est de décrire le protocole d’un plan expérimental parallèle, randomisé et en triple aveugle. Pour s’assurer de la faisabilité du protocole et de son efficacité potentielle, une description complète des procédures appliquées à un seul participant pilote est fournie.
L’intégration de stratégies de neuromodulation tDCS dans les processus de réadaptation cognitive peut conduire à des temps d’intervention raccourcis et à améliorer l’état fonctionnel et la qualité de vie des patients.
Introduction
L’accident vasculaire cérébral est la cause la plus fréquente d’invalidité dans le monde chez les adultes et la deuxième cause de décès après la cardiopathie ischémique1. La plupart des patients qui ont survécu à un AVC développent des conditions cliniques très hétérogènes et différents degrés d’invalidité. Entre 55 % et 75 % des patients victimes d’un AVC ont des limitations motrices qui persistent 6 mois après la blessure2. En plus des conséquences physiques, les altérations cognitives sont très fréquentes3. Ces déficits affectent négativement la performance des activités de la vie quotidienne, limitant l’indépendance fonctionnelle et la qualité de vie des patients et des proches 4,5. La négligence hémispatiale est l’une des déficiences attentionnelles les plus courantes à la suite d’un AVC, survenant dans environ 25 % à 50 % des cas 6,7,8 et atteignant jusqu’à 80 % chez les personnes ayant subi un AVC de l’hémisphère droit 9,10.
La négligence hémispatiale implique une difficulté à s’occuper de l’hémichamp controlatéral à la zone blessée, étant cette inattention allocentrique (omettre les objets situés dans la moitié gauche de l’espace) ou égocentrique (le patient ne s’occupe pas des parties gauches de son propre corps). Sur le plan fonctionnel, la négligence génère de graves difficultés d’indépendance du patient, tant dans les activités de base (par exemple, se toiletter, s’habiller, manger, etc.) que dans les activités instrumentales de la vie quotidienne (par exemple, la gestion de l’argent, les transports en commun ou la marche autonome). De plus, la présence de cette altération a été associée à des temps d’hospitalisation et de réadaptation plus longs, à un risque plus élevé de chutes, à une mauvaise récupération motrice et à une probabilité plus faible de rentrer à la maison après avoir quitté l’hôpital11,12.
Plusieurs stratégies ont été mises en œuvre pour traiter la négligence hémispatiale. Dans les approches traditionnelles de réadaptation, on peut distinguer les approches descendantes et les approches ascendantes. La principale différence entre eux est le niveau de participation active et de conscience de la personne dans les tâches. Dans le cadre de ces approches, les procédures les plus largement utilisées à ce jour ont été l’entraînement au balayage visuel et l’adaptation prismatique, respectivement13. Autres techniques de réadaptation en négligence hémispatiale avec une large utilisation Localisation centrale, stimulation optocinétique, calorique et vestibulaire, vibration du cou et traitements pharmacologiques 13,14,15,16. Cependant, ces traitements ont certaines limites : la durée de leurs résultats est très limitée et ils ont une faible applicabilité dans les phases aiguës ou subaiguës car la sévérité des patients dans ces phases interfère avec leur collaboration dans les activités à effectuer17.
La stimulation transcrânienne à courant continu (tDCS) est une technique de neuromodulation non invasive et sûre capable de modifier l’activité corticale en induisant un faible courant électrique dans le cerveau qui modifie l’activité corticale, et elle peut être utilisée pour compléter la réadaptation neuropsychologique pour la négligence hémispatiale. La tDCS module l’activation neuronale spontanée en réponse à des entrées provenant d’autres zones du cerveau. De plus, la tDCS induit des changements synaptiques plastiques qui ressemblent à une potentialisation à long terme (LTP) ou à une dépression à long terme (LTD) et durent même au-delà de la durée de la stimulation18.
Au moyen de la tDCS, l’activité corticale peut être modulée en appliquant un courant électrique de très faible intensité qui circule de l’anode à la cathode. La tDCS module l’activité cérébrale en influençant le seuil du potentiel d’action, en l’augmentant ou en le diminuant, mais sans provoquer de potentiels d’action18. En général, l’anode induit une augmentation de l’excitabilité de la région cérébrale sur laquelle elle se trouve, tandis que la cathode induit une inhibition corticale. Cette technique n’a pas une haute résolution spatiale, mais cette limitation a été surmontée par l’apparition de nouveaux dispositifs tDCS appelés multisites ou haute définition (HD-tDCS). Ces dispositifs permettent différentes configurations d’électrodes, comme la formation d’un anneau cathodal autour de l’anode (ou vice versa) afin d’augmenter ou de diminuer l’excitabilité corticale dans une zone spécifique du cerveau. L’anneau cathodique agit de la même manière que les électrodes de retour, limitant la zone de stimulation ; De cette façon, une stimulation plus focale est obtenue. La tDCS s’est avérée efficace en tant qu’approche thérapeutique pour la récupération motrice après un AVC19, et il existe une littérature scientifique avec des résultats prometteurs dans la réhabilitation de la négligence hémispatiale20.
L’hypothèse la plus acceptée de la négligence hémispatiale soutient qu’elle pourrait être expliquée sur la base du modèle de rivalité hémisphérique, proposé par Kinsbourne en 197721,22. Selon cette approche, à l’état basal, les deux hémisphères s’inhibent constamment l’un l’autre de manière réciproque ; La négligence hémispatiale est causée par un déséquilibre entre eux. Après une blessure, l’hémisphère endommagé n’est pas en mesure d’inhiber efficacement l’activité de l’hémisphère préservé. Il en résulte une hyperactivité pathologique de l’hémisphère sain en raison de l’absence d’inhibition exercée par l’hémisphère endommagé, ce qui réduit, encore plus, l’activité neuronale de l’hémisphère affecté en raison de l’inhibition accrue exercée sur celui-ci23. Par conséquent, le dysfonctionnement qui sous-tend la négligence hémispatiale est causé à la fois par l’hypoactivité de l’hémisphère endommagé et l’hyperactivité de l’hémisphère intact24.
Avec ce modèle comme base théorique, différentes stratégies de stimulation cérébrale non invasives visant à améliorer les symptômes de négligence hémispatiale sont proposées. Ces stratégies visent à diminuer l’hyperactivité de l’hémisphère sain, à augmenter l’activité de l’hémisphère blessé ou à combiner les deux25,26.
Plusieurs études ont montré le potentiel de la tDCS dans la réduction de la symptomatologie de la négligence hémispatiale en appliquant à la fois la tDCS anodale 17,27,28,29 et cathodale 17,29 dans l’hémisphère blessé ou non endommagé, respectivement, ou une combinaison des deux 28,30,31,32. Malgré des résultats prometteurs, davantage de preuves empiriques sont nécessaires pour connaître les paramètres exacts de la tDCS afin d’obtenir des résultats optimaux, ce qui est essentiel pour savoir si la tDCS focale est plus efficace que les montages tDCS conventionnels. À notre connaissance, toutes les recherches précédentes ont été développées à l’aide de la tDCS conventionnelle, la présente étude étant la première à utiliser la HD-tDCS pour la réhabilitation de la négligence hémispatiale.
Les interventions basées sur la stimulation cérébrale non invasive constituent une approche clinique très prometteuse compte tenu des résultats à jour et des effets indésirables limités selon différentes méta-analyses et revues 33,34,35,36,37. De plus, la tDCS est une technique très sûre, portable et peu coûteuse, c’est pourquoi son utilisation est devenue une priorité dans les milieux cliniques et de recherche. De plus, sa facilité d’assemblage et de portabilité permet à l’appareil d’être utilisé simultanément avec la réalisation de toute autre activité, telle que la réadaptation physique, cognitive ou les activités fonctionnelles. Ainsi, un plus grand nombre d’études contrôlées, en aveugle et randomisées avec des échantillons de plus grande taille sont nécessaires pour valider les protocoles tDCS qui améliorent les effets des approches d’intervention conventionnelles.
Protocole
Ce projet a été approuvé par le Comité d’éthique de la recherche clinique de l’hôpital 12 de Octubre (réf. Nº CEIm : 19/180), et il est enregistré au www.clinicaltrials.gov (ID : NCT04458974). Les chercheurs s’engagent à respecter toute la législation en vigueur en matière de recherche clinique et de protection des données (Déclaration de l’AMM d’Helsinki, 2004 ; Règlement (UE) 2016/679 et loi organique 3/2018 sur la protection des données à caractère personnel ; Loi 41/2002 sur l’autonomie du patient). Conformément au Règlement (UE) 2016/679 relatif à la protection des données à caractère personnel, toutes les données collectées auprès des participants seront traitées avec une stricte confidentialité. Le protocole tDCS suit les directives de sécurité internationales pour la tDCS38.
REMARQUE : L’objectif principal de la présente étude est de décrire un protocole d’intervention tDCS pour un essai clinique parallèle, randomisé et en triple aveugle. Pour ce faire, une description complète des procédures est fournie, et les résultats d’une demande de participation au projet pilote sont présentés dans le présent document. Le protocole d’intervention consiste en un programme de 10 séances combinant la tDCS cathodique (20 min, 2 mA) avec un programme informatisé de réadaptation neuropsychologique conçu pour améliorer la négligence hémispatiale. Des évaluations neuropsychologiques et fonctionnelles sont effectuées au départ et après la fin de l’intervention. La figure 1 montre la chronologie du protocole. La figure montre l’évaluation de base, la description détaillée de l’intervention et l’évaluation post-intervention de l’étude. La participation des patients était volontaire après avoir été informés de l’objectif de l’étude et avoir signé un formulaire écrit de consentement éclairé. Le participant peut se retirer de l’étude à tout moment. Le participant à cette étude répond à tous les critères d’inclusion et d’exclusion décrits dans le tableau 1.

Figure 1 : chronologie du protocole. Toutes les étapes de l’étude sont décrites : évaluation de base, description détaillée de l’intervention et évaluation post-intervention. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Critères d’inclusion et d’exclusion
- S’assurer que le participant pilote à cette étude répond aux critères d’inclusion et d’exclusion suivants (tableau 1).
| Critères d’inclusion : |
| Accident vasculaire cérébral hémorragique ou ischémique dans l’hémisphère droit |
| Accident vasculaire cérébral : 3 à 12 mois depuis l’événement (qu’ils aient ou non bénéficié d’une réadaptation préalable) |
| De 18 à 89 ans |
| Etude de neuroimagerie |
| Absence d’AVC antérieurs |
| Capacité fonctionnelle qui permet au patient de rester assis et actif pendant une heure (score de l’indice de Barthel supérieur à 5 dans l’item des transferts entre la chaise et le lit ; cet item peut être noté de 0 à 15, étant 0 totalement dépendant et 15 totalement indépendant). |
| Domination manuelle pour droitier |
| Scores de négligence à au moins deux des tests administrés pour l’évaluation de la négligence visuospatiale |
| Signature du consentement éclairé par le patient ou son tuteur légal |
| Critère d’exclusion : |
| Problèmes dermatologiques (psoriasis, dermatite du cuir chevelu ou du visage) |
| Présence d’implants ou de pièces métalliques dans la tête à l’exclusion des obturations. |
| Stimulateurs cardiaques, pompes à médicaments, stimulateurs (vagal, cérébral, transcutané), shunts ventriculo-péritonéaux ou clips d’anévrisme. |
| Présence d’accidents vasculaires cérébraux antérieurs |
| Maladie neurologique autre qu’un accident vasculaire cérébral décrite dans les critères d’inclusion |
| Troubles cognitifs sévères évalués à l’aide du Mini-mental state examination (MMSE) (Folstein, 1975), à l’exclusion des patients ayant des scores inférieurs à 24 (les scores du MMSE sont compris entre 0 et 30, soit 0 pour un trouble cognitif sévère et 30 pour aucun trouble cognitif) |
| Difficultés langagières importantes qui ne permettent pas une bonne compréhension des activités ou limitent fortement l’expression |
| Antécédents d’abus d’alcool ou de drogues |
| Dépression active modérée ou sévère |
| Problèmes médicaux non contrôlés (pathologies en phase aiguë sans traitement médical ou pharmacologique à l’efficacité prouvée ou pathologies à risque vital imminent) |
| Grossesse ou suspicion de grossesse qui sera vérifiée par un test de grossesse au début de l’étude chez les patientes en âge de procréer et avec la recommandation de l’utilisation de méthodes contraceptives jusqu’à la fin de l’intervention |
Tableau 1 : Critères d’inclusion et d’exclusion. Le participant pilote de cette étude répond à tous les critères d’inclusion et d’exclusion décrits dans ce tableau.
2. Matériaux
REMARQUE : Tous les matériaux utilisés dans toutes les phases de l’étude sont méticuleusement décrits.
- Kit de dispositif tDCS
- Pour l’application de la tDCS, utilisez un dispositif HD-tDCS à 8 canaux et ses électrodes recommandées (voir Figure 2). Pour faciliter l’assemblage, placez une base en plastique à l’endroit souhaité sur le capuchon en néoprène (en suivant le système EEG 10/20). Une fois placé, appliquez le gel conducteur et assemblez ensuite l’électrode.
- Plateforme informatisée de neuroréhabilitation
REMARQUE : Pour effectuer la stimulation cognitive, une plateforme informatisée de neuroréhabilitation en ligne est utilisée (voir Figure 3). La plateforme permet la conception et l’application de chaque séance du programme d’intervention, en adaptant la difficulté des tâches individuellement.- Créez un nouvel utilisateur pour chaque patient en cliquant sur Gestion des utilisateurs et en ajoutant un nouvel utilisateur. Nommez à l’aide d’un code d’étude pour personnaliser le programme cognitif individuellement.
- Pour concevoir les tâches, accédez à l’espace de travail/sessions/sessions numériques et cliquez sur la date à laquelle la session aura lieu.
- Insérez le nom de la session, par exemple, session 1. Sélectionnez une icône et une couleur pour cette session et cliquez sur le bouton Créer .
- Cliquez sur les activités à inclure dans le programme.
- Vérifiez que les tâches de chaque session apparaissent sur le côté gauche de l’écran.
- Dans chacun d’eux, programmez les paramètres suivants : Temps (7 min) et commencer au dernier résultat (n’indiquez OUI que dans les sessions 3 à 10).
- Indiquez pour enregistrer.
- Répétez les étapes 2.2.3 à 2.2.7 pour la conception de chacune des 10 séances du programme de stimulation cognitive.

Figure 2 : kit d’appareil tDCS. (1) Capuchon en néoprène, (2) appareil tDCS, (3) électrodes, (4) câbles, (5) clip d’oreille, (6) gel conducteur ; (7) Seringue pour administrer le gel conducteur sous les électrodes. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Planification des séances de la plateforme de neuroréadaptation. En cliquant sur chaque session, les tâches s’affichent, y compris la durée de chaque tâche et la durée totale de la session. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Description du protocole d’évaluation : Évaluation neuropsychologique et fonctionnelle pré-intervention :
REMARQUE : Une fois que le participant a signé le consentement éclairé, une évaluation neuropsychologique et fonctionnelle est effectuée. L’évaluation a lieu le vendredi précédant le début du programme de stimulation et dure 50 min. Au cours de cette séance, les performances cognitives générales sont évaluées, et des tests neuropsychologiques axés sur l’évaluation des processus attentionnels et de la négligence hémispatiale sont administrés, ainsi que des échelles fonctionnelles. Lors d’une séance d’information précédant la première évaluation, le participant reçoit tous les détails nécessaires sur l’objectif de l’étude, la procédure, la durée de la session et les effets indésirables potentiels. Le consentement signé est obtenu avant de procéder à l’évaluation et à l’intervention. Le participant est également informé de la possibilité de se retirer de l’étude à tout moment.
- Administration d’un mini-examen de l’état mental (MMSE) (5 min)
REMARQUE : Une échelle structurée simple. Il obtient un maximum de 30 points et les éléments sont regroupés en 5 sections qui évaluent l’orientation, la mémoire immédiate, l’attention et le calcul, la mémoire différée, le langage et la construction. Les scores varient de 0 à 30 points, le point limite étant de 24 ; Les scores inférieurs à 24 indiquent une déficience cognitive.- Expliquez le test au participant et demandez-lui de suivre les instructions du test. Vérifiez que le score total est de ≥24 points pour continuer.
- Administration d’un test de bissection de ligne (5 min)
REMARQUE : Dix-huit lignes sont présentées dans une feuille de format A4 organisée en 3 séries de 6 : une série située principalement à gauche du papier, une au centre du papier et une principalement à droite du papier. Les patients sont invités à marquer les points centraux de chaque ligne. L’écart de la marque du patient par rapport au véritable centre de la ligne est mesuré pour chaque ligne et moyenné pour les 18 lignes.- Placez la tâche centrée devant le participant, en indiquant sur la feuille les côtés droit et gauche du participant. Expliquez le test au participant et demandez-lui de suivre les instructions du test.
- Administration du test Bells (5 min)
REMARQUE : Instrument visant à évaluer le balayage visuel horizontal en présence de distracteurs. Il s’agissait d’identifier des figures en forme de cloche disposées de manière semi-aléatoire. Celles-ci étaient disposées en sept colonnes verticales, chacune contenant cinq cloches. En ce qui concerne leur placement sur la feuille, trois colonnes sont apparues à gauche, une au centre et trois à droite.- Placez la tâche centrée devant le participant, en indiquant sur la feuille les côtés droit et gauche du participant. Expliquez le test au participant et demandez-lui de suivre les instructions du test.
- Sous-tests de dessin d’images de l’administration des tests de Barcelone (5 min)
REMARQUE : Il se compose d’une copie de 6 figures : cercle, carré, triangle, croix, cube et maison. Le temps d’exécution est contrôlé. Chaque figure est notée comme suit : 3 points pour la reproduction parfaite, 2 points pour l’altération discrète, 1 point pour l’altération modérée, 0 point pour l’altération grave. Le score maximum est de 18. Il est récompensé par 3, 2 ou 1 point, en fonction du temps passé dans l’exécution.- Placez la tâche centrée devant le participant, en pointant les images qui apparaissent. Expliquez le test au participant et demandez-lui de suivre les instructions du test.
- Sous-tests d’annulation de l’administration du test de Barcelone (5 min)
- Placez la tâche centrée devant le participant, en indiquant sur la feuille les côtés droit et gauche du participant. Expliquez le test au participant et demandez-lui de suivre les instructions du test.
- Digit span administration avant et arrière (5 min).
- Expliquez le test au participant et demandez-lui de suivre les instructions du test.
- Gérez d’abord la tâche à chiffres directs. Deuxièmement, administrez ensuite la tâche des chiffres inverses.
- Administration d’un bref test d’attention (BTA) (5 min)
- Administrez verbalement la première partie de la tâche (comptez les chiffres qui apparaissent dans la séquence). Immédiatement après, appliquez la deuxième partie du test (comptez les lettres qui apparaissent dans la séquence)
- N’autorisez pas l’utilisation de notes ou le comptage sur les doigts.
- Administration du test facial (5 min)
- Présentez la feuille de test du visage. Expliquez le test au participant et demandez-lui de suivre les instructions du test.
- Activez le chronomètre et terminez la tâche au bout de 3 min. Comptez le nombre de stimuli correctement marqués.
- Administration d’un test de perception visuelle sans moteur (MVPT-4) (15 min)
REMARQUE : Le test à choix multiples de 36 éléments évalue 5 sous-dimensions de la négligence visuospatiale : la discrimination visuelle, la discrimination figure-bas, la relation spatiale, la fermeture visuelle et la mémoire visuelle. Différents paramètres sont utilisés pour quantifier le comportement de la réponse gauche (comportement de réponse gauche/droite, score brut, performance gauche/droite et temps de traitement de la perception visuelle). Les scores pour les réponses du côté gauche varient de 0 à 21, les valeurs les plus faibles indiquant une négligence visuospatiale plus grave.- Placez le cahier de devoirs devant le patient. Expliquez le test au participant et demandez-lui de suivre les instructions du test.
- Balances fonctionnelles
REMARQUE : Interrogez le patient et les membres de la famille/soignants pour connaître l’état fonctionnel du patient et l’impact de la négligence sur les activités de la vie quotidienne.- Administrez l’échelle de l’indice de Barthel (5 min) au membre de la famille ou au principal dispensateur de soins et notez les réponses sur la feuille de réponses.
REMARQUE : L’indice de Barthel mesure la capacité d’une personne à effectuer dix activités de base de la vie quotidienne, obtenant une estimation quantitative de son degré d’indépendance. - Administrez l’échelle de Catherine Bergego (ECS) (5 min) au membre de la famille ou au principal dispensateur de soins et notez les réponses sur la feuille de réponses.
REMARQUE : Ce questionnaire repose sur l’observation directe de la performance du patient dans 10 situations réelles simulées cliniquement, y compris des tâches telles que la toilette, l’habillage et l’utilisation d’un fauteuil roulant. L’évaluation du patient est comparée à celle d’un membre de la famille / principal dispensateur. Ce questionnaire donne un score compris entre 0 et 30, tandis que des scores plus élevés reflètent une plus grande gravité de la négligence visuospatiale. .
- Administrez l’échelle de l’indice de Barthel (5 min) au membre de la famille ou au principal dispensateur de soins et notez les réponses sur la feuille de réponses.
4. Description du protocole d’intervention
- Configuration du dispositif d’intervention
REMARQUE : Réglez les paramètres de stimulation HD-tDCS dans le logiciel. Quelques jours avant le début de l’intervention, l’appareil doit être programmé avec les paramètres à appliquer dans l’intervention, c’est-à-dire la durée, l’intensité, la polarité, l’état (actif ou simulé), le montage, le type d’électrodes, le site de stimulation, les positions des électrodes renvoyées et le pourcentage de retour électrique à chacune d’elles (voir point 5). Vérifiez que l’appareil dispose d’une batterie suffisante pour terminer toute la session.- Ouvrez le logiciel, sélectionnez Éditeur de protocole, puis ajoutez un nouveau protocole.
- Entrez le nom du protocole. Réglez la durée de la rampe : Marches : (gauche).
- Confirmez la rampe et le temps total de stimulation. Indiquez Montée en puissance : 30 et Descente : 30.
- Dans la section durée totale de la stimulation, indiquez 20 min. Réglez les paramètres de stimulation et d’électrode : Design (à droite).
- Réglez la polarité de la stimulation en cathodale. Configurez chaque électrode indépendamment. Commencez par l’électrode active, P3.
- Sélectionnez l’électrode P3 et faites-la glisser dans la case de droite. Sélectionnez la stimulation et la cathodale. Sélectionnez 2000 μA.
- Sélectionnez et faites glisser vers la gauche, espacez le reste des électrodes une par une. Dans ces cas, ce sont toutes des électrodes de retour et font la même action, en indiquant le pourcentage de retour dans chaque électrode.
REMARQUE : Il est important de noter que la somme du pourcentage de retour doit être égale à 100. Dans cette étude, les pourcentages de retour étaient CP1, PO3, PO7, P7, CP5, C3 : 10 % et PZ : 40 % (voir figure 4 et figure 5). Ce montage est conçu pour réduire l’hyperactivation pathologique du cortex pariétal postérieur dans l’hémisphère controlatéral à la lésion. - Cliquez sur le bouton Terminer une fois toutes les étapes terminées.
- Évaluation pré-intervention du patient
- Évaluation générale de l’État.
- Avant et après chaque séance de tDCS, évaluez l’état général en posant les questions suivantes : Vous sentez-vous bien ? Avez-vous mal à la tête ? Avez-vous des douleurs au cou ? Avez-vous bu de l’alcool hier ou aujourd’hui ? Avez-vous consommé de la drogue hier ou aujourd’hui ? Avez-vous consommé du café, du thé ou du chocolat au cours des 5 dernières heures ? Avez-vous bien dormi la nuit dernière ? À quand remonte la dernière fois que vous avez mangé depuis des heures ?
- Évaluez la fatigue et l’humeur sur l’échelle visuelle analogique (EVA).
- Évaluez le niveau de fatigue mentale et d’humeur à l’aide de deux EVA auto-administrés. En réponse à ces questions, demandez au participant de fournir un score compris entre 1 et 10, en se référant à ce qu’il ressent face aux questions : À quel point êtes-vous fatigué en ce moment ?, où 1 signifie pas fatigué du tout, 10 signifie très fatigué et Comment va votre humeur en ce moment ?, où 1 signifie très triste et 10 signifie très heureux.
- Évaluation générale de l’État.
- Montage tDCS haute définition
- Avant de commencer l’assemblage de l’appareil tDCS, vérifiez que tout le matériel nécessaire est disponible et que l’appareil tDCS dispose de suffisamment de batterie pour effectuer la séance de stimulation.
- Partie inférieure en plastique du placement de l’électrode
- Sélectionnez dans le capuchon en néoprène les positions suivantes : placez l’électrode cathodique active à P3 ; placez les électrodes de retour à C3, CP5, CP1, Pz, PO3, PO7 et P7 (voir Figure 5 et Figure 6).
- Placez la partie inférieure de l’électrode dans chacune des zones sélectionnées du capuchon. Mettez le bonnet sur la tête du participant, en ajustant Cz en fonction des mesures précédemment prises.
- Placement du capuchon en néoprène tDCS
- Asseyez le participant dans une position confortable sur une chaise.
- Mettez le capuchon en néoprène (voir figure 6) en sélectionnant la taille qui convient le mieux à la tête du sujet. Évitez de choisir un gros bonnet car il doit être serré à la tête. Ajustez le capuchon avec le bandeau jusqu’à ce qu’il soit bien ajusté sur la tête.
- Localisez le point Cz et les zones de stimulation du protocole.
- Mesurez la distance entre la nasion et l’inion et entre les points préauriculaires, à l’aide d’un mètre. Localisez le point Cz au milieu des deux emplacements.
- Placement de gel électroconducteur
- Séparez les cheveux situés sous l’électrode du lieu de stimulation. Assurer un bon contact entre l’électrode et la peau ; Utilisez un objet allongé qui permet d’enlever les poils de l’intérieur Les électrodes sans modifier le placement du capuchon ont été mesurées au préalable.
- Assurez-vous que le cuir chevelu est sec sans aucune autre préparation supplémentaire. Retirez les épingles à cheveux ou autres éléments métalliques (bandeaux, barrettes, etc.).
- Ne nettoyez jamais la peau avec de l’alcool car cela pourrait produire une abrasion avec la tDCS.
- Introduisez, à l’aide d’une seringue munie d’un embout final en plastique, une quantité suffisante de gel électroconducteur à la base de chaque électrode.
ATTENTION : Seul le gel électroconducteur peut être utilisé ; N’utilisez jamais d’eau ou de solution saline dans ce type d’électrode car cela pourrait provoquer une abrasion. - Retirez autant de poils que possible à l’aide de l’embout en plastique de la seringue.
- Contrôle d’impédance
REMARQUE : Le bouton de vérification d’impédance mesure l’impédance de tous les canaux actifs et de retour avant la stimulation. Il doit être utilisé avant d’initier tout protocole de stimulation. Les niveaux d’impédance sont affichés sous forme de barres de couleur sous l’icône de chaque canal de stimulation, le vert indiquant les valeurs acceptables. Le programme de stimulation ne peut commencer que lorsque tous les canaux sont verts. Pendant la stimulation, l’impédance est surveillée toutes les secondes, et si une électrode dépasse 20 kW à tout moment, le protocole est automatiquement interrompu.- Allumez l’appareil. Ouvrez le logiciel du périphérique tDCS sur l’ordinateur.
- Sélectionnez la connexion utilisée avec l’appareil. Sélectionnez l’option Rechercher l’appareil.
- Sélectionnez Vérifier l’impédance.
- Si toutes les électrodes apparaissent en vert, appuyez sur le bouton Play et le programme de stimulation démarrera.
- Si, après avoir terminé la vérification de l’impédance, une électrode apparaît rouge, appliquez à nouveau du gel sur cette électrode, retirez tous les cheveux et vérifiez à nouveau l’impédance jusqu’à ce que toutes les électrodes restent vertes.
- Plateforme informatisée de neuroréhabilitation
REMARQUE : Concevez à l’avance les 10 séances d’intervention sur la plateforme de neuroréhabilitation et préparez la plateforme pour celle-ci (voir point 2.2). Chaque séance se compose de quatre tâches d’une durée de 7 minutes chacune. Les tâches incluses dans chaque session sont indiquées dans le Tableau 2. Lors de la planification de chaque session, il est nécessaire de sélectionner parmi les paramètres de chaque tâche : durée de chaque tâche : 7 min, durée totale de la session (28 min), langue, inclure l’évaluation de l’utilisateur après chaque activité, inclure la confirmation de la fin de chaque activité à la fin de chaque tâche, et l’absence du bouton continu dans chaque tâche, puisque les tâches doivent être effectuées séquentiellement les unes après les autres (Figure 7).- Accédez à la plateforme informatisée de neuroréadaptation.
- Accédez à la session précédemment planifiée (voir étape 2.2) et appuyez sur le bouton Démarrer. Présentez quatre activités de stimulation différentes de 7 minutes chacune de manière séquentielle.
REMARQUE : La séance de stimulation cognitive a une durée totale de 30 min. Après le temps total de simulation (30 min), les activités s’arrêtent. La stimulation cognitive se poursuit pendant 5 minutes de plus après la fin de la stimulation tDCS.
- Programme de stimulation tDCS (20 min)
- Activez le démarrage de la stimulation tDCS en appuyant sur le bouton Play du logiciel de contrôle tDCS 4 min et 20 s après le début de la tâche de neuroréhabilitation informatisée.
- Après 30 secondes de rampe ascendante, la stimulation active ou simulacre commence. Appliquez la stimulation tDCS (20 min) en même temps que la tâche de neuroréhabilitation informatisée. Après 20 min., une rampe de descente commence et dure 30 s. Après ce temps, la stimulation tDCS s’arrête.
- Évaluation post-intervention du patient.
- Questionnaire sur les effets secondaires.
- Appliquez une adaptation du Questionnaire des sensations liées à la stimulation électrique transcrânienne39 (Tableau 3) avec 9 questions sur la présence de divers symptômes tels que maux de tête, brûlure sur le cuir chevelu ou sensation de démangeaisons ou de picotements sous les électrodes.
- Dans chaque élément, évaluez la gravité du symptôme sur une échelle de 1 à 4 et sa relation avec la tDCS sur une échelle de 1 à 5 (voir le tableau 3).
- Échelles visuelles analogiques pour la fatigue et l’humeur
- Administrer la même échelle que celle utilisée avant la séance de stimulation pour évaluer la fatigue et l’humeur après l’intervention (voir étape 4.2.2.).
- Questionnaire sur les effets secondaires.
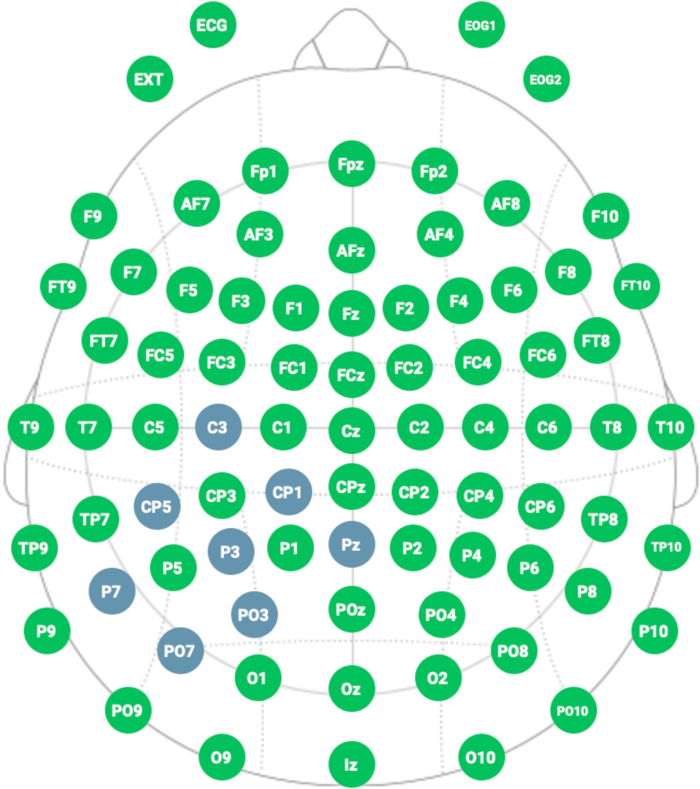
Figure 4 : Montage HD-tDCS représentatif. La couleur bleue indique l’emplacement des électrodes suivant le système international 10-20 pour le placement des électrodes. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Modèle de calcul de la HD-tDCS appliquée. La distribution du courant électrique est focalisée dans l’électrode centrale (active) (P3), limitant la stimulation à une zone spécifique par les électrodes de retour (C3, CP5, CP1, Pz, PO3, PO7, P7). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Capuchon en néoprène pour la stimulation HD-tDCS. Le capuchon a des trous pour placer les électrodes selon le système de classification 10/20 pour l’EEG. Veuillez cliquer ici pour voir une version agrandie de cette figure.
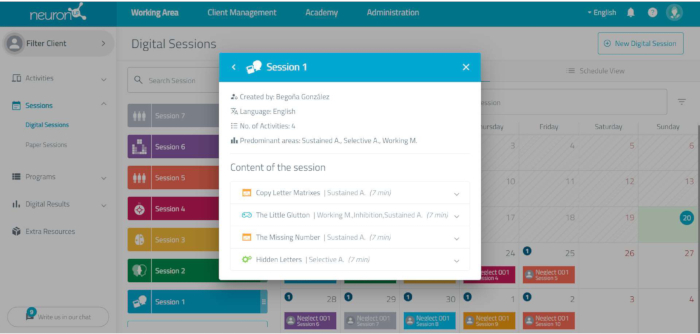
Figure 7 : Planification des tâches. Paramètres à sélectionner lors de la programmation de chaque tâche dans la plateforme de neuroréhabilitation informatisée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Bloquer | Session | Tâches de la plateforme de neuroréhabilitation | Durée |
| Je | 1, 3, 6 et 8 | · Lettres cachées | 7 min pour chacune des tâches. |
| · Somme des chiffres | |||
| · Soupe aux lettres | |||
| · Trouver des formes assorties | |||
| II | 2, 4, 7 et 9 | · Copie de matrices de lettres | |
| · Le petit carcajou | |||
| · Recherche de numéros manquants | |||
| · Comparer des textes | |||
| III | 5 et 10 | · Comparaison de texte | |
| · Somme des chiffres | |||
| · Le petit glouton | |||
| · Recherche de stimuli consécutifs |
Tableau 2 : Tâches incluses dans chacune des 10 séances d’intervention. Toutes les tâches sont incluses dans la plateforme de neuroréhabilitation informatisée.
| Avez-vous l’une des sensations ou symptômes suivants ? | Classement de la gravité (1–4) | Le cas échéant : relation avec la tDCS ? |
| 1-Absent | 1-Aucun | |
| 2-Doux | 2-Télécommande | |
| 3-Modéré | 3-Possible | |
| 4-Sévère | 4-Probable | |
| 5-Définitif | ||
| Mal de tête | ||
| Douleur au cou ou aux cervicales | ||
| Douleur au cuir chevelu | ||
| Brûlure du cuir chevelu | ||
| Sensations sous l’électrode (picotements, démangeaisons, brûlures, douleurs) | ||
| Rougeurs cutanées | ||
| Engourdissement | ||
| Problème de concentration | ||
| Sautes d’humeur aiguës | ||
| Autres (préciser) | ||
| Commentaires supplémentaires | ||
Tableau 3 : questionnaire sur les effets secondaires de la tDCS. Une liste des effets indésirables qui peuvent apparaître après l’application de la stimulation est fournie. La présence ou l’absence de chacun de ces effets est enregistrée immédiatement après l’application de la stimulation. Adaptation du questionnaire des sensations liées à la stimulation électrique transcrânienne39.
5. Retrait de la tDCS
- Une fois le programme de stimulation tDCS et les tâches de neuroréhabilitation informatisées terminés, fermez le logiciel tDCS.
- Déconnectez le périphérique tDCS.
- Retirez le câble qui relie la tDCS aux électrodes.
- Retirez le capuchon de la tête du patient.
- Retirez les électrodes du capuchon en néoprène.
- Nettoyez les cheveux du patient.
- Après avoir retiré le capuchon en néoprène, retirez le gel restant à l’aide d’un papier/serviette et lavez-le à l’eau.
- Nettoyez le capuchon et l’électrode en néoprène tDCS.
- Lavez le capuchon à l’eau pour enlever le gel restant après chaque séance et laissez-le sécher.
- Lavez les électrodes à l’eau, évitez de les frotter et séchez-les doucement avec un chiffon sec. N’utilisez jamais de savon, d’alcool ou d’autres produits pour nettoyer les électrodes.
6. Évaluation neuropsychologique et fonctionnelle post-intervention
- Le lundi, après avoir terminé l’intervention, suivez la même procédure que lors de la pré-évaluation, en administrant les mêmes tâches d’évaluation et questionnaires (voir section 3).
Résultats
L’objectif principal de la présente étude est de décrire un protocole d’intervention tDCS pour un essai clinique parallèle, randomisé et en triple aveugle. Pour étudier la faisabilité de l’intervention, le protocole a été appliqué à un seul participant ; Les résultats sont présentés dans cet article.
Nous avons appliqué le protocole d’intervention complet à un homme de 57 ans ayant un niveau d’éducation élevé (diplôme en journalisme) qui avait subi un accident vasculaire cérébral dans les ganglions de la base droite neuf mois auparavant et qui répondait à tous les critères d’inclusion pour participer à l’étude.
Les résultats avant et après l’intervention (voir le tableau 4 et la figure 8) sont présentés pour toutes les tâches administrées. Dans l’évaluation post-intervention, des changements quantitatifs ont été observés dans 6 des 13 variables mesurées, dont 4 sont directement liées à la négligence.
| Évaluations | ||
| Pré-intervention | Après l’intervention | |
| Test MMSE | 29 | 29 |
| Test des cloches | 21 | 25* |
| Test d’annulation | 24 | 28* |
| Test de dessins | 12 | 12 |
| Essai de bissection | 19.95 | 3.47* |
| Test BTA | 11 | 9 |
| Visages touchés | 11 | 9 |
| Erreurs de visage | 3 | 2* |
| Test des chiffres directs | 11 | 10 |
| Test des chiffres inverses | 9 | 8 |
| Sans moteur | 26 | 29* |
| Test de Barthel | 25 | 30* |
| CBS | 20 | 20 |
Tableau 4 : Résultats des évaluations pré et post-intervention. Les résultats de l’évaluation neuropsychologique et fonctionnelle avant et après l’intervention sont présentés par des scores directs. *Améliorations quantitatives de la performance dans l’évaluation post-intervention par rapport à la ligne de base. **Les valeurs plus éloignées du score 0 indiquent une moins bonne performance et une plus grande négligence.

Figure 8 : Résultats de l’évaluation avant et après l’intervention. Des valeurs plus élevées indiquent un changement positif, sauf dans le test de bissection de droite, où l’amélioration est représentée par des scores plus faibles. Les résultats sont présentés sous forme de scores directs. *Améliorations quantitatives de la performance dans l’évaluation post-intervention par rapport à la ligne de base. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le pourcentage d’amélioration entre l’évaluation avant et après le traitement a été calculé. Une amélioration clinique a été observée dans les tests spécifiques de négligence hémispatiale : test de Bells, test d’annulation, bissection de ligne, test de perception visuelle sans moteur et échelle d’indice de Barthel. D’autre part, des changements négatifs ont été observés dans d’autres tâches attentionnelles (test des doigts, test bref de l’attention, test du visage). Enfin, aucun changement n’est apparu dans le MMSE, la copie des dessins ou l’échelle fonctionnelle de Catherine Bergego (CBS) (voir la figure 9).

Figure 9 : Pourcentage de changement entre l’évaluation initiale et l’évaluation post-intervention. Les résultats sont exprimés en pourcentage. Les scores positifs indiquent un changement positif, sauf dans le test de bissection de ligne, où l’amélioration est représentée par des scores négatifs. *Pourcentage d’amélioration positive lorsque l’on compare les évaluations avant et après l’intervention. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les procédures d’étude ont été réalisées dans des salles spacieuses équipées pour le bon déroulement des séances d’évaluation et d’intervention et le respect des mesures de sécurité et d’hygiène.
Quant au patient, il n’a manifesté de fatigue dans aucune des séances de pré et post-évaluation, il n’a donc pas été nécessaire de se reposer dans aucune d’entre elles. Le traitement a été évalué par le patient comme étant divertissant et stimulant, ce qui a amélioré l’observance du traitement et la collaboration active tout au long de la procédure. Par conséquent, il est considéré que le protocole aurait une grande faisabilité, et nous poursuivrons l’étude en suivant la procédure établie.
En termes d’inconfort et d’effets secondaires, le participant n’a ressenti aucun effet secondaire modéré ou sévère lié à l’application de la tDCS.
Discussion
La négligence hémispatiale est une conséquence cognitive fréquente de l’AVC et, lorsqu’elle persiste, elle a tendance à avoir un impact négatif sur l’efficacité du processus de réadaptation. L’efficacité et l’efficience des approches thérapeutiques disponibles peuvent être améliorées en incluant des techniques de stimulation cérébrale non invasives dans la neuroréadaptation, à la recherche d’un effet synergique 40,41. Ainsi, grâce à la tDCS, nous pouvons augmenter l’efficacité de l’intervention conventionnelle, en obtenant une meilleure récupération, des temps de rééducation plus courts et de meilleurs résultats fonctionnels dans la réadaptation du patient victime d’un AVC par rapport à une intervention conventionnelle isolée. La recherche sur le potentiel de la tDCS dans les troubles neurologiques et psychiatriques a augmenté de façon exponentielle au cours de la dernière décennie 42,43,44,45,46,47,48,49.
De plus, le coût de la tDCS est abordable et l’appareil est portable, ce qui le rend hautement évolutif, ce qui permet son application à la fois dans les cliniques externes et les hôpitaux, avec la formation professionnelle requise50.
Nous avons constaté une amélioration après le traitement dans quatre des treize tests administrés (test de cloches, test d’annulation, section de la ligne, test de perception visuelle sans moteur). Les tests où nous avons observé ces changements positifs sont liés aux performances associées à la négligence hémispatiale. D’autre part, une stabilisation a été observée dans la réalisation de certains tests liés aux performances cognitives générales, aux processus attentionnels et/ou à la mémoire de travail (MMSE, dessins, CBS). Une réduction a été observée dans la performance de certaines autres tâches (BTA, Faces, chiffres directs et inverses).
En ce qui concerne les échelles fonctionnelles, il y avait des preuves d’amélioration, signalées par le principal dispensateur de soins et évaluées par l’échelle de l’indice de Barthel. L’échelle fonctionnelle de la SCS, qui est directement liée à l’impact de la négligence sur la vie quotidienne, a également été administrée et, dans ce cas, aucun changement n’a été mis en évidence, demeurant stable par rapport à l’évaluation précédente. Dans cette étude, nous avons constaté les bénéfices du traitement combiné pour certains domaines cognitifs mais pas pour d’autres. Ces résultats sont cohérents avec l’idée que le traitement pourrait être plus bénéfique pour certains domaines attentionnels 51,52,53,54,55,56,57. Certaines études montrent comment des protocoles spécifiques de tDCS induisent des altérations durables de l’excitabilité et de l’activité corticales58. Afin de pouvoir analyser le maintien des changements au-delà d’une semaine, il serait conseillé de réaliser un nouveau bilan après une période de temps plus longue 53,54,55,56,57.
La tDCS haute définition ou haute résolution, utilisée dans cette étude, est une version techniquement améliorée de la tDCS qui permet d’augmenter la focalité de la stimulation en utilisant un anneau d’électrodes de retour autour d’une anode ou d’une cathode pour augmenter ou diminuer, respectivement, l’excitabilité corticale d’une manière beaucoup plus focale59. Sur la base de cette focale élevée et de la tolérabilité et des effets antérieurs de l’étude HD-tDCS de Borckardt et al.60, l’utilisation de la HD-tDCS a augmenté ces dernières années.
Des études de modélisation indiquent que cette configuration d’électrode génère l’intensité de champ électrique (FE) la plus élevée sous l’électrode cible, le flux de courant cérébral étant limité par le rayon de la configuration de l’anneau 4 x 1 et, par conséquent, un champ électrique plus important sur la cible sélectionnée par rapport au placement d’électrode conventionnel 60,61,62. Les électrodes de retour contribuent à isoler la zone ciblée, ce qui permet une stimulation cérébrale plus ciblée et produit des effets plus durables que la tDCS63 conventionnelle.
De plus, selon certaines études, la HD-tDCS a des effets plus durables. Dernièrement, la recherche clinique s’est intéressée à ce protocole. À notre connaissance, seules six études ont été menées avec la HD-tDCS dans les maladies neurologiques, trois essais contrôlés randomisés, deux rapports ouverts et un rapport de cas (voir la revue49).
Bien qu’il n’y ait pas de consensus total sur les zones anatomiques liées à la négligence hémispatiale, il semble y avoir un certain accord sur certaines zones spécifiques. Le cortex pariétal postérieur semble être la zone clé de l’altération 64,65,66, et à l’intérieur de cette zone, le gyrus angulaire 64,65,67,68,69, le sillon intrapariétal 64,69,70, la jonction temporopariétale 69,71 et le gyrus supramarginal65,72,73,74.
Étant donné que l’avantage de la HD-tDCS par rapport à la tDCS conventionnelle est d’augmenter la précision de la cible de stimulation et sur la base de la connaissance d’une localisation précise de la présence de négligence hémispatiale, on peut s’attendre à obtenir des avantages plus importants de la stimulation focale par rapport à une stimulation plus générale ou diffuse. Pendant ce temps, la configuration la plus utilisée dans les études de neurologie est le montage 4 x 1 75,76,77,78,79. Dans notre étude, nous avons utilisé une configuration 7 x 1 dans le but d’augmenter encore plus la focalité de la stimulation, étant la première étude utilisant ce montage dans la réhabilitation clinique de la négligence. Par conséquent, d’autres recherches doivent être menées dans cette condition clinique et dans d’autres conditions cliniques pour déterminer la supériorité ou l’efficacité de ce montage HD-tDCS par rapport à d’autres montages HD et tDCS conventionnels.
En ce qui concerne l’intensité, 2 mA sont appliqués dans ce protocole, comme dans la plupart des études avec tDCS, quel que soit le montage ou la configuration utilisée. Il serait intéressant de comparer le même protocole avec des intensités plus faibles et plus élevées dans d’autres études pour déterminer l’effet des différentes intensités appliquées.
Certaines recommandations utiles en matière de sécurité et de dépannage technique doivent être prises en compte avec le protocole actuel. Chez chaque patient, mais surtout chez les patients victimes d’un AVC, les problèmes de sécurité doivent être soigneusement évalués. Bien que la tDCS chez les patients victimes d’un AVC soit sûre et bien tolérée80, les patients et leurs familles ont parfois des doutes à ce sujet. Ainsi, des informations compréhensibles doivent être transmises à l’avance et discutées avec le patient et ses proches, en veillant à ce qu’ils comprennent la procédure et puissent abandonner le protocole quand ils le souhaitent.
D’autre part, dans ce protocole, l’emplacement exact de la lésion a été considéré et enregistré, car nous sommes prêts à comparer l’effet du protocole sur la négligence hémispatiale après des lésions corticales (par exemple, l’artère cérébrale moyenne droite)69 et après des lésions sous-corticales (par exemple, les ganglions de la base)81. Dans ce contexte, il est crucial d’évaluer l’efficacité de la technique à la lumière de l’hétérogénéité des localisations des lésions. Plus précisément, nous devons analyser les variations d’efficacité concernant les lésions corticales par rapport aux lésions sous-corticales.
En ce qui concerne la phase de l’AVC, lors de l’application de la stimulation (aiguë, subaiguë ou chronique), il est important de connaître le moment où l’intervention pourrait être la plus bénéfique. Dans cette étude, nous avons utilisé comme critère d’inclusion 3 à 12 mois depuis la blessure (phase subaiguë). Cependant, une revue systématique précédente s’est concentrée sur les aspects moteurs après un AVC, et les résultats ont montré des améliorations dans les phases chroniques, mais pas dans la phase aiguë (dans les 3 premiers jours suivant l’apparition des symptômes)82. Des recherches plus approfondies sont nécessaires pour explorer les avantages de la tDCS sur les altérations cognitives post-AVC et pour identifier les facteurs qui prédisent son efficacité optimale à différents stades de la récupération.
Les connaissances actuelles sur la HD-tDCS en tant qu’approche thérapeutique dans les maladies neurologiques soutiennent sa tolérabilité et son efficacité clinique. En outre, d’autres recherches contrôlées randomisées sont nécessaires pour déterminer les paramètres optimaux dans chaque maladie et chaque patient afin d’établir l’efficacité de cette technique de stimulation cérébrale non invasive dans les troubles neurologiques et au-delà.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions NeuronUp (www.neuronup.com) pour son soutien et sa collaboration désintéressée dans ce projet.
matériels
| Name | Company | Catalog Number | Comments |
| 10 electrode cable | Neuroelectrics | NE017 | |
| Barthel Index | N/A | Mahoney, F. I., Barthel, D. W. Functional evaluation: The Barthel Index. Md State Med J. 14, 61–65 (1965). | |
| Copy of drawings subtest | N/A | https://test-barcelona.com/es/tienda.html | J. Peña Casanova, Programa integrado de exploración neuropsicológica: test Barcelona revisado?: TBR. Barcelona: Masson. |
| Curved Syrenge | Neuroelectrics | NE014 | |
| Electrode Gel | Neuroelectrics | NE016a | |
| Line bisection test | N/A | Schenkenberg, T., Bradford, D. C., Ajax, E. T. Line bisection and unilateral visual neglect in patients with neurologic impairment. Neurology. 30 (5) 509–517 (1980). | |
| Mini-mental state examination (MMSE) | N/A | Folstein, M. F., Folstein, S. E., McHugh, P. R. “Mini-mental state”. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res. 12 (3) 189–198 (1975). | |
| Neoprene headcap | Neuroelectrics | NE019-M | |
| Saline Solution | Neuroelectrics | NE033 | |
| Satrstim Necbox | Neuroelectrics | NE012 | |
| Starstim tES-EEG System | Neuroelectrics | ||
| Teastboard Cable | Neuroelectrics | NE039 | |
| Testboard Head | Neuroelectrics | NE038 | |
| The Bell Test | N/A | https://strokengine.ca/en/assessments/bells-test/ | L. Gauthier, F. Deahault and Y. Joanette, The Bells Test: A quantitative and qualitative test for visual neglect (Vol. 11). |
| The Catherine Bergego Scale | N/A | Azouvi, P. et al. Behavioral assessment of unilateral neglect: study of the psychometric properties of the Catherine Bergego Scale. Arch Phys Med Rehabil. 84 (1) 51–57 (2003). | |
| The motor-free visual perception test (MVPT) | N/A | https://www.wpspublish.com/mvpt-4-motor-free-visual-perception-test-4 | Colarusso, R. P., Hammill, D.D. The Motor Free Visual Perception Test (MVPT-3). Navato, CA: Academic Therapy Publications (2003). |
| USB Bluetooth Dongle | Neuroelectrics | NE031 | |
| USB charging Cable | Neuroelectrics | NE043 | |
| USB Power Adapter & Power Supply Plug | Neuroelectrics | NE013 & NE013a, NE013b, NE013c | |
| USB Stick with Manuals & NIC SW | Neuroelectrics | NE015 |
Références
- Sun, J. -H., Tan, L., Yu, J. -T. Post-stroke cognitive impairment: epidemiology, mechanisms and management. Ann Transl Med. 2 (8), 80(2014).
- Abo, M., et al. comparative study of NEURO versus CIMT in poststroke patients with upper limb hemiparesis: the neuro-verify study. Int J Stroke. 9 (5), 607-612 (2014).
- Mijajlović, M. D., et al. Post-stroke dementia - a comprehensive review. BMC Med. 15 (1), 11(2017).
- Kerkhoff, G., Schenk, T. Rehabilitation of neglect: an update. Neuropsychologia. 50 (6), 1072-1079 (2012).
- Jehkonen, M., et al. Predictors of discharge to home during the first year after right hemisphere stroke. Acta Neurol Scand. 104 (3), 136-141 (2001).
- Buxbaum, L. J., et al. Hemispatial neglect: subtypes, neuroanatomy, and disability. Neurology. 62 (5), 749-756 (2004).
- Nijboer, T. C. W., Kollen, B. J., Kwakkel, G. Time course of visuospatial neglect early after stroke: a longitudinal cohort study. Cortex. 49 (8), 2021-2027 (2013).
- Ringman, J. M., Saver, J. L., Woolson, R. F., Clarke, W. R., Adams, H. P. Frequency, risk factors, anatomy, and course of unilateral neglect in an acute stroke cohort. Neurology. 63 (3), 468-474 (2004).
- Parton, A., Malhotra, P., Husain, M. Hemispatial neglect. J Neurol Neurosurg Psychiatry. 75 (1), 13-21 (2004).
- Stone, S. P., Patel, P., Greenwood, R. J., Halligan, P. W. Measuring visual neglect in acute stroke and predicting its recovery: the visual neglect recovery index. J Neurol Neurosurg Psychiatry. 55 (6), 431(1992).
- Chen, P., Hreha, K., Kong, Y., Barrett, A. M. Impact of spatial neglect on stroke rehabilitation: evidence from the setting of an inpatient rehabilitation facility. Arch Phys Med Rehabil. 96 (8), 1458-1466 (2015).
- Wilkinson, D., Sakel, M., Camp, S. -J., Hammond, L. Patients with hemispatial neglect are more prone to limb spasticity, but this does not prolong their hospital stay. Arch Phys Med Rehabil. 93 (7), 1191-1195 (2012).
- Gammeri, R., Iacono, C., Ricci, R., Salatino, A. Unilateral spatial neglect after stroke: current insights. Neuropsychiatr Dis Treat. 16, 131-152 (2020).
- Muñoz-Marrón, E., Redolar-Ripoll, D., Zulaica-Cardoso, A. New therapeutic approaches in the treatment of neglect: transcranial magnetic stimulation. Rev Neurol. 55 (5), 297-305 (2012).
- Cicerone, K. D., et al. Evidence-based cognitive rehabilitation: systematic review of the literature from 2009 through 2014. Arch Phys Med Rehabil. 100 (8), 1515-1533 (2009).
- Pizzamiglio, L., et al. Cognitive rehabilitation of the hemineglect disorder in chronic patients with unilateral right brain damage. J Clin Exp Neuropsychol. 14 (6), 901-923 (1992).
- Yi, Y., et al. The effect of transcranial direct current stimulation on neglect syndrome in stroke patients. Ann Rehabil Med. 40 (2), 223-229 (2016).
- Fregni, F., Pascual-Leone, A. Technology insight: noninvasive brain stimulation in neurology-perspectives on the therapeutic potential of rTMS and tDCS. Nat Rev Neurol. 3 (7), 383-393 (2007).
- Lefaucheur, J. -P., et al. Evidence-based guidelines on the therapeutic use of transcranial direct current stimulation (tDCS). Clin Neurophysiol. 128 (1), 56-92 (2017).
- González-Rodriguez, B., Serradell-Ribé, N., Viejo-Sobera, R., Romero-Muñoz, J. P., Marron, E. M. Transcranial direct current stimulation in neglect rehabilitation after stroke: a systematic review. J Neurol. 269 (12), 6310-6329 (2022).
- Kinsbourne, M. A model for the mechanism of unilateral neglect of space. Trans Am Neurol Assoc. 95, 143-146 (1970).
- Kinsbourne, M. Hemi-neglect and hemisphere rivalry. Adv Neurol. 18, 41-49 (1977).
- Koch, I. Instruction effects in task switching. Psychon Bull Rev. 15 (2), 448-452 (2008).
- Corbetta, M., Kincade, M. J., Lewis, C., Snyder, A. Z., Sapir, A. Neural basis and recovery of spatial attention deficits in spatial neglect. Nat Neurosci. 8 (11), 1603-1610 (2005).
- Hummel, F. C., Cohen, L. G. Noninvasive brain stimulation: a new strategy to improve neurorehabilitation after stroke. Lancet Neurol. 5 (8), 708-712 (2006).
- Miniussi, C., et al. Efficacy of repetitive transcranial magnetic stimulation/transcranial direct current stimulation in cognitive neurorehabitation. Brain Stimul. 1 (4), 326-336 (2008).
- Bornheim, S., Maquet, P., Croisier, J., Crielaard, J., Kaux, J. Motor cortex transcranial direct current stimulation (tDCS) improves acute stroke visuo-spatial neglect: a series of four case reports. Brain Stimul. 11 (2), 459-461 (2018).
- Sunwoo, H., et al. Effects of dual transcranial direct current stimulation on post-stroke unilateral visuospatial neglect. Neurosci Lett. 554, 94-98 (2013).
- Ladavas, E., et al. A-tDCS on the ipsilesional parietal cortex boosts the effects of prism adaptation treatment in neglect. Restor Neurol Neurosci. 33 (5), 647-662 (2015).
- Turgut, N., Miranda, M., Kastrup, A., Eling, P., Hildebrandt, H. tDCS combined with optokinetic drift reduces egocentric neglect in severely impaired post-acute patients. Neuropsychol Rehabil. 28 (4), 515-526 (2018).
- Smit, M., et al. Transcranial direct current stimulation to the parietal cortex in hemispatial neglect: a feasibility study. Neuropsychologia. 74, 152-161 (2015).
- Brem, A. -K., Unterburger, E., Speight, I., Jancke, L. Treatment of visuospatial neglect with biparietal tDCS and cognitive training: a single-case study. Front Syst Neurosci. 8, 180-180 (2014).
- Cappon, D., Jahanshahi, M., Bisiacchi, P. Value and efficacy of transcranial direct current stimulation in the cognitive rehabilitation: a critical review since 2000. Front Neurosci. 10, 157(2016).
- Fan, J., Li, Y., Yang, Y., Qu, Y., Li, S. Efficacy of noninvasive brain stimulation on unilateral neglect after stroke: a systematic review and meta-analysis. Am J Phys Med Rehabil. 97 (4), 261-269 (2018).
- Kashiwagi, F. T., et al. Noninvasive brain stimulations for unilateral spatial neglect after stroke: a systematic review and meta-analysis of randomized and nonrandomized controlled trials. Neural Plast. , (2018).
- Salazar, A. P. S., et al. Noninvasive brain stimulation improves hemispatial neglect after stroke: a systematic review and meta-analysis. Arch Phys Med Rehabil. 99 (2), 355-366 (2018).
- Zebhauser, P. T., Vernet, M., Unterburger, E., Brem, A. -K. Visuospatial neglect-a theory-informed overview of current and emerging strategies and a systematic review on the therapeutic use of noninvasive brain stimulation. Neuropsychol Rev. 29 (4), 397-420 (2019).
- Bikson, M., et al. Safety of transcranial direct current stimulation: evidence based update 2016. Brain Stimul. 9 (5), 641-661 (2016).
- Antal, A., et al. Low intensity transcranial electric stimulation: safety, ethical, legal regulatory and application guidelines. Clin Neurophysiol. 128 (9), 1774-1809 (2017).
- Sathappan, A. V., Luber, B. M., Lisanby, S. H. The dynamic duo: combining noninvasive brain stimulation with cognitive interventions. Prog Neuropsychopharmacol Biol Psychiatry. 89, 347-360 (2019).
- Draaisma, L. R., Wessel, M. J., Hummel, F. C. Noninvasive brain stimulation to enhance cognitive rehabilitation after stroke. Neurosci Lett. 719, 133678(2020).
- David, M. C. M. M., Moraes, A. A., de Costa, M. L., da Franco, C. I. F. Transcranial direct current stimulation in the modulation of neuropathic pain: a systematic review. Neurol Res. 40 (7), 557-565 (2018).
- Dondé, C., et al. Transcranial direct-current stimulation (tDCS) for bipolar depression: a systematic review and meta-analysis. Prog Neuropsychopharmacol Biol Psychiatry. 78, 123-131 (2017).
- Gowda, S. M., et al. Efficacy of pre-supplementary motor area transcranial direct current stimulation for treatment resistant obsessive compulsive disorder: a randomized, double blinded, sham controlled trial. Brain Stimul. 12 (4), 922-929 (2019).
- Kang, N., Summers, J. J., Cauraugh, J. H. Transcranial direct current stimulation facilitates motor learning post-stroke: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry. 87 (4), 345-355 (2016).
- Narayanaswamy, J. C., et al. Successful application of add-on transcranial direct current stimulation (tDCS) for treatment of SSRI resistant OCD. Brain Stimul. 8 (3), 655-657 (2015).
- Osoegawa, C., et al. Noninvasive brain stimulation for negative symptoms in schizophrenia: an updated systematic review and meta-analysis. Schizophr Res. 197, 34-44 (2018).
- Vacas,, et al. Noninvasive brain stimulation for behavioural and psychological symptoms of dementia: a systematic review and meta-analysis. Int J Geriatr Psychiatry. 34 (9), 1336-1345 (2019).
- Parlikar, R., et al. High definition transcranial direct current stimulation (HD-tDCS): a systematic review on the treatment of neuropsychiatric disorders. Asian J Psychiatry. 56, 102542(2021).
- Fried, P. J., et al. Training in the practice of noninvasive brain stimulation: recommendations from an IFCN committee. Clin Neurophysiol. 132 (3), 819-837 (2021).
- Cappa, S. F., et al. EFNS guidelines on cognitive rehabilitation: report of an EFNS task force. Eur J Neurol. 12 (9), 665-680 (2005).
- Sturm, W., Willmes, K., Orgass, B., Hartje, W. Do specific attention deficits need specific training. Neuropsychol Rehabil. 7 (2), 81-103 (1997).
- Verveer, I., Remmerswaal, D., Van der Veen, F. M., Franken, I. H. A. Long-term tDCS effects on neurophysiological measures of cognitive control in tobacco smokers. Biol Psychol. 156, 107962(2020).
- Katz, B., et al. Individual differences and long-term consequences of tDCS-augmented cognitive training. J Cogn Neurosci. 29 (9), 1498-1508 (2017).
- Gu, J., et al. The effect and mechanism of transcranial direct current stimulation on episodic memory in patients with mild cognitive impairment. Front Neurosci. 16, 811403(2022).
- Zhou, Y., et al. Efficacy and safety of transcranial direct current stimulation (tDCS) on cognitive function in chronic schizophrenia with tardive dyskinesia (TD): a randomized, double-blind, sham-controlled, clinical trial. BMC Psychiatry. 23 (1), 623(2023).
- Au, J., et al. Enhancing working memory training with transcranial direct current stimulation. J Cogn Neurosci. 28 (9), 1419-1432 (2016).
- Stagg, C. J., Antal, A., Nitsche, M. A. Physiology of transcranial direct current stimulation. J ECT. 34 (3), 144-152 (2018).
- Da Silva Machado, D. G., et al. Acute effect of high-definition and conventional tDCS on exercise performance and psychophysiological responses in endurance athletes: a randomized controlled trial. Sci Rep. 11, 13911(2021).
- Borckardt, J. J., et al. A pilot study of the tolerability and effects of high-definition transcranial direct current stimulation (HD-tDCS) on pain perception. J Pain. 13 (2), 112-120 (2012).
- Villamar, M. F., et al. Technique and considerations in the use of 4x1 ring high-definition transcranial direct current stimulation (HD-tDCS). J Vis Exp. (77), e50309(2013).
- Effects of electrode configurations and injected current intensity on the electrical field of transcranial direct current stimulation: a simulation study. Mackenbach, C., Tian, R., Yang, Y. Annu Int Conf IEEE Eng Med Biol Soc, , 3517-3520 (2020).
- Bikson, M., Datta, A., Rahman, A., Scaturro, J. Electrode montages for tDCS and weak transcranial electrical stimulation: role of "return" electrode's position and size. Clin Neurophysiol. 121 (12), 1976-1978 (2010).
- Chambers, C. D., Stokes, M. G., Mattingley, J. B. Modality-specific control of strategic spatial attention in parietal cortex. Neuron. 44 (6), 925-930 (2004).
- Chambers, C. D., Payne, J. M., Mattingley, J. B. Parietal disruption impairs reflexive spatial attention within and between sensory modalities. Neuropsychologia. 45 (8), 1715-1724 (2007).
- Chambers, C. D., Mattingley, J. B. Neurodisruption of selective attention: insights and implications. Trends Cogn Sci. 9 (11), 542-550 (2005).
- Rushworth, M. F., Ellison, A., Walsh, V. Complementary localization and lateralization of orienting and motor attention. Nat Neurosci. 4 (6), 656-661 (2001).
- Hillis, A. E., et al. Anatomy of spatial attention: insights from perfusion imaging and hemispatial neglect in acute stroke. J Neurosci. 25 (12), 3161-3167 (2005).
- Mort, D. J., et al. The anatomy of visual neglect. Brain. 126 (9), 1986-1997 (2003).
- Mannan, S. K., et al. Revisiting previously searched locations in visual neglect: role of right parietal and frontal lesions in misjudging old locations as new. J Cogn Neurosci. 17 (2), 340-354 (2005).
- Vallar, G. Extrapersonal visual unilateral spatial neglect and its neuroanatomy. Neuroimage. 14 (1 Pt 2), S52-S58 (2001).
- Oliveri, M., Vallar, G. Parietal versus temporal lobe components in spatial cognition: setting the mid-point of a horizontal line. J Neuropsychol. 3 (2), 201-211 (2009).
- Committeri, G., et al. Neural bases of personal and extrapersonal neglect in humans. Brain. 130 (Pt 2), 431-441 (2007).
- Doricchi, F., Tomaiuolo, F. The anatomy of neglect without hemianopia: a key role for parietal-frontal disconnection. Neuroreport. 14 (17), 2239-2243 (2003).
- Fiori, V., Nitsche, M. A., Cucuzza, G., Caltagirone, C., Marangolo, P. High-definition transcranial direct current stimulation improves verb recovery in aphasic patients depending on current intensity. Neuroscience. 406, 159-166 (2019).
- Karvigh, S. A., Motamedi, M., Arzani, M., Roshan, J. H. N. HD-tDCS in refractory lateral frontal lobe epilepsy patients. Seizure. 47, 74-80 (2017).
- Meiron, O., et al. Antiepileptic effects of a novel noninvasive neuromodulation treatment in a subject with early-onset epileptic encephalopathy: case report with 20 sessions of HD-tDCS intervention. Front Neurosci. 13, (2019).
- Reckow, J., et al. Tolerability and blinding of 4x1 high-definition transcranial direct current stimulation (HD-tDCS) at two and three milliamps. Brain Stimul. 11 (5), 991-997 (2018).
- Motes, M. A., et al. High-definition transcranial direct current stimulation to improve verbal retrieval deficits in chronic traumatic brain injury. J Neurotrauma. 37 (1), 170-177 (2020).
- Russo, C., Souza Carneiro, M. I., Bolognini, N., Fregni, F. Safety review of transcranial direct current stimulation in stroke. Neuromodulation. 20 (3), 215-222 (2017).
- Hochstenbach, J., Van Spaendonck, K. P., Cools, A. R., Horstink, M. W., Mulder, T. Cognitive deficits following stroke in the basal ganglia. Clin Rehabil. 12 (6), 514-520 (1998).
- Marquez, J., Van Vliet, P., McElduff, P., Lagopoulos, J., Parsons, M. Transcranial direct current stimulation (tDCS): does it have merit in stroke rehabilitation? A systematic review. Int J Stroke. 10 (3), 306-316 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon