Method Article
ミクログリアによる網膜オルガノイドの組み立て
要約
ミクログリアは、網膜に特異的に存在した免疫細胞であり、さまざまな網膜変性疾患において重要な役割を果たしています。網膜オルガノイドとミクログリアの共培養モデルを作成することで、網膜疾患の病因と発症の進行の理解を深めることができます。
要約
ヒトの網膜へのアクセスが限られているため、網膜オルガノイド(RO)はヒトの網膜疾患を研究するための最良のモデルであり、網膜の発達のメカニズムと網膜疾患の発生を明らかにする可能性があります。ミクログリア(MG)は、網膜および中枢神経系(CNS)に特異的に常在するマクロファージであり、重要な免疫機能を果たしています。しかし、レチナールオルガノイドは、分化の起源が卵黄嚢であるため、ミクログリアを欠いています。これらの網膜疾患におけるミクログリアの特異的な病因は不明のままです。したがって、ミクログリアに組み込まれた網膜オルガノイドモデルの確立が必要であることが判明しました。本研究では、ヒト幹細胞由来のミクログリアを用いたレチナールオルガノイドの共培養モデルの構築に成功しました。本稿では、ミクログリアを分化させた上で、初期段階で網膜オルガノイドに共培養しました。免疫細胞を組み込むこのモデルは、網膜疾患モデリングと薬物スクリーニングに最適化されたプラットフォームを提供し、網膜およびCNS関連疾患の病因と治療に関する詳細な研究を促進します。
概要
ヒト網膜の限られた供給源として、ヒト幹細胞の三次元(3D)網膜オルガノイドへの分化は、網膜1をシミュレートするための有望なin vitroモデルを表しています。それは、光受容体、網膜神経節細胞、双極細胞、ミュラー細胞、水平細胞、および星状細胞2を含む、網膜内の異なる細胞タイプを含む。このモデルにより、網膜の発達メカニズムと網膜疾患の病因の両方をエミュレートし、研究することができます。しかし、方向性分化法により、網膜オルガノイドは神経外胚葉3に由来し、卵黄嚢のミクログリアや中胚葉の血管周囲細胞など、異なる胚葉に由来する他の多くの細胞型を欠いていました4,5,6。
現在、網膜色素変性症7、緑内障8、網膜芽細胞腫9など、多くの網膜疾患が網膜内のミクログリアと密接に関連していることが証明されています。しかし、適切な研究モデルがないため、ミクログリアとこれらの疾患との関係を示す具体的なメカニズムはまだ不明です。マウスは網膜疾患の研究に有利なモデルとして機能してきましたが、最近の研究では、寿命、増殖率、およびヒトの相同遺伝子の欠如の点で、マウスとヒトのミクログリアの間に有意な違いがあることが強調されています10,11。これらの知見は、マウスモデルから導き出された結論が完全に信頼できるわけではないことを示唆しており、ミクログリアを含むヒト網膜オルガノイドを構築することの重要性を強調しています。
過去数十年にわたり、網膜オルガノイドの3D分化のための様々な方法が開発されてきた12,13。網膜オルガノイド内でのミクログリアの共培養操作を容易にするために、接着培養から浮遊培養への移行を含む分化方法を選択しました。このアプローチにより、ミクログリアを網膜オルガノイドに組み込むことに成功し、少なくとも60日間維持することができます14。
プロトコル
この研究は、首都医科大学北京同仁病院の制度倫理委員会によって承認されました。HESCs細胞株H9はWiCell Research Instituteに由来します。実験前に、細胞培養培地を室温(RT)で30分間予温します。
1. ヒトミクログリアの生成
- 細胞密度が80%〜90%に達するまで、幹細胞培地でhESCを培養します。各ウェルに少なくとも1 x 106 個の細胞を播種します。
- 幹細胞培地を吸引し、1x DPBS(1 mL/ウェル6ウェルプレート)で細胞をすすぎます。次の手順では、2 x 107-1 x 108 セルが必要です。十分でない場合は、2〜5ウェルのセルを組み合わせて、次の手順を実行します。
- 0.5 mM EDTA溶液を37 °Cインキュベーター(1 mL/ウェル6ウェルプレート)で約5分間使用して、幹細胞コロニーを解離します。
- 5分後にコロニーの形態を確認します。コロニーの端がわずかに丸まって隙間が緩くなっている場合、細胞は分化してEDTAを吸引する準備ができています。そうでない場合は、細胞を37°Cでさらに1〜2分間インキュベートします。8分以上インキュベートしないでください。
- 6 mLの培地A(表1)と6 μLの10 mM ROCK阻害剤Y-27632溶液を使用して、各ウェルの細胞を穏やかにすすぎます。皿の底を軽くたたいて、細胞をすすぎます。日を 0 日に設定します。
注:セルをピペットで動かさないでください。細胞は翌日に胚様体(EB)を形成します。 - 24時間後、顕微鏡で細胞を観察し、EB形成を確認します。EBを10 mLピペットで15 mL遠心チューブに集め、EBが5分で底に落ち着くのを待ちます。
- 上清を慎重に吸引し、EBを6 mLの新鮮な培地Aで再懸濁し、6ウェルプレートの新しい低接着ウェルに移します。37°Cのインキュベーターで培養します。
注:1日目のウェルトランスファーの目的は、細胞増殖の状態に影響を与える可能性のあるEB形成の過程で多数の死細胞の影響を減らすことです。 - 新鮮な培地Aを4日目まで毎日更新します(6 mL /ウェル6ウェルプレート)。
- 4日目に、10cmの皿に3mLの0.1%魚ゼラチン溶液を5%CO2、37°Cのインキュベーターで少なくとも1時間コーティングします。
注:コーティング時間が1時間未満の場合、次の手順を実行することは困難です。 - EBを10 mLピペットで15 mL遠心チューブに慎重に収集し、EBが5分で底に落ち着くのを待ちます。
- 0.1%ゼラチン溶液を取り出し、10cmの皿を5〜6mLの1x DPBSで1回すすぎます。DPBSを取り外します。
- 15 mLの遠心チューブに15 mLの培地B(表1)でEBを静かに再懸濁し、コーティングされた10 cmディッシュに移します。37°C、5%CO2 インキュベーターで1週間培養します。
注意: 最初の7日間は、皿を動かさないでください。 - 週に一度、49日目まで新鮮な培地B(15 mL / 10 cm皿)でリフレッシュし、週に1回顕微鏡で細胞を検査します。
注:49日目以降、培養皿の上清にいくつかの分泌細胞が見つかる。 - 上清細胞を200 x g で室温で5分間遠心分離します。
- 上清を慎重に吸引し、2 mLの新鮮な培地Bで細胞を再懸濁し、6ウェルプレートの新しい低接着ウェルに移します。5% CO2, 37 °Cインキュベーターでインキュベートします。
注意: 次の7日間は、プレートを動かさないでください。ミクログリアは、低接着性の井戸の底に付着する可能性があります。 - 56日目に、ミディアムC(表1)(2 mL/ウェル6ウェルプレート)と交換します。ミクログリアは低接着ウェルの底に付着し、顕微鏡下で分岐して見えます。
注:3日ごとにミディアムC(2 mL /ウェル6ウェルプレート)を交換することにより、ミクログリアをミディアムCで約15日間培養することができました。
2. ヒトROsの生成とミクログリアとの共培養
- 細胞密度が80%〜90%に達するまで、幹細胞培地でhESCを培養しました。各ウェルに少なくとも1 x 106 個の細胞を播種します。
- ディスパーゼ(1 mL/ウェル6ウェルプレート)を培養細胞に加えます。37°Cで5分間インキュベートします。ディスパーゼ溶液を井戸から吸引します。
- ミディアムD(表1)(1 mL/6ウェルプレート入り)をウェルに加えます。10μLのピペットで細胞を細かく切断します。
- すべての細胞片と培地を1.5 mLの微量遠心チューブに静かに集めます。
- 200 x g で5分間遠心分離し、上清を除去します。
- 細胞を200 μLのコールドマトリックスに穏やかに再懸濁します。1.5マイクロ遠心チューブをインキュベーターに20分間移動させます。マトリックスは室温(RT)で固化するため、高速に動作します。インキュベーター内で20分後、マトリックスは固化します。
- 15 mLのミディアムDで10 cmのディッシュを準備し、ミディアムDでマトリックスを再懸濁し、ペトリディッシュを静かに振ってください。
- その後、皿をインキュベーターに5日間入れます。プレートを動かさないでください。日を 0 日目 (RO) として設定します。細胞は3日で接着します。
- 5日目(RO)と10日目(RO)に、ミディアムDでメディウムを更新します。
- 12日目(RO)に、培地を取り出し、各ディッシュに3 mLのディスパーゼを5分間加えます。
- ディスパーゼを吸引し、15 mLの培地Eを加えます(表1)。
- ミクログリアの収穫:56日目(MG)に、Medium Cを穏やかに吸引し、Accutase(1 mL/ウェル、6ウェルプレート)を加え、37°Cで3分間インキュベートします。
- ミクログリア細胞を5mLピペット付きの15mL遠心チューブに集めます。細胞を200 x g で室温で5分間遠心分離します。
- 上清を穏やかに吸引し、ミクログリアを1 mLの培地Eで懸濁します。12日目に消化したROにミクログリアを追加します。.
注:12日目(RO)には、細胞は接着しています。13日目(RO)に、細胞は培地Eに懸濁しているのが見つかります。培地が12日目(RO)から19日目(RO)に黄色に変わった場合は、培地をミディアムEでリフレッシュします。 - 19日目(RO)に、プレートを静かに回転させることにより、オルガノイドを皿の中央に凝集させます。ミディアムEをやさしく吸引し、ミディアムFでメディウムをリフレッシュします。
- Medium Fでオルガノイドを新しい懸濁皿に移します。
- 週に一度培地を交換し、実験用のオルガノイドを選択します。
結果
網膜オルガノイドを生成する手順は、以前の研究15で説明されています。ここでは、ミクログリアとミクログリアとレチナールオルガノイドの共培養の代表的な結果を示します。
ここでは、ミクログリアの分化の各段階を示します(図1A)。0日目は幹細胞培養の段階を表します。その後、幹細胞を消化し、EB形成のために培養しました。プロセスの最初の4日間で、細胞はEBを形成します(図1B)。その後、懸濁したEBを付着した10cmの皿に移します。約7日後、細胞は 図1Cに示す細胞と類似しています。培養が進行するにつれて、接着細胞は造血前駆細胞を上清に分泌します(図1D)。このプロセスには約45日かかります。この時点で、上清から細胞を回収し、6ウェルプレートに移すことができます。次の7日間で、ミクログリアは成熟し(図1E)、さらなる実験の準備が整います。
レチナールオルガノイド分化の12日目に、接着細胞を消化して浮遊培養し、ミクログリアを含む培地Eをレチナールオルガノイドに加えます。ミクログリアは網膜オルガノイドに移行します。ミクログリアの形態を鮮明に観察するために、hESCにEGFPレンチウイルストランスフェクションを添加したところ、分化したミクログリア発現GFPに自家蛍光(緑)を持たせました(図2A-C)。また、ミクログリア共培養網オルガノイドにおいて、光受容体細胞マーカーCRXおよびミクログリア細胞マーカーIBA1を用いてミクログリアと共培養した網膜オルガノイドの組織構造を、50日間分化した後、免疫蛍光アッセイにより調べました(図2D)。
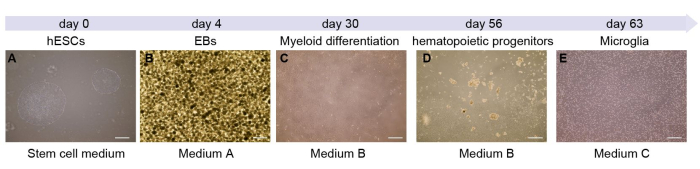
図1:hESC由来のミクログリア細胞の概略図とタイムライン (A)プロトコールは、6ウェルプレートでのhESCの解凍と継代から始まります。(B)培地Aを含む均質なEBを形成。(D,E)56日目に、細胞を含む上清を収集(D)し、低接着性の6ウェルプレートに移して63日目(E)にミクログリアを形成します。スケールバー:500μm.この図の拡大版を表示するには、ここをクリックしてください。

図2:ミクログリアとレチナールオルガノイドの共培養中のタイムラインに沿った代表的な画像。 (A)EGFP-hESC由来のミクログリア細胞の代表画像。(B)18日間の分化後のEGFP+ ミクログリアとレチナールオルガノイドとの共培養。(C)30日間の分化後のEGFP+ ミクログリアと網膜オルガノイドの共培養。スケールバー:300 μm. (D) CRX(光受容体細胞マーカー;赤)およびIBA1(ミクログリアマーカー;緑)を用いて、ミクログリアと共培養した網膜オルガノイドの組織構造を分化後50日後に検出した。DAPI(青)は核を染色します。スケールバー:30μmこの 図の拡大版を表示するには、ここをクリックしてください。
表1:この研究で使用したメディアの組成。 各培地の 500 mL 容量を調製するために必要な成分を表に示します。 このテーブルをダウンロードするには、ここをクリックしてください。
ディスカッション
ヒトの網膜の利用可能性が限られているため、網膜の炎症反応に関する現在の理解は、ほとんど動物モデルから来ています。この制限を克服するために、網膜オルガノイドを分化しました。網膜オルガノイドモデルの開発は、ヒトの網膜の複雑さを再現して疾患モデリングと治療法の開発に役立てることを目的とした活発な研究分野です。いくつかの研究で、ヒト多能性幹細胞1,2,12,13から網膜オルガノイドの生成に成功したことが報告されています。しかし、これらのモデルのほとんどは、網膜の発達と疾患の病因に重要な役割を果たすことが知られているミクログリアの存在を欠いています。最近の研究では、ミクログリアを網膜オルガノイドまたは脳オルガノイドモデルに統合する試みが試みられています16,17,18が、詳細な方法は不明です。ここでは、ミクログリアとレチナールオルガノイドを初期段階で共培養するための詳細なステップバイステップのプロトコルを提供します。どちらも同じhESC株に由来します。いくつかの研究では、動物モデルまたは細胞培養システムを使用して網膜疾患におけるミクログリアの役割を調査していますが7,8,9、ここで紹介する共培養モデルは、ミクログリアと網膜の相互作用と疾患の病因におけるそれらの影響を研究するための、より生理学的に関連性のあるヒトベースのシステムを提供します。
重要なステップは、ヒト幹細胞の細胞状態と、ミクログリアとレチナールオルガノイドの分化です。ミクログリアとROは段階的に区別し、正しい試薬とディッシュ(組織培養処理ディッシュまたは懸濁ディッシュ)を異なる段階で使用する必要があります。このモデルは、ミクログリアが網膜疾患の発生にどのように寄与するかのプロセスを理解するのに役立ちます。これは、将来の薬物スクリーニングや疾患メカニズムの研究に大きな意味を持ちます。ただし、現在公開している方法にはまだいくつかの制限があります。ミクログリアの分化期間が長く、適切な凍結保存方法がないため、共培養のためのミクログリアとレチナールオルガノイドの分化に時間を賢く計画する必要があります。
レチナールオルガノイドに加えて、免疫細胞を他のオルガノイドモデルに統合することで、オルガノイドの発生も促進できると考えています。したがって、他のオルガノイドシステムの試験は非常に重要です。さまざまな細胞タイプとオルガノイドを統合して完全な臓器を形成することは、将来に向けて有望なモデルです。
開示事項
著者らは、この研究の客観性に影響を与える可能性のある所属、メンバーシップ、助成金、または財政的保有について認識していません。
謝辞
この研究は、中国国家自然科学基金会(82101145)と北京自然科学基金会(Z200014)の支援を受けています。
資料
| Name | Company | Catalog Number | Comments |
| Acctuase | Stemcell Technologies | 07920 | |
| Advanced DMEM/F12 | Thermo | 12634-010 | |
| Anti-CRX(M02) | abnova | H00001406-M02 | Antibody; dilution as per the manufacturer's instructions |
| Anti-IBA1 | Abcam | ab5076 | Antibody; dilution as per the manufacturer's instructions |
| B27 | Life Technologies | 17105-041 | |
| Dispase (1U/mL) | Stemcell Technologies | 07923 | |
| DMEM basic | Gibco | 10566-016 | |
| DMEM/F12 | Gibco | 10565-042 | |
| DPBS | Gibco | C141905005BT | |
| EDTA | Thermo | 15575020 | |
| F12 | Gibco | 11765-054 | |
| FBS | Biological Industry | 04-002-1A | |
| Gelatin | Sigma | G7041-100G | Solid |
| Glutamax | Gibco | 35050-061 | |
| H9 cell line | WiCell Research Institute | ||
| IL-3 | RD Systems | 203-IL-050 | |
| IL-34 | PeproTech | 200-34-50UG | |
| KSR | Gibco | 10828028 | |
| Matrix | Corning | 356231 | |
| M-CSF | RD Systems | 216-MC-500 | |
| MEM Non-essential Amino Acid Solution | Sigma | M7145 | |
| N2 | Life Technologies | 17502-048 | |
| Neurobasal | Gibco | 21103-049 | |
| Pen/strep | Gibco | 15140-122 | |
| Stem cell medium | Stemcell Technologies | 5990 | |
| Taurine | Sigma | T-8691-25G | |
| X-ViVO | LONZA | 04-418Q | |
| Y27632 | Selleck | S1049 | |
| β-mercaptoethanol | Life Technologies | 21985-023 |
参考文献
- Cowan, C. S., et al. Cell types of the human retina and its organoids at single-cell resolution. Cell. 182 (6), 1623-1640.e34 (2020).
- Zhang, X., Jin, Z. B. Directed induction of retinal organoids from human pluripotent stem cells. J Vis Exp. (170), e62298(2021).
- Eiraku, M., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472 (7341), 51-56 (2011).
- Ginhoux, F., et al. Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science. 330 (6005), 841-845 (2010).
- Kierdorf, K., et al. Microglia emerge from erythromyeloid precursors via pu.1- and irf8-dependent pathways. Nat Neurosci. 16 (3), 273-280 (2013).
- Schulz, C., et al. A lineage of myeloid cells independent of myb and hematopoietic stem cells. Science. 336 (6077), 86-90 (2012).
- O'koren, E. G., et al. Microglial function is distinct in different anatomical locations during retinal homeostasis and degeneration. Immunity. 50 (3), 723-737.e7 (2019).
- Margeta, M. A., et al. Apolipoprotein E4 impairs the response of neurodegenerative retinal microglia and prevents neuronal loss in glaucoma. Immunity. 55 (9), 1627-1644.e7 (2022).
- Xu, J., et al. Enhanced innate responses in microglia derived from retinoblastoma patient-specific IPSCs. Glia. 72 (5), 872-884 (2024).
- Gosselin, D., et al. An environment-dependent transcriptional network specifies human microglia identity. Science. 356 (6344), eaal3222(2017).
- Galatro, T. F., et al. Transcriptomic analysis of purified human cortical microglia reveals age-associated changes. Nat Neurosci. 20 (8), 1162-1171 (2017).
- Nakano, T., et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 10 (6), 771-785 (2012).
- Kim, S., et al. transcriptome profiling, and functional validation of cone-rich human retinal organoids. Proc Natl Acad Sci U S A. 116 (22), 10824-10833 (2019).
- Gao, M. L., et al. Functional microglia derived from human pluripotent stem cells empower retinal organ. Sci China Life Sci. 65 (6), 1057-1071 (2022).
- Zhang, X., Jin, Z. B. Reconstruct human retinoblastoma in vitro. J Vis Exp. (188), e62629(2022).
- Park, D. S., et al. IPS-cell-derived microglia promote brain organoid maturation via cholesterol transfer. Nature. 623 (7986), 397-405 (2023).
- Usui-Ouchi, A., et al. Integrating human ipsc-derived macrophage progenitors into retinal organoids to generate a mature retinal microglial niche. Glia. 71 (10), 2372-2382 (2023).
- Chichagova, V., et al. Incorporating microglia-like cells in human induced pluripotent stem cell-derived retinal organoids. J Cell Mol Med. 27 (3), 435-445 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved