Method Article
Assemblierung von Netzhaut-Organoiden mit Mikroglia
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Mikroglia sind einzigartige residente Immunzellen in der Netzhaut, die eine entscheidende Rolle bei verschiedenen degenerativen Erkrankungen der Netzhaut spielen. Die Generierung eines Co-Kulturmodells von retinalen Organoiden mit Mikroglia kann ein besseres Verständnis der Pathogenese und des Entwicklungsfortschritts von Netzhauterkrankungen ermöglichen.
Zusammenfassung
Aufgrund der eingeschränkten Zugänglichkeit der menschlichen Netzhaut sind retinale Organoide (ROs) das beste Modell für die Untersuchung menschlicher Netzhauterkrankungen, das den Mechanismus der Netzhautentwicklung und das Auftreten von Netzhauterkrankungen aufdecken könnte. Mikroglia (MG) sind einzigartige residente Makrophagen in der Netzhaut und im Zentralnervensystem (ZNS), die wichtige Immunfunktionen erfüllen. Retinalen Organoiden fehlen jedoch Mikroglia, da ihr Differenzierungsursprung der Dottersack ist. Die spezifische Pathogenese von Mikroglia bei diesen Netzhauterkrankungen ist noch unklar; Daher erweist sich die Etablierung eines Mikroglia-eingebauten retinalen Organoidmodells als notwendig. Hier ist es uns gelungen, ein co-kultiviertes Modell von Netzhaut-Organoiden mit Mikroglia zu konstruieren, die aus menschlichen Stammzellen gewonnen wurden. In diesem Artikel haben wir Mikroglia differenziert und dann im Frühstadium zu retinalen Organoiden cokultiviert. Als Integration von Immunzellen bietet dieses Modell eine optimierte Plattform für die Modellierung von Netzhauterkrankungen und das Wirkstoffscreening, um eine eingehende Erforschung der Pathogenese und Behandlung von Netzhaut- und ZNS-bedingten Erkrankungen zu ermöglichen.
Einleitung
Die Differenzierung menschlicher Stammzellen in dreidimensionale (3D) Netzhautorganoide stellt als begrenzte Quelle der menschlichen Netzhaut ein vielversprechendes in vitro Modell zur Simulation der Netzhautdar 1. Es enthält verschiedene Zelltypen in der Netzhaut, darunter Photorezeptoren, retinale Ganglienzellen, bipolare Zellen, Müller-Zellen, horizontale Zellen und Astrozyten2. Dieses Modell ermöglicht die Emulation und Untersuchung sowohl der Entwicklungsmechanismen der Netzhaut als auch der Pathogenese von Netzhauterkrankungen. Aufgrund der gerichteten Differenzierungsmethode wurden jedoch retinale Organoide aus dem Neuroektoderm3 abgeleitet, wobei viele andere Zelltypen, die aus verschiedenen Keimblättern stammen, wie z.B. Mikroglia aus dem Dottersack und perivaskuläre Zellen aus dem Mesoderm 4,5,6, fehlen.
Gegenwärtig ist bei vielen Netzhauterkrankungen wie Retinitis pigmentosa7, Glaukom8 und Retinoblastom9 nachgewiesen, dass sie eng mit den Mikroglia in der Netzhaut zusammenhängen. Aufgrund des Mangels an geeigneten Forschungsmodellen sind die spezifischen Mechanismen, die den Zusammenhang zwischen Mikroglia und diesen Krankheiten veranschaulichen, jedoch noch unklar. Während Mäuse als günstiges Modell für die Untersuchung von Netzhauterkrankungen dienten, haben neuere Studien signifikante Unterschiede zwischen Maus- und menschlichen Mikroglia in Bezug auf Lebensdauer, Proliferationsrate und das Fehlen menschlicher homologe Gene hervorgehoben10,11. Diese Ergebnisse deuten darauf hin, dass die Schlussfolgerungen aus Mausmodellen möglicherweise nicht ganz zuverlässig sind, was die Bedeutung der Konstruktion menschlicher Netzhautorganoide mit Mikroglia unterstreicht.
In den letzten Jahrzehnten wurden verschiedene Methoden zur 3D-Differenzierung von retinalen Organoiden entwickelt12,13. Um den Co-Kulturbetrieb von Mikroglia innerhalb von retinalen Organoiden zu erleichtern, haben wir eine Differenzierungsmethode gewählt, die einen Übergang von adhärenter zu Suspensionskultur beinhaltet. Dieser Ansatz ermöglicht es, Mikroglia erfolgreich in die retinalen Organoide einzubauen und sie mindestens 60 Tage lang zu erhalten14.
Protokoll
Diese Studie wurde von der institutionellen Ethikkommission des Beijing Tongren Hospital der Capital Medical University genehmigt. Die HESC-Zelllinie H9 stammt aus dem WiCell Research Institute. Erwärmen Sie das Zellkulturmedium vor dem Experiment 30 Minuten lang bei Raumtemperatur (RT).
1. Erzeugung menschlicher Mikroglia
- Kultivieren Sie die hES-Zellen in Stammzellmedium, bis die Zelldichte 80%-90% erreicht. Säen Sie mindestens 1 x 106 Zellen in jede Vertiefung.
- Aspirieren Sie das Stammzellmedium und spülen Sie die Zellen mit 1x DPBS (1 mL/Well oder 6-Well-Platte). Für den nächsten Schritt werden 2 x 10,7-1 x 10,8 Zellen benötigt. Wenn dies nicht ausreicht, kombinieren Sie Zellen mit 2-5 Vertiefungen, um die folgenden Schritte auszuführen.
- Dissoziieren Sie die Stammzellkolonien mit der 0,5 mM EDTA-Lösung für etwa 5 Minuten in einem 37 °C-Inkubator (1 ml/Vertiefung einer 6-Well-Platte).
- Überprüfen Sie die Morphologie der Kolonie nach 5 Minuten. Wenn die Kolonieränder leicht zusammengerollt sind und lose Lücken aufweisen, sind die Zellen bereit, sich zu differenzieren und das EDTA abzusaugen. Wenn nicht, inkubieren Sie die Zellen bei 37 °C für weitere 1-2 Minuten. Nicht länger als 8 Minuten inkubieren.
- Spülen Sie die Zellen in jeder Vertiefung vorsichtig mit 6 ml Medium A (Tabelle 1) und 6 μl 10 mM ROCK-Inhibitor Y-27632 Lösung. Klopfen Sie vorsichtig auf den Boden der Schüssel, um die Zellen abzuspülen. Legen Sie den Tag auf Tag 0 fest.
HINWEIS: Pipettieren Sie die Zellen nicht. Die Zellen bilden am nächsten Tag embryoide Körper (EBs). - Beobachten Sie nach 24 Stunden die Zellen unter dem Mikroskop, um die EB-Bildung zu bestätigen. Sammeln Sie die EBs in einem 15-ml-Zentrifugalröhrchen mit einer 10-ml-Pipette und warten Sie, bis sich die EBs in 5 Minuten am Boden abgesetzt haben.
- Der Überstand wird vorsichtig aspiriert, die EBs mit 6 ml frischem Medium A resuspendiert und in eine neue Vertiefung mit geringer Adhäsion aus einer 6-Well-Platte überführt. Kultur in einem 37 °C Inkubator.
HINWEIS: Der Zweck des Well-Transfers am Tag 1 besteht darin, den Einfluss einer großen Anzahl abgestorbener Zellen während des Prozesses der EB-Bildung zu reduzieren, was den Zustand des Zellwachstums beeinflussen kann. - Frischen Sie das frische Medium A täglich bis zum 4. Tag auf (6 ml/Well 6-Well-Platte).
- An Tag 4 wird eine 10 cm große Schale mindestens 1 h lang in einem Inkubator mit 5 % CO2 und 37 °C mit 3 ml 0,1 % Fischgelatinelösung bestreicht.
HINWEIS: Wenn die Beschichtungszeit weniger als 1 h beträgt, ist es schwierig, die folgenden Schritte durchzuführen. - Sammeln Sie die EBs vorsichtig mit einer 10-ml-Pipette in einem 15-ml-Zentrifugalröhrchen und warten Sie, bis sich die EBs in 5 Minuten am Boden abgesetzt haben.
- Entfernen Sie die 0,1%ige Gelatinelösung und spülen Sie die 10 cm lange Schale einmal mit 5-6 mL 1x DPBS aus. Entfernen Sie das DPBS.
- Die EBs werden vorsichtig mit 15 mL Medium B (Tabelle 1) im 15 mL Zentrifugalröhrchen resuspendiert und in die beschichtete 10 cm Schale überführt. 1 Woche lang in einem 37 °C heißen Inkubator mit 5 % CO2 kultivieren.
HINWEIS: Bewegen Sie die Schüssel in den ersten 7 Tagen nicht. - Einmal pro Woche bis zum Tag 49 (15 mL/10 cm Schale) mit frischem Medium B auffrischen und die Zellen einmal pro Woche unter dem Mikroskop untersuchen.
HINWEIS: Nach Tag 49 können mehrere sekretorische Zellen im Überstand in der Kulturschale gefunden werden. - Die überstehenden Zellen werden bei 200 x g für 5 min bei RT zentrifugiert.
- Den Überstand vorsichtig aspirieren und die Zellen mit 2 ml frischem Medium B resuspendieren und in eine neue Vertiefung mit geringer Adhäsion aus 6-Well-Platte überführen. Inkubation in einem Inkubator mit 5 % CO2 und 37 °C.
HINWEIS: Bewegen Sie die Platte in den nächsten 7 Tagen nicht. Die Mikroglia konnten am Boden der Vertiefung mit geringer Adhäsion haften. - An Tag 56 durch Medium C (Tabelle 1) ersetzen (2 ml/Vertiefung der 6-Well-Platte). Die Mikroglia haften am Boden der Vertiefung mit geringer Adhäsion und sehen unter dem Mikroskop verzweigt aus.
HINWEIS: Durch einen Wechsel von Medium C alle 3 Tage (2 ml/Vertiefung der 6-Well-Platte) können die Mikroglia etwa 15 Tage lang in Medium C kultiviert werden.
2. Erzeugung humaner ROs und Co-Kultur der ROs mit Mikroglia
- Die hES-Zellen wurden in Stammzellmedium kultiviert, bis die Zelldichte 80%-90% erreichte. Säen Sie mindestens 1 x 106 Zellen in jede Vertiefung.
- Geben Sie Dispase (1 ml/Vertiefung einer 6-Well-Platte) in die Kulturzelle. Bei 37 °C 5 min inkubieren. Aspirieren Sie die Dispase-Lösung aus der Vertiefung.
- Geben Sie Medium D (Tabelle 1) (1 ml/Vertiefung einer 6-Well-Platte) in die Vertiefung. Schneiden Sie die Zelle mit einer 10 μL Pipette in kleine Stücke.
- Sammeln Sie vorsichtig alle Zellstücke und das Medium in einem 1,5-ml-Mikrozentrifugenröhrchen.
- Bei 200 x g für 5 min zentrifugieren und den Überstand entfernen.
- Resuspendieren Sie die Zellen vorsichtig in 200 μl einer kalten Matrix. Schieben Sie das 1,5-Mikrozentrifugenröhrchen für 20 Minuten in einen Inkubator. Arbeiten Sie schnell, da die Matrix bei Raumtemperatur (RT) erstarrt. Nach 20 Minuten im Inkubator verfestigt sich die Matrix.
- Bereiten Sie eine 10 cm Schale mit 15 mL Medium D vor. Resuspendieren Sie die Matrix mit Medium D und schütteln Sie die Petrischale vorsichtig.
- Legen Sie das Gericht dann für 5 Tage in einen Inkubator. Bewegen Sie die Platte nicht. Legen Sie den Tag auf Tag 0 (ROs) fest. Die Zellen werden in 3 Tagen haften.
- An Tag 5 (ROs) und Tag 10 (ROs) frischen Sie das Medium mit Medium D auf.
- Entfernen Sie am Tag 12 (ROs) das Medium und geben Sie 3 ml Dispase für 5 Minuten in jede Schale.
- Aspirieren Sie die Dispase und fügen Sie 15 ml Medium E hinzu (Tabelle 1).
- Ernte der Mikroglia: An Tag 56 (MGs) das Medium C vorsichtig aspirieren, Accutase (1 ml/Vertiefung einer 6-Well-Platte) hinzufügen und 3 Minuten lang bei 37 °C inkubieren.
- Sammeln Sie die Mikrogliazellen in ein 15-ml-Zentrifugalröhrchen mit einer 5-ml-Pipette. Zellen bei 200 x g bei RT für 5 min zentrifugieren.
- Aspirieren Sie den Überstand vorsichtig und suspendieren Sie die Mikroglia mit 1 ml Medium E. Fügen Sie Mikroglia zu den verdauten ROs an Tag 12 hinzu.
HINWEIS: An Tag 12 (ROs) sind die Zellen adhäsiv. An Tag 13 (ROs) werden die Zellen in Medium E suspendiert. Wenn sich das Medium von Tag 12 (ROs) bis Tag 19 (ROs) gelb ändert, aktualisieren Sie das Medium mit Medium E. - An Tag 19 (ROs) aggregieren Sie die Organoide in der Mitte der Schale, indem Sie den Teller vorsichtig schwenken. Saugen Sie Medium E sanft an und erfrischen Sie das Medium mit Medium F.
- Übertragen Sie die Organoide mit Medium F in eine neue Suspensionsschale.
- Wechseln Sie das Medium einmal pro Woche und wählen Sie Organoide für Experimente aus.
Ergebnisse
Das Verfahren zur Erzeugung von retinalen Organoiden ist in unserer Vorgängerstudiebeschrieben 15. Hier zeigen wir die repräsentativen Ergebnisse von Mikroglia und Co-Kultur von Mikroglia und retinalen Organoiden.
Hier zeigen wir jedes Stadium der Mikroglia-Differenzierung (Abbildung 1A). Tag 0 stellt das Stadium der Stammzellkultur dar. Dann wurden die Stammzellen verdaut und für die EB-Bildung kultiviert. In den ersten 4 Tagen des Prozesses bilden die Zellen EBs (Abbildung 1B). Anschließend überführen wir die suspendierten EBs in anhaftende 10 cm Schalen. Nach etwa 7 Tagen ähneln die Zellen denen in Abbildung 1C. Im Laufe der Kultur sezernieren adhärente Zellen hämatopoetische Vorläuferzellen in den Überstand (Abbildung 1D). Dieser Vorgang dauert ca. 45 Tage. Zu diesem Zeitpunkt können Zellen aus dem Überstand entnommen und auf 6-Well-Platten übertragen werden. In den nächsten 7 Tagen werden die Mikroglia reif sein (Abbildung 1E) und sind bereit für weitere Experimente.
Am Tag 12 der Differenzierung von Netzhaut-Organoiden werden adhärente Zellen in eine Suspensionskultur verdaut und Medium E, das Mikroglia enthält, wird den Netzhaut-Organoiden zugesetzt. Mikroglia wandern in retinale Organoide ein. Um die Morphologie der Mikroglia eindeutig zu beobachten, fügten wir EGFP-Lentivirus-Transfektion in die hES-Zellen ein, wodurch die differenzierten Mikroglia-exprimierenden GFP eine Autofluoreszenz aufwiesen (Grün) (Abbildung 2A-C). Wir untersuchten auch die Gewebestruktur von retinalen Organoiden, die mit Mikroglia kokultiviert wurden, unter Verwendung des Photorezeptorzellmarkers CRX und des Mikrogliazellmarkers IBA1 mittels Immunfluoreszenzassay in mikroglia-kokultivierten Netzhautorganoiden nach 50-tägiger Differenzierung (Abbildung 2D).
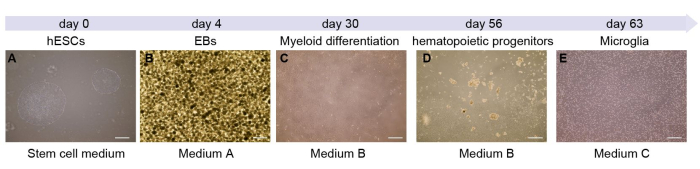
Abbildung 1: Schematische Darstellung und Zeitleiste einer aus hES-Zellen gewonnenen Mikroglia-Zelle. (A) Das Protokoll beginnt mit dem Auftauen und Passieren von hES-Zellen in einer 6-Well-Platte. (B) Die homogenen EBs, die das Medium A enthalten. (C) EBs werden auf eine beschichtete Schale übertragen, und hämatopoetische Vorläuferzellen werden an den Tagen 4-56 gebildet. (D,E) An Tag 56 wird der Überstand mit den Zellen gesammelt (D) und auf eine 6-Well-Platte mit geringer Adhäsion übertragen, um an Tag 63 Mikroglia zu bilden (E). Maßstab: 500 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Repräsentative Bilder entlang der Zeitachse während der Co-Kultur von Mikroglia und retinalen Organoiden. (A) Repräsentative Bilder von Mikrogliazellen, die aus EGFP-hESC gewonnen wurden. (B) Co-Kultur von EGFP+ -Mikroglia mit Netzhautorganoiden nach 18-tägiger Differenzierung. (C) Co-Kultur von EGFP+ -Mikroglia mit Netzhautorganoiden nach 30-tägiger Differenzierung. Maßstabsbalken: 300 μm. (D) CRX (Photorezeptorzellmarker; rot) und IBA1 (Mikrogliamarker; grün) wurden verwendet, um die Gewebestruktur von retinalen Organoiden zu detektieren, die nach 50 Tagen Differenzierung mit Mikroglia kokultiviert wurden. DAPI (blau) färbt den Zellkern. Maßstabsleiste: 30 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Zusammensetzung der in dieser Studie verwendeten Medien. Die Komponenten, die zur Vorbereitung eines Volumens von 500 ml jedes Mediums erforderlich sind, sind in der Tabelle aufgeführt. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Aufgrund der eingeschränkten Verfügbarkeit der menschlichen Netzhaut stammt unser heutiges Verständnis von retinalen Entzündungsreaktionen fast aus Tiermodellen. Um diese Einschränkung zu überwinden, wurden retinale Organoide differenziert. Die Entwicklung von Netzhaut-Organoidmodellen ist ein aktives Forschungsgebiet, das darauf abzielt, die Komplexität der menschlichen Netzhaut für die Modellierung von Krankheiten und die therapeutische Entwicklung zu rekapitulieren. Mehrere Studien haben über die erfolgreiche Erzeugung von Netzhaut-Organoiden aus humanen pluripotenten Stammzellen berichtet 1,2,12,13. Den meisten dieser Modelle fehlen jedoch Mikroglia, von denen bekannt ist, dass sie eine entscheidende Rolle bei der Entwicklung der Netzhaut und der Krankheitspathogenese spielen. Neuere Studien haben versucht, Mikroglia in retinale Organoide oder Gehirn-Organoidmodelle zu integrieren 16,17,18, aber die detaillierte Methode ist unklar. Hier stellen wir ein detailliertes Schritt-für-Schritt-Protokoll für die Co-Kultivierung von Mikroglia mit retinalen Organoiden im Frühstadium zur Verfügung, die beide aus derselben hES-Linie stammen. Während einige Studien die Rolle von Mikroglia bei Netzhauterkrankungen anhand von Tiermodellen oder Zellkultursystemen untersucht haben 7,8,9, bietet das hier vorgestellte Co-Kultur-Modell ein physiologisch relevanteres humanbasiertes System zur Untersuchung von Mikroglia-Netzhaut-Interaktionen und deren Auswirkungen auf die Krankheitspathogenese.
Die kritischen Schritte sind der Zellzustand menschlicher Stammzellen und die Differenzierung von Mikroglia und retinalen Organoiden. Mikroglia und ROs sollten Schritt für Schritt unterschieden werden, und die richtigen Reagenzien und Schalen (gewebekultivierte, behandelte Schale oder Suspensionsschale) sollten in verschiedenen Stadien verwendet werden. Dieses Modell kann uns helfen, den Prozess zu verstehen, wie Mikroglia zum Auftreten von Netzhauterkrankungen beitragen. Sie hat erhebliche Auswirkungen auf zukünftige Wirkstoffscreenings und die Erforschung von Krankheitsmechanismen. Die Methoden, die wir derzeit veröffentlichen, haben jedoch noch einige Einschränkungen. Aufgrund der verlängerten Differenzierungsphase der Mikroglia und des Mangels an geeigneten Kryokonservierungsmethoden sollten wir unsere Zeit für die Differenzierung von Mikroglia und retinalen Organoiden für die Co-Kultur sinnvoll einplanen.
Wir glauben, dass neben retinalen Organoiden auch die Integration von Immunzellen in andere Organoidmodelle die Entwicklung von Organoiden fördern kann. Daher ist es von entscheidender Bedeutung, andere organoide Systeme zu testen. Die Integration verschiedener Zelltypen und Organoide zu kompletten Organen stellt ein vielversprechendes Modell für die Zukunft dar.
Offenlegungen
Den Autoren sind keine Zugehörigkeiten, Mitgliedschaften, Zuschüsse oder finanzielle Beteiligungen bekannt, die die Objektivität dieser Studie beeinträchtigen könnten.
Danksagungen
Diese Studie wird von der National Natural Science Foundation of China (82101145) und der Beijing Natural Science Foundation (Z200014) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Acctuase | Stemcell Technologies | 07920 | |
| Advanced DMEM/F12 | Thermo | 12634-010 | |
| Anti-CRX(M02) | abnova | H00001406-M02 | Antibody; dilution as per the manufacturer's instructions |
| Anti-IBA1 | Abcam | ab5076 | Antibody; dilution as per the manufacturer's instructions |
| B27 | Life Technologies | 17105-041 | |
| Dispase (1U/mL) | Stemcell Technologies | 07923 | |
| DMEM basic | Gibco | 10566-016 | |
| DMEM/F12 | Gibco | 10565-042 | |
| DPBS | Gibco | C141905005BT | |
| EDTA | Thermo | 15575020 | |
| F12 | Gibco | 11765-054 | |
| FBS | Biological Industry | 04-002-1A | |
| Gelatin | Sigma | G7041-100G | Solid |
| Glutamax | Gibco | 35050-061 | |
| H9 cell line | WiCell Research Institute | ||
| IL-3 | RD Systems | 203-IL-050 | |
| IL-34 | PeproTech | 200-34-50UG | |
| KSR | Gibco | 10828028 | |
| Matrix | Corning | 356231 | |
| M-CSF | RD Systems | 216-MC-500 | |
| MEM Non-essential Amino Acid Solution | Sigma | M7145 | |
| N2 | Life Technologies | 17502-048 | |
| Neurobasal | Gibco | 21103-049 | |
| Pen/strep | Gibco | 15140-122 | |
| Stem cell medium | Stemcell Technologies | 5990 | |
| Taurine | Sigma | T-8691-25G | |
| X-ViVO | LONZA | 04-418Q | |
| Y27632 | Selleck | S1049 | |
| β-mercaptoethanol | Life Technologies | 21985-023 |
Referenzen
- Cowan, C. S., et al. Cell types of the human retina and its organoids at single-cell resolution. Cell. 182 (6), 1623-1640.e34 (2020).
- Zhang, X., Jin, Z. B. Directed induction of retinal organoids from human pluripotent stem cells. J Vis Exp. (170), e62298(2021).
- Eiraku, M., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472 (7341), 51-56 (2011).
- Ginhoux, F., et al. Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science. 330 (6005), 841-845 (2010).
- Kierdorf, K., et al. Microglia emerge from erythromyeloid precursors via pu.1- and irf8-dependent pathways. Nat Neurosci. 16 (3), 273-280 (2013).
- Schulz, C., et al. A lineage of myeloid cells independent of myb and hematopoietic stem cells. Science. 336 (6077), 86-90 (2012).
- O'koren, E. G., et al. Microglial function is distinct in different anatomical locations during retinal homeostasis and degeneration. Immunity. 50 (3), 723-737.e7 (2019).
- Margeta, M. A., et al. Apolipoprotein E4 impairs the response of neurodegenerative retinal microglia and prevents neuronal loss in glaucoma. Immunity. 55 (9), 1627-1644.e7 (2022).
- Xu, J., et al. Enhanced innate responses in microglia derived from retinoblastoma patient-specific IPSCs. Glia. 72 (5), 872-884 (2024).
- Gosselin, D., et al. An environment-dependent transcriptional network specifies human microglia identity. Science. 356 (6344), eaal3222(2017).
- Galatro, T. F., et al. Transcriptomic analysis of purified human cortical microglia reveals age-associated changes. Nat Neurosci. 20 (8), 1162-1171 (2017).
- Nakano, T., et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 10 (6), 771-785 (2012).
- Kim, S., et al. transcriptome profiling, and functional validation of cone-rich human retinal organoids. Proc Natl Acad Sci U S A. 116 (22), 10824-10833 (2019).
- Gao, M. L., et al. Functional microglia derived from human pluripotent stem cells empower retinal organ. Sci China Life Sci. 65 (6), 1057-1071 (2022).
- Zhang, X., Jin, Z. B. Reconstruct human retinoblastoma in vitro. J Vis Exp. (188), e62629(2022).
- Park, D. S., et al. IPS-cell-derived microglia promote brain organoid maturation via cholesterol transfer. Nature. 623 (7986), 397-405 (2023).
- Usui-Ouchi, A., et al. Integrating human ipsc-derived macrophage progenitors into retinal organoids to generate a mature retinal microglial niche. Glia. 71 (10), 2372-2382 (2023).
- Chichagova, V., et al. Incorporating microglia-like cells in human induced pluripotent stem cell-derived retinal organoids. J Cell Mol Med. 27 (3), 435-445 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten