Method Article
تجميع عضويات الشبكية مع الخلايا الدبقية الصغيرة
* These authors contributed equally
In This Article
Summary
الخلايا الدبقية الصغيرة هي خلايا مناعية مقيمة فريدة في شبكية العين ، وتلعب أدوارا حاسمة في العديد من الأمراض التنكسية في شبكية العين. يمكن أن يؤدي إنشاء نموذج زراعة مشتركة لعضويات الشبكية مع الخلايا الدبقية الصغيرة إلى تسهيل فهم أفضل للتسبب في أمراض الشبكية والتقدم التنموي.
Abstract
نظرا لمحدودية الوصول إلى شبكية العين البشرية ، فإن عضويات الشبكية (ROs) هي أفضل نموذج لدراسة أمراض الشبكية البشرية ، والتي يمكن أن تكشف عن آلية تطور الشبكية وحدوث أمراض الشبكية. الخلايا الدبقية الصغيرة (MG) هي بلاعم مقيمة فريدة من نوعها في شبكية العين والجهاز العصبي المركزي (CNS) ، وتخدم وظائف المناعة الحاسمة. ومع ذلك ، تفتقر الكائنات العضوية في شبكية العين إلى الخلايا الدبقية الصغيرة لأن أصل تمايزها هو كيس الصفار. لا يزال التسبب المحدد للخلايا الدبقية الصغيرة في أمراض الشبكية هذه غير واضح. لذلك ، تبين أن إنشاء نموذج عضوي شبكي مدمج في الخلايا الدبقية الصغيرة أمر ضروري. هنا ، نجحنا في بناء نموذج مشترك من عضويات الشبكية مع الخلايا الدبقية الصغيرة المشتقة من الخلايا الجذعية البشرية. في هذه المقالة ، قمنا بتمييز الخلايا الدبقية الصغيرة ثم شاركنا في الاستزراع إلى عضويات الشبكية في المرحلة المبكرة. كدمج للخلايا المناعية ، يوفر هذا النموذج منصة محسنة لنمذجة أمراض الشبكية وفحص الأدوية لتسهيل البحث المتعمق حول التسبب في أمراض الشبكية والجهاز العصبي المركزي وعلاجها.
Introduction
كمصدر محدود لشبكية العين البشرية ، يمثل تمايز الخلايا الجذعية البشرية إلى عضويات شبكية ثلاثية الأبعاد (3D) نموذجا واعدا في المختبر لمحاكاة شبكية العين1. يحتوي على أنواع مختلفة من الخلايا في شبكية العين ، بما في ذلك المستقبلات الضوئية وخلايا العقدة الشبكية والخلايا ثنائية القطب وخلايا مولر والخلايا الأفقية والخلايا النجمية2. يتيح هذا النموذج محاكاة ودراسة كل من آليات نمو الشبكية والتسبب في أمراض الشبكية. ومع ذلك ، بسبب طريقة التمايز الاتجاهي ، تم اشتقاق عضويات الشبكية من الأديم الظاهر العصبي3 ، والتي تفتقر إلى العديد من أنواع الخلايا الأخرى التي تنشأ من طبقات جرثومية مختلفة ، مثل الخلايا الدبقية الصغيرة من كيس الصفار والخلايا المحيطة بالأوعية الدموية من الأديم المتوسط4،5،6.
في الوقت الحاضر ، ثبت أن العديد من أمراض الشبكية ، مثل التهاب الشبكية الصباغي7 ، والزرق8 ، والورم الأرومي الشبكي9 ، ترتبط ارتباطا وثيقا بالخلايا الدبقية الصغيرة داخل شبكية العين. ومع ذلك ، نظرا لعدم وجود نماذج بحثية مناسبة ، لا تزال الآليات المحددة التي توضح العلاقة بين الخلايا الدبقية الصغيرة وهذه الأمراض غير واضحة. في حين أن الفئران كانت بمثابة نموذج مناسب لدراسة أمراض الشبكية ، فقد أبرزت الدراسات الحديثة اختلافات كبيرة بين الخلايا الدبقية الصغيرة للفأر والإنسان من حيث العمر ومعدل الانتشار وغياب الجينات البشريةالمتماثلة 10,11. أشارت هذه النتائج إلى أن الاستنتاجات المستخلصة من نماذج الفئران قد لا تكون موثوقة تماما ، مما يؤكد أهمية بناء عضويات شبكية العين البشرية التي تحتوي على الخلايا الدبقية الصغيرة.
على مدى العقود القليلة الماضية ، تم تطوير طرق مختلفة للتمايز ثلاثي الأبعاد لعضويات الشبكية12,13. لتسهيل عملية الاستزراع المشترك للخلايا الدبقية الصغيرة داخل عضويات الشبكية ، اخترنا طريقة تمايز تتضمن الانتقال من ثقافة الالتصاق إلى ثقافة التعليق. يتيح هذا النهج بنجاح دمج الخلايا الدبقية الصغيرة في عضويات الشبكية ، والحفاظ عليها لمدة 60 يوما على الأقل14.
Protocol
تمت الموافقة على هذه الدراسة من قبل لجنة الأخلاقيات المؤسسية لمستشفى بكين تونغرن ، جامعة العاصمة الطبية. كان خط خلية HESCs H9 من معهد أبحاث WiCell. قم بتسخين وسط زراعة الخلايا مسبقا في درجة حرارة الغرفة (RT) لمدة 30 دقيقة قبل التجربة.
1. توليد الخلايا الدبقية الصغيرة البشرية
- استزرع hESCs في وسط الخلايا الجذعية حتى تصل كثافة الخلية إلى 80٪ -90٪. بذر ما لا يقل عن 1 × 106 خلايا في كل بئر.
- نضح وسط الخلايا الجذعية وشطف الخلايا باستخدام 1x DPBS (1 مل / بئر من 6 صفيحة بئر). تتطلب الخطوة التالية 2 × 107-1 × 108 خلايا. إذا لم يكن ذلك كافيا ، فقم بدمج خلايا 2-5 آبار للقيام بالخطوات التالية.
- فصل مستعمرات الخلايا الجذعية باستخدام محلول EDTA 0.5 mM لمدة 5 دقائق تقريبا في حاضنة 37 درجة مئوية (1 مل / بئر من 6 صفيحة بئر).
- تحقق من مورفولوجيا المستعمرة بعد 5 دقائق. عندما تكون حواف المستعمرة ملتفة قليلا مع وجود فجوات فضفاضة ، تكون الخلايا جاهزة للتمايز واستنشاق EDTA. إذا لم يكن كذلك ، احتضان الخلايا عند 37 درجة مئوية لمدة 1-2 دقيقة أخرى. لا تحتضن لمدة تزيد عن 8 دقائق.
- اشطف الخلايا برفق في كل بئر باستخدام 6 مل من Medium A (الجدول 1) مع 6 ميكرولتر من محلول مثبط 10 mM ROCK Y-27632. اضغط برفق على الجزء السفلي من الطبق للمساعدة في شطف الخلايا. اضبط اليوم على أنه اليوم 0.
ملاحظة: لا ماصة الخلايا. ستشكل الخلايا أجساما جنينية (EBs) في اليوم التالي. - بعد 24 ساعة ، راقب الخلايا الموجودة تحت المجهر لتأكيد تكوين EB. اجمع EBs في أنبوب طرد مركزي سعة 15 مل مع ماصة سعة 10 مل وانتظر حتى تستقر EBs في القاع في غضون 5 دقائق.
- قم بشفط المادة الطافية بعناية وأعد تعليق EBs ب 6 مل من Medium A الطازج وانقلها إلى بئر جديد منخفض الالتصاق من 6 آبار. الثقافة في حاضنة 37 درجة مئوية.
ملاحظة: الغرض من نقل البئر في اليوم 1 هو تقليل تأثير عدد كبير من الخلايا الميتة أثناء عملية تكوين EB ، مما قد يؤثر على حالة نمو الخلايا. - قم بتحديث Medium A الطازج يوميا حتى اليوم الرابع (6 مل / بئر من 6 آبار).
- في اليوم الرابع ، قم بتغطية طبق 10 سم ب 3 مل من محلول جيلاتين السمك 0.1٪ لمدة ساعة على الأقل في حاضنة 5٪ CO2 ، 37 درجة مئوية.
ملاحظة: إذا كان وقت الطلاء أقل من 1 ساعة ، فمن الصعب تنفيذ الخطوات التالية. - اجمع EBs بعناية في أنبوب طرد مركزي سعة 15 مل مع ماصة سعة 10 مل وانتظر حتى تستقر EBs في القاع في غضون 5 دقائق.
- قم بإزالة محلول الجيلاتين بنسبة 0.1٪ وشطف الطبق 10 سم مرة واحدة باستخدام 5-6 مل من 1x DPBS. إزالة DPBS.
- أعد تعليق EBs برفق مع 15 مل من Medium B (الجدول 1) في أنبوب الطرد المركزي سعة 15 مل وانقلها إلى الطبق المطلي مقاس 10 سم. الثقافة في 37 °C ، 5٪ CO2 حاضنة لمدة 1 أسبوع.
ملاحظة: في أول 7 أيام ، لا تحرك الطبق. - انتعش باستخدام Medium B الطازج مرة واحدة في الأسبوع حتى اليوم 49 (طبق 15 مل / 10 سم) ، وافحص الخلايا تحت المجهر مرة واحدة في الأسبوع.
ملاحظة: بعد اليوم 49 ، يمكن العثور على العديد من الخلايا الإفرازية في المادة الطافية في طبق الاستزراع. - أجهزة الطرد المركزي الخلايا الطافية في 200 × غرام لمدة 5 دقائق في RT.
- قم بشفط المادة الطافية بعناية وأعد تعليق الخلايا ب 2 مل من Medium B الطازج وانقلها إلى بئر جديد منخفض الالتصاق من 6 آبار. احتضان في حاضنة CO 5 ٪2 ، 37 درجة مئوية.
ملاحظة: في الأيام ال 7 القادمة ، لا تحرك اللوحة. يمكن أن تلتصق الخلايا الدبقية الصغيرة بقاع بئر الالتصاق المنخفض. - في اليوم 56 ، استبدل ب Medium C (الجدول 1) (2 مل / بئر من لوحة 6 آبار). تلتصق الخلايا الدبقية الصغيرة بقاع بئر الالتصاق المنخفض وستبدو متفرعة تحت المجهر.
ملاحظة: عن طريق تغيير الوسط C كل 3 أيام (2 مل / بئر من لوحة 6 آبار) ، يمكن زراعة الخلايا الدبقية الصغيرة في Medium C لمدة 15 يوما تقريبا.
2. توليد ROs البشرية والمشاركة في ثقافة ROs مع الخلايا الدبقية الصغيرة
- استزراع hESCs في وسط الخلايا الجذعية حتى تصل كثافة الخلية إلى 80٪ -90٪. بذر ما لا يقل عن 1 × 106 خلايا في كل بئر.
- أضف Dispase (1 مل / بئر من 6 ألواح بئر) إلى خلية الاستزراع. احتضان على حرارة 37 درجة مئوية لمدة 5 دقائق. نضح محلول Dispase من البئر.
- أضف الوسط D (الجدول 1) (1 مل / بئر من 6 ألواح بئر) إلى البئر. قطع الخلية إلى قطع صغيرة مع ماصة 10 ميكرولتر.
- اجمع برفق كل قطع الخلايا والمتوسطة في أنبوب طرد مركزي دقيق سعة 1.5 مل.
- أجهزة الطرد المركزي في 200 × غرام لمدة 5 دقائق وإزالة طاف.
- أعد تعليق الخلايا برفق في 200 ميكرولتر من المصفوفة الباردة. انقل أنبوب الطرد المركزي 1.5 إلى حاضنة لمدة 20 دقيقة. تعمل بسرعة لأن المصفوفة سوف تصلب في درجة حرارة الغرفة (RT). بعد 20 دقيقة في الحاضنة ، سوف تصلب المصفوفة.
- تحضير طبق 10 سم مع 15 مل متوسط D. أعد تعليق المصفوفة ب Medium D ورج طبق بتري برفق.
- ثم ضع الطبق في حاضنة لمدة 5 أيام. لا تحرك اللوحة. حدد اليوم على أنه اليوم 0 (ROs). سوف تلتصق الخلايا في 3 أيام.
- في اليوم 5 (ROs) واليوم 10 (ROs) ، قم بتحديث الوسيط باستخدام Medium D.
- في اليوم 12 (ROs) ، قم بإزالة الوسط وإضافة 3 مل من Dispase إلى كل طبق لمدة 5 دقائق.
- نضح Dispase وإضافة 15 مل من متوسط E (الجدول 1).
- حصاد الخلايا الدبقية الصغيرة: في اليوم 56 (MGs) ، قم بشفط الوسط C برفق ، وأضف Accutase (1 مل / بئر من صفيحة 6 آبار) ، واحتضانها عند 37 درجة مئوية لمدة 3 دقائق.
- اجمع الخلايا الدبقية الصغيرة في أنبوب طرد مركزي سعة 15 مل باستخدام ماصة سعة 5 مل. خلايا الطرد المركزي في 200 × غرام في RT لمدة 5 دقائق.
- قم بشفط المادة الطافية برفق وقم بتعليق الخلايا الدبقية الصغيرة ب 1 مل من Medium E. أضف الخلايا الدبقية الصغيرة إلى ROs المهضومة في اليوم 12.
ملاحظة: في اليوم 12 (ROs) ، تكون الخلايا لاصقة. في اليوم 13 (ROs) ، تم العثور على الخلايا معلقة في Medium E. إذا تغير الوسط إلى اللون الأصفر من اليوم 12 (ROs) إلى اليوم 19 (ROs) ، فقم بتحديث الوسيط باستخدام Medium E. - في اليوم 19 (ROs) ، قم بتجميع المواد العضوية في وسط الطبق عن طريق تدوير الطبق برفق. قم بشفط Medium E برفق وقم بتحديث الوسيط باستخدام Medium F.
- انقل المواد العضوية باستخدام Medium F إلى طبق تعليق جديد.
- قم بتغيير الوسيط مرة واحدة في الأسبوع وحدد المواد العضوية للتجارب.
النتائج
تم وصف الإجراء الخاص بتوليد عضويات الشبكية في دراستنا السابقة15. هنا ، نعرض النتائج التمثيلية للخلايا الدبقية الصغيرة والخلايا الدبقية الصغيرة والعضوية الشبكية.
هنا ، نوضح كل مرحلة من مراحل تمايز الخلايا الدبقية الصغيرة (الشكل 1 أ). يمثل اليوم 0 مرحلة زراعة الخلايا الجذعية. بعد ذلك ، تم هضم الخلايا الجذعية وزراعتها لتشكيل EB. في أول 4 أيام من العملية ، ستشكل الخلايا EBs (الشكل 1B). بعد ذلك ، نقوم بنقل EBs المعلقة إلى أطباق ملتصقة مقاس 10 سم. بعد 7 أيام تقريبا، تتشابه الخلايا مع تلك الموضحة في الشكل 1C. مع تقدم الثقافة ، تفرز الخلايا الملتصقة أسلاف المكونة للدم في المادة الطافية (الشكل 1 د). تستغرق هذه العملية حوالي 45 يوما. عند هذه النقطة ، يمكن حصاد الخلايا من المادة الطافية ونقلها إلى 6 ألواح جيدة. خلال الأيام ال 7 القادمة ، ستصبح الخلايا الدبقية الصغيرة ناضجة (الشكل 1E) وجاهزة لمزيد من التجارب.
في اليوم 12 من تمايز الأعضاء في شبكية العين ، يتم هضم الخلايا الملتصقة لتعليق الثقافة ، ويضاف Medium E الذي يحتوي على الخلايا الدبقية الصغيرة إلى عضويات الشبكية. سوف تهاجر الخلايا الدبقية الصغيرة إلى عضويات الشبكية. من أجل مراقبة مورفولوجيا الخلايا الدبقية الصغيرة بوضوح ، أضفنا انتقال EGFP-lentivirus إلى hESCs ، مما جعل الخلايا الدبقية الصغيرة المتمايزة تعبر عن GFP لها تألق ذاتي (أخضر) (الشكل 2A-C). قمنا أيضا بفحص بنية أنسجة الكائنات العضوية في شبكية العين المزروعة بشكل مشترك مع الخلايا الدبقية الصغيرة باستخدام علامة الخلايا المستقبلة للضوء CRX وعلامة الخلايا الدبقية الصغيرة IBA1 عن طريق مقايسة التألق المناعي في عضويات الشبكية المستزرعة بشكل مشترك بعد التمايز لمدة 50 يوما (الشكل 2D).
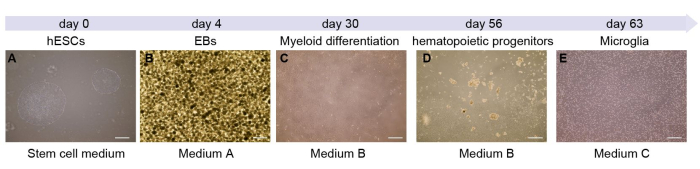
الشكل 1: رسم تخطيطي ومخطط زمني لخلية الخلايا الدبقية الصغيرة المشتقة من hESC. (أ) يبدأ البروتوكول بإذابة وتمرير الخلايا الجذعية السرطانية في صفيحة مكونة من 6 آبار. (ب) يتم نقل EBs المتجانسة التي تحتوي على الوسيط A. (C) EBs إلى طبق مطلي ، ويتم تشكيل السلف المكونة للدم في الأيام 4-56. (د، ه) في اليوم 56 ، يتم جمع المادة الطافية مع الخلايا (D) ونقلها إلى صفيحة منخفضة الالتصاق من 6 آبار لتشكيل الخلايا الدبقية الصغيرة في اليوم 63 (E). شريط المقياس: 500 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 2: صور تمثيلية على طول الجدول الزمني أثناء الاستزراع المشترك للخلايا الدبقية الصغيرة وعضويات الشبكية. (أ) صور تمثيلية لخلايا الخلايا الدبقية الصغيرة المشتقة من EGFP-hESC. (ب) الاستزراع المشترك للخلايا الدبقية الصغيرة EGFP + مع عضويات الشبكية بعد التمايز لمدة 18 يوما. (ج) الاستزراع المشترك للخلايا الدبقية الصغيرة EGFP + مع عضويات الشبكية بعد التمايز لمدة 30 يوما. شريط المقياس: 300 ميكرومتر. (D) تم استخدام CRX (علامة الخلايا المستقبلة للضوء ؛ الأحمر) و IBA1 (علامة الخلايا الدبقية الصغيرة ؛ الأخضر) للكشف عن بنية أنسجة عضويات الشبكية المزروعة بشكل مشترك مع الخلايا الدبقية الصغيرة بعد 50 يوما من التمايز. DAPI (الأزرق) بقع النواة. شريط المقياس: 30 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
الجدول 1: تكوين الوسائط المستخدمة في هذه الدراسة. يتم سرد المكونات المطلوبة لإعداد حجم 500 mL من كل وسيط في الجدول. الرجاء النقر هنا لتنزيل هذا الجدول.
Discussion
نظرا لمحدودية توافر شبكية العين البشرية ، فإن فهمنا الحالي للاستجابات الالتهابية للشبكية يأتي تقريبا من النماذج الحيوانية. للتغلب على هذا القيد ، تم تمييز عضويات الشبكية. كان تطوير نماذج الشبكية العضوية مجالا نشطا للبحث ، يهدف إلى تلخيص تعقيد شبكية العين البشرية لنمذجة المرض والتطوير العلاجي. أفادت العديد من الدراسات عن نجاحها في توليد عضويات شبكية العين من الخلايا الجذعية البشرية متعددة القدرات1،2،12،13. ومع ذلك ، فإن معظم هذه النماذج تفتقر إلى وجود الخلايا الدبقية الصغيرة ، والتي من المعروف أنها تلعب أدوارا حاسمة في نمو الشبكية والتسبب في المرض. حاولت الدراسات الحديثة دمج الخلايا الدبقية الصغيرة في عضويات الشبكية أو نماذج عضويات الدماغ16،17،18 ، لكن الطريقة التفصيلية غير واضحة. هنا ، نقدم بروتوكولا مفصلا خطوة بخطوة للاستزراع المشترك للخلايا الدبقية الصغيرة مع عضويات الشبكية في المرحلة المبكرة ، وكلاهما مشتق من نفس خط hESC. في حين أن بعض الدراسات قد استكشفت دور الخلايا الدبقية الصغيرة في أمراض الشبكية باستخدام النماذج الحيوانية أو أنظمة زراعة الخلايا7،8،9 ، فإن نموذج الثقافة المشتركة المقدم هنا يقدم نظاما أكثر صلة من الناحية الفسيولوجية قائما على الإنسان لدراسة تفاعلات الخلايا الدبقية الصغيرة والشبكية وآثارها في التسبب في المرض.
الخطوات الحاسمة هي حالة الخلية للخلايا الجذعية البشرية والتمايز بين الخلايا الدبقية الصغيرة وعضويات الشبكية. يجب التمييز بين الخلايا الدبقية الصغيرة و ROs خطوة بخطوة ، ويجب استخدام الكواشف الصحيحة والطبق (الطبق المعالج بالأنسجة المزروعة أو طبق التعليق) في مراحل مختلفة. يمكن أن يساعدنا هذا النموذج في فهم عملية كيفية مساهمة الخلايا الدبقية الصغيرة في حدوث أمراض الشبكية. وينطوي على آثار كبيرة على فحص المخدرات في المستقبل والتحقيقات في آليات المرض. ومع ذلك ، فإن الطرق التي ننشرها حاليا لا تزال بها بعض القيود. نظرا لفترة التمايز الطويلة للخلايا الدبقية الصغيرة وعدم وجود طرق مناسبة للحفظ بالتبريد ، يجب أن نخطط لوقتنا بحكمة لتمايز الخلايا الدبقية الصغيرة وعضويات الشبكية للثقافة المشتركة.
بالإضافة إلى عضويات الشبكية ، نعتقد أن دمج الخلايا المناعية في نماذج عضوية أخرى يمكن أن يعزز أيضا تطور الكائنات العضوية. لذلك ، يعد اختبار الأنظمة العضوية الأخرى أمرا بالغ الأهمية. يمثل دمج أنواع الخلايا المختلفة والكائنات العضوية لتشكيل أعضاء كاملة نموذجا واعدا للمستقبل.
Disclosures
لا يعلم المؤلفون بأي انتماءات أو عضوية أو منح أو حيازة مالية قد تؤثر على موضوعية هذه الدراسة.
Acknowledgements
هذه الدراسة مدعومة من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (82101145) ومؤسسة بكين للعلوم الطبيعية (Z200014).
Materials
| Name | Company | Catalog Number | Comments |
| Acctuase | Stemcell Technologies | 07920 | |
| Advanced DMEM/F12 | Thermo | 12634-010 | |
| Anti-CRX(M02) | abnova | H00001406-M02 | Antibody; dilution as per the manufacturer's instructions |
| Anti-IBA1 | Abcam | ab5076 | Antibody; dilution as per the manufacturer's instructions |
| B27 | Life Technologies | 17105-041 | |
| Dispase (1U/mL) | Stemcell Technologies | 07923 | |
| DMEM basic | Gibco | 10566-016 | |
| DMEM/F12 | Gibco | 10565-042 | |
| DPBS | Gibco | C141905005BT | |
| EDTA | Thermo | 15575020 | |
| F12 | Gibco | 11765-054 | |
| FBS | Biological Industry | 04-002-1A | |
| Gelatin | Sigma | G7041-100G | Solid |
| Glutamax | Gibco | 35050-061 | |
| H9 cell line | WiCell Research Institute | ||
| IL-3 | RD Systems | 203-IL-050 | |
| IL-34 | PeproTech | 200-34-50UG | |
| KSR | Gibco | 10828028 | |
| Matrix | Corning | 356231 | |
| M-CSF | RD Systems | 216-MC-500 | |
| MEM Non-essential Amino Acid Solution | Sigma | M7145 | |
| N2 | Life Technologies | 17502-048 | |
| Neurobasal | Gibco | 21103-049 | |
| Pen/strep | Gibco | 15140-122 | |
| Stem cell medium | Stemcell Technologies | 5990 | |
| Taurine | Sigma | T-8691-25G | |
| X-ViVO | LONZA | 04-418Q | |
| Y27632 | Selleck | S1049 | |
| β-mercaptoethanol | Life Technologies | 21985-023 |
References
- Cowan, C. S., et al. Cell types of the human retina and its organoids at single-cell resolution. Cell. 182 (6), 1623-1640.e34 (2020).
- Zhang, X., Jin, Z. B. Directed induction of retinal organoids from human pluripotent stem cells. J Vis Exp. (170), e62298(2021).
- Eiraku, M., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472 (7341), 51-56 (2011).
- Ginhoux, F., et al. Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science. 330 (6005), 841-845 (2010).
- Kierdorf, K., et al. Microglia emerge from erythromyeloid precursors via pu.1- and irf8-dependent pathways. Nat Neurosci. 16 (3), 273-280 (2013).
- Schulz, C., et al. A lineage of myeloid cells independent of myb and hematopoietic stem cells. Science. 336 (6077), 86-90 (2012).
- O'koren, E. G., et al. Microglial function is distinct in different anatomical locations during retinal homeostasis and degeneration. Immunity. 50 (3), 723-737.e7 (2019).
- Margeta, M. A., et al. Apolipoprotein E4 impairs the response of neurodegenerative retinal microglia and prevents neuronal loss in glaucoma. Immunity. 55 (9), 1627-1644.e7 (2022).
- Xu, J., et al. Enhanced innate responses in microglia derived from retinoblastoma patient-specific IPSCs. Glia. 72 (5), 872-884 (2024).
- Gosselin, D., et al. An environment-dependent transcriptional network specifies human microglia identity. Science. 356 (6344), eaal3222(2017).
- Galatro, T. F., et al. Transcriptomic analysis of purified human cortical microglia reveals age-associated changes. Nat Neurosci. 20 (8), 1162-1171 (2017).
- Nakano, T., et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 10 (6), 771-785 (2012).
- Kim, S., et al. transcriptome profiling, and functional validation of cone-rich human retinal organoids. Proc Natl Acad Sci U S A. 116 (22), 10824-10833 (2019).
- Gao, M. L., et al. Functional microglia derived from human pluripotent stem cells empower retinal organ. Sci China Life Sci. 65 (6), 1057-1071 (2022).
- Zhang, X., Jin, Z. B. Reconstruct human retinoblastoma in vitro. J Vis Exp. (188), e62629(2022).
- Park, D. S., et al. IPS-cell-derived microglia promote brain organoid maturation via cholesterol transfer. Nature. 623 (7986), 397-405 (2023).
- Usui-Ouchi, A., et al. Integrating human ipsc-derived macrophage progenitors into retinal organoids to generate a mature retinal microglial niche. Glia. 71 (10), 2372-2382 (2023).
- Chichagova, V., et al. Incorporating microglia-like cells in human induced pluripotent stem cell-derived retinal organoids. J Cell Mol Med. 27 (3), 435-445 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved