Method Article
用小胶质细胞组装视网膜类器官
摘要
小胶质细胞是视网膜中独特的常驻免疫细胞,在各种视网膜退行性疾病中起着至关重要的作用。生成视网膜类器官与小胶质细胞的共培养模型有助于更好地了解视网膜疾病的发病机制和发展进展。
摘要
由于人类视网膜的可及性有限,视网膜类器官 (ROs) 是研究人类视网膜疾病的最佳模型,它可以揭示视网膜发育的机制和视网膜疾病的发生。小胶质细胞 (MG) 是视网膜和中枢神经系统 (CNS) 中独特的常驻巨噬细胞,发挥着关键的免疫功能。然而,视网膜类器官缺乏小胶质细胞,因为它们的分化起点是卵黄囊。这些视网膜疾病中小胶质细胞的具体发病机制尚不清楚;因此,建立小胶质细胞掺入的视网膜类器官模型是必要的。在这里,我们成功地构建了视网膜类器官与来自人类干细胞的小胶质细胞的共培养模型。在本文中,我们区分了小胶质细胞,然后在早期共培养为视网膜类器官。作为免疫细胞的结合,该模型为视网膜疾病建模和药物筛选提供了一个优化的平台,以促进对视网膜和 CNS 相关疾病的发病机制和治疗的深入研究。
引言
作为人类视网膜的有限来源,人类干细胞分化为三维 (3D) 视网膜类器官代表了一种很有前途的模拟视网膜1 的体外模型。它在视网膜中包含不同的细胞类型,包括光感受器、视网膜神经节细胞、双极细胞、Müller 细胞、水平细胞和星形胶质细胞2。该模型能够模拟和研究视网膜发育机制和视网膜疾病的发病机制。然而,由于定向分化方法,视网膜类器官来源于神经外胚层3,缺乏许多其他源自不同胚层的细胞类型,例如来自卵黄囊的小胶质细胞和来自中胚层的血管周围细胞 4,5,6。
目前,许多视网膜疾病,如视网膜色素变性7、青光眼8 和视网膜母细胞瘤9,已被证明与视网膜内的小胶质细胞密切相关。然而,由于缺乏适当的研究模型,说明小胶质细胞与这些疾病之间关系的具体机制仍不清楚。虽然小鼠是研究视网膜疾病的有利模型,但最近的研究强调了小鼠和人类小胶质细胞在寿命、增殖速率和人类同源基因缺失方面的显著差异10,11。这些发现表明,从小鼠模型中得出的结论可能并不完全可靠,这强调了构建包含小胶质细胞的人类视网膜类器官的重要性。
在过去的几十年里,已经开发了各种视网膜类器官 3D 分化的方法12,13。为了促进视网膜类器官内小胶质细胞的共培养操作,我们选择了一种涉及从贴壁培养过渡到悬浮培养的分化方法。这种方法成功地使小胶质细胞能够掺入视网膜类器官中,使它们维持至少 60 天14。
研究方案
本研究获得首都医科大学北京同仁医院机构伦理委员会批准。HESC 细胞系 H9 来自 WiCell 研究所。实验前在室温 (RT) 下预热细胞培养基 30 分钟。
1. 人类小胶质细胞的产生
- 在干细胞培养基中培养 hESCs,直到细胞密度达到 80%-90%。在每个孔中接种至少 1 x 106 个细胞。
- 吸出干细胞培养基并用 1x DPBS(1 mL/孔的 6 孔板)冲洗细胞。下一步需要 2 x 107-1 x 108 个细胞。如果不够,请合并 2-5 个孔的细胞以执行以下步骤。
- 使用 0.5 mM EDTA 溶液在 37 °C 培养箱(1 mL/孔的 6 孔板)中解离干细胞集落约 5 分钟。
- 5 分钟后检查菌落形态。当集落边缘略微卷曲并出现松散的间隙时,细胞就可以分化并吸出 EDTA。如果没有,请将细胞在 37 °C 下再孵育 1-2 分钟。孵育时间不要超过 8 分钟。
- 使用 6 mL 培养基 A(表 1)和 6 μL 10 mM ROCK 抑制剂 Y-27632 溶液轻轻冲洗每个孔中的细胞。轻轻敲击培养皿底部以帮助冲洗细胞。将日期设置为第 0 天。
注意:不要移液细胞。细胞将在第二天形成胚状体 (EB)。 - 24 小时后,在显微镜下观察细胞以确认 EB 形成。用 10 mL 移液管将 EB 收集到 15 mL 离心管中,等待 EB 在 5 分钟内沉降到底部。
- 小心吸出上清液,用 6 mL 新鲜培养基 A 重悬 EB,然后将它们转移到新的 6 孔板低粘附孔中。在 37 °C 培养箱中培养。
注:第 1 天转移孔的目的是减少 EB 形成过程中大量死细胞的影响,这可能会影响细胞生长状态。 - 每天刷新新鲜的培养基 A,直到第 4 天(6 mL/孔的 6 孔板)。
- 第 4 天,在 5% CO2、37 °C 培养箱中用 3 mL 0.1% 鱼明胶溶液包被 10 cm 培养皿至少 1 小时。
注意:如果涂层时间少于 1 小时,则很难执行以下步骤。 - 用 10 mL 移液管小心地将 EB 收集到 15 mL 离心管中,然后等待 EB 在 5 分钟内沉降到底部。
- 取出 0.1% 明胶溶液,用 5-6 mL 的 1x DPBS 冲洗 10 cm 培养皿一次。删除 DPBS。
- 在 15 mL 离心管中用 15 mL 培养基 B(表 1)轻轻重悬 EB,然后将它们转移到涂层的 10 cm 培养皿中。在 37 °C、5% CO2 培养箱中培养 1 周。
注意:在前 7 天内,不要移动盘子。 - 每周一次用新鲜的培养基 B 刷新,直到第 49 天(15 mL/10 cm 培养皿),并每周在显微镜下检查细胞一次。
注意:第 49 天后,可以在培养皿的上清液中找到几个分泌细胞。 - 在 RT 下以 200 x g 离心上清液细胞 5 分钟。
- 小心吸出上清液,用 2 mL 新鲜培养基 B 重悬细胞,然后转移到新的 6 孔板低粘附孔中。在 5% CO2、37 °C 培养箱中孵育。
注意:在接下来的 7 天内,请勿移动板。小胶质细胞可以很好地粘附在低粘附力的底部。 - 第 56 天,更换为培养基 C(表 1)(2 mL/孔的 6 孔板)。小胶质细胞很好地粘附在低粘附力的底部,在显微镜下看起来呈分枝状。
注:通过每 3 天更换培养基 C(2 mL/孔的 6 孔板),小胶质细胞可以在培养基 C 中培养约 15 天。
2. 生成人类 RO 并将 RO 与小胶质细胞共培养
- 在干细胞培养基中培养 hESCs,直至细胞密度达到 80%-90%。在每个孔中接种至少 1 x 106 个细胞。
- 向培养池中加入 Dispase(1 mL/孔 6 孔板)。在 37 °C 孵育 5 分钟。从孔中吸出 Dispase 溶液。
- 向孔中加入培养基 D(表 1)(1 mL/孔,6 孔板)。用 10 μL 移液器将细胞切成小块。
- 将所有细胞碎片和培养基轻轻收集在 1.5 mL 微量离心管中。
- 以 200 x g 离心 5 分钟,然后去除上清液。
- 将细胞轻轻重悬于 200 μL 的冷基质中。将 1.5 微量离心管移至培养箱中 20 分钟。操作速度快,因为基质会在室温 (RT) 下凝固。在培养箱中 20 分钟后,基质将凝固。
- 用 15 mL 培养基 D 制备一个 10 cm 培养皿。用培养基 D 重悬基质,轻轻摇动培养皿。
- 然后,将培养皿放入培养箱中 5 天。不要移动板。将日期设置为第 0 天 (RO)。细胞将在 3 天内粘附。
- 在第 5 天 (ROs) 和第 10 天 (ROs),用培养基 D 刷新培养基。
- 在第 12 天 (RO) 上,去除培养基并向每个培养皿中加入 3 mL 分散酶 5 分钟。
- 吸出分散酶并加入 15 mL 培养基 E(表 1)。
- 收获小胶质细胞:在第 56 天 (MGs),轻轻吸出培养基 C,加入 Accutase(1 mL/孔的 6 孔板),并在 37 °C 下孵育 3 分钟。
- 用 5 mL 移液管将小胶质细胞收集到 15 mL 离心管中。在 RT 下以 200 x g 离心细胞 5 分钟。
- 轻轻吸出上清液,并用 1 mL 培养基 E 悬浮小胶质细胞。第 12 天将小胶质细胞添加到消化的 RO 中。
注意:在第 12 天 (ROs),细胞是粘附性的。在第 13 天 (ROs),发现细胞悬浮在培养基 E 中。如果培养基从第 12 天 (RO) 变为黄色到第 19 天 (RO),请使用培养基 E 刷新培养基。 - 在第 19 天 (ROs),通过轻轻旋转板将类器官聚集到培养皿的中心。轻轻吸出培养基 E,然后用培养基 F 刷新培养基。
- 将含有培养基 F 的类器官转移到新的悬浮培养皿中。
- 每周更换一次培养基并选择类器官进行实验。
结果
生成视网膜类器官的过程在我们之前的研究15 中进行了描述。在这里,我们展示了小胶质细胞和共培养小胶质细胞和视网膜类器官的代表性结果。
在这里,我们展示了小胶质细胞分化的每个阶段(图 1A)。第 0 天代表干细胞培养的阶段。然后,消化和培养干细胞以形成 EB。在该过程的最初 4 天内,细胞将形成 EB(图 1B)。随后,我们将悬浮的 EB 转移到贴壁的 10 cm 培养皿中。大约 7 天后,细胞与 图 1C 中所示的细胞相似。随着培养的进行,贴壁细胞将造血祖细胞分泌到上清液中(图 1D)。此过程大约需要 45 天。此时,可以从上清液中收获细胞并转移到 6 孔板中。在接下来的 7 天内,小胶质细胞将成熟(图 1E)并准备好进行进一步的实验。
在视网膜类器官分化的第 12 天,将贴壁细胞消化至悬浮培养物中,并将含有小胶质细胞的培养基 E 添加到视网膜类器官中。小胶质细胞将迁移到视网膜类器官中。为了清楚地观察小胶质细胞的形态,我们在 hESC 中加入了 EGFP 慢病毒转染,这使得分化的小胶质细胞表达 GFP 具有自发荧光(绿色)(图 2A-C)。我们还在分化 50 天后,通过免疫荧光测定在小胶质细胞共培养的视网膜类器官中使用感光细胞标志物 CRX 和小胶质细胞标志物 IBA1 检查了与小胶质细胞共培养的视网膜类器官的组织结构(图 2D)。
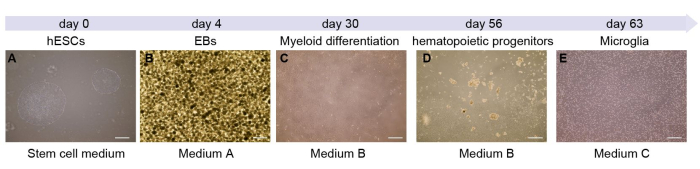
图 1:源自 hESC 的小胶质细胞的示意图和时间表。(A) 该方案从 6 孔板中 hESC 的解冻和传代开始。(B) 含有培养基 A 形成的均质 EB。(C) EB 转移到包被培养皿中,并在第 4-56 天形成造血祖细胞。(D,E)在第 56 天,收集带有细胞的上清液 (D) 并在第 63 天 (E) 转移至低粘附性 6 孔板以形成小胶质细胞。比例尺:500 μm。请点击此处查看此图的较大版本。

图 2:小胶质细胞和视网膜类器官共培养过程中沿时间轴的代表性图像。 (A) 来自 EGFP-hESC 的小胶质细胞的代表性图像。(B) 分化 18 天后 EGFP+ 小胶质细胞与视网膜类器官的共培养。(C) 分化 30 天后 EGFP+ 小胶质细胞与视网膜类器官的共培养。比例尺:300 μm。(D) CRX(感光细胞标志物;红色)和 IBA1(小胶质细胞标志物;绿色)用于检测分化 50 天后与小胶质细胞共培养的视网膜类器官的组织结构。DAPI(蓝色)对细胞核进行染色。比例尺:30 μm。 请点击此处查看此图的较大版本。
表 1:本研究中使用的培养基成分。 表中列出了制备 500 mL 体积的每种培养基所需的组分。 请点击此处下载此表格。
讨论
由于人类视网膜的可用性有限,我们目前对视网膜炎症反应的理解几乎来自动物模型。为了克服这一限制,对视网膜类器官进行了分化。视网膜类器官模型的开发一直是一个活跃的研究领域,旨在概括人类视网膜的复杂性,用于疾病建模和治疗开发。几项研究报道了从人类多能干细胞中成功生成视网膜类器官 1,2,12,13。然而,这些模型中的大多数缺乏小胶质细胞的存在,众所周知,小胶质细胞在视网膜发育和疾病发病机制中起着至关重要的作用。最近的研究试图将小胶质细胞整合到视网膜类器官或脑类器官模型中 16,17,18,但具体方法尚不清楚。在这里,我们提供了在早期阶段将小胶质细胞与视网膜类器官共培养的详细分步方案,两者均来自相同的 hESC 系。虽然一些研究使用动物模型或细胞培养系统探讨了小胶质细胞在视网膜疾病中的作用 7,8,9,但这里介绍的共培养模型为研究小胶质细胞-视网膜相互作用及其在疾病发病机制中的影响提供了一个更具生理相关性的人类系统。
关键步骤是人类干细胞的细胞状态以及小胶质细胞和视网膜类器官的分化。应逐步区分小胶质细胞和 ROs,并在不同阶段使用正确的试剂和培养皿 (组织培养处理的培养皿或悬浮培养皿)。该模型可以帮助我们了解小胶质细胞如何导致视网膜疾病发生的过程。它对未来的药物筛选和疾病机制的研究具有重要意义。但是,我们目前发布的方法仍然存在一些限制。由于小胶质细胞的分化期延长且缺乏合适的冷冻保存方法,我们应该明智地规划小胶质细胞和视网膜类器官分化以进行共培养的时间。
除了视网膜类器官,我们相信将免疫细胞整合到其他类器官模型中也可以促进类器官发育。因此,测试其他类器官系统至关重要。整合各种细胞类型和类器官以形成完整的器官代表了未来的有前途的模式。
披露声明
作者不知道任何可能影响本研究客观性的从属关系、会员资格、赠款或财务持有。
致谢
这项研究得到了中国国家自然科学基金 (82101145) 和北京自然科学基金 (Z200014) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| Acctuase | Stemcell Technologies | 07920 | |
| Advanced DMEM/F12 | Thermo | 12634-010 | |
| Anti-CRX(M02) | abnova | H00001406-M02 | Antibody; dilution as per the manufacturer's instructions |
| Anti-IBA1 | Abcam | ab5076 | Antibody; dilution as per the manufacturer's instructions |
| B27 | Life Technologies | 17105-041 | |
| Dispase (1U/mL) | Stemcell Technologies | 07923 | |
| DMEM basic | Gibco | 10566-016 | |
| DMEM/F12 | Gibco | 10565-042 | |
| DPBS | Gibco | C141905005BT | |
| EDTA | Thermo | 15575020 | |
| F12 | Gibco | 11765-054 | |
| FBS | Biological Industry | 04-002-1A | |
| Gelatin | Sigma | G7041-100G | Solid |
| Glutamax | Gibco | 35050-061 | |
| H9 cell line | WiCell Research Institute | ||
| IL-3 | RD Systems | 203-IL-050 | |
| IL-34 | PeproTech | 200-34-50UG | |
| KSR | Gibco | 10828028 | |
| Matrix | Corning | 356231 | |
| M-CSF | RD Systems | 216-MC-500 | |
| MEM Non-essential Amino Acid Solution | Sigma | M7145 | |
| N2 | Life Technologies | 17502-048 | |
| Neurobasal | Gibco | 21103-049 | |
| Pen/strep | Gibco | 15140-122 | |
| Stem cell medium | Stemcell Technologies | 5990 | |
| Taurine | Sigma | T-8691-25G | |
| X-ViVO | LONZA | 04-418Q | |
| Y27632 | Selleck | S1049 | |
| β-mercaptoethanol | Life Technologies | 21985-023 |
参考文献
- Cowan, C. S., et al. Cell types of the human retina and its organoids at single-cell resolution. Cell. 182 (6), 1623-1640.e34 (2020).
- Zhang, X., Jin, Z. B. Directed induction of retinal organoids from human pluripotent stem cells. J Vis Exp. (170), e62298(2021).
- Eiraku, M., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472 (7341), 51-56 (2011).
- Ginhoux, F., et al. Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science. 330 (6005), 841-845 (2010).
- Kierdorf, K., et al. Microglia emerge from erythromyeloid precursors via pu.1- and irf8-dependent pathways. Nat Neurosci. 16 (3), 273-280 (2013).
- Schulz, C., et al. A lineage of myeloid cells independent of myb and hematopoietic stem cells. Science. 336 (6077), 86-90 (2012).
- O'koren, E. G., et al. Microglial function is distinct in different anatomical locations during retinal homeostasis and degeneration. Immunity. 50 (3), 723-737.e7 (2019).
- Margeta, M. A., et al. Apolipoprotein E4 impairs the response of neurodegenerative retinal microglia and prevents neuronal loss in glaucoma. Immunity. 55 (9), 1627-1644.e7 (2022).
- Xu, J., et al. Enhanced innate responses in microglia derived from retinoblastoma patient-specific IPSCs. Glia. 72 (5), 872-884 (2024).
- Gosselin, D., et al. An environment-dependent transcriptional network specifies human microglia identity. Science. 356 (6344), eaal3222(2017).
- Galatro, T. F., et al. Transcriptomic analysis of purified human cortical microglia reveals age-associated changes. Nat Neurosci. 20 (8), 1162-1171 (2017).
- Nakano, T., et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 10 (6), 771-785 (2012).
- Kim, S., et al. transcriptome profiling, and functional validation of cone-rich human retinal organoids. Proc Natl Acad Sci U S A. 116 (22), 10824-10833 (2019).
- Gao, M. L., et al. Functional microglia derived from human pluripotent stem cells empower retinal organ. Sci China Life Sci. 65 (6), 1057-1071 (2022).
- Zhang, X., Jin, Z. B. Reconstruct human retinoblastoma in vitro. J Vis Exp. (188), e62629(2022).
- Park, D. S., et al. IPS-cell-derived microglia promote brain organoid maturation via cholesterol transfer. Nature. 623 (7986), 397-405 (2023).
- Usui-Ouchi, A., et al. Integrating human ipsc-derived macrophage progenitors into retinal organoids to generate a mature retinal microglial niche. Glia. 71 (10), 2372-2382 (2023).
- Chichagova, V., et al. Incorporating microglia-like cells in human induced pluripotent stem cell-derived retinal organoids. J Cell Mol Med. 27 (3), 435-445 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。