Method Article
酸化亜鉛ナノ粒子の調製と抗菌効果の評価
* これらの著者は同等に貢献しました
要約
本研究では、沈殿法を用いて酸化亜鉛ナノ粒子を合成しました。合成された粒子の抗菌効果は、多剤耐性メチシリン耐性 黄色ブドウ球 菌(MRSA)および 緑膿菌 菌株に対して試験されました。
要約
院内細菌感染症は、抗生物質に対する固有の耐性により、ますます困難になっています。病院における多剤耐性菌株の出現は、抗生物質の広範かつ多様な使用に起因しており、抗生物質耐性の問題をさらに悪化させています。金属ナノマテリアルは、抗生物質耐性細菌細胞を根絶するための代替ソリューションとして広く研究されてきました。金属ナノ粒子は、抗菌イオンの放出、活性酸素種の生成、物理的撹乱など、細菌が抵抗力を発現できないさまざまなメカニズムで細菌細胞を攻撃します。抗菌性金属ナノ粒子の中でも、FDAの認可を受けた酸化亜鉛ナノ粒子は、生体適合性や抗菌性が知られています。本研究では、酸化亜鉛ナノ粒子の合成のための沈殿法の開発、そのナノ粒子の性質解析、抗菌試験の実施に着目しました。酸化亜鉛ナノ粒子は、透過型電子顕微鏡(TEM)、動的光散乱(DLS)、紫外線/可視分光法、およびX線回折(XRD)を使用して特性評価されました。抗菌試験は、メチシリン耐性黄色ブドウ 球 菌(MRSA)および 緑膿菌の多剤耐性株を用いたブロス微量希釈試験を用いて実施しました。この研究は、酸化亜鉛ナノ粒子が抗生物質耐性菌の増殖を阻害する可能性を実証しました。
概要
多剤耐性(MDR)細菌感染症は、人間の健康に重大な世界的な脅威をもたらします1。これらの感染症は基礎疾患のある患者にとって致命的となる可能性があるため、活発な研究がこの問題に対処しようとしています2。細菌は、さまざまな薬物の作用を避けるために進化してきました。ペニシリンは、世界中で何百万人もの命を救ったことで広く知られ、認められているβラクタム系抗生物質で、細菌の細胞壁の合成を阻害します3。しかし、細菌は、排出ポンプ、トランスペプチダーゼの変化、透過性の低下など、さまざまなメカニズムを通じて薬物の有効性を中和するように進化してきました4。さらに、細菌細胞はこれらの耐性遺伝子を次世代に伝達することができ、後続世代の生存率を高め、耐性株の問題を強化する5。
抗生物質耐性菌の増加は、一般的に複数の抗生物質に対する耐性を示すMDR細菌の出現につながっています。MDR株は、複数の細菌株がさまざまな抗生物質にさらされ、その結果、さまざまな抗生物質に対する耐性を獲得する病院環境で最も頻繁に遭遇します6。黄色ブドウ球菌、特にメチシリン耐性黄色ブドウ球菌(MRSA)は、ヒトの約30%の皮膚にクラスターを形成するグラム陽性共生細菌です7,8。1960年代に初めて同定されたMRSAは、βラクタム系抗生物質に対する感受性が低下し、1990年代以降、感染率が急激に増加しました9。グラム陰性菌の中でも、緑膿菌(P. aeruginosa)は病院で多く見られる株の一つです。 この種は通性桿体状の細菌で、ヒトに日和見感染を引き起こす10。特に、人間の健康に直接影響を与えるMDR株は、医療関連感染症の50%以上を占めています11。本研究では、病院内で最も多く見られる多剤耐性株であるMRSAと緑膿菌を利用しました。
抗菌目的でのナノ粒子(NP)の使用は、抗生物質耐性の問題に取り組むために広く研究されてきました。特に金属NPは、さまざまなメカニズムで細菌細胞死を誘導し、薬剤耐性の問題に対する解決策となる可能性があります。金属NPは、抗菌イオンの放出、活性酸素種(ROS)の生成、細胞の物理的破壊など、複数のメカニズムを通じて抗菌活性を発揮する12。銀、銅、酸化亜鉛(ZnO)、酸化チタンからなるNPは、高い抗菌効果を有しており、盛んに研究されている13。
ZnO NPは、米国食品医薬品局(FDA)によってヒトでの使用が承認されています。逆に、銀や銅のNPは、その高い抗菌効果にもかかわらず、その高い細胞毒性により、ヒトでの使用が制限されています。しかし、ZnO NPは日常生活で一般的に見られ、広く使用されている日焼け止め製剤にも存在します14。注目すべきは、ZnO NPから放出されるZn2+ イオンは、細菌治療に非常に効果的であり、ROSの生成やその他の物理的損傷メカニズムを通じて細菌細胞死を誘導する15。
本研究では、沈殿法を用いてZnOナノ粒子(NPs)を合成するプロトコールを概説するとともに、MRSAおよび 緑膿菌の臨床検体を用いたミクロブロス希釈法を用いた抗菌試験アプローチについて紹介します。ZnO NPsの沈殿法は、酢酸亜鉛や硝酸亜鉛などの可溶性前駆体を用いてpHおよび温度を調整することにより、不溶性固体ZnO NPを合成することを含む16。この方法は、比較的容易で迅速な生産に加えて、合成の再現性を確保し、粒子サイズと形態の制御を容易にします17。この合成プロトコルでは、最も一般的に使用される沈殿剤の1つである水酸化ナトリウム(NaOH)を酢酸亜鉛を沈殿させるために利用し、ナノ粒子18の制御されていない合成を阻害するために少量の臭化ヘキサデシルトリメチルアンモニウム(CTAB)を使用した。様々な抗菌試験の中でも、ZnOナノ粒子の抗菌活性は、金属酸化物ナノ粒子からの光干渉を回避し、MIC19を決定するための直接コロニー測定を可能にするミクロブロス希釈法を用いて評価されました。
プロトコル
この研究で使用した試薬と機器は、 材料表に記載されています。
1. 酸化亜鉛ナノ粒子の調製
- 200mLの無水エチルアルコールを測定し、ガラスの丸底フラスコに注ぎます。
- 丸底フラスコを加熱マントルに置き、25〜40°Cで攪拌を維持します。
- 50 mLバイアルで500 mgのCTABを測定し、フラスコのエチルアルコールに加えます。.CTABが完全に溶解するまで撹拌します。
- 酢酸亜鉛1.4gを溶液に加え、完全に溶解するまで攪拌します。
- ヒーティングマントル温度を70°Cに設定して、溶液の温度を上げます。
- 混合物に0.5 M NaOH溶液25 mLを加え、透明な溶液が白色になるまで1時間反応させます。
- 溶液を50mLのコニカルチューブに分注し、室温で15000 × g で15分間遠心分離し、上清を捨てます。
- コニカルチューブの1つに10mLの蒸留水を加え、溶液を超音波処理してナノ粒子を再懸濁します。懸濁溶液をZnOペレットを含む別の円錐形チューブに移し、すべてのZnO溶液が1つの円錐形チューブに集まるまで繰り返します。
- ナノ粒子を15000 × g で15分間(室温)遠心分離して洗浄し、上清を除去し、蒸留水に再懸濁します。pH試験紙を使用して上澄み液のpHを確認し、溶液のpHが中性になるまで繰り返します。
注:上清液のpHが中性(pH = 7)になったら、上清液を廃棄し、蒸留水で再懸濁しないでください。 - サンプルパレットを60°Cで24時間真空乾燥し、ZnO NP粉末を得ます。
2. MRSAと緑膿菌を用いた抗菌試験
- 細菌培養
注:臨床MDR細菌株は、韓国のソウルにある中央大学病院から入手しました。- トリプシン大豆ブロス(TSB)にストックされたMRSAおよび 緑膿菌株 をディープフリーザーから取り出します。
- 細菌溶液を解凍した後、使い捨ての接種ループを使用して、溶液をトリプシン大豆寒天培地(TSA)プレートに縞模様にします。縞模様の寒天プレートをインキュベーターに入れ、24時間インキュベートします。
注:TSAプレートから選択した単一のコロニーを、細菌接種ループを使用して50 mLコニカルチューブ内の10 mLのTSB培地に添加しました。細菌を24時間培養した。細菌は、37°Cの好気培養条件下で培養しました。 - 細菌溶液の濃度を測定するには、蒸留水を使用して10倍段階希釈して10-6 に培養溶液を希釈します。その後、希釈した溶液50μLをTSAプレートに置き、L型スプレッダーで溶液を広げます。
- プレートをインキュベーター内で24時間インキュベートします。
注:コロニーを光学的にカウントし、培養溶液の濃度を希釈係数にカウントしたコロニーの数を掛けることによって計算しました。
- バクテリアサンプリング
- 広範囲のZnO濃度をテストするには、ダルベッコのリン酸緩衝生理食塩水(DPBS)を使用して2 mg/mLのZnO NPs溶液を調製し、2倍段階希釈を行ってさまざまな濃度を作ります。
注:1000 μg/mL、500 μg/mL、250 μg/mL、125 μg/mL、および62.5 μg/mLを試験しました。 - 試験したZnO NPの濃度ごとに100 μLを96ウェルプレートに加えます。
注:ウェル内の各サンプルは100μLの細菌培養物を添加して希釈されるため、ZnO NPの最終所望濃度の2倍(2倍)を使用してください。ポジティブコントロールとして2%抗生物質-抗真菌薬(A / A)溶液を使用し、ネガティブコントロールとしてDPBSを使用します。A/Aはペニシリンとストレプトマイシンの抗生物質複合体で、それぞれグラム陽性菌とグラム陰性菌に効果があります。 - TSB培地を使用して細菌培養物を1 × 106 CFU/mLに希釈し、異なる濃度のZnO NPを含む各ウェルに100 μLを加えます。
注:初期のMRSAおよび 緑膿菌の 培養溶液濃度は3 x 109 CFU / mLでした。細菌培養濃度1×106CFU /mLは、培養液の1/20および1/150希釈により調製した。100 μL の ZnO NP と混合した後、細菌の最終濃度は 5 × 105 CFU/mL になります。 - 96ウェルプレートを37°Cのインキュベーターに置き、24時間インキュベートします。
- 広範囲のZnO濃度をテストするには、ダルベッコのリン酸緩衝生理食塩水(DPBS)を使用して2 mg/mLのZnO NPs溶液を調製し、2倍段階希釈を行ってさまざまな濃度を作ります。
- 細菌の拡散
- 各ウェルから100μLをピペットで移し、10-6になるまで様々な10倍段階希釈液を調製します。
注:細菌溶液を含むZnO NP100 μLを900 μLの滅菌蒸留水に加え、6回繰り返します。 - 4つの希釈溶液から50μLをピペットで取り出し、TSA培地プレートに加えます。L字型のセルスプレッダーを使用して、細菌懸濁液を寒天プレートに広げます。
注意: 100、10-2、10-4、および10-6 希釈を使用してください。すべての実験を3回に分けて実施します。すべての細菌溶液が寒天プレートに吸収されるまで広げます。 - 寒天プレートを37°Cのインキュベーターに入れ、24時間インキュベートします。
- 各ウェルから100μLをピペットで移し、10-6になるまで様々な10倍段階希釈液を調製します。
- バクテリアCFU計数
- 各グループでカウント可能な希釈係数を選択します。可算希釈プレート内のすべてのコロニーをマークし、濃度が # of CFU/mL になるように再計算します。
注:可算希釈係数は、個々のプレートに20〜100 CFUを持つプレートを示します。最初にカウントされた濃度結果 # カウントされた CFU/50 μL 希釈されていない細菌溶液を含むスプレッドプレートを使用して、潜在的な最小殺菌濃度を決定します。 - 取得したデータを使用して、ネガティブコントロールの細菌に対する生きた細菌の割合を表します。
注:生きた細菌の割合(%)=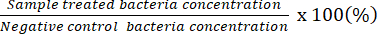
- 各グループでカウント可能な希釈係数を選択します。可算希釈プレート内のすべてのコロニーをマークし、濃度が # of CFU/mL になるように再計算します。
結果
ZnO NPの合成の成功は、 図1Aに示すように、透過型電子顕微鏡(TEM)を用いて確認されました。得られたZnO NPは、平均粒径が35.35 nm、標準偏差が6.81 nmの円形であることが観察されました。これらのナノ粒子の沈殿は、酢酸亜鉛にNaOH溶液を添加し、Zn2+ イオンが加水分解を受ける二重置換反応によって観察されました。
動的光散乱(DLS)を用いて、 図1Bに示すように、合成されたナノ粒子の平均サイズとゼータ電位は、それぞれ130.4 nmと28.92 mVと決定されました。DLSを用いて測定したZnO NPsのサイズがTEM画像から得られたサイズと異なるのは、裸のナノ粒子の凝集によるものであった。正のゼータ電位は、細菌の細胞表面と静電的に相互作用し、物理的損傷を引き起こす可能性のあるZnO NPの獲得を間接的に確認しました。ゼータ電位の大きさは、コロイド系のポテンシャル安定性を示します。懸濁液中のすべての粒子が大きな正または負のゼータ電位を持っている場合、それらは互いに反発する傾向があり、凝集を防ぎます。ゼータ電位が+30mVより大きいまたは-30mV未満の粒子は、一般に安定していると見なされます。合成されたZnO NPは+28.92mVのゼータ電位を示し、水中での相対的な安定性を示しました20。
ZnO NPの吸収スペクトルをマイクロプレートリーダーを用いて調べたところ、360 nmにおけるZnOの特異的な吸収ピークが明らかになりました(図1C)。前駆体酢酸亜鉛には固有のピークがありませんが、ZnO NPには360〜370 nmに固有のピークがあることが知られています。この合成は、合成されたZnONPs中に360nmの特異なピークが存在することによって確認された21。これらの特異的なUV吸収特性により、ZnO NPの直接合成が確認されました。さらに、X線回折(XRD)分析(図1D)により、ZnOの特徴である明確な結晶ピークが明らかになりました。ZnO NPsの代表的なウルツ岩構造(JCPDS No.36-1415)と比較すると、(1, 0, 0), (0, 0, 2), (1, 0, 1), (1, 0, 2), (1, 1, 0), (1, 0, 3), (2, 0, 0), (1, 1, 2), (2, 0, 1)は22に整列していることが観察されました。
合成されたZnO NPの抗菌効果は、韓国ソウルの中央大学病院から入手した緑膿菌およびMRSAの臨床サンプルに対するマイクロブロス希釈試験を使用して評価されました。細菌培養物の画像を解析のために撮影しました。同じ希釈係数を使用してナノ粒子の抗菌効果を視覚的に評価するために、希釈されていない細菌溶液を塗布したスプレッドプレートを使用しました(図2A、B)。元の溶液を塗布したスプレッドプレートを使用して、潜在的な最小殺菌濃度を決定しました。両菌株とも最高濃度でも細菌コロニーが観察されたため、完全な殺菌効果は得られませんでした。各グループの細菌濃度は、可算希釈係数を使用して計算されました。各治療群とネガティブコントロール群の生存率を比較したところ、緑膿菌株とMRSA株の両方でZnO NPの抗菌効果が明らかでした。ZnO NPの研究された細胞毒性範囲を考慮して、毒性を誘発することが知られている最高濃度である1000μg / mLから始まり、62.5μg / mLの非毒性範囲まで、段階希釈23,24を通じて、さまざまなZnO濃度が試験されました。緑膿菌の場合、ZnO NPsの抗菌活性は濃度依存的に増加しました(図2A)。しかし、希釈されていない(100)細菌培養の開始から緑膿菌細菌コロニーの数の目に見える減少は明らかではありませんでした。
逆に、ZnO NPはグラム陽性菌MRSAに対して高い抗菌活性を示し、希釈した細菌培養の画像と希釈していない細菌培養物(100)の画像を比較することで確認されたように、細菌コロニー形成単位(CFU)が顕著に減少しました。この結果から、合成したZnO NPsは両菌株に対して抗菌活性を示し、特にMRSA株に対して高い有効性を示すことが確認されました。

図1:酸化亜鉛ナノ粒子の特性評価 (A)ZnO NPの異なる倍率での透過型電子顕微鏡画像。(B)DLS解析によるサイズ(左)とゼータ電位分布(右)。(C)マイクロプレートリーダーを使用したZnO NPの吸光度スペクトル。(D)ZnO NPとその結晶ピークのXRD分析。 この図の拡大版を表示するには、ここをクリックしてください。

図2:5 x 105 CFU/mL細菌株で試験したZnO NPsの抗菌特性 (A) 緑膿菌 株に対する抗菌試験。(B) MRSA 株に対する抗菌試験。N = ネガティブコントロール(DPBS)、P = ポジティブコントロール(A / A)。アスタリスクは、対照群と比較した統計的に有意な差 ****p ≤ 0.0001 を示します。データは±トリプリケートで実施された3つの独立した実験の平均SDとして提示されました。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
沈殿 による ZnO NPの合成は比較的単純で簡単です。この方法を使用してZnO NPをうまく合成するには、前駆体(酢酸亜鉛)が溶媒に完全に溶解していることを確認するために攪拌することが重要です。さらに、温度を上げると、成功した二重変位反応を誘発するのに役立ちます。ZnO NPの合成には、沈殿剤、沈殿剤の濃度、界面活性剤など、サイズや形状を決定する多くの要因があります。NaOH以外の沈殿剤を使用すると、粒子の形状が変わることがあります。Gharpureらによって報告されているように25、水酸化アンモニウム(NH4OH)を使用して酢酸亜鉛をさまざまな界面活性剤とともに沈殿させたとき、粒子は主に円錐形と三角形に合成されました。水酸化カリウム(KOH)を用いて合成しても、球状の粒子を見ることは困難であった26。この観察により、NaOHによる沈殿が丸みを帯びた形状のZnOナノ粒子の合成を促進することが確認されました。
本研究では、ZnO NPsのバイオメディカルへの応用が期待できることと、迅速な合成法の開発により、少量の界面活性剤とNaOHを用いてZnO NPを合成した。その結果、丸い形状のナノスケール粒子の合成は可能であったにもかかわらず、均質な球状粒子の合成は、追加の修飾なしには制限されていた27。ZnO NPは、非極性溶媒または極性溶媒と非極性溶媒の混合中によく分散することが知られているため、水中での安定性と凝集の問題は限定的です28,29。ZnO NPsがDPBSに分散しているため、凝集現象が観察され、これはTEM像とDLS測定値のサイズの違いから明らかでした。キャッピング剤や3-アミノプロピルトリエトキシシラン(APTES)などのカップリング剤の導入により、水中での分散が促進されることが期待されますが、この研究ではZnO NPsの固有の抗菌特性を評価するための変更は行われませんでした30。
本研究で提示されたZnO NPの合成方法は、高圧や熱を必要とせず、少量の界面活性剤31,32以外のリンカーを含まないという点で、マイクロ波支援技術やソルボサーマル技術とは異なる。合成反応時間はわずか2時間で、誰でも簡単に手に入れることができます。生物医学的応用の観点から、本研究では、中洋大学から入手したMDR臨床サンプルを用いてZnO NPの抗菌特性を評価し、実環境で細菌を根絶するために必要なZnO濃度を決定することを可能にしました。緑膿菌に対してほとんどの細菌が60μg/mLの濃度範囲で根絶されたKhanらの研究と比較すると、この研究で使用されたMDR臨床株はより高い生存率を示したことがわかりました33。
合成されたZnO NPsの抗菌効果を、 P. aeruginosa およびMRSA株に対して評価した。実験中のバクテリアの倍加時間が短いため、まずナノ粒子溶液を96ウェルプレートに入れ、次にバクテリア溶液を速やかに加えることが重要です。また、ナノ粒子の抗菌活性を正確に測定するためには、様々な希釈液を用いて培養することが重要です。10倍段階希釈液の生成中に細菌溶液を完全に混合することも重要です。そのため、慎重なピペッティングとボルテックスが必要です。ただし、この実験手順には時間がかかることに注意する必要があります。したがって、600 nmの吸光度測定値を使用した予備評価により、培養前の抗菌活性の概算を得ることができます。
合成されたZnO NPは、MRSA株に対して高い抗菌活性を示しましたが、これはおそらく細菌構造の違いによるものです。 緑膿菌などのグラム陰性菌は、細胞膜の構造、特にリポ多糖を含む二重膜の形成においてMRSAと異なり、MRSAの単層の厚いペプチドグリカン膜とは対照的です。この二重膜構造は、抗菌剤Zn2+ イオンの浸透を阻害し、 緑膿菌の生存率を高める可能性があります。ZnO NPは、その抗菌特性に利用され、日焼け止めや皮膚の再生にも積極的に使用されています。このように、ZnO NPを用いた多様な研究は今後も続くことが予想されます。
ZnO NPは、表面改質やさまざまな材料結合を通じて、さまざまな分野に適用できます。ZnOは、とりわけ、薬物送達、抗菌コーティング、癌治療、および創傷治癒における潜在的な用途を保持しています34。ZnO NPは、抗体などの標的分子を結合させることにより、特定の細胞または組織への標的送達を可能にする薬物送達に適用できる35。また、ZnO NPは活性酸素種の生成により、細菌細胞だけでなくがん細胞も標的にすることができます。さらに、ZnOナノ粒子からのZn2+イオンの放出および活性酸素種による過酸化水素(H2O2)の生成は、創傷部位36における創傷治癒過程を促進することができる。これらの可能性は、さまざまな分野でのZnO NPの使用を探求する多くの研究につながることが期待されます。
開示事項
Jonghoon Choi博士は、Nanomedicine CorporationのFeynman Institute of TechnologyのCEO/Founderであり、Yonghyun Choi博士はCTOです。
謝辞
本研究は、2022年度に中安大学大学院研究奨学金(李ガヒョン氏)の支援を受けて行われました。本研究は、韓国政府(MSIT)の助成を受けた韓国国立研究財団(NRF)(No.2020R1A5A1018052)と、韓国中小企業・スタートアップ省(MSS、韓国)の助成を受けた技術開発プログラム(RS202300261938)の支援も受けました。
資料
| Name | Company | Catalog Number | Comments |
| DLS | Zetasizer Pro | ||
| Ethyl alcohol, absolute | DAEJUNG | 4023-2304 | |
| Microplate reader | BioTeck | ||
| Sodium Hydroxide | Sigma-Aldrich | 221465 | |
| TEM | JEOL JEM-F200 | ||
| TSA | DB difco | 236950 | |
| TSB | DB difco | 211825 | |
| XRD | NEW D8-Advance | ||
| Zinc acetate | Sigma-Aldrich | 383317 |
参考文献
- Catalano, A., et al. Multidrug resistance (MDR): A widespread phenomenon in pharmacological therapies. Molecules. 27 (3), 616 (2022).
- Bazaid, A. S., et al. Bacterial infections among patients with chronic diseases at a tertiary care hospital in Saudi Arabia. Microorganisms. 10 (10), 1907 (2022).
- Miller, E. L. The penicillins: A review and update. J Midwifery Women's Health. 47 (6), 426-434 (2002).
- Martínez-Trejo, A., et al. Evasion of antimicrobial activity in acinetobacter baumannii by target site modifications: An effective resistance mechanism. Int J Mol Sci. 23 (12), 6582 (2022).
- Jiang, J. -. H., et al. Antibiotic resistance and host immune evasion in staphylococcus aureus mediated by a metabolic adaptation. Proc Natl Acad Sci U S A. 116 (9), 3722-3727 (2019).
- Lee, H. N., et al. A lateral flow assay for nucleic acid detection based on rolling circle amplification using capture ligand-modified oligonucleotides. BioChip J. 16 (4), 441-450 (2022).
- Craft, K. M., Nguyen, J. M., Berg, L. J., Townsend, S. D. Methicillin-resistant staphylococcus aureus (MRSA): Antibiotic-resistance and the biofilm phenotype. Med Chem Comm. 10 (8), 1231-1241 (2019).
- Tieu, M. -. V., Pham, D. T., Le, H. T. N., Hoang, T. X., Cho, S. Rapid and ultrasensitive detection of Staphylococcus aureus using a gold-interdigitated single-wave-shaped electrode (AU-ISWE) electrochemical biosensor. BioChip J. 17, 1-10 (2023).
- Turner, N. A., et al. Methicillin-resistant Staphylococcus aureus: An overview of basic and clinical research. Nat Rev Microbiol. 17 (4), 203-218 (2019).
- Tuon, F. F., Dantas, L. R., Suss, P. H., Tasca Ribeiro, V. S. Pathogenesis of the Pseudomonas aeruginosa biofilm: A review. Pathogens. 11 (3), 300 (2022).
- Sarabhai, S., Sharma, P., Capalash, N. Ellagic acid derivatives from terminalia chebula retz. Downregulate the expression of quorum sensing genes to attenuate pseudomonas aeruginosa pao1 virulence. PLoS One. 8 (1), e53441 (2013).
- Dizaj, S. M., Lotfipour, F., Barzegar-Jalali, M., Zarrintan, M. H., Adibkia, K. Antimicrobial activity of the metals and metal oxide nanoparticles. Mat Sci Eng: C. 44, 278-284 (2014).
- Ribeiro, A. I., Dias, A. M., Zille, A. Synergistic effects between metal nanoparticles and commercial antimicrobial agents: A review. ACS App Nano Mater. 5 (3), 3030-3064 (2022).
- Newman, M. D., Stotland, M., Ellis, J. I. The safety of nanosized particles in titanium dioxide-and zinc oxide-based sunscreens. J Am Acad Dermatol. 61 (4), 685-692 (2009).
- Sivakumar, P., Lee, M., Kim, Y. -. S., Shim, M. S. Photo-triggered antibacterial and anticancer activities of zinc oxide nanoparticles. J Mater Chem B. 6 (30), 4852-4871 (2018).
- Kołodziejczak-Radzimska, A., Jesionowski, T. Zinc oxide-from synthesis to application: A review. Materials. 7 (4), 2833-2881 (2014).
- Raoufi, D. Synthesis and microstructural properties of ZnO nanoparticles prepared by precipitation method. Renew Energy. 50, 932-937 (2013).
- Wang, Y. -. X., Sun, J., Fan, X., Yu, X. A CTAB-assisted hydrothermal and solvothermal synthesis of ZnO nanopowders. Ceram Int. 37 (8), 3431-3436 (2011).
- Balouiri, M., Sadiki, M., Ibnsouda, S. K. Methods for in vitro evaluating antimicrobial activity: A review. J Pharm Anal. 6 (2), 71-79 (2016).
- Clogston, J. D., Patri, A. K., McNeil, S. Zeta potential measurement. Characterization of nanoparticles intended for drug delivery. Methods Mol Biol. , 63-70 (2011).
- Abdelbaky, A. S., Mohamed, A. M., Sharaky, M., Mohamed, N. A., Diab, Y. M. Green approach for the synthesis of ZnO nanoparticles using Cymbopogon citratus aqueous leaf extract: Characterization and evaluation of their biological activities. Chem Biol Technol Agric. 10 (1), 63 (2023).
- Ankamwar, B. G., Kamble, V. B., Annsi, J. I., Sarma, L. S., Mahajan, C. M. Solar photocatalytic degradation of methylene blue by ZnO nanoparticles. J Nanosci Nanotechnol. 17 (2), 1185-1192 (2017).
- Babayevska, N., et al. Zno size and shape effect on antibacterial activity and cytotoxicity profile. Scientific Rep. 12 (1), 8148 (2022).
- Hamidian, K., Sarani, M., Behjati, S., Mahjoub, M., Zafarnia, N. Cytotoxic performance of synthesized mn-doped ZnO nanorods in mcf-7 cells. ChemistrySelect. 8 (19), e202300292 (2023).
- Gharpure, S., et al. Non-antibacterial and antibacterial ZnO nanoparticles composed of different surfactants. J Nanosci Nanotechnol. 21 (12), 5945-5959 (2021).
- Dhoke, S. K. Synthesis of nano-ZnO by chemical method and its characterization. Results Chem. 5, 100771 (2023).
- Choi, K. -. C., et al. Modifying hydrogen bonding interaction in solvent and dispersion of ZnO nanoparticles: Impact on the photovoltaic performance of inverted organic solar cells. RSC Adv. 4 (14), 7160-7166 (2014).
- Lee, W., et al. High colloidal stability ZnO nanoparticles independent on solvent polarity and their application in polymer solar cells. Scientific Rep. 10 (1), 18055 (2020).
- Cozzoli, P. D., Kornowski, A., Weller, H. Colloidal synthesis of organic-capped ZnO nanocrystals via a sequential reduction-oxidation reaction. J Phy Chem B. 109 (7), 2638-2644 (2005).
- Roh, S., Jang, Y., Yoo, J., Seong, H. Surface modification strategies for biomedical applications: Enhancing cell-biomaterial interfaces and biochip performances. BioChip J. 17, 1-18 (2023).
- Chen, D., Jiao, X., Cheng, G. Hydrothermal synthesis of zinc oxide powders with different morphologies. Solid State Commun. 113 (6), 363-366 (1999).
- Hu, X. -. L., Zhu, Y. -. J., Wang, S. -. W. Sonochemical and microwave-assisted synthesis of linked single-crystalline ZnO rods. Mater Chem Phys. 88 (2-3), 421-426 (2004).
- Ahamad Khan, M., et al. Phytogenically synthesized zinc oxide nanoparticles (ZnO-NPs) potentially inhibit the bacterial pathogens: In vitro studies. Toxics. 11 (5), 452 (2023).
- Xie, J., et al. Recent advances in ZnO nanomaterial-mediated biological applications and action mechanisms. Nanomaterials. 13 (9), 1500 (2023).
- Chawla, U., et al. A review on ZnO-based targeted drug delivery system. Lett Drug Des Discov. 21 (3), 397-420 (2024).
- Alavi, M., Nokhodchi, A. An overview on antimicrobial and wound healing properties of ZnO nanobiofilms, hydrogels, and bionanocomposites based on cellulose, chitosan, and alginate polymers. Carbohydr Polym. 227, 115349 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved