Method Article
ブタ内毒素ショックモデルとしてのリポ多糖類注入
要約
我々は、リポ多糖類の注入によるブタの実験的エンドトキセミックショックモデルのプロトコルを提供する。
要約
敗血症と敗血症性ショックは、集中治療室(ICU)で治療された患者に頻繁に遭遇し、これらの患者の主要な死因の1つです。これは、感染症に対する免疫反応の調節不全によって引き起こされます。最適化された治療を行っても、死亡率は依然として高いため、病態生理学と新しい治療オプションに関するさらなる洞察が必要になります。リポ多糖類(LPS)はグラム陰性菌の細胞膜の成分であり、敗血症や敗血症性ショックを引き起こす感染症の原因となることがよくあります。
敗血症と敗血症性ショックの重症度と高い死亡率により、ヒトでの標準化された実験的研究は不可能です。したがって、さらなる研究には動物モデルが必要です。ブタは、解剖学、生理学、サイズが人間によく似ているため、この目的に特に適しています。
このプロトコルはLPSの注入によってブタのendotoxemicショックに実験モデルを提供する。敗血症性ショック患者によく見られる血行動態の不安定性、呼吸不全、アシドーシスなどの変化を確実に誘導することができました。これにより、研究者はこの関連性の高い状態に関する貴重な洞察を得て、実験環境で新しい治療アプローチを評価することができます。
概要
敗血症と敗血症性ショックは、集中治療を受けている患者の死亡の主な原因にランクされています1,2,3。敗血症は、感染が免疫反応の調節不全を引き起こし、多臓器不全を引き起こすときに発生します。血行動態の不安定性、呼吸困難、肝不全および腎不全、認知障害などの生命を脅かす症状を特徴としています4,5。敗血症性ショックは敗血症のサブセットであり、特に重篤な症状を示し、死亡率を有意に増加させます。これらの症状には、昇圧剤療法を必要とする持続性低血圧と、2 mmol・L-1 4,5を超える血清乳酸レベルが含まれます。敗血症性ショック患者の死亡率は、病院での治療を行っても40%と高いと推定されています1,3,5。
シュードモナス菌や大腸菌などのグラム陰性菌は、しばしば感染症を引き起こし、この調節不全の免疫応答を引き起こします4。根底にある病態生理学的メカニズムは複雑であり、まだ完全には理解されていません。よく知られている態様の1つは、病原体関連分子パターン(PAMP)による免疫細胞上のToll様受容体の活性化であり、腫瘍壊死因子α(TNFα)またはインターロイキン1(IL 1)4などのサイトカインの放出をもたらす。これらのPAMPの1つがリポ多糖(LPS)であり、グラム陰性菌の細胞膜の成分を構成します6。LPSは、エンドトキセミアおよびエンドトキセミックショックを誘発するために動物モデルで使用されています7,8。
動物モデルは、新しい治療戦略を開発および調査するための制御および標準化された設定を提供します。解剖学的構造、免疫学的生理学、および同等の血行動態パラメータにより、ブタモデルは内毒素性ショックの影響を研究するのに特に適しています9,10。さらに、ヒトの患者に一般的に使用される標準的な医療機器は、気道と血管のサイズが似ているため、ブタに容易に適用でき、器具と血行動態のモニタリングが容易になります。
このプロトコルでは、 大腸菌由来のLPSを静脈内注入することにより、ブタのエンドトキセミックショックの実験モデルを提供します。効果を監視するために、動脈血圧、心拍数、末梢酸素飽和度、肺動脈圧、気道内圧などの血行動態および肺パラメータを測定しました。エンドトキセミアが脳の酸素供給に及ぼす影響を評価するために、近赤外分光法(NIRS)を使用しました。この方法により、前額11に塗布された接着電極を介して脳酸素飽和度を評価することができる。
プロトコル
このプロトコルの実験は、州および施設の動物管理委員会(Landesuntersuchungsamt Rheinland-Pfalz、Koblenz、Germany、TVA G21-1-080)によって承認されました。実験はARRIVEガイドラインに従って行われました。この研究では、生後2〜3か月、体重30〜35 kgの健康な雄のドイツ在来種豚6頭を使用しました。実験のタイムラインを 図1にまとめました。このプロトコルで使用されるすべての材料と機器に関連する詳細は、 材料表に記載されています。

図1:実験のタイムライン。 ベースラインの健康測定は、動物の調製と30分間の安定化期間の後に行われました。エンドトキシアムは 30 分間の LPS 注射によって誘発され、さらに 30 分後に 0 時間の測定が行われました。その後、1時間ごとの測定を4時間続けた。略語: BLH = ベースラインが正常です。LPS = リポ多糖類。 この図の拡大版をご覧になるには、ここをクリックしてください。
1.動物の調製
- ストレスを最小限に抑えるために、動物をできるだけ長く通常の環境に置いてください。麻酔を投与する6時間前に食事を差し控え、水への自由なアクセスを許可します。
- 正常な環境にいる間に、アザペロン(3 mg∙kg-1)とミダゾラム(0.5 mg kg-1)の筋肉内注射で動物を鎮静させます。.
- 鎮静が効いたら、通常、投与後約15〜20分以内に起こり、豚を実験室に輸送します。
注:移送中、継続的な鎮静が維持されていることを確認することが重要です。地域の議会によっては、獣医師の恒久的な監督が必要になる場合があります。 - 輸送中は、豚の正常な体温(~38°C)を維持するように細心の注意を払ってください。たとえば、低体温症を防ぐために動物を毛布で覆うことを検討してください。
注:輸送時間は、通常30分から60分の範囲の鎮静時間を超えないようにすることが重要です。. - 消毒後、耳介静脈に22Gのカテーテルを挿入して静脈内アクセスを確立します。豚のさらなる動きや麻酔の導入を進める前に、突然の動きによる脱臼を防ぐために、カテーテルがしっかりと固定されていることを確認してください。
- 末梢酸素飽和度を、尾または耳にクリップで留めたセンサーを使用して継続的に監視します。
2.麻酔と人工呼吸器
- 静脈内フェンタニル(4 μg kg-1)とプロポフォール(3 mg kg-1)を投与して麻酔を誘発します。.
- 豚を仰臥位にします。
- 筋弛緩剤としてアトラクリウム(0.5 mg kg-1)を投与し、犬の換気マスクを使用してすぐに非侵襲的換気を開始します。.マスクを鼻にかぶせ、親指でしっかりと圧力をかけながら、中指/薬指で下顎を前方に引っ張ります。人工呼吸器を次のパラメータに設定します:吸気酸素分率(FiO 2)= 100%、一回換気量= 6〜8 mL kg-1、呼気終末陽圧(PEEP)= 5 mbar、ピーク吸気圧≤20 mbar、呼吸数= 18〜20 min-1。
- バランスの取れた電解質溶液(5 mL kg-1 h-1)、フェンタニル(10 μg kg-1 h-1)、およびプロポフォール(6 mg kg-1 h-1)の連続注入を開始して、麻酔を維持します。.
- 標準的な気管内チューブ(ID 6-7 mm)、ガイドワイヤー、およびMacintoshブレード(サイズ4)を備えた喉頭鏡を使用して気管内挿管を行います。
- 助手に口を開けてもらい、舌を左側に持っていきます。
- 喉頭蓋が見えるまでMacintosh Bladeを挿入します。次に、喉頭鏡を上に持ち上げて喉頭蓋を腹側に動かし、声帯を視覚化します。時折、喉頭蓋が軟口蓋にくっつくことがあります。この場合、チューブまたはブジーでそっと横にスワイプして動員します。
- 気管内チューブを声帯から慎重に挿入し、誘導剤を取り外します。問題が発生した場合は、過度の力を加えずにチューブを回転させてみてください。必要に応じて、より小さなチューブを使用してください。チューブが所定の位置に収まったら、10 mLの空気でカフを膨らませます。
- 気管内チューブを人工呼吸器に接続し、換気を開始します。呼気終末CO2を検出し、両側聴診を行うことにより、適切なチューブの位置を確認します。次の換気設定を使用します:FiO2 = 40%、一回換気量= 6〜8 mL kg-1、PEEP = 5 mbar、吸気と呼気の比率= 1:2、呼吸数=潮汐終末CO2レベル<45 mmHg、通常は30〜40 min-1を達成するように調整されます。
注意: チューブが食道に正しく配置されていないと、空気が胃を膨らませ、目に見える膨らみを引き起こします。このような場合は、すぐにチューブを取り外し、非侵襲的換気を1〜2分間行い、チューブを正しく配置してください。 - 逆流や嘔吐を防ぐために胃管を挿入します。挿入が困難な場合は、喉頭鏡を使用して食道入口をよりよく見てください。
3. インストルメンテーション
- 大腿動脈と静脈にそれぞれ動脈と中心静脈ラインを配置し、血行動態モニタリングと静脈内ボリューム療法を行います。
- 包帯を使用して後ろ足を引っ込めて固定し、大腿血管へのアクセスを改善します。
- 計装の前に必要なすべての材料を準備します。すべてのカテーテルを生理食塩水で満たし、ワイヤーとカテーテルに簡単にアクセスできるようにして、複数回のカテーテル挿入の試みや不必要な失血の必要性を最小限に抑えます。
- 鼠径部にアルコール消毒剤を塗布し、滅菌綿棒で拭きます。このプロセスを 2 回繰り返します。拭かずに消毒液を再度塗布し、3分間待ちます。鼠径部に滅菌の開窓ドレープを置きます。
- 超音波を使用して大腿血管を特定します。カテーテル挿入には、面内超音波ガイド下セルディンガー法を使用して、組織の損傷と失血を最小限に抑えます。
- 大腿動脈を縦方向に視覚化します。針に取り付けた注射器で動脈を穿刺し、連続吸引します。真っ赤な脈動する血液は、動脈穿刺を確認します。シリンジを取り外し、準備したワイヤーを挿入します。ワイヤーを所定の位置に残したまま針を取り外します。
- 大腿静脈についても同じ手順を繰り返します。静脈穿刺は、ゆっくりと流れる暗赤色の血液によって確認されます。
- 超音波を使用して両方の大腿血管を視覚化することにより、両方のワイヤーの正しい位置を確認します。
- セルディンガーの手法を使用して、最初に動脈導入鞘を挿入し、次に静脈導入鞘を挿入します。2本のラインから採取した血液サンプルの血液ガス分析により、適切な位置を確認します。
- すべてのラインから血液を吸引できることを確認してください。血栓の形成を防ぐために、すべてのラインを生理食塩水で洗い流します。
- 脱臼を防ぐために、外科用縫合糸を使用してラインを皮膚にしっかりと固定します。
- 動脈および中心静脈ラインをトランスデューサに接続して、血行動態パラメータを測定します。
- パルス輪郭心拍出量(PiCCO)カテーテルを動脈イントロデューサーシースに挿入し、PiCCOモニターの動脈圧力トランスデューサーと温度インターフェースケーブルに接続します。
- Swan-Ganzカテーテルをトランスデューサーに接続します。
- 圧力を連続的に測定しながら、カテーテルを中心静脈導入器シースに挿入します。約30cm後、中心静脈圧曲線が見えたらバルーンを膨らませます。
- 圧力曲線を監視しながら、カテーテルをゆっくりと進めます。カテーテルが右心室に入ると、収縮期値が高く拡張期値が低い脈拍曲線を探します。カテーテルをさらに前進させると、収縮期値が一定になり、拡張期値が上昇し、肺動脈への留置が示されます。
- カテーテルをこの位置(通常は50〜70cm)に固定します。PiCCOシステムの注入温度センサーをSwan-Ganzカテーテルの近位内腔に接続します。
- 豚の額を剃り、接着センサー電極を塗布して脳局所酸素飽和度を測定します。
- 麻酔導入と器具使用の後、ベースライン測定を実施して内毒素性ショックを誘発する前に、30分間、または血行動態パラメータが安定するまで動物を安定させます。.
4.ショック誘導
注意: LPSを使用するときは、常に手袋、保護メガネ、マスク、白衣を着用してください。LPSとの直接の接触は避けてください。
- 5mgのLPSを50mLの0.9%NaClに溶解することにより、濃度100μgmL-1のLPS溶液を調製する。
- LPS注入を開始する直前にベースラインの血行動態測定値を取得します。.
- 150 μg kg-1 用量の LPS を 30 分間投与します (300 μg kg-1∙h-1 の連続注入速度を 30 分間に相当)。
- 30分後、実験の残りの間、注入速度を15μg∙kg-1∙h-1 に下げます。
- 動脈および肺動脈の血圧、心拍数、換気パラメータなどの血行動態パラメータを継続的に監視します。体温を継続的に監視して、正常熱症を維持します。
5.血行動態不安定性の治療
- 平均動脈血圧が 60mmHgを下回った場合は、PiCCOを使用して心臓指数(CI)、グローバル拡張末期容積指数(GEDI)、血管外肺水指数(ELWI)を測定します。 図2のフローチャートの推奨事項に従って低血圧を治療します。
- PiCCOモニターで、 熱希釈ボタン (TD)を押します。
- 中心静脈圧(CVP)入力のボタンを押して、現在のCVP値を入力します。
- スタートボタンを押します。
- 指示されたら、 10 mL の 冷生理食塩水 をSwan-Ganzカテーテルに接続された注射温度センサーに注入します。
注:PiCCO測定の直前または測定中に他のものを注入すると、測定が損なわれるため、他のものを注入しないでください。
- CI、GEDI、およびELWIの測定値を取得した後、 図2のフローチャートに従って血行動態の不安定性を治療します。ボリュームローディングが推奨される場合は、 200 mL のバランス 電解質溶液を急速に注入します。カテコールアミン療法が推奨される場合は、 ノルエピネフリン注入 率を 1 μg kg-1 h-1増やします。.
- 平均動脈血圧が60mmHgを下回るたびに、このプロセスを繰り返します。重度の血行動態が不安定の場合は、治療の急速なエスカレーションを選択してください。.

図2:血行動態不安定性のPiCCOガイド下療法。 CI、GEDIおよびELWIの測定値を取得した後、チャートに従って処理を適用します。この図は、PiCCOユーザーガイドブック12から引用したものです。略語:PiCCO =パルス輪郭心拍出量;V+ = 体積負荷;cat = カテコールアミン療法;V-=体積減少;CI = 心臓指数;GEDI = グローバル拡張末期容積指数;ELWI = 血管外肺水指数。 この図の拡大版をご覧になるには、ここをクリックしてください。
6. 実験の終結と安楽死
- 0.5mgのフェンタニルを静脈内注射します。5分待ちます。200mgのプロポフォールを注射します。
- 中心静脈ラインから40mLの1M塩化カリウムを迅速に注射して豚を安楽死させます。
結果
この研究では、生後2〜3か月、体重30〜35 kgの6匹の健康な雄豚に麻酔をかけ、内毒素血症を誘発するためにリポ多糖類(LPS)を注入しました。ショックの症状を一貫して誘発するために必要なLPSの適切な投与量を決定するために、ブタは30分間にわたって100μgkg-1から200μgkg-1の範囲のLPSのさまざまな誘導用量を投与され、その後、実験の残りの期間、1時間あたり初期用量の1/10の維持用量が投与されました。すべての動物は、LPS注入の直後にショックの徴候を示した。血行動態パラメータは、PiCCOシステムを使用してモニターしました。動物は心指数の低下と心拍数の増加を示し、ショック状態中の血行動態の不安定性を示しました。平均動脈血圧はLPS注入後に低下しましたが、輸液蘇生または必要に応じてノルエピネフリン注入により60mmHg以上に維持されました(図3)。肺の損傷は、PaO2FiO2-1比の低下と肺動脈圧の上昇によって示されました(図4)。脳の酸素化は近赤外分光法(NIRS)を用いて測定され、ショックの誘発後に減少しました(図5)。また、アシドーシスと乳酸濃度の上昇も見られました(図6)。多重比較による一元配置分散分析を使用して有意性を判断しました。
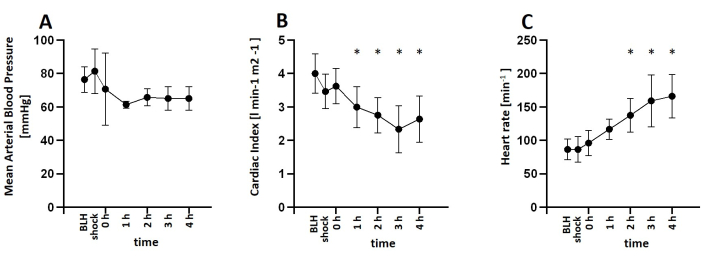
図3:LPS注入後の血行動態パラメータの開発。 (A)ショック誘発後、平均動脈血圧は低下したが、必要に応じてノルエピネフリン注入により60mmHg以上を維持した。(B)心指数は低下し、(C)LPS注入後に心拍数は増加しました。平均と標準偏差が表示されます。*p<ベースライン測定値と比較して0.05。略語: BLH = ベースラインの正常性。LPS = リポ多糖類。 この図の拡大版をご覧になるには、ここをクリックしてください。

図4:LPS注入後の肺パラメータの開発。 (A)PaO2 FiO2-1比は、LPS注入後まもなく低下した。(B)ショック誘導後に駆動圧力が上昇した。(C)ショック時に肺動脈圧も上昇した。平均と標準偏差が表示されます。*p<ベースライン測定値と比較して0.05。略語: BLH = ベースラインの正常性。LPS =リポ多糖類;FIO2=吸気酸素分率;PaO2 = 動脈血中の酸素分圧。この図の拡大版をご覧になるには、ここをクリックしてください。

図5:LPS注入後の脳酸素化。 近赤外分光法で測定した脳酸素化は、LPSによるショック誘導後に減少した。平均と標準偏差が表示されます。*p<ベースライン測定値と比較して0.05。略語: BLH = ベースラインの正常性。LPS =リポ多糖類;NIRS = 近赤外分光法。 この図の拡大版をご覧になるには、ここをクリックしてください。

図6:LPS誘発性内毒素血症中の動脈血ガス分析。 (A)動物は時間の経過とともに酸性度が増し、(B)LPS注入後に乳酸レベルが上昇した。平均と標準偏差が表示されます。*p<ベースライン測定値と比較して0.05。略語: BLH = ベースラインの正常性。LPS = リポ多糖類。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
敗血症や敗血症性ショックで一般的に観察される変化を確実に誘発することを目的とした、LPS注入による実験的なエンドトキシン血症をブタに誘導するためのプロトコルを提示します。このプロトコルでは、いくつかの重要なステップを考慮する必要があります。輸送前に豚に適切な鎮静剤を投与することは、ストレスによるカテコールアミン濃度の上昇を防ぐために重要であり、結果を損なう可能性があります。豚の挿管は、細長い鼻の解剖学的特徴により、人間と比較して困難をもたらす可能性があります。これに対処するには、挿管にはマッキントッシュブレードの使用を推奨し、気管内チューブにはストレートインデューサーを装備する必要があります。喉頭蓋が軟口蓋に付着することは一般的であり、動物の気管が声門下狭窄するため、より小さな気管内チューブが必要になる場合があり、声帯を通過できるチューブがまだ大きすぎる場合があります。
LPS注入の前に、LPS濃度の正確な調製が不可欠です。高用量のLPSを投与すると、重度の血行動態が不安定になり、死に至ることさえありますが、低用量では望ましい効果が得られない可能性があります。.さらに、LPS料金が異なれば、有効性のレベルも異なる可能性があることに注意する必要があります。各トライアルで同じLPS料金を使用することをおすすめします。各研究の適切な投与量を決定するために、用量設定試験を実施することができます。.LPS注入の開始時に、血行動態パラメータの継続的なモニタリングは、急速な不安定性の可能性があるため重要です。.副作用を管理するには、迅速な介入が必要な場合があります。
PiCCOは、高度な血行動態測定に使用されました。この技術は、ICUで治療を受ける人間の患者にも頻繁に使用されています。これは人間用に開発されたものであり、豚での使用にはいくつかの課題がある可能性があります。体表面積(BSA)は、血行動態パラメータの計算に使用されます。これは、患者の身長と体重を入力すると自動的に計算されます。ここで使用されている式(人間の場合)は、豚のBSAを計算するのに理想的ではありませんが、残念ながら、BSAを入力する他の方法はありません。この問題は、私たちの経験では、豚の身長を130cmに入力することで解決され、BSAに最も適切な結果が得られます。ただし、PiCCOの結果を解釈する際には、この制限に留意する必要があります。
以前の研究では、LPSを使用してブタの敗血症性ショックをシミュレートすることが説明されています。これらの研究では、低血圧、末梢血管拡張、肺動脈圧の上昇、全身酸素摂取量の増加など、敗血症患者で頻繁に観察される変化が説明されています13,14,15。ブタに実験的敗血症および敗血症性ショックを誘発するための代替方法も記載されている。1つのモデルでは、糞便の腹腔内投与による腹膜炎の誘発が含まれます16、17、18、19。別のアプローチは、動物の血流に生きた細菌を直接注射することです19,20。LPS注射と比較して、腹膜炎や菌血症を利用して実験的敗血症を誘発するプロトコルは、より現実的であるという利点があります。これらの方法は、細菌感染を通じて実際の敗血症状態を誘発しますが、LPS注射は、根本的な病因メカニズムの1つの側面のみを表しています。
しかし、LPS注入法にはメリットもあります。腹膜炎モデルと比較して、このプロトコルは、腹腔内アクセスを必要とせずに静脈内注射のみを必要とするため、労力と専門知識が少なくて済みます。さらに、ショックの症状は他のモデルよりも急速に現れるため、観察時間が短縮され、リソース使用率が低下します。さらに、各豚が同じLPS投与量を受けるため、結果の再現性は高いです。対照的に、投与された糞便の組成は大きく異なる可能性があり、細菌の増殖は制御不能な要因によって影響を受ける19。
一定の制限にもかかわらず、このプロトコルは一貫して内毒素性ショックを誘発し、複数の臓器系に影響を与えました。肺機能と血行動態の特徴的な変化、および乳酸レベルの上昇が、LPSで処理されたすべての動物で観察されました。実験全体を通して深い麻酔が続いたため、ヒトのグラスゴー昏睡スケールを使用してSOFAスコアに組み込まれている認知機能を評価することができませんでした。しかし、脳の酸素化の減少が観察され、LPS誘発性ショックが脳機能に影響を与える可能性が示唆されました。初期段階では、敗血症はしばしば心拍出量の上昇を特徴とする過動期と関連しています。このモデルでは症状が急速に進行するため、ここで紹介するデータは、このハイパーダイナミックな段階を適切に示していません。この段階に特に関心がある場合は、実験の初期段階でより定期的に測定を行う必要があります。LPS用量の調整は、症状の進行を遅らせ、亢進期の観察を容易にするのに役立つ可能性があります。
LPSやその他の細菌性エンドトキシンは、小動物モデルでの敗血症のシミュレーションに以前から用いられてきました8。しかし、この文脈でブタを使用することは、マウスのような小動物モデルと比較して特定の課題を提起します。ブタの飼育と維持には、かなりの時間と労力が必要であり、実験ごとに使用できる動物の数も少なくなります。それにもかかわらず、大型動物モデル、特にブタは、人体のより現実的な表現を提供します。ブタは、解剖学、ゲノム、食餌、免疫系の反応性の点で人間と類似しています9,10。もう一つの利点は、血液サンプル分析を繰り返すことができることです。小動物モデルには特殊な機器が必要になることがよくありますが、ヒトの患者に一般的に使用される標準的な医療機器をブタに適用できるため、臨床ICU環境での機器や血行動態のモニタリングに似ています。結論として、このプロトコルは、LPS注入によるブタの実験的なエンドトキシン血症モデルを確立します。敗血症性ショック患者で頻繁に観察される変化を一貫して誘発するためのシンプルで標準化された方法を提供します。
開示事項
NIRSデバイスは、実験研究目的で米国メドトロニックPLCから無条件に提供されました。Alexander ZiebartさんがMedtronic PLCから講演料を受け取りました。著者のいずれも、金銭的またはその他の利益相反を報告していません。原稿はChatGPT®(Python Software、バージョン:2023年5月24日)によって校正・編集されました。
謝辞
著者は、Dagmar Dirvonskis氏の優れた技術サポートに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Atracurium Hikma 50 mg/5mL | Hikma Pharma GmbH, Martinsried | ||
| Azaperone (Stresnil) 40 mg/mL | Lilly Deutschland GmbH, Bad Homburg, Germany | ||
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy, AB Helsingborg, Schweden | 3-way-stopcock | |
| Curafix i.v. classics | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Cannula retention dressing | |
| Datex Ohmeda S5 | GE Healthcare Finland Oy, Helsinki, Finland | hemodynamic monitor | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland, GmbH | perfusor line | |
| Intrafix Primeline | B. Braun Melsungen AG, Melsungen, Germany | Infusion line | |
| Introducer sheath 5 Fr. | Terumo Healthcare | arterial introducer | |
| INVOS | Medtronic, Dublin, Ireland | near infrared spectrometry | |
| JOZA Einmal Nitril Untersuchungshandschuhe | JOZA, München, Germany | disposable gloves | |
| Laryngoscope, 45.48.50, KL 2000 | Medicon | Laryngoscope handle | |
| Littmann Classic III Stethoscope | 3M Deutschland GmbH, Neuss, Germany | stethoscope | |
| LPS (E. coli; Serotype O111:B4) | Sigma-Aldrich, Switzerland | ||
| MAC Two-Lumen Central venous access set | Arrow international inc. Reading, PA, USA | venous introducer | |
| Maimed Vlieskompresse | Maimed GmbH, Neuenkirchen, Germany | Fleece compress to fix the tongue | |
| Masimo LNCS Adtx SpO2 sensor | Masimo Corporation Irvine, Ca 92618 USA | saturation clip for the tail | |
| Masimo LNCS TC-I SpO2 ear clip sensor | Masimo Corporation Irvine, Ca 92618 USA | Saturation clip for the ear | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Midazolam 15 mg/3 mL | B.Braun Melsungen AG, Germany | ||
| Midmark Canine Mask Small Plastic with Diaphragm FRSCM-0005 | Midmark Corp., Dayton, Ohio, USA | dog ventilation mask | |
| Monocryl surgical suture | Johnson & Johnson, Belgium | ||
| B.Braun Melsungen AG, Germany | saline solution | ||
| NaCl 0.9 % | Sanofi- Aventis, Seutschland GmbH | ||
| Octeniderm farblos | Schülke & Mayr GmbH, Nordenstedt, Germany | Alcoholic disinfectant | |
| Original Perfusor syringe 50 mL | B.Braun Melsungen AG, Germany | perfusor syringe | |
| PA-Katheter Swan Ganz 7.5 Fr 110 cm | Edwards Lifesciences LLC, Irvine CA, USA | Swan-Ganz catheter | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| PiCCO catheter | PULSION Medical Systems SE, Feldkirchen, DE | ||
| Potassium chloride 1 M | Fresenius, Kabi Germany GmbH | ||
| Propofol 2% 20 mg/mL (50 mL flasks) | Fresenius, Kabi Deutschland, GmbH | ||
| Pulse-contour continous cardiac output System PiCCO2 | PULSION Medical Systems SE, Feldkirchen, DE | ||
| Rüschelit Super Safety Clear >ID 6/6.5 /7.0 mm | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Sonosite Micromaxx Ultrasoundsystem | Sonosite Bothell, WA, USA | ultrasound | |
| Stainless Macintosh Größe 4 | Welch Allyn69604 | blade for laryngoscope | |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | Balanced electrolyte solution | |
| Vasco OP sensitive | B.Braun Melsungen AG, Germany | sterile gloves | |
| Vasofix Safety 22 G-16 G | B.Braun Melsungen AG, Germany | venous catheter | |
| VBM Cuff Manometer | VBM Medizintechnik GmbH, Sulz a.N., Germany | cuff pressure gauge |
参考文献
- Vincent, J. -. L., Jones, G., David, S., Olariu, E., Cadwell, K. K. Frequency and mortality of septic shock in Europe and North America: a systematic review and meta-analysis. Critical Care. 23 (1), 196 (2019).
- Reinhart, K., et al. Recognizing sepsis as a Global Health Priority - A WHO Resolution. New England Journal of Medicine. 377 (5), 414-417 (2017).
- Cecconi, M., Evans, L., Levy, M., Rhodes, A. Sepsis and septic shock. The Lancet. 392 (10141), 75-87 (2018).
- Font, M. D., Thyagarajan, B., Khanna, A. K. Sepsis and septic shock - basics of diagnosis, pathophysiology and clinical decision making. Medical Clinics of North America. 104 (4), 573-585 (2020).
- Singer, M., et al. The Third International Consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 315 (8), 801 (2016).
- Jerala, R. Structural biology of the LPS recognition. International Journal of Medical Microbiology. 297 (5), 353-363 (2007).
- Copeland, S., Warren, H. S., Lowry, S. F., Calvano, S. E., Remick, D. Inflammation and the host response to injury investigators acute inflammatory response to endotoxin in mice and humans. Clinical and Diagnostic Laboratory Immunology. 12 (1), 60-67 (2005).
- Dickson, K., Lehmann, C. Inflammatory response to different toxins in experimental sepsis models. International Journal of Molecular Sciences. 20 (18), 4341 (2019).
- Bassols, A., Costa, C., Eckersall, P. D., Osada, J., Sabrià, J., Tibau, J. The pig as an animal model for human pathologies: A proteomics perspective. PROTEOMICS - Clinical Applications. 8 (9-10), 715-731 (2014).
- Meurens, F., Summerfield, A., Nauwynck, H., Saif, L., Gerdts, V. The pig: a model for human infectious diseases. Trends in Microbiology. 20 (1), 50-57 (2012).
- Ali, J., Cody, J., Maldonado, Y., Ramakrishna, H. Near-infrared spectroscopy (NIRS) for cerebral and tissue oximetry: analysis of evolving applications. Journal of Cardiothoracic and Vascular Anesthesia. 36, 2758-2766 (2022).
- . Getinge Deutschland GmbH PiCCO Technologie Erweitertes hämodynamisches Monitoring auf höchstem Niveau Available from: https://www.getinge.com/dam/hospital/documents/german/picco_haemodynamisches_monitoring_broschuere-de-non_us.pdf (2023)
- Breslow, M. J., Miller, C. F., Parker, S. D., Walman, A. T., Traystman, R. J. Effect of vasopressors on organ blood flow during endotoxin shock in pigs. American Journal of Physiology-Heart and Circulatory Physiology. 252 (2), H291-H300 (1987).
- Fink, M. P., et al. Systemic and mesenteric O2 metabolism in endotoxic pigs: effect of ibuprofen and meclofenamate. Journal of Applied Physiology. 67 (5), 1950-1957 (1989).
- Lado-Abeal, J., et al. Lipopolysaccharide (LPS)-induced septic shock causes profound changes in myocardial energy metabolites in pigs. Metabolomics. 14 (10), 131 (2018).
- Park, I., et al. Characterization of fecal peritonitis-induced sepsis in a porcine model. The Journal of Surgical Research. 244, 492-501 (2019).
- Jarkovska, D., et al. Heart rate variability in porcine progressive peritonitis-induced sepsis. Frontiers in Physiology. 6, 412 (2015).
- Kohoutova, M., et al. Vagus nerve stimulation attenuates multiple organ dysfunction in resuscitated porcine progressive sepsis. Critical Care Medicine. 47 (6), e461-e469 (2019).
- Vintrych, P., et al. Modeling sepsis, with a special focus on large animal models of porcine peritonitis and bacteremia. Frontiers in Physiology. 13, 1094199 (2022).
- Stengl, M., et al. Reduced L-type calcium current in ventricular myocytes from pigs with hyperdynamic septic shock. Critical Care Medicine. 38 (2), 579-587 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved