Method Article
Perfusion de lipopolysaccharides comme modèle de choc endotoxémique porcin
Dans cet article
Résumé
Nous fournissons un protocole pour un modèle expérimental de choc endotoxémique chez le porc par perfusion de lipopolysaccharide.
Résumé
La septicémie et le choc septique sont fréquemment rencontrés chez les patients traités dans les unités de soins intensifs (USI) et figurent parmi les principales causes de décès chez ces patients. Elle est causée par une réponse immunitaire déréglée à une infection. Même avec un traitement optimisé, les taux de mortalité restent élevés, ce qui rend nécessaire de mieux comprendre la physiopathologie et de nouvelles options de traitement. Le lipopolysaccharide (LPS) est un composant de la membrane cellulaire des bactéries à Gram négatif, qui sont souvent responsables d’infections provoquant une septicémie et un choc septique.
La gravité et la mortalité élevée de la septicémie et du choc septique rendent impossibles les études expérimentales standardisées chez l’homme. Ainsi, un modèle animal est nécessaire pour des études ultérieures. Le cochon est particulièrement bien adapté à cet effet car il ressemble beaucoup aux humains en anatomie, physiologie et taille.
Ce protocole fournit un modèle expérimental pour le choc endotoxémique chez les porcs par perfusion de LPS. Nous avons pu induire de manière fiable des changements fréquemment observés chez les patients en choc septique, notamment une instabilité hémodynamique, une insuffisance respiratoire et une acidose. Cela permettra aux chercheurs d’obtenir des informations précieuses sur cette condition très pertinente et d’évaluer de nouvelles approches thérapeutiques dans un cadre expérimental.
Introduction
La septicémie et le choc septique figurent parmi les principales causes de mortalité chez les patients recevant un traitement en soins intensifs 1,2,3. La septicémie survient lorsqu’une infection déclenche une réponse immunitaire déréglée entraînant une défaillance multiviscérale. Elle se caractérise par des symptômes potentiellement mortels, notamment une instabilité hémodynamique, une détresse respiratoire, une insuffisance hépatique et rénale, ainsi que des troubles cognitifs 4,5. Le choc septique représente un sous-ensemble de la septicémie avec des symptômes particulièrement graves qui augmentent considérablement la mortalité. Ces symptômes comprennent une hypotension persistante nécessitant un traitement vasopresseur et un taux de lactate sérique supérieur à 2 mmol∙L-1 4,5. Les taux de mortalité chez les patients atteints de choc septique ont été estimés à 40 %, même avec un traitement hospitalier 1,3,5.
Les bactéries à Gram négatif, telles que Pseudomonas et Escherichia coli, provoquent souvent des infections déclenchant cette réponse immunitaire déréglée4. Les mécanismes physiopathologiques sous-jacents sont complexes et ne sont pas encore entièrement compris. Un aspect bien décrit concerne l’activation de récepteurs de type Toll sur les cellules immunitaires par des motifs moléculaires associés à des agents pathogènes (PAMP), conduisant à la libération de cytokines telles que le facteur de nécrose tumorale alpha (TNFα) ou l’interleukine 1 (IL 1)4. L’un de ces PAMP est le lipopolysaccharide (LPS), qui constitue un composant de la membrane cellulaire chez les bactéries à Gram négatif6. Le LPS a été utilisé dans des modèles animaux pour induire une endotoxémie et un choc endotoxémique 7,8.
Les modèles animaux fournissent un cadre contrôlé et standardisé pour développer et étudier de nouvelles stratégies de traitement. En raison de son anatomie, de sa physiologie immunologique et de ses paramètres hémodynamiques similaires, le modèle porcin est particulièrement bien adapté à l’étude des effets du choc endotoxémique 9,10. De plus, les équipements médicaux standard couramment utilisés chez les patients humains peuvent être facilement appliqués chez les porcs en raison de la taille similaire de leurs voies respiratoires et de leurs vaisseaux sanguins, ce qui facilite l’instrumentation et la surveillance hémodynamique.
Avec ce protocole, nous fournissons un modèle expérimental de choc endotoxémique chez les porcs par perfusion intraveineuse de LPS dérivé d’E. coli. Pour surveiller les effets, nous avons mesuré les paramètres hémodynamiques et pulmonaires, notamment la pression artérielle, la fréquence cardiaque, la saturation périphérique en oxygène, la pression artérielle pulmonaire et la pression des voies respiratoires. Pour évaluer l’influence de l’endotoxémie sur l’apport en oxygène cérébral, nous avons utilisé la spectrométrie proche infrarouge (NIRS). Avec cette méthode, la saturation cérébrale en oxygène peut être évaluée via une électrode adhésive appliquée sur le front11.
Protocole
Les expériences de ce protocole ont été approuvées par le Comité national et institutionnel de protection des animaux (Landesuntersuchungsamt Rheinland-Pfalz, Coblence, Allemagne, TVA G21-1-080). Les expériences ont été menées conformément aux directives ARRIVE. Pour cette étude, six porcs mâles allemands Landrace en bonne santé âgés de 2 à 3 mois et pesant 30 à 35 kg ont été utilisés. La chronologie expérimentale est résumée à la figure 1. Les détails relatifs à tous les matériaux et instruments utilisés dans ce protocole sont énumérés dans le tableau des matériaux.

Figure 1 : Chronologie expérimentale. Des mesures de santé de base ont été prises après la préparation de l’animal et une période de stabilisation de 30 minutes. L’endotoxémie a été induite par l’injection de LPS pendant 30 minutes et des mesures à 0 heure ont été prises après 30 minutes supplémentaires ; Après cela, les mesures horaires ont été poursuivies pendant 4 h. Abréviations : BLH = santé de base ; LPS = lipopolysaccharide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Préparation des animaux
- Gardez les animaux dans leur environnement habituel le plus longtemps possible pour minimiser le stress. Retenir la nourriture pendant 6 heures avant l’administration de l’anesthésie, tout en laissant libre accès à l’eau.
- Sédater les animaux par injection intramusculaire d’azaperone (3 mg∙kg-1) et de midazolam (0,5 mg kg-1) alors qu’ils sont encore dans leur environnement normal.
- Une fois que la sédation fait effet, ce qui se produit généralement dans les 15 à 20 minutes suivant l’administration, transportez les porcs au laboratoire.
REMARQUE : Il est crucial de s’assurer que la sédation continue est maintenue tout au long du transfert ; Selon la législature régionale, cela peut nécessiter la surveillance permanente d’un vétérinaire. - Portez une attention particulière au maintien de la température corporelle normale des porcs (~38 °C) pendant le transport. Par exemple, envisagez de couvrir l’animal avec une couverture pour éviter l’hypothermie.
REMARQUE : Il est important de limiter le temps de transport pour ne pas dépasser la durée de la sédation, qui varie généralement de 30 min à 60 min. - Après la désinfection, établissez un accès intraveineux en insérant un cathéter de 22 G dans la veine auriculaire. Avant de procéder à tout autre mouvement du porc ou à l’induction de l’anesthésie, assurez-vous que le cathéter est solidement fixé pour éviter toute luxation par des mouvements brusques.
- Surveillez en permanence la saturation périphérique en oxygène à l’aide d’un capteur fixé à la queue ou à l’oreille.
2. Anesthésie et ventilation mécanique
- Administrer du fentanyl (4 μg kg-1) et du propofol (3 mg kg-1) par voie intraveineuse pour induire l’anesthésie.
- Placez le cochon en position couchée.
- Administrer de l’atracurium (0,5 mg kg-1) comme relaxant musculaire et commencer immédiatement une ventilation non invasive à l’aide d’un masque de ventilation pour chien. Placez le masque sur le museau et appliquez une pression ferme avec les pouces tout en tirant la mâchoire inférieure vers l’avant à l’aide du majeur/annulaire. Réglez le ventilateur sur les paramètres suivants : fraction d’oxygène inspiratoire (FiO2 ) = 100 %, volume courant = 6-8 mL kg-1, pression expiratoire positive (PEP) = 5 mbar, pression inspiratoire maximale ≤ 20 mbar, fréquence respiratoire = 18-20 min-1.
- Maintenez l’anesthésie en initiant une perfusion continue d’une solution d’électrolyte équilibrée (5 mL kg-1 h-1), de fentanyl (10 μg kg-1 h-1) et de propofol (6 mg kg-1 h-1).
- Effectuez une intubation endotrachéale à l’aide d’une sonde endotrachéale standard (ID 6-7 mm), d’un fil-guide et d’un laryngoscope équipé d’une lame Macintosh (taille 4).
- Demandez à un assistant d’ouvrir la bouche et de tenir la langue sur le côté gauche.
- Insérez la lame Macintosh jusqu’à ce que l’épiglotte soit visible. Ensuite, soulevez le laryngoscope vers le haut pour déplacer l’épiglotte ventralement et visualiser les cordes vocales. Parfois, l’épiglotte peut coller au palais mou ; Dans ce cas, mobilisez-le en glissant doucement sur le côté avec le tube ou une bougie.
- Insérez délicatement le tube endotrachéal dans les cordes vocales et retirez l’inducteur. Si vous rencontrez des difficultés, essayez de faire pivoter le tube sans appliquer de force excessive. Si nécessaire, utilisez un tube plus petit. Une fois le tube en place, gonflez le brassard avec 10 ml d’air.
- Connectez la sonde endotrachéale au ventilateur et lancez la ventilation. Confirmer le bon positionnement de la sonde en détectant le CO2 en fin d’expiration et en effectuant une auscultation bilatérale. Utilisez les réglages de ventilation suivants : FiO2 = 40 %, volume courant = 6-8 mL kg-1, PEP = 5 mbar, rapport inspiration/expiration = 1 :2, fréquence respiratoire = ajustée pour atteindre un niveau de CO2 en fin d’expiration de <45 mmHg, généralement 30-40 min-1 .
REMARQUE : Si le tube a été mal placé dans l’œsophage, l’air gonflera l’estomac, provoquant un renflement visible. Dans de tels cas, retirez immédiatement la sonde, administrez une ventilation non invasive pendant 1 à 2 minutes et repositionnez correctement la sonde. - Insérez une sonde gastrique pour prévenir le reflux ou les vomissements. Si l’insertion s’avère difficile, utilisez le laryngoscope pour obtenir une meilleure vue de l’entrée de l’œsophage.
3. Instrumentation
- Placer un cathéter artériel et un cathéter veineux central dans l’artère et la veine fémorales, respectivement, pour la surveillance hémodynamique et le traitement volumique intraveineux.
- Utilisez des bandages pour rétracter et sécuriser les pattes arrière, offrant un meilleur accès aux vaisseaux fémoraux.
- Préparez tout le matériel nécessaire avant l’instrumentation. Remplissez tous les cathéters avec une solution saline et assurez-vous d’un accès facile aux fils et aux cathéters pour minimiser le besoin de tentatives de cathétérisme multiples et de pertes de sang inutiles.
- Appliquez un désinfectant alcoolique sur la zone inguinale et essuyez-la avec un écouvillon stérile. Répétez ce processus deux fois. Appliquez à nouveau le désinfectant sans essuyer et attendez 3 min. Placez un champ fenêtré stérile sur la zone inguinale.
- Utilisez l’échographie pour identifier les vaisseaux sanguins fémoraux. Utilisez une technique de Seldinger guidée par échographie dans le plan pour le cathétérisme afin de minimiser les lésions tissulaires et la perte de sang.
- Visualisez l’artère fémorale longitudinalement. Percer l’artère avec une seringue attachée à l’aiguille pour une aspiration continue. Le sang rouge vif et pulsé confirme la ponction artérielle. Retirez la seringue et insérez le fil préparé. Retirez l’aiguille tout en laissant le fil en place.
- Répétez la même procédure pour la veine fémorale. La ponction veineuse est confirmée par du sang rouge foncé à écoulement lent.
- Confirmez le positionnement correct des deux fils en visualisant les deux vaisseaux fémoraux à l’aide d’ultrasons.
- Utilisez la technique de Seldinger pour insérer d’abord la gaine d’introduction artérielle, suivie de la gaine d’introduction veineuse. Confirmer le bon positionnement par l’analyse des gaz du sang des échantillons de sang prélevés dans les deux lignes.
- S’assurer que le sang peut être aspiré de toutes les lignes. Rincez toutes les lignes avec une solution saline pour éviter la formation de caillots.
- Fixez solidement les lignes à la peau à l’aide de sutures chirurgicales pour éviter la luxation.
- Connectez les cathéters artériels et veineux centraux à des transducteurs pour la mesure des paramètres hémodynamiques.
- Insérez un cathéter de sortie cardiaque à contour de pouls (PiCCO) dans la gaine d’introduction artérielle et connectez-le au transducteur de pression artérielle et au câble d’interface de température du moniteur PiCCO.
- Connectez un cathéter Swan-Ganz à un transducteur.
- Tout en mesurant continuellement la pression, insérez le cathéter dans la gaine centrale de l’introducteur veineux. Gonflez le ballonnet après environ 30 cm, lorsqu’une courbe de pression veineuse centrale devient visible.
- Avancez lentement le cathéter tout en surveillant la courbe de pression. Lorsque le cathéter pénètre dans le ventricule droit, recherchez une courbe de pouls avec une valeur systolique élevée et une valeur diastolique faible. L’avancement du cathéter se traduira par une valeur systolique constante et une valeur diastolique accrue, indiquant un placement dans l’artère pulmonaire.
- Fixez le cathéter dans cette position (généralement entre 50 et 70 cm). Connectez le capteur de température d’injection du système PiCCO à la lumière proximale du cathéter Swan-Ganz.
- Rasez le front du porc et appliquez l’électrode adhésive du capteur pour mesurer la saturation régionale en oxygène cérébrale.
- Après l’induction de l’anesthésie et l’instrumentation, laisser l’animal se stabiliser pendant 30 minutes ou jusqu’à ce que les paramètres hémodynamiques se soient stabilisés avant d’effectuer des mesures de base et d’induire un choc endotoxémique.
4. Induction de choc
REMARQUE : Lorsque vous travaillez avec LPS, portez toujours des gants, des lunettes de protection, un masque et une blouse de laboratoire. Évitez tout contact direct avec le LPS.
- Préparer une solution de LPS à une concentration de 100 μg mL-1 en dissolvant 5 mg de LPS dans 50 mL de NaCl à 0,9 %.
- Obtenez des mesures hémodynamiques de base immédiatement avant de commencer la perfusion de LPS.
- Administrer une dose de 150 μg kg-1 de LPS pendant 30 minutes (équivalent à un débit de perfusion continu de 300 μg kg-1∙h-1 pendant 30 min).
- Après 30 min, réduire le débit de perfusion à 15 μg∙kg-1∙h-1 pour le reste de l’expérience.
- Surveillez en permanence les paramètres hémodynamiques, y compris la pression artérielle artérielle et pulmonaire, la fréquence cardiaque et les paramètres de ventilation. Surveillez la température corporelle en permanence pour maintenir la normothermie.
5. Traitement de l’instabilité hémodynamique
- Lorsque la pression artérielle moyenne tombe en dessous de 60 mmHg, utilisez PiCCO pour mesurer l’indice cardiaque (IC), l’indice global de volume diastolique (GEDI) et l’indice d’eau pulmonaire extravasculaire (ELWI). Traitez l’hypotension artérielle selon les recommandations de l’organigramme de la figure 2.
- Sur le moniteur PiCCO, appuyez sur le bouton de thermodilution (TD).
- Appuyez sur le bouton d’entrée de la pression veineuse centrale (CVP) et entrez la valeur CVP actuelle.
- Appuyez sur le bouton Démarrer .
- Lorsque vous le demandez, injectez 10 mL de solution saline froide dans le capteur de température d’injection connecté au cathéter Swan-Ganz.
REMARQUE : N’injectez rien d’autre directement avant ou pendant la mesure PiCCO car cela compromettrait la mesure.
- Après avoir obtenu des mesures pour l’IC, le GEDI et l’ELWI, traiter l’instabilité hémodynamique selon l’organigramme de la figure 2. Si la charge volumique est recommandée, perfuser rapidement 200 mL de solution d’électrolyte équilibré. Si un traitement par catécholamines est recommandé, augmenter le débit de perfusion de noradrénaline de 1 μg kg-1 h-1.
- Répétez ce processus chaque fois que la pression artérielle moyenne tombe en dessous de 60 mmHg. En cas d’instabilité hémodynamique sévère, optez pour une escalade rapide du traitement.

Figure 2 : Traitement de l’instabilité hémodynamique guidé par PiCCO. Après avoir obtenu des mesures pour l’IC, le GEDI et l’ELWI, appliquer le traitement conformément au tableau. Cette figure a été adaptée du guide de l’utilisateur12 de PiCCO. Abréviations : PiCCO = débit cardiaque du contour du pouls ; V+ = charge volumique ; chat = traitement par catécholamines ; V- = réduction du volume ; IC = indice cardiaque ; GEDI = indice global de volume de fin de diastolique ; ELWI = indice d’eau pulmonaire extravasculaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Fin de l’expérience et euthanasie
- Injecter 0,5 mg de fentanyl par voie intraveineuse. Attendez 5 min. Injecter 200 mg de propofol.
- Euthanasier le porc par injection rapide de 40 mL de chlorure de potassium 1 M par voie veineuse centrale.
Résultats
Pour cette étude, six porcs mâles en bonne santé âgés de 2 à 3 mois et pesant 30 à 35 kg ont été anesthésiés et ont reçu une perfusion de lipopolysaccharide (LPS) pour induit une endotoxémie. Pour déterminer la dose appropriée de LPS nécessaire pour induire systématiquement des symptômes de choc, les porcs ont reçu diverses doses d’induction de LPS allant de 100 μg kg-1 à 200 μg kg-1 sur une période de 30 minutes, suivies d’une dose d’entretien de 1/10 de la dose initiale par heure pour le reste de l’expérience. Tous les animaux ont montré des signes de choc peu de temps après la perfusion de LPS. Les paramètres hémodynamiques ont été surveillés à l’aide du système PiCCO. Les animaux ont montré une diminution de l’indice cardiaque et une augmentation de la fréquence cardiaque, indiquant une instabilité hémodynamique pendant l’état de choc. La pression artérielle moyenne a diminué après la perfusion de LPS, mais a été maintenue au-dessus de 60 mmHg par réanimation liquidienne ou perfusion de noradrénaline si nécessaire (Figure 3). Les lésions pulmonaires ont été indiquées par une diminution du rapport PaO2 FiO 2-1 et une augmentation de la pression artérielle pulmonaire (Figure 4). L’oxygénation cérébrale a été mesurée par spectroscopie proche infrarouge (NIRS) et a diminué après l’induction du choc (Figure 5). Les animaux présentaient également une acidose et une augmentation des niveaux de lactate (Figure 6). Une ANOVA à un facteur avec des comparaisons multiples a été utilisée pour déterminer la signification.
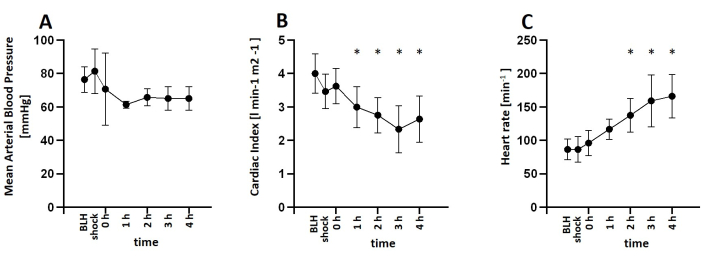
Figure 3 : Développement des paramètres hémodynamiques après perfusion de LPS. (A) La pression artérielle moyenne a diminué après l’induction du choc, mais a été maintenue au-dessus de 60 mmHg en utilisant une perfusion de noradrénaline si nécessaire. (B) L’indice cardiaque a été diminué et (C) la fréquence cardiaque a augmenté après la perfusion de LPS. La moyenne et l’écart-type sont indiqués. *p < 0,05 par rapport aux mesures de base. Abréviations : BLH = santé de base ; LPS = lipopolysaccharide. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Développement des paramètres pulmonaires après perfusion de LPS. (A) Le rapport PaO2 FiO2-1 a diminué peu de temps après la perfusion de LPS. (B) La pression motrice a augmenté après l’induction du choc. (C) La pression artérielle pulmonaire a également augmenté pendant le choc. La moyenne et l’écart-type sont indiqués. *p < 0,05 par rapport aux mesures de base. Abréviations : BLH = santé de base ; LPS = lipopolysaccharide ; FiO2 = fraction d’oxygène inspiratoire ; PaO2 = pression partielle d’oxygène dans le sang artériel. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Oxygénation cérébrale après perfusion de LPS. L’oxygénation cérébrale mesurée par spectroscopie proche infrarouge a diminué après induction de choc avec LPS. La moyenne et l’écart-type sont indiqués. *p < 0,05 par rapport aux mesures de base. Abréviations : BLH = santé de base ; LPS = lipopolysaccharide ; NIRS = spectroscopie proche infrarouge. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Analyse des gaz du sang artériel au cours de l’endotoxémie induite par le LPS. (A) Les animaux sont devenus plus acidotiques avec le temps et (B) les niveaux de lactate ont augmenté après la perfusion de LPS. La moyenne et l’écart-type sont indiqués. *p < 0,05 par rapport aux mesures de base. Abréviations : BLH = santé de base ; LPS = lipopolysaccharide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Nous présentons un protocole d’induction d’endotoxémie expérimentale chez le porc par perfusion de LPS, visant à induire de manière fiable les changements couramment observés dans le sepsis et le choc septique. Plusieurs étapes critiques doivent être prises en compte dans ce protocole. Une sédation adéquate des porcs avant le transport est cruciale pour éviter l’élévation des taux de catécholamines induite par le stress, ce qui pourrait potentiellement compromettre les résultats. L’intubation des porcs peut poser des défis par rapport aux humains en raison des caractéristiques anatomiques de leur museau allongé. Pour y remédier, nous recommandons l’utilisation d’une lame Macintosh pour l’intubation, et la sonde endotrachéale doit être équipée d’un inducteur droit. Il est courant que l’épiglotte adhère au palais mou et, parfois, un tube endotrachéal plus petit peut être nécessaire en raison du rétrécissement sous-glottique de la trachée de l’animal, de sorte qu’un tube capable de traverser les cordes vocales peut encore être trop grand.
Avant la perfusion de LPS, une préparation précise de la concentration de LPS est essentielle. L’administration d’une dose plus élevée de LPS peut entraîner une instabilité hémodynamique sévère et même la mort, tandis qu’une dose plus faible peut ne pas produire les effets souhaités. De plus, il convient de noter que différents frais LPS peuvent présenter des niveaux d’efficacité variables. Nous vous recommandons d’utiliser les mêmes frais LPS pour chaque essai. Des essais de détermination de la dose peuvent être menés pour déterminer la posologie appropriée pour chaque étude. Au début de la perfusion de LPS, la surveillance continue des paramètres hémodynamiques est cruciale en raison du potentiel d’instabilité rapide. Une intervention rapide peut être nécessaire pour gérer les effets indésirables.
PiCCO a été utilisé pour des mesures hémodynamiques avancées. Cette technologie est également fréquemment utilisée chez les patients humains traités en soins intensifs. Il a été développé pour les humains et son utilisation chez les porcs peut poser certains défis. La surface corporelle (BSA) est utilisée pour le calcul des paramètres hémodynamiques. Celui-ci est calculé automatiquement lors de la saisie de la taille et du poids du patient. Bien que la formule utilisée ici (pour les humains) ne soit pas idéale pour calculer la BSA des porcs, il n’y a malheureusement pas d’autre moyen d’entrer dans la BSA. Ce problème a été résolu en saisissant une hauteur de 130 cm pour les porcs, car d’après notre expérience, cela donne les résultats les plus adéquats pour BSA. Cependant, cette limitation doit être gardée à l’esprit lors de l’interprétation des résultats de PiCCO.
Des études antérieures ont décrit l’utilisation du LPS pour simuler le choc septique chez les porcs. Dans ces études, des changements fréquemment observés chez les patients septiques sont décrits tels que l’hypotension, la vasodilatation périphérique, l’augmentation de la pression artérielle pulmonaire et l’augmentation de l’absorption systémique d’oxygène 13,14,15. D’autres méthodes ont également été décrites pour induire une septicémie expérimentale et un choc septique chez les porcs. Un modèle consiste à induire une péritonite par administration intrapéritonéale de matières fécales 16,17,18,19. Une autre approche consiste à injecter directement des bactéries vivantes dans la circulation sanguine des animaux19,20. Par rapport à l’injection de LPS, les protocoles utilisant la péritonite ou la bactériémie pour induire une septicémie expérimentale offrent l’avantage d’un plus grand réalisme. Ces méthodes induisent un état septique réel par infection bactérienne, alors que l’injection de LPS ne représente qu’un aspect des mécanismes pathogéniques sous-jacents.
Cependant, la méthode d’infusion LPS a aussi ses mérites. Par rapport au modèle de péritonite, ce protocole nécessite moins d’efforts et d’expertise car il n’implique qu’une injection intraveineuse sans avoir besoin d’un accès intrapéritonéal. De plus, les symptômes de choc se manifestent plus rapidement que dans les autres modèles, ce qui permet des temps d’observation plus courts et une utilisation réduite des ressources. De plus, les résultats sont hautement reproductibles puisque chaque porc reçoit le même dosage de LPS. En revanche, la composition des matières fécales administrées peut varier considérablement et la croissance bactérienne est influencée par des facteurs incontrôlables19.
Malgré certaines limites, ce protocole induisait systématiquement un choc endotoxémique, affectant plusieurs systèmes organiques. Nous avons observé des altérations caractéristiques de la fonction pulmonaire et de l’hémodynamique, ainsi que des taux élevés de lactate chez tous les animaux traités au LPS. En raison de l’anesthésie profonde continue tout au long de l’expérience, nous n’avons pas pu évaluer la fonction cognitive, qui est incorporée dans le score SOFA à l’aide de l’échelle de coma de Glasgow chez l’homme. Cependant, nous avons observé une réduction de l’oxygénation cérébrale, suggérant un impact potentiel du choc induit par le LPS sur la fonction cérébrale. Dans les premiers stades, le sepsis est souvent associé à une phase hyperdynamique caractérisée par un débit cardiaque élevé. En raison de la progression rapide des symptômes dans ce modèle, les données présentées ici ne montrent pas adéquatement cette phase hyperdynamique. Si cette phase présente un intérêt particulier, les mesures doivent être prises plus régulièrement dans la phase initiale de l’expérience. Un ajustement de la dose de LPS peut aider à ralentir le développement des symptômes et faciliter l’observation de la phase hyperdynamique.
Le LPS et d’autres endotoxines bactériennes ont déjà été utilisés pour simuler le sepsis dans des modèles de petits animaux8. Cependant, l’utilisation de porcs dans ce contexte pose certains défis par rapport aux modèles de petits animaux comme les souris. L’élevage et l’entretien des porcs nécessitent beaucoup plus de temps et d’efforts, et moins d’animaux peuvent être utilisés par expérience. Néanmoins, les grands modèles d’animaux, en particulier les porcs, fournissent une représentation plus réaliste du corps humain. Les porcs présentent des similitudes avec les humains en termes d’anatomie, de génome, de régime alimentaire et de réactivité du système immunitaire 9,10. Un autre avantage est la possibilité d’analyses répétées d’échantillons de sang. Alors que les modèles de petits animaux nécessitent souvent un équipement spécialisé, l’équipement médical standard couramment utilisé chez les patients humains peut être appliqué aux porcs, ressemblant ainsi à l’instrumentation et à la surveillance hémodynamique dans un environnement de soins intensifs cliniques. En conclusion, ce protocole établit un modèle expérimental d’endotoxémie chez le porc par perfusion de LPS. Il offre une méthode simple et standardisée pour induire de manière cohérente les changements fréquemment observés chez les patients en choc septique.
Déclarations de divulgation
Le dispositif NIRS a été fourni inconditionnellement par Medtronic PLC, États-Unis, à des fins de recherche expérimentale. Alexander Ziebart a reçu des frais de conférence de Medtronic PLC. Aucun des auteurs ne signale de conflits d’intérêts financiers ou autres. Le manuscrit a été relu et édité par ChatGPT® (Python Software, version : 24 mai 2023).
Remerciements
Les auteurs tiennent à remercier Dagmar Dirvonskis pour son excellent soutien technique.
matériels
| Name | Company | Catalog Number | Comments |
| Atracurium Hikma 50 mg/5mL | Hikma Pharma GmbH, Martinsried | ||
| Azaperone (Stresnil) 40 mg/mL | Lilly Deutschland GmbH, Bad Homburg, Germany | ||
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy, AB Helsingborg, Schweden | 3-way-stopcock | |
| Curafix i.v. classics | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Cannula retention dressing | |
| Datex Ohmeda S5 | GE Healthcare Finland Oy, Helsinki, Finland | hemodynamic monitor | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland, GmbH | perfusor line | |
| Intrafix Primeline | B. Braun Melsungen AG, Melsungen, Germany | Infusion line | |
| Introducer sheath 5 Fr. | Terumo Healthcare | arterial introducer | |
| INVOS | Medtronic, Dublin, Ireland | near infrared spectrometry | |
| JOZA Einmal Nitril Untersuchungshandschuhe | JOZA, München, Germany | disposable gloves | |
| Laryngoscope, 45.48.50, KL 2000 | Medicon | Laryngoscope handle | |
| Littmann Classic III Stethoscope | 3M Deutschland GmbH, Neuss, Germany | stethoscope | |
| LPS (E. coli; Serotype O111:B4) | Sigma-Aldrich, Switzerland | ||
| MAC Two-Lumen Central venous access set | Arrow international inc. Reading, PA, USA | venous introducer | |
| Maimed Vlieskompresse | Maimed GmbH, Neuenkirchen, Germany | Fleece compress to fix the tongue | |
| Masimo LNCS Adtx SpO2 sensor | Masimo Corporation Irvine, Ca 92618 USA | saturation clip for the tail | |
| Masimo LNCS TC-I SpO2 ear clip sensor | Masimo Corporation Irvine, Ca 92618 USA | Saturation clip for the ear | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Midazolam 15 mg/3 mL | B.Braun Melsungen AG, Germany | ||
| Midmark Canine Mask Small Plastic with Diaphragm FRSCM-0005 | Midmark Corp., Dayton, Ohio, USA | dog ventilation mask | |
| Monocryl surgical suture | Johnson & Johnson, Belgium | ||
| B.Braun Melsungen AG, Germany | saline solution | ||
| NaCl 0.9 % | Sanofi- Aventis, Seutschland GmbH | ||
| Octeniderm farblos | Schülke & Mayr GmbH, Nordenstedt, Germany | Alcoholic disinfectant | |
| Original Perfusor syringe 50 mL | B.Braun Melsungen AG, Germany | perfusor syringe | |
| PA-Katheter Swan Ganz 7.5 Fr 110 cm | Edwards Lifesciences LLC, Irvine CA, USA | Swan-Ganz catheter | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| PiCCO catheter | PULSION Medical Systems SE, Feldkirchen, DE | ||
| Potassium chloride 1 M | Fresenius, Kabi Germany GmbH | ||
| Propofol 2% 20 mg/mL (50 mL flasks) | Fresenius, Kabi Deutschland, GmbH | ||
| Pulse-contour continous cardiac output System PiCCO2 | PULSION Medical Systems SE, Feldkirchen, DE | ||
| Rüschelit Super Safety Clear >ID 6/6.5 /7.0 mm | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Sonosite Micromaxx Ultrasoundsystem | Sonosite Bothell, WA, USA | ultrasound | |
| Stainless Macintosh Größe 4 | Welch Allyn69604 | blade for laryngoscope | |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | Balanced electrolyte solution | |
| Vasco OP sensitive | B.Braun Melsungen AG, Germany | sterile gloves | |
| Vasofix Safety 22 G-16 G | B.Braun Melsungen AG, Germany | venous catheter | |
| VBM Cuff Manometer | VBM Medizintechnik GmbH, Sulz a.N., Germany | cuff pressure gauge |
Références
- Vincent, J. -L., Jones, G., David, S., Olariu, E., Cadwell, K. K. Frequency and mortality of septic shock in Europe and North America: a systematic review and meta-analysis. Critical Care. 23 (1), 196(2019).
- Reinhart, K., et al. Recognizing sepsis as a Global Health Priority - A WHO Resolution. New England Journal of Medicine. 377 (5), 414-417 (2017).
- Cecconi, M., Evans, L., Levy, M., Rhodes, A. Sepsis and septic shock. The Lancet. 392 (10141), 75-87 (2018).
- Font, M. D., Thyagarajan, B., Khanna, A. K. Sepsis and septic shock - basics of diagnosis, pathophysiology and clinical decision making. Medical Clinics of North America. 104 (4), 573-585 (2020).
- Singer, M., et al. The Third International Consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 315 (8), 801(2016).
- Jerala, R. Structural biology of the LPS recognition. International Journal of Medical Microbiology. 297 (5), 353-363 (2007).
- Copeland, S., Warren, H. S., Lowry, S. F., Calvano, S. E., Remick, D. Inflammation and the host response to injury investigators acute inflammatory response to endotoxin in mice and humans. Clinical and Diagnostic Laboratory Immunology. 12 (1), 60-67 (2005).
- Dickson, K., Lehmann, C. Inflammatory response to different toxins in experimental sepsis models. International Journal of Molecular Sciences. 20 (18), 4341(2019).
- Bassols, A., Costa, C., Eckersall, P. D., Osada, J., Sabrià, J., Tibau, J. The pig as an animal model for human pathologies: A proteomics perspective. PROTEOMICS - Clinical Applications. 8 (9-10), 715-731 (2014).
- Meurens, F., Summerfield, A., Nauwynck, H., Saif, L., Gerdts, V. The pig: a model for human infectious diseases. Trends in Microbiology. 20 (1), 50-57 (2012).
- Ali, J., Cody, J., Maldonado, Y., Ramakrishna, H. Near-infrared spectroscopy (NIRS) for cerebral and tissue oximetry: analysis of evolving applications. Journal of Cardiothoracic and Vascular Anesthesia. 36, 2758-2766 (2022).
- Getinge Deutschland GmbH PiCCO Technologie Erweitertes hämodynamisches Monitoring auf höchstem Niveau. , Available from: https://www.getinge.com/dam/hospital/documents/german/picco_haemodynamisches_monitoring_broschuere-de-non_us.pdf (2023).
- Breslow, M. J., Miller, C. F., Parker, S. D., Walman, A. T., Traystman, R. J. Effect of vasopressors on organ blood flow during endotoxin shock in pigs. American Journal of Physiology-Heart and Circulatory Physiology. 252 (2), H291-H300 (1987).
- Fink, M. P., et al. Systemic and mesenteric O2 metabolism in endotoxic pigs: effect of ibuprofen and meclofenamate. Journal of Applied Physiology. 67 (5), Bethesda, Md. 1950-1957 (1989).
- Lado-Abeal, J., et al. Lipopolysaccharide (LPS)-induced septic shock causes profound changes in myocardial energy metabolites in pigs. Metabolomics. 14 (10), 131(2018).
- Park, I., et al. Characterization of fecal peritonitis-induced sepsis in a porcine model. The Journal of Surgical Research. 244, 492-501 (2019).
- Jarkovska, D., et al. Heart rate variability in porcine progressive peritonitis-induced sepsis. Frontiers in Physiology. 6, 412(2015).
- Kohoutova, M., et al. Vagus nerve stimulation attenuates multiple organ dysfunction in resuscitated porcine progressive sepsis. Critical Care Medicine. 47 (6), e461-e469 (2019).
- Vintrych, P., et al. Modeling sepsis, with a special focus on large animal models of porcine peritonitis and bacteremia. Frontiers in Physiology. 13, 1094199(2022).
- Stengl, M., et al. Reduced L-type calcium current in ventricular myocytes from pigs with hyperdynamic septic shock. Critical Care Medicine. 38 (2), 579-587 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon