Method Article
膵管腺癌の多能性へのリプログラミング
要約
本プロトコルは、膵管腺癌(PDAC)および正常な膵管上皮細胞を人工多能性幹細胞(iPS細胞)に再プログラミングすることを記述する。レンチウイルスの調製から安定なiPS細胞株の樹立まで、最適化された詳細な手順を段階的に提供します。
要約
転写因子を用いた人工多能性幹細胞(iPS細胞)の作製は、ほぼすべての分化細胞種から達成されており、研究や臨床応用に高い価値があることが証明されています。興味深いことに、膵管腺がん(PDAC)などのがん細胞のiPS細胞のリプログラミングは、浸潤性PDAC表現型を逆転させ、がんエピゲノムを上書きすることが示されています。PDAC由来iPS細胞の分化は、初期の膵臓上皮内腫瘍(PanIN)前駆体からのPDACの進行を再現し、PDACの進行の初期に起こる分子的および細胞的変化を明らかにすることができます。したがって、PDAC由来のiPS細胞は、早期発見診断マーカーの発見のためのPDACの初期段階をモデル化するために使用できます。これは、初期のPanIN期の信頼できるバイオマーカーがないため、通常、転移後期で診断されるPDAC患者にとって特に重要です。しかし、PDACを含むがん細胞株を多能性にリプログラミングすることは、依然として困難で労働集約的であり、異なる細胞株間で大きなばらつきがあります。ここでは、ビシストロニックレンチウイルスベクターを用いて、様々なヒトPDAC細胞株からiPS細胞を作製するための、より一貫性のあるプロトコルについて述べる。得られたiPS細胞株は安定しており、リプログラミング因子や誘導性薬物の外因性発現に依存しないことを示しています。全体として、このプロトコルは、PDAC症例のより特異的で代表的な早期バイオマーカーの発見に不可欠な、幅広いPDAC由来iPS細胞の作製を容易にします。
概要
膵管腺がん(PDAC)は最も致命的な悪性腫瘍の1つであり、この疾患の無症候性の性質のために早期診断は依然として困難です。PDAC患者の大多数は、治療の選択肢が非常に限られている進行性転移段階で診断されます1,2。これは主に、血流に放出されたタンパク質として便利に検出できるバイオマーカーなど、初期段階の信頼できるバイオマーカーが不足しているためです。
PDACは進行の非常に早い時期に播種する可能性があり、PDACが膵臓に局在している場合、予後が良好になるとがんの早期発見につながることがわかっています3。しかし、予後が良好と診断され、外科的切除が可能となるPDAC患者の10分の1未満である。それにもかかわらず、切除可能な腫瘍を有する少数の患者は、12ヵ月以内に腫瘍が再発する傾向もあります4。
過去50年間で、外科的技術、患者ケア、および治療法において目覚ましい改善が行われました5,6。しかし、外科的に切除されたPDAC患者の5年生存率は17%にかろうじて上昇している。それにもかかわらず、これはほとんど変わらない(0.9%)未切除患者よりもまだましです4,7。化学療法は、PDACの代替療法としては他に唯一の治療法です。しかし、PDAC患者の大多数はゲムシタビン7,8などの化学療法薬に対して強い耐性を示すため、この選択肢は非常に限られています。エルロチニブなどの他の薬剤は、特定の変異を有する少数のPDAC患者にのみ利用可能であり、そのほとんどがエルロチニブ耐性を示す9。ほとんどのPDAC患者における化学療法に関連する有害な副作用は、この治療のさらに別の欠点です10。最近、有望な戦略により、免疫チェックポイント阻害剤(ICI)と低分子キナーゼ阻害剤(SMKI)がPDACの治療に有効であることが示されていますが、これらの標的療法に対する持続的な反応は少数の患者に限られています11,12。全体として、PDAC特異的な早期バイオマーカーの発見は、早期診断と治療のための新しい道を開く可能性があります。
PDACは、非侵襲性膵管上皮増殖に起因する膵臓上皮内腫瘍(PanIN)前駆体病変から発症する13,14。PanINの形成はKRASなどのがん遺伝子変異によって開始されますが、PDACへの進行には追加の遺伝的およびエピジェネティックな変化が必要です。PanINがさまざまな段階を経て侵襲性PDACに進行するには、約10年かかると予測されています13、15、16、17。この時間枠は、早期PDAC診断の恩恵を受ける絶好の機会を提供します。したがって、PDACの進行を研究するために、腫瘍異種移植動物モデルとオルガノイド培養を確立するための広範な研究が行われてきました18,19,20,21。これらのモデルは、PDACの侵襲的段階を研究するのに非常に有用であるが、初期のPanIN段階からの移行ではない。したがって、早期発見バイオマーカーの発見を可能にするために、PanINステージの初期の進行を再現できる実験モデルを開発することが重要です。
4つの転写因子OCT4、SOX2、KLF4、およびc-MYC(OSKM)を使用して、体細胞を人工多能性幹細胞(iPSC)にリプログラミングすると、細胞の可塑性の程度が示されました22。がん細胞の可塑性は十分に立証されており、ヒトがん細胞をiPS細胞にリプログラミングすることで、細胞を元の細胞状態にリセットし、がんの進行中に蓄積したエピジェネティックな損傷の多くを取り除くことに成功しています23,24,25,26,27,28,29.したがって、このリプログラミング戦略を使用してがん細胞の同一性を操作する可能性は、がんの治療に大きな期待が寄せられています30,31。実際、PDAC由来のiPS細胞の分化は、初期のPanINステージ32を通じてPDACの進行を再現できることを以前に示しました。PDACの初期から中期に特異的な遺伝子と経路を特定することにより、PDACの早期診断に臨床的に使用できる候補バイオマーカーが特定されました32,33。しかし、単一のiPS細胞株を用いて発見されたバイオマーカーは、PDAC患者の大多数において限られた範囲しかカバーしていないことが示された32。他のPDAC患者からiPS細胞株を作製するという課題により、より信頼性の高いバイオマーカーを発見する能力が妨げられてきました。これは、ヒト初代PDAC細胞のごく一部のみが4つの因子をすべて含み、リプログラミングに正常に応答したため、OSKM送達の不均一性を含む多くの技術的要因によるものです。ここでは、OSKMのより効率的で一貫性のあるデュアルレンチウイルス送達を使用して初代PDAC細胞をリプログラミングするための詳細なプロトコルを示します。
プロトコル
すべての実験プロトコルは、OHSU治験審査委員会によって承認されました。すべての方法は、関連するガイドラインと規制に従って実施されました。PDX腫瘍に対するすべての動物実験は、OHSU Institutional Animal Use and Care Committee(IACUC)の承認を得て実施された。このプロトコルは、患者由来の異種移植片(PDX)からの一次PDAC細胞、腺癌の61歳の女性患者の膵臓組織から単離された上皮形態を示すBxPc3細胞株、正常なヒト膵管上皮に由来するH6C7不死化上皮細胞株、および健康な個人の皮膚生検に由来する一次ヒト線維芽細胞でテストされました。ヒトPDAC標本は、Oregon Pancreas Tissue Registry研究(IRB00003609)で取得されました。インフォームドコンセントはすべての被験者から得られました。ヒト一次線維芽細胞は、英国エジンバラのRBiomedicalで、英国のリトルフランスにあるエジンバラ王立病院で、同意と倫理的承認の下で定期的な手術を受けている匿名のドナーからの皮膚サンプルから得られました(09 / MRE00 / 91)。すべてのレンチウイルス研究は、クラス2の研究活動(GM207 / 16.6)の下で実施され、エジンバラ大学の健康安全部門によって承認され、スコットランド政府のHSE所轄官庁に通知されています。ヒト膵臓細胞を用いたすべてのリプログラミング実験は、エジンバラ大学生物科学部倫理委員会の倫理的承認の下で実施された(参照#asoufi-0002)。
1. レンチウイルスの調製
- レンチウイルスの調製には、psPAX2、pMDG34、および2つのRES含有ビシストロニックベクターを含む濃度が1〜2μg/μLの高品質のパッケージングおよび発現プラスミド(エンドトキシンフリー)を調製します。EF-1αプロモーターによって駆動されるOCT4およびSOX2発現に対するpSIN4-EF1a-O2Sエンコーディング、およびCMVエンハンサー/プロモーター35 ( 材料表参照)の下でのKLF4およびc-MYC発現に対するpSIN4-CMV-K2M。また、トランスフェクションコントロールとして使用するpWPT-GFPプラスミドを調製します。
- ヒト胚性腎臓細胞株(293T)を融解し、10%ウシ胎児血清(FCS)、1x非必須アミノ酸、1 mMピルビン酸ナトリウム、1 mMグルタミンを添加したグラスゴー最小必須培地(GMEM)で、37°Cおよび5%CO2で培養します(材料表を参照)。
注:293T細胞は、融解後4継代以内で使用することが推奨されます。 - トランスフェクションの24時間前に、15 cmディッシュあたり300万個の細胞密度で293Tを播種します。合計3品の料理が必要です。細胞を播種するのは午後~16:00の遅い時間帯が望ましいです。
- 翌日(~16:00)、細胞のコンフルエント度が~40%-50%に達したら、3回のトランスフェクション反応のために以下を準備します。
注:ピペッティングエラーを考慮して、容量を10%追加してください。- 3本の15 mLプラスチックチューブに適切なレンチウイルス名(pSIN4-EF1a-O2S、pSIN4-CMV-K2M、およびpwPT-GFPコントロール)をラベル付けします。各チューブに1.710 mLの還元血清培地( 材料表を参照)を追加します。
- トランスフェクション試薬 90 μL ( 材料表を参照) を 1.710 mL の還元血清培地で希釈し、バーテックスで 2 秒間混合し、室温で 5 分間インキュベートします。
- パッケージングベクターを混合します。5.1 μg の psPAX2 および 2.4 μg の pMDG (合計 7.5 μg)。
- パッケージングベクター混合物をトランスフェクション培地に添加し(ステップ1.4.2から)、2秒間ボルテックスします。
- 各リプログラミングベクター(pSIN4-EF1a-O2S、pSIN4-CMV-K2M、pwPT-GFPコントロール)をステップ(1.4.4)のトランスフェクション混合物に加え、2秒間ボルテックスします。
注:発現ベクター:ウイルスベクターを1:1の比率で使用してください。
- トランスフェクションチューブを室温で15分間インキュベートします。
- ステップ(1.4.5)のトランスフェクション-DNA混合物を培地に滴下して直接添加することにより、各レンチウイルスに293T細胞をトランスフェクションします。皿を渦巻かせて、表面全体に均一に分布するようにします。
- トランスフェクションした細胞を37°C、5%CO2 インキュベーターで一晩インキュベートします。
注意: ウイルス固有の廃棄物、金属製の廃棄バケツ、オートクレーブバッグ付きのダブルバッグを使用し、ウイルス用の液体廃棄物容器を取り、消毒剤の錠剤を追加します。すべてのピペット、チップ、チューブは金属製のバケツに入れて廃棄してください。古い培地はウイルス液の廃棄物容器に廃棄してください。偶発的なウイルス汚染を防ぐために、ガラスピペットやガラス器具の使用は避けてください。 - トランスフェクション後14〜16時間後、培地を30 mLの新鮮な293T培地と交換します。
- トランスフェクションした細胞を培地交換後60〜72時間、37°C、5%CO2 でインキュベートします。細胞を毎日観察し、GFP蛍光でトランスフェクション効率を確認します。
注:理想的には、トランスフェクション効率はGFPで>90%である必要があります。他のウイルスについては、293T細胞はウイルス粒子を産生する際により丸くなる傾向があるため、明確な形態学的変化が観察されるはずです。 - 各ウイルストランスフェクション培養液を 50 mL チューブに回収し、スピンダウンして 1932 x g で 4 °C で 10 分間細胞破片を取り除きます。
- 各レンチウイルス上清を0.45 μMシリンジフィルターでろ過し、小さな破片を取り除き、新しい50 mLチューブに回収します。
- 各レンチウイルス上清を6 mLのアリコートに分割し、それぞれを液体窒素で急速凍結します。
- レンチウイルスアリコートは、使用する準備ができるまで-80°Cで保管してください。
2. レンチウイルス形質導入のリプログラミング
- 37°C、5%CO2、および5% O2 (低酸素)インキュベーター中で、ウシ下垂体抽出物(BPE)、5 ng/mLのヒト組換え上皮成長因子(EGF)、および50 ng/mLのコレラ毒素を添加した、完全に定義されたケラチノサイト血清遊離培地(KSFM)で初代PDAC細胞および培養を解凍します( 材料表を参照)。
- 扁平上皮膵管腺癌細胞株であるBxPc3を融解し、37°Cで10%ウシ胎児血清(FCS)を添加したRPMI 1640培地で培養し、5%CO2で培養します。
- H6C7細胞、膵管上皮細胞、およびBPEおよびEGFを添加したKSFMで5 ng/mL、37°C、5%CO2で融解します。
- ヒト線維芽細胞(hFib)を解凍し、10% FCS、1x 非必須アミノ酸、1 mMピルビン酸ナトリウム、1 mMグルタミン、0.05 mM(最終)β-メルカプトエタノールを添加したグラスゴー最小必須培地(GMEM)で、37°Cおよび5%CO2で融解します。
- レンチウイルス形質導入の1日前(できれば午後遅く)に、PDAC、BxPc3、H6C7、およびhFib細胞のそれぞれ1ウェルあたり100,000個の細胞を含む6ウェルプレートの2つのウェルを調製します。1つのウェルをOSKMレンチウイルスに感染させ、もう1つのウェルを未感染のコントロールとして使用します。
注意: 細胞の種類ごとに別々のプレートを使用してください。 - 翌日の午後(約24時間後)に、細胞のコンフルエント度が少なくとも70%に達していることを確認してから、次のレンチウイルス感染ステップに進みます。
3. PDACのレンチウイルス形質導入
- 各レンチウイルス上清5 mLを37°Cのウイルスインキュベーターで解凍します。
- それぞれに2 mLの予熱したPDAC培地が入った15 mLのチューブを2本用意します。
- 最初のチューブに、各リプログラミングレンチウイルス(pSIN4-CMV-K2MおよびpSIN4-EF1a-O2S)6 mLと4.5 mg/mLポリブレン12 μL(最終4.5 μg/mL、 材料表を参照)を加えて混合します。
- 2本目のチューブに、2 μLの4.5 mg/mLのポリブレンを加えます(最終4.5 μg/mL)。
- 各ウェルから培地を廃棄し、室温でPBSで一度洗浄します。
- リプログラミング感染培地(チューブ1)を最初のウェルに加えます。
- チューブ2の混合物を2番目のウェルに加えます。これが感染していないコントロールになります。
- PDAC細胞を37°C、5%CO2、 および5%O2 (低酸素)インキュベーターで一晩インキュベートします。
- 翌日の午後に、両方のウェルから培地を廃棄し、新しいPDAC培地と交換します。
- 細胞を37°C、5%CO2、 および5%O2 (低酸素)で48時間インキュベートします。
4. BxPc3細胞のレンチウイルス形質導入
- 各レンチウイルス上清3 mLを37°Cのウイルスインキュベーターで解凍します。
- それぞれ2 mLのBxPc3培地を含む15 mLチューブを2本準備します。
- 最初のチューブに、各リプログラミングレンチウイルス(pSIN4-CMV-K2MおよびpSIN4-EF1a-O2S)3 mLと4.5 mg/mLポリブレン6 μL(最終4.5 μg/mL)を加えて混合します。
- 2本目のチューブに、2 μLの4.5 mg/mLのポリブレンを加えます(最終4.5 μg/mL)。
- 各ウェルから培地を捨て、PBSで一度洗浄します。
- リプログラミング感染培地(チューブ1)を最初のウェルに加えます。
- チューブ2の混合物を2番目のウェルに加えます。これが感染していないコントロールになります。
- 感染したBxPc3細胞を37°Cのウイルスと5%CO2 で一晩インキュベートします。
- 翌日の午後に、両方のウェルから培地を廃棄し、新しいBxPc3培地と交換します。
- 細胞を37°C、5%CO2 で48時間インキュベートします。
5. H6c7細胞感染のレンチウイルス形質導入
- 各レンチウイルス上清4 mLを37°Cのウイルスインキュベーターで解凍します。
- それぞれ2 mLのH6c7培地を含む15 mLチューブを2本準備します。
- 最初のチューブに、各リプログラミングレンチウイルス(pSIN4-CMV-K2MおよびpSIN4-EF1a-O2S)4 mLと4.5 mg/mLのポリブレン(最終4.5 μg/mL)8 μLを加えて混合します。
- 2本目のチューブに、2 μLの4.5 mg/mLのポリブレンを加えます(最終4.5 μg/mL)。
- 両方のウェルから培地を廃棄し、PBSで一度洗浄します。
- リプログラミング感染培地(チューブ1)を最初のウェルに加えます。
- チューブ2の混合物を2番目のウェルに加えます。これが感染していないコントロールになります。
- 感染したH6C7細胞を37°Cのウイルスと5%CO2 で一晩インキュベートします。
- 翌日の午後に、両方のウェルから培地を廃棄し、新しいH6c7培地と交換します。
- 細胞を37°C、5%CO2 で48時間インキュベートします。
6. hFib細胞のレンチウイルス形質導入
- 各レンチウイルス上清2 mLを37°Cのウイルスインキュベーターで解凍します。
- それぞれ2 mLのhFib培養培地を含む15 mLチューブを2本用意します。
- 最初のチューブに、各リプログラミングウイルス(pSIN4-CMV-K2MおよびpSIN4-EF1a-O2S)を2 mL添加し、4.5 mg/mLのポリブレン(最終4.5 μg/mL)を4 μL添加して混合します。
- 2本目のチューブに、2 μLの4.5 mg/mLポリブレン(最終4.5 μg/mL)を加えて混合します。
- 各ウェルから培地を捨て、PBSで一度洗浄します。
- リプログラミング感染培地(チューブ1)を最初のウェルに加えます。
- チューブ2の混合物を2番目のウェルに加えます。これが感染していないコントロールになります。
- 感染したhFib細胞を37°C、5%CO2 で一晩インキュベートします。
- 翌日の午後に、両方のウェルから培地を廃棄し、新しいhFib培地と交換します。
- 細胞を37°C、5%CO2 でさらに48時間インキュベートします。
注:レンチウイルスの形質導入を効率的に行うには、レンチウイルスの量は細胞の種類によって大きく異なるため、慎重に力価を計上してください。細胞の種類によっては、複数のレンチウイルス形質導入が必要になる場合があります。PDAC細胞株は最大3回の投与が必要ですが、BxPc3、H6C7、およびhFib株のリプログラミングには1回の投与で十分です。
7. iMEFフィーダーセルの調製
- 1%ゼラチン原液をPBSで希釈して、0.2%ゼラチン溶液40mLを調製します。
- 4枚の6ウェルプレートを2 mLの0.2%ゼラチン溶液で覆います。
- ゼラチンでコーティングしたプレートを37°C、5%CO2 で少なくとも30分間インキュベートします。
- 余分なゼラチン溶液を吸引し、プレートをフローフードの下で乾燥させます。
- 照射したマウス胚性線維芽細胞(iMEF)のバイアル2本(バイアルあたり~400万細胞)を37°Cの水槽で旋回させて解凍します。
注意: 汚染の可能性を減らすために、キャップ開口部の近くに水が飛び散らないように注意してください。バイアルをペーパータオルで乾かし、70%エタノールをスプレーします。 - 組織培養フード内で、解凍した各iMEFバイアルの内容物を、予め温めたhFib培養培地10 mLを含む1本の15 mLチューブに滴下し、チューブを静かに反転させてよく混合します。
- 細胞懸濁液を室温で3分間309 x g でスピンダウンし、各チューブから上清を取り除きます。各細胞ペレットを12 mLのhFib培地に再懸濁します。
- ゼラチンでコーティングされた6ウェルプレートのウェルあたり2 mLの細胞懸濁液をプレートします。プレートを全方向に静かに振って細胞を均等に分散させます。
- プレートを37°C、5%CO2 で一晩インキュベートします。
注:リプログラミング実験に使用する24時間前に、新しいiMEFプレートを調製してください。
8. 感染細胞をiMEFフィーダー層に転写
- 感染したPDAC、非感染のPDAC、BxPc3、H6c7、およびhFib細胞から培地を廃棄します。室温でPBSで各ウェルを2回洗浄します。
- 各ウェルに0.5 mLのトリプシンを添加して、細胞をプレートから解離します。PDAC細胞を37°C、5%CO2、 および5%O2 (低酸素)インキュベーターで15分間インキュベートします。
- BxPc3細胞を37°C、5%CO2 で5分間インキュベートします。
- H6c7およびhFib細胞を37°C、5%CO2 で4分間インキュベートします。
- 解離した細胞懸濁液を各ウェルから、感染または非感染とラベル付けされた15 mLチューブに移します。
- 次のように遠心分離により細胞を回収します:PDACの場合、細胞懸濁液を300 x g で5分間回転させます。BxPc3 の場合、細胞懸濁液を 120 x g で 5 分間回転させます。H6C7 の場合は、細胞懸濁液を 112 x g で 4 分間回転させます。hFibの場合は、細胞懸濁液を161 x g で3分間スピンします。すべての遠心分離は室温で行います。
- 各細胞タイプペレットを適切な培地1 mLに再懸濁します。
- ステップ7で調製したiMEFプレートを各細胞型培養培地で2回洗浄します。すなわち、1枚のプレートをPDAC培地で洗浄し、1枚をBxPc3培地で、1枚をH6C7培地で、もう1枚をhFib培地で洗浄します。
- ウェルあたり 50,000 個の感染細胞を iMEF 6 ウェルプレートの 5 つのウェルでプレートします。50,000個の未感染コントロール細胞をiMEF 6ウェルプレートの残りの1ウェルに播種します。
注:播種する感染細胞の数を、ウェルあたり1,000〜50,000細胞に最適化します。 - PDAC細胞を37°C、5%CO2、および5%O2 (低酸素)で一晩インキュベートします。
- BxPc3、H6C7、およびhFib細胞を37°C、5%CO2 で一晩インキュベートします。
- 翌日、リプログラミング培地を次のように調製します:ノックアウト血清交換用(25%ファイナル)、200 mMグルタミン5 mL(ファイナル1 mM)、100倍非必須アミノ酸5 mL(ファイナル100 μM)、1.5 mLのベータメルカプトエタノール(0.1 mMファイナル)を400 mLのモディファイドイーグル培地(DMEM)に加えます。
- リプログラミング培地を100 mLアリコートに入れ、4°Cで最大4週間、または-20°Cで長期間保存します。
- 使用する準備ができたら、100 μL の 10 mg/mL 塩基性線維芽細胞増殖因子(bFGF)(最終 10 ng/mL)を 100 mL リプログラミング培地のアリコート 1 つに添加します。
- リプログラミング培地を37°Cのウォーターバスで温めます。
- iMEFフィーダーで増殖した細胞を、予め温めたリプログラミング培地で2回洗浄します。
各ウェルに2 mLの再プログラミング培地を加えます。 - リプログラミングプレートを37°C、5%CO2および3%O2 (低酸素)インキュベーターに移します。
メモ: 再プログラミングメディアが追加された日は、再プログラミングの 1 日目と見なされます。 - iPS細胞コロニーが現れ始めるまで、新鮮なリプログラミング培地を毎日細胞に与えます。
注:iPS細胞コロニーは、ESC様形態(エッジがはっきりし、核/細胞質比が高い細胞で構成されるコンパクトなコロニー)で識別します。 - iPS細胞コロニーを毎日モニタリングし、十分な数が形成されたら、プールとして継代します。
注:iPS細胞コロニー同士が接触しないと、分化が起こり、長期的な安定性に影響を与えるため、注意が必要です。 - クローン株を確立するには、iPS細胞プールを約5回継代し、ESC様の形態を維持する頑健なコロニーを選別します。
- 完全に再プログラムされたiPS細胞コロニーを同定するには、TRA-160( 材料表参照)で生染色を行い、iPS細胞コロニーからRNAを採取して遺伝子発現の特性評価を行います。
9. iPS細胞コロニーの継代
- ステップ7で説明したように、iPS細胞コロニーを継代する24時間前に十分な数のiMEFフィーダープレートを準備します。
- iMEFフィーダープレートを、あらかじめ温めたリプログラミング培地で2回洗浄します。
- ROCK阻害剤(Y2)(10 μM)を添加したリプログラミング培地2 mLをiMEFプレートの各ウェルに加えます。
- iMEFプレートを37°C、5%CO2、 および3%O2 インキュベーターで、使用する準備ができるまでインキュベートします。
- エチレンジアミン四酢酸/リン酸緩衝生理食塩水(EDTA/PBS)溶液を、0.5 M EDTA 1:1000 PBS で希釈して調製します(0.5 mM 最終)。
- リプログラミング培地を各ウェルで 0.5 mL の EDTA/PBS と交換します。
- 細胞の種類に応じて、37°C、5%CO2、 および3%O2 インキュベーターまたは室温でインキュベートします。BxPc3およびPDAC iPS細胞は、37°Cで15分間のインキュベーションが必要です。 H6C7およびhFib iPS細胞は、室温で5分間インキュベートする必要があります。
- iPS細胞がコロニー全体でフィーダー層から均一に解離し始めるまで、顕微鏡で観察します。
- 解離したiPS細胞懸濁液を15mLの遠心チューブに集めます。室温で300 x g で5分間スピンダウンします。
- 細胞ペレットを、Y2(10 μM)を添加したリプログラミング培地1 mLに再懸濁します。
- iPS細胞懸濁液1 mLをiMEFプレートの3つのウェルに移すことにより、iMEFフィーダー層に細胞をプレーティングします。
注:分割比は、採取したiPS細胞コロニーの数によって異なる場合があります。 - 37°C、5%CO2 および3%O2 インキュベーターでインキュベートします。
10. TRA-1-60によるiPS細胞コロニーの生染色
- リプログラミング培地で4 μg/mLのTRA-1-60抗体をウェルあたり0.5 mL調製します。
- リプログラミング培地を廃棄し、各ウェルで0.5 mLの抗体混合物と交換します。37°C、5% CO2、 3% O2 インキュベーターで 30 分間インキュベートします。
- リプログラミング培地で細胞を2回洗浄します。
- GFPフィルターを用いた細胞イメージングシステムで蛍光画像を撮影します。
- ネガティブコントロールチャンネルを考慮して画質を確認します。
結果
PDAC、BXPc3、H6C7、hFib細胞由来のiPS細胞コロニーの形態を示す代表的な画像を 図1に示します。PDAC-iPS細胞コロニーは、リプログラミング25日目に形成され始めました。より確立されたESC様形態を持つ頑健なiPS細胞コロニーが、リプログラミングの40日目に同定されました(図1)。同様に、BxPc3-iPS細胞の形成は23日目に始まり、35日目までに確立されました。H6C7-iPS細胞の形成はPDAC-iPS細胞と類似しており、45日目に確立され始めました。hFib-iPS細胞コロニーは、リプログラミングの15日目に形成され始めました。
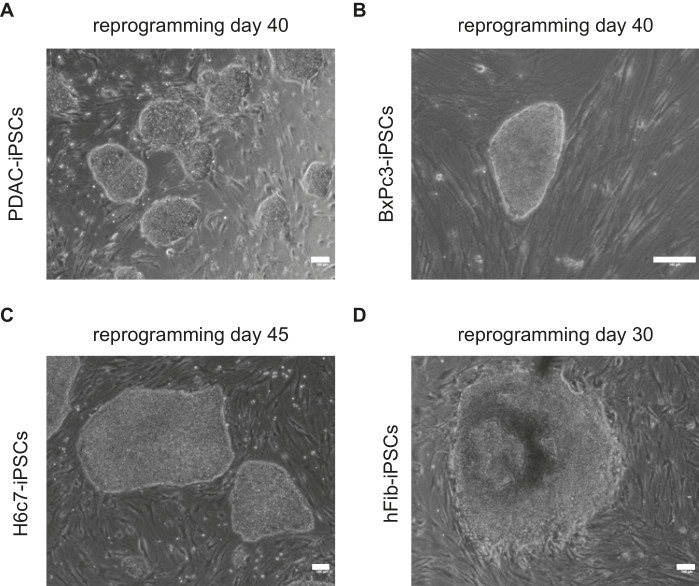
図1: iPS細胞コロニーの代表画像画像は、(A)PDAC、(B)BxPc3、(C)H6c7、および(D)hFibに由来する確立されたヒトES細胞様形態を示しています。再プログラミングの日数は、各画像の上に示されています。スケールバー = 100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
クローンiPS細胞株は、PDAC、BxPc3、H6C7、およびhFib細胞の各リプログラミングから確立されました。確立されたすべてのiPS細胞株は、未分化ヒトESC細胞表面マーカーであるTRA-1-60に陽性で染色され、多能性へのリプログラミングが確認されました(図2)。

図2:クローンiPS細胞株の代表画像。 画像は、(A)PDAC、(B)BxPc3、(C)H6c7、および(D)hFibから得られたもので、ESC様の形態(上段)およびTRA-1-60の陽性染色(下段)を示しています。スケールバー = 100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
がんの進行を研究するためのiPS細胞リプログラミングの使用を容易にするために、膵臓がん細胞をリプログラミングするための堅牢なプロトコルが確立されています。がん細胞からiPS細胞を作製することに成功した研究はごくわずかであり、がん細胞を多能性にリプログラミングすることは非常に困難であることが証明されています32,36,37,38,39,40,41,42,43,44,45,46.これらの研究のほとんどは、iPS細胞株を作製するために不死化がん細胞株を使用し、初代患者由来細胞36,37,38,40,42,43,44,46を使用しませんでした36。例えば、OSKM因子のレトロウイルス導入を用いて、4つの異なる肝癌細胞株のリプログラミングが試みられたが、1つの細胞株だけが正常に再プログラムされた41。しかし、作製された肝臓がんiPS細胞株は、数回の継代後に幹細胞性が失われ、OSKMリプログラミングに対するがん細胞の高い耐性が浮き彫りになった41。以前は、OSKMのレンチウイルス送達を使用してPDAC細胞を個別に再プログラムする試みが行われていました。しかし、外因性OSKM発現に依存して1本のiPS細胞株しか作製されなかったため、完全に再プログラムされていなかった37。別の研究では、エピソームベクターを用いて、ゲノム統合を行わずにOSKM因子を送達したが、PDACから1つのiPS細胞クローンしか作製できなかった39。がん細胞のリプログラミングの成功は限られているため、がん研究におけるiPS細胞技術の使用を妨げる多くの課題が増加しています。
ここでは、2人の異なる患者と1つの確立されたPDAC細胞株(BxPc3)に由来する初代PDACサンプルからのiPS細胞の作製について説明します。さらに、iPS細胞は膵管上皮細胞株であるH6c7からも作製されています。私たちの知る限り、BxPc3とH6c7から安定なiPS細胞株の導出に成功したのはこれが初めてです。このプロトコールに続いて、健康な人から得られた初代ヒト線維芽細胞からiPS細胞を作製することにも成功し、この方法の適用範囲はがん研究にとどまりません。
プロトコルの成功の背後にある重要な要素の1つは、OS因子とKM因子を共発現するためのビシストロニックレンチウイルスベクターの使用です。これらのベクターには、一方のベクターにOCT4とSOX2を発現し、もう一方のベクターにKLF4とcMYCを発現する内部リボソーム侵入部位2(IRES2)が含まれています。各リプログラミング因子が個別に送達されたモノシストロニックベクターを用いた複数の研究は、各ベクターの取り込みが異なり、OSKMの化学量論とリプログラミング効率に影響を与えることを示している47。バイシストロニックベクターを使用すると、この問題を軽減できます。さらに、レンチウイルスベクターにIRESを用いることで、リプログラミング効率が有意に向上することが示されている48。このレンチウイルス系では、OSの発現はEF1aプロモーターによって駆動され、KMの発現はCMVプロモーターの制御下にあります。CMVプロモーターは、EF1a49,50とは異なり、DNAメチル化およびヒストンの脱アセチル化により、高効率なサイレンシングを受けることができることが知られている。したがって、再プログラミング中のOS前のKMの早期サイレンシングは、プロトコルの成功のための重要な要素である可能性があります。これは、リプログラミング51,52,53,54,55におけるOSKM発現ダイナミクスの重要性を示す以前の研究と一致しています。したがって、ビシストロニックベクトルは、すべてのOSKM因子が単一のプロモーター56から発現されるポリシストロニックベクトルよりも有利でもある。プロトコルの成功に寄与する他の要因には、レンチウイルス感染の用量と、細胞タイプごとにカスタマイズされたリプログラミングに使用される感染細胞の数が含まれます。
要約すると、初代PDAC細胞を他の細胞株および正常細胞とともに再プログラミングするための最適化された方法が提示されます。この方法は、がんの進行をモデル化し、この場合は早期のPDACバイオマーカーを発見するためのiPS細胞リプログラミングの使用を拡大するのに役立ちます。
開示事項
著者らは、利益相反がないことを宣言します。
謝辞
A.S.とJ.K.は、Cancer Research UKとOHSUの資金提供に感謝します(CRUK-OHSUプロジェクト賞C65925 / A26986)。A.S.は、MRCキャリア開発賞(MR/N024028/1)によってサポートされています。A.A.は、キング・アブドゥルアズィーズ・シティ・フォー・サイエンス・アンド・テクノロジーの博士号奨学金(奨学金文献1078107040)によって資金提供されています。JKは、MRF新治験責任医師助成金(GCNCR1042A)およびKnight CEDAR助成金(68182-933-000、68182-939-000)によって資金提供されています。梶圭介教授には、リプログラミングベクターpSIN4-EF1a-O2SとpSIN4-CMV-K2Mを提供していただき、誠にありがとうございます。オープンアクセスの目的で、著者はクリエイティブ・コモンズ表示(CC BY)ライセンスを、この投稿から生じる著者が承認した原稿のバージョンに適用しています。
資料
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol (50 mM) | Thermo Fisher | 31350010 | |
| Alexa Fluor 488 anti- human TRA-1-60-R | BioLegend | 330613 | |
| Bovine Pituitary Extract (BPE) | Thermo Fisher | 13028014 | |
| BxPc3 | ATCC | CRL-1687 | |
| Cholera Toxin from Vibrio cholerae | Merck | C8052-1MG | |
| Collagen, Type I solution from rat tail | Merck | C3867 | |
| Completed Defined K-SFM | Thermo Fisher | 10744-019 | |
| Corning Costar TC-Treated Multiple Well Plates | Merck | CLS3516 | |
| Corning syringe filters | Merck | CLS431231 | |
| Corning tissue-culture treated culture dishes | Merck | CLS430599 | |
| Day Impex Virkon Disinfectant Virucidal Tablets | Thermo Fisher | 12328667 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Merck | D8537 | |
| Fetal Calf Serum (FCS) | Thermo Fisher | 10270-106 | |
| Fugene HD Transfection Reagent | Promega | E2312 | |
| Gelatin solution, Type B, 2% in H2O | Merck | G1393-100ML | |
| Glasgow Minimum Essential Media (GMEM) | Merck | G5154 | |
| Human EGF Recombinant Protein | Thermo Fisher | PHG0311 | |
| Human FGF-basic (FGF-2/bFGF) (154 aa) Recombinant Protein, PeproTech | Thermo Fisher | 100-18B | |
| Human Pancreatic Duct Epithelial Cell Line (H6c7) | Kerafast | ECA001-FP | |
| iMEF feeder cells | iXcells Biotechnologies | 10MU-001-1V | |
| Keratinocyte Serum Free Media (KSFM) | Thermo Fisher | 17005-042 | |
| KnockOut DMEM | Thermo Fisher | 10829018 | |
| KnockOut serum Replacement | Thermo Fisher | 10828028 | |
| L-Glutamine (200 mM) | Thermo Fisher | 25030-024 | |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher | 11140050 | |
| Millex-HP 0.45 μM syringe Filter Unit (Sterile) | Merck | SLHP033RS | |
| Opti-MEM Reduced Serum Medium | Thermo Fisher | 31985062 | |
| pMDG | AddGene | 187440 | |
| Polybrene (Hexadimethrine bromide) | Merck | H9268-5G | |
| pSIN4-CMV-K2M | AddGene | 21164 | |
| pSIN4-EF2-O2S | AddGene | 21162 | |
| psPAX2 | AddGene | 12260 | |
| pWPT-GFP | AddGene | 12255 | |
| RPMI 1640 Medium (ATCC modification) | Thermo Fisher | A1049101 | |
| Sodym Pyruvate | Thermo Fisher | 11360-039 | |
| Sterile Syringes for Single Use (60 mL) | Thermo Fisher | 15899152 | |
| TrypLE Express Enzyme (1x), phenol red | Thermo Fisher | 12605036 | |
| UltraPure 0.5M EDTA, pH 8.0 | Thermo Fisher | 15575020 | |
| Y-27632 (Dihydrochloride) | STEMCELL Technologies | 72304 |
参考文献
- Rahib, L., et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Research. 74 (11), 2913-2921 (2014).
- Hu, J. X., et al. Pancreatic cancer: A review of epidemiology, trend, and risk factors. World Journal of Gastroenterology. 27 (27), 4298 (2021).
- Howlader, N., et al. SEER cancer statistics review, 1975-2013. National Cancer Institute. 19, (2016).
- Bengtsson, A., Andersson, R., Ansari, D. The actual 5-year survivors of pancreatic ductal adenocarcinoma based on real-world data. Scientific Reports. 10 (1), 16425 (2020).
- He, J., et al. 2564 resected periampullary adenocarcinomas at a single institution: trends over three decades. HPB. 16 (1), 83-90 (2014).
- Dusch, N., et al. Factors predicting long-term survival following pancreatic resection for ductal adenocarcinoma of the pancreas: 40 years of experience. Journal of Gastrointestinal Surgery. 18 (4), 674-681 (2014).
- Principe, D. R., et al. The current treatment paradigm for pancreatic ductal adenocarcinoma and barriers to therapeutic efficacy. Frontiers in Oncology. 11, 688377 (2021).
- Papademetrio, D. L., et al. Interplay between autophagy and apoptosis in pancreatic tumors in response to gemcitabine. Targeted Oncology. 9 (2), 123-134 (2014).
- Ng, S. S., Tsao, M. S., Nicklee, T., Hedley, D. W. Effects of the epidermal growth factor receptor inhibitor OSI-774, Tarceva, on downstream signaling pathways and apoptosis in human pancreatic adenocarcinoma 1 supported by the National Cancer Institute of Canada and the Pat Myhal Fund for Pancreatic Cancer Research. Molecular Cancer Therapeutics. 1 (10), 777-783 (2002).
- Sultana, A., et al. Meta-analyses of chemotherapy for locally advanced and metastatic pancreatic cancer. Journal of Clinical Oncology. 25 (18), 2607-2615 (2007).
- Sun, J., Russell, C. C., Scarlett, C. J., McCluskey, A. Small molecule inhibitors in pancreatic cancer. RSC Medicinal Chemistry. 11 (2), 164-183 (2020).
- Jiang, H., et al. Targeting focal adhesion kinase renders pancreatic cancers responsive to checkpoint immunotherapy. Nature Medicine. 22 (8), 851-860 (2016).
- Hruban, R. H., et al. Pancreatic intraepithelial neoplasia: a new nomenclature and classification system for pancreatic duct lesions. The American Journal of Surgical Pathology. 25 (5), 579-586 (2001).
- Maitra, A., Hruban, R. H. Pancreatic cancer. Annual Review of Pathology: Mechanisms of Disease. 3, 157-188 (2008).
- Vincent, A., Herman, J., Schulick, R., Hruban, R. H., Goggins, M. Pancreatic cancer. The Lancet. 378 (9791), 607-620 (2011).
- Yachida, S., et al. Distant metastasis occurs late during the genetic evolution of pancreatic cancer. Nature. 467 (7319), 1114-1117 (2010).
- Lennon, A. M., et al. The early detection of pancreatic cancer: what will it take to diagnose and treat curable pancreatic neoplasia. Cancer Research. 74 (13), 3381-3389 (2014).
- Rubio-Viqueira, B., et al. An in vivo platform for translational drug development in pancreatic cancer. Clinical Cancer Research. 12 (15), 4652-4661 (2006).
- Li, C., et al. Identification of pancreatic cancer stem cells. Cancer Research. 67 (3), 1030-1037 (2007).
- Hermann, P. C., et al. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell. 1 (3), 313-323 (2007).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Suvà, M. L., et al. Reconstructing and reprogramming the tumor-propagating potential of glioblastoma stem-like cells. Cell. 157, 580-594 (2014).
- Kotini, A. G., et al. Stage-specific human induced pluripotent stem cells map the progression of myeloid transformation to transplantable leukemia. Cell Stem Cell. 20 (3), 315-328 (2017).
- Stricker, S. H., et al. Widespread resetting of DNA methylation in glioblastoma-initiating cells suppresses malignant cellular behavior in a lineage-dependent manner. Genes Development. 27 (6), 654-669 (2013).
- Chao, M. P., et al. Human AML-iPSCs reacquire leukemic properties after differentiation and model clonal variation of disease. Cell Stem Cell. 20 (3), 329-344 (2017).
- Aparicio, L. A., et al. Clinical implications of epithelial cell plasticity in cancer progression. Cancer letters. 366 (1), 1-10 (2015).
- Grimont, A., Leach, S. D., Chandwani, R. Uncertain beginnings: acinar and ductal cell plasticity in the development of pancreatic cancer. Cellular and Molecular Gastroenterology and Hepatology. 13 (2), 369-382 (2022).
- Greenspan, L. J., Weinstein, B. M. To be or not to be: endothelial cell plasticity in development, repair, and disease. Angiogenesis. 24 (2), 251-269 (2021).
- Papapetrou, E. P. Patient-derived induced pluripotent stem cells in cancer research and precision oncology. Nature Medicine. 22 (12), 1392-1401 (2016).
- Zhang, X., Cruz, F. D., Terry, M., Remotti, F., Matushansky, I. Terminal differentiation and loss of tumorigenicity of human cancers via pluripotency-based reprogramming. Oncogene. 32 (18), 2249-2260 (2013).
- Kim, J., et al. An iPSC line from human pancreatic ductal adenocarcinoma undergoes early to invasive stages of pancreatic cancer progression. Cell Reports. 3 (6), 2088-2099 (2013).
- Kim, J., et al. Detection of early pancreatic ductal adenocarcinoma with thrombospondin-2 and CA19-9 blood markers. Science Translational Medicine. 9 (398), (2017).
- Susac, L., et al. Structure of a fully assembled tumor-specific T cell receptor ligated by pMHC. Cell. 185 (17), 3201-3213 (2022).
- Yu, J., et al. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Carette, J. E., et al. Generation of iPSCs from cultured human malignant cells. Blood, The Journal of the American Society of Hematology. 115 (20), 4039-4042 (2010).
- Choi, S. M., et al. Reprogramming of EBV-immortalized B-lymphocyte cell lines into induced pluripotent stem cells. Blood, The Journal of the American Society of Hematology. 118 (7), 1801-1805 (2011).
- Hochedlinger, K., et al. Reprogramming of a melanoma genome by nuclear transplantation. Genes & Development. 18 (15), 1875-1885 (2004).
- Hu, K., et al. Efficient generation of transgene-free induced pluripotent stem cells from normal and neoplastic bone marrow and cord blood mononuclear cells. Blood, The Journal of the American Society of Hematology. 117 (14), e109-e119 (2011).
- Iskender, B., Izgi, K., Canatan, H. Reprogramming bladder cancer cells for studying cancer initiation and progression. Tumor Biology. 37, 13237-13245 (2016).
- Khoshchehreh, R., et al. Epigenetic reprogramming of primary pancreatic cancer cells counteracts their in vivo tumourigenicity. Oncogene. 38 (34), 6226-6239 (2019).
- Kim, H. J., et al. Establishment of hepatocellular cancer induced pluripotent stem cells using a reprogramming technique. Gut and Liver. 11 (2), 261 (2017).
- Lin, S. L., et al. Mir-302 reprograms human skin cancer cells into a pluripotent ES-cell-like state. RNA. 14 (10), 2115-2124 (2008).
- Miyoshi, N., et al. Defined factors induce reprogramming of gastrointestinal cancer cells. Proceedings of the National Academy of Sciences. 107 (1), 40-45 (2010).
- Singovski, G., et al. In vivo epigenetic reprogramming of primary human colon cancer cells enhances metastases. Journal of Molecular Cell Biology. 8 (2), 157-173 (2016).
- Zhao, H., et al. A highly optimized protocol for reprogramming cancer cells to pluripotency using nonviral plasmid vectors. Cellular Reprogramming (Formerly" Cloning and Stem Cells". 17 (1), 7-18 (2015).
- Lo, C. A., et al. Quantification of protein levels in single living cells). Cell Reports. 13 (11), 2634-2644 (2015).
- Yu, J., et al. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324 (5928), 797-801 (2009).
- Prösch, S., et al. Inactivation of the very strong HCMV immediate early promoter by DNA CpG methylation in vitro. Biological Chemistry Hoppe-Seyler. 377 (3), 195-201 (1996).
- Mehta, A. K., Majumdar, S. S., Alam, P., Gulati, N., Brahmachari, V. Epigenetic regulation of cytomegalovirus major immediate-early promoter activity in transgenic mice. Gene. 428 (1-2), 20-24 (2009).
- Chen, X., et al. Integration of external signaling pathways with the core transcriptional network in embryonic stem cells. Cell. 133 (6), 1106-1117 (2008).
- Kim, J., Chu, J., Shen, X., Wang, J., Orkin, S. H. An extended transcriptional network for pluripotency of embryonic stem cells. Cell. 132 (6), 1049-1061 (2008).
- Chronis, C., et al. Cooperative binding of transcription factors orchestrates reprogramming. Cell. 168 (3), 442-459 (2017).
- Li, D., et al. Chromatin accessibility dynamics during iPSC reprogramming. Cell Stem Cell. 21 (6), 819-833 (2017).
- Soufi, A., Donahue, G., Zaret, K. S. Facilitators and impediments of the pluripotency reprogramming factors' initial engagement with the genome. Cell. 151 (5), 994-1004 (2012).
- Carey, B. W., et al. Reprogramming of murine and human somatic cells using a single polycistronic vector. Proceedings of the National Academy of Sciences of the United States of America. 106, 157-162 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved