Method Article
إعادة برمجة سرطان البنكرياس الغدي النخوي إلى تعدد القدرات
In This Article
Summary
يصف البروتوكول الحالي إعادة برمجة سرطان البنكرياس الغدي القنوي (PDAC) والخلايا الظهارية البنكرياسية القنية الطبيعية إلى خلايا جذعية مستحثة متعددة القدرات (iPSCs). نحن نقدم إجراء محسنا ومفصلا خطوة بخطوة ، من تحضير فيروس العدس إلى إنشاء خطوط iPSC مستقرة.
Abstract
تم تحقيق توليد الخلايا الجذعية المستحثة متعددة القدرات (iPSCs) باستخدام عوامل النسخ من أي نوع من الخلايا المتمايزة تقريبا وأثبتت قيمتها العالية للبحث والتطبيقات السريرية. ومن المثير للاهتمام ، أن إعادة برمجة iPSC للخلايا السرطانية ، مثل سرطان البنكرياس الغدي القنوي (PDAC) ، قد ثبت أنها تعيد النمط الظاهري ل PDAC الغازي وتتجاوز الجينوم السرطاني. يمكن أن يلخص تمايز iPSCs المشتقة من PDAC تطور PDAC من سلائف الأورام داخل الظهارة البنكرياسية المبكرة (PanIN) ، مما يكشف عن التغيرات الجزيئية والخلوية التي تحدث مبكرا أثناء تطور PDAC. لذلك ، يمكن استخدام iPSCs المشتقة من PDAC لنمذجة المراحل المبكرة من PDAC لاكتشاف علامات التشخيص المبكرة الكشف. هذا مهم بشكل خاص لمرضى PDAC ، الذين يتم تشخيصهم عادة في المراحل النقيلية المتأخرة بسبب نقص المؤشرات الحيوية الموثوقة لمراحل PanIN السابقة. ومع ذلك ، فإن إعادة برمجة خطوط الخلايا السرطانية ، بما في ذلك PDAC ، إلى تعدد القدرات لا يزال يمثل تحديا وكثيف العمالة ومتغيرا للغاية بين الخطوط المختلفة. هنا ، نصف بروتوكولا أكثر اتساقا لتوليد iPSCs من خطوط خلايا PDAC البشرية المختلفة باستخدام ناقلات الفيروسات العدسية bicistronic . خطوط iPSC الناتجة مستقرة ، ولا تظهر أي اعتماد على التعبير الخارجي لعوامل إعادة البرمجة أو الأدوية المحرضة. بشكل عام ، يسهل هذا البروتوكول توليد مجموعة واسعة من iPSCs المشتقة من PDAC ، وهو أمر ضروري لاكتشاف المؤشرات الحيوية المبكرة الأكثر تحديدا وتمثيلا لحالات PDAC.
Introduction
يعد سرطان البنكرياس الغدي القنوي (PDAC) أحد أكثر الأورام الخبيثة فتكا ، ولا يزال التشخيص المبكر يمثل تحديا بسبب الطبيعة الخالية من الأعراض للمرض. يتم تشخيص غالبية مرضى PDAC في المرحلة النقيلية المتقدمة عندما تتوفر خيارات علاج محدودة للغاية 1,2. ويرجع ذلك أساسا إلى عدم وجود مؤشرات حيوية موثوقة للمراحل المبكرة ، مثل تلك التي يمكن اكتشافها بسهولة كبروتينات يتم إطلاقها في مجرى الدم.
يمكن أن ينتشر PDAC في وقت مبكر جدا أثناء تقدمه ، وقد تم ربط التشخيص الأفضل بالكشف المبكر عن السرطان عندما يكون PDAC موضعيا في البنكرياس3. ومع ذلك ، يتم تشخيص أقل من عشر مرضى PDAC بتشخيص إيجابي ، مما يسمح بالاستئصال الجراحي. ومع ذلك ، فإن أولئك القلائل الذين يعانون من أورام قابلة للاستئصال معرضون أيضا لتكرار الورم في غضون 12 شهرا4.
في العقود الخمسة الماضية ، تم إجراء تحسينات ملحوظة في التقنيات الجراحية ورعاية المرضى وطرق العلاج 5,6. ومع ذلك ، فإن معدل البقاء على قيد الحياة لمدة 5 سنوات في مرضى PDAC الذين تم استئصالهم جراحيا بالكاد ارتفع إلى 17٪. ومع ذلك ، لا يزال هذا أفضل من ذلك في المرضى غير المستأصلين ، والذي ظل دون تغيير تقريبا (0.9٪) 4,7. العلاج الكيميائي هو العلاج البديل الوحيد الآخر PDAC. ومع ذلك ، فإن هذا الخيار محدود للغاية لأن الغالبية العظمى من مرضى PDAC يظهرون مقاومة قوية لأدوية العلاج الكيميائي مثل Gemcitabine 7,8. الأدوية الأخرى ، مثل Erlotinib ، متاحة فقط لمجموعة صغيرة من مرضى PDAC الذين يعانون من طفرات محددة ، ومعظمهم يظهرون مقاومة Erlotinib9. الآثار الجانبية الضارة المرتبطة بالعلاج الكيميائي في معظم مرضى PDAC هي عيب آخر لهذا العلاج10. في الآونة الأخيرة ، أظهرت الاستراتيجيات الواعدة أن مثبطات نقاط التفتيش المناعية (ICIs) ومثبطات كيناز الجزيئات الصغيرة (SMKIs) يمكن أن تكون فعالة في علاج PDAC ، لكن الاستجابات الدائمة لهذه العلاجات المستهدفة لا تزال تقتصر على أقلية من المرضى11,12. بشكل عام ، يمكن أن يمهد اكتشاف المؤشرات الحيوية المبكرة الخاصة ب PDAC طرقا جديدة للتشخيص والعلاج المبكرين.
يتطور PDAC من آفات السلائف داخل البنكرياس داخل الظهارة (PanIN) التي تنتج عن التكاثر الظهاري للقناة البنكرياسية غير الغازية13,14. في حين أن تكوين PanIN يبدأ بواسطة طفرات جينية مسرطنة مثل KRAS ، هناك حاجة إلى تغييرات جينية وجينية إضافية للتقدم إلى PDAC. من المتوقع أن يستغرق تقدم PanIN خلال المراحل المختلفة إلى PDAC الغازية حوالي 10 سنوات13،15،16،17. يوفر هذا الإطار الزمني فرصة رائعة للاستفادة من التشخيص المبكر ل PDAC. لذلك ، تم إجراء بحث مكثف لإنشاء نماذج حيوانية للورم xenograft ومزارع عضوية لدراسة تقدم PDAC18،19،20،21. كانت هذه النماذج مفيدة جدا لدراسة المراحل الغازية من PDAC ، على الرغم من عدم الانتقال من مراحل PanIN المبكرة. لذلك ، من المهم تطوير نماذج تجريبية يمكنها تلخيص التقدم المبكر لمراحل PanIN لتمكين اكتشاف المؤشرات الحيوية للكشف المبكر.
إن إعادة برمجة الخلايا الجسدية إلى خلايا جذعية مستحثة متعددة القدرات (iPSCs) باستخدام عوامل النسخ الأربعة OCT4 و SOX2 و KLF4 و c-MYC (OSKM) قد أوضحت مدى اللدونة الخلوية22. تم توثيق لدونة الخلايا السرطانية جيدا ، وتم استخدام إعادة برمجة الخلايا السرطانية البشرية إلى iPSCs بنجاح لإعادة الخلايا إلى حالتها الخلوية الأصلية ، وإزالة العديد من الإهانات اللاجينية التي تراكمت أثناء تطور السرطان23،24،25،26،27،28،29. وبالتالي ، فإن إمكانية استخدام استراتيجية إعادة البرمجة هذه للتلاعب بهوية الخلايا السرطانية قد قدمت وعدا كبيرا في علاج السرطان30,31. في الواقع ، لقد أظهرنا سابقا أن تمايز iPSCs المشتقة من PDACs يمكن أن يلخص تقدم PDAC خلال مراحل PanIN المبكرة32. من خلال تحديد الجينات والمسارات الخاصة بالمراحل المبكرة إلى المتوسطة من PDAC ، تم تحديد المؤشرات الحيوية المرشحة التي يمكن استخدامها سريريا لتشخيص PDAC المبكر32,33. ومع ذلك ، أظهرت المؤشرات الحيوية المكتشفة باستخدام خط iPSC واحد تغطية محدودة في غالبية مرضى PDAC32. أدت تحديات توليد خطوط iPSC من مرضى PDAC الآخرين إلى إيقاف القدرة على اكتشاف مؤشرات حيوية أكثر موثوقية. ويرجع ذلك إلى العديد من العوامل التقنية ، بما في ذلك عدم تجانس توصيل OSKM ، حيث احتوى جزء صغير فقط من خلايا PDAC الأولية البشرية على جميع العوامل الأربعة واستجاب بنجاح لإعادة البرمجة. هنا ، يتم تقديم بروتوكول مفصل لإعادة برمجة خلايا PDAC الأولية باستخدام توصيل فيروسي مزدوج أكثر كفاءة واتساقا ل OSKM.
Protocol
تمت الموافقة على جميع البروتوكولات التجريبية من قبل مجلس المراجعة المؤسسية OHSU. تم تنفيذ جميع الطرق وفقا للمبادئ التوجيهية واللوائح ذات الصلة. تم تنفيذ جميع الأعمال الحيوانية لأورام PDX بموافقة لجنة استخدام ورعاية المؤسسية (IACUC) التابعة ل OHSU. تم اختبار هذا البروتوكول في خلايا PDAC الأولية من xenograft المشتق من المريض (PDX) ، وخط خلايا BxPc3 الذي يظهر مورفولوجيا ظهارية تم عزلها من أنسجة البنكرياس لمريضة تبلغ من العمر 61 عاما مصابة بسرطان غدي ، وخط الخلايا الظهارية الخلود H6C7 المشتق من ظهارة القناة البنكرياسية البشرية الطبيعية ، والخلايا الليفية البشرية الأولية المشتقة من خزعة الجلد للأفراد الأصحاء. تم الحصول على عينات PDAC البشرية في إطار دراسة سجل أنسجة البنكرياس في ولاية أوريغون (IRB00003609). تم الحصول على موافقة مستنيرة من جميع الأشخاص. تم اشتقاق الخلايا الليفية الأولية البشرية في RBiomedical ، إدنبرة ، المملكة المتحدة ، من عينات الجلد من متبرعين مجهولين يخضعون لجراحة روتينية في مستشفى إدنبرة الملكي ، ليتل فرانس ، المملكة المتحدة ، بموجب موافقتهم وموافقتهم الأخلاقية (09 / MRE00 / 91). تم تنفيذ جميع أعمال فيروس العدس في إطار نشاط بحثي من الفئة 2 (GM207 / 16.6) وتمت الموافقة عليه من قبل إدارة الصحة والسلامة في جامعة إدنبرة وتم إخطار السلطة المختصة بالصحة والسلامة والبيئة التابعة للحكومة الاسكتلندية. تم إجراء جميع تجارب إعادة البرمجة باستخدام خلايا البنكرياس البشرية بموجب الموافقة الأخلاقية للجنة أخلاقيات كلية العلوم البيولوجية في جامعة إدنبرة (المرجع # asoufi-0002).
1. إعداد فيروسات العدس
- لإعداد فيروس العدس، إعداد بلازميدات تعبئة وتعبير عالية الجودة (خالية من السموم الداخلية) بتركيزات تتراوح بين 1-2 ميكروغرام/ميكرولتر بما في ذلك psPAX2 و pMDG34 واثنين من النواقل bicistronic المحتوية على RES؛ ترميز pSIN4-EF1a-O2S لتعبير OCT4 وSOX2 مدفوعا بمروج EF-1α ، و pSIN4-CMV-K2M لتعبير KLF4 و c-MYC تحت محسن / مروج CMV35 (انظر جدول المواد). أيضا ، قم بإعداد بلازميد pWPT-GFP لاستخدامه كعنصر تحكم في النقل.
- ذوبان الجليد خط خلايا الكلى الجنينية البشرية (293T) والثقافة في الحد الأدنى من الوسط الأساسي في غلاسكو (GMEM) ، مع استكمال 10 ٪ مصل العجل الجنيني (FCS) ، 1x الأحماض الأمينية غير الأساسية ، 1 mM بيروفات الصوديوم و 1 mM الجلوتامين في (انظر جدول المواد) 37 درجة مئوية و 5 ٪ CO2.
ملاحظة: يوصى باستخدام خلايا 293T داخل أربعة ممرات بعد الذوبان. - بذرة 293T بكثافة 3 ملايين خلية لكل طبق 15 سم ، قبل 24 ساعة من النقل. مطلوب ما مجموعه ثلاثة أطباق. يفضل زرع الخلايا في وقت لاحق بعد الظهر ~ 16:00.
- في اليوم التالي (~ 16:00) ، عندما تصل الخلايا إلى التقاء ~ 40٪ -50٪ ، قم بإعداد ما يلي لثلاثة تفاعلات انتقال:
ملاحظة: ضع في اعتبارك دائما خطأ السحب عن طريق إضافة حجم إضافي بنسبة 10٪.- قم بتسمية ثلاثة أنابيب بلاستيكية سعة 15 مل باسم فيروس عدسي مناسب (pSIN4-EF1a-O2S و pSIN4-CMV-K2M والتحكم في pwPT-GFP). أضف 1.710 مل من وسط المصل المخفض (انظر جدول المواد) إلى كل أنبوب.
- قم بتخفيف كاشف نقل 90 ميكرولتر (انظر جدول المواد) في وسط مصل مخفض 1.710 مل ، واخلطه عن طريق الرأس لمدة 2 ثانية ، واحتضنه في درجة حرارة الغرفة لمدة 5 دقائق.
- خلط ناقلات التعبئة والتغليف. 5.1 ميكروغرام من psPAX2 و 2.4 ميكروغرام من pMDG (إجمالي 7.5 ميكروغرام).
- أضف خليط ناقل التغليف إلى وسط النقل (من الخطوة 1.4.2) والدوامة لمدة 2 ثانية.
- أضف 7.5 ميكروغرام من كل متجه إعادة برمجة: pSIN4-EF1a-O2S و pSIN4-CMV-K2M وعنصر التحكم pwPT-GFP إلى خليط النقل من الخطوة (1.4.4) والدوامة لمدة 2 ثانية.
ملاحظة: استخدم التعبير vector: ناقل فيروسي بنسبة 1: 1.
- احتضان أنابيب النقل لمدة 15 دقيقة في درجة حرارة الغرفة.
- قم بنقل الخلايا التائية 293 مع كل فيروس عدسي عن طريق إضافة خليط الحمض النووي للنقل مباشرة من الخطوة (1.4.5) إلى الوسائط بطريقة قطرة. قم بتدوير الطبق لضمان التوزيع المتساوي على السطح بأكمله.
- احتضان الخلايا المنقولة في حاضنة 37 درجة مئوية ، 5٪ CO2 بين عشية وضحاها.
ملاحظة: استخدم نفايات خاصة بالفيروسات ، ودلو للتخلص من المعادن ، وحقيبة مزدوجة مع أكياس الأوتوكلاف ، وخذ حاوية نفايات سائلة للفيروس وأضف قرصا مطهرا. تخلص من جميع الماصات والأطراف والأنابيب في دلو معدني. تخلص من الوسائط القديمة في حاوية نفايات سائلة للفيروسات. تجنب استخدام الماصات الزجاجية والأواني الزجاجية للتخلص من التلوث العرضي بالفيروسات. - بعد 14-16 ساعة بعد النقل ، استبدل الوسط بوسط 30 مل طازج 293T.
- احتضان الخلايا المنقولة عند 37 درجة مئوية ، 5٪ CO2 لمدة 60-72 ساعة بعد التغيير المتوسط. مراقبة الخلايا يوميا والتحقق من كفاءة النقل عن طريق مضان GFP.
ملاحظة: من الناحية المثالية ، يجب أن تكون كفاءة النقل >90٪ بواسطة GFP. بالنسبة للفيروسات الأخرى ، يجب على المرء أن يلاحظ التغيرات المورفولوجية الواضحة للخلايا التائية 293 ، لأنها تميل إلى أن تصبح أكثر استدارة عند إنتاج جزيئات الفيروس. - اجمع الوسائط من كل مزرعة لنقل الفيروس في أنابيب سعة 50 مل وقم بتدويرها لأسفل لإزالة حطام الخلايا عند 1932 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- قم بتصفية كل طاف من فيروسات العدس من خلال مرشح حقنة 0.45 ميكرومتر لإزالة الحطام الأصغر وتجميعه في أنابيب جديدة سعة 50 مل.
- قسم كل طاف من فيروسات العدس إلى 6 مل من القسامات وقم بتجميد كل منها في النيتروجين السائل.
- قم بتخزين حصص الفيروسات العدسية في درجة حرارة -80 درجة مئوية حتى تصبح جاهزة للاستخدام.
2. إعادة برمجة نقل الفيروس العدسي
- إذابة خلايا PDAC الأولية وزراعتها في وسط خال من الخلايا الكيراتينية المحدد تماما (KSFM) ، مع استكمال مستخلص الغدة النخامية البقري (BPE) ، وعامل نمو البشرة البشري المؤتلف (EGF) عند 5 نانوغرام / مل ، وتوكسين الكوليرا عند 50 نانوغرام / مل في حاضنة 37 درجة مئوية ، و 5٪ CO2 ، و 5٪ O2 (نقص الأكسجة) (انظر جدول المواد).
- ذوبان الجليد BxPc3 ، خط خلايا سرطان الغدة القنوية البنكرياسية الحرشفية ، والثقافة في وسط RPMI 1640 المكمل بمصل ربلة الساق الجنيني بنسبة 10٪ (FCS) عند 37 درجة مئوية ، و 5٪ CO2.
- ذوبان خلايا H6C7 ، والخلايا الظهارية الأقنية البنكرياسية ، والثقافة في KSFM تستكمل مع BPE و EGF عند 5 نانوغرام / مل ، عند 37 درجة مئوية و 5٪ CO2.
- ذوبان الخلايا الليفية البشرية (hFib) والثقافة في الحد الأدنى من الوسط الأساسي في غلاسكو (GMEM) ، مع استكمال 10 ٪ FCS ، 1x الأحماض الأمينية غير الأساسية ، 1 mM بيروفات الصوديوم و 1 mM الجلوتامين ، و 0.05 mM (النهائي) بيتا ميركابتوإيثانول عند 37 درجة مئوية و 5 ٪ CO2.
- قبل يوم واحد من نقل فيروس lentivirus (يفضل في وقت متأخر بعد الظهر) ، قم بإعداد بئرين من صفيحة من 6 آبار تحتوي على 100000 خلية لكل بئر من كل من خلايا PDAC و BxPc3 و H6C7 و hFib. تصيب بئرا واحدا بفيروسات OSKM العدسية واستخدم الثانية كعنصر تحكم غير مصاب.
ملاحظة: استخدم لوحة منفصلة لكل نوع خلية. - في اليوم التالي ، في فترة ما بعد الظهر (بعد حوالي 24 ساعة) ، تأكد من أن التقاء الخلية يصل إلى 70٪ على الأقل قبل الانتقال إلى الخطوة التالية لعدوى فيروس lentivirus.
3. نقل فيروس Lentivirus من PDAC
- قم بإذابة 5 مل من كل طاف للفيروسات العدسية في حاضنة فيروسات 37 درجة مئوية.
- قم بإعداد أنبوبين سعة 15 مل ، يحتوي كل منهما على 2 مل من وسط زراعة PDAC المسخن مسبقا.
- إلى الأنبوب الأول ، أضف 6 مل من كل فيروس عدسي لإعادة البرمجة (pSIN4-CMV-K2M و pSIN4-EF1a-O2S) و 12 ميكرولتر من 4.5 مجم / مل بوليبرين (4.5 ميكروغرام / مل نهائي ، انظر جدول المواد) واخلطها.
- إلى الأنبوب الثاني ، أضف 2 ميكرولتر من 4.5 مجم / مل بوليبرين (النهائي 4.5 ميكروغرام / مل).
- تخلص من الوسط من كل بئر واغسله مرة واحدة باستخدام برنامج تلفزيوني في درجة حرارة الغرفة.
- أضف وسائط عدوى إعادة البرمجة (الأنبوب 1) إلى البئر الأول.
- أضف خليط الأنبوب 2 إلى البئر الثاني. سيكون هذا هو التحكم غير المصاب.
- احتضان خلايا PDAC في حاضنة 37 درجة مئوية و 5٪ CO2 و 5٪ O2 (نقص الأكسجة) طوال الليل.
- في اليوم التالي ، في فترة ما بعد الظهر ، تخلص من الوسائط من كلا البئرين واستبدلها بوسط استزراع PDAC جديد.
- احتضان الخلايا عند 37 درجة مئوية ، 5٪ CO2 ، و 5٪ O2 (نقص الأكسجة) لمدة 48 ساعة.
4. نقل فيروس Lentivirus لخلايا BxPc3
- قم بإذابة 3 مل من كل طاف للفيروسات العدسية في حاضنة فيروسات 37 درجة مئوية.
- قم بإعداد أنبوبين سعة 15 مل ، يحتوي كل منهما على 2 مل من وسط الاستزراع BxPc3.
- إلى الأنبوب الأول ، أضف 3 مل من كل فيروس عدسي لإعادة البرمجة (pSIN4-CMV-K2M و pSIN4-EF1a-O2S) و 6 ميكرولتر من 4.5 مجم / مل بوليبرين (نهائي 4.5 ميكروغرام / مل) واخلط.
- إلى الأنبوب الثاني ، أضف 2 ميكرولتر من 4.5 مجم / مل بوليبرين (النهائي 4.5 ميكروغرام / مل).
- تخلص من الوسط من كل بئر واغسله مرة واحدة باستخدام برنامج تلفزيوني.
- أضف وسائط عدوى إعادة البرمجة (الأنبوب 1) إلى البئر الأول.
- أضف خليط الأنبوب 2 إلى البئر الثاني. سيكون هذا هو التحكم غير المصاب.
- احتضان خلايا BxPc3 المصابة عند 37 درجة مئوية و 5٪ CO2 بين عشية وضحاها.
- في اليوم التالي ، في فترة ما بعد الظهر ، تخلص من الوسائط من كلا البئرين واستبدلها بوسيط ثقافة BxPc3 جديد.
- احتضان الخلايا عند 37 درجة مئوية و 5٪ CO2 لمدة 48 ساعة.
5. نقل فيروس Lentivirus لعدوى خلايا H6c7
- قم بإذابة 4 مل من كل طاف للفيروس العدسي في حاضنة فيروسات 37 درجة مئوية.
- تحضير أنبوبين سعة 15 مل ، يحتوي كل منهما على وسط استزراع H6c7 سعة 2 مل.
- إلى الأنبوب الأول ، أضف 4 مل من كل فيروس عدسي لإعادة البرمجة (pSIN4-CMV-K2M و pSIN4-EF1a-O2S) و 8 ميكرولتر من 4.5 مجم / مل بوليبرين (نهائي 4.5 ميكروغرام / مل) واخلطه.
- إلى الأنبوب الثاني ، أضف 2 ميكرولتر من 4.5 مجم / مل بوليبرين (النهائي 4.5 ميكروغرام / مل).
- تخلص من الوسط من كلا البئرين واغسله مرة واحدة باستخدام برنامج تلفزيوني.
- أضف وسائط عدوى إعادة البرمجة (الأنبوب 1) إلى البئر الأول.
- أضف خليط الأنبوب 2 إلى البئر الثاني. سيكون هذا هو التحكم غير المصاب.
- احتضان خلايا H6C7 المصابة عند 37 درجة مئوية و 5٪ CO2 بين عشية وضحاها.
- في اليوم التالي ، في فترة ما بعد الظهر ، تخلص من الوسائط من كلا البئرين واستبدلها بوسط استزراع H6c7 جديد.
- احتضان الخلايا عند 37 درجة مئوية و 5٪ CO2 لمدة 48 ساعة.
6. نقل فيروس Lentivirus لخلايا hFib
- قم بإذابة 2 مل من كل طاف فيروس عدسي في حاضنة فيروسات 37 درجة مئوية.
- قم بإعداد أنبوبين سعة 15 مل ، يحتوي كل منهما على وسط استزراع hFib سعة 2 مل.
- إلى الأنبوب الأول ، أضف 2 مل من كل فيروسات إعادة برمجة (pSIN4-CMV-K2M و pSIN4-EF1a-O2S) وأضف 4 ميكرولتر من 4.5 مجم / مل بوليبرين (4.5 ميكروغرام / مل نهائي) واخلطها.
- إلى الأنبوب الثاني ، أضف 2 ميكرولتر من 4.5 مجم / مل بوليبرين (4.5 ميكروغرام / مل نهائي) واخلطه.
- تخلص من الوسط من كل بئر واغسله مرة واحدة باستخدام برنامج تلفزيوني.
- أضف وسائط عدوى إعادة البرمجة (الأنبوب 1) إلى البئر الأول.
- أضف خليط الأنبوب 2 إلى البئر الثاني. سيكون هذا هو التحكم غير المصاب.
- احتضان خلايا hFib المصابة عند 37 درجة مئوية و 5٪ CO2 بين عشية وضحاها.
- في اليوم التالي ، في فترة ما بعد الظهر ، تخلص من الوسائط من كلا البئرين واستبدلها بوسيط استزراع hFib جديد.
- احتضان الخلايا عند 37 درجة مئوية و 5٪ CO2 لمدة 48 ساعة أخرى.
ملاحظة: لنقل فيروس العدس بكفاءة ، قم بمعايرة كمية فيروس العدس بعناية ، لأن هذا يختلف اختلافا كبيرا بين أنواع الخلايا المختلفة. قد تكون هناك حاجة إلى عمليات نقل فيروس عدسي متعددة لبعض أنواع الخلايا. تتطلب خطوط خلايا PDAC ما يصل إلى ثلاث جرعات ، بينما كانت جرعة واحدة كافية لإعادة برمجة خطوط BxPc3 و H6C7 و hFib.
7. تحضير خلايا تغذية iMEF
- تحضير 40 مل 0.2٪ محلول جيلاتين عن طريق تخفيف محلول مخزون الجيلاتين 1٪ باستخدام برنامج تلفزيوني.
- قم بتغطية أربعة ألواح من 6 آبار بتغطية كل بئر ب 2 مل من محلول الجيلاتين 0.2٪.
- احتضان الألواح المطلية بالجيلاتين عند 37 درجة مئوية و 5٪ CO2 لمدة 30 دقيقة على الأقل.
- استنشاق محلول الجيلاتين الزائد واترك الألواح لتجف تحت غطاء التدفق.
- قم بإذابة قارورتين (~ 4 ملايين خلية لكل قارورة) من الخلايا الليفية الجنينية للفأر المشع (iMEFs) عن طريق تحريكها في حمام مائي 37 درجة مئوية.
ملاحظة: لتقليل احتمالية التلوث ، احرص على منع تناثر الماء بالقرب من فتحة الغطاء. جفف القارورة بمنشفة ورقية ورشها بنسبة 70٪ من الإيثانول. - في غطاء زراعة الأنسجة ، ماصة محتوى كل قارورة iMEFs مذابة في أنبوب واحد سعة 15 مل يحتوي على 10 مل من وسط زراعة hFib المسخن مسبقا بطريقة قطرة قطرة ويخلط جيدا عن طريق قلب الأنبوب برفق.
- قم بتدوير تعليق الخلية عند 309 × جم لمدة 3 دقائق في درجة حرارة الغرفة وإزالة المادة الطافية من كل أنبوب. أعد تعليق كل حبيبة خلية في وسط 12 مل hFib.
- لوحة 2 مل من تعليق الخلية لكل بئر من ألواح 6 آبار المطلية بالجيلاتين. قم بتوزيع الخلايا بالتساوي عن طريق هز الألواح برفق في جميع الاتجاهات.
- احتضان لوحات في 37 درجة مئوية و 5٪ CO2 بين عشية وضحاها.
ملاحظة: قم بإعداد لوحات iMEF جديدة قبل 24 ساعة من استخدامها في تجربة إعادة البرمجة.
8. نقل الخلايا المصابة إلى طبقة تغذية iMEF
- تجاهل الوسائط من خلايا PDAC و BxPc3 و H6c7 و hFib المصابة وغير المصابة. اغسل كل بئر مرتين باستخدام برنامج تلفزيوني في درجة حرارة الغرفة.
- افصل الخلايا عن اللوحة بإضافة 0.5 مل من التربسين إلى كل بئر. احتضان خلايا PDAC في حاضنة 37 درجة مئوية و 5٪ CO2 و 5٪ O2 (نقص الأكسجة) لمدة 15 دقيقة.
- احتضان خلايا BxPc3 عند 37 درجة مئوية و 5٪ CO2 لمدة 5 دقائق.
- احتضان خلايا H6c7 و hFib عند 37 درجة مئوية و 5٪ CO2 لمدة 4 دقائق.
- انقل معلق الخلية المنفصل من كل بئر إلى أنابيب سعة 15 مل تحمل علامة وفقا لذلك على أنها مصابة أو غير مصابة.
- حصاد الخلايا عن طريق الطرد المركزي على النحو التالي: بالنسبة ل PDAC ، قم بتدوير تعليق الخلية عند 300 × جم لمدة 5 دقائق ؛ بالنسبة إلى BxPc3 ، قم بتدوير تعليق الخلية عند 120 × جم لمدة 5 دقائق ؛ بالنسبة ل H6C7 ، قم بتدوير تعليق الخلية عند 112 × جم لمدة 4 دقائق ؛ بالنسبة إلى hFib ، قم بتدوير تعليق الخلية عند 161 × g لمدة 3 دقائق. أداء جميع أجهزة الطرد المركزي في درجة حرارة الغرفة.
- أعد تعليق كل نوع من أنواع الخلايا في 1 مل من وسائط الاستزراع المناسبة.
- اغسل ألواح iMEF المحضرة في الخطوة 7 مع كل وسائط زراعة من نوع الخلية مرتين. على سبيل المثال ، اغسل صفيحة واحدة بوسائط PDAC ، وواحدة بوسائط BxPc3 ، وواحدة بوسط H6C7 ، والأخرى بوسط hFib.
- صفيحة 50000 خلية مصابة لكل بئر في خمسة آبار من لوحة iMEF ذات 6 آبار. لوحة 50000 خلية تحكم غير مصابة في البئر المتبقي من لوحة iMEF 6-well.
ملاحظة: قم بتحسين عدد الخلايا المصابة المراد طلاؤها من 1000 إلى 50000 خلية لكل بئر. - احتضان خلايا PDAC عند 37 درجة مئوية ، 5٪ CO2 ، و 5٪ O2 (نقص الأكسجة) بين عشية وضحاها.
- احتضان خلايا BxPc3 و H6C7 و hFib عند 37 درجة مئوية و 5٪ CO2 طوال الليل.
- في اليوم التالي ، قم بإعداد وسيط إعادة البرمجة على النحو التالي: أضف 100 مل من استبدال مصل خروج المغلوب (25٪ نهائي) ، 5 مل من 200 مللي مول من الجلوتامين (1 مللي متر نهائي) ، 5 مل من 100x من الأحماض الأمينية غير الأساسية (100 ميكرومتر نهائي) ، 1.5 مل من بيتا ميركابتوإيثانول (0.1 مللي متر نهائي) إلى 400 مل من وسط النسر المعدل (DMEM).
- قم بتخزين وسائط إعادة البرمجة في قسامات سعة 100 مل عند 4 درجات مئوية لمدة تصل إلى 4 أسابيع أو عند -20 درجة مئوية لفترة أطول.
- عندما تكون جاهزا للاستخدام ، أضف 100 ميكرولتر من عامل نمو الخلايا الليفية الأساسي 10 مجم / مل (bFGF) (10 نانوغرام / مل نهائي) إلى حصة وسائط إعادة برمجة 100 مل.
- قم بتسخين وسائط إعادة البرمجة في حمام مائي بدرجة حرارة 37 درجة مئوية.
- اغسل الخلايا التي تنمو على مغذيات iMEFs باستخدام وسائط إعادة البرمجة الدافئة مسبقا مرتين.
أضف 2 مل من وسيط إعادة البرمجة إلى كل بئر. - انقل ألواح إعادة البرمجة إلى حاضنة 37 درجة مئوية و 5٪ CO2و 3٪ O2 (نقص الأكسجة).
ملاحظة: يعتبر اليوم الذي تتم فيه إضافة وسائط إعادة البرمجة هو اليوم 1 من إعادة البرمجة. - قم بتغذية الخلايا يوميا بوسائط إعادة برمجة جديدة حتى تبدأ مستعمرات iPSC في الظهور.
ملاحظة: حدد مستعمرات iPSC من خلال مورفولوجيتها الشبيهة ب ESC (مستعمرات مدمجة ذات حواف محددة جيدا وتتألف من خلايا ذات نسبة عالية من النواة / السيتوبلازم). - راقب مستعمرات iPSC يوميا ، وبعد تكوين عدد كاف ، قم بتمريرها كتجمع.
ملاحظة: تأكد من أن مستعمرات iPSC لا تلمس بعضها البعض ، لأن هذا سيؤدي إلى التمايز ويؤثر على استقرارها على المدى الطويل. - لإنشاء خطوط نسيلية ، قم بتمرير تجمع iPSC حوالي 5 مرات ، ثم اختر مستعمرات قوية تحافظ على مورفولوجيتها الشبيهة ب ESC.
- لتحديد مستعمرات iPSC المعاد برمجتها بالكامل ، قم بإجراء تلطيخ حي باستخدام TRA-160 (انظر جدول المواد) ، وحصاد الحمض النووي الريبي من مستعمرات iPSC لتوصيف التعبير الجيني.
9. مرور مستعمرات iPSC
- قم بإعداد ما يكفي من لوحات تغذية iMEF قبل 24 ساعة من اجتياز مستعمرات iPSC كما هو موضح في الخطوة 7.
- اغسل ألواح التغذية iMEF مرتين باستخدام وسائط إعادة البرمجة التي تم تسخينها مسبقا.
- أضف 2 مل من وسائط إعادة البرمجة المكملة بمثبط ROCK (Y2) (10 ميكرومتر) إلى كل بئر من لوحة iMEF.
- احتضن ألواح iMEF في حاضنة 37 درجة مئوية و 5٪ CO2 و 3٪ O2 حتى تصبح جاهزة للاستخدام.
- تحضير محلول محلول حمض الإيثيلين ديامينيترايتيك / محلول ملحي مخزن بالفوسفات (EDTA / PBS) عن طريق تخفيف 0.5 M EDTA 1: 1000 في PBS (0.5 mM النهائي).
- استبدل وسائط ثقافة إعادة البرمجة ب 0.5 مل من EDTA / PBS في كل بئر.
- احتضان في حاضنة 37 درجة مئوية ، 5٪ CO2 ، و 3٪ O2 أو في درجة حرارة الغرفة ، اعتمادا على نوع الخلية. تتطلب BxPc3 و PDAC iPSCs حضانة لمدة 15 دقيقة عند 37 درجة مئوية. يجب تحضين H6C7 و hFib iPSCs في درجة حرارة الغرفة لمدة 5 دقائق.
- تحقق من خلايا iPSCs تحت المجهر حتى تبدأ في الانفصال بشكل موحد عن طبقة التغذية في جميع أنحاء المستعمرة بأكملها.
- اجمع معلق خلية iPSC المنفصل في أنبوب طرد مركزي سعة 15 مل. قم بتدويرها عند 300 × جم لمدة 5 دقائق في درجة حرارة الغرفة.
- أعد تعليق حبيبات الخلية في 1 مل من وسائط إعادة البرمجة المكملة ب Y2 (10 ميكرومتر).
- قم بطلاء الخلايا على طبقة تغذية iMEF عن طريق نقل كل 1 مل من تعليق خلية iPSC إلى ثلاثة آبار من لوحة iMEF.
ملاحظة: قد تختلف نسبة الانقسام حسب عدد مستعمرات iPSC المحصودة. - احتضان في حاضنة 37 درجة مئوية ، 5٪ CO2 و 3٪ O2 .
10. تلطيخ حي لمستعمرات iPSC باستخدام TRA-1-60
- تحضير 0.5 مل لكل بئر من 4 ميكروغرام / مل من الجسم المضاد TRA-1-60 في وسائط إعادة البرمجة.
- تخلص من وسائط إعادة البرمجة واستبدلها بخليط 0.5 مل من الأجسام المضادة في كل بئر. احتضان في حاضنة 37 درجة مئوية ، 5٪ CO2 ، و 3٪ O2 لمدة 30 دقيقة.
- اغسل الخلايا مرتين باستخدام وسائط إعادة البرمجة.
- التقط صورا مضان باستخدام نظام تصوير خلوي باستخدام مرشح GFP.
- تحقق من جودة الصورة من خلال النظر في قناة التحكم السلبية.
النتائج
يتم عرض الصور التمثيلية التي تعرض مورفولوجيا مستعمرات iPSC المشتقة من خلايا PDAC و BXPc3 و H6C7 و hFib في الشكل 1. بدأت مستعمرات PDAC-iPSC في التكون في اليوم 25 من إعادة البرمجة. تم تحديد مستعمرات iPSC القوية ذات التشكل الشبيه ب ESC الأكثر رسوخا في اليوم 40 من إعادة البرمجة (الشكل 1). وبالمثل ، بدأ تشكيل BxPc3-iPSCs في اليوم 23 وأصبح أكثر رسوخا بحلول اليوم 35. كان تشكيل H6C7-iPSC مشابها ل PDAC-iPSCs وبدأ في التأسيس في اليوم 45. بدأت مستعمرات hFib-iPSC في التكون في اليوم 15 من إعادة البرمجة.
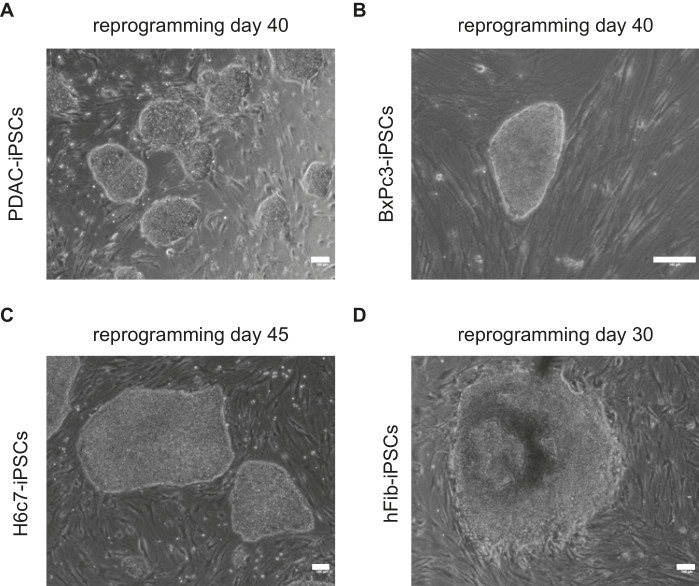
الشكل 1: صور تمثيلية لمستعمرات iPSC. تظهر الصور مورفولوجيا شبيهة ب hESC مشتقة من (A) PDAC و (B) BxPc3 و (C) H6c7 و (D) hFib. يشار إلى أيام إعادة البرمجة فوق كل صورة. قضبان المقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تم إنشاء خطوط iPSC المستنسخة من كل إعادة برمجة لخلايا PDAC و BxPc3 و H6C7 و hFib. جميع خطوط iPSC الراسخة ملطخة بإيجابية ل TRA-1-60 ، وهي علامة سطح خلية hESC غير متمايزة ، مما يؤكد إعادة برمجتها إلى تعدد القدرات (الشكل 2).

الشكل 2: صور تمثيلية لخطوط iPSC النسيلية. الصور مشتقة من (A) PDAC و (B) BxPc3 و (C) H6c7 و (D) hFib تظهر مورفولوجيا تشبه ESC (الألواح العلوية) وتلطيخ إيجابي ل TRA-1-60 (اللوحة السفلية). قضبان المقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
لتسهيل استخدام إعادة برمجة iPSC لدراسة تطور السرطان ، تم وضع بروتوكول قوي لإعادة برمجة خلايا سرطان البنكرياس. أثبتت إعادة برمجة الخلايا السرطانية إلى تعدد القدرات أنها صعبة للغاية حتى الآن ، حيث نجحت دراسات قليلة فقط في توليد iPSCs من الخلايا السرطانية32،36،37،38،39،40،41،42،43،44،45،46. استخدمت معظم هذه الدراسات خطوط الخلايا السرطانية الخالدة لتوليد خطوط iPSC ، وليس الخلايا الأولية المشتقة من المريض36،37،38،40،42،43،44،46. على سبيل المثال ، تمت محاولة إعادة برمجة أربعة خطوط مختلفة لخلايا سرطان الكبد باستخدام إدخال الفيروس القهقري لعوامل OSKM ، ولكن تم إعادة برمجة خط خلية واحد فقط بنجاح41. ومع ذلك ، أظهر خط iPSC لسرطان الكبد المتولد فقدانا للجذع بعد بضع مقاطع ، مما يسلط الضوء على المقاومة العالية للخلايا السرطانية لإعادة برمجة OSKM41. في السابق ، بذلت محاولات لإعادة برمجة خلايا PDAC باستخدام توصيل الفيروس العدسي ل OSKM بشكل فردي. ومع ذلك ، تم إنشاء سطر iPSC واحد فقط ، يعتمد على تعبير OSKM الخارجي وبالتالي لم تتم إعادة برمجته بالكامل37. استخدمت دراسة أخرى النواقل العرضية لتقديم عوامل OSKM دون تكامل جينومي ولكنها تمكنت فقط من توليد استنساخ iPSC واحد من PDAC39. يضيف النجاح المحدود في إعادة برمجة الخلايا السرطانية إلى العديد من التحديات التي تعيق استخدام تقنية iPSC في أبحاث السرطان.
هنا ، يتم شرح توليد iPSCs من عينات PDAC الأولية المشتقة من مريضين مختلفين وخط خلية PDAC واحد (BxPc3). علاوة على ذلك ، تم إنشاء iPSCs أيضا من H6c7 ، وهو خط الخلايا الظهارية للقنية البنكرياسية. على حد علمنا ، هذا هو التقرير الأول لخطوط iPSC المستقرة المشتقة بنجاح من BxPc3 و H6c7. باتباع هذا البروتوكول ، تم أيضا إنشاء iPSCs بنجاح من الخلايا الليفية البشرية الأولية المشتقة من الأفراد الأصحاء ، مما يوسع نطاق تطبيق الطريقة إلى ما بعد أبحاث السرطان.
أحد العناصر الرئيسية وراء نجاح البروتوكول هو استخدام ناقلات الفيروسات العدسية bicistronic للتعبير المشترك عن عوامل OS و KM. تحتوي هذه النواقل على موقع دخول الريبوسوم الداخلي 2 (IRES2) للتعبير عن OCT4 و SOX2 في أحد المتجهين و KLF4 و cMYC في الآخر. أظهرت دراسات متعددة باستخدام ناقلات أحادية الشكل حيث تم تسليم كل عامل إعادة برمجة على حدة أن امتصاص كل متجه مختلف ، مما يؤثر على القياس الكيميائي OSKM وكفاءة إعادة البرمجة47. يمكن أن يساعد استخدام النواقل bicistronic في التخفيف من هذه المشكلة. علاوة على ذلك ، أظهر استخدام IRES في ناقلات الفيروسات العدسية زيادة كبيرة في كفاءة إعادة البرمجة48. في نظام lentivirus هذا ، يتم تشغيل تعبير نظام التشغيل بواسطة مروج EF1a ، بينما يكون تعبير KM تحت سيطرة مروج CMV. من المعروف أن مروج CMV يمكن أن يتعرض لإسكات عالي الكفاءة عن طريق مثيلة الحمض النووي وإزالة الأستيل من الهستون ، على عكس EF1a49,50. لذلك ، قد يكون الإسكات المبكر ل KM قبل نظام التشغيل أثناء إعادة البرمجة عاملا رئيسيا لنجاح البروتوكول. وهذا يتفق مع الدراسات السابقة التي تبين أهمية ديناميكيات التعبير OSKM أثناء إعادة برمجة51،52،53،54،55. وبالتالي ، فإن ناقل bicistronic هو أيضا أكثر فائدة من ناقل polycistronic ، حيث يتم التعبير عن جميع عوامل OSKM من مروج واحد56. تشمل العوامل الأخرى التي تساهم في نجاح البروتوكول جرعات عدوى فيروس العدس وعدد الخلايا المصابة المستخدمة لإعادة البرمجة ، والتي تم تخصيصها لكل نوع من الخلايا.
باختصار ، يتم تقديم طريقة محسنة لإعادة برمجة خلايا PDAC الأولية جنبا إلى جنب مع خطوط الخلايا الأخرى والخلايا الطبيعية. ستساعد هذه الطريقة في توسيع استخدام إعادة برمجة iPSC لنمذجة تطور السرطان ، وفي هذه الحالة ، اكتشاف المؤشرات الحيوية المبكرة PDAC.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تود A.S و JK أن تشكر أبحاث السرطان في المملكة المتحدة و OHSU على التمويل (جائزة مشروع CRUK-OHSU C65925 / A26986). يتم دعم A.S بجائزة MRC للتطوير الوظيفي (MR / N024028 / 1). يتم تمويل AA من خلال منحة الدكتوراه (مرجع المنحة 1078107040) من مدينة الملك عبد العزيز للعلوم والتقنية. يتم تمويل JK من قبل MRF New Investigator Grant (GCNCR1042A) ومنحة Knight CEDAR (68182-933-000 ، 68182-939-000). نشكر البروفيسور كيسوكي كاجي على التكرم بتوفير متجه إعادة البرمجة pSIN4-EF1a-O2S و pSIN4-CMV-K2M. لغرض الوصول المفتوح ، قام المؤلف بتطبيق ترخيص المشاع الإبداعي (CC BY) على أي نسخة مخطوطة مقبولة من المؤلف ناشئة عن هذا التقديم.
Materials
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol (50 mM) | Thermo Fisher | 31350010 | |
| Alexa Fluor 488 anti- human TRA-1-60-R | BioLegend | 330613 | |
| Bovine Pituitary Extract (BPE) | Thermo Fisher | 13028014 | |
| BxPc3 | ATCC | CRL-1687 | |
| Cholera Toxin from Vibrio cholerae | Merck | C8052-1MG | |
| Collagen, Type I solution from rat tail | Merck | C3867 | |
| Completed Defined K-SFM | Thermo Fisher | 10744-019 | |
| Corning Costar TC-Treated Multiple Well Plates | Merck | CLS3516 | |
| Corning syringe filters | Merck | CLS431231 | |
| Corning tissue-culture treated culture dishes | Merck | CLS430599 | |
| Day Impex Virkon Disinfectant Virucidal Tablets | Thermo Fisher | 12328667 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Merck | D8537 | |
| Fetal Calf Serum (FCS) | Thermo Fisher | 10270-106 | |
| Fugene HD Transfection Reagent | Promega | E2312 | |
| Gelatin solution, Type B, 2% in H2O | Merck | G1393-100ML | |
| Glasgow Minimum Essential Media (GMEM) | Merck | G5154 | |
| Human EGF Recombinant Protein | Thermo Fisher | PHG0311 | |
| Human FGF-basic (FGF-2/bFGF) (154 aa) Recombinant Protein, PeproTech | Thermo Fisher | 100-18B | |
| Human Pancreatic Duct Epithelial Cell Line (H6c7) | Kerafast | ECA001-FP | |
| iMEF feeder cells | iXcells Biotechnologies | 10MU-001-1V | |
| Keratinocyte Serum Free Media (KSFM) | Thermo Fisher | 17005-042 | |
| KnockOut DMEM | Thermo Fisher | 10829018 | |
| KnockOut serum Replacement | Thermo Fisher | 10828028 | |
| L-Glutamine (200 mM) | Thermo Fisher | 25030-024 | |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher | 11140050 | |
| Millex-HP 0.45 μM syringe Filter Unit (Sterile) | Merck | SLHP033RS | |
| Opti-MEM Reduced Serum Medium | Thermo Fisher | 31985062 | |
| pMDG | AddGene | 187440 | |
| Polybrene (Hexadimethrine bromide) | Merck | H9268-5G | |
| pSIN4-CMV-K2M | AddGene | 21164 | |
| pSIN4-EF2-O2S | AddGene | 21162 | |
| psPAX2 | AddGene | 12260 | |
| pWPT-GFP | AddGene | 12255 | |
| RPMI 1640 Medium (ATCC modification) | Thermo Fisher | A1049101 | |
| Sodym Pyruvate | Thermo Fisher | 11360-039 | |
| Sterile Syringes for Single Use (60 mL) | Thermo Fisher | 15899152 | |
| TrypLE Express Enzyme (1x), phenol red | Thermo Fisher | 12605036 | |
| UltraPure 0.5M EDTA, pH 8.0 | Thermo Fisher | 15575020 | |
| Y-27632 (Dihydrochloride) | STEMCELL Technologies | 72304 |
References
- Rahib, L., et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Research. 74 (11), 2913-2921 (2014).
- Hu, J. X., et al. Pancreatic cancer: A review of epidemiology, trend, and risk factors. World Journal of Gastroenterology. 27 (27), 4298 (2021).
- Howlader, N., et al. SEER cancer statistics review, 1975-2013. National Cancer Institute. 19, (2016).
- Bengtsson, A., Andersson, R., Ansari, D. The actual 5-year survivors of pancreatic ductal adenocarcinoma based on real-world data. Scientific Reports. 10 (1), 16425 (2020).
- He, J., et al. 2564 resected periampullary adenocarcinomas at a single institution: trends over three decades. HPB. 16 (1), 83-90 (2014).
- Dusch, N., et al. Factors predicting long-term survival following pancreatic resection for ductal adenocarcinoma of the pancreas: 40 years of experience. Journal of Gastrointestinal Surgery. 18 (4), 674-681 (2014).
- Principe, D. R., et al. The current treatment paradigm for pancreatic ductal adenocarcinoma and barriers to therapeutic efficacy. Frontiers in Oncology. 11, 688377 (2021).
- Papademetrio, D. L., et al. Interplay between autophagy and apoptosis in pancreatic tumors in response to gemcitabine. Targeted Oncology. 9 (2), 123-134 (2014).
- Ng, S. S., Tsao, M. S., Nicklee, T., Hedley, D. W. Effects of the epidermal growth factor receptor inhibitor OSI-774, Tarceva, on downstream signaling pathways and apoptosis in human pancreatic adenocarcinoma 1 supported by the National Cancer Institute of Canada and the Pat Myhal Fund for Pancreatic Cancer Research. Molecular Cancer Therapeutics. 1 (10), 777-783 (2002).
- Sultana, A., et al. Meta-analyses of chemotherapy for locally advanced and metastatic pancreatic cancer. Journal of Clinical Oncology. 25 (18), 2607-2615 (2007).
- Sun, J., Russell, C. C., Scarlett, C. J., McCluskey, A. Small molecule inhibitors in pancreatic cancer. RSC Medicinal Chemistry. 11 (2), 164-183 (2020).
- Jiang, H., et al. Targeting focal adhesion kinase renders pancreatic cancers responsive to checkpoint immunotherapy. Nature Medicine. 22 (8), 851-860 (2016).
- Hruban, R. H., et al. Pancreatic intraepithelial neoplasia: a new nomenclature and classification system for pancreatic duct lesions. The American Journal of Surgical Pathology. 25 (5), 579-586 (2001).
- Maitra, A., Hruban, R. H. Pancreatic cancer. Annual Review of Pathology: Mechanisms of Disease. 3, 157-188 (2008).
- Vincent, A., Herman, J., Schulick, R., Hruban, R. H., Goggins, M. Pancreatic cancer. The Lancet. 378 (9791), 607-620 (2011).
- Yachida, S., et al. Distant metastasis occurs late during the genetic evolution of pancreatic cancer. Nature. 467 (7319), 1114-1117 (2010).
- Lennon, A. M., et al. The early detection of pancreatic cancer: what will it take to diagnose and treat curable pancreatic neoplasia. Cancer Research. 74 (13), 3381-3389 (2014).
- Rubio-Viqueira, B., et al. An in vivo platform for translational drug development in pancreatic cancer. Clinical Cancer Research. 12 (15), 4652-4661 (2006).
- Li, C., et al. Identification of pancreatic cancer stem cells. Cancer Research. 67 (3), 1030-1037 (2007).
- Hermann, P. C., et al. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell. 1 (3), 313-323 (2007).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Suvà, M. L., et al. Reconstructing and reprogramming the tumor-propagating potential of glioblastoma stem-like cells. Cell. 157, 580-594 (2014).
- Kotini, A. G., et al. Stage-specific human induced pluripotent stem cells map the progression of myeloid transformation to transplantable leukemia. Cell Stem Cell. 20 (3), 315-328 (2017).
- Stricker, S. H., et al. Widespread resetting of DNA methylation in glioblastoma-initiating cells suppresses malignant cellular behavior in a lineage-dependent manner. Genes Development. 27 (6), 654-669 (2013).
- Chao, M. P., et al. Human AML-iPSCs reacquire leukemic properties after differentiation and model clonal variation of disease. Cell Stem Cell. 20 (3), 329-344 (2017).
- Aparicio, L. A., et al. Clinical implications of epithelial cell plasticity in cancer progression. Cancer letters. 366 (1), 1-10 (2015).
- Grimont, A., Leach, S. D., Chandwani, R. Uncertain beginnings: acinar and ductal cell plasticity in the development of pancreatic cancer. Cellular and Molecular Gastroenterology and Hepatology. 13 (2), 369-382 (2022).
- Greenspan, L. J., Weinstein, B. M. To be or not to be: endothelial cell plasticity in development, repair, and disease. Angiogenesis. 24 (2), 251-269 (2021).
- Papapetrou, E. P. Patient-derived induced pluripotent stem cells in cancer research and precision oncology. Nature Medicine. 22 (12), 1392-1401 (2016).
- Zhang, X., Cruz, F. D., Terry, M., Remotti, F., Matushansky, I. Terminal differentiation and loss of tumorigenicity of human cancers via pluripotency-based reprogramming. Oncogene. 32 (18), 2249-2260 (2013).
- Kim, J., et al. An iPSC line from human pancreatic ductal adenocarcinoma undergoes early to invasive stages of pancreatic cancer progression. Cell Reports. 3 (6), 2088-2099 (2013).
- Kim, J., et al. Detection of early pancreatic ductal adenocarcinoma with thrombospondin-2 and CA19-9 blood markers. Science Translational Medicine. 9 (398), (2017).
- Susac, L., et al. Structure of a fully assembled tumor-specific T cell receptor ligated by pMHC. Cell. 185 (17), 3201-3213 (2022).
- Yu, J., et al. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Carette, J. E., et al. Generation of iPSCs from cultured human malignant cells. Blood, The Journal of the American Society of Hematology. 115 (20), 4039-4042 (2010).
- Choi, S. M., et al. Reprogramming of EBV-immortalized B-lymphocyte cell lines into induced pluripotent stem cells. Blood, The Journal of the American Society of Hematology. 118 (7), 1801-1805 (2011).
- Hochedlinger, K., et al. Reprogramming of a melanoma genome by nuclear transplantation. Genes & Development. 18 (15), 1875-1885 (2004).
- Hu, K., et al. Efficient generation of transgene-free induced pluripotent stem cells from normal and neoplastic bone marrow and cord blood mononuclear cells. Blood, The Journal of the American Society of Hematology. 117 (14), e109-e119 (2011).
- Iskender, B., Izgi, K., Canatan, H. Reprogramming bladder cancer cells for studying cancer initiation and progression. Tumor Biology. 37, 13237-13245 (2016).
- Khoshchehreh, R., et al. Epigenetic reprogramming of primary pancreatic cancer cells counteracts their in vivo tumourigenicity. Oncogene. 38 (34), 6226-6239 (2019).
- Kim, H. J., et al. Establishment of hepatocellular cancer induced pluripotent stem cells using a reprogramming technique. Gut and Liver. 11 (2), 261 (2017).
- Lin, S. L., et al. Mir-302 reprograms human skin cancer cells into a pluripotent ES-cell-like state. RNA. 14 (10), 2115-2124 (2008).
- Miyoshi, N., et al. Defined factors induce reprogramming of gastrointestinal cancer cells. Proceedings of the National Academy of Sciences. 107 (1), 40-45 (2010).
- Singovski, G., et al. In vivo epigenetic reprogramming of primary human colon cancer cells enhances metastases. Journal of Molecular Cell Biology. 8 (2), 157-173 (2016).
- Zhao, H., et al. A highly optimized protocol for reprogramming cancer cells to pluripotency using nonviral plasmid vectors. Cellular Reprogramming (Formerly" Cloning and Stem Cells". 17 (1), 7-18 (2015).
- Lo, C. A., et al. Quantification of protein levels in single living cells). Cell Reports. 13 (11), 2634-2644 (2015).
- Yu, J., et al. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324 (5928), 797-801 (2009).
- Prösch, S., et al. Inactivation of the very strong HCMV immediate early promoter by DNA CpG methylation in vitro. Biological Chemistry Hoppe-Seyler. 377 (3), 195-201 (1996).
- Mehta, A. K., Majumdar, S. S., Alam, P., Gulati, N., Brahmachari, V. Epigenetic regulation of cytomegalovirus major immediate-early promoter activity in transgenic mice. Gene. 428 (1-2), 20-24 (2009).
- Chen, X., et al. Integration of external signaling pathways with the core transcriptional network in embryonic stem cells. Cell. 133 (6), 1106-1117 (2008).
- Kim, J., Chu, J., Shen, X., Wang, J., Orkin, S. H. An extended transcriptional network for pluripotency of embryonic stem cells. Cell. 132 (6), 1049-1061 (2008).
- Chronis, C., et al. Cooperative binding of transcription factors orchestrates reprogramming. Cell. 168 (3), 442-459 (2017).
- Li, D., et al. Chromatin accessibility dynamics during iPSC reprogramming. Cell Stem Cell. 21 (6), 819-833 (2017).
- Soufi, A., Donahue, G., Zaret, K. S. Facilitators and impediments of the pluripotency reprogramming factors' initial engagement with the genome. Cell. 151 (5), 994-1004 (2012).
- Carey, B. W., et al. Reprogramming of murine and human somatic cells using a single polycistronic vector. Proceedings of the National Academy of Sciences of the United States of America. 106, 157-162 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved