Method Article
ナイーブおよびエフェクターCD8 T細胞のミトコンドリア機能の測定
要約
CD8 T細胞の生体エネルギーは、水戸ストレステストを使用して調査できます。この方法論は、急性および慢性の代謝プログラミングの研究に使用できます。このプロトコルは、T細胞受容体生物学と生体エネルギー分析との関係を調べるためのアプローチを説明しています。
要約
免疫代謝がリンパ球の機能、分化、および運命にどのように影響するかを理解することは、大きな関心と注目を集めています。リンパ球生物学は、生体エネルギー分析を使用して探求されており、現在ではこの分野で重要なインポートツールになっています。したがって、私たちは、受容体刺激のための前処理や急性注射に適応できる生体エネルギー分析アッセイの最適化を目指しました。ここでは、ナイーブCD8T細胞とエフェクターCD8T細胞における酸素消費と細胞外酸性化の速度を評価するために、Cell Mito Stress Testを使用してCD8 T細胞 のex vivo 代謝を評価しました。抗原特異的エフェクターCD8 T細胞は ex vivo 刺激によって誘導され、ナイーブCD8 T細胞は脾細胞から採取され、磁気ビーズカラム分離によって単離されました。
前処理はマイクロプレートで行われ、センサーカートリッジの準備方法について詳しく説明します。注射ポートに薬物を装填して間接的に代謝能力を測定する方法と、代謝調節剤を使用して、このプロトコルを使用して特定の酵素活性を研究する方法を示します。T細胞受容体刺激は、急性注射によるリアルタイム研究と、注入ポートを用いた抗CD3/CD28刺激による刺激で研究することができます。機器分析装置は測定に使用され、データ収集とデータの視覚化はソフトウェアプログラムを使用して細胞代謝を解釈します。この戦略により、免疫細胞生物学とミトコンドリアの生体エネルギー学に関する広範なデータが生成されるため、研究者はプロトコルをさまざまな方法でカスタマイズしてCD8 T細胞の代謝を探索できます。
概要
免疫細胞の運命と機能は、代謝、酸化的消費、および嫌気性呼吸によって大きな影響を受けます1,2,3,4。近年、CD8 T細胞の運命やエフェクター機能を再プログラムまたは再活性化し、ウイルスクリアランスの改善や内因性抗腫瘍免疫の増強のための戦略として、代謝調節を標的とすることへの関心が高まっている5,6,7,8,9。特に、T細胞受容体(TCR)を介した抗原受容体シグナル伝達は、CD8 T細胞の分化にとって重要な要件であり、その結果、下流のシグナル伝達と活性化10,11,12がもたらされます(図1)。免疫学的傷害への長期にわたる曝露は、TCRに対する持続的な抗原特異的刺激を引き起こし、最終的には慢性炎症状態、T細胞疲労、免疫微小環境のリモデリング、および免疫逃避につながります11,13,14,15,16,17,18,19。
消耗したCD8 T細胞の代謝は、機能的エフェクターCD8 T細胞の代謝とは基本的に異なります2,3,14,15,18,20。T細胞の分化、インターフェロンγ(IFNγ)分泌、および想起能力は、ミトコンドリア機能とβ酸化分解産物によって部分的に決定されます。IFNγ+ CD8 T細胞は、抗腫瘍免疫応答と抗ウイルス免疫応答の両方の重要な構成要素である21,22,23。解糖系と電子伝達鎖を介した特異的代謝フラックスは、CD8 T細胞の活性化、サイトカイン分泌、および記憶応答に重要である 4,11,13,15,18,24,25,26,27,28 .T細胞の活性化やエフェクターの分化などの最適な応答には、協調的かつ特異的なミトコンドリア応答が必要であり、一方、ミトコンドリアの欠陥や過剰な活性酸素種(ROS)は、疲弊したT細胞や機能不全のT細胞を特徴づける9,29。最近、in vitroでのCD8 T細胞の持続的なTCR刺激は、酸化ストレスを誘発し、T細胞の増殖に必要な酸化代謝と代謝能力を再プログラミングすることにより、CD8 T細胞の網羅的な分化を部分的に促進します1,2,13,20,24,29 .全体として、代謝制御軸は、CD8 T細胞の分化と、エフェクター、記憶、または疲弊/機能不全の表現型への進行を指示する上で重要な要素です。
代謝化合物はまた、自己分泌またはパラクリンシグナル伝達分子として機能することにより、免疫細胞の応答を指示する9,30,31,32,33,34,35。スフィンゴシン-1-リン酸(S1P)およびリゾホスファチジン酸(LPA)は、Gタンパク質共役受容体(GPCR)を介してシグナルを伝達し、リンパ球の排出とCD8 T細胞による細胞毒性を調節する生理活性および炎症性脂質である36。CD8 T細胞上のGPCR LPA受容体を介したLPAシグナル伝達は、代謝を再プログラムして脂肪分解、脂肪酸酸化、およびプロトン漏れを増加させます9。全体として、CD8 T細胞の生体エネルギーと代謝は、主に基質の利用可能性、環境の手がかり、およびエネルギー要件によって駆動されます。
CD8 T細胞の代謝を調査する方法論は、ますます重要になっています。Cell Mito Stress Testは、生体エネルギー学の包括的な評価を提供し、現在では免疫代謝およびCD8 T細胞エネルギー学の分野における特徴的な技術として認識されている9,37。接着細胞は、歴史的に水戸ストレステストアッセイに使用されてきました38。しかし、懸濁液中で増殖した細胞にこのプロトコルを適用し、特にCell Mito Stress Testアッセイに免疫細胞を使用することへの関心が高まっています。ここでは、最近の論文9に基づいて、CD8 T細胞の代謝活性を測定するための詳細なプロトコルを紹介します。Cell Mito Stress Testアッセイでは、CD8 T細胞の増殖、ナイーブCD8 T細胞の単離、アッセイ調製、および前処理と急性注射の両方のプロトコルによる治療について詳しく説明します。重要なことは、TCR刺激とCD8 T細胞活性化のための複数の方法(ポリクローナルおよび抗原特異的TCR刺激を含む)を比較対照することです。
このプロトコルは、すべてのマウスT細胞が同じVα2およびVβ5遺伝子を発現するOT-Iトランスジェニックマウス(古典的なトランスジェニックマウスモデル)を使用した抗原特異的刺激を詳述しています39。OT-IマウスCD8 T細胞はすべて、オボアルブミンオクタペプチド(OVA257-264、アミノ酸配列SIINFEKLまたはN4とも呼ばれる)に対して特異的な同じTCRを保有しており、これは広く研究されているエピトープであり、主要組織適合遺伝子複合体(MHC)クラスIによって提示されると、細胞傷害性CD8 T細胞を活性化します39(図1A)。全体として、OT-Iトランスジェニックマウスモデルは、免疫学者によってTCRシグナル伝達と抗原特異的T細胞エフェクター機能を研究するために広く使用されています。OT-Iマウスモデルによるモノクローナル活性化とは対照的に、ポリクローナルCD8 T細胞は、TCR CD3サブユニットおよびCD28共刺激分子40に対する抗CD3/CD28抗体を用いて作製され得る。抗CD3/CD28抗体は、TCRシグナル伝達の抗原特異的成分をバイパスして、T細胞のポリクローナル集団を活性化する40。最終的に、このレポートに記載されている結果は、Cell Mito Stress Testを使用してCD8 T細胞の動的代謝フラックスを定量化するための複数の方法を比較しています。
プロトコル
マウスは病原体のない環境で飼育され、動物施設管理委員会の基準と規制に従って維持されました。
1. 抗原特異的刺激によるCD8 T細胞の作製と増殖
- 初日は、OT-Iマウス由来の脾細胞を採取します。次に、SIINFEKL (4) ペプチドを用いて in vitro で調製し、活性化します。
- フードスペースを掃除し、試薬を準備し、マウス培地を集めます。マウス培地を水またはビーズインキュベーターで温めます。
- 6ウェルプレートで、7 mLのマウス培地を1つのウェルに入れ、次に別のウェルにさらに3 mLのマウス培地を入れます。その後、7 mLの培地が入ったウェルにストレーナーを挿入します。
- マウスをビバリウムからトランスファーケージに入れて実験室に持ち込みます。マウスを空の新しいケージに移し、CO2 アダプターを上に置きます。マウスをCO2 で2.75の流量レベルまで安楽死させます。
- マウスを注意深く観察し、苦痛の兆候がないか観察してください。最後の息の後、少なくとも1分間は呼吸と生命の兆候を観察します。CO2 をオフにし、安楽死の二次的な方法として子宮頸部脱臼を行います。次に、ベンチトップ、ケージ、その他の作業エリアを清掃し、マウスを解剖フードに運びます。
- マウスから脾臓を解剖します。
- 70%エタノールを使用して解剖装置を滅菌し、マウスの左側を下にして置き、マウスの左側にスプレーして消毒します。
- 清潔な器具を使用して、解剖して皮膚を取り除き、腹膜を特定します。腹膜を小さく切開して脾臓を見つけ、次に脾臓を切除します。ストレーナー上部の6ウェルプレートに脾臓を入れます。
- その場所をきれいにし、ネズミの死骸を廃棄袋に入れてから、袋を冷凍庫に入れて廃棄します。
- 領域全体が清潔であることを確認し、次のステップのために6ウェルプレートを組織培養フードに移動します。
- 組織培養フードで、脾臓をホモジナイズし、細胞を凝集のない単一細胞懸濁液に再懸濁します。
- 5mLシリンジのプランジャーを使用して、7mLの培地で脾臓をストレーナーを通してウェルに押し込みます。
- ストレーナーと残留組織を、追加のウェルに3 mLの培地を使用してすすぎます。
- 血清学的ピペットで細胞懸濁液を新しい10 mLコニカルチューブに移します。
- 500 × g で5分間遠心分離し、ガラスピペットを使用して上清を吸引します。
- 赤血球を溶解します。
- 1 mLのACK溶解バッファーを使用して赤血球溶解のプロセスを開始し、細胞をACK溶解バッファーに再懸濁し、室温で1〜5分間インキュベートします。
注:インキュベーション時間は、ACK溶解バッファーの特定のバッチに合わせて最適化して、脾細胞の死を最小限に抑えながら最大の赤血球溶解を達成する必要があります。 - 10 mLの培地をコニカルチューブに加えて中和し、500 × gで5分間遠心分離します。
- 細胞を50 mLの培地に再懸濁し、T75フラスコに移します。
- 1 mLのACK溶解バッファーを使用して赤血球溶解のプロセスを開始し、細胞をACK溶解バッファーに再懸濁し、室温で1〜5分間インキュベートします。
- SIINFEKL(N4)ペプチドで細胞を刺激します。
- SIINFEKLペプチドを組織培養フードに入れます。SIINFEKLペプチドを-20°Cで保存します。
- SIINFEKLを培地に直接添加して、最終濃度2 μg/mLを達成します。50 mLの培地に50 μLのSIINFEKL(2 mg/mL)を加えて、最終濃度を2 μg/mLにします。
- 細胞を37°Cで72時間インキュベートします。
- 70%エタノールを使用して組織培養フードを消毒します。
- フードスペースを掃除し、試薬を準備し、マウス培地を集めます。マウス培地を水またはビーズインキュベーターで温めます。
- 4日目に、細胞を洗浄してペプチドを除去します。IL-2を添加した新たに調製した培地を使用して、細胞を再懸濁し、フラスコをインキュベーターに戻します。
- T75組織培養フラスコから細胞を50 mLの円錐チューブに集めます。OT-I CD8 T細胞を遠心分離してペレット化し、吸引して余分な培地を取り除きます。1,000 U/mLのIL-2を含む新しいマウス培地50 mLを添加し、細胞を新しいT75フラスコに再懸濁します。
- 保管するには、IL-2ストックのアリコートを-80°Cの冷凍庫に保管してください。 -80°Cで保存すると、ペプチドの分解が最小限に抑えられます。
- ミトコンドリア機能アッセイのための拡大抗原特異的細胞傷害性CD8 T細胞の調製
- 7日目に、ミトコンドリア機能アッセイが行われます。アッセイのために抗原特異的OT-I CD8 T細胞を調製します。
- 生きたCD8 T細胞を採取します。
- T-75組織培養フラスコから新しい50 mLコニカルチューブに細胞を移します。次に、円錐管を500 × gで5分間遠心分離します。
- 新しい50 mLコニカルチューブで、細胞が回転している間に、密度勾配培地20 mL(密度= 1.077 g/mL)をピペットで移します。
- 遠心分離が完了したら、コニカルチューブを取り、10 mLの培地を使用して、細胞を再懸濁します。次に、非常にゆっくりとピペッティングを行い、再懸濁した細胞を密度勾配の上に重ねます。勾配を乱さずに、コニカルチューブを室温で1,300 × g で20分間遠心分離し、ブレーキなしで最大加速と最小減速に設定します。
- 遠心分離が完了したら、P1000ピペットを使用してT細胞の中間層を採取します。細胞層を視覚化し、ピペットが上に留まり、層を乱さないことを確認します。採取した細胞を、30 mLの完全マウス培地が入った新鮮な50 mLコニカルチューブに移します。次に、50 mLのコニカルチューブを500 × g で5分間遠心分離します。遠心分離が完了したら、OT-I CD8 T細胞から余分な上清を吸引します。20 mLの新鮮なマウス培地で、細胞を再懸濁します。
- 血球計算盤を使用して、生細胞の総数をカウントします。細胞の小さなアリコートをトリパンブルーで1:4の希釈液で染色し、死細胞を同定します。
注:1つのOT-Iマウスから約40〜60×106 個の細胞が期待できます。 - 追加の遠心分離ステップで、残りの細胞を追加の20 mLの新鮮なマウス培地で洗浄します。次に、マイクロプレートを使用して、完全なマウス培地で細胞200,000細胞/ウェルをピペットします。
2. 抗CD3/抗CD28刺激による多重特異的CD8 T細胞の作製と増殖
- 0日目に、24ウェルプレートをCD3にコーティングします。24ウェルプレートの各ウェルに、PBSで希釈した5 μg/mLの濃度の抗CD3-ビオチン1 mLを1 mL加えます。プレートを加湿した5%CO2 インキュベーターに一晩置きます。
- 翌日、マウスを収穫し、脾細胞を採取します。ステップ1.1.1-1.1.5.3に従って、抗CD3/抗CD28で in vitro で脾臓細胞を活性化します。
- 磁気ビーズ分離プロトコルを使用して、CD8 T細胞を単離します。
注:セルが冷たく保たれていることを確認してください。予冷された条件下では、迅速に作業してください。- 40 μLのMACSバッファーを使用して、MACSバッファー40 μLあたり10,000,000個の細胞で細胞を再懸濁します。溶液に10 μLのビオチン抗体カクテルを細胞溶液に十分に混合し、4°Cで5分間インキュベートします。
- 細胞が冷蔵庫でインキュベートするのを待っている間に、ポジティブセレクション用のカラムを準備します。3 mL のバッファーを使用してカラムを洗浄し、流れた廃液を廃棄します。
- 5分後、細胞抗体溶液を冷蔵庫から取り出し、10,000,000細胞あたり30 μLのMACSバッファー、20 μLの抗ビオチンを加え、4°Cでさらに10分間インキュベートします。
- 新しい15 mLコニカルチューブを使用して、ポジティブセレクションカラムの下に新しいコレクションチューブを調製します。10分間のインキュベーションが完了したら、細胞懸濁液をポジティブセレクションカラムに移します。新しい15 mLのコニカルチューブで、フロースルーを回収します。3 mLのMACSバッファーを使用してカラムを洗浄し、残留細胞を回収します。
注:細胞懸濁液が0.5mL以上の容量であることを確認してください。 - 陽性で選択したCD8 T細胞を24ウェルプレートに再播種し、抗CD3/抗CD28刺激を行います。
- フロースルーを500 × g で4°Cで5分間遠心分離します。 余分な上清を吸引し、細胞をピペッティングして溶液に再懸濁します。血球計算盤とトリパンブルーを使用して、細胞を数えます。
注:マウスの脾臓あたり~8-10×106 個の生細胞がカウントされることを期待してください。 - 細胞をカウントした後、CD8 T細胞を500,000細胞/mLで再懸濁します。次に、24ウェルプレートからPBS1 mLを慎重に吸引し、カウントした細胞を24ウェルプレートに再播種し、ウェルごとに10個の6 細胞を添加します。
- 細胞を刺激するには、抗CD28を24ウェルプレートにピペットで移し、抗CD28の最終濃度が2 μg/mLになるようにします。細胞を混合するには、プレートを慎重にたたきます。セルを次の72時間37°Cに保ちます。
- フロースルーを500 × g で4°Cで5分間遠心分離します。 余分な上清を吸引し、細胞をピペッティングして溶液に再懸濁します。血球計算盤とトリパンブルーを使用して、細胞を数えます。
- 70%エタノールを使用して、ティッシュカルチャーフードを清掃します。
- 4日目(72時間後)に、抗CD3 /抗CD28刺激から細胞を取り出します。ポリクローナルCD8 T細胞を遠心分離して細胞を洗浄します。吸引により余分な上清を除去し、その後、1,000ユニット/mLのIL-2と10mLの培地を含む新鮮なマウス培地で細胞を再懸濁します。再懸濁した細胞を新しい6ウェルプレートに移し、インキュベーターに入れます。
ノート: 1.2.2.保管のために、IL-2ストックのアリコートは-80°Cの冷凍庫に保管することができます。 -80°Cで保存すると、ペプチドの分解が最小限に抑えられます。 - ミトコンドリア機能アッセイ用の拡張ポリクローナルエフェクターCD8 T細胞を調製します。
- 7日目に、アッセイ用のポリクローナルCD8 T細胞を準備して処理します。
- 生きたCD8 T細胞を採取します。
- ピペットを使用して6ウェルプレートからきれいな円錐形チューブに細胞を移し、細胞を500 × gで5分間遠心分離します。
- 手順1.3.3.2〜1.3.4に従います。
注:1つのC57BL/6マウスから約1,000万〜3,000万個の生CD8 T細胞が期待できます。 - フローサイトメトリー用に細胞のアリコートを保存して、CD8の純度を評価します。フローサイトメトリーでは、選択した生存率色素9を用いて細胞を氷上で20分間染色します。
3. ナイーブCD8 T細胞の回収
- 7日目に、手順1.1.1-1.1.5.3に従ってマウスから脾細胞を採取します。
- ステップ2.3-2.3.5.1で説明した磁気ビーズベースのプロトコルを使用して、CD8 T細胞の単離を実行します。
- CD8 T細胞をマイクロプレートに200,000細胞/ウェルで完全培地でプレート化します。
4. ミトコンドリア機能アッセイの実施
- ミトコンドリア機能アッセイを実施する前日に材料を準備します。
- センサーカートリッジをハイドレートします。
- 200 μLの蒸留水をユーティリティプレートの各ウェルにピペットで移します。センサーカートリッジをユーティリティプレートの上に置きます。適切な水分補給を確保するために、センサーカートリッジの端が水没していることを確認してください。センサーカートリッジとユーティリティプレートの両方を非CO2 インキュベーターに37°Cで最低10時間入れます。
- 50 mLのコニカルチューブを50 mLのCalbrantで調製し、非CO2 インキュベーターに入れて一晩インキュベートします。
- アッセイの前日に、アッセイの準備として完全な新鮮な培地を準備します。合計50 mLで、アッセイ培地に1 mMピルビン酸、2 mMグルタミン、および10 mMグルコースの溶液を調製します。
- センサーカートリッジをハイドレートします。
- 翌日にミトコンドリア機能アッセイを実施します。
- ユーティリティプレートから蒸留水をはじいて取り出します。200μLのキャリブラントで再水和します。非CO2 インキュベーターに一晩保管したキャリブラントを使用してください。ユーティリティプレートの上部にあるセンサーカートリッジを交換した後。センサーカートリッジ付きのユーティリティプレートを非CO2 インキュベーターに戻します。
注:プレートをフリックするには、蒸留水がプレートからすばやく落ちるように、シンク上で1回の流体運動でプレートを迅速かつ迅速に反転させます。
- ユーティリティプレートから蒸留水をはじいて取り出します。200μLのキャリブラントで再水和します。非CO2 インキュベーターに一晩保管したキャリブラントを使用してください。ユーティリティプレートの上部にあるセンサーカートリッジを交換した後。センサーカートリッジ付きのユーティリティプレートを非CO2 インキュベーターに戻します。
- CD8 T細胞は、上記1〜3のセクションに従って調製します。
- マルチチャンネルピペットを使用して、10 × 10個の 6 個の細胞を 4.5 mL の完全培地に再懸濁し、ウェルあたり 90 μL をプレーティングすることにより、ウェルあたり 200,000 個の細胞をプレート化します。次に、前処理中にウェルごとにさらに90 μLの指定培地を追加します。
注:前処理がない場合は、ウェルあたり180μLに細胞をプレートし、ウェルあたり最終濃度を200,000細胞にします。プロトコルのこの時点から先は、プレートを室温または非CO2 インキュベーターに保ちます。プレートは5%CO2 インキュベーターに入れないでください。マイクロプレートの最終容量は180μLになることに注意してください。
- マルチチャンネルピペットを使用して、10 × 10個の 6 個の細胞を 4.5 mL の完全培地に再懸濁し、ウェルあたり 90 μL をプレーティングすることにより、ウェルあたり 200,000 個の細胞をプレート化します。次に、前処理中にウェルごとにさらに90 μLの指定培地を追加します。
- 前処理(脂質または他の代謝物の補給を含む)を準備します。.
- クイックスピンミニ遠心分離機を使用して凍結乾燥脂質を冷凍庫からスピンダウンすることにより、脂質前処理を調製します。前処理に必要な濃度を決定し、これらの濃度に対する脂質前処理を準備します。希釈した脂質を使用直前に30分間超音波処理します。
- 脂質カクテルを準備します。
- ミトコンドリア機能アッセイで使用する目的の脂質濃度を決定します。
- 脂質を所望の濃度の2倍の濃度で調製します。次に、マイクロプレート内の既存の容量に脂質溶液を添加して、1:2の希釈を達成します。これを完了するには、90 μLの脂質溶液を既存の90 μLに直接加えます。最終容量はウェルあたり180μL(1:2希釈)です。
注意: 表1 は、可能なプレートのセットアップと設計の図の例を詳しく説明しています。5-6回のテクニカルリピートでアッセイを実施し、脂質添加物の有無にかかわらず、ナイーブエフェクターCD8T細胞と抗原特異的エフェクターCD8 T細胞の両方を組み込むことをお勧めします。特に、このプロトコルは、細胞の混乱を最小限に抑えるために遠心分離を回避するように設計されています。ミトコンドリア機能アッセイは細胞数に非常に敏感であるため、細胞損失を減らすことが重要です。遠心分離の代わりに、細胞はフリックによって処理され、細胞の完全性が維持されます。 - 180 μLの完全培地をプレートの各コーナーにピペットで移します。CD8 T細胞を入れたマイクロプレートを非CO2 インキュベーターに入れます。
注:インキュベーション時間は、希望する前処理の長さによって異なります。細胞死を最小限に抑えるために、CD8 T細胞に対して最大4時間の前処理を推奨しました。前処理時間を過度に延長すると、過剰な細胞死を引き起こし、結果の精度に影響を与える可能性があります。
- 急性注射用の毒物と溶液を準備します。
- ストック溶液を使用して、希釈形態のオリゴマイシンを調製します。オリゴマイシンを 3 mL の完全培地に希釈します。15 mLの円錐管で、毒物と急性注射を慎重に調製します。毒物は光に敏感であるため、光への曝露から保護するために、スズ箔で包まれたチューブを使用してこれらの溶液を準備します。
- スズホイルで包まれた15 mLのコニカルチューブ1本で、オリゴマイシンを3 mLの完全培地で希釈し、注入後の最終濃度が2.5 μMになるようにします。
- スズ箔で包んだ 2 つ目の 15 mL コニカルチューブで、FCCP を 3 mL の完全培地で希釈し、注入後の最終濃度が 2.0 μM になるようにします。
- スズホイルで包まれた3番目の15 mLコニカルチューブで、3 mLの完全培地にロテノンとアンチマイシンAの溶液を作成し、注射後に両方の毒素に対して0.5 μMの濃度を達成します。.
- アッセイが追加の代謝調節剤、薬物、または刺激を用いて実施される場合は、これらの薬剤を完全な培地で希釈してください。エトモキシルやその他の代謝調節剤や薬物の使用を計画している場合は、まず滴定曲線をテストし、使用に最適な濃度を決定するためのアッセイを実行します。.急性注射でTCR刺激を行う場合、アッセイは抗CD3/抗CD28磁気ビーズ、またはプレート結合抗CD3-ビオチンと抗CD28ストレプトアビジンの組み合わせのいずれかを使用して行うことができます。
注:追加の説明については、急性抗CD3/CD28注射によるTCR刺激のプロトコルを説明するセクション5を参照してください。
- センサーカートリッジを非CO2 インキュベーターから取り外します。プレートアダプターを使用して、毒物をセンサーカートリッジにピペットで移します。プレートアダプターを配置して、各チャンバーに毒物やその他の急性注射を特別に装填できるようにします。
注意: 毒物をピペッティングするときは注意してください。- センサーカートリッジのポートに毒物をロードします。追加のインジェクションが実行されていない場合、ポート A から C には毒がロードされます。20 μLのオリゴマイシンをポートAに、22 μLのFCCPをポートBに、25 μLのロテノンをポートCに、25 μLのアンチマイシンAをポートCにピペットでピペットします。
- ストック溶液を使用して、希釈形態のオリゴマイシンを調製します。オリゴマイシンを 3 mL の完全培地に希釈します。15 mLの円錐管で、毒物と急性注射を慎重に調製します。毒物は光に敏感であるため、光への曝露から保護するために、スズ箔で包まれたチューブを使用してこれらの溶液を準備します。
- 装置でアッセイを開始する1時間前に、マイクロプレートを非CO2 インキュベーターに入れます。
- 装置を起動する前に、ソフトウェアを開いて装置を校正してください。この作業は、マイクロプレートを装置にロードする30分前に実行して、キャリブレーションに十分な時間を確保します。
- ソフトウェアシステムで、ウェルにラベルを付け、注入スキームを確認します。
- キャリブレーション中は、センサーカートリッジを機器にロードします。ソフトウェアは、初期化と品質チェックを完了するように求めます。キャリブレーションでは、各ウェルのpHとO2 を評価し、合格または不合格のいずれかになります。機器は、チェックマークまたは「X」で画面に結果を報告します。
5. TCR刺激を用いたミトコンドリア機能アッセイの修正版を、急性抗CD3/CD28注射を用いた別の実験で実施します
注:ミトコンドリア機能アッセイは、1)ステップ5.2または2)ステップ5.3に記載されている抗CD3 +抗CD28+ストレプトアビジンを使用するか、または2)ステップ5.3に記載されている抗CD3 / CD28磁気ビーズを使用して、2つの異なるアプローチを介して急性TCRシミュレーションで実行できますこれらの別々の実験は両方とも、アッセイ中に急性注射を介してTCRを刺激する機能します。
- 追加の注入を行う場合は、前のセクション4で説明したようにアッセイを調製します。注入用の追加のチャンバーを使用して注入スキームを変更します。このプロトコルでは、アンチCD3/アンチCD28がセンサーカートリッジのポートAにロードされます。次に、他のポートも同様にロードし、オリゴマイシンをポートBに、FCCPをポートCに、ロテノンとアンチマイシンAをポートDにロードします。
- ビオチン化抗CD3 + 抗CD28 +ストレプトアビジン成分を調製し、装填します。
- 20 μL のビオチン化抗 CD3 を 10 μg/mL で、センサーカートリッジ内の指定ウェルにピペットで移します。
- 20 μL の抗 CD28 + ストレプトアビジン (20 μg/mL) をセンサーカートリッジ内の指定ウェルにピペットで移します。
- 20 μL のビオチン化抗 CD3 を 10 μg/mL で + 抗 CD28 を 2 μg/mL + ストレプトアビジンを 20 μg/mL でセンサーカートリッジ内の指定ウェルにピペットで移します。
- 制御ウェルが準備されていることを確認します。培地のみ、ビオチン化抗CD3単独、抗CD28 + ストレプトアビジン、およびビオチン化抗CD3 + 抗CD28 + ストレプトアビジンのみを注入した指定ウェルがあることを確認してください。
- ビーズと細胞の比率が1:1で、抗CD3/CD28磁気ビーズを調製し、ロードします。
- ウェルあたり200,000個の細胞が入ったプレートで、5 μLの磁気ビーズをセンサーカートリッジ内の指定されたウェルにピペットで移します。
- 指定されたコントロールウェルを注入専用の培地で調製します。
- 注入後の最終的な濃度がオリゴマイシンで2.5 μM、FCCPで2.0 μM、ロテノンおよびアンチマイシンAで0.5 μMになるように、毒物の量を調整します。
- マイクロプレートを装置にロードする前に、更新された時点を反映するように注入スキームが変更されていることを確認してください。
- 急性TCR刺激を合計140分間実行するようにソフトウェアをプログラムします。この期間内に、オリゴマイシン注入前に x10 の時点測定が行われるようにスキームを変更します。
結果
解糖系および酸化的代謝能力は、特定の時点における電子伝達系の成分を標的とすることにより能力を評価するミトコンドリア機能アッセイを使用して測定できます(図2A)。センサーカートリッジポートにさまざまな注入スキームをロードして、従来のアッセイを変更し、急性TCR刺激を評価できます(図2B、C)。結果を解釈する前に、さまざまな細胞タイプの細胞数と薬物濃度を最適化する必要があります。ここで、このレポートでは、ナイーブ細胞とエフェクター細胞の両方の容量を測定するために最適化された電子伝達鎖の阻害剤を使用して、CD8 T細胞(図3A、B)に最適化された条件について説明します。重要なことに、このアッセイは、抗原特異的刺激または抗CD3/CD28刺激から生成されたエフェクターCD8 T細胞に対するTCR刺激を研究するように変更することができます。さらに、特にリゾホスファチジン酸またはLPAを用いた生理活性脂質シグナル伝達に対するCD8 T細胞の応答について調べます。LPAシグナル伝達(マイクロプレートを分析装置にロードする30分前、2時間前、または4時間前)に応答する代謝傾向は、抗原特異的またはポリクローナルTCR刺激のいずれかで活性化された両方のCD8T細胞で類似していると判断しました(図5A-D)。TCR刺激の種類と活性化のメカニズムは、抗原特異的な活性化で代謝的にエネルギーのある細胞が最初に生成されるという微妙な違いをもたらしました(図5E-L)。
エフェクターCD8 T細胞に抗CD3/CD28を急性注射すると、リアルタイム測定でTCRを急激に刺激することができます。ビオチン化抗CD3、抗CD28、およびストレプトアビジンを併用して、急性注射モデルでTCRを刺激することができます。別の方法として、この生体エネルギーアッセイでは、抗CD3および抗CD28に結合した磁気ビーズを使用して急性注射を行い、TCRをリアルタイムで刺激することができます。アッセイ中の途中で、培地、ビオチン化抗CD3、抗CD28 +ストレプトアビジン、またはビオチン化抗CD3 +抗CD28 +ストレプトアビジンの凝集体のいずれかをエフェクターOT-I CD8 T細胞に注入するようにモデルを適応させました(図6A、B)。抗CD3/CD28による刺激が観察され、OCRとECARの両方が増加しました。OCRおよびECARシグナルも上昇しましたが、抗CD3/CD28と同じレベルには達しておらず、ビオチン化抗CD3シグナルのみでした。重要なことに、抗CD3/CD28磁気ビーズ急性注射に匹敵する同様の代謝傾向が見られます(図6C-F)。要するに、これらの結果は、複数のアプローチと方法論により、ミトコンドリア機能アッセイがリンパ球の免疫代謝、特にCD8 T細胞の研究に堅牢で再現性があることを示しています。

図1:抗原特異的およびポリクローナル刺激によるT細胞受容体の活性化。 (A)T細胞受容体に結合したペプチドを持つ主要組織適合遺伝子複合体(MHC)クラスIによる抗原特異的シグナル伝達の概略図。 (B)CD3サブユニットとCD28共刺激分子を抗CD3/28抗体と結合させることによるCD8 T細胞ポリクローナル活性化の描写。 この図の拡大版を表示するには、ここをクリックしてください。

図2:ミトコンドリア機能アッセイにおける電子伝達鎖の薬物標的化 (A)ここで使用した電子伝達鎖阻害剤(赤)の概略図。(B,C)ミトコンドリア機能試験では、センサーカートリッジへの注入戦略は次のとおりです:(B)オリゴマイシンをポートAに、FCCPをポートBに、ロテノンとアンチマイシンAをポートCにロードする従来の注入アプローチ。 ポートDのロテノンとアンチマイシンA略語:FCCP = 4-(トリフルオロメトキシ)フェニル)カルボノヒドラゾノイルジシアン化物。この図の拡大版を表示するには、ここをクリックしてください。

図3:LPA処理後の抗CD3および抗CD28刺激から生成されたCD8 T細胞のCD8およびCD44の表面発現、生存率、および代謝差 (A)エフェクターCD8 T細胞は、抗原提示細胞としてのSIINFEKL(N4)および脾細胞またはプレート上の抗CD3および抗CD28でマウス由来のCD8 T細胞を刺激することにより、 ex vivo で生成されます。4日目には、IL-2が初期刺激を置き換え、分化と増殖をサポートします。次に、均質な7日目のエフェクターCD8 T細胞を、 in vitro 培養後にフローサイトメトリーで分析します。(B)T細胞は、リンパ球の状態をゲーティングし、次にCD8+/CD44+ を発現させることにより同定されます。代表的な画像は、CD8とCD44がLPA処理の影響を受けないことを示しています。この図は、Turner et al.9から修正されました。 この図の拡大版を表示するには、ここをクリックしてください。
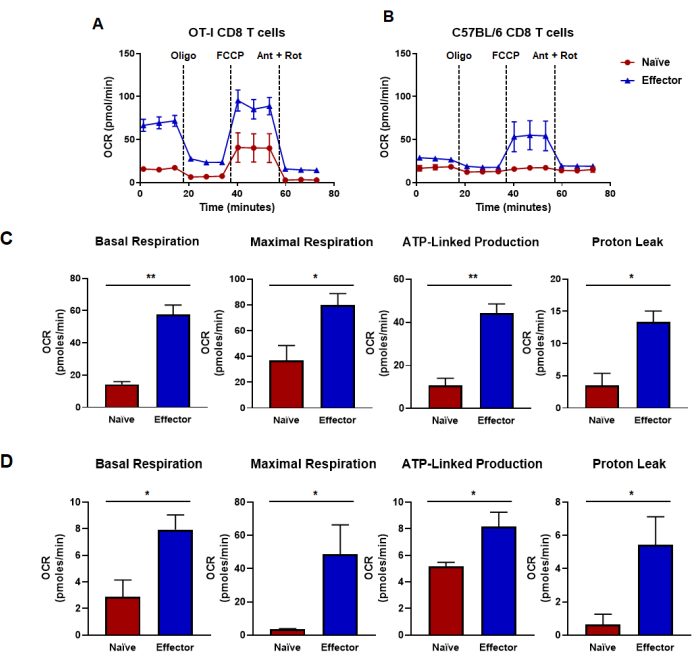
図4:酸素消費率から決定される酸化能力。 (A,B)(A)OT-I CD8 T細胞抗原特異的刺激および増殖、または(B)野生型C57B/6マウス由来の抗CD3/CD28ポリクローナル刺激およびCD8 T細胞の増殖によって生成されたナイーブCD8 T細胞およびエフェクターCD8 T細胞の酸素消費率。オリゴマイシン、FCCP、アンチマイシンA、およびロテノンを18分間隔で25 mMグルコース培地に注入しました。結果は代表的なデータとして示されており、n = 6 回のテクニカルレプリケートを使用して取得されました。(C,D)パネル(A、B)で実施された代謝フラックスアッセイから導き出された容量指標は、計算された基礎呼吸、最大呼吸、ATP関連産生、およびプロトン漏れを表示します。(C)代謝能はOT-I、CD8 T細胞から決定され、パネル(A)に示すデータに対応する。(D)C57BL/6 CD8 T細胞から決定された代謝能で、パネル(B)に示されているデータに対応します。対応のないスチューデントの t検定分析は、*p < 0.05、**p < 0.005、***p < 0.0005、および****p < 0.0001の図全体に対して行われました。略語:OCR =酸素消費率;オリゴ=オリゴマイシン;FCCP = 4-(トリフルオロメトキシ)フェニル)カルボノヒドラゾノイルジシアン化物;ant = アンチマイシンA;rot = ロテノン。 この図の拡大版を表示するには、ここをクリックしてください。
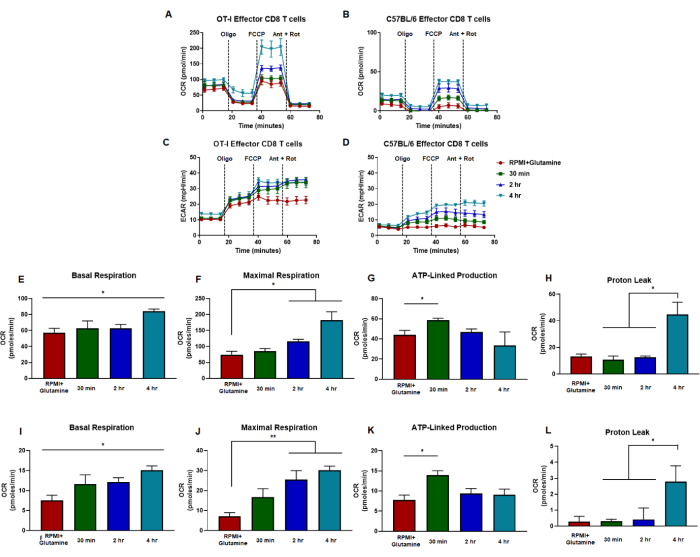
(A,B) CD8 T細胞の酸素消費率は、(A)OT-I CD8 T細胞の抗原特異的刺激および増殖、または(B)野生型C57B/6マウス由来の抗CD3/CD28ポリクローナル刺激およびCD8 T細胞の増殖によって生成された細胞から測定されます。(C,D)エフェクターCD8 T細胞の細胞外酸性化率の測定は、(C)OT-I CD8 T細胞抗原特異的刺激および増殖、または(D)野生型C57B/6マウス由来のCD8 T細胞の抗CD3/CD28ポリクローナル刺激および増殖によって生成された細胞について示されています。CD8 T細胞の代謝容量は、グルタミン(赤)または1μM LPAを添加した培地で30分間(緑)、2時間(青)、または4時間(緑)で測定しました。オリゴマイシン、FCCP、アンチマイシンA、およびロテノンを18分間隔で25 mMグルコース培地に注入しました。結果は代表的なデータとして示されており、n = 6 回のテクニカルレプリケートを使用して取得されました。(E-H)パネル(A、C)で実施された代謝フラックスアッセイから導き出された容量指標は、計算された基礎呼吸、最大呼吸、ATP関連産生、およびプロトン漏れを表示します。(I-L)基礎呼吸、最大呼吸、ATP連動産生、および陽子漏出を示すパネル(B、D)からの容量計算。全体の数値は、*p が 0.05 である一元配置分散分析を使用して統計的に分析<。略語:OCR =酸素消費率;ECAR = 細胞外酸性化率;オリゴ=オリゴマイシン;FCCP = 4-(トリフルオロメトキシ)フェニル)カルボノヒドラゾノイルジシアン化物;ant = アンチマイシンA;rot = ロテノン。この図の拡大版を表示するには、ここをクリックしてください。

図6:抗CD3/CD28の急性注射によるT細胞受容体刺激のリアルタイム戦略。 (A,B)ミトコンドリア機能評価のためのビオチン化抗CD3、ストレプトアビジン、および抗CD28を含む急性注射戦略。パネルには、抗原刺激OT-IエフェクターCD8 T細胞の代謝能力が示されており、具体的には(A)細胞外酸性化率と(B)酸素消費率が示されています。注射では、培地のみ(赤)、ビオチン化抗CD3(緑)、抗CD28 +ストレプトアビジン(青)、またはビオチン化抗CD3 +抗CD28 +ストレプトアビジン(青緑)の組み合わせを使用します。(C,D)ミトコンドリア活性を評価するための抗CD3/CD28と結合した磁気ビーズの急性注射。パネルには、抗原刺激OT-IエフェクターCD8 T細胞の代謝能が表示され、具体的には(C)細胞外酸性化率と(D)酸素消費率が示されています。注射では、培地のみ(赤)または抗CD3/CD28ビーズ注射(青緑色)を使用します。アッセイは、25 mM グルコースを添加した培地にオリゴマイシン、FCCP、アンチマイシン A、およびロテノンを 18 分間隔で注射して実施しました。結果は代表的なデータとして示されており、n = 6 回のテクニカルレプリケートを使用して取得されました。(E)注射前の基礎代謝(赤)、注射後呼吸(青)、および最大呼吸能力(灰色)を示すパネル(A-D)からの容量計算。条件は、アッセイ内注入に基づいて分離されます。(F)基礎呼吸、最大呼吸、ATP連動産生、および陽子漏出を示す容量計算。この図全体の統計は、*p < 0.05、**p < 0.005、***p < 0.0005、および ****p < 0.0001 の一元配置分散分析を使用して実行されました。略語:OCR =酸素消費率;ECAR = 細胞外酸性化率;オリゴ=オリゴマイシン;FCCP = 4-(トリフルオロメトキシ)フェニル)カルボノヒドラゾノイルジシアン化物;ant = アンチマイシンA;rot = ロテノン。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この記事では、ナイーブCD8T細胞とエフェクターCD8 T細胞のミトコンドリア機能を評価するためのプロトコルについて概説します。OT-IマウスおよびC57BL/6マウスを使用して、抗原特異的およびポリクローナルCD8 T細胞の両方を調製する方法を詳細に比較します。私たちの結果は、CD8 T細胞の活性化と前処理の方法にもかかわらず、代謝に同様の傾向があることを示しています。このデータは、抗原特異的な活性化が、抗CD3および抗CD28で刺激されたC57BL/6野生型T細胞と比較して、より代謝活性の高いOT-I CD8 T細胞につながることを明らかにしています。ここで説明するプロトコルは、ミトコンドリア機能アッセイであるMitoストレステストが、複数のさまざまな条件や細胞タイプにわたって信頼性の高い結果を生成する、非常に感度が高く、一貫して再現性のあるアッセイであることを示しています。私たちの調査結果と詳細なプロトコルは、CD8 T細胞の代謝と生体エネルギー学を分析するための基本的な方法論として、このアッセイの認識が高まっていることに貢献しています。
免疫療法や様々な細胞治療が進歩し続ける中、T細胞標的療法を適用することの重要性も高まっている41。免疫療法に対する反応および抗腫瘍免疫応答は、上流のTCR活性化から引き起こされるT細胞媒介代謝、カルシウムシグナル伝達、および酸化フラックスに依存している42。最適なCD8 T細胞応答5,6,7,15,17,26,43には代謝効率と柔軟性の両方が必要であるが、プロトン漏れの増加とそれに続く酸化的損傷はT細胞応答を損ない、機能障害を促進する9,44。T細胞の増殖とサイトカイン産生は、ミトコンドリアの酸化ストレスを緩和することで救うことができる5,13,20,24,25,29。私たちの実験では、生存率を維持するIL-2で培養されたナイーブCD8 T細胞を使用しました。しかし、これらのCD8 T細胞は、もはや真正なナイーブなCD8 T細胞と同等ではないと言えるでしょう。そこで、マウスから直接採取したナイーブCD8 T細胞を用いて、より質の高いデータとサイトカインの影響を受けにくい細胞を使用することを選択しました。全体として、T細胞サブセット全体の代謝を調べるための技術を最適化することが重要です。
CD8 T細胞の運命は、適応免疫応答に影響を与える代謝プログラミングによって部分的に指示されています2,4,45。ナイーブなCD8 T細胞は、TCR刺激25,46,47,48,49,50で静止状態を終了します。それにもかかわらず、連続的なTCR刺激はCD8 T細胞の枯渇を招き、その結果、機能的なCD8T細胞と比較して著しくエネルギー表現型が減少する3,20,51,52。しかし、代謝に対するこの影響は改善され、消耗したCD8 T細胞2,3,20,46,51,52を活性化させる可能性があります。CD8 T細胞の運命と網羅的な分化を支配する正確なメカニズムはよく理解されていないが、機能不全および/または疲弊したCD8 T細胞は、特徴的に、CD8 T細胞のエフェクター機能を調節する重要な因子であるミトコンドリアの欠陥とROSの過剰産生を持っている 9,15,53.CD8 T細胞の代謝、表現型、および網羅的な分化は、Mitoストレステストを使用して研究されてきました。歴史的に、エフェクター機能の進行性の喪失をもたらす持続的なTCR刺激は、CD8 T細胞の枯渇を定義します11,13,16,17。しかし、消耗したCD8 T細胞をより良く特徴付け、クロマチンおよび転写のランドスケープも疲労を定義し、代謝フラックス18,27,28と密接に関連していることを示すための最近の取り組みが行われています。全体として、持続的なTCR刺激とそれに続く表現型および代謝後遺症をMitoストレステストで研究し、代謝の脆弱性と運命決定的なイベントを特定できる可能性があります。
TCRの刺激は、顆粒のエキソサイトーシスおよび指向性T細胞の死滅に必要な下流のカルシウムシグナル伝達を開始します24,33。特に、インフラマソームの活性化やIFNγ産生などの先行する事象は、持続的で持続的なATP54に依存しています。カルシウムシグナル伝達中に、「ミトコンドリアフラッシュ」現象55,56,57,58として知られるミトコンドリア効率の調節不全が報告されています。ミトコンドリアフラッシュは、活発に呼吸しているミトコンドリアが短時間非結合呼吸を経験し、その結果、ATPが減少し、ROS55,56の増加がバースト増加するプロセスを表しています。ミトコンドリアフラッシュに関する研究は限られており、CD8 T細胞におけるその関連性は広く未解明のままです。重要なことに、この研究で概説された方法論は、これらの現象、CD8 T細胞の網羅的な分化、およびその他の免疫細胞プロファイルを調査するために利用できます。
要約すると、これらの方法論とツールは、急性代謝と慢性代謝の両方を研究するためのより包括的なアプローチを提供します。Mitoストレステストは、代謝プログラミングと、それがCD8 T細胞のエフェクター機能障害と網羅的な分化をどのように制御するかを調べるために適用できます。リンパ球における代謝リプログラミングは、免疫寛容、CD8 T細胞の機能不全、および消耗免疫応答の根底にあるメカニズムを理解するための要因となる可能性があります。さらに、代謝および/または脂質メディエーターは、CD8 T細胞の細胞毒性および枯渇9において重要な役割を果たしているため、 枯渇を予防したり、抗腫瘍免疫を低下させるための網羅的分化を逆転させる可能性のある新しいアプローチとして標的とすることができる。全体として、Cell Mito Stress Testアッセイは、免疫代謝に関するこれらの未解決の問題に対処するために利用すべき堅牢なツールとして立っています。
開示事項
著者らには、開示すべき競合する利害関係はありません。
謝辞
ハーツ財団、エイミー・デイビス財団、ムーア・ファミリー財団、ハイディ・ホーナー財団は、貴重な支援を提供してくださり、感謝しています。この研究は、NIHのRMT(AI052157年、AI136534年)への助成金によっても部分的に支援され、JATはHertz Graduate Fellowshipによって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Anti-CD28 | Biolegend | 102116 | |
| Anti-CD3/CD28 Dynabeads | ThermoFisher | 11456D | |
| Biotinylated anti-CD3 | Biolegend | 317320 | |
| Bovine Serum Albumin | Sigma-Aldrich | 108321-42-2 | |
| CD8a+ T cell isolation kit | Miltenyi Biotec | 130-104-075 | |
| Cell Strainers (100 µm) | CELL TREAT | 229485 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E8008 | |
| Ficoll | Sigma-Aldrich | 26873-85-8 | density gradient medium |
| FCCP ((4-(trifluoromethoxy) phenyl) carbonohydrazonoyl dicyanide) | Sigma-Aldrich | C2920 | |
| Glucose | Sigma-Aldrich | G-6152 | |
| Glutamine | Sigma-Aldrich | G7513 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | Positive selection columns |
| Magnetic cell separation column | Miltenyi Biotec | 130-042-301 | |
| Microplate | Agilent | 102601-100 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Pyruvate | Sigma-Aldrich | 113-24-6 | |
| Recobinant IL-2 | PeproTech | 200-02 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Seahorse media | Agilent | 103576-100 | |
| Sensor cartridge | Agilent | 102601-100 | |
| Streptavidin | Sigma-Aldrich | A9275 | |
| Sterile 6 well plate | CELL TREAT | 230601 | |
| Sterile 24 well plate | CELL TREAT | 229524 | |
| XF Calibrant | Agilent | 102601-100 |
参考文献
- Patsoukis, N., et al. PD-1 alters T-cell metabolic reprogramming by inhibiting glycolysis and promoting lipolysis and fatty acid oxidation. Nat Commun. 6, 6692 (2015).
- Scharping, N. E., et al. Mitochondrial stress induced by continuous stimulation under hypoxia rapidly drives T cell exhaustion. Nat Immunol. 22, 205-215 (2021).
- Schurich, A., et al. Distinct Metabolic Requirements of Exhausted and Functional Virus-Specific CD8 T Cells in the Same Host. Cell Rep. 16 (5), 1243-1252 (2016).
- Zhang, L., Romero, P. Metabolic control of CD8(+) T cell fate decisions and antitumor immunity. Trends Mol Med. 24 (1), 30-48 (2018).
- Batabyal, R., et al. Metabolic dysfunction and immunometabolism in COVID-19 pathophysiology and therapeutics. Int J Obes (Lond). 45 (6), 1163-1169 (2021).
- Chavakis, T. Immunometabolism: Where immunology and metabolism meet. J Innate Immun. 14, 1-3 (2022).
- Frezza, C., Mauro, C. Editorial: The metabolic challenges of immune cells in health and disease. Front Immunol. 6, 293 (2015).
- Wang, X., Ping, F. F., Bakht, S., Ling, J., Hassan, W. Immunometabolism features of metabolic deregulation and cancer. J Cell Mol Med. 23 (2), 694-701 (2019).
- Turner, J. A., et al. Lysophosphatidic acid modulates CD8 T cell immunosurveillance, metabolism, and anti-tumor immunity. Nat Commun. 14, 3214 (2023).
- Coussens, L. M., Werb, Z. Inflammation and cancer. Nature. 420, 860-867 (2002).
- Jiang, Y., Li, Y., Zhu, B. T-cell exhaustion in the tumor microenvironment. Cell Death Dis. 6 (6), e1792 (2015).
- Krangel, M. S. Mechanics of T cell receptor gene rearrangement. Curr Opin Immunol. 21 (2), 133-139 (2009).
- Barber, D. L., et al. Restoring function in exhausted CD8 T cells during chronic viral infection. Nature. 439, 682-687 (2006).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Bengsch, B., et al. Bioenergetic insufficiencies due to metabolic alterations regulated by the inhibitory receptor PD-1 are an early driver of CD8(+) T cell exhaustion. Immunity. 45 (2), 358-373 (2016).
- Blank, C. U., et al. Defining 'T cell exhaustion'. Nat Rev Immunol. 19, 665-674 (2019).
- Dolina, J. S., Van Braeckel-Budimir, N., Thomas, G. D., Salek-Ardakani, S. CD8(+) T cell exhaustion in cancer. Front Immunol. 12, 715234 (2021).
- Mognol, G. P., et al. Exhaustion-associated regulatory regions in CD8(+) tumor-infiltrating T cells. Proc Natl Acad Sci U S A. 114 (13), E2776-E2785 (2017).
- Wang, D., et al. A comprehensive profile of TCF1(+) progenitor and TCF1(-) terminally exhausted PD-1(+)CD8(+) T cells in head and neck squamous cell carcinoma: implications for prognosis and immunotherapy. Int J Oral Sci. 14 (1), 8 (2022).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21, 1022-1033 (2020).
- Kang, S., Brown, H. M., Hwang, S. Direct antiviral mechanisms of interferon-gamma. Immune Netw. 18 (5), e33 (2018).
- Samuel, C. E. Antiviral actions of interferons. Clin Microbiol Rev. 14, 778-809 (2001).
- Schellekens, H., Weimar, W., Cantell, K., Stitz, L. Antiviral effect of interferon in vivo may be mediated by the host. Nature. 278, 742 (1979).
- Radoja, S., et al. CD8(+) tumor-infiltrating T cells are deficient in perforin-mediated cytolytic activity due to defective microtubule-organizing center mobilization and lytic granule exocytosis. J Immunol. 167 (9), 5042-5051 (2001).
- van der Windt, G. J., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Balmer, M. L., et al. Memory CD8(+) T cells require increased concentrations of acetate induced by stress for optimal function. Immunity. 44 (6), 1312-1324 (2016).
- Pereira, R. M., Hogan, P. G., Rao, A., Martinez, G. J. Transcriptional and epigenetic regulation of T cell hyporesponsiveness. J Leukoc Biol. 102, 601-615 (2017).
- Sen, D. R., et al. The epigenetic landscape of T cell exhaustion. Science. 354, 1165-1169 (2016).
- Quintana, A., et al. T cell activation requires mitochondrial translocation to the immunological synapse. Proc Natl Acad Sci U S A. 104 (36), 14418-14423 (2007).
- Brindley, D. N. Lysophosphatidic acid signaling in cancer. Cancers (Basel). 12 (12), 3791 (2020).
- Chae, C. S., et al. Tumor-derived lysophosphatidic acid blunts protective type I interferon responses in ovarian cancer. Cancer Discov. 12, 1904-1921 (2022).
- Kremer, K. N., et al. LPA suppresses T cell function by altering the cytoskeleton and disrupting immune synapse formation. Proc Natl Acad Sci U S A. 119 (15), e2118816119 (2022).
- Mathew, D., et al. LPA5 is an inhibitory receptor that suppresses CD8 T-cell cytotoxic function via disruption of early TCR signaling. Front Immunol. 10, 1159 (2019).
- Mathew, D., Torres, R. M. Lysophosphatidic acid is an inflammatory lipid exploited by cancers for immune evasion via mechanisms similar and distinct from CTLA-4 and PD-1. Front Immunol. 11, 531910 (2020).
- Oda, S. K., et al. Lysophosphatidic acid inhibits CD8 T cell activation and control of tumor progression. Cancer Immunol Res. 1 (4), 245-255 (2013).
- Lidgerwood, G. E., Pitson, S. M., Bonder, C., Pebay, A. Roles of lysophosphatidic acid and sphingosine-1-phosphate in stem cell biology. Prog Lipid Res. 72, 42-54 (2018).
- Torres, R. M., Turner, J. A., D'Antonio, M., Pelanda, R., Kremer, K. N. Regulation of CD8 T-cell signaling, metabolism, and cytotoxic activity by extracellular lysophosphatidic acid. Immunol Rev. 317 (1), 203-222 (2023).
- Turner, J. A., et al. BRAF modulates lipid use and accumulation. Cancers (Basel). 14 (9), 2110 (2022).
- Hogquist, K. A., et al. T cell receptor antagonist peptides induce positive selection. Cell. 76, 17-27 (1994).
- Li, Y., Kurlander, R. J. Comparison of anti-CD3 and anti-CD28-coated beads with soluble anti-CD3 for expanding human T cells: differing impact on CD8 T cell phenotype and responsiveness to restimulation. J Transl Med. 8, 104 (2010).
- Ralli, M., et al. Immunotherapy in the treatment of metastatic melanoma: current knowledge and future directions. J Immunol Res. 2020, 9235638 (2020).
- Philip, M., Schietinger, A. CD8(+) T cell differentiation and dysfunction in cancer. Nat Rev Immunol. 22, 209-223 (2022).
- Bajrai, L. H., et al. Understanding the role of potential pathways and its components including hypoxia and immune system in case of oral cancer. Sci Rep. 11, 19576 (2021).
- Nicholls, D. G. Mitochondrial proton leaks and uncoupling proteins. Biochim Biophys Acta Bioenerg. 1862, 148428 (2021).
- Tyrakis, P. A., et al. S-2-hydroxyglutarate regulates CD8(+) T-lymphocyte fate. Nature. 540, 236-241 (2016).
- Guo, Y., et al. Metabolic reprogramming of terminally exhausted CD8(+) T cells by IL-10 enhances anti-tumor immunity. Nat Immunol. 22, 746-756 (2021).
- Notarangelo, G., et al. Oncometabolite d-2HG alters T cell metabolism to impair CD8(+) T cell function. Science. 377 (6614), 1519-1529 (2022).
- Yang, K., et al. T cell exit from quiescence and differentiation into Th2 cells depend on Raptor-mTORC1-mediated metabolic reprogramming. Immunity. 39 (6), 1043-1056 (2013).
- Ricciardi, S., et al. The translational machinery of human CD4(+) T cells is poised for activation and controls the switch from quiescence to metabolic remodeling. Cell Metab. 28 (6), 895-906.e5 (2018).
- Moller, S. H., Hsueh, P. C., Yu, Y. R., Zhang, L., Ho, P. C. Metabolic programs tailor T cell immunity in viral infection, cancer, and aging. Cell Metab. 34 (3), 378-395 (2022).
- Alrubayyi, A., et al. Functional restoration of exhausted CD8 T cells in chronic HIV-1 infection by targeting mitochondrial dysfunction. Front Immunol. 13, 908697 (2022).
- Vignali, P. D. A., et al. Hypoxia drives CD39-dependent suppressor function in exhausted T cells to limit antitumor immunity. Nat Immunol. 24, 267-279 (2023).
- Ogando, J., et al. PD-1 signaling affects cristae morphology and leads to mitochondrial dysfunction in human CD8(+) T lymphocytes. J Immunother Cancer. 7 (1), 151 (2019).
- Billingham, L. K., et al. Mitochondrial electron transport chain is necessary for NLRP3 inflammasome activation. Nat Immunol. 23, 692-704 (2022).
- Eberhardt, D. R., et al. EFHD1 ablation inhibits cardiac mitoflash activation and protects cardiomyocytes from ischemia. J Mol Cell Cardiol. 167, 1-14 (2022).
- Hou, T., et al. Identification of EFHD1 as a novel Ca(2+) sensor for mitoflash activation. Cell Calcium. 59 (5), 262-270 (2016).
- Mun, S. A., et al. Structural and biochemical characterization of EFhd1/Swiprosin-2, an actin-binding protein in mitochondria. Front Cell Dev Biol. 8, 628222 (2020).
- Stein, M., et al. A defined metabolic state in pre B cells governs B-cell development and is counterbalanced by Swiprosin-2/EFhd1. Cell Death Differ. 24 (7), 1239-1252 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved