Method Article
Misurazione della funzione mitocondriale delle cellule T CD8 naive ed effettrici
In questo articolo
Riepilogo
La bioenergetica delle cellule T CD8 può essere interrogata utilizzando il Mito Stress Test. Questa metodologia può essere utilizzata per studiare la programmazione metabolica acuta e cronica. Questo protocollo descrive gli approcci per esaminare le relazioni tra la biologia del recettore delle cellule T e l'analisi bioenergetica.
Abstract
Comprendere come l'immunometabolismo influisce sulla funzione, la differenziazione e il destino dei linfociti ha suscitato notevole interesse e attenzione. La biologia dei linfociti è stata esplorata utilizzando l'analisi bioenergetica ed è ora diventata uno strumento di importanza critica nel campo. Pertanto, abbiamo cercato di ottimizzare un saggio di analisi bioenergetica che può essere adattato con pretrattamenti e iniezione acuta per la stimolazione dei recettori. Qui, abbiamo valutato il metabolismo ex vivo delle cellule T CD8 utilizzando il Cell Mito Stress Test per valutare i tassi di consumo di ossigeno e acidificazione extracellulare nelle cellule T CD8 naive ed effettrici. Le cellule T effettrici antigene-specifiche CD8 sono state derivate tramite stimolazione ex vivo e le cellule T CD8 naive sono state raccolte dagli splenociti e isolate con la separazione della colonna magnetica delle biglie .
I pretrattamenti vengono eseguiti in micropiastre e vengono descritte in dettaglio come preparare le cartucce dei sensori. Mostriamo come le porte di iniezione possono essere caricate con farmaci per misurare indirettamente le capacità metaboliche e con modulatori metabolici, questo protocollo può essere utilizzato per studiare l'attività enzimatica specifica. Le stimolazioni del recettore delle cellule T possono essere studiate in tempo reale con iniezione acuta e stimolazione con anti-CD3/CD28 utilizzando le porte di iniezione. Gli analizzatori strumentali vengono utilizzati per le misurazioni e la raccolta e la visualizzazione dei dati viene eseguita con programmi software per interpretare il metabolismo cellulare. Questa strategia produce un'ampia quantità di dati sulla biologia delle cellule immunitarie e sulla bioenergetica mitocondriale, consentendo ai ricercatori di personalizzare il protocollo in numerosi modi per esplorare il metabolismo delle cellule T CD8.
Introduzione
Il destino e la funzionalità delle cellule immunitarie sono significativamente influenzati dal metabolismo, dal consumo ossidativo e dalla respirazione anaerobica 1,2,3,4. Recentemente, c'è stato un crescente interesse nel mirare alla modulazione metabolica come strategia per riprogrammare o rinvigorire il destino delle cellule T CD8 e la funzione effettrice e migliorare la clearance virale o migliorare l'immunità antitumorale endogena 5,6,7,8,9. In particolare, la segnalazione del recettore dell'antigene attraverso il recettore delle cellule T (TCR) è un requisito chiave per la differenziazione delle cellule T CD8 con conseguente segnalazione e attivazione a valle 10,11,12 (Figura 1). L'esposizione prolungata agli insulti immunologici provoca una stimolazione persistente antigene-specifica sul TCR, che alla fine porta a stati di infiammazione cronica, affaticamento delle cellule T, un rimodellamento del microambiente immunitario e fuga immunitaria 11,13,14,15,16,17,18,19.
Il metabolismo delle cellule T CD8 esaurite è fondamentalmente distinto da quello delle cellule T effettrici funzionali CD8 2,3,14,15,18,20. La differenziazione delle cellule T, la secrezione di interferone γ (IFNγ) e la capacità di richiamo sono, in parte, determinate dalla funzione mitocondriale e dai prodotti di degradazione dell'ossidazione β. Le cellule T IFNγ+ CD8 sono componenti fondamentali delle risposte immunitarie sia antitumorali che antivirali 21,22,23. Il flusso metabolico specifico attraverso la glicolisi e la catena di trasporto degli elettroni è importante per l'attivazione delle cellule T CD8, la secrezione di citochine e le risposte alla memoria 4,11,13,15,18,24,25,26,27,28 . Le risposte ottimali, tra cui l'attivazione delle cellule T e la differenziazione degli effettori, richiedono una risposta mitocondriale coordinata e specifica, mentre i difetti mitocondriali e l'eccesso di specie reattive dell'ossigeno (ROS) caratterizzano le cellule T esauste o disfunzionali 9,29. Recentemente, la stimolazione persistente del TCR delle cellule T CD8 in vitro promuove la differenziazione esaustiva delle cellule T CD8 in parte inducendo stress ossidativo e riprogrammando il metabolismo ossidativo e le capacità metaboliche necessarie per la proliferazione delle cellule T 1,2,13,20,24,29 . Nel complesso, gli assi di controllo metabolico sono componenti fondamentali nel dirigere la differenziazione delle cellule T CD8 e la loro progressione verso fenotipi effettori, di memoria o esausti/disfunzionali.
I composti metabolici dirigono anche le risposte delle cellule immunitarie funzionando come molecole di segnalazione autocrine o paracrine 9,30,31,32,33,34,35. La sfingosina-1-fosfato (S1P) e l'acido lisofosfatidico (LPA) sono lipidi bioattivi e infiammatori che segnalano attraverso i recettori accoppiati a proteine G (GPCR) di modulare l'uscita dei linfociti e la citotossicità da parte delle cellule T CD836. La segnalazione LPA tramite i recettori LPA GPCR sulle cellule T CD8 riprogramma il metabolismo per aumentare la lipolisi, l'ossidazione degli acidi grassi e la perdita di protoni9. Nel complesso, la bioenergetica e il metabolismo delle cellule T CD8 sono in gran parte guidati dalla disponibilità di substrati, dagli stimoli ambientali e dai requisiti energetici.
Le metodologie per interrogare il metabolismo delle cellule T CD8 sono diventate sempre più importanti. Il Cell Mito Stress Test fornisce una valutazione completa della bioenergetica ed è ora riconosciuto come una tecnica distintiva nel campo dell'immunometabolismo e dell'energetica delle cellule T CD8 9,37. Le cellule aderenti sono state storicamente utilizzate per il test da sforzo Mito38; tuttavia, c'è un crescente interesse nell'applicazione di questo protocollo per le cellule coltivate in sospensione e in particolare nell'utilizzo di cellule immunitarie per il test da sforzo Cell Mito. Qui, presentiamo un protocollo dettagliato per misurare l'attività metabolica delle cellule T CD8 basato sulla nostra recente pubblicazione9. Forniamo una spiegazione dettagliata dell'espansione delle cellule T CD8, dell'isolamento naive delle cellule T CD8, della preparazione del test e del trattamento con protocolli sia per i pretrattamenti che per le iniezioni acute nel test da sforzo Cell Mito. È importante sottolineare che confrontiamo e contrastiamo diversi metodi per la stimolazione del TCR e l'attivazione delle cellule T CD8, inclusa la stimolazione policlonale e antigene-specifica del TCR.
Questo protocollo descrive in dettaglio la stimolazione antigene-specifica utilizzando topi transgenici OT-I (un classico modello murino transgenico) per i quali tutte le cellule T di topo esprimono gli stessi geni Vα2 e Vβ5 39. Le cellule T CD8 di topo OT-I ospitano tutte lo stesso TCR che è specifico contro l'ovoalbumina octapeptide (OVA257-264 scritto anche come sequenza di aminoacidi SIINFEKL o N4, un epitopo ampiamente studiato che, dopo la presentazione da parte del complesso maggiore di istocompatibilità (MHC) di classe I, attiva le cellule T CD8 citotossiche39 (Figura 1A). Nel complesso, il modello murino transgenico OT-I è ampiamente utilizzato dagli immunologi per studiare la segnalazione TCR e la funzione effettrice delle cellule T antigene-specifiche. A differenza dell'attivazione monoclonale con il modello murino OT-I, le cellule T policlonali CD8 possono essere generate con anticorpi anti-CD3/CD28 contro le subunità CD3 del TCR e la molecolaco-stimolatrice CD28 40 (Figura 1B). Gli anticorpi anti-CD3/CD28 bypassano la componente antigene-specifica della segnalazione TCR per attivare una popolazione policlonale di cellule T40. In definitiva, i risultati descritti in questo rapporto confrontano più metodi per l'utilizzo del Cell Mito Stress Test per quantificare il flusso metabolico dinamico nelle cellule T CD8.
Protocollo
I topi sono stati tenuti in un ambiente privo di agenti patogeni e mantenuti secondo gli standard e i regolamenti del Comitato istituzionale per la cura e l'uso degli animali.
1. Generazione ed espansione di cellule T CD8 tramite stimolazione antigene-specifica
- Il primo giorno, prelevare gli splenociti derivati da topi OT-I; quindi, prepararli e attivarli in vitro con il peptide SIINFEKL (4).
- Pulisci lo spazio della cappa, prepara i reagenti e raccogli il mezzo del mouse. Riscalda il supporto del mouse in un'incubatrice ad acqua o a perline.
- In una piastra a 6 pozzetti, inserire 7 mL di terreno di coltura per topi in un pozzetto e poi altri 3 mL di terreno di coltura per topo in un pozzetto diverso. Successivamente, inserire un colino nel pozzetto contenente 7 ml di terreno.
- Porta un topo in laboratorio dal vivaio in una gabbia di trasferimento. Trasferire il mouse in una nuova gabbia vuota e posizionare l'adattatore CO2 sulla parte superiore. Eutanasia del topo con CO2 fino a un livello di flusso di 2,75.
- Osserva attentamente il mouse e osserva eventuali segni di angoscia. Dopo l'ultimo respiro, osservare i segni di respirazione e di vita per almeno 1 minuto. Spegnere la CO2 ed eseguire la lussazione cervicale come metodo secondario di eutanasia. Quindi, pulire il piano di lavoro, la gabbia e il resto dell'area di lavoro e portare il mouse alla cappa di dissezione.
- Sezionare la milza dal topo.
- Utilizzare etanolo al 70% per sterilizzare l'attrezzatura di dissezione e, posizionando il mouse con il lato sinistro rivolto verso il basso, spruzzare il lato sinistro del mouse per disinfettarlo.
- Utilizzando strumenti puliti, sezionare per rimuovere la pelle e identificare il peritoneo. Fai una piccola incisione attraverso il peritoneo per trovare la milza e poi asporta la milza. Metti la milza nella piastra a 6 pozzetti sopra il colino.
- Pulisci l'area, metti la carcassa del topo in un sacchetto per lo smaltimento, quindi metti il sacchetto in un congelatore per lo smaltimento.
- Assicurarsi che l'intera area sia pulita e spostare la piastra a 6 pozzetti nella cappa di coltura tissutale per i passaggi successivi.
- Nella cappa di coltura tissutale, omogeneizzare la milza e risospendere le cellule in una sospensione unicellulare senza grumi.
- Spingere la milza attraverso il colino nel pozzetto con 7 mL di terreno con lo stantuffo di una siringa da 5 mL.
- Sciacquare il colino e l'eventuale tessuto residuo utilizzando 3 ml di terreno nel pozzetto aggiuntivo.
- Trasferire la sospensione cellulare con una pipetta sierologica in una nuova provetta conica da 10 mL.
- Centrifugare per 5 minuti a 500 × g e aspirare il surnatante utilizzando una pipetta di vetro.
- Lisi dei globuli rossi.
- Iniziare il processo di lisi dei globuli rossi utilizzando 1 mL di tampone di lisi ACK risospendendo le cellule nel tampone di lisi ACK e incubando a temperatura ambiente per 1-5 minuti.
NOTA: Il tempo di incubazione deve essere ottimizzato in base al lotto specifico di tampone di lisi ACK per ottenere la massima lisi dei globuli rossi con la minima morte degli splenociti. - Aggiungere 10 mL di terreno alla provetta conica per la neutralizzazione e centrifugare per 5 minuti a 500 × g.
- Risospendere le cellule in 50 mL di terreno e trasferirle in un matraccio T75.
- Iniziare il processo di lisi dei globuli rossi utilizzando 1 mL di tampone di lisi ACK risospendendo le cellule nel tampone di lisi ACK e incubando a temperatura ambiente per 1-5 minuti.
- Stimolare le cellule con il peptide SIINFEKL (N4).
- Portare il peptide SIINFEKL nella cappa di coltura tissutale. Conservare il peptide SIINFEKL a -20 °C.
- Aggiungere SIINFEKL direttamente al terreno per ottenere una concentrazione finale di 2 μg/mL. Aggiungere 50 μL di SIINFEKL (2 mg/mL) a 50 mL di terreno per ottenere una concentrazione finale di 2 μg/mL.
- Incubare le cellule a 37 °C per 72 h.
- Igienizzare la cappa di coltura tissutale utilizzando etanolo al 70%.
- Pulisci lo spazio della cappa, prepara i reagenti e raccogli il mezzo del mouse. Riscalda il supporto del mouse in un'incubatrice ad acqua o a perline.
- Il quarto giorno, lavare le cellule per rimuovere il peptide. Utilizzando terreni appena preparati e integrati con IL-2, risospendere le cellule e quindi rimettere il pallone nell'incubatore.
- Raccogliere le cellule dal pallone di coltura tissutale T75 in una provetta conica da 50 mL. Centrifugare e pellettare le cellule T OT-I CD8 e quindi rimuovere il terreno in eccesso con l'aspirazione. Aggiungere 50 mL di nuovo terreno di coltura murina contenente 1.000 U/mL di IL-2 e trasferire le cellule in un nuovo matraccio T75.
- Per la conservazione, conservare le aliquote del brodo di IL-2 in congelatore a -80 °C. La conservazione a -80 °C riduce al minimo la degradazione dei peptidi.
- Preparare cellule T CD8 citotossiche antigene-specifiche espanse per il test della funzione mitocondriale
- Il settimo giorno viene eseguito il test della funzione mitocondriale. Preparare la cellula T CD8 OT-I antigene-specifica per il test.
- Raccogli le cellule T CD8 vive.
- Trasferire le cellule dal pallone di coltura tissutale T-75 in una nuova provetta conica da 50 mL. Quindi, centrifugare la provetta conica per 5 minuti a 500 × g.
- In una nuova provetta conica da 50 mL, pipettare 20 mL di un mezzo a gradiente di densità (densità = 1,077 g/mL) mentre le cellule stanno ruotando.
- Una volta completata la centrifugazione, prendere la provetta conica e utilizzando 10 mL di terreno, risospendere le cellule. Quindi, pipettando molto lentamente, sovrapporre le cellule risospese sopra il gradiente di densità. Senza disturbare la pendenza, centrifugare il tubo conico a 1.300 × g per 20 minuti a temperatura ambiente con l'impostazione impostata su massima accelerazione e minima decelerazione senza freno.
- Al termine della centrifugazione, utilizzare una pipetta P1000 per raccogliere lo strato intermedio di cellule T. Visualizzare lo strato cellulare e assicurarsi che la pipetta rimanga al di sopra e non disturbi lo strato. Trasferire le cellule raccolte in una provetta conica fresca da 50 mL contenente 30 mL di terreno di coltura murina completo. Quindi, centrifugare la provetta conica da 50 mL a 500 × g per 5 minuti. Al termine della centrifugazione, aspirare il surnatante in eccesso dalle cellule T CD8 OT-I. Con 20 mL di terreno fresco di topo, risospendere le cellule.
- Utilizzando un emocitometro, contare il numero totale di cellule vitali. Colorare una piccola aliquota di cellule con blu di tripano in una diluizione 1:4 per identificare le cellule morte.
NOTA: Da un topo OT-I ci si possono aspettare circa 40-60 × 106 cellule. - Con un'ulteriore fase di centrifugazione, lavare le cellule rimanenti con altri 20 mL di terreno fresco per topo. Quindi, utilizzando una micropiastra, pipettare le cellule 200.000 cellule/pozzetto in un terreno di topo completo.
2. Generazione ed espansione di cellule T CD8 poli-specifiche tramite stimolazione anti-CD3/anti-CD28
- Il giorno 0, rivestire una piastra a 24 pozzetti in CD3. Aggiungere 1 mL di anti-CD3-biotina a una concentrazione di 5 μg/mL, diluito in PBS, a ciascun pozzetto di una piastra a 24 pozzetti. Mettere la piastra in un'incubatrice umidificata al 5% di CO2 per una notte.
- Il giorno successivo, raccogli un topo e raccogli gli splenociti. Attivare gli splenociti in vitro con anti-CD3/anti-CD28 seguendo i passaggi 1.1.1-1.1.5.3.
- Utilizzando il protocollo di separazione delle biglie magnetiche, isolare le cellule T CD8.
NOTA: Assicurarsi che le celle siano mantenute fredde. In condizioni di pre-raffreddamento, lavorare rapidamente.- Utilizzando 40 μL di tampone MACS, risospendere le cellule con 10.000.000 di cellule per 40 μL di tampone MACS. Nella soluzione, miscelare accuratamente 10 μL di cocktail di anticorpi biotina nella soluzione cellulare e quindi incubare per 5 minuti a 4 °C.
- In attesa che la cella incubi in frigorifero, preparare una colonna per la selezione positiva. Utilizzare 3 ml di tampone per lavare la colonna e quindi scartare il flusso di scarto.
- Dopo 5 minuti, raccogliere la soluzione di anticorpi cellulari dal frigorifero e aggiungere 30 μL di tampone MACS per 10.000.000 di cellule, 20 μL di anti-biotina, quindi incubare a 4 °C per altri 10 minuti.
- Preparare una nuova provetta di raccolta sotto una colonna di selezione positiva utilizzando una provetta conica fresca da 15 mL. Una volta completata l'incubazione di 10 minuti, trasferire la sospensione cellulare nella colonna di selezione positiva. In una provetta conica fresca da 15 mL, raccogliere il flusso. Utilizzando 3 mL di tampone MACS, lavare la colonna per raccogliere le cellule residue.
NOTA: Assicurarsi che la sospensione della cella abbia un volume minimo di 0,5 mL. - Riplaccare le cellule T CD8 selezionate positivamente nella piastra a 24 pozzetti per la stimolazione anti-CD3/anti-CD28.
- Centrifugare il flusso a 500 × g per 5 minuti a 4 °C. Aspirare il surnatante in eccesso e pipettare le cellule per risospenderle in soluzione. Usando un ematocitometro e il blu di tripano, contare le cellule.
NOTA: Si prega di aspettarsi che vengano contate ~8-10 ×10 6 cellule vive per milza di topo. - Dopo aver contato le cellule, risospendere le cellule T CD8 a 500.000 cellule per mL. Quindi, aspirare con cautela 1 mL di PBS dalla piastra a 24 pozzetti, riplaccare le cellule contate nella piastra a 24 pozzetti e aggiungere 106 cellule per pozzetto.
- Per stimolare le cellule, pipettare l'anti-CD28 nella piastra a 24 pozzetti in modo che la concentrazione finale di anti-CD28 sia di 2 μg/mL. Per mescolare le cellule, picchiettare con cautela la piastra. Mantenere le celle a 37 °C per le successive 72 ore.
- Centrifugare il flusso a 500 × g per 5 minuti a 4 °C. Aspirare il surnatante in eccesso e pipettare le cellule per risospenderle in soluzione. Usando un ematocitometro e il blu di tripano, contare le cellule.
- Utilizzando etanolo al 70%, pulire la cappa di coltura tissutale.
- Il giorno 4 (72 ore dopo), rimuovere le cellule dalla stimolazione anti-CD3/anti-CD28. Lavare le cellule centrifugando le cellule T policlonali CD8. Rimuovere il surnatante in eccesso mediante aspirazione e quindi risospendere le cellule con terreno di topo fresco con 1.000 unità/mL di IL-2 con 10 mL di terreno. Trasferire le cellule risospese in una nuova piastra a 6 pozzetti e posizionarla nell'incubatore.
NOTA: 1.2.2. Per la conservazione, le aliquote della pasta di IL-2 possono essere conservate in un congelatore a -80 °C. La conservazione a -80 °C riduce al minimo la degradazione dei peptidi. - Preparare le cellule T CD8 effettrici policlonali espanse per il test della funzione mitocondriale.
- Il settimo giorno, preparare ed elaborare le cellule T CD8 policlonali per il test.
- Raccogli le cellule T CD8 vive.
- Trasferire le cellule dalla piastra a 6 pozzetti in una provetta conica pulita utilizzando una pipetta, quindi centrifugare le cellule per 5 minuti a 500 × g.
- Seguire i passaggi 1.3.3.2-1.3.4.
NOTA: Ci si può aspettare circa 10-30 milioni di cellule T CD8 vive da un singolo topo C57BL/6. - Conservare un'aliquota di cellule per la citometria a flusso per valutare la purezza del CD8. Per la citometria a flusso, colorare le cellule sul ghiaccio per 20 minuti con un colorante vitale a scelta9.
3. Raccogli le cellule T CD8 naive
- Il settimo giorno, prelevare gli splenociti da un topo seguendo i passaggi 1.1.1-1.1.5.3.
- Eseguire l'isolamento delle cellule T CD8 utilizzando il protocollo basato su biglie magnetiche descritto nei passaggi 2.3-2.3.5.1.
- Piastra di cellule T CD8 nella micropiastra a 200.000 cellule/pozzetto in terreno completo.
4. Eseguire il test della funzione mitocondriale
- Preparare i materiali il giorno prima di eseguire il test di funzionalità mitocondriale.
- Idratare la cartuccia del sensore.
- Versare 200 μL di acqua distillata in ciascun pozzetto della piastra di servizio. Posizionare la cartuccia del sensore sopra la piastra di servizio. Verificare che le estremità della cartuccia del sensore siano immerse per garantire una corretta idratazione. Mettere sia la cartuccia del sensore che la piastra di servizio in un incubatore senza CO2 a 37 °C per un minimo di 10 ore.
- Preparare una provetta conica da 50 mL con 50 mL di Calbrant e metterla in un incubatore non CO2 e incubare per una notte.
- Il giorno prima del saggio, preparare il terreno fresco completo in preparazione per il saggio. In un totale di 50 mL preparare una soluzione di 1 mM di piruvato, 2 mM di glutammina e 10 mM di glucosio nel terreno di analisi.
- Idratare la cartuccia del sensore.
- Eseguire il test della funzione mitocondriale il giorno successivo.
- Rimuovere l'acqua distillata dalla piastra di servizio muovendola. Reidratare con 200 μl di calibrante. Utilizzare il calibrante che è stato conservato nell'incubatore non CO2 durante la notte. Dopo aver sostituito la cartuccia del sensore sulla parte superiore della piastra di servizio. Riposizionare la piastra di servizio con la cartuccia del sensore nell'incubatore senza CO2 .
NOTA: Per muovere la piastra, capovolgere rapidamente e rapidamente la piastra con un movimento fluido sopra il lavandino in modo che l'acqua distillata cada rapidamente dalla piastra.
- Rimuovere l'acqua distillata dalla piastra di servizio muovendola. Reidratare con 200 μl di calibrante. Utilizzare il calibrante che è stato conservato nell'incubatore non CO2 durante la notte. Dopo aver sostituito la cartuccia del sensore sulla parte superiore della piastra di servizio. Riposizionare la piastra di servizio con la cartuccia del sensore nell'incubatore senza CO2 .
- Preparare le cellule T CD8 come descritto sopra nelle sezioni 1-3.
- Utilizzando una pipetta multicanale, piastrate 200.000 cellule per pozzetto risospendendo 10 × 106 cellule in 4,5 mL di terreno completo e piastrando 90 μL per pozzetto. Quindi, aggiungere altri 90 μl di terreno designato per pozzetto durante il pretrattamento.
NOTA: Se non ci sono pretrattamenti, piastrate le cellule in 180 μL per pozzetto con una concentrazione finale di 200.000 cellule per pozzetto. Da questo punto in poi nel protocollo, mantenere la piastra a temperatura ambiente o nell'incubatore senza CO2 . La piastra non deve essere collocata in un incubatore al 5% di CO2 . Si noti che il volume finale della micropiastra sarà di 180 μl.
- Utilizzando una pipetta multicanale, piastrate 200.000 cellule per pozzetto risospendendo 10 × 106 cellule in 4,5 mL di terreno completo e piastrando 90 μL per pozzetto. Quindi, aggiungere altri 90 μl di terreno designato per pozzetto durante il pretrattamento.
- Preparare i pretrattamenti (compresa l'integrazione di lipidi o di altri metaboliti).
- Preparare il pretrattamento dei lipidi centrifugando il lipide liofilizzato dal congelatore utilizzando una mini centrifuga a rotazione rapida. Determinare le concentrazioni desiderate per il pretrattamento e preparare il pretrattamento lipidico a queste concentrazioni. Sonicare il lipide diluito per 30 minuti immediatamente prima dell'uso.
- Prepara cocktail lipidici.
- Determinare la concentrazione lipidica desiderata da utilizzare nel test di funzionalità mitocondriale.
- Preparare i lipidi a una concentrazione che sia 2 volte la concentrazione desiderata. Quindi, aggiungere la soluzione lipidica al volume esistente nella micropiastra per ottenere una diluizione 1:2. Completa questo aggiungendo 90 μl della soluzione lipidica direttamente ai 90 μl preesistenti. Il volume finale sarà di 180 μl (diluizione 1:2) per pozzetto.
NOTA: La Tabella 1 descrive in dettaglio un esempio di diagramma di una possibile configurazione e progettazione della piastra. Si consiglia di condurre il test con 5-6 repliche tecniche, incorporando cellule T CD8 effettrici sia naive che antigene-specifiche con e senza additivi lipidici. In particolare, questo protocollo è progettato per evitare la centrifugazione per ridurre al minimo l'interruzione cellulare. Poiché il test della funzione mitocondriale è altamente sensibile al numero di cellule, la riduzione della perdita cellulare è fondamentale. Invece della centrifugazione, le cellule vengono manipolate mediante flicking per preservarne l'integrità. - Pipetettare 180 μl di terreno completo in ogni angolo della piastra. Posizionare la micropiastra con cellule T CD8 in un incubatore non CO2 .
NOTA: Il tempo di incubazione varia a seconda della durata desiderata del pretrattamento. Per ridurre al minimo la morte cellulare, si raccomanda un massimo di 4 ore di pretrattamenti per le cellule T CD8. L'estensione eccessiva del tempo di pretrattamento può causare un'eccessiva morte cellulare, compromettendo l'accuratezza dei risultati.
- Preparare veleni e soluzioni per iniezioni acute.
- Utilizzando soluzioni madre, preparare una forma diluita di oligomicina. Creare una diluizione di oligomicina in 3 mL di terreno completo. In provette coniche da 15 mL, preparare con cautela veleni e iniezioni acute. Poiché i veleni sono sensibili alla luce, preparare queste soluzioni utilizzando tubi avvolti in carta stagnola per proteggerli dall'esposizione alla luce.
- In una provetta conica da 15 mL avvolta in un foglio di stagnola, diluire l'oligomicina in 3 mL di terreno completo in modo che la concentrazione finale sia di 2,5 μM dopo l'iniezione.
- In una seconda provetta conica da 15 mL avvolta in carta stagnola, diluire FCCP in 3 mL di terreno completo in modo che la concentrazione finale sia di 2,0 μM dopo l'iniezione.
- In una terza provetta conica da 15 mL avvolta in carta stagnola, creare soluzioni di rotenone e antimicina A in 3 mL di terreno completo per ottenere concentrazioni di 0,5 μM per entrambe le tossine dopo l'iniezione.
- Se il test viene eseguito con modulatori metabolici, farmaci o stimolazioni aggiuntivi, diluire questi agenti in un terreno completo. Se si prevede di utilizzare etomoxir o altri modulatori metabolici e farmaci, eseguire prima un test per testare la curva di titolazione e determinare la concentrazione ottimale per l'uso. Se si conduce una stimolazione TCR tramite iniezione acuta, il test può essere eseguito utilizzando biglie magnetiche anti-CD3/anti-CD28 o una combinazione di anti-CD3-biotina legata alla piastra con streptavidina anti-CD28.
NOTA: Per ulteriori descrizioni, fare riferimento alla sezione 5 che descrive il protocollo per la stimolazione del TCR con iniezione acuta anti-CD3/CD28.
- Rimuovere la cartuccia del sensore dall'incubatore senza CO2 . Utilizzando gli adattatori per piastre, pipettare i veleni nella cartuccia del sensore. Posizionare gli adattatori per piastre in modo che ogni camera possa essere caricata appositamente con veleni o altre iniezioni acute.
NOTA: Prestare attenzione durante il pipettaggio dei veleni.- Caricare i veleni nelle porte della cartuccia del sensore. Se non vengono eseguite ulteriori iniezioni, le porte A-C verranno caricate con veleni. Pipet 20 μL di oligomicina nella porta A, 22 μL di FCCP nella porta B, 25 μL di rotenone nella porta C e 25 μL di antimicina A nella porta C.
- Utilizzando soluzioni madre, preparare una forma diluita di oligomicina. Creare una diluizione di oligomicina in 3 mL di terreno completo. In provette coniche da 15 mL, preparare con cautela veleni e iniezioni acute. Poiché i veleni sono sensibili alla luce, preparare queste soluzioni utilizzando tubi avvolti in carta stagnola per proteggerli dall'esposizione alla luce.
- Un'ora prima di iniziare il test sullo strumento, inserire la micropiastra nell'incubatore senza CO2 .
- Prima di avviare lo strumento, aprire il software e calibrare lo strumento. Eseguire questa operazione 30 minuti prima di caricare la micropiastra nello strumento per garantire un ampio tempo per la calibrazione.
- Sul sistema software, etichettare i pozzetti e rivedere lo schema di iniezione.
- Durante la calibrazione, caricare la cartuccia del sensore nello strumento. Il software ti chiederà di completare l'inizializzazione e il controllo di qualità. La calibrazione valuterà il pH e l'O2 su ciascun pozzetto, che passerà o fallirà. Lo strumento riporterà i risultati sullo schermo con un segno di spunta o una "X".
5. Eseguire una versione modificata del test della funzione mitocondriale con stimolazione TCR in un esperimento separato con un'iniezione acuta anti-CD3/CD28
NOTA: Il test della funzione mitocondriale può essere eseguito con una simulazione del TCR acuto attraverso due diversi approcci: 1) utilizzando biglie magnetiche biotinilate anti-CD3 + anti-CD28 + streptavidina descritte nella fase 5.2 o 2) anti-CD3/CD28 descritte nella fase 5.3 Questi esperimenti separati funzionano entrambi per stimolare il TCR tramite un'iniezione acuta durante il test.
- Se si eseguono ulteriori iniezioni, preparare il test come descritto nel paragrafo 4 precedente. Modificare gli schemi di iniezione utilizzando la camera aggiuntiva per l'iniezione. In questo protocollo, gli anti-CD3/anti-CD28 sono caricati nella porta A della cartuccia del sensore. Quindi, caricare le altre porte in modo simile, con oligomicina nella porta B, FCCP nella porta C e rotenone e antimicina A nella porta D.
- Preparare e caricare i componenti biotinilati anti-CD3 + anti-CD28 + streptavidina.
- Pipettare 20 μL di anti-CD3 biotinilato a 10 μg/mL negli appositi pozzetti della cartuccia del sensore.
- Pipet 20 μL di anti-CD28 a 2 μg/mL + streptavidina a 20 μg/mL nei pozzetti designati nella cartuccia del sensore.
- Pipetta 20 μL di anti-CD3 biotinilato a 10 μg/mL + anti-CD28 a 2 μg/mL + streptavidina a 20 μg/mL nei pozzetti designati nella cartuccia del sensore.
- Assicurarsi che i pozzetti di controllo siano predisposti. Assicurarsi che ci siano pozzetti designati iniettati solo con terreno, biotinilato anti-CD3 da solo, anti-CD28 + streptavidina e biotinilato anti-CD3 + anti-CD28 + streptavidina.
- Utilizzando un rapporto perlina-cella 1:1, preparare e caricare le microsfere magnetiche anti-CD3/CD28.
- In una piastra con 200.000 celle per pozzetto, pipettare 5 μL di microsfere magnetiche nei pozzetti designati nella cartuccia del sensore.
- Preparare i pozzetti di controllo designati con terreni solo per iniezione.
- Regolare il volume dei veleni in modo che le concentrazioni finali post-iniezione siano: 2,5 μM per oligomicina, 2,0 μM per FCCP e 0,5 μM per rotenone e antimicina A.
- Assicurarsi che lo schema di iniezione sia modificato per riflettere i punti temporali aggiornati prima di caricare la micropiastra sullo strumento.
- Programma il software per eseguire la stimolazione acuta del TCR per un totale di 140 minuti. Entro questo lasso di tempo, modificare lo schema in modo che ci siano x10 misurazioni del punto temporale prima dell'iniezione di oligomicina.
Risultati
Le capacità metaboliche glicolitiche e ossidative possono essere misurate utilizzando un saggio funzionale mitocondriale che valuta le capacità mirando ai componenti della catena di trasporto degli elettroni in particolari punti temporali (Figura 2A). Diversi schemi di iniezione possono essere caricati sulle porte della cartuccia del sensore per modificare il test tradizionale e valutare la stimolazione acuta del TCR (Figura 2B, C). Il numero di cellule e la concentrazione del farmaco per i vari tipi di cellule devono essere ottimizzati prima di interpretare i risultati. Qui, questo rapporto descrive le condizioni che sono state ottimizzate per le cellule T CD8 (Figura 3A, B) con inibitori della catena di trasporto degli elettroni ottimizzati per misurare le capacità sia nelle cellule naive che in quelle effettrici (Figura 4A, B). È importante sottolineare che questo test può essere modificato per studiare la stimolazione del TCR sulle cellule T effettrici CD8 generate dalla stimolazione antigene-specifica o dalla stimolazione anti-CD3/CD28. Esaminiamo ulteriormente la risposta delle cellule T CD8 alla segnalazione lipidica bioattiva, in particolare con acido lisofosfatidico o LPA. Abbiamo determinato che le tendenze metaboliche in risposta alla segnalazione LPA (a 30 minuti, 2 ore o 4 ore prima del caricamento della micropiastra nello strumento analizzatore) erano simili in entrambe le cellule T CD8 attivate con stimolazione TCR antigene-specifica o policlonale (Figura 5A-D). Il tipo di stimolazione del TCR e il meccanismo di attivazione hanno portato a sottili differenze in cui le cellule metabolicamente energetiche sono state inizialmente generate con attivazione antigene-specifica (Figura 5E-L).
L'iniezione acuta di anti-CD3/CD28 su cellule T effettrici CD8 può stimolare acutamente il TCR con misurazioni in tempo reale. Gli anti-CD3, gli anti-CD28 biotinilati e la streptavidina possono essere utilizzati in aggregato per stimolare il TCR in un modello di iniezione acuta. Come metodo separato, le iniezioni acute possono essere eseguite con biglie magnetiche coniugate ad anti-CD3 e anti-CD28 in questo test bioenergetico per stimolare il TCR in tempo reale. Abbiamo adattato il modello per iniettare terreni biotinilati anti-CD3, anti-CD28 + streptavidina o un aggregato di anti-CD3 biotinilato + anti-CD28 + streptavidina su cellule T effettrici OT-I CD8 a metà tempo durante il test (Figura 6A, B). Abbiamo osservato la stimolazione con anti-CD3/CD28, che ha portato ad un aumento sia dell'OCR che dell'ECAR. Anche i segnali OCR ed ECAR erano elevati, ma non allo stesso livello degli anti-CD3/CD28, con il solo segnale anti-CD3 biotinilato. È importante sottolineare che troviamo tendenze metaboliche simili che sono paragonabili all'iniezione acuta di microsfere magnetiche anti-CD3/CD28 (Figura 6C-F). In sintesi, questi risultati mostrano con molteplici approcci e metodologie che il test della funzione mitocondriale è robusto e riproducibile per lo studio dell'immunometabolismo dei linfociti e, in particolare, delle cellule T CD8.

Figura 1: Attivazione del recettore delle cellule T con stimolazione antigene-specifica e policlonale. (A) Schema della segnalazione antigene-specifica con complesso maggiore di istocompatibilità (MHC) di classe I con peptide legato al recettore delle cellule T. (B) Rappresentazione dell'attivazione policlonale delle cellule T CD8 legando le subunità CD3 e la molecola costimolatoria CD28 con anticorpi anti-CD3/28. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Targeting farmacologico della catena di trasporto degli elettroni nel saggio della funzione mitocondriale. (A) Schema degli inibitori della catena di trasporto degli elettroni (rosso) utilizzati qui. (B,C) Per il test di funzionalità mitocondriale, le strategie di iniezione sulla cartuccia del sensore sono le seguenti: (B) approccio di iniezione tradizionale in cui l'oligomicina viene caricata nella porta A, FCCP nella porta B e rotenone e antimicina A nella porta C. (C) Il metodo di iniezione acuta prevede il posizionamento di iniezione acuta (anti-CD3/CD28) nella porta A, oligomicina nella porta B, FCCP nella porta C, e rotenone e antimicina A nella porta D. Abbreviazione: FCCP = 4-(trifluorometossi) fenil) carbonoidrazonoil dicianide. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Espressione superficiale di CD8 e CD44, vitalità e differenze metaboliche nelle cellule T CD8 generate dalla stimolazione anti-CD3 e anti-CD28 dopo il trattamento con LPA. (A) Le cellule T effettrici CD8 sono generate ex vivo stimolando le cellule T CD8 derivate dal topo con SIINFEKL (N4) e splenociti come cellule presentanti l'antigene o anti-CD3 e anti-CD28 su piastre. Il quarto giorno, l'IL-2 sostituisce gli stimoli iniziali, supportando la differenziazione e la proliferazione. Le cellule T CD8 effettrici omogenee del giorno 7 vengono quindi analizzate tramite citometria a flusso dopo la coltura in vitro . (B) Le cellule T vengono identificate mediante gating sullo stato dei linfociti e quindi sull'espressione di CD8+/CD44+ . Un'immagine rappresentativa mostra che il CD8 e il CD44 non sono influenzati dal trattamento con LPA. Questa cifra è stata modificata da Turner et al.9. Clicca qui per visualizzare una versione più grande di questa figura.
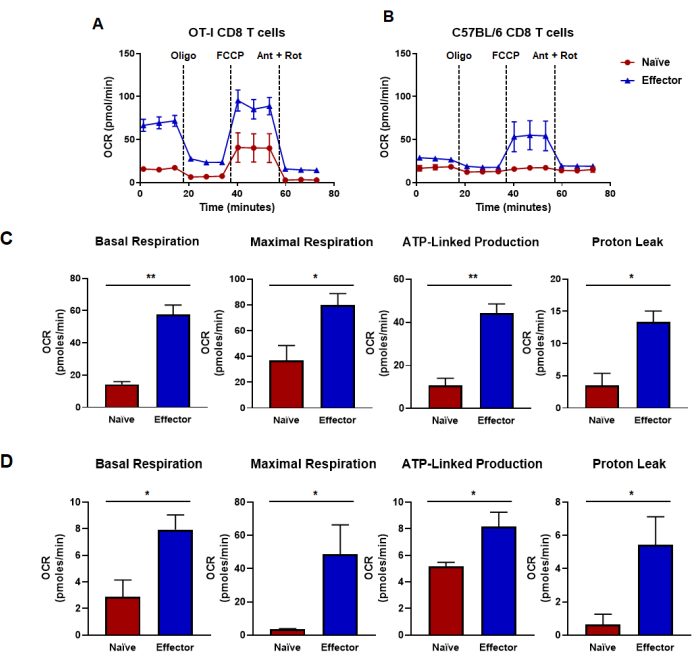
Figura 4: Capacità ossidative determinate dal tasso di consumo di ossigeno. (A,B) Tassi di consumo di ossigeno per cellule T CD8 naive ed effettrici generate da (A) stimolazione ed espansione antigene-specifica delle cellule T CD8 OT-I o (B) stimolazione policlonale anti-CD3/CD28 ed espansione di cellule T CD8 da topi C57B/6 wild-type. Oligomicina, FCCP, antimicina A e rotenone sono stati iniettati a intervalli di 18 minuti con 25 mM di terreno glucosio. I risultati sono mostrati come dati rappresentativi e sono stati ottenuti utilizzando n = 6 repliche tecniche. (C, D) Le metriche di capacità derivate dai saggi di flusso metabolico eseguiti nei pannelli (A,B) e mostrano la respirazione basale calcolata, la respirazione massima, la produzione legata all'ATP e la perdita di protoni. (C) Le capacità metaboliche sono state determinate dalle cellule T CD8 OT-I e corrispondono ai dati mostrati nel pannello (A). (D) Capacità metaboliche determinate da cellule T CD8 C57BL/6 e corrispondenti ai dati riportati nel pannello (B). L'analisi del t-test di Student non accoppiato è stata eseguita per l'intera cifra in cui *p < 0,05, **p < 0,005, ***p < 0,0005 e ****p < 0,0001. Abbreviazioni: OCR = Tasso di consumo di ossigeno; Oligo = oligomicina; FCCP = 4-(trifluorometossi) fenil) carbonoidrazonoil dicianide; formica = antimicina A; marciume = rotenone. Clicca qui per visualizzare una versione più grande di questa figura.
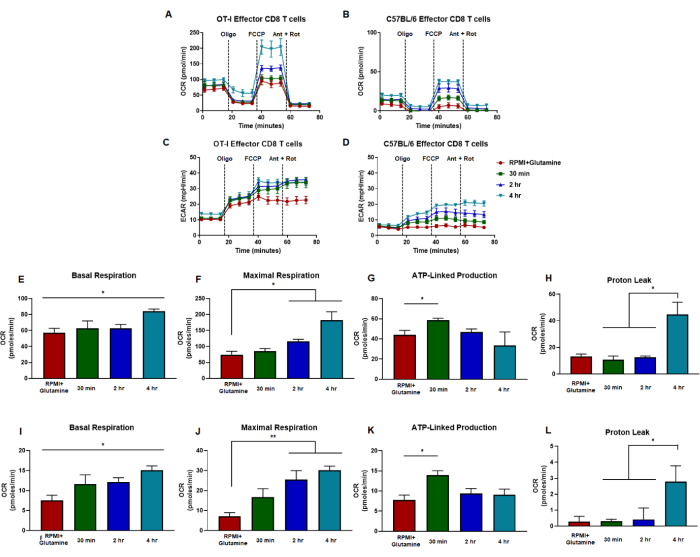
Figura 5: Tendenze simili nelle risposte delle cellule T CD8 effettrici alla segnalazione del recettore LPA indipendentemente dall'attivazione antigene-specifica o policlonale. (A,B) Il tasso di consumo di ossigeno delle cellule T CD8 è misurato da cellule generate da (A) stimolazione ed espansione antigene specifico delle cellule T CD8 OT-I o (B) stimolazione policlonale anti-CD3/CD28 ed espansione di cellule T CD8 da topi C57B/6 wild-type. (C, D) Le misurazioni del tasso di acidificazione extracellulare delle cellule T effettrici CD8 sono mostrate per le cellule generate da (C) stimolazione ed espansione specifica dell'antigene delle cellule T OT-I CD8 o (D) stimolazione policlonale anti-CD3/CD28 ed espansione delle cellule T CD8 da topi C57B/6 wild-type. Le capacità metaboliche delle cellule T CD8 sono state misurate in terreni integrati con glutammina (rosso) o 1 μM di LPA per 30 minuti (verde), 2 ore (blu) o 4 ore (verde). Oligomicina, FCCP, antimicina A e rotenone sono stati iniettati a intervalli di 18 minuti con 25 mM di terreno glucosio. I risultati sono mostrati come dati rappresentativi e sono stati ottenuti utilizzando n = 6 repliche tecniche. (E-H) Le metriche di capacità derivate dai saggi di flusso metabolico eseguiti in pannelli (A,C) e mostrano la respirazione basale calcolata, la respirazione massima, la produzione legata all'ATP e la perdita di protoni. (I-L) Calcoli di capacità da pannelli (B,D) che mostrano la respirazione basale, la respirazione massima, la produzione legata all'ATP e la perdita di protoni. L'intero dato è stato analizzato statisticamente utilizzando l'ANOVA unidirezionale dove *p < 0,05. Abbreviazioni: OCR = Tasso di consumo di ossigeno; ECAR = tasso di acidificazione extracellulare; Oligo = oligomicina; FCCP = 4-(trifluorometossi) fenil) carbonoidrazonoil dicianide; formica = antimicina A; marciume = rotenone. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Strategie per la stimolazione del recettore delle cellule T in tempo reale con iniezione acuta di anti-CD3/CD28. (A,B) Strategia di iniezione acuta che coinvolge anti-CD3 biotinilato, streptavidina e anti-CD28 per la valutazione della funzione mitocondriale. I pannelli mostrano le capacità metaboliche delle cellule T CD8 effettrici OT-I stimolate dall'antigene, mostrando in particolare (A) il tasso di acidificazione extracellulare e (B) il tasso di consumo di ossigeno. Le iniezioni utilizzano solo terreni (rosso), biotinilato anti-CD3 (verde), anti-CD28 + streptavidina (blu) o una combinazione di biotinilato anti-CD3 + anti-CD28 + streptavidina (verde acqua). (C, D) Iniezione acuta di biglie magnetiche coniugate con anti-CD3/CD28 per valutare l'attività mitocondriale. I pannelli mostrano le capacità metaboliche delle cellule T CD8 effettrici OT-I stimolate dall'antigene, mostrando in particolare (C) il tasso di acidificazione extracellulare e (D) il tasso di consumo di ossigeno. Le iniezioni utilizzano solo l'iniezione di terreno (rosso) o di microsfere anti-CD3/CD28 (verde acqua). I saggi sono stati eseguiti con iniezioni di oligomicina, FCCP, antimicina A e rotenone a intervalli di 18 minuti in terreni integrati con 25 mM di glucosio. I risultati sono mostrati come dati rappresentativi e sono stati ottenuti utilizzando n = 6 repliche tecniche. (E) Calcoli della capacità da pannelli (A-D) che mostrano il metabolismo basale prima dell'iniezione (rosso), la respirazione dopo l'iniezione (blu) e la capacità respiratoria massima (grigio). Le condizioni sono separate in base all'iniezione intra-dosaggio. (F) Calcoli della capacità che mostrino la respirazione basale, la respirazione massima, la produzione legata all'ATP e la perdita di protoni. Le statistiche per l'intera cifra sono state eseguite utilizzando l'ANOVA unidirezionale dove *p < 0,05, **p < 0,005, ***p < 0,0005 e ****p < 0,0001. Abbreviazioni: OCR = Tasso di consumo di ossigeno; ECAR = tasso di acidificazione extracellulare; Oligo = oligomicina; FCCP = 4-(trifluorometossi) fenil) carbonoidrazonoil dicianide; formica = antimicina A; marciume = rotenone. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
In questo articolo, descriviamo un protocollo per valutare la funzione mitocondriale delle cellule T CD8 naive ed effettrici. Descriviamo in dettaglio e confrontiamo i metodi per preparare cellule T CD8 antigene-specifiche e policlonali utilizzando topi OT-I e C57BL/6. I nostri risultati dimostrano che ci sono tendenze simili nel metabolismo nonostante il metodo di attivazione e pretrattamento nelle cellule T CD8. I dati rivelano che l'attivazione antigene-specifica porta a cellule T OT-I CD8 più metabolicamente attive rispetto alle loro controparti C57BL/6 wild-type stimolate con anti-CD3 e anti-CD28. Il protocollo qui descritto mostra che il test funzionale mitocondriale, il Mito Stress Test, è un test molto sensibile e costantemente ripetibile che produce risultati affidabili in diverse condizioni e tipi di cellule. I nostri risultati e il protocollo dettagliato contribuiscono al crescente riconoscimento di questo test come metodologia fondamentale per l'analisi del metabolismo delle cellule T CD8 e della bioenergetica.
Con l'avanzare dell'immunoterapia e di vari trattamenti cellulari, cresce anche l'importanza dell'applicazione di terapie mirate alle cellule T41. La risposta all'immunoterapia e le risposte immunitarie antitumorali si basano sul metabolismo mediato dalle cellule T, sulla segnalazione del calcio e sul flusso ossidativo innescato dall'attivazione del TCR a monte42. Sia l'efficienza metabolica che la flessibilità sono necessarie per risposte ottimali delle cellule T CD8 5,6,7,15,17,26,43, mentre l'aumento della perdita di protoni e il conseguente danno ossidativo compromettono le risposte delle cellule T e promuovono la disfunzione 9,44. Sia la proliferazione delle cellule T che la produzione di citochine possono essere salvate mitigando lo stress ossidativo mitocondriale 5,13,20,24,25,29. Nell'ambito dei nostri esperimenti, abbiamo utilizzato cellule T CD8 naive che sono coltivate in IL-2, che ne sostiene la vitalità; tuttavia, queste cellule T CD8 non sono probabilmente più equivalenti alle cellule T CD8 naive in buona fede. Pertanto, abbiamo scelto di utilizzare cellule T CD8 naive direttamente dal topo per ottenere dati di migliore qualità e cellule che hanno meno probabilità di essere influenzate dalle citochine. Nel complesso, è fondamentale ottimizzare le tecniche per esaminare il metabolismo nei sottogruppi di cellule T.
Il destino delle cellule T CD8 è in parte diretto dalla programmazione metabolica che influisce sulle risposte immunitarie adattative 2,4,45. Le cellule T CD8 naive escono dallo stato di quiescenza dopo stimolazione TCR 25,46,47,48,49,50. Tuttavia, la stimolazione continua del TCR porta all'esaurimento delle cellule T CD8, determinando un fenotipo notevolmente meno energetico rispetto alle cellule T CD8 funzionali 3,20,51,52. Tuttavia, questo impatto sul metabolismo può essere migliorato e potenzialmente rivitalizzare le cellule T CD8 esaurite 2,3,20,46,51,52. Mentre l'esatto meccanismo che governa il destino delle cellule T CD8 e la differenziazione esaustiva rimangono poco compresi, le cellule T CD8 disfunzionali e/o esaurite presentano tipicamente mitocondri difettosi e sovrapproduzione di ROS, che sono fattori chiave nella regolazione della funzione effettrice delle cellule T CD8 9,15,53. Il metabolismo, i fenotipi e la differenziazione esaustiva delle cellule T CD8 sono stati studiati utilizzando il Mito Stress Test. Storicamente, la stimolazione persistente del TCR con conseguente perdita progressiva delle funzioni effettrici definisce l'esaurimento delle cellule T CD8 11,13,16,17. Tuttavia, ci sono stati recenti sforzi per caratterizzare meglio le cellule T CD8 esaurite e mostrare che anche la cromatina e i paesaggi trascrizionali definiscono l'esaurimento e sono strettamente correlati al flusso metabolico 18,27,28. Nel complesso, la stimolazione persistente del TCR e i successivi fenotipi e sequele metaboliche possono essere studiati con il Mito Stress Test per identificare potenzialmente le vulnerabilità metaboliche e gli eventi che determinano il destino.
La stimolazione del TCR avvia a valle la segnalazione del calcio necessaria per l'esocitosi dei granuli e l'uccisione diretta delle cellule T24,33. In particolare, gli eventi precedenti, come l'attivazione dell'inflammasoma e la produzione di IFNγ, si basano su un ATP54 persistente e sostenuto. Durante la segnalazione del calcio, è stata segnalata una disregolazione dell'efficienza mitocondriale, nota come fenomeno del "flash mitocondriale" 55,56,57,58. Il flash mitocondriale rappresenta un processo in cui i mitocondri che respirano attivamente sperimentano brevemente una respirazione disaccoppiata con conseguente riduzione dell'ATP e aumento dell'esplosione di ROS55,56. La ricerca sul flash mitocondriale è stata limitata e la sua rilevanza nelle cellule T CD8 rimane ampiamente inesplorata. È importante sottolineare che le metodologie descritte in questo studio possono essere utilizzate per studiare questi fenomeni, la differenziazione esaustiva nelle cellule T CD8 e altri profili di cellule immunitarie.
In sintesi, queste metodologie e strumenti offrono un approccio più completo allo studio del metabolismo acuto e cronico. Il Mito Stress Test può essere applicato per esaminare la programmazione metabolica e il modo in cui regola la disfunzione effettrice e la differenziazione esaustiva nelle cellule T CD8. La riprogrammazione metabolica nei linfociti può essere un fattore nella comprensione dei meccanismi alla base della tolleranza immunitaria, della disfunzione delle cellule T CD8 e delle risposte immunitarie esaurite. Inoltre, il metabolismo e/o i mediatori lipidici svolgono un ruolo chiave nella citotossicità e nell'esaurimentodelle cellule T CD8 9 e quindi potrebbero essere presi di mira come un nuovo approccio per prevenire l'esaurimento o potenzialmente invertire la differenziazione esaustiva per ridurre l'immunità antitumorale. Nel complesso, il test Cell Mito Stress Test rappresenta uno strumento robusto che dovrebbe essere utilizzato per affrontare queste questioni irrisolte sull'immunometabolismo.
Divulgazioni
Gli autori non hanno interessi concorrenti da rivelare.
Riconoscimenti
La Hertz Foundation, la Amy Davis Foundation, la Moore Family Foundation e la Heidi Horner Foundation hanno fornito un sostegno inestimabile, per il quale siamo grati. Questo lavoro è stato anche sostenuto in parte da sovvenzioni NIH a RMT (AI052157, AI136534), mentre JAT è stato sostenuto dalla Hertz Graduate Fellowship.
Materiali
| Name | Company | Catalog Number | Comments |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Anti-CD28 | Biolegend | 102116 | |
| Anti-CD3/CD28 Dynabeads | ThermoFisher | 11456D | |
| Biotinylated anti-CD3 | Biolegend | 317320 | |
| Bovine Serum Albumin | Sigma-Aldrich | 108321-42-2 | |
| CD8a+ T cell isolation kit | Miltenyi Biotec | 130-104-075 | |
| Cell Strainers (100 µm) | CELL TREAT | 229485 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E8008 | |
| Ficoll | Sigma-Aldrich | 26873-85-8 | density gradient medium |
| FCCP ((4-(trifluoromethoxy) phenyl) carbonohydrazonoyl dicyanide) | Sigma-Aldrich | C2920 | |
| Glucose | Sigma-Aldrich | G-6152 | |
| Glutamine | Sigma-Aldrich | G7513 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | Positive selection columns |
| Magnetic cell separation column | Miltenyi Biotec | 130-042-301 | |
| Microplate | Agilent | 102601-100 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Pyruvate | Sigma-Aldrich | 113-24-6 | |
| Recobinant IL-2 | PeproTech | 200-02 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Seahorse media | Agilent | 103576-100 | |
| Sensor cartridge | Agilent | 102601-100 | |
| Streptavidin | Sigma-Aldrich | A9275 | |
| Sterile 6 well plate | CELL TREAT | 230601 | |
| Sterile 24 well plate | CELL TREAT | 229524 | |
| XF Calibrant | Agilent | 102601-100 |
Riferimenti
- Patsoukis, N., et al. PD-1 alters T-cell metabolic reprogramming by inhibiting glycolysis and promoting lipolysis and fatty acid oxidation. Nat Commun. 6, 6692 (2015).
- Scharping, N. E., et al. Mitochondrial stress induced by continuous stimulation under hypoxia rapidly drives T cell exhaustion. Nat Immunol. 22, 205-215 (2021).
- Schurich, A., et al. Distinct Metabolic Requirements of Exhausted and Functional Virus-Specific CD8 T Cells in the Same Host. Cell Rep. 16 (5), 1243-1252 (2016).
- Zhang, L., Romero, P. Metabolic control of CD8(+) T cell fate decisions and antitumor immunity. Trends Mol Med. 24 (1), 30-48 (2018).
- Batabyal, R., et al. Metabolic dysfunction and immunometabolism in COVID-19 pathophysiology and therapeutics. Int J Obes (Lond). 45 (6), 1163-1169 (2021).
- Chavakis, T. Immunometabolism: Where immunology and metabolism meet. J Innate Immun. 14, 1-3 (2022).
- Frezza, C., Mauro, C. Editorial: The metabolic challenges of immune cells in health and disease. Front Immunol. 6, 293 (2015).
- Wang, X., Ping, F. F., Bakht, S., Ling, J., Hassan, W. Immunometabolism features of metabolic deregulation and cancer. J Cell Mol Med. 23 (2), 694-701 (2019).
- Turner, J. A., et al. Lysophosphatidic acid modulates CD8 T cell immunosurveillance, metabolism, and anti-tumor immunity. Nat Commun. 14, 3214 (2023).
- Coussens, L. M., Werb, Z. Inflammation and cancer. Nature. 420, 860-867 (2002).
- Jiang, Y., Li, Y., Zhu, B. T-cell exhaustion in the tumor microenvironment. Cell Death Dis. 6 (6), e1792 (2015).
- Krangel, M. S. Mechanics of T cell receptor gene rearrangement. Curr Opin Immunol. 21 (2), 133-139 (2009).
- Barber, D. L., et al. Restoring function in exhausted CD8 T cells during chronic viral infection. Nature. 439, 682-687 (2006).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Bengsch, B., et al. Bioenergetic insufficiencies due to metabolic alterations regulated by the inhibitory receptor PD-1 are an early driver of CD8(+) T cell exhaustion. Immunity. 45 (2), 358-373 (2016).
- Blank, C. U., et al. Defining 'T cell exhaustion'. Nat Rev Immunol. 19, 665-674 (2019).
- Dolina, J. S., Van Braeckel-Budimir, N., Thomas, G. D., Salek-Ardakani, S. CD8(+) T cell exhaustion in cancer. Front Immunol. 12, 715234 (2021).
- Mognol, G. P., et al. Exhaustion-associated regulatory regions in CD8(+) tumor-infiltrating T cells. Proc Natl Acad Sci U S A. 114 (13), E2776-E2785 (2017).
- Wang, D., et al. A comprehensive profile of TCF1(+) progenitor and TCF1(-) terminally exhausted PD-1(+)CD8(+) T cells in head and neck squamous cell carcinoma: implications for prognosis and immunotherapy. Int J Oral Sci. 14 (1), 8 (2022).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21, 1022-1033 (2020).
- Kang, S., Brown, H. M., Hwang, S. Direct antiviral mechanisms of interferon-gamma. Immune Netw. 18 (5), e33 (2018).
- Samuel, C. E. Antiviral actions of interferons. Clin Microbiol Rev. 14, 778-809 (2001).
- Schellekens, H., Weimar, W., Cantell, K., Stitz, L. Antiviral effect of interferon in vivo may be mediated by the host. Nature. 278, 742 (1979).
- Radoja, S., et al. CD8(+) tumor-infiltrating T cells are deficient in perforin-mediated cytolytic activity due to defective microtubule-organizing center mobilization and lytic granule exocytosis. J Immunol. 167 (9), 5042-5051 (2001).
- van der Windt, G. J., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Balmer, M. L., et al. Memory CD8(+) T cells require increased concentrations of acetate induced by stress for optimal function. Immunity. 44 (6), 1312-1324 (2016).
- Pereira, R. M., Hogan, P. G., Rao, A., Martinez, G. J. Transcriptional and epigenetic regulation of T cell hyporesponsiveness. J Leukoc Biol. 102, 601-615 (2017).
- Sen, D. R., et al. The epigenetic landscape of T cell exhaustion. Science. 354, 1165-1169 (2016).
- Quintana, A., et al. T cell activation requires mitochondrial translocation to the immunological synapse. Proc Natl Acad Sci U S A. 104 (36), 14418-14423 (2007).
- Brindley, D. N. Lysophosphatidic acid signaling in cancer. Cancers (Basel). 12 (12), 3791 (2020).
- Chae, C. S., et al. Tumor-derived lysophosphatidic acid blunts protective type I interferon responses in ovarian cancer. Cancer Discov. 12, 1904-1921 (2022).
- Kremer, K. N., et al. LPA suppresses T cell function by altering the cytoskeleton and disrupting immune synapse formation. Proc Natl Acad Sci U S A. 119 (15), e2118816119 (2022).
- Mathew, D., et al. LPA5 is an inhibitory receptor that suppresses CD8 T-cell cytotoxic function via disruption of early TCR signaling. Front Immunol. 10, 1159 (2019).
- Mathew, D., Torres, R. M. Lysophosphatidic acid is an inflammatory lipid exploited by cancers for immune evasion via mechanisms similar and distinct from CTLA-4 and PD-1. Front Immunol. 11, 531910 (2020).
- Oda, S. K., et al. Lysophosphatidic acid inhibits CD8 T cell activation and control of tumor progression. Cancer Immunol Res. 1 (4), 245-255 (2013).
- Lidgerwood, G. E., Pitson, S. M., Bonder, C., Pebay, A. Roles of lysophosphatidic acid and sphingosine-1-phosphate in stem cell biology. Prog Lipid Res. 72, 42-54 (2018).
- Torres, R. M., Turner, J. A., D'Antonio, M., Pelanda, R., Kremer, K. N. Regulation of CD8 T-cell signaling, metabolism, and cytotoxic activity by extracellular lysophosphatidic acid. Immunol Rev. 317 (1), 203-222 (2023).
- Turner, J. A., et al. BRAF modulates lipid use and accumulation. Cancers (Basel). 14 (9), 2110 (2022).
- Hogquist, K. A., et al. T cell receptor antagonist peptides induce positive selection. Cell. 76, 17-27 (1994).
- Li, Y., Kurlander, R. J. Comparison of anti-CD3 and anti-CD28-coated beads with soluble anti-CD3 for expanding human T cells: differing impact on CD8 T cell phenotype and responsiveness to restimulation. J Transl Med. 8, 104 (2010).
- Ralli, M., et al. Immunotherapy in the treatment of metastatic melanoma: current knowledge and future directions. J Immunol Res. 2020, 9235638 (2020).
- Philip, M., Schietinger, A. CD8(+) T cell differentiation and dysfunction in cancer. Nat Rev Immunol. 22, 209-223 (2022).
- Bajrai, L. H., et al. Understanding the role of potential pathways and its components including hypoxia and immune system in case of oral cancer. Sci Rep. 11, 19576 (2021).
- Nicholls, D. G. Mitochondrial proton leaks and uncoupling proteins. Biochim Biophys Acta Bioenerg. 1862, 148428 (2021).
- Tyrakis, P. A., et al. S-2-hydroxyglutarate regulates CD8(+) T-lymphocyte fate. Nature. 540, 236-241 (2016).
- Guo, Y., et al. Metabolic reprogramming of terminally exhausted CD8(+) T cells by IL-10 enhances anti-tumor immunity. Nat Immunol. 22, 746-756 (2021).
- Notarangelo, G., et al. Oncometabolite d-2HG alters T cell metabolism to impair CD8(+) T cell function. Science. 377 (6614), 1519-1529 (2022).
- Yang, K., et al. T cell exit from quiescence and differentiation into Th2 cells depend on Raptor-mTORC1-mediated metabolic reprogramming. Immunity. 39 (6), 1043-1056 (2013).
- Ricciardi, S., et al. The translational machinery of human CD4(+) T cells is poised for activation and controls the switch from quiescence to metabolic remodeling. Cell Metab. 28 (6), 895-906.e5 (2018).
- Moller, S. H., Hsueh, P. C., Yu, Y. R., Zhang, L., Ho, P. C. Metabolic programs tailor T cell immunity in viral infection, cancer, and aging. Cell Metab. 34 (3), 378-395 (2022).
- Alrubayyi, A., et al. Functional restoration of exhausted CD8 T cells in chronic HIV-1 infection by targeting mitochondrial dysfunction. Front Immunol. 13, 908697 (2022).
- Vignali, P. D. A., et al. Hypoxia drives CD39-dependent suppressor function in exhausted T cells to limit antitumor immunity. Nat Immunol. 24, 267-279 (2023).
- Ogando, J., et al. PD-1 signaling affects cristae morphology and leads to mitochondrial dysfunction in human CD8(+) T lymphocytes. J Immunother Cancer. 7 (1), 151 (2019).
- Billingham, L. K., et al. Mitochondrial electron transport chain is necessary for NLRP3 inflammasome activation. Nat Immunol. 23, 692-704 (2022).
- Eberhardt, D. R., et al. EFHD1 ablation inhibits cardiac mitoflash activation and protects cardiomyocytes from ischemia. J Mol Cell Cardiol. 167, 1-14 (2022).
- Hou, T., et al. Identification of EFHD1 as a novel Ca(2+) sensor for mitoflash activation. Cell Calcium. 59 (5), 262-270 (2016).
- Mun, S. A., et al. Structural and biochemical characterization of EFhd1/Swiprosin-2, an actin-binding protein in mitochondria. Front Cell Dev Biol. 8, 628222 (2020).
- Stein, M., et al. A defined metabolic state in pre B cells governs B-cell development and is counterbalanced by Swiprosin-2/EFhd1. Cell Death Differ. 24 (7), 1239-1252 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon