Method Article
Mesure de la fonction mitochondriale des lymphocytes T CD8 naïfs et effecteurs
Dans cet article
Résumé
La bioénergie des lymphocytes T CD8 peut être interrogée à l’aide du test de stress Mito. Cette méthodologie peut être utilisée pour étudier la programmation métabolique aiguë et chronique. Ce protocole décrit des approches pour examiner les relations entre la biologie des récepteurs des lymphocytes T et l’analyse bioénergétique.
Résumé
Comprendre comment l’immunométabolisme influe sur la fonction, la différenciation et le destin des lymphocytes a suscité beaucoup d’intérêt et d’attention. La biologie des lymphocytes a été explorée à l’aide de l’analyse bioénergétique et est maintenant devenue un outil d’importance critique dans le domaine. Ainsi, nous avons cherché à optimiser un test d’analyse bioénergétique qui peut être adapté avec des prétraitements et des injections aiguës pour les stimulations de récepteurs. Ici, nous avons évalué le métabolisme ex vivo des lymphocytes T CD8 à l’aide du test de stress Cell Mito pour évaluer les taux de consommation d’oxygène et d’acidification extracellulaire chez les lymphocytes T CD8 naïfs et effecteurs. Des lymphocytes T CD8 effecteurs spécifiques de l’antigène ont été obtenus par stimulation ex vivo , et des lymphocytes T CD8 naïfs ont été prélevés à partir de splénocytes et isolés par séparation par colonne de billes magnétiques.
Les prétraitements sont effectués dans des microplaques et nous détaillons comment préparer les cartouches de capteurs. Nous montrons comment les ports d’injection peuvent être chargés de médicaments pour mesurer indirectement les capacités métaboliques et avec des modulateurs métaboliques, ce protocole peut être utilisé pour étudier l’activité enzymatique spécifique. Les stimulations des récepteurs des lymphocytes T peuvent être étudiées en temps réel avec une injection aiguë et la stimulation avec des anti-CD3/CD28 à l’aide des ports d’injection. Les analyseurs d’instruments sont utilisés pour les mesures et la collecte de données et la visualisation des données se fait à l’aide de logiciels pour interpréter le métabolisme cellulaire. Cette stratégie produit une grande quantité de données sur la biologie des cellules immunitaires et la bioénergétique mitochondriale, ce qui permet aux chercheurs de personnaliser le protocole de nombreuses façons pour explorer le métabolisme des lymphocytes T CD8.
Introduction
Le destin et la fonctionnalité des cellules immunitaires sont considérablement influencés par le métabolisme, la consommation oxydative et la respiration anaérobie1,2,3,4. Récemment, on s’est intéressé de plus en plus à la modulation métabolique en tant que stratégie pour reprogrammer ou revigorer le destin et la fonction effectrice des lymphocytes T CD8 et améliorer la clairance virale ou renforcer l’immunité antitumorale endogène 5,6,7,8,9. Notamment, la signalisation du récepteur antigénique par le biais du récepteur des lymphocytes T (TCR) est une condition clé de la différenciation des lymphocytes T CD8, ce qui entraîne une signalisation et une activation en aval 10,11,12 (Figure 1). L’exposition prolongée à des agressions immunologiques provoque une stimulation persistante spécifique de l’antigène sur le TCR, conduisant finalement à des états inflammatoires chroniques, à une fatigue des lymphocytes T, à un remodelage du microenvironnement immunitaire et à un échappement immunitaire 11,13,14,15,16,17,18,19.
Le métabolisme des lymphocytes T CD8 épuisés est fondamentalement distinct de celui des lymphocytes T CD8 effecteurs fonctionnels 2,3,14,15,18,20. La différenciation des lymphocytes T, la sécrétion d’interféron γ (IFNγ) et la capacité de rappel sont, en partie, déterminées par la fonction mitochondriale et les produits de dégradation de la β-oxydation. Les lymphocytes T CD8 IFNγ+ sont des composants essentiels des réponses immunitaires antitumorales et antivirales 21,22,23. Le flux métabolique spécifique via la glycolyse et la chaîne de transport d’électrons est important pour l’activation des lymphocytes T CD8, la sécrétion de cytokines et les réponses de mémoire 4,11,13,15,18,24,25,26,27,28 . Les réponses optimales, y compris l’activation des lymphocytes T et la différenciation des effecteurs, nécessitent une réponse mitochondriale coordonnée et spécifique, tandis que les défauts mitochondriaux et les espèces réactives de l’oxygène (ROS) excessives caractérisent les lymphocytes T épuisés ou dysfonctionnels 9,29. Récemment, la stimulation persistante des lymphocytes T CD8 in vitro favorise la différenciation exhaustive des lymphocytes T CD8 en partie en induisant un stress oxydatif et en reprogrammant le métabolisme oxydatif et les capacités métaboliques nécessaires à la prolifération des lymphocytes T 1,2,13,20,24,29. Dans l’ensemble, les axes de contrôle métabolique sont des composants essentiels dans la direction de la différenciation des lymphocytes T CD8 et de leur progression vers des phénotypes effecteurs, mémoires ou épuisés/dysfonctionnels.
Les composés métaboliques dirigent également les réponses des cellules immunitaires en fonctionnant comme des molécules de signalisation autocrines ou paracrines 9,30,31,32,33,34,35. La sphingosine-1-phosphate (S1P) et l’acide lysophosphatidique (LPA) sont des lipides bioactifs et inflammatoires qui signalent via les récepteurs couplés aux protéines G (RCPG) pour moduler la sortie des lymphocytes et la cytotoxicité des lymphocytes T CD836. La signalisation LPA via les récepteurs GPCR LPA sur les lymphocytes T CD8 reprogramme le métabolisme pour augmenter la lipolyse, l’oxydation des acides gras et la fuite de protons9. Dans l’ensemble, la bioénergie et le métabolisme des lymphocytes T CD8 sont en grande partie déterminés par la disponibilité du substrat, les signaux environnementaux et les besoins énergétiques.
Les méthodologies permettant d’interroger le métabolisme des lymphocytes T CD8 sont devenues de plus en plus importantes. Le Cell Mito Stress Test fournit une évaluation complète de la bioénergétique et est maintenant reconnu comme une technique de référence dans le domaine de l’immunométabolisme et de l’énergie des lymphocytes T CD8 9,37. Les cellules adhérentes étaient historiquement utilisées pour le test de stress Mito38 ; cependant, il y a un intérêt croissant pour l’application de ce protocole aux cellules cultivées en suspension et plus particulièrement à l’utilisation de cellules immunitaires pour le test de stress cellulaire Mito. Nous présentons ici un protocole détaillé pour mesurer l’activité métabolique des lymphocytes T CD8 basé sur notre récente publication9. Nous fournissons une explication détaillée de l’expansion des lymphocytes T CD8, de l’isolement naïf des lymphocytes T CD8, de la préparation du test et du traitement avec des protocoles pour les prétraitements et les injections aiguës dans le test de stress cellulaire de Mito. Il est important de noter que nous comparons plusieurs méthodes de stimulation TCR et d’activation des lymphocytes T CD8, y compris la stimulation TCR polyclonale et spécifique de l’antigène.
Ce protocole détaille la stimulation spécifique de l’antigène à l’aide de souris transgéniques OT-I (un modèle de souris transgénique classique) pour lesquelles tous les lymphocytes T de souris expriment les mêmes gènes Vα2 et Vβ5 39. Les lymphocytes T CD8 de souris OT-I hébergent tous le même TCR spécifique de l’octapeptide d’ovalbumine (OVA257-264, également écrit sous la forme de la séquence d’acides aminés SIINFEKL ou N4, un épitope largement étudié qui, lorsqu’il est présenté par le complexe majeur d’histocompatibilité (CMH) de classe I, active les lymphocytes T CD8 cytotoxiques39 (Figure 1A). Dans l’ensemble, le modèle de souris transgénique OT-I est largement utilisé par les immunologistes pour étudier la signalisation TCR et la fonction effectrice des lymphocytes T spécifiques de l’antigène. Contrairement à l’activation monoclonale avec le modèle murin OT-I, les lymphocytes T CD8 polyclonaux peuvent être générés avec des anticorps anti-CD3/CD28 contre les sous-unités CD3 du TCR et la molécule de co-stimulationCD28 40 (Figure 1B). Les anticorps anti-CD3/CD28 contournent la composante spécifique de l’antigène de la signalisation TCR pour activer une population polyclonale de lymphocytes T40. En fin de compte, les résultats décrits dans ce rapport comparent plusieurs méthodes d’utilisation du test de stress Cell Mito pour quantifier le flux métabolique dynamique dans les lymphocytes T CD8.
Protocole
Les souris ont été gardées dans un environnement exempt d’agents pathogènes et entretenues conformément aux normes et règlements du Comité institutionnel de protection et d’utilisation des animaux.
1. Génération et expansion de lymphocytes T CD8 par stimulation spécifique de l’antigène
- Le premier jour, récoltez des splénocytes dérivés de souris OT-I ; ensuite, préparez-les et activez-les in vitro avec le peptide SIINFEKL (4).
- Nettoyez l’espace du capot, préparez les réactifs et rassemblez le milieu de souris. Réchauffez le support de souris dans un incubateur d’eau ou de billes.
- Dans une assiette à 6 puits, mettez 7 ml de milieu pour souris dans un puits, puis 3 ml de milieu pour souris dans un autre puits. Ensuite, insérez dans le puits une passoire contenant 7 ml de milieu.
- Amenez une souris du vivarium dans une cage de transfert dans le laboratoire. Transférez la souris dans une nouvelle cage vide et positionnez l’adaptateur CO2 sur le dessus. Euthanasier la souris avec du CO2 jusqu’à un niveau de débit de 2,75.
- Surveillez attentivement la souris et observez tout signe de détresse. Après la dernière respiration, surveillez les signes de respiration et de vie pendant au moins 1 min. Éteignez le CO2 et effectuez une luxation cervicale comme méthode secondaire d’euthanasie. Ensuite, nettoyez la paillasse, la cage et le reste de la zone de travail et portez la souris jusqu’au capot de dissection.
- Disséquez la rate de la souris.
- Utilisez de l’éthanol à 70 % pour stériliser le matériel de dissection et en plaçant le côté gauche de la souris vers le bas, vaporisez le côté gauche de la souris pour désinfecter.
- À l’aide d’instruments propres, disséquez pour enlever la peau et identifier le péritoine. Faites une petite incision à travers le péritoine pour trouver la rate, puis excisez la rate. Mettez la rate dans la plaque à 6 puits sur le dessus de la passoire.
- Nettoyez la zone, mettez la carcasse de souris dans un sac d’élimination, puis placez le sac dans un congélateur pour l’élimination.
- Assurez-vous que toute la zone est propre et déplacez la plaque à 6 puits dans le capot de culture tissulaire pour les prochaines étapes.
- Dans le capot de culture tissulaire, homogénéisez la rate et remettez les cellules en suspension dans une suspension unicellulaire sans grumeaux.
- Poussez la rate à travers la passoire dans le puits avec 7 mL de milieu avec le piston d’une seringue de 5 mL.
- Rincez la passoire et tout tissu résiduel à l’aide de 3 ml de milieu dans le puits supplémentaire.
- Transférez la suspension cellulaire à l’aide d’une pipette sérologique dans un nouveau tube conique de 10 mL.
- Centrifuger pendant 5 min à 500 × g et aspirer le surnageant à l’aide d’une pipette en verre.
- Lyse des globules rouges.
- Commencer le processus de lyse des globules rouges à l’aide de 1 mL de tampon de lyse ACK en mettant les cellules en suspension dans le tampon de lyse ACK et en les incubant à température ambiante pendant 1 à 5 min.
REMARQUE : Le temps d’incubation doit être optimisé en fonction du lot spécifique de tampon de lyse ACK afin d’obtenir une lyse maximale des globules rouges avec une mort minimale des splénocytes. - Ajouter 10 mL de fluide dans le tube conique pour la neutralisation et centrifuger pendant 5 min à 500 × g.
- Remettre les cellules en suspension dans 50 mL de milieu et les transférer dans une fiole T75.
- Commencer le processus de lyse des globules rouges à l’aide de 1 mL de tampon de lyse ACK en mettant les cellules en suspension dans le tampon de lyse ACK et en les incubant à température ambiante pendant 1 à 5 min.
- Stimulez les cellules avec le peptide SIINFEKL (N4).
- Introduisez le peptide SIINFEKL dans le capot de culture tissulaire. Conservez le peptide SIINFEKL à -20 °C.
- Ajouter SIINFEKL directement dans le milieu pour obtenir une concentration finale de 2 μg/mL. Ajouter 50 μL de SIINFEKL (2 mg/mL) à 50 mL de milieu pour obtenir une concentration finale de 2 μg/mL.
- Incuber les cellules à 37 °C pendant 72 h.
- Désinfectez la hotte de culture tissulaire avec de l’éthanol à 70 %.
- Nettoyez l’espace du capot, préparez les réactifs et rassemblez le milieu de souris. Réchauffez le support de souris dans un incubateur d’eau ou de billes.
- Le quatrième jour, lavez les cellules pour éliminer le peptide. À l’aide de milieux fraîchement préparés complétés par de l’IL-2, remettre les cellules en suspension, puis remettre le ballon dans l’incubateur.
- Prélever les cellules de la fiole de culture tissulaire T75 dans un tube conique de 50 mL. Centrifugez et granulez les cellules T OT-I CD8, puis éliminez tout excès de milieu par aspiration. Ajouter 50 ml de nouveau milieu de souris contenant 1 000 U/mL d’IL-2 et transférer les cellules en suspension dans une nouvelle fiole T75.
- Pour le stockage, conservez les aliquotes du bouillon IL-2 dans un congélateur à -80 °C. Le stockage à -80 °C minimisera la dégradation des peptides.
- Préparer des lymphocytes T CD8 cytotoxiques spécifiques de l’antigène élargi pour le test de la fonction mitochondriale
- Le septième jour, le test de la fonction mitochondriale est effectué. Préparez le lymphocyte T OT-I CD8 spécifique de l’antigène pour le test.
- Prélever des lymphocytes T CD8 vivants.
- Transférez les cellules de la fiole de culture tissulaire T-75 dans un nouveau tube conique de 50 ml. Ensuite, centrifugez le tube conique pendant 5 min à 500 × g.
- Dans un tube conique neuf de 50 ml, pipeter 20 mL d’un milieu à gradient de densité (densité = 1,077 g/mL) pendant que les cellules tournent.
- Une fois la centrifugation terminée, prendre le tube conique et, à l’aide de 10 mL de milieu, remettre les cellules en suspension. Ensuite, en pipetant très lentement, superposez les cellules remises en suspension sur le gradient de densité. Sans perturber la pente, centrifugez le tube conique à 1 300 × g pendant 20 min à température ambiante avec le réglage réglé sur l’accélération maximale et la décélération minimale sans frein.
- Lorsque la centrifugation est terminée, utilisez une pipette P1000 pour recueillir la couche intermédiaire des lymphocytes T. Visualisez la couche cellulaire et assurez-vous que la pipette reste au-dessus et ne perturbe pas la couche. Transférez les cellules recueillies dans un tube conique frais de 50 ml contenant 30 ml de milieu de souris complet. Ensuite, centrifugez le tube conique de 50 mL à 500 × g pendant 5 min. Une fois la centrifugation terminée, aspirer l’excès de surnageant des lymphocytes T CD8 OT-I. Avec 20 ml de milieu de souris frais, remettre les cellules en suspension.
- À l’aide d’un hémocytomètre, comptez le nombre total de cellules viables. Colorer une petite aliquote de cellules avec du bleu trypan dans une dilution de 1:4 pour identifier les cellules mortes.
REMARQUE : Environ 40-60 × 106 cellules peuvent être attendus d’une souris OT-I. - Avec une étape de centrifugation supplémentaire, laver les cellules restantes avec 20 ml supplémentaires de milieu de souris frais. Ensuite, à l’aide d’une microplaque, pipetez les cellules de 200 000 cellules/puits dans un milieu de souris complet.
2. Génération et expansion de lymphocytes T CD8 polyspécifiques via une stimulation anti-CD3/anti-CD28
- Le jour 0, enduire une plaque de 24 puits de CD3. Ajouter 1 mL d’anti-CD3-biotine à une concentration de 5 μg/mL, diluée dans du PBS, dans chaque puits d’une plaque à 24 puits. Placez la plaque dans un incubateur humidifié à 5 % de CO2 pendant la nuit.
- Le lendemain, récoltez une souris et collectez des splénocytes. Activez les splénocytes in vitro avec l’anti-CD3/anti-CD28 en suivant les étapes 1.1.1-1.1.5.3.
- À l’aide du protocole de séparation par billes magnétiques, isolez les lymphocytes T CD8.
REMARQUE : Assurez-vous que les cellules sont maintenues froides. Dans des conditions pré-refroidies, travaillez rapidement.- À l’aide de 40 μL de tampon MACS, remettez les cellules en suspension avec 10 000 000 cellules par 40 μL de tampon MACS. Pour la solution, mélangez soigneusement 10 μL de cocktail d’anticorps à la biotine dans la solution cellulaire, puis incubez pendant 5 min à 4 °C.
- En attendant que la cellule incuber dans le réfrigérateur, préparez une colonne pour la sélection positive. Utilisez 3 ml de tampon pour laver la colonne, puis jetez le flux de déchets.
- Après 5 min, prélevez la solution d’anticorps cellulaires du réfrigérateur et ajoutez 30 μL de tampon MACS pour 10 000 000 cellules, 20 μL d’anti-biotine, puis incubez à 4 °C pendant 10 minutes supplémentaires.
- Préparez un nouveau tube de prélèvement sous une colonne de sélection positive à l’aide d’un tube conique frais de 15 ml. Une fois l’incubation de 10 minutes terminée, transférez la suspension cellulaire dans la colonne de sélection positive. Dans un tube conique frais de 15 ml, recueillir l’écoulement. À l’aide de 3 mL de tampon MACS, laver la colonne pour recueillir les cellules résiduelles.
REMARQUE : Assurez-vous que la suspension cellulaire est dans un volume minimum de 0,5 ml. - Replaquez les lymphocytes T CD8 sélectionnés positivement dans la plaque à 24 puits pour la stimulation anti-CD3/anti-CD28.
- Centrifuger le débit à 500 × g pendant 5 min à 4 °C. Aspirez l’excès de surnageant et pipetez les cellules pour les remettre en suspension dans la solution. À l’aide d’un hémacytomètre et d’un bleu trypan, comptez les cellules.
REMARQUE : Veuillez vous attendre à ce que ~8-10 × 106 cellules vivantes soient comptées par rate de souris. - Après avoir compté les cellules, remettre en suspension les lymphocytes T CD8 à 500 000 cellules par ml. Ensuite, aspirez soigneusement 1 mL de PBS de la plaque à 24 puits, replaquez les cellules comptées dans la plaque à 24 puits et ajoutez 10à 6 cellules par puits.
- Pour stimuler les cellules, injectez l’anti-CD28 dans la plaque à 24 puits de sorte que la concentration finale d’anti-CD28 soit de 2 μg/mL. Pour mélanger les cellules, tapotez soigneusement la plaque. Maintenez les cellules à 37 °C pendant les 72 prochaines heures.
- Centrifuger le débit à 500 × g pendant 5 min à 4 °C. Aspirez l’excès de surnageant et pipetez les cellules pour les remettre en suspension dans la solution. À l’aide d’un hémacytomètre et d’un bleu trypan, comptez les cellules.
- En utilisant de l’éthanol à 70 %, nettoyez le capot de culture tissulaire.
- Le jour 4 (72 h plus tard), retirez les cellules de la stimulation anti-CD3/anti-CD28. Laver les cellules en centrifugeant des lymphocytes T CD8 polyclonaux. Retirer l’excès de surnageant par aspiration, puis remettre les cellules en suspension avec un milieu de souris frais contenant 1 000 unités/ml d’IL-2 et 10 ml de milieu. Transférez les cellules remises en suspension dans une nouvelle plaque à 6 puits et placez-la dans l’incubateur.
REMARQUE : 1.2.2. Pour le stockage, les aliquotes de la crosse IL-2 peuvent être conservées dans un congélateur à -80 °C. Le stockage à -80 °C minimisera la dégradation des peptides. - Préparez les lymphocytes T CD8 effecteurs polyclonaux élargis pour le test de la fonction mitochondriale.
- Le septième jour, préparez et traitez les lymphocytes T CD8 polyclonaux pour le dosage.
- Prélever des lymphocytes T CD8 vivants.
- Transférez les cellules de la plaque à 6 puits dans un tube conique propre à l’aide d’une pipette, puis centrifugez les cellules pendant 5 min à 500 × g.
- Suivez les étapes 1.3.3.2 à 1.3.4.
REMARQUE : On peut s’attendre à environ 10 à 30 millions de lymphocytes T CD8 vivants à partir d’une seule souris C57BL/6. - Conservez une aliquote de cellules pour la cytométrie en flux afin d’évaluer la pureté du CD8. Pour la cytométrie en flux, colorer les cellules sur de la glace pendant 20 min avec un colorant de viabilité de votre choix9.
3. Récolter des lymphocytes T CD8 naïfs
- Le septième jour, récoltez les splénocytes d’une souris en suivant les étapes 1.1.1-1.1.5.3.
- Effectuez l’isolement des lymphocytes T CD8 à l’aide du protocole basé sur des billes magnétiques décrit aux étapes 2.3 à 2.3.5.1.
- Plaquez les lymphocytes T CD8 dans la microplaque à 200 000 cellules/par puits dans un milieu complet.
4. Effectuer le test de la fonction mitochondriale
- Préparez les matériaux la veille de l’analyse de la fonction mitochondriale.
- Hydratez la cartouche du capteur.
- Pipette 200 μL d’eau distillée dans chaque puits de la plaque utilitaire. Placez la cartouche du capteur sur la plaque utilitaire. Vérifiez que les extrémités de la cartouche du capteur sont immergées pour assurer une bonne hydratation. Placez la cartouche du capteur et la plaque utilitaire dans un incubateur sans CO2 à 37 °C pendant au moins 10 h.
- Préparez un tube conique de 50 ml avec 50 ml de Calbrant et placez-le dans un incubateur sans CO2 et incubez pendant la nuit.
- La veille du dosage, préparez le milieu frais complet en préparation du dosage. Dans un total de 50 mL, préparer une solution de 1 mM de pyruvate, 2 mM de glutamine et 10 mM de glucose dans un milieu de dosage.
- Hydratez la cartouche du capteur.
- Effectuez le test de la fonction mitochondriale le lendemain.
- Retirez l’eau distillée de la plaque utilitaire en la retirant. Réhydratez avec 200 μL de Calibrant. Utilisez le Calibrant qui a été stocké dans l’incubateur sans CO2 pendant la nuit. Après avoir replacé la cartouche du capteur sur le dessus de la plaque utilitaire. Remettez la plaque utilitaire avec la cartouche du capteur dans l’incubateur sans CO2 .
REMARQUE : Pour faire pivoter la plaque, retournez rapidement et rapidement la plaque en un mouvement fluide au-dessus de l’évier afin que l’eau distillée tombe rapidement de la plaque.
- Retirez l’eau distillée de la plaque utilitaire en la retirant. Réhydratez avec 200 μL de Calibrant. Utilisez le Calibrant qui a été stocké dans l’incubateur sans CO2 pendant la nuit. Après avoir replacé la cartouche du capteur sur le dessus de la plaque utilitaire. Remettez la plaque utilitaire avec la cartouche du capteur dans l’incubateur sans CO2 .
- Préparez les lymphocytes T CD8 comme décrit ci-dessus dans les sections 1 à 3.
- À l’aide d’une pipette multicanaux, plaquer 200 000 cellules par puits en remettant en suspension 10 × 106 cellules dans 4,5 mL de milieu complet et en placant 90 μL par puits. Ensuite, ajoutez encore 90 μL de milieu désigné par puits pendant le prétraitement.
REMARQUE : S’il n’y a pas de prétraitement, plaquez les cellules dans 180 μL par puits avec une concentration finale de 200 000 cellules par puits. À partir de ce moment du protocole, conservez la plaque à température ambiante ou dans l’incubateur sans CO2 . La plaque ne doit pas être placée dans un incubateur à 5 % de CO2 . Notez que le volume final de la microplaque sera de 180 μL.
- À l’aide d’une pipette multicanaux, plaquer 200 000 cellules par puits en remettant en suspension 10 × 106 cellules dans 4,5 mL de milieu complet et en placant 90 μL par puits. Ensuite, ajoutez encore 90 μL de milieu désigné par puits pendant le prétraitement.
- Préparez des prétraitements (y compris une supplémentation en lipides ou en un autre métabolite).
- Préparez le prétraitement des lipides en faisant tourner les lipides lyophilisés du congélateur à l’aide d’une mini-centrifugeuse à essorage rapide. Déterminez les concentrations souhaitées pour le prétraitement et préparez le prétraitement des lipides à ces concentrations. Sonicate le lipide dilué pendant 30 minutes immédiatement avant l’utilisation.
- Préparez des cocktails de lipides.
- Déterminer la concentration lipidique souhaitée à utiliser dans le test de la fonction mitochondriale.
- Préparez les lipides à une concentration 2 fois supérieure à la concentration souhaitée. Ensuite, ajoutez la solution lipidique au volume existant dans la microplaque pour obtenir une dilution de 1:2. Complétez cette opération en ajoutant 90 μL de la solution lipidique directement aux 90 μL préexistants. Le volume final sera de 180 μL (dilution 1:2) par puits.
REMARQUE : Le tableau 1 détaille un exemple de schéma d’une configuration et d’une conception possibles de la plaque. Nous suggérons d’effectuer le test avec 5 à 6 réplicats techniques, incorporant à la fois des lymphocytes T CD8 effecteurs naïfs et spécifiques de l’antigène avec et sans additifs lipidiques. Notamment, ce protocole est conçu pour éviter la centrifugation afin de minimiser les perturbations cellulaires. Étant donné que le test de la fonction mitochondriale est très sensible au nombre de cellules, la réduction de la perte de cellules est essentielle. Au lieu de la centrifugation, les cellules sont manipulées par effleurement pour préserver leur intégrité. - Pipeter 180 μL de milieu complet dans chaque coin de la plaque. Placez la microplaque contenant des lymphocytes T CD8 dans un incubateur sans CO2 .
REMARQUE : Le temps d’incubation variera en fonction de la durée souhaitée du prétraitement. Pour minimiser la mort cellulaire, nous avons recommandé un maximum de 4 heures de prétraitement pour les lymphocytes T CD8. Un allongement excessif du temps de prétraitement peut entraîner une mort cellulaire excessive, affectant la précision des résultats.
- Préparez des poisons et des solutions pour les injections aiguës.
- À l’aide de solutions mères, préparez une forme diluée d’oligomycine. Créer une dilution d’oligomycine dans 3 mL de milieu complet. Dans des tubes coniques de 15 ml, préparer avec précaution les poisons et les injections aiguës. Comme les poisons sont sensibles à la lumière, préparez ces solutions à l’aide de tubes enveloppés dans du papier d’aluminium pour les protéger de l’exposition à la lumière.
- Dans un tube conique de 15 mL enveloppé dans une feuille d’étain, diluer l’oligomycine dans 3 mL de milieu complet de sorte que la concentration finale soit de 2,5 μM après l’injection.
- Dans un deuxième tube conique de 15 mL enveloppé dans du papier d’aluminium, diluer le FCCP dans 3 mL de milieu complet de sorte que la concentration finale soit de 2,0 μM après l’injection.
- Dans un troisième tube conique de 15 mL enveloppé dans du papier d’aluminium, créer des solutions de roténone et d’antimycine A dans 3 mL de milieu complet pour atteindre des concentrations de 0,5 μM pour les deux toxines après l’injection.
- Si le test est effectué avec des modulateurs métaboliques, des médicaments ou des stimulations supplémentaires, diluez ces agents dans un milieu complet. Si vous prévoyez d’utiliser de l’étomoxir ou d’autres modulateurs métaboliques et médicaments, effectuez d’abord un test pour tester la courbe de titrage et déterminer la concentration optimale à utiliser. Si l’on effectue une stimulation TCR par injection aiguë, le dosage peut être effectué à l’aide de billes magnétiques anti-CD3/anti-CD28 ou d’une combinaison d’anti-CD3-biotine liée à une plaque et de streptavidine anti-CD28.
REMARQUE : Pour des descriptions supplémentaires, reportez-vous à la rubrique 5 qui décrit le protocole de stimulation TCR par injection aiguë d’anti-CD3/CD28.
- Retirez la cartouche du capteur de l’incubateur sans CO2 . À l’aide des adaptateurs de plaque, piquez les poisons dans la cartouche du capteur. Placez les adaptateurs de plaque de manière à ce que chaque chambre puisse être spécialement chargée de poisons ou d’autres injections aiguës.
REMARQUE : Soyez prudent lorsque vous pipetez les poisons.- Chargez les poisons dans les ports de la cartouche du capteur. Si aucune injection supplémentaire n’est effectuée, les orifices A à C seront chargés de poisons. Pipetez 20 μL d’oligomycine dans l’orifice A, 22 μL de FCCP dans l’orifice B, 25 μL de roténone dans l’orifice C et 25 μL d’antimycine A dans l’orifice C.
- À l’aide de solutions mères, préparez une forme diluée d’oligomycine. Créer une dilution d’oligomycine dans 3 mL de milieu complet. Dans des tubes coniques de 15 ml, préparer avec précaution les poisons et les injections aiguës. Comme les poisons sont sensibles à la lumière, préparez ces solutions à l’aide de tubes enveloppés dans du papier d’aluminium pour les protéger de l’exposition à la lumière.
- Une heure avant de commencer le dosage sur l’instrument, placez la microplaque dans l’incubateur sans CO2 .
- Avant de démarrer l’instrument, ouvrez le logiciel et étalonnez l’instrument. Effectuez cette tâche 30 minutes avant de charger la microplaque dans l’instrument afin de disposer de suffisamment de temps pour l’étalonnage.
- Sur le système logiciel, étiquetez les puits et examinez le schéma d’injection.
- Pendant l’étalonnage, chargez la cartouche du capteur dans l’instrument. Le logiciel vous demandera d’effectuer l’initialisation et le contrôle qualité. L’étalonnage évaluera le pH et l’O2 sur chaque puits, ce qui passera ou échouera. L’instrument affichera les résultats à l’écran avec une coche ou un « X ».
5. Effectuer une version modifiée du test de la fonction mitochondriale avec stimulation TCR dans une expérience distincte avec une injection aiguë d’anti-CD3/CD28
REMARQUE : Le test de la fonction mitochondriale peut être effectué avec une simulation de TCR aigu via deux approches différentes soit par 1) en utilisant des anti-CD3 + anti-CD28 + streptavidine biotinylés décrits à l’étape 5.2 ou 2) des billes magnétiques anti-CD3/CD28 décrites à l’étape 5.3 Ces expériences distinctes ont toutes deux pour fonction de stimuler le TCR via une injection aiguë pendant le test.
- Si vous effectuez des injections supplémentaires, préparez le test comme décrit dans la section 4 précédente. Modifiez les schémas d’injection à l’aide de la chambre supplémentaire pour l’injection. Dans ce protocole, les anti-CD3/anti-CD28 sont chargés dans le port A de la cartouche du capteur. Ensuite, chargez les autres ports de la même manière, avec de l’oligomycine dans l’orifice B, du FCCP dans l’orifice C et de la roténone et de l’antimycine A dans l’orifice D.
- Préparez et chargez les composants biotinylés anti-CD3 + anti-CD28 + streptavidine.
- Pipeter 20 μL d’anti-CD3 biotinylé à 10 μg/mL dans les puits désignés dans la cartouche du capteur.
- Pipeter 20 μL d’anti-CD28 à 2 μg/mL + streptavidine à 20 μg/mL dans les puits prévus à cet effet dans la cartouche du capteur.
- Pipeter 20 μL d’anti-CD3 biotinylé à 10 μg/mL + d’anti-CD28 à 2 μg/mL + de streptavidine à 20 μg/mL dans les puits prévus à cet effet dans la cartouche du capteur.
- Assurez-vous que les puits de contrôle sont prêts. Assurez-vous qu’il y a des puits désignés injectés avec du milieu seulement, de l’anti-CD3 biotinylé seul, de l’anti-CD28 + streptavidine et de l’anti-CD3 biotinylé + anti-CD28 + streptavidine.
- À l’aide d’un rapport bille / cellule de 1:1, préparez et chargez des billes magnétiques anti-CD3/CD28.
- Dans une plaque avec 200 000 cellules par puits, pipetez 5 μL de billes magnétiques vers les puits désignés dans la cartouche du capteur.
- Préparez les puits de contrôle désignés avec un média uniquement pour l’injection.
- Ajuster le volume des poisons de sorte que les concentrations finales après l’injection soient de 2,5 μM pour l’oligomycine, de 2,0 μM pour le FCCP et de 0,5 μM pour la roténone et l’antimycine A.
- Assurez-vous que le schéma d’injection est modifié pour refléter les points temporels mis à jour avant de charger la microplaque sur l’instrument.
- Programmez le logiciel pour exécuter la stimulation TCR aiguë pendant un total de 140 min. Dans ce délai, modifiez le schéma de manière à ce qu’il y ait des mesures de points temporels x10 avant l’injection d’oligomycine.
Résultats
Les capacités métaboliques glycolytiques et oxydatives peuvent être mesurées à l’aide d’un test fonctionnel mitochondrial qui évalue les capacités en ciblant les composants de la chaîne de transport d’électrons à des points temporels particuliers (Figure 2A). Différents schémas d’injection peuvent être chargés sur les ports de cartouche du capteur pour modifier le test traditionnel et évaluer la stimulation TCR aiguë (Figure 2B,C). Le nombre de cellules et la concentration de médicaments pour divers types de cellules doivent être optimisés avant d’interpréter les résultats. Ici, ce rapport décrit les conditions qui ont été optimisées pour les lymphocytes T CD8 (Figure 3A,B) avec des inhibiteurs de la chaîne de transport d’électrons optimisés pour mesurer les capacités dans les cellules naïves et effectrices (Figure 4A,B). Il est important de noter que ce test peut être modifié pour étudier la stimulation TCR sur les lymphocytes T CD8 effecteurs générés par une stimulation spécifique de l’antigène ou une stimulation anti-CD3/CD28. Nous examinons plus en détail la réponse des lymphocytes T CD8 à la signalisation lipidique bioactive, en particulier avec l’acide lysophosphatidique ou LPA. Nous avons déterminé que les tendances métaboliques en réponse à la signalisation LPA (à 30 min, 2 h ou 4 h avant le chargement de la microplaque dans l’instrument d’analyse) étaient similaires dans les deux lymphocytes T CD8 activés par une stimulation TCR spécifique de l’antigène ou polyclonale (Figure 5A-D). Le type de stimulation TCR et le mécanisme d’activation ont entraîné des différences subtiles dans lesquelles les cellules métaboliquement énergétiques ont été initialement générées avec une activation spécifique de l’antigène (Figure 5E-L).
L’injection aiguë d’anti-CD3/CD28 sur les lymphocytes T CD8 effecteurs peut stimuler de manière aiguë le TCR avec des mesures en temps réel. Les anti-CD3, anti-CD28 et la streptavidine biotinylés peuvent être utilisés en agrégat pour stimuler le TCR dans un modèle d’injection aiguë. En tant que méthode distincte, des injections aiguës peuvent être effectuées avec des billes magnétiques conjuguées à des anti-CD3 et anti-CD28 dans ce test bioénergétique pour stimuler le TCR en temps réel. Nous avons adapté le modèle pour injecter soit un milieu, soit un anti-CD3 biotinylé, soit un anti-CD28 + streptavidine biotinylée, soit un agrégat d’anti-CD3 + anti-CD28 + streptavidine biotinylée sur des lymphocytes T CD8 OT-I effecteurs au milieu du temps pendant le test (Figure 6A,B). Nous avons observé une stimulation avec des anti-CD3/CD28, ce qui a entraîné une augmentation de l’OCR et de l’ECAR. Les signaux OCR et ECAR étaient également élevés, mais pas au même niveau que les signaux anti-CD3/CD28, avec le signal anti-CD3 biotinylé seul. Il est important de noter que nous trouvons des tendances métaboliques similaires qui sont comparables à l’injection aiguë de billes magnétiques anti-CD3/CD28 (Figure 6C-F). En somme, ces résultats montrent avec de multiples approches et méthodologies que le test de la fonction mitochondriale est robuste et reproductible pour l’étude de l’immunométabolisme des lymphocytes et plus particulièrement des lymphocytes T CD8.

Figure 1 : Activation du récepteur des lymphocytes T avec stimulation spécifique de l’antigène et polyclonale. (A) Schéma de la signalisation spécifique de l’antigène avec le complexe majeur d’histocompatibilité (CMH) de classe I avec peptide lié au récepteur des lymphocytes T. (B) Représentation de l’activation polyclonale des lymphocytes T CD8 en liant les sous-unités CD3 et la molécule costimulatrice CD28 avec des anticorps anti-CD3/28. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Ciblage médicamenteux de la chaîne de transport d’électrons dans le test de la fonction mitochondriale. (A) Schéma des inhibiteurs de la chaîne de transport d’électrons (rouge) utilisé ici. (B, C) Pour le test de la fonction mitochondriale, les stratégies d’injection sur la cartouche du capteur sont les suivantes : (B) approche d’injection traditionnelle où l’oligomycine est chargée dans l’orifice A, le FCCP dans l’orifice B et la roténone et l’antimycine A dans l’orifice C. (C) La méthode d’injection aiguë consiste à placer l’injection aiguë (anti-CD3/CD28) dans l’orifice A, l’oligomycine dans l’orifice B, le FCCP dans l’orifice C, et roténone et antimycine A dans l’orifice D. Abréviation : FCCP = 4-(trifluorométhoxy) phényl) carbonohydrazonoyle dicyanure. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Expression de surface des cellules CD8 et CD44, viabilité et différences métaboliques dans les cellules T CD8 générées par la stimulation anti-CD3 et anti-CD28 après un traitement LPA. (A) Les cellules T CD8 effectrices sont générées ex vivo en stimulant les cellules T CD8 dérivées de souris avec SIINFEKL (N4) et les splénocytes en tant que cellules présentatrices d’antigène ou anti-CD3 et anti-CD28 sur des plaques. Le jour 4, l’IL-2 remplace les stimuli initiaux, favorisant la différenciation et la prolifération. Les lymphocytes T CD8 effecteurs homogènes du jour 7 sont ensuite analysés par cytométrie en flux après culture in vitro. (B) Les lymphocytes T sont identifiés par un contrôle sur l’état lymphocytaire, puis l’expression de CD8+/CD44+. Une image représentative montre que CD8 et CD44 ne sont pas affectés avec le traitement LPA. Cette figure a été modifiée à partir de Turner et al.9. Veuillez cliquer ici pour voir une version agrandie de cette figure.
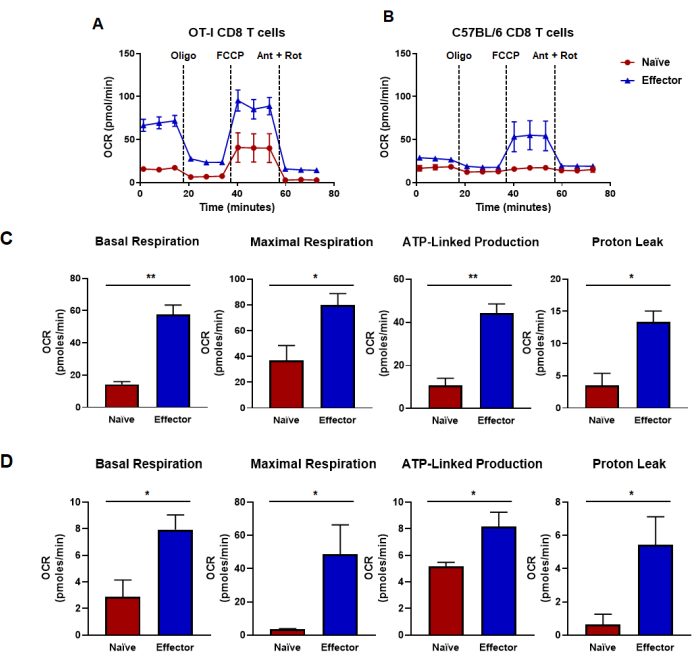
Figure 4 : Capacités oxydatives déterminées à partir du taux de consommation d’oxygène. (A,B) Taux de consommation d’oxygène pour les lymphocytes T CD8 naïfs et effecteurs générés par (A) la stimulation et l’expansion spécifiques de l’antigène des lymphocytes T CD8 OT-I ou (B) la stimulation polyclonale anti-CD3/CD28 et l’expansion des lymphocytes T CD8 de souris C57B/6 de type sauvage. L’oligomycine, le FCCP, l’antimycine A et la roténone ont été injectés à des intervalles de 18 minutes avec un milieu de glucose de 25 mM. Les résultats sont présentés sous forme de données représentatives et ont été obtenus à l’aide de n = 6 répétitions techniques. (C, D) Les mesures de capacité dérivées des tests de flux métaboliques effectués dans des panels (A, B) montrent les calculs de la respiration basale, de la respiration maximale, de la production liée à l’ATP et de la fuite de protons. (C) Les capacités métaboliques ont été déterminées à partir des lymphocytes T CD8 OT-I et correspondent aux données présentées dans le panneau (A). (D) Les capacités métaboliques déterminées à partir des lymphocytes T C57BL/6 CD8 correspondent aux données présentées dans le panneau (B). L’analyse du test t non appariée de Student a été effectuée pour l’ensemble de la figure où *p < 0,05, **p < 0,005, ***p < 0,0005 et ****p < 0,0001. Abréviations : OCR = Taux de consommation d’oxygène ; Oligo = oligomycine ; FCCP = dicyanure de 4-(trifluorométhoxy) phényl) carbonohydrazonoyle ; ant = antimycine A ; pourriture = roténone. Veuillez cliquer ici pour voir une version agrandie de cette figure.
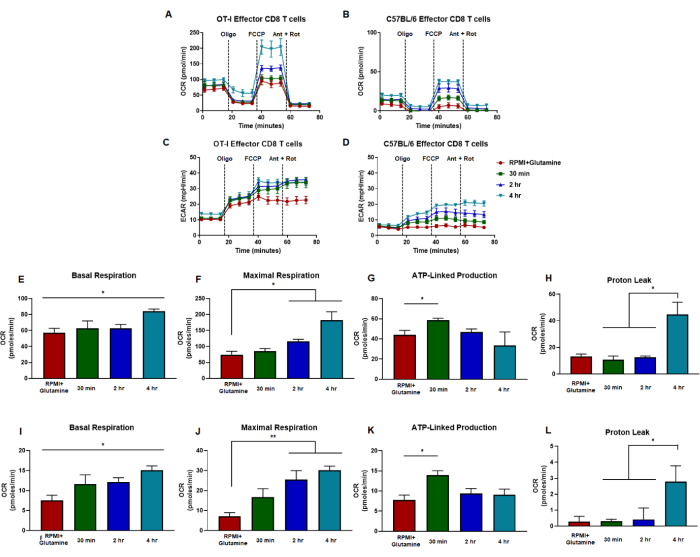
Figure 5 : Tendances similaires des réponses des lymphocytes T CD8 effecteurs à la signalisation du récepteur LPA, indépendamment de l’activation spécifique de l’antigène ou polyclonale. (A,B) Le taux de consommation d’oxygène des lymphocytes T CD8 est mesuré à partir de cellules générées par (A) la stimulation et l’expansion spécifiques de l’antigène des lymphocytes T CD8 OT-I ou (B) la stimulation polyclonale anti-CD3/CD28 et l’expansion des lymphocytes T CD8 de souris C57B/6 de type sauvage. (C, D) Les mesures du taux d’acidification extracellulaire des lymphocytes T CD8 effecteurs sont présentées pour les cellules générées par (C) la stimulation et l’expansion spécifiques de l’antigène des lymphocytes T CD8 OT-I ou (D) la stimulation polyclonale et l’expansion des lymphocytes T CD8 anti-CD3/CD28 de souris C57B/6 de type sauvage. Les capacités métaboliques des lymphocytes T CD8 ont été mesurées dans des milieux supplémentés en glutamine (rouge) ou 1 μM LPA pendant 30 min (vert), 2 h (bleu) ou 4 h (vert). L’oligomycine, le FCCP, l’antimycine A et la roténone ont été injectés à des intervalles de 18 minutes avec un milieu de glucose de 25 mM. Les résultats sont présentés sous forme de données représentatives et ont été obtenus à l’aide de n = 6 répétitions techniques. (E-H) Les mesures de capacité dérivées des tests de flux métaboliques effectués dans des panels (A, C) montrent les calculs de la respiration basale, de la respiration maximale, de la production liée à l’ATP et de la fuite de protons. (I-L) Calculs de capacité à partir de panels (B,D) montrant la respiration basale, la respiration maximale, la production liée à l’ATP et la fuite de protons. L’ensemble du chiffre a été analysé statistiquement à l’aide de l’ANOVA à un facteur où *p < 0,05. Abréviations : OCR = Taux de consommation d’oxygène ; ECAR = taux d’acidification extracellulaire ; Oligo = oligomycine ; FCCP = dicyanure de 4-(trifluorométhoxy) phényl) carbonohydrazonoyle ; ant = antimycine A ; pourriture = roténone. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Stratégies de stimulation des récepteurs des lymphocytes T en temps réel avec injection aiguë d’anti-CD3/CD28. (A,B) Stratégie d’injection aiguë impliquant de l’anti-CD3 biotinylé, de la streptavidine et de l’anti-CD28 pour l’évaluation de la fonction mitochondriale. Les panneaux montrent les capacités métaboliques des lymphocytes T effecteurs OT-I CD8 stimulés par l’antigène, montrant spécifiquement (A) le taux d’acidification extracellulaire et (B) le taux de consommation d’oxygène. Les injections utilisent uniquement un milieu (rouge), un anti-CD3 biotinylé (vert), un anti-CD28 + streptavidine (bleu), ou une combinaison d’anti-CD3 biotinylé + anti-CD28 + streptavidine (sarcelle). (C, D) Injection aiguë de billes magnétiques conjuguées à des anti-CD3/CD28 pour évaluer l’activité mitochondriale. Les panneaux montrent les capacités métaboliques des lymphocytes T effecteurs OT-I CD8 stimulés par l’antigène, montrant spécifiquement (C) le taux d’acidification extracellulaire et (D) le taux de consommation d’oxygène. Les injections utilisent uniquement un média (rouge) ou une injection de billes anti-CD3/CD28 (sarcelle). Des dosages ont été effectués avec des injections d’oligomycine, de FCCP, d’antimycine A et de roténone à des intervalles de 18 minutes dans des milieux supplémentés en glucose de 25 mM. Les résultats sont présentés sous forme de données représentatives et ont été obtenus à l’aide de n = 6 répétitions techniques. (E) Calculs de capacité à partir de panels (A-D) montrant le métabolisme de base avant l’injection (rouge), la respiration après l’injection (bleu) et la capacité respiratoire maximale (gris). Les conditions sont séparées en fonction de l’injection intra-essai. (F) Calculs de capacité montrant la respiration basale, la respiration maximale, la production liée à l’ATP et la fuite de protons. Les statistiques pour l’ensemble de cette figure ont été effectuées à l’aide de l’ANOVA à un facteur où *p < 0,05, **p < 0,005, ***p < 0,0005 et ****p < 0,0001. Abréviations : OCR = Taux de consommation d’oxygène ; ECAR = taux d’acidification extracellulaire ; Oligo = oligomycine ; FCCP = dicyanure de 4-(trifluorométhoxy) phényl) carbonohydrazonoyle ; ant = antimycine A ; pourriture = roténone. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Dans cet article, nous décrivons un protocole pour évaluer la fonction mitochondriale des lymphocytes T CD8 naïfs et effecteurs. Nous détaillons et comparons les méthodes de préparation de lymphocytes T CD8 spécifiques de l’antigène et polyclonaux en utilisant des souris OT-I et C57BL/6. Nos résultats démontrent qu’il existe des tendances similaires dans le métabolisme malgré la méthode d’activation et de prétraitement dans les lymphocytes T CD8. Les données révèlent que l’activation spécifique de l’antigène conduit à un plus grand nombre de lymphocytes T OT-I métaboliquement actifs par rapport à leurs homologues de type sauvage C57BL/6 stimulés par des anti-CD3 et des anti-CD28. Le protocole décrit ici montre que le test fonctionnel mitochondrial, le Mito Stress Test, est un test très sensible et constamment reproductible qui produit des résultats fiables dans de multiples conditions et types de cellules. Nos résultats et notre protocole détaillé contribuent à la reconnaissance croissante de ce test en tant que méthodologie fondamentale pour l’analyse du métabolisme et de la bioénergétique des lymphocytes T CD8.
Alors que l’immunothérapie et divers traitements cellulaires continuent de progresser, l’importance de l’application de thérapies ciblant les lymphocytes T augmente également41. La réponse à l’immunothérapie et les réponses immunitaires antitumorales reposent sur le métabolisme médié par les lymphocytes T, la signalisation calcique et le flux oxydatif déclenché par l’activation en amont du TCR42. L’efficacité métabolique et la flexibilité sont nécessaires pour des réponses optimales des lymphocytes T CD8 5,6,7,15,17,26,43, tandis que l’augmentation des fuites de protons et les dommages oxydatifs qui en résultent altèrent les réponses des lymphocytes T et favorisent le dysfonctionnement 9,44. La prolifération des lymphocytes T et la production de cytokines peuvent être sauvées en atténuant le stress oxydatif mitochondrial 5,13,20,24,25,29. Dans le cadre de nos expériences, nous avons utilisé des lymphocytes T CD8 naïfs qui sont cultivés dans l’IL-2, ce qui maintient la viabilité ; cependant, ces lymphocytes T CD8 ne sont sans doute plus équivalents aux lymphocytes T CD8 naïfs de bonne foi. Ainsi, nous avons choisi d’utiliser des lymphocytes T CD8 naïfs directement de la souris pour des données de meilleure qualité et des cellules moins susceptibles d’être affectées par les cytokines. Dans l’ensemble, il est crucial d’optimiser les techniques d’examen du métabolisme dans les sous-ensembles de lymphocytes T.
Le destin des lymphocytes T CD8 est en partie dirigé par la programmation métabolique qui affecte les réponses immunitaires adaptatives 2,4,45. Les lymphocytes T CD8 naïfs sortent de l’état de quiescence lors de la stimulation TCR 25,46,47,48,49,50. Néanmoins, la stimulation continue du TCR entraîne l’épuisement des lymphocytes T CD8, ce qui se traduit par un phénotype nettement moins énergique que les lymphocytes T CD8 fonctionnels 3,20,51,52. Cependant, cet impact sur le métabolisme peut être atténué et potentiellement revitaliser les lymphocytes T CD8 épuisés2, 3, 20, 46, 51, 52. Bien que le(s) mécanisme(s) exact(s) régissant le destin et la différenciation exhaustive des lymphocytes T CD8 restent mal compris, les lymphocytes T CD8 dysfonctionnels et/ou épuisés ont généralement des mitochondries défectueuses et une surproduction de ROS qui sont des facteurs clés dans la régulation de la fonction effectrice des lymphocytes T CD8 9,15,53. Le métabolisme, les phénotypes et la différenciation exhaustive des lymphocytes T CD8 ont été étudiés à l’aide du test de stress Mito. Historiquement, la stimulation persistante du TCR entraînant une perte progressive des fonctions effectrices définit l’épuisement des lymphocytes T CD8 11,13,16,17. Cependant, des efforts récents ont été déployés pour mieux caractériser les lymphocytes T CD8 épuisés et montrer que la chromatine et les paysages transcriptionnels définissent également l’épuisement et sont étroitement liés au flux métabolique 18,27,28. Dans l’ensemble, la stimulation persistante du TCR et les phénotypes et séquelles métaboliques qui en découlent peuvent être étudiés avec le test de stress Mito pour identifier potentiellement les vulnérabilités métaboliques et les événements déterminants du destin.
La stimulation du TCR initie la signalisation calcique en aval nécessaire à l’exocytose des granules et à la destruction dirigée des lymphocytes T24,33. Notamment, les événements précédents, tels que l’activation de l’inflammasome et la production d’IFNγ, reposent sur un ATP54 persistant et soutenu. Au cours de la signalisation calcique, il y a une dérégulation signalée de l’efficacité mitochondriale, connue sous le nom de phénomène de « flash mitochondrial » 55,56,57,58. Le flash mitochondrial représente un processus dans lequel les mitochondries respirant activement subissent brièvement une respiration découplée, ce qui entraîne une réduction de l’ATP et une augmentation de l’explosion de ROS55,56. Il y a eu peu de recherches sur le flash mitochondrial et sa pertinence dans les lymphocytes T CD8 reste largement inexplorée. Il est important de noter que les méthodologies décrites dans cette étude peuvent être utilisées pour étudier ces phénomènes, la différenciation exhaustive des lymphocytes T CD8 et d’autres profils de cellules immunitaires.
En résumé, ces méthodologies et outils offrent une approche plus complète de l’étude du métabolisme aigu et chronique. Le test de stress Mito peut être appliqué pour examiner la programmation métabolique et la façon dont elle régule le dysfonctionnement des effecteurs et la différenciation exhaustive dans les lymphocytes T CD8. La reprogrammation métabolique dans les lymphocytes peut être un facteur dans la compréhension des mécanismes sous-jacents à la tolérance immunitaire, au dysfonctionnement des lymphocytes T CD8 et à l’épuisement des réponses immunitaires. De plus, le métabolisme et/ou les médiateurs lipidiques jouent un rôle clé dans la cytotoxicité et l’épuisement des lymphocytes T CD89 et pourraient donc être ciblés comme une nouvelle approche pour prévenir l’épuisement ou potentiellement inverser la différenciation exhaustive pour réduire l’immunité antitumorale. Dans l’ensemble, le test Cell Mito Stress Test est un outil robuste qui devrait être utilisé pour répondre à ces questions non résolues sur l’immunométabolisme.
Déclarations de divulgation
Les auteurs n’ont aucun intérêt concurrent à divulguer.
Remerciements
La Fondation Hertz, la Fondation Amy Davis, la Fondation de la famille Moore et la Fondation Heidi Horner ont apporté un soutien inestimable, dont nous sommes reconnaissants. Ce travail a également été soutenu en partie par des subventions du NIH à RMT (AI052157, AI136534), tandis que JAT a été soutenu par le Hertz Graduate Fellowship.
matériels
| Name | Company | Catalog Number | Comments |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Anti-CD28 | Biolegend | 102116 | |
| Anti-CD3/CD28 Dynabeads | ThermoFisher | 11456D | |
| Biotinylated anti-CD3 | Biolegend | 317320 | |
| Bovine Serum Albumin | Sigma-Aldrich | 108321-42-2 | |
| CD8a+ T cell isolation kit | Miltenyi Biotec | 130-104-075 | |
| Cell Strainers (100 µm) | CELL TREAT | 229485 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E8008 | |
| Ficoll | Sigma-Aldrich | 26873-85-8 | density gradient medium |
| FCCP ((4-(trifluoromethoxy) phenyl) carbonohydrazonoyl dicyanide) | Sigma-Aldrich | C2920 | |
| Glucose | Sigma-Aldrich | G-6152 | |
| Glutamine | Sigma-Aldrich | G7513 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | Positive selection columns |
| Magnetic cell separation column | Miltenyi Biotec | 130-042-301 | |
| Microplate | Agilent | 102601-100 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Pyruvate | Sigma-Aldrich | 113-24-6 | |
| Recobinant IL-2 | PeproTech | 200-02 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Seahorse media | Agilent | 103576-100 | |
| Sensor cartridge | Agilent | 102601-100 | |
| Streptavidin | Sigma-Aldrich | A9275 | |
| Sterile 6 well plate | CELL TREAT | 230601 | |
| Sterile 24 well plate | CELL TREAT | 229524 | |
| XF Calibrant | Agilent | 102601-100 |
Références
- Patsoukis, N., et al. PD-1 alters T-cell metabolic reprogramming by inhibiting glycolysis and promoting lipolysis and fatty acid oxidation. Nat Commun. 6, 6692 (2015).
- Scharping, N. E., et al. Mitochondrial stress induced by continuous stimulation under hypoxia rapidly drives T cell exhaustion. Nat Immunol. 22, 205-215 (2021).
- Schurich, A., et al. Distinct Metabolic Requirements of Exhausted and Functional Virus-Specific CD8 T Cells in the Same Host. Cell Rep. 16 (5), 1243-1252 (2016).
- Zhang, L., Romero, P. Metabolic control of CD8(+) T cell fate decisions and antitumor immunity. Trends Mol Med. 24 (1), 30-48 (2018).
- Batabyal, R., et al. Metabolic dysfunction and immunometabolism in COVID-19 pathophysiology and therapeutics. Int J Obes (Lond). 45 (6), 1163-1169 (2021).
- Chavakis, T. Immunometabolism: Where immunology and metabolism meet. J Innate Immun. 14, 1-3 (2022).
- Frezza, C., Mauro, C. Editorial: The metabolic challenges of immune cells in health and disease. Front Immunol. 6, 293 (2015).
- Wang, X., Ping, F. F., Bakht, S., Ling, J., Hassan, W. Immunometabolism features of metabolic deregulation and cancer. J Cell Mol Med. 23 (2), 694-701 (2019).
- Turner, J. A., et al. Lysophosphatidic acid modulates CD8 T cell immunosurveillance, metabolism, and anti-tumor immunity. Nat Commun. 14, 3214 (2023).
- Coussens, L. M., Werb, Z. Inflammation and cancer. Nature. 420, 860-867 (2002).
- Jiang, Y., Li, Y., Zhu, B. T-cell exhaustion in the tumor microenvironment. Cell Death Dis. 6 (6), e1792 (2015).
- Krangel, M. S. Mechanics of T cell receptor gene rearrangement. Curr Opin Immunol. 21 (2), 133-139 (2009).
- Barber, D. L., et al. Restoring function in exhausted CD8 T cells during chronic viral infection. Nature. 439, 682-687 (2006).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Bengsch, B., et al. Bioenergetic insufficiencies due to metabolic alterations regulated by the inhibitory receptor PD-1 are an early driver of CD8(+) T cell exhaustion. Immunity. 45 (2), 358-373 (2016).
- Blank, C. U., et al. Defining 'T cell exhaustion'. Nat Rev Immunol. 19, 665-674 (2019).
- Dolina, J. S., Van Braeckel-Budimir, N., Thomas, G. D., Salek-Ardakani, S. CD8(+) T cell exhaustion in cancer. Front Immunol. 12, 715234 (2021).
- Mognol, G. P., et al. Exhaustion-associated regulatory regions in CD8(+) tumor-infiltrating T cells. Proc Natl Acad Sci U S A. 114 (13), E2776-E2785 (2017).
- Wang, D., et al. A comprehensive profile of TCF1(+) progenitor and TCF1(-) terminally exhausted PD-1(+)CD8(+) T cells in head and neck squamous cell carcinoma: implications for prognosis and immunotherapy. Int J Oral Sci. 14 (1), 8 (2022).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21, 1022-1033 (2020).
- Kang, S., Brown, H. M., Hwang, S. Direct antiviral mechanisms of interferon-gamma. Immune Netw. 18 (5), e33 (2018).
- Samuel, C. E. Antiviral actions of interferons. Clin Microbiol Rev. 14, 778-809 (2001).
- Schellekens, H., Weimar, W., Cantell, K., Stitz, L. Antiviral effect of interferon in vivo may be mediated by the host. Nature. 278, 742 (1979).
- Radoja, S., et al. CD8(+) tumor-infiltrating T cells are deficient in perforin-mediated cytolytic activity due to defective microtubule-organizing center mobilization and lytic granule exocytosis. J Immunol. 167 (9), 5042-5051 (2001).
- van der Windt, G. J., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Balmer, M. L., et al. Memory CD8(+) T cells require increased concentrations of acetate induced by stress for optimal function. Immunity. 44 (6), 1312-1324 (2016).
- Pereira, R. M., Hogan, P. G., Rao, A., Martinez, G. J. Transcriptional and epigenetic regulation of T cell hyporesponsiveness. J Leukoc Biol. 102, 601-615 (2017).
- Sen, D. R., et al. The epigenetic landscape of T cell exhaustion. Science. 354, 1165-1169 (2016).
- Quintana, A., et al. T cell activation requires mitochondrial translocation to the immunological synapse. Proc Natl Acad Sci U S A. 104 (36), 14418-14423 (2007).
- Brindley, D. N. Lysophosphatidic acid signaling in cancer. Cancers (Basel). 12 (12), 3791 (2020).
- Chae, C. S., et al. Tumor-derived lysophosphatidic acid blunts protective type I interferon responses in ovarian cancer. Cancer Discov. 12, 1904-1921 (2022).
- Kremer, K. N., et al. LPA suppresses T cell function by altering the cytoskeleton and disrupting immune synapse formation. Proc Natl Acad Sci U S A. 119 (15), e2118816119 (2022).
- Mathew, D., et al. LPA5 is an inhibitory receptor that suppresses CD8 T-cell cytotoxic function via disruption of early TCR signaling. Front Immunol. 10, 1159 (2019).
- Mathew, D., Torres, R. M. Lysophosphatidic acid is an inflammatory lipid exploited by cancers for immune evasion via mechanisms similar and distinct from CTLA-4 and PD-1. Front Immunol. 11, 531910 (2020).
- Oda, S. K., et al. Lysophosphatidic acid inhibits CD8 T cell activation and control of tumor progression. Cancer Immunol Res. 1 (4), 245-255 (2013).
- Lidgerwood, G. E., Pitson, S. M., Bonder, C., Pebay, A. Roles of lysophosphatidic acid and sphingosine-1-phosphate in stem cell biology. Prog Lipid Res. 72, 42-54 (2018).
- Torres, R. M., Turner, J. A., D'Antonio, M., Pelanda, R., Kremer, K. N. Regulation of CD8 T-cell signaling, metabolism, and cytotoxic activity by extracellular lysophosphatidic acid. Immunol Rev. 317 (1), 203-222 (2023).
- Turner, J. A., et al. BRAF modulates lipid use and accumulation. Cancers (Basel). 14 (9), 2110 (2022).
- Hogquist, K. A., et al. T cell receptor antagonist peptides induce positive selection. Cell. 76, 17-27 (1994).
- Li, Y., Kurlander, R. J. Comparison of anti-CD3 and anti-CD28-coated beads with soluble anti-CD3 for expanding human T cells: differing impact on CD8 T cell phenotype and responsiveness to restimulation. J Transl Med. 8, 104 (2010).
- Ralli, M., et al. Immunotherapy in the treatment of metastatic melanoma: current knowledge and future directions. J Immunol Res. 2020, 9235638 (2020).
- Philip, M., Schietinger, A. CD8(+) T cell differentiation and dysfunction in cancer. Nat Rev Immunol. 22, 209-223 (2022).
- Bajrai, L. H., et al. Understanding the role of potential pathways and its components including hypoxia and immune system in case of oral cancer. Sci Rep. 11, 19576 (2021).
- Nicholls, D. G. Mitochondrial proton leaks and uncoupling proteins. Biochim Biophys Acta Bioenerg. 1862, 148428 (2021).
- Tyrakis, P. A., et al. S-2-hydroxyglutarate regulates CD8(+) T-lymphocyte fate. Nature. 540, 236-241 (2016).
- Guo, Y., et al. Metabolic reprogramming of terminally exhausted CD8(+) T cells by IL-10 enhances anti-tumor immunity. Nat Immunol. 22, 746-756 (2021).
- Notarangelo, G., et al. Oncometabolite d-2HG alters T cell metabolism to impair CD8(+) T cell function. Science. 377 (6614), 1519-1529 (2022).
- Yang, K., et al. T cell exit from quiescence and differentiation into Th2 cells depend on Raptor-mTORC1-mediated metabolic reprogramming. Immunity. 39 (6), 1043-1056 (2013).
- Ricciardi, S., et al. The translational machinery of human CD4(+) T cells is poised for activation and controls the switch from quiescence to metabolic remodeling. Cell Metab. 28 (6), 895-906.e5 (2018).
- Moller, S. H., Hsueh, P. C., Yu, Y. R., Zhang, L., Ho, P. C. Metabolic programs tailor T cell immunity in viral infection, cancer, and aging. Cell Metab. 34 (3), 378-395 (2022).
- Alrubayyi, A., et al. Functional restoration of exhausted CD8 T cells in chronic HIV-1 infection by targeting mitochondrial dysfunction. Front Immunol. 13, 908697 (2022).
- Vignali, P. D. A., et al. Hypoxia drives CD39-dependent suppressor function in exhausted T cells to limit antitumor immunity. Nat Immunol. 24, 267-279 (2023).
- Ogando, J., et al. PD-1 signaling affects cristae morphology and leads to mitochondrial dysfunction in human CD8(+) T lymphocytes. J Immunother Cancer. 7 (1), 151 (2019).
- Billingham, L. K., et al. Mitochondrial electron transport chain is necessary for NLRP3 inflammasome activation. Nat Immunol. 23, 692-704 (2022).
- Eberhardt, D. R., et al. EFHD1 ablation inhibits cardiac mitoflash activation and protects cardiomyocytes from ischemia. J Mol Cell Cardiol. 167, 1-14 (2022).
- Hou, T., et al. Identification of EFHD1 as a novel Ca(2+) sensor for mitoflash activation. Cell Calcium. 59 (5), 262-270 (2016).
- Mun, S. A., et al. Structural and biochemical characterization of EFhd1/Swiprosin-2, an actin-binding protein in mitochondria. Front Cell Dev Biol. 8, 628222 (2020).
- Stein, M., et al. A defined metabolic state in pre B cells governs B-cell development and is counterbalanced by Swiprosin-2/EFhd1. Cell Death Differ. 24 (7), 1239-1252 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon