Method Article
قياس وظيفة الميتوكوندريا للخلايا التائية CD8 الساذجة والمستجيبة
In This Article
Summary
يمكن استجواب الطاقة الحيوية للخلايا التائية CD8 باستخدام اختبار الإجهاد ميتو. يمكن استخدام هذه المنهجية لدراسة البرمجة الأيضية الحادة والمزمنة. يصف هذا البروتوكول مناهج لفحص العلاقات بين بيولوجيا مستقبلات الخلايا التائية وتحليل الطاقة الحيوية.
Abstract
لقد حظي فهم كيفية تأثير التمثيل الغذائي المناعي على وظيفة الخلايا الليمفاوية وتمايزها ومصيرها باهتمام واهتمام كبيرين. تم استكشاف بيولوجيا الخلايا الليمفاوية باستخدام تحليل الطاقة الحيوية وأصبحت الآن أداة استيراد حاسمة في هذا المجال. وبالتالي ، سعينا إلى تحسين اختبار تحليل الطاقة الحيوية الذي يمكن تكييفه مع المعالجات المسبقة والحقن الحاد لتحفيز المستقبلات. هنا ، قمنا بتقييم استقلاب الخلايا التائية CD8 خارج الجسم الحي باستخدام اختبار إجهاد الخلية ميتو لتقييم معدلات استهلاك الأكسجين والتحمض خارج الخلية في خلايا CD8 T الساذجة والمستجيبة. تم اشتقاق الخلايا التائية المستجيبة الخاصة بالمستضد CD8 عن طريق التحفيز خارج الجسم الحي ، وخلايا CD8 T الساذجة التي تم حصادها من خلايا الطحال وعزلها بفصل عمود الخرزة المغناطيسية.
يتم إجراء المعالجات المسبقة في ألواح دقيقة ونقوم بتفصيل كيفية تحضير خراطيش المستشعر. نوضح كيف يمكن تحميل منافذ الحقن بالأدوية لقياس قدرات التمثيل الغذائي بشكل غير مباشر ومع معدلات التمثيل الغذائي ، يمكن استخدام هذا البروتوكول لدراسة نشاط إنزيم معين. يمكن دراسة تحفيز مستقبلات الخلايا التائية في الوقت الفعلي من خلال الحقن الحاد والتحفيز باستخدام مضاد CD3 / CD28 باستخدام منافذ الحقن. تستخدم أجهزة تحليل الأدوات للقياسات وجمع البيانات ويتم تصور البيانات باستخدام برامج لتفسير التمثيل الغذائي الخلوي. تنتج هذه الاستراتيجية كمية كبيرة من البيانات حول بيولوجيا الخلايا المناعية والطاقة الحيوية للميتوكوندريا مما يسمح للباحثين بتخصيص البروتوكول بطرق عديدة لاستكشاف استقلاب الخلايا التائية CD8.
Introduction
يتأثر مصير ووظائف الخلايا المناعية بشكل كبير بالتمثيل الغذائي والاستهلاك التأكسدي والتنفس اللاهوائي1،2،3،4. في الآونة الأخيرة ، كان هناك اهتمام متزايد باستهداف التعديل الأيضي كاستراتيجية لإعادة برمجة أو تنشيط مصير الخلايا التائية CD8 ووظيفة المستجيب وتحسين التصفية الفيروسية أو تعزيز المناعة الذاتية المضادة للورم5،6،7،8،9. والجدير بالذكر أن إشارات مستقبلات المستضد من خلال مستقبل الخلايا التائية (TCR) هي مطلب رئيسي لتمايز الخلايا التائية CD8 مما يؤدي إلى إرسال إشارات المصب وتنشيطها10،11،12 (الشكل 1). يؤدي التعرض المطول للإهانات المناعية إلى تحفيز مستمر خاص بالمستضد على TCR مما يؤدي في النهاية إلى حالات ملتهبة مزمنة ، وإرهاق الخلايا التائية ، وإعادة تشكيل البيئة المكروية المناعية ، والهروب المناعي11،13،14،15،16،17،18،19.
يختلف التمثيل الغذائي للخلايا التائية CD8 المستنفدة بشكل أساسي عن الخلايا التائية المستجيب الوظيفيCD8 2،3،14،15،18،20. يتم تحديد تمايز الخلايا التائية وإفراز γ الإنترفيرون (IFNγ) وقدرة الاستدعاء جزئيا من خلال وظيفة الميتوكوندريا ومنتجات انهيار أكسدة β. IFNγ + خلايا CD8 T هي مكونات مهمة لكل من الاستجابات المناعية المضادة للورم والمضادة للفيروسات21،22،23. يعد التدفق الأيضي المحدد عن طريق تحلل السكر وسلسلة نقل الإلكترون أمرا مهما لتنشيط الخلايا التائية CD8 وإفراز السيتوكين واستجابات الذاكرة4،11،13،15،18،24،25،26،27،28. تتطلب الاستجابات المثلى ، بما في ذلك تنشيط الخلايا التائية وتمايز المستجيب ، استجابة ميتوكوندريا منسقة ومحددة ، بينما تميز عيوب الميتوكوندريا وأنواع الأكسجين التفاعلية المفرطة (ROS) الخلايا التائية المنهكة أو المختلةوظيفيا 9،29. في الآونة الأخيرة ، يعزز التحفيز المستمر ل TCR لخلايا CD8 T في المختبر التمايز الشامل للخلايا التائية CD8 جزئيا عن طريق إحداث الإجهاد التأكسدي وإعادة برمجة التمثيل الغذائي التأكسدي والقدرات الأيضية المطلوبة لتكاثر الخلايا التائية1،2،13،20،24،29. إجمالا ، تعد محاور التحكم في التمثيل الغذائي مكونات حاسمة في توجيه تمايز الخلايا التائية CD8 وتطورها إلى المستجيب أو الذاكرة أو الأنماط الظاهرية المنهكة / المختلة.
توجه المركبات الأيضية أيضا استجابات الخلايا المناعية من خلال العمل كجزيئات إشارات أوتوكرين أو باراكرين9،30،31،32،33،34،35. السفينجوزين -1-فوسفات (S1P) وحمض الليزوفوسفاتيديك (LPA) عبارة عن دهون نشطة بيولوجيا والتهابية تشير عبر المستقبلات المقترنة ببروتين G (GPCRs) لتعديل خروج الخلايا الليمفاوية والسمية الخلوية بواسطة خلايا CD8 T36. تعيد إشارات LPA عبر مستقبلات GPCR LPA على خلايا CD8 T برمجة عملية التمثيل الغذائي لزيادة تحلل الدهون وأكسدة الأحماض الدهنية وتسرب البروتون9. إجمالا ، فإن الطاقة الحيوية والتمثيل الغذائي لخلايا CD8 T مدفوعة إلى حد كبير بتوافر الركيزة والإشارات البيئية والمتطلبات النشطة.
أصبحت منهجيات استجواب استقلاب الخلايا التائية CD8 أكثر أهمية من أي وقت مضى. يوفر اختبار إجهاد الخلية ميتو تقييما شاملا للطاقة الحيوية وهو معترف به الآن كتقنية مميزة في مجال التمثيل الغذائي المناعي وطاقة الخلايا التائية CD89،37. تم استخدام الخلايا الملتصقة تاريخيا في اختبار ميتو للإجهاد38. ومع ذلك ، هناك اهتمام متزايد بتطبيق هذا البروتوكول على الخلايا المزروعة في معلق واستخدام الخلايا المناعية على وجه التحديد لمقايسة اختبار إجهاد الخلية ميتو. هنا ، نقدم بروتوكولا مفصلا لقياس النشاط الأيضي لخلايا CD8 T بناء على منشورنا الأخير9. نقدم شرحا مفصلا لتوسع الخلايا التائية CD8 ، وعزل الخلايا التائية CD8 الساذجة ، وإعداد الفحص ، والعلاج ببروتوكولات لكل من المعالجات المسبقة والحقن الحادة في اختبار إجهاد الخلية ميتو. الأهم من ذلك ، أننا نقارن ونقارن بين طرق متعددة لتحفيز TCR وتنشيط الخلايا التائية CD8 ، بما في ذلك تحفيز TCR متعدد النسيلة والمستضد.
يوضح هذا البروتوكول بالتفصيل التحفيز الخاص بالمستضد باستخدام الفئران المعدلة وراثيا OT-I (نموذج فأر كلاسيكي معدل وراثيا) حيث تعبر جميع خلايا الفأر التائية عن نفس جينات Vα2 و Vβ5 39. تحتوي جميع خلايا CD8 T للماوس OT-I على نفس TCR المحدد ضد أوتابيبتيد البيضا (OVA257-264 مكتوب أيضا باسم تسلسل الأحماض الأمينية SIINFEKL أو N4 ، وهو حاتم تمت دراسته على نطاق واسع ، عند تقديمه بواسطة مركب التوافق النسيجي الرئيسي (MHC) من الفئة الأولى ، ينشط خلايا CD8 T السامةللخلايا 39 (الشكل 1 أ). بشكل عام ، يستخدم علماء المناعة نموذج الفأر المعدل وراثيا OT-I على نطاق واسع لدراسة إشارات TCR ووظيفة مستجيب الخلايا التائية الخاصة بالمستضد. على عكس التنشيط أحادي النسيلة مع نموذج الفأر OT-I ، يمكن إنشاء خلايا CD8 T متعددة النسيلة مع الأجسام المضادة المضادة ل CD3 / CD28 ضد الوحدات الفرعية TCR CD3 وجزيء التحفيز المشتركCD28 40 (الشكل 1 ب). تتجاوز الأجسام المضادة ل CD3 / CD28 المكون الخاص بالمستضد لإشارات TCR لتنشيط مجموعة متعددة النسيلة من الخلايا التائية40. في النهاية ، تقارن النتائج الموضحة في هذا التقرير طرقا متعددة لاستخدام اختبار إجهاد الخلية ميتو لتحديد التدفق الأيضي الديناميكي في خلايا CD8 T.
Protocol
تم الاحتفاظ بالفئران في بيئة خالية من مسببات الأمراض وتم صيانتها وفقا لمعايير ولوائح اللجنة المؤسسية لرعاية واستخدامها.
1. توليد وتوسيع الخلايا التائية CD8 عن طريق التحفيز الخاص بالمستضد
- في اليوم الأول ، حصاد خلايا الطحال المشتقة من الفئران OT-I. ثم قم بإعدادها وتنشيطها في المختبر باستخدام ببتيد SIINFEKL (4).
- نظف مساحة غطاء المحرك ، وقم بإعداد الكواشف ، واجمع وسط الماوس. قم بتسخين وسائط الماوس في حاضنة الماء أو الخرز.
- في طبق مكون من 6 آبار ، ضع 7 مل من وسط الماوس في بئر واحد ثم 3 مل أخرى من وسط الماوس في بئر مختلف. بعد ذلك ، أدخل مصفاة في البئر تحتوي على 7 مل من الوسائط.
- أحضر فأرا إلى المختبر من الحمام في قفص النقل. انقل الماوس إلى قفص جديد فارغ وضع محول ثاني أكسيد الكربون2 في الأعلى. قتل الماوس باستخدام ثاني أكسيد الكربون2 حتى مستوى تدفق 2.75.
- راقب الماوس بعناية وراقب أي علامات للضيق. بعد التنفس الأخير ، راقب علامات التنفس والحياة لمدة دقيقة واحدة على الأقل. قم بإيقاف تشغيل ثاني أكسيد الكربون2 وإجراء خلع عنق الرحم كطريقة ثانوية للقتل الرحيم. بعد ذلك ، قم بتنظيف سطح الطاولة والقفص وبقية منطقة العمل واحمل الماوس إلى غطاء التشريح.
- تشريح الطحال من الفأر.
- استخدم 70٪ من الإيثانول لتعقيم معدات التشريح ووضع الجانب الأيسر للماوس لأسفل ، ورش الجانب الأيسر من الماوس للتطهير.
- باستخدام أدوات نظيفة ، قم بتشريح لإزالة الجلد وتحديد الصفاق. قم بعمل شق صغير عبر الصفاق للعثور على الطحال ثم استئصال الطحال. ضع الطحال في الطبق المكون من 6 آبار فوق المصفاة.
- نظف المنطقة ، ضع جثة الفأر في كيس التخلص ، ثم ضع الكيس في الفريزر للتخلص منه.
- تأكد من نظافة المنطقة بأكملها وانقل اللوحة المكونة من 6 آبار إلى غطاء مزرعة الأنسجة للخطوات التالية.
- في غطاء مزرعة الأنسجة ، قم بتجانس الطحال وإعادة تعليق الخلايا في معلق أحادي الخلية بدون كتل.
- ادفع الطحال عبر المصفاة إلى البئر باستخدام 7 مل من الوسائط باستخدام مكبس حقنة سعة 5 مل.
- اشطف المصفاة وأي أنسجة متبقية باستخدام 3 مل من الوسط في البئر الإضافي.
- انقل معلق الخلية باستخدام ماصة مصلية إلى أنبوب مخروطي جديد سعة 10 مل.
- جهاز طرد مركزي لمدة 5 دقائق عند 500 × جم وشفط المادة الطافية باستخدام ماصة زجاجية.
- ليز خلايا الدم الحمراء.
- ابدأ عملية تحلل خلايا الدم الحمراء باستخدام 1 مل من المخزن المؤقت لتحلل ACK عن طريق تعليق الخلايا في المخزن المؤقت لتحلل ACK واحتضانها في درجة حرارة الغرفة لمدة 1-5 دقائق.
ملاحظة: يجب تحسين وقت الحضانة لمجموعة محددة من المخزن المؤقت لتحلل ACK لتحقيق أقصى قدر من تحلل الخلايا الحمراء مع الحد الأدنى من موت خلايا الطحال. - أضف 10 مل من الوسط إلى الأنبوب المخروطي للتحييد والطرد المركزي لمدة 5 دقائق عند 500 × جم.
- أعد تعليق الخلايا في 50 مل من الوسط وانقلها إلى قارورة T75.
- ابدأ عملية تحلل خلايا الدم الحمراء باستخدام 1 مل من المخزن المؤقت لتحلل ACK عن طريق تعليق الخلايا في المخزن المؤقت لتحلل ACK واحتضانها في درجة حرارة الغرفة لمدة 1-5 دقائق.
- تحفيز الخلايا باستخدام SIINFEKL (N4) الببتيد.
- أحضر ببتيد SIINFEKL إلى غطاء مزرعة الأنسجة. قم بتخزين ببتيد SIINFEKL عند -20 درجة مئوية.
- أضف SIINFEKL مباشرة إلى الوسائط لتحقيق تركيز نهائي يبلغ 2 ميكروغرام / مل. أضف 50 ميكرولتر من SIINFEKL (2 مجم / مل) إلى 50 مل من الوسط لتحقيق تركيز نهائي يبلغ 2 ميكروغرام / مل.
- احتضان الخلايا عند 37 درجة مئوية لمدة 72 ساعة.
- قم بتعقيم غطاء مزرعة الأنسجة باستخدام 70٪ من الإيثانول.
- نظف مساحة غطاء المحرك ، وقم بإعداد الكواشف ، واجمع وسط الماوس. قم بتسخين وسائط الماوس في حاضنة الماء أو الخرز.
- في اليوم الرابع ، اغسل الخلايا لإزالة الببتيد. باستخدام وسائط معدة حديثا مكملة ب IL-2 ، قم بتعليق الخلايا ثم أعد القارورة إلى الحاضنة.
- اجمع الخلايا من قارورة ثقافة الأنسجة T75 في أنبوب مخروطي سعة 50 مل. أجهزة الطرد المركزي والحبيبات OT-I خلايا CD8 T ثم إزالة أي وسائط زائدة مع الشفط. أضف 50 مل من وسائط الماوس الجديدة التي تحتوي على 1,000 وحدة / مل من IL-2 وانقل الخلايا المؤقتة إلى قارورة T75 جديدة.
- للتخزين ، احتفظ بكميات من مخزون IL-2 في الفريزر عند -80 درجة مئوية. التخزين عند -80 درجة مئوية سيقلل من تدهور الببتيد.
- تحضير خلايا CD8 T السامة للخلايا الخاصة بالمستضد الموسعة لمقايسة وظيفة الميتوكوندريا
- في اليوم السابع ، يتم إجراء فحص وظيفة الميتوكوندريا. قم بإعداد خلية OT-I CD8 T الخاصة بالمستضد للمقايس.
- اجمع خلايا CD8 T الحية.
- انقل الخلايا من قارورة ثقافة الأنسجة T-75 إلى أنبوب مخروطي جديد سعة 50 مل. ثم ، قم بالطرد المركزي للأنبوب المخروطي لمدة 5 دقائق عند 500 × جم.
- في أنبوب مخروطي جديد سعة 50 مل ، ماصة 20 مل من وسط تدرج الكثافة (الكثافة = 1.077 جم / مل) أثناء دوران الخلايا.
- بمجرد اكتمال الطرد المركزي ، خذ الأنبوب المخروطي وباستخدام 10 مل من الوسط ، أعد تعليق الخلايا. بعد ذلك ، عند سحب العينة ببطء شديد ، ضع طبقة من الخلايا المعلقة فوق تدرج الكثافة. دون إزعاج التدرج ، قم بالطرد المركزي للأنبوب المخروطي عند 1,300 × جم لمدة 20 دقيقة في درجة حرارة الغرفة مع ضبط الإعداد على أقصى تسارع والحد الأدنى من التباطؤ بدون فرامل.
- عند اكتمال الطرد المركزي، استخدم ماصة P1000 لتجميع الطبقة الوسطى من الخلايا التائية. تصور الطبقة الخلوية وتأكد من بقاء الماصة في الأعلى ولا تزعج الطبقة. انقل الخلايا المجمعة إلى أنبوب مخروطي جديد سعة 50 مل يحتوي على 30 مل من وسط الفأر الكامل. بعد ذلك ، قم بالطرد المركزي للأنبوب المخروطي سعة 50 مل عند 500 × جم لمدة 5 دقائق. عند اكتمال الطرد المركزي ، قم بشفط المادة الطافية الزائدة من خلايا OT-I CD8 T. مع 20 مل من وسط الفأر الطازج ، أعد تعليق الخلايا.
- باستخدام مقياس كثافة الدم ، احسب العدد الإجمالي للخلايا القابلة للحياة. قم بتلطيخ كمية صغيرة من الخلايا باللون الأزرق التربان في تخفيف 1: 4 لتحديد الخلايا الميتة.
ملاحظة: يمكن توقع ما يقرب من 40-60 × 106 خلايا من ماوس OT-I واحد. - مع خطوة طرد مركزي إضافية ، اغسل الخلايا المتبقية ب 20 مل إضافية من وسط الماوس الطازج. ثم باستخدام صفيحة دقيقة ، خلايا ماصة 200,000 خلية / بئر في وسط فأر كامل.
2. توليد وتوسيع خلايا CD8 T الخاصة ب poly عن طريق التحفيز المضاد ل CD3 / المضاد ل CD28
- في اليوم 0 ، قم بتغطية طبق مكون من 24 بئرا في CD3. أضف 1 مل من البيوتين المضاد ل CD3 بتركيز 5 ميكروغرام / مل ، مخفف في PBS ، إلى كل بئر من صفيحة 24 بئرا. ضع الطبق في حاضنة رطبة بنسبة 5٪ ثاني أكسيد الكربون2 طوال الليل.
- في اليوم التالي ، احصد فأر واجمع خلايا الطحال. قم بتنشيط خلايا الطحال في المختبر باستخدام anti-CD3/anti-CD28 باتباع الخطوات 1.1.1-1.1.5.3.
- باستخدام بروتوكول فصل الخرزة المغناطيسية ، قم بعزل خلايا CD8 T.
ملاحظة: تأكد من أن الخلايا تبقى باردة. في ظل ظروف التبريد المسبق ، اعمل بسرعة.- باستخدام 40 ميكرولتر من المخزن المؤقت MACS ، قم بإعادة تعليق الخلايا ب 10,000,000 خلية لكل 40 ميكرولتر من المخزن المؤقت MACS. إلى المحلول ، امزج جيدا 10 ميكرولتر من كوكتيل الأجسام المضادة للبيوتين في محلول الخلية ثم احتضانه لمدة 5 دقائق عند 4 درجات مئوية.
- أثناء انتظار احتضان الخلية في الثلاجة ، قم بإعداد عمود للاختيار الإيجابي. استخدم 3 مل من المخزن المؤقت لغسل العمود ثم تخلص من تدفق النفايات.
- بعد 5 دقائق ، اجمع محلول الأجسام المضادة للخلية من الثلاجة وأضف 30 ميكرولتر من مخزن MACS المؤقت لكل 10،000،000 خلية ، و 20 ميكرولتر من مضادات البيوتين ، ثم احتضنه عند 4 درجات مئوية لمدة 10 دقائق إضافية.
- قم بإعداد أنبوب تجميع جديد تحت عمود اختيار إيجابي باستخدام أنبوب مخروطي جديد سعة 15 مل. بمجرد اكتمال الحضانة لمدة 10 دقائق ، انقل تعليق الخلية إلى عمود التحديد الإيجابي. في أنبوب مخروطي جديد سعة 15 مل ، اجمع التدفق. باستخدام 3 مل من المخزن المؤقت MACS ، اغسل العمود لجمع الخلايا المتبقية.
ملاحظة: تأكد من أن تعليق الخلية بحجم لا يقل عن 0.5 مل. - أعد طلاء خلايا CD8 T المختارة بشكل إيجابي في اللوحة المكونة من 24 بئرا للتحفيز المضاد ل CD3 / المضاد ل CD28.
- جهاز الطرد المركزي للتدفق عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية. استنشق المادة الطافية الزائدة وقم بسحب الخلايا لإعادة تعليقها في المحلول. باستخدام مقياس الدم والتريبان الأزرق ، عد الخلايا.
ملاحظة: يرجى توقع ~ 8-10 × 10 6خلايا حية يتم عدها لكل طحال فأر. - بعد عد الخلايا ، أعد تعليق الخلايا التائية CD8 عند 500,000 خلية لكل مل. بعد ذلك ، قم بشفط 1 مل من PBS بعناية من اللوحة المكونة من 24 بئرا ، وأعد طلاء الخلايا المحسوبة في اللوحة المكونة من 24 بئرا ، وأضف 106 خلايا لكل بئر.
- لتحفيز الخلايا ، قم بسحب ماصة مضاد CD28 في الصفيحة المكونة من 24 بئرا بحيث يكون التركيز النهائي ل anti-CD28 هو 2 ميكروغرام / مل. لخلط الخلايا ، اضغط بعناية على اللوحة. احتفظ بالخلايا عند 37 درجة مئوية لمدة 72 ساعة قادمة.
- جهاز الطرد المركزي للتدفق عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية. استنشق المادة الطافية الزائدة وقم بسحب الخلايا لإعادة تعليقها في المحلول. باستخدام مقياس الدم والتريبان الأزرق ، عد الخلايا.
- باستخدام 70٪ من الإيثانول ، قم بتنظيف غطاء مزرعة الأنسجة.
- في اليوم 4 (بعد 72 ساعة)، قم بإزالة الخلايا من التحفيز المضاد ل CD3/anti-CD28. اغسل الخلايا عن طريق الطرد المركزي لخلايا CD8 T متعددة النسيرة. قم بإزالة المادة الطافية الزائدة عن طريق الشفط ثم أعد تعليق الخلايا بوسط فأر جديد مع 1,000 وحدة / مل من IL-2 مع 10 مل من الوسائط. انقل الخلايا المعلقة إلى صفيحة جديدة مكونة من 6 آبار وضعها في الحاضنة.
ملاحظة: 1.2.2. للتخزين ، يمكن تخزين حصص مخزون IL-2 في الفريزر عند -80 درجة مئوية. التخزين عند -80 درجة مئوية سيقلل من تدهور الببتيد. - قم بإعداد الخلايا التائية المستجيب متعدد النسيلة الموسع CD8 لمقايسة وظيفة الميتوكوندريا.
- في اليوم السابع ، قم بتجهيز ومعالجة خلايا CD8 T متعددة النسيلة للفحص.
- اجمع خلايا CD8 T الحية.
- انقل الخلايا من الصفيحة المكونة من 6 آبار إلى أنبوب مخروطي نظيف باستخدام ماصة ، ثم قم بالطرد المركزي للخلايا لمدة 5 دقائق عند 500 × جم.
- اتبع الخطوات 1.3.3.2-1.3.4.
ملاحظة: يمكن توقع ما يقرب من 10-30 مليون خلية CD8 T حية من ماوس C57BL / 6 واحد. - احفظ كمية من الخلايا لقياس التدفق الخلوي لتقييم نقاء CD8. لقياس التدفق الخلوي ، قم بتلطيخ الخلايا على الجليد لمدة 20 دقيقة باستخدام صبغة قابلة للحياة من الاختيار9.
3. حصاد خلايا CD8 التائية الساذجة
- في اليوم السابع ، احصد خلايا الطحال من الفأر باتباع الخطوات 1.1.1-1.1.5.3.
- قم بعزل الخلايا التائية CD8 باستخدام البروتوكول القائم على الخرزة المغناطيسية الموصوف في الخطوات 2.3-2.3.5.1.
- لوحة خلايا CD8 T في الصفيحة الدقيقة عند 200,000 خلية / لكل بئر في وسط كامل.
4. إجراء فحص وظيفة الميتوكوندريا
- قم بإعداد المواد في اليوم السابق لإجراء مقايسة وظيفة الميتوكوندريا.
- قم بترطيب خرطوشة المستشعر.
- Pipet 200 ميكرولتر من الماء المقطر في كل بئر من لوحة المنفعة. ضع خرطوشة المستشعر أعلى لوحة المرافق. تأكد من غمر نهايات خرطوشة المستشعر لضمان الترطيب المناسب. ضع كل من خرطوشة المستشعر ولوحة المرافق في حاضنة غير CO2 عند 37 درجة مئوية لمدة لا تقل عن 10 ساعات.
- قم بإعداد أنبوب مخروطي سعة 50 مل مع 50 مل من Calbrant وضعه في حاضنة غير CO2 واحتضانه طوال الليل.
- في اليوم السابق للفحص ، قم بإعداد الوسط الطازج الكامل استعدادا للمقايس. في المجموع 50 مل ، قم بإعداد محلول 1 ملي بيروفات ، 2 ملي جلوتامين ، و 10 ملي جلوكوز في وسط الفحص.
- قم بترطيب خرطوشة المستشعر.
- قم بإجراء فحص وظيفة الميتوكوندريا في اليوم التالي.
- قم بإزالة الماء المقطر من لوحة المرافق عن طريق النقر فوقها. أعد الترطيب ب 200 ميكرولتر من العيار. استخدم العيار الذي تم تخزينه في حاضنة غير ثاني أكسيد الكربون2 طوال الليل. بعد استبدال خرطوشة المستشعر أعلى لوحة المرافق. ضع لوحة المرافق مع خرطوشة المستشعر مرة أخرى في الحاضنة غير CO2 .
ملاحظة: لنفض الغبار على اللوحة ، قم بقلب اللوحة بسرعة وسرعة بحركة سائلة واحدة فوق الحوض بحيث يسقط الماء المقطر بسرعة من اللوحة.
- قم بإزالة الماء المقطر من لوحة المرافق عن طريق النقر فوقها. أعد الترطيب ب 200 ميكرولتر من العيار. استخدم العيار الذي تم تخزينه في حاضنة غير ثاني أكسيد الكربون2 طوال الليل. بعد استبدال خرطوشة المستشعر أعلى لوحة المرافق. ضع لوحة المرافق مع خرطوشة المستشعر مرة أخرى في الحاضنة غير CO2 .
- قم بإعداد خلايا CD8 T كما هو موضح أعلاه في الأقسام 1-3.
- باستخدام ماصة متعددة القنوات ، قم بلوحة 200,000 خلية لكل بئر عن طريق تعليق 10 × 106 خلايا في 4.5 مل من الوسط الكامل والطلاء 90 ميكرولتر لكل بئر. ثم أضف 90 ميكرولتر أخرى من الوسائط المخصصة لكل بئر أثناء المعالجة المسبقة.
ملاحظة: إذا لم تكن هناك معالجات مسبقة ، فقم بوضع الخلايا في 180 ميكرولتر لكل بئر بتركيز نهائي يبلغ 200,000 خلية لكل بئر. من هذه النقطة فصاعدا في البروتوكول ، احتفظ باللوحة في درجة حرارة الغرفة المحيطة أو في الحاضنة غير CO2 . لا ينبغي وضع اللوحة في حاضنة ثاني أكسيد الكربونبنسبة 5 ٪. لاحظ أن الحجم النهائي للصفيحة الدقيقة سيكون 180 ميكرولتر.
- باستخدام ماصة متعددة القنوات ، قم بلوحة 200,000 خلية لكل بئر عن طريق تعليق 10 × 106 خلايا في 4.5 مل من الوسط الكامل والطلاء 90 ميكرولتر لكل بئر. ثم أضف 90 ميكرولتر أخرى من الوسائط المخصصة لكل بئر أثناء المعالجة المسبقة.
- تحضير المعالجات المسبقة (بما في ذلك مكملات الدهون أو غيرها من المستقلبات).
- قم بإعداد المعالجة المسبقة للدهون عن طريق تدوير الدهون المجففة بالتجميد من الفريزر باستخدام جهاز طرد مركزي صغير سريع الدوران. تحديد التركيزات المطلوبة للمعالجة المسبقة وإعداد المعالجة المسبقة للدهون لهذه التركيزات. قم بتقطيع الدهون المخففة لمدة 30 دقيقة قبل الاستخدام مباشرة.
- تحضير الكوكتيلات الدهنية.
- تحديد تركيز الدهون المطلوب لاستخدامه في مقايسة وظيفة الميتوكوندريا.
- تحضير الدهون بتركيز 2x التركيز المطلوب. ثم أضف محلول الدهون إلى الحجم الموجود في الصفيحة الدقيقة لتحقيق تخفيف 1: 2. أكمل ذلك بإضافة 90 ميكرولتر من محلول الدهون مباشرة إلى 90 ميكرولتر الموجود مسبقا. سيكون الحجم النهائي 180 ميكرولتر (تخفيف 1: 2) لكل بئر.
ملاحظة: يوضح الجدول 1 مثالا تخطيطيا لإعداد وتصميم لوحة محتملة. نقترح إجراء الاختبار مع 5-6 مكررات تقنية ، مع دمج خلايا CD8 T المستجيب الساذجة والخاصة بالمستضد مع وبدون إضافات دهونية. والجدير بالذكر أن هذا البروتوكول مصمم لتجنب الطرد المركزي لتقليل الاضطراب الخلوي. نظرا لأن مقايسة وظيفة الميتوكوندريا حساسة للغاية لأعداد الخلايا ، فإن تقليل فقدان الخلايا أمر بالغ الأهمية. بدلا من الطرد المركزي ، يتم التعامل مع الخلايا عن طريق النقر للحفاظ على سلامتها. - Pipet 180 ميكرولتر من الوسط الكامل في كل ركن من أركان اللوحة. ضع الصفيحة الدقيقة مع خلايا CD8 T في حاضنة غير CO2 .
ملاحظة: سيختلف وقت الحضانة اعتمادا على الطول المطلوب للمعالجة المسبقة. لتقليل موت الخلايا ، أوصينا بمعالجة مسبقة لمدة 4 ساعات كحد أقصى لخلايا CD8 T. قد يؤدي الإفراط في إطالة وقت المعالجة المسبقة إلى موت الخلايا بشكل مفرط ، مما يؤثر على دقة النتائج.
- تحضير السموم والمحاليل للحقن الحادة.
- باستخدام محاليل المخزون ، قم بإعداد شكل مخفف من oligomycin. قم بإنشاء مخفف من oligomycin في 3 مل من الوسط الكامل. في أنابيب مخروطية سعة 15 مل ، قم بإعداد السموم والحقن الحادة بحذر. نظرا لأن السموم حساسة للضوء ، قم بإعداد هذه المحاليل باستخدام أنابيب ملفوفة بورق قصدير للحماية من التعرض للضوء.
- في أنبوب مخروطي واحد سعة 15 مل ملفوف بورق قصدير ، قم بتخفيف oligomycin في 3 مل من الوسط الكامل بحيث يكون التركيز النهائي 2.5 ميكرومتر بعد الحقن.
- في أنبوب مخروطي ثان سعة 15 مل ملفوف بورق قصدير ، قم بتخفيف FCCP في 3 مل من الوسط الكامل بحيث يكون التركيز النهائي 2.0 ميكرومتر بعد الحقن.
- في أنبوب مخروطي ثالث سعة 15 مل ملفوف بورق قصدير ، قم بإنشاء محاليل من روتينون وأنتيمايسين أ في 3 مل من الوسط الكامل لتحقيق تركيزات 0.5 ميكرومتر لكل من السموم بعد الحقن.
- إذا تم إجراء الفحص باستخدام معدلات أو أدوية أو محفزات أيضية إضافية ، فقم بتخفيف هذه العوامل في وسط كامل. إذا كنت تخطط لاستخدام إيتوموكسير أو غيرها من معدلات التمثيل الغذائي والأدوية ، فقم أولا بإجراء اختبار لاختبار منحنى المعايرة بالتحليل الحجمي وتحديد التركيز الأمثل للاستخدام. في حالة إجراء تحفيز TCR عن طريق الحقن الحاد ، يمكن إجراء الفحص باستخدام الخرز المغناطيسي المضاد ل CD3 / المضاد ل CD28 أو مزيج من مضادات CD3-biotin المرتبطة بلوحة مع الستربتافيدين المضاد ل CD28.
ملاحظة: للحصول على أوصاف إضافية ، راجع القسم 5 الذي يصف بروتوكول تحفيز TCR مع الحقن الحاد المضاد ل CD3 / CD28.
- قم بإزالة خرطوشة المستشعر من الحاضنة غيرCO2 . باستخدام محولات الألواح ، قم بإدخال السموم في خرطوشة المستشعر. ضع محولات الألواح بحيث يمكن تحميل كل غرفة بشكل خاص بالسموم أو الحقن الحادة الأخرى.
ملاحظة: توخي الحذر عند سحب السموم.- قم بتحميل السموم في منافذ خرطوشة المستشعر. إذا لم يتم إجراء حقن إضافية ، تحميل منافذ التيار المتردد بالسموم. Pipet 20 ميكرولتر من oligomycin في المنفذ A ، و 22 ميكرولتر من FCCP في المنفذ B ، و 25 ميكرولتر من الروتينون في المنفذ C ، و 25 ميكرولتر من antimycin A في المنفذ C.
- باستخدام محاليل المخزون ، قم بإعداد شكل مخفف من oligomycin. قم بإنشاء مخفف من oligomycin في 3 مل من الوسط الكامل. في أنابيب مخروطية سعة 15 مل ، قم بإعداد السموم والحقن الحادة بحذر. نظرا لأن السموم حساسة للضوء ، قم بإعداد هذه المحاليل باستخدام أنابيب ملفوفة بورق قصدير للحماية من التعرض للضوء.
- قبل ساعة واحدة من بدء الفحص على الأداة ، ضع الصفيحة الدقيقة في الحاضنة غير CO2 .
- قبل بدء تشغيل الجهاز ، افتح البرنامج وقم بمعايرة الجهاز. قم بتنفيذ هذه المهمة قبل 30 دقيقة من تحميل الصفيحة الدقيقة في الجهاز لضمان وقت كاف للمعايرة.
- في نظام البرنامج ، قم بتسمية الآبار ومراجعة مخطط الحقن.
- أثناء المعايرة، قم بتحميل خرطوشة المستشعر في الجهاز. سيطالبك البرنامج بإكمال التهيئة وفحص الجودة. ستقوم المعايرة بتقييم درجة الحموضة و O2 على كل بئر ، والتي ستمر أو تفشل. ستقوم الأداة بالإبلاغ عن النتائج على الشاشة بعلامة اختيار أو "X".
5. إجراء نسخة معدلة من مقايسة وظيفة الميتوكوندريا مع تحفيز TCR في تجربة منفصلة مع حقن حاد مضاد ل CD3 / CD28
ملاحظة: يمكن إجراء مقايسة وظيفة الميتوكوندريا من خلال محاكاة TCR الحادة عبر طريقتين مختلفتين إما عن طريق 1) باستخدام مضادات CD3 البيوتينيل + anti-CD28 + ستربتافيدين الموصوفة في الخطوة 5.2 أو 2) الخرز المغناطيسي المضاد ل CD3 / CD28 الموصوف في الخطوة 5.3 تعمل هذه التجارب المنفصلة على تحفيز TCR عن طريق حقن حاد أثناء الفحص.
- في حالة إجراء حقن إضافية ، قم بإعداد الفحص كما هو موضح في القسم السابق 4. قم بتعديل مخططات الحقن باستخدام الغرفة الإضافية للحقن. في هذا البروتوكول ، يتم تحميل anti-CD3 / anti-CD28 في المنفذ A من خرطوشة المستشعر. بعد ذلك ، قم بتحميل المنافذ الأخرى بالمثل ، مع oligomycin في المنفذ B ، و FCCP في المنفذ C ، و rotenone و antimycin A في المنفذ D.
- تحضير وتحميل مكونات مضادات CD3 + مضادة CD28 + ستربتافيدين.
- Pipet 20 ميكرولتر من مضادات CD3 البيوتينيل عند 10 ميكروغرام / مل في الآبار المخصصة في خرطوشة المستشعر.
- Pipet 20 ميكرولتر من anti-CD28 عند 2 ميكروغرام / مل + ستربتافيدين عند 20 ميكروغرام / مل في الآبار المخصصة في خرطوشة المستشعر.
- Pipet 20 ميكرولتر من مضاد CD3 البيوتينيل عند 10 ميكروغرام / مل + مضاد CD28 عند 2 ميكروغرام / مل + ستربتافيدين عند 20 ميكروغرام / مل في الآبار المخصصة في خرطوشة المستشعر.
- تأكد من تجهيز آبار التحكم. تأكد من وجود آبار مخصصة يتم حقنها بالوسائط فقط ، ومضاد CD3 البيوتينيل وحده ، ومضاد CD28 + ستربتافيدين ، ومضاد للبيوتينيل CD3 + مضاد CD28 + ستربتافيدين.
- باستخدام نسبة 1: 1 من حبة إلى خلية ، قم بإعداد وتحميل الخرز المغناطيسي المضاد ل CD3 / CD28.
- في صفيحة بها 200,000 خلية لكل بئر ، قم بسحب 5 ميكرولتر من الخرز المغناطيسي إلى الآبار المخصصة في خرطوشة المستشعر.
- تحضير آبار التحكم المخصصة بالوسائط للحقن فقط.
- اضبط حجم السموم بحيث تكون التركيزات النهائية بعد الحقن هي: 2.5 ميكرومتر للأوليغومايسين ، و 2.0 ميكرومتر ل FCCP ، و 0.5 ميكرومتر للروتينون ومضادات المايسين A.
- تأكد من تعديل مخطط الحقن ليعكس النقاط الزمنية المحدثة قبل تحميل الصفيحة الدقيقة على الجهاز.
- قم ببرمجة البرنامج لتشغيل تحفيز TCR الحاد لمدة 140 دقيقة. خلال هذا الإطار الزمني ، قم بتعديل المخطط بحيث تكون هناك قياسات للنقاط الزمنية x10 قبل حقن oligomycin.
النتائج
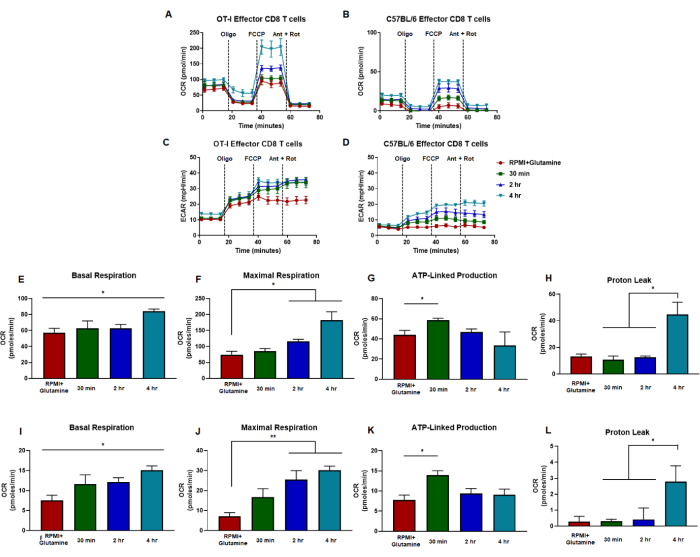
يمكن قياس القدرات الأيضية المحللة للسكر والأكسدة باستخدام الفحص الوظيفي للميتوكوندريا الذي يقيم القدرات من خلال استهداف مكونات سلسلة نقل الإلكترون في نقاط زمنية معينة (الشكل 2 أ). يمكن تحميل مخططات حقن مختلفة على منافذ خرطوشة المستشعر لتعديل الفحص التقليدي وتقييم تحفيز TCR الحاد (الشكل 2 ب ، ج). يجب تحسين عدد الخلايا وتركيز الدواء لأنواع الخلايا المختلفة قبل تفسير النتائج. هنا ، يصف هذا التقرير الظروف التي تم تحسينها لخلايا CD8 T (الشكل 3 أ ، ب) مع مثبطات سلسلة نقل الإلكترون المحسنة لقياس القدرات في كل من الخلايا الساذجة والمستجيبة (الشكل 4 أ ، ب). الأهم من ذلك ، يمكن تعديل هذا الاختبار لدراسة تحفيز TCR على خلايا CD8 T المستجيبة الناتجة عن التحفيز الخاص بالمستضد أو التحفيز المضاد ل CD3 / CD28. نقوم بفحص المزيد من استجابة الخلايا التائية CD8 لإشارات الدهون النشطة بيولوجيا ، خاصة مع حمض الليزوفوسفاتيديك أو LPA. قررنا أن اتجاهات التمثيل الغذائي استجابة لإشارات LPA (إما في 30 دقيقة أو 2 ساعة أو 4 ساعات قبل تحميل الصفيحة الدقيقة في أداة المحلل) كانت متشابهة في كل من خلايا CD8 T التي تم تنشيطها إما بتحفيز TCR الخاص بالمستضد أو متعدد النسيلة (الشكل 5A-D). أدى نوع تحفيز TCR وآلية التنشيط إلى اختلافات طفيفة حيث تم إنشاء خلايا نشطة أيضيا في البداية مع تنشيط خاص بالمستضد (الشكل 5E-L).
يمكن أن يؤدي الحقن الحاد ل anti-CD3 / CD28 على خلايا CD8 T المستجيب إلى تحفيز TCR بشكل حاد من خلال قياسات في الوقت الفعلي. يمكن استخدام مضادات CD3 المضادة للبيوتينيل ، ومضاد CD28 ، والستربتافيدين بشكل إجمالي لتحفيز TCR في نموذج الحقن الحاد. كطريقة منفصلة ، يمكن إجراء الحقن الحادة بخرز مغناطيسي مترافق مع مضاد CD3 ومضاد CD28 في هذا الاختبار الحيوي لتحفيز TCR في الوقت الفعلي. قمنا بتكييف النموذج لحقن إما الوسائط ، أو مضادات CD3 الحيوية ، أو المضادة ل CD28 + الستربتافيدين ، أو مجموعة من مضادات CD3 + المضادة CD28 + الستربتافيدين على الخلايا التائية OT-I CD8 المستجيبة في منتصف الوقت أثناء الفحص (الشكل 6 أ ، ب). لاحظنا التحفيز باستخدام مضاد CD3 / CD28 ، مما أدى إلى زيادة في كل من التعرف الضوئي على الحروف و ECAR. تم أيضا رفع إشارات OCR و ECAR ، ولكن ليس إلى نفس مستوى anti-CD3 / CD28 ، مع إشارة مضادة للبيوتينيل CD3 وحدها. الأهم من ذلك ، نجد اتجاهات استقلابية مماثلة يمكن مقارنتها بالحقن الحاد للحبة المغناطيسية المضادة ل CD3 / CD28 (الشكل 6C-F). باختصار ، تظهر هذه النتائج من خلال مناهج ومنهجيات متعددة أن مقايسة وظيفة الميتوكوندريا قوية وقابلة للتكرار لدراسة التمثيل الغذائي المناعي للخلايا الليمفاوية وعلى وجه التحديد ، خلايا CD8 T.

الشكل 1: تنشيط مستقبلات الخلايا التائية مع التحفيز النوعي للمستضد ومتعدد النسيلة. (أ) تخطيطي للإشارات الخاصة بالمستضد مع مركب التوافق النسيجي الرئيسي (MHC) من الفئة الأولى مع الببتيد المرتبط بمستقبل الخلية التائية. (ب) تصوير التنشيط متعدد النسيلة للخلايا التائية CD8 عن طريق ربط الوحدات الفرعية CD3 وجزيء التكلفة CD28 بالأجسام المضادة ل CD3 / 28. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: استهداف الدواء لسلسلة نقل الإلكترون في مقايسة وظيفة الميتوكوندريا. (أ) تخطيطي لمثبطات سلسلة نقل الإلكترون (أحمر) المستخدمة هنا. (ب ، ج) بالنسبة لاختبار وظيفة الميتوكوندريا ، تكون استراتيجيات الحقن على خرطوشة المستشعر كما يلي: (ب) نهج الحقن التقليدي حيث يتم تحميل oligomycin في المنفذ A ، و FCCP في المنفذ B ، والروتينون وأنتيمايسين A في المنفذ C. (C) تتضمن طريقة الحقن الحاد وضع حقن حاد (مضاد CD3 / CD28) في المنفذ A ، oligomycin في المنفذ B ، FCCP في المنفذ C ، والروتينون وأنتيمايسين أ في المنفذ D. الاختصار: FCCP = 4- (ثلاثي فلوروميثوكسي) فينيل) كاربونوهيدرازونويل ديسيانايد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: التعبير السطحي ل CD8 و CD44 ، والجدوى ، والاختلافات الأيضية في خلايا CD8 T المتولدة من التحفيز المضاد ل CD3 ومضاد ل CD28 بعد علاج LPA. (أ) يتم إنشاء الخلايا التائية المستجيبة CD8 خارج الجسم الحي عن طريق تحفيز خلايا CD8 T المشتقة من الفأر مع SIINFEKL (N4) وخلايا الطحال كخلايا مقدمة للمستضد أو مضاد ل CD3 ومضاد ل CD28 على الألواح. في اليوم 4 ، يحل IL-2 محل المحفزات الأولية ، مما يدعم التمايز والانتشار. ثم يتم تحليل الخلايا التائية المستجيب CD8 المتجانسة في اليوم 7 عن طريق قياس التدفق الخلوي بعد الثقافة في المختبر . (ب) يتم تحديد الخلايا التائية عن طريق البوابات على حالة الخلايا الليمفاوية ثم تعبير CD8 + / CD44 + . تظهر صورة تمثيلية أن CD8 و CD44 لا يتأثران بعلاج LPA. تم تعديل هذا الرقم من Turner et al.9. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
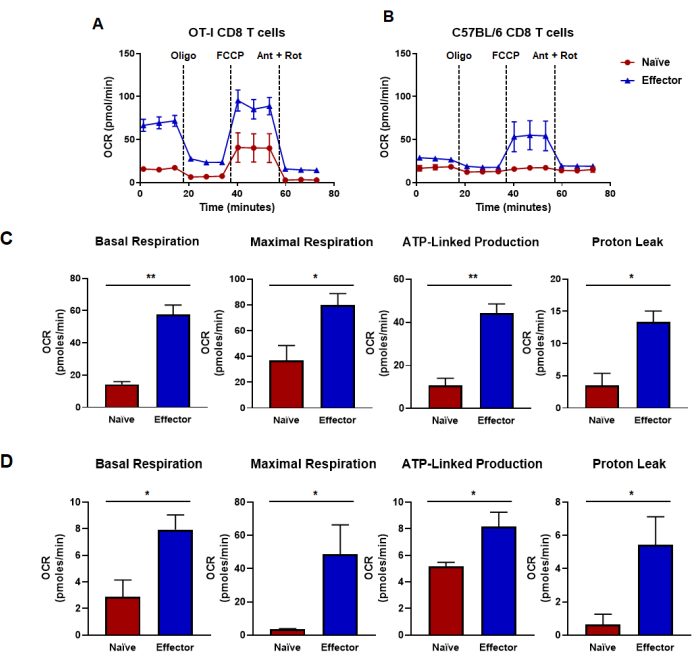
الشكل 4: القدرات التأكسدية المحددة من معدل استهلاك الأكسجين. (أ ، ب) معدلات استهلاك الأكسجين لخلايا CD8 T الساذجة والمستجيبة الناتجة عن (أ) التحفيز والتمدد الخاص بمستضد الخلايا التائية CD8 OT-I أو (ب) التحفيز متعدد النسيلة المضاد ل CD3 / CD28 وتوسيع خلايا CD8 T من الفئران C57B / 6 من النوع البري. تم حقن أوليغومايسين ، FCCP ، أنتيمايسين أ ، وروتينون على فترات 18 دقيقة مع وسائط جلوكوز 25 مليمتر. تظهر النتائج كبيانات تمثيلية وتم الحصول عليها باستخدام n = 6 تكرارات تقنية. (ج، د) مقاييس السعة المشتقة من فحوصات التدفق الأيضي التي يتم إجراؤها في اللوحات (A ، B) وتعرض التنفس القاعدي المحسوب ، والتنفس الأقصى ، والإنتاج المرتبط ب ATP ، وتسرب البروتون. (ج) تم تحديد القدرات الأيضية من خلايا OT-I CD8 T وتتوافق مع البيانات الموضحة في اللوحة (A). (د) القدرات الأيضية المحددة من خلايا C57BL / 6 CD8 T وتتوافق مع البيانات الموضحة في اللوحة (B). تم إجراء تحليل اختبار t للطالب غير المزوج للرقم بأكمله حيث * p < 0.05 ، ** p < 0.005 ، ***p < 0.0005 ، و **** p < 0.0001. الاختصارات: OCR = معدل استهلاك الأكسجين ؛ أوليغو = أوليغومايسين. FCCP = 4- (ثلاثي فلوروميثوكسي) فينيل) كاربونوهيدرازونويل ديسيانايد. النملة = antimycin A ؛ تعفن = روتينون. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 5: اتجاهات مماثلة في استجابات الخلايا التائية CD8 المستجيبة لإشارات مستقبلات LPA المستقلة عن التنشيط الخاص بالمستضد أو متعدد النسيلة. (أ ، ب) يتم قياس معدل استهلاك الأكسجين للخلايا التائية CD8 من الخلايا المتولدة بواسطة (أ) التحفيز والتمدد الخاص بمستضد الخلايا التائية OT-I CD8 أو (ب) التحفيز متعدد النسيلة المضاد ل CD3 / CD28 وتوسيع خلايا CD8 T من الفئران C57B / 6 من النوع البري. (ج، د) يتم عرض قياسات معدل تحمض الخلايا التائية CD8 خارج الخلية للخلايا الناتجة عن (C) OT-I CD8 T للتحفيز والتوسع الخاص بمستضد الخلايا التائية أو (D) التحفيز متعدد النسيلة المضاد ل CD3 / CD28 وتوسيع خلايا CD8 T من الفئران C57B / 6 من النوع البري. تم قياس القدرات الأيضية لخلايا CD8 T في وسائط مكملة بالجلوتامين (أحمر) أو 1 ميكرومتر LPA لمدة 30 دقيقة (أخضر) أو 2 ساعة (أزرق) أو 4 ساعات (أخضر). تم حقن أوليغومايسين ، FCCP ، أنتيمايسين أ ، وروتينون على فترات 18 دقيقة مع وسائط جلوكوز 25 مليمتر. تظهر النتائج كبيانات تمثيلية وتم الحصول عليها باستخدام n = 6 تكرارات تقنية. (E-H) مقاييس السعة المشتقة من فحوصات التدفق الأيضي التي يتم إجراؤها في الألواح (A ، C) وتعرض التنفس الأساسي المحسوب ، والتنفس الأقصى ، والإنتاج المرتبط ب ATP ، وتسرب البروتون. (I-L) حسابات السعة من الألواح (B ، D) توضح التنفس الأساسي ، والتنفس الأقصى ، والإنتاج المرتبط ب ATP ، وتسرب البروتون. تم تحليل الرقم بأكمله إحصائيا باستخدام ANOVA أحادي الاتجاه حيث * p < 0.05. الاختصارات: OCR = معدل استهلاك الأكسجين ؛ ECAR = معدل التحمض خارج الخلية ؛ أوليغو = أوليغومايسين. FCCP = 4- (ثلاثي فلوروميثوكسي) فينيل) كاربونوهيدرازونويل ديسيانايد. النملة = antimycin A ؛ تعفن = روتينون. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: استراتيجيات تحفيز مستقبلات الخلايا التائية في الوقت الفعلي مع الحقن الحاد لمضاد CD3 / CD28. (أ ، ب) استراتيجية الحقن الحادة التي تتضمن مضادات CD3 الحيوية والستربتافيدين ومضادات CD28 لتقييم وظيفة الميتوكوندريا. تعرض اللوحات القدرات الأيضية لخلايا CD8 T المستجيب OT-I المحفزة بالمستضد ، مما يدل على وجه التحديد على (أ) معدل التحمض خارج الخلية و (ب) معدل استهلاك الأكسجين. تستخدم الحقن الوسائط فقط (الأحمر) أو مضادات CD3 البيوتينيلات (الأخضر) أو المضادة CD28 + الستربتافيدين (الأزرق) أو مزيج من مضادات CD3 البيوتينيلات + المضادة CD28 + الستربتافيدين (البط الأزرق). (ج، د) الحقن الحاد للخرز المغناطيسي المترافق مع مضاد CD3 / CD28 لتقييم نشاط الميتوكوندريا. تعرض اللوحات القدرات الأيضية لخلايا CD8 T المستجيب OT-I المحفزة بالمستضد ، والتي تظهر على وجه التحديد (C) معدل التحمض خارج الخلية و (D) معدل استهلاك الأكسجين. تستخدم الحقن الوسائط فقط (الأحمر) أو حقن الخرزة المضادة ل CD3 / CD28 (البط البري). تم إجراء المقايسات بحقن oligomycin و FCCP وantimycin A و rotenone على فترات 18 دقيقة في الوسائط المكملة ب 25 ملي مولار من الجلوكوز. تظهر النتائج كبيانات تمثيلية وتم الحصول عليها باستخدام n = 6 تكرارات تقنية. (ه) حسابات السعة من الألواح (A-D) توضح التمثيل الغذائي الأساسي قبل الحقن (أحمر) ، والتنفس بعد الحقن (الأزرق) ، والقدرة التنفسية القصوى (الرمادي). يتم فصل الحالات بناء على الحقن داخل الفحص. (و) حسابات السعة التي تظهر التنفس القاعدي ، والتنفس الأقصى ، والإنتاج المرتبط ب ATP ، وتسرب البروتونات. تم إجراء إحصائيات لهذا الرقم بأكمله باستخدام ANOVA أحادي الاتجاه حيث * p < 0.05 ، ** p < 0.005 ، ***p < 0.0005 ، و **** p < 0.0001. الاختصارات: OCR = معدل استهلاك الأكسجين ؛ ECAR = معدل التحمض خارج الخلية ؛ أوليغو = أوليغومايسين. FCCP = 4- (ثلاثي فلوروميثوكسي) فينيل) كاربونوهيدرازونويل ديسيانايد. النملة = antimycin A ؛ تعفن = روتينون. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في هذه المقالة ، نحدد بروتوكولا لتقييم وظيفة الميتوكوندريا لخلايا CD8 T الساذجة والمستجيبة. نقوم بتفصيل ومقارنة طرق تحضير كل من خلايا CD8 التائية الخاصة بالمستضد ومتعددة النسيلة باستخدام فئران OT-I و C57BL / 6. توضح نتائجنا أن هناك اتجاهات مماثلة في عملية التمثيل الغذائي على الرغم من طريقة التنشيط والمعالجة المسبقة في خلايا CD8 T. تكشف البيانات أن التنشيط الخاص بالمستضد يؤدي إلى خلايا OT-I CD8 T أكثر نشاطا من الناحية الأيضية مقارنة بنظيراتها من النوع البري C57BL / 6 المحفزة بمضادات CD3 ومضادة ل CD28. يوضح البروتوكول الموصوف هنا أن الاختبار الوظيفي للميتوكوندريا ، اختبار ميتو للإجهاد ، هو اختبار حساس للغاية وقابل للتكرار باستمرار ينتج عنه نتائج موثوقة عبر العديد من الظروف وأنواع الخلايا المختلفة. تساهم النتائج التي توصلنا إليها وبروتوكولنا التفصيلي في الاعتراف المتزايد بهذا الاختبار كمنهجية تأسيسية لتحليل التمثيل الغذائي للخلايا التائية CD8 والطاقة الحيوية.
مع استمرار تقدم العلاج المناعي والعلاجات الخلوية المختلفة ، تزداد أهمية تطبيق العلاجات التي تستهدف الخلايا التائيةأيضا 41. تعتمد الاستجابة للعلاج المناعي والاستجابات المناعية المضادة للورم على التمثيل الغذائي بوساطة الخلايا التائية ، وإشارات الكالسيوم ، والتدفق التأكسدي الناتج عن تنشيط TCR42. كل من الكفاءة الأيضية والمرونة مطلوبة لاستجابات الخلايا التائية CD8 المثلى5،6،7،15،17،26،43 في حين أن زيادة تسرب البروتون والضرر التأكسدي اللاحق يضعف استجابات الخلايا التائية ويعزز الخللالوظيفي 9،44. يمكن إنقاذ كل من تكاثر الخلايا التائية وإنتاج السيتوكين عن طريق التخفيف من الإجهاد التأكسدي للميتوكوندريا5،13،20،24،25،29. ضمن تجاربنا ، استخدمنا خلايا CD8 T الساذجة التي يتم زراعتها في IL-2 ، والتي تحافظ على الجدوى. ومع ذلك ، يمكن القول إن خلايا CD8 T هذه لم تعد مكافئة لخلايا CD8 T الساذجة بحسن نية . وبالتالي ، اخترنا استخدام خلايا CD8 T الساذجة مباشرة من الفأر للحصول على بيانات وخلايا ذات جودة أفضل أقل عرضة للتأثر بالسيتوكينات. إجمالا ، من الأهمية بمكان تحسين تقنيات فحص التمثيل الغذائي عبر مجموعات فرعية من الخلايا التائية.
يتم توجيه مصير الخلايا التائية CD8 جزئيا عن طريق البرمجة الأيضية التي تؤثر على الاستجابات المناعية التكيفية2،4،45. تخرج خلايا CD8 التائية الساذجة من الحالات الهادئة عند تحفيز TCR25،46،47،48،49،50. ومع ذلك ، فإن التحفيز المستمر TCR يؤدي إلى استنفاد الخلايا التائية CD8 ، مما يؤدي إلى نمط ظاهري أقل نشاطا بشكل ملحوظ مقارنة بخلايا CD8 Tالوظيفية 3،20،51،52. ومع ذلك ، يمكن تحسين هذا التأثير على عملية التمثيل الغذائي وربما تنشيط خلايا CD8 T المستنفدة2،3،20،46،51،52. في حين أن الآلية (الآليات) الدقيقة التي تحكم مصير الخلايا التائية CD8 والتمايز الشامل لا تزال غير مفهومة جيدا ، فإن خلايا CD8 التائية المختلة و / أو المستنفدة لها بشكل مميز بها ميتوكوندريا معيبة وإفراط إنتاج ROS وهي عوامل رئيسية في تنظيم وظيفة مستجيب الخلايا التائية CD89،15،53. تمت دراسة استقلاب الخلايا التائية CD8 والأنماط الظاهرية والتمايز الشامل باستخدام اختبار إجهاد ميتو. تاريخيا ، يحدد التحفيز المستمر ل TCR الذي يؤدي إلى فقدان تدريجي لوظائف المستجيب استنفاد الخلايا التائية CD811،13،16،17. ومع ذلك ، كانت هناك جهود حديثة لتوصيف خلايا CD8 T المستنفدة بشكل أفضل وإظهار الكروماتين والمناظر الطبيعية النسخية تحدد أيضا الإرهاق وترتبط ارتباطا وثيقا بالتدفق الأيضي18،27،28. إجمالا ، يمكن دراسة التحفيز المستمر ل TCR والأنماط الظاهرية اللاحقة والعواقب الأيضية باستخدام اختبار الإجهاد ميتو لتحديد نقاط الضعف الأيضية والأحداث التي تحدد المصير.
يبدأ تحفيز TCR إشارات الكالسيوم النهائية اللازمة لإفراز الخلايا الحبيبية وقتل الخلايا التائيةالموجهة 24،33. والجدير بالذكر أن الأحداث السابقة ، مثل تنشيط الالتهابات وإنتاج IFNγ ، تعتمد على ATP54 المستمر والمستمر. أثناء إشارات الكالسيوم ، تم الإبلاغ عن خلل في التنظيم في كفاءة الميتوكوندريا ، ويعرف باسم ظاهرة "وميض الميتوكوندريا"55،56،57،58. يمثل وميض الميتوكوندريا عملية تتعرض فيها الميتوكوندريا التي تنفس نشط لفترة وجيزة للتنفس غير المقترن مما يؤدي إلى انخفاض ATP وزيادة انفجار ROS55،56. كانت هناك أبحاث محدودة حول وميض الميتوكوندريا ولا تزال أهميتها في خلايا CD8 T غير مستكشفة على نطاق واسع. الأهم من ذلك ، يمكن استخدام المنهجيات الموضحة في هذه الدراسة للتحقيق في هذه الظواهر ، والتمايز الشامل في خلايا CD8 T ، وملامح الخلايا المناعية الأخرى.
باختصار ، تقدم هذه المنهجيات والأدوات نهجا أكثر شمولا لدراسة كل من التمثيل الغذائي الحاد والمزمن. يمكن تطبيق اختبار ميتو للإجهاد لفحص البرمجة الأيضية وكيف ينظم الخلل الوظيفي المستجيب والتمايز الشامل في خلايا CD8 T. قد تكون إعادة برمجة التمثيل الغذائي في الخلايا الليمفاوية عاملا في فهم الآليات الكامنة وراء تحمل المناعة ، وخلل الخلايا التائية CD8 ، والاستجابات المناعية المنهكة. بالإضافة إلى ذلك ، يلعب وسطاء التمثيل الغذائي و / أو الدهون أدوارا رئيسية في السمية الخلوية للخلايا التائية CD8 واستنفادها9 ، وبالتالي يمكن استهدافها كنهج جديد لمنع الإرهاق أو عكس التمايز الشامل لتقليل المناعة المضادة للأورام. إجمالا ، يقف اختبار Cell Mito Stress Test كأداة قوية يجب استخدامها لمعالجة هذه الأسئلة التي لم يتم حلها حول التمثيل الغذائي المناعي.
Disclosures
ليس لدى المؤلفين مصالح متنافسة للإفصاح عنها.
Acknowledgements
قدمت مؤسسة هيرتز ومؤسسة إيمي ديفيس ومؤسسة عائلة مور ومؤسسة هايدي هورنر دعما لا يقدر بثمن ، ونحن ممتنون له. تم دعم هذا العمل أيضا جزئيا من خلال منح المعاهد الوطنية للصحة إلى RMT (AI052157 ، AI136534) ، بينما تم دعم JAT من قبل زمالة Hertz للخريجين.
Materials
| Name | Company | Catalog Number | Comments |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Anti-CD28 | Biolegend | 102116 | |
| Anti-CD3/CD28 Dynabeads | ThermoFisher | 11456D | |
| Biotinylated anti-CD3 | Biolegend | 317320 | |
| Bovine Serum Albumin | Sigma-Aldrich | 108321-42-2 | |
| CD8a+ T cell isolation kit | Miltenyi Biotec | 130-104-075 | |
| Cell Strainers (100 µm) | CELL TREAT | 229485 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E8008 | |
| Ficoll | Sigma-Aldrich | 26873-85-8 | density gradient medium |
| FCCP ((4-(trifluoromethoxy) phenyl) carbonohydrazonoyl dicyanide) | Sigma-Aldrich | C2920 | |
| Glucose | Sigma-Aldrich | G-6152 | |
| Glutamine | Sigma-Aldrich | G7513 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | Positive selection columns |
| Magnetic cell separation column | Miltenyi Biotec | 130-042-301 | |
| Microplate | Agilent | 102601-100 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Pyruvate | Sigma-Aldrich | 113-24-6 | |
| Recobinant IL-2 | PeproTech | 200-02 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Seahorse media | Agilent | 103576-100 | |
| Sensor cartridge | Agilent | 102601-100 | |
| Streptavidin | Sigma-Aldrich | A9275 | |
| Sterile 6 well plate | CELL TREAT | 230601 | |
| Sterile 24 well plate | CELL TREAT | 229524 | |
| XF Calibrant | Agilent | 102601-100 |
References
- Patsoukis, N., et al. PD-1 alters T-cell metabolic reprogramming by inhibiting glycolysis and promoting lipolysis and fatty acid oxidation. Nat Commun. 6, 6692 (2015).
- Scharping, N. E., et al. Mitochondrial stress induced by continuous stimulation under hypoxia rapidly drives T cell exhaustion. Nat Immunol. 22, 205-215 (2021).
- Schurich, A., et al. Distinct Metabolic Requirements of Exhausted and Functional Virus-Specific CD8 T Cells in the Same Host. Cell Rep. 16 (5), 1243-1252 (2016).
- Zhang, L., Romero, P. Metabolic control of CD8(+) T cell fate decisions and antitumor immunity. Trends Mol Med. 24 (1), 30-48 (2018).
- Batabyal, R., et al. Metabolic dysfunction and immunometabolism in COVID-19 pathophysiology and therapeutics. Int J Obes (Lond). 45 (6), 1163-1169 (2021).
- Chavakis, T. Immunometabolism: Where immunology and metabolism meet. J Innate Immun. 14, 1-3 (2022).
- Frezza, C., Mauro, C. Editorial: The metabolic challenges of immune cells in health and disease. Front Immunol. 6, 293 (2015).
- Wang, X., Ping, F. F., Bakht, S., Ling, J., Hassan, W. Immunometabolism features of metabolic deregulation and cancer. J Cell Mol Med. 23 (2), 694-701 (2019).
- Turner, J. A., et al. Lysophosphatidic acid modulates CD8 T cell immunosurveillance, metabolism, and anti-tumor immunity. Nat Commun. 14, 3214 (2023).
- Coussens, L. M., Werb, Z. Inflammation and cancer. Nature. 420, 860-867 (2002).
- Jiang, Y., Li, Y., Zhu, B. T-cell exhaustion in the tumor microenvironment. Cell Death Dis. 6 (6), e1792 (2015).
- Krangel, M. S. Mechanics of T cell receptor gene rearrangement. Curr Opin Immunol. 21 (2), 133-139 (2009).
- Barber, D. L., et al. Restoring function in exhausted CD8 T cells during chronic viral infection. Nature. 439, 682-687 (2006).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Bengsch, B., et al. Bioenergetic insufficiencies due to metabolic alterations regulated by the inhibitory receptor PD-1 are an early driver of CD8(+) T cell exhaustion. Immunity. 45 (2), 358-373 (2016).
- Blank, C. U., et al. Defining 'T cell exhaustion'. Nat Rev Immunol. 19, 665-674 (2019).
- Dolina, J. S., Van Braeckel-Budimir, N., Thomas, G. D., Salek-Ardakani, S. CD8(+) T cell exhaustion in cancer. Front Immunol. 12, 715234 (2021).
- Mognol, G. P., et al. Exhaustion-associated regulatory regions in CD8(+) tumor-infiltrating T cells. Proc Natl Acad Sci U S A. 114 (13), E2776-E2785 (2017).
- Wang, D., et al. A comprehensive profile of TCF1(+) progenitor and TCF1(-) terminally exhausted PD-1(+)CD8(+) T cells in head and neck squamous cell carcinoma: implications for prognosis and immunotherapy. Int J Oral Sci. 14 (1), 8 (2022).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21, 1022-1033 (2020).
- Kang, S., Brown, H. M., Hwang, S. Direct antiviral mechanisms of interferon-gamma. Immune Netw. 18 (5), e33 (2018).
- Samuel, C. E. Antiviral actions of interferons. Clin Microbiol Rev. 14, 778-809 (2001).
- Schellekens, H., Weimar, W., Cantell, K., Stitz, L. Antiviral effect of interferon in vivo may be mediated by the host. Nature. 278, 742 (1979).
- Radoja, S., et al. CD8(+) tumor-infiltrating T cells are deficient in perforin-mediated cytolytic activity due to defective microtubule-organizing center mobilization and lytic granule exocytosis. J Immunol. 167 (9), 5042-5051 (2001).
- van der Windt, G. J., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Balmer, M. L., et al. Memory CD8(+) T cells require increased concentrations of acetate induced by stress for optimal function. Immunity. 44 (6), 1312-1324 (2016).
- Pereira, R. M., Hogan, P. G., Rao, A., Martinez, G. J. Transcriptional and epigenetic regulation of T cell hyporesponsiveness. J Leukoc Biol. 102, 601-615 (2017).
- Sen, D. R., et al. The epigenetic landscape of T cell exhaustion. Science. 354, 1165-1169 (2016).
- Quintana, A., et al. T cell activation requires mitochondrial translocation to the immunological synapse. Proc Natl Acad Sci U S A. 104 (36), 14418-14423 (2007).
- Brindley, D. N. Lysophosphatidic acid signaling in cancer. Cancers (Basel). 12 (12), 3791 (2020).
- Chae, C. S., et al. Tumor-derived lysophosphatidic acid blunts protective type I interferon responses in ovarian cancer. Cancer Discov. 12, 1904-1921 (2022).
- Kremer, K. N., et al. LPA suppresses T cell function by altering the cytoskeleton and disrupting immune synapse formation. Proc Natl Acad Sci U S A. 119 (15), e2118816119 (2022).
- Mathew, D., et al. LPA5 is an inhibitory receptor that suppresses CD8 T-cell cytotoxic function via disruption of early TCR signaling. Front Immunol. 10, 1159 (2019).
- Mathew, D., Torres, R. M. Lysophosphatidic acid is an inflammatory lipid exploited by cancers for immune evasion via mechanisms similar and distinct from CTLA-4 and PD-1. Front Immunol. 11, 531910 (2020).
- Oda, S. K., et al. Lysophosphatidic acid inhibits CD8 T cell activation and control of tumor progression. Cancer Immunol Res. 1 (4), 245-255 (2013).
- Lidgerwood, G. E., Pitson, S. M., Bonder, C., Pebay, A. Roles of lysophosphatidic acid and sphingosine-1-phosphate in stem cell biology. Prog Lipid Res. 72, 42-54 (2018).
- Torres, R. M., Turner, J. A., D'Antonio, M., Pelanda, R., Kremer, K. N. Regulation of CD8 T-cell signaling, metabolism, and cytotoxic activity by extracellular lysophosphatidic acid. Immunol Rev. 317 (1), 203-222 (2023).
- Turner, J. A., et al. BRAF modulates lipid use and accumulation. Cancers (Basel). 14 (9), 2110 (2022).
- Hogquist, K. A., et al. T cell receptor antagonist peptides induce positive selection. Cell. 76, 17-27 (1994).
- Li, Y., Kurlander, R. J. Comparison of anti-CD3 and anti-CD28-coated beads with soluble anti-CD3 for expanding human T cells: differing impact on CD8 T cell phenotype and responsiveness to restimulation. J Transl Med. 8, 104 (2010).
- Ralli, M., et al. Immunotherapy in the treatment of metastatic melanoma: current knowledge and future directions. J Immunol Res. 2020, 9235638 (2020).
- Philip, M., Schietinger, A. CD8(+) T cell differentiation and dysfunction in cancer. Nat Rev Immunol. 22, 209-223 (2022).
- Bajrai, L. H., et al. Understanding the role of potential pathways and its components including hypoxia and immune system in case of oral cancer. Sci Rep. 11, 19576 (2021).
- Nicholls, D. G. Mitochondrial proton leaks and uncoupling proteins. Biochim Biophys Acta Bioenerg. 1862, 148428 (2021).
- Tyrakis, P. A., et al. S-2-hydroxyglutarate regulates CD8(+) T-lymphocyte fate. Nature. 540, 236-241 (2016).
- Guo, Y., et al. Metabolic reprogramming of terminally exhausted CD8(+) T cells by IL-10 enhances anti-tumor immunity. Nat Immunol. 22, 746-756 (2021).
- Notarangelo, G., et al. Oncometabolite d-2HG alters T cell metabolism to impair CD8(+) T cell function. Science. 377 (6614), 1519-1529 (2022).
- Yang, K., et al. T cell exit from quiescence and differentiation into Th2 cells depend on Raptor-mTORC1-mediated metabolic reprogramming. Immunity. 39 (6), 1043-1056 (2013).
- Ricciardi, S., et al. The translational machinery of human CD4(+) T cells is poised for activation and controls the switch from quiescence to metabolic remodeling. Cell Metab. 28 (6), 895-906.e5 (2018).
- Moller, S. H., Hsueh, P. C., Yu, Y. R., Zhang, L., Ho, P. C. Metabolic programs tailor T cell immunity in viral infection, cancer, and aging. Cell Metab. 34 (3), 378-395 (2022).
- Alrubayyi, A., et al. Functional restoration of exhausted CD8 T cells in chronic HIV-1 infection by targeting mitochondrial dysfunction. Front Immunol. 13, 908697 (2022).
- Vignali, P. D. A., et al. Hypoxia drives CD39-dependent suppressor function in exhausted T cells to limit antitumor immunity. Nat Immunol. 24, 267-279 (2023).
- Ogando, J., et al. PD-1 signaling affects cristae morphology and leads to mitochondrial dysfunction in human CD8(+) T lymphocytes. J Immunother Cancer. 7 (1), 151 (2019).
- Billingham, L. K., et al. Mitochondrial electron transport chain is necessary for NLRP3 inflammasome activation. Nat Immunol. 23, 692-704 (2022).
- Eberhardt, D. R., et al. EFHD1 ablation inhibits cardiac mitoflash activation and protects cardiomyocytes from ischemia. J Mol Cell Cardiol. 167, 1-14 (2022).
- Hou, T., et al. Identification of EFHD1 as a novel Ca(2+) sensor for mitoflash activation. Cell Calcium. 59 (5), 262-270 (2016).
- Mun, S. A., et al. Structural and biochemical characterization of EFhd1/Swiprosin-2, an actin-binding protein in mitochondria. Front Cell Dev Biol. 8, 628222 (2020).
- Stein, M., et al. A defined metabolic state in pre B cells governs B-cell development and is counterbalanced by Swiprosin-2/EFhd1. Cell Death Differ. 24 (7), 1239-1252 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved