Method Article
飛行時間型陽電子放出断層撮影-コンピューター断層撮影スキャナーを使用した脳の酸素および糖代謝のマルチトレーサー研究
要約
PETによる酸素およびグルコース代謝の定量的測定は確立された技術ですが、実際のプロトコルの詳細は文献にほとんど記載されていません。この論文では、最先端の陽電子放出断層撮影-コンピューター断層撮影スキャナーにうまく実装された実用的なプロトコルを紹介します。
要約
著者らは、脳グルコース代謝率(CMRGlc)、脳酸素代謝率(CMRO2)、脳血流(CBF)、および脳血液量(CBV)の測定を組み合わせた、複数の放射性医薬品トレーサーを備えた陽電子放出断層撮影法(PET)を使用してパラダイムを開発し、脳の好気性解糖(AG)の推定に至りました。酸化的および非酸化的グルコース代謝に関するこれらの in vivo 推定値は、健康と疾患におけるヒトの脳の研究に関連しています。最新の陽電子放出断層撮影-コンピュータ断層撮影(PET-CT)スキャナーは、飛行時間型(TOF)イメージングと、空間分解能とアーティファクトの低減における重要な改善を提供します。これにより、放射性トレーサーの線量を減らして、イメージングが大幅に改善されました。
最新のPET-CTスキャナーに最適化された方法では、 15O標識一酸化炭素(CO)と酸素(O2)、 15O標識水(H2O)、 18F-デオキシグルコース(FDG)を吸入して2時間または3時間のスキャンセッションで投与し、CMRGlc、CMRO2の高分解能で定量的な測定を行います、CBF、CBV、およびAG。この手法論文では、トレーサー動態モデルと動脈血サンプルを使用して脳代謝を定量化するために設計されたスキャンの実際的な側面を説明し、人間の脳代謝の画像測定の例を提供します。
概要
人間の脳は、代謝のために酸素とブドウ糖を大量に消費しています。健康な人間の脳におけるグルコース代謝の一部は、脳好気性解糖(AG)として知られる酸素使用以外で発生し、その目的は集中的に調査されています1,2,3,4,5。動物モデルおよびヒトでの先行研究では、AGと発生および老化、シナプスおよび神経突起の発達、記憶、アルツハイマー病におけるアミロイド沈着、および白質機能と疾患との関連が報告されています1,6,7,8,9,10,11,12,13 .したがって、AGや脳代謝の他の側面を研究して、老化して怪我や病気を引き起こす人間の脳をよりよく理解することに継続的な関心が寄せられています。
現在、ヒト脳AGをin vivoで評価する方法は、脳内グルコース代謝率(CMRGlc)14、脳内酸素代謝率(CMRO2)15、脳血流(CBF)16、脳血量(CBV)17のそれぞれを測定するために、複数の酸素およびグルコース放射性トレーサーを用いたPETイメージングが必要です.イメージング以外にも、PETで脳代謝を定量的に測定するには、通常は侵襲的な動脈カニューレ挿入やサンプリングによる動脈入力機能の評価など、他の複雑さが必要です。参加者が頭の動きを制限しながら、放射性トレーサーの吸入の指示に正確に従うことを確認します。半減期が非常に短い(2分)放射性トレーサーの取り扱いを安全かつ効果的に行う。大規模なデータセットの管理。代謝パラメータを正確に計算するための高度な分析方法を実行します。また、CMRGlc 5,14 の推定に [18F]FDG を使用することの限界も注目に値します。
このプロトコルは、私たちの経験における定量的脳代謝の成功した測定に最も関連する実際的な問題に対処します。このプロトコルには、一般的なエラーを回避するための基本的な手順と注意点の説明が含まれています。代謝、神経科学、イメージング、トレーサー動態、および放射性トレーサーPETイメージングからの推論方法のより一般的な原則についての慎重な議論を延期します。対象読者には、PETを使用した代謝測定の初心者だけでなく、 15O放射性トレーサーの使用に関心のある経験豊富なPET研究者や臨床医も含まれます。このプロトコルは、ヒト画像研究、侵襲的医療処置、放射性トレーサー、および定量的推論方法に精通していることを前提としています。脳PETイメージング全般18、 および15O-酸素PETについて、より具体的には19の優れた参考文献が数多く存在します。[18F]FDGおよびPETの実施に関するその他の実際的な問題については、トゥルクPETセンターは貴重な参考資料と広範な一次研究文献へのリンクを提供しています20。
プロトコルのセクションは、コンプライアンスとスキャンの成功に不可欠な参加者の選択に関する関連する考慮事項から始まります。次に、プロトコルでは、神経解剖学のためのMRIによる支持的スキャンに関連する側面を概説します。次に、プロトコルでは、酸素とグルコース代謝の定量化に重要な手段を含む臨床検査室の注文について説明します。次に、議定書には、サイクロトロンと放射性医薬品の送達に関する事項がリストされています。説明は、画像施設のポイントオブケアで働く研究者の視点を取っているだけであり、サイクロトロン施設やスタッフに必要な考慮事項は省略されています。次に、プロトコルでは、動脈ラインの準備と管理について詳しく説明します。幹線を確立し維持するには、機関に固有のコンプライアンス基準を満たす必要があり、プロトコルは成功するワークフローの概要を示しています。次に、このプロトコルは、参加者のポジショニング、減衰補正のためのCT、放射性医薬品の投与、動脈測定の実施など、PETによるスキャンに不可欠な操作手順を提供します。静脈サンプリングでは、[18F]FDGによるCMRGlcの測定における動脈サンプリングの潜在的な代替手段について説明します。PET画像再構成とデータストレージに関するセクションでは、ソフトウェアパラメータと情報技術の実用的な問題について詳しく説明します。退院と参加者のフォローアップに関するセクションでは、参加者の安全のための重要なコミュニケーションが記載されています。また、重要なキャリブレーション作業についても説明します。多くの適切な分析方法と動力学モデルは、公開された科学レポートとその多数の前例に詳しく説明されています。したがって、このプロトコルは、公開されたアプローチの参照に読者を主に導きます。代表的な結果は、プロトコルの実装が成功したことを示しています。ディスカッションセクションでは、プロトコルの有利な側面と制限、人間の神経科学におけるその可能性、および安全性に関連する事項について詳しく説明します。
プロトコル
注:ワシントン大学医学部の治験審査委員会および放射性薬物研究委員会は、以下に説明するプロトコルに基づいてすべての研究を承認しました。すべての人間の参加者は、以下のプロトコルに基づく調査研究に参加する前に、書面によるインフォームドコンセントを提供しました。このプロトコルで使用されるすべての機器、材料、および試薬に関連する詳細については、 材料の表 を参照してください。
1. 参加者の選考
- 選択基準
- 大人の参加者のみを含めます。参加者が放射性医薬品ガスの吸入に関する指示を含む研究手順に従うことができ、インフォームド コンセントまたは適切な代理同意による同意を提供できることを確認します。参加者が仰臥位で最大 2 時間から 3 時間、休憩なしで 60 分間連続してイメージングを受けられるようにします。
- 除外基準
- PET時の妊娠など、放射性薬物研究に禁忌がある参加者は除外します。MRIは解剖学的画像登録、空間的正規化、および部分体積補正に必要であるため、MRIに禁忌のある参加者を除外します。
- 橈骨動脈カニューレ挿入を行う場合は、橈骨動脈カニューレ挿入が禁忌である参加者を除外します。侵襲的な動脈サンプリングにより総血液量が 100 mL を超える可能性があるため、著しい貧血のある参加者や最近血液製剤を提供した参加者は除外します。
- 重大な肺疾患のある参加者は、肺で標識された [15O]O2 および [15O]CO をうまく吸入および交換する能力が損なわれる可能性があるため、除外します。関心のある疾患以外に進行中の医学的疾患を持つ個人を除外し、脳の代謝と血流を大きく変化させると予想される。
注:これは、特定のプロジェクトの特定の目的とターゲットに依存します、たとえば、プロジェクトが健康な老化に焦点を当てている場合、大きな脳卒中や鎌状赤血球貧血は除外基準に含まれる可能性があります。 - [18F]FDG の投与前に血糖値が 165 mg/dL 未満を達成できない参加者は除外します。
2. 神経解剖学のためのMRI
- PETスキャンの前にMRIをスケジュールします。等方性0.8〜1.0mmの分解能を持つ磁化準備急速勾配エコー(MPRAGE)パルスシーケンスと、理想的には動き補正のための有望な方法を含む3TスキャナーのMRIプロトコルを確保します21。
注: 前向き運動矯正は、PET イメージングとの融合で使用するための T1w 解剖学的構造の追加の最適化を提供しますが、前向き運動矯正の省略は、頭部の動きを避けることに固執している参加者の現在の PET イメージングにとって非常に重要である可能性は低いです。高品質のT1w解剖学的構造は、PET22,23の部分体積補正に重要です。 - 神経解剖学的MRIを取得して、局所的なパーセルレーションとセグメンテーション、アトラス登録、および部分的な体積補正を行います。参加者を侵襲的な動脈ラインと放射性医薬品にスケジュールしてさらす前に、神経解剖学的MRIが成功したことを確認してください。
3. ラボラトリーオーダー
- 動脈血ガス、ヘモグロビン、ヘマトクリット、血漿グルコースは、臨床認定検査室でご注文いただけます。喫煙者およびヘモグロビンの変化に関連する病状のある人のために、定量的なオキシヘモグロビン、カルボキシヘモグロビン、およびメトヘモグロビンを注文してください。.
- パルスオキシメトリは、クリティカルケア用に設計されたデバイスなど、検証済みのデバイスを使用して測定します。
4. 放射性医薬品の配送
注:PETで脳の酸素代謝とAGを測定するには、半減期が 122秒の15O放射性医薬品を製造および送達できるサイクロトロン施設が必要です。サイクロトロン施設とPETスキャナー間の放射性医薬品の輸送は、放射性トレーサー投与時に適切な投与を提供するために、十分かつ確実に迅速でなければなりません。
- すべての放射能線量校正器に電源があり、十分な機器のウォームアップ(通常は少なくとも60分)の時間を確保してください。
- ガス状放射性医薬品の場合は、シールドガスキャニスターとそれに組み込まれたピコ電流計線量キャリブレーターをPETスキャナーのPETガントリーの近くに配置してください。滅菌された拡張可能なベローズ、微粒子フィルター、大口径プラスチックポリマーチューブ、クランプ、および使い捨てマウスピースの安全な取り付けを確保します。 図 1 を参照してください。
- ナイロンガスライン、内径1/8インチ、排気下、サイクロトロンからの[15O]COおよび[15O]O2の供給のための完全な品質保証手順。精製された水素源と、[15O]O2の誘導体として放射性医薬品[15O]H2Oを生成するための処理ユニットの完全な品質保証。図 1 を参照してください。
5.幹線
- 配置と管理
- 橈骨動脈のカニューレ挿入は、インターベンショナルラジオロジー、麻酔科、救命救急医学など、動脈ラインの日常的な留置に関する専門的なトレーニングを受けた医師に相談して行います。
- 橈骨動脈のイメージングに適したプローブを備えた超音波装置を利用できるようにします。
- インターベンション医に動脈ライン留置用の好みの消耗品、最も一般的には、セルディンガー技術を実装するガイドワイヤー付きのキットを提供します。
- 参加者の利き手ではない手に血管カテーテルを挿入するためにあらゆる努力をしてください。
- 経験豊富な看護師または同等の医療専門家のサービスを使用して、橈骨動脈カニューレ挿入全体を通じて参加者を評価および管理します。
- 超音波による手の側副動脈循環を確保します。
- 動脈カニューレ挿入中の無菌野を準備し、管理します。
- インターベンション専門医の滅菌カニューレ挿入手術を支援します。
- 硬質圧力ラインをプライムし、300mmHgに加圧された通常の生理食塩水を供給します。
- 動脈圧波形の定期的なモニタリングや動脈ライン回路の操作など、2〜3時間のプロトコル中に継続的な動脈ライン管理を実行します。連続的な動脈サンプリングのためには、橈骨動脈への背圧の供給から蠕動ポンプによる動脈血の抽出、フラッシングと橈骨動脈へのアクセスの維持まで、インラインストップコックを切り替えます。橈骨動脈に流れ込まないラインセグメントをプライミングする場合は、開存性を維持するためにヘパリン処理溶液(最大10 U/mL)で洗い流してください。
注:その有効性の不確実な証拠を考慮して、橈骨動脈カテーテルを維持し、ヘパリン誘発性血小板減少症を誘発するリスクを回避するために、可能な限りヘパリンの使用を最小限に抑えます。. - 成形可能でありながら剛性の高いアームボードを使用して、橈骨動脈カテーテルとラインを固定します。ストップコックの繰り返し操作が橈骨動脈カテーテルを乱さないようにしてください。
- 各放射性トレーサー投与前に正常な動脈圧波形を確認し、橈骨動脈カテーテルの開存性を確保します。
- 橈骨動脈のカニューレ挿入は、インターベンショナルラジオロジー、麻酔科、救命救急医学など、動脈ラインの日常的な留置に関する専門的なトレーニングを受けた医師に相談して行います。
- 動脈サンプル用ガンマ検出器
注:動脈入力機能の測定には、ガンマ検出プローブデバイスと蠕動ポンプを使用してください。手描きのサンプルは、[18F]FDGやその他のより長い半減期の放射性トレーサーでは実現可能ですが、4回の迅速な 15Oスキャンのシーケンスを採用することは、蠕動ポンプと参加者の手の横に配置できるほどコンパクトなガンマ検出器を使用した自動サンプリングによって大幅に容易になります。- 動脈ラインアセンブリを橈骨動脈カテーテルにできるだけ近づけて配置し、ガンマ検出プローブでの分散と遅延を最小限に抑えて測定を行います。カニューレ挿入部位からラインアセンブリを経由してガンマ検出プローブまでの経路が、ラインアセンブリで利用可能なキャリブレーションデータと一致していることを確認します。
- 無停電電源装置を通じて連続電力を供給し、偶然のガンマ検出器の光電子増倍管の安定性を確保します。一致検出では、100 ns のタイミング・ウィンドウを使用し、公称検出感度が 2.4 cps kBq-1 mL-1 以上で、10 kcps まで <1% の直線性であることを確認してください。
注:偶然検出用の液体充填導波路は壊れやすいため、保管エリアからPETスイートまでの取り扱いや輸送には注意が必要です。
6. スキャン
- 頭の動きを最小限に抑えます
- スキャンする前に、スキャン中に頭を動かさないようにすることの重要性について参加者を教育します。
- 研究参加者のポジショニング
- PET-CTハードウェアおよびソフトウェア構成で、研究参加者の頭または足を優先してスキャンできることを確認してください。可能な限り、PETでは足を優先して配置し、参加者の四肢と胴体がPETガントリーの向こう側にあり、参加者の頭がPETガントリの中央に留まり、CTガントリーが空いているようにします(図1)。
- 最近の尿排尿の確認、適切な衣服の着用、スキャナーと互換性のない眼鏡、宝石、または髪飾りの取り外しなど、人間のPET-CTスキャンのすべての既存のプロトコルに従って、参加者を下げたガントリーテーブルに横たわるように誘導および配置します。
- ガントリーテーブルがスキャナーボアに移動するときに、すべての動脈ラインと静脈ラインの完全性を確保します。動脈ラインと加圧生理食塩水源との連続接続を確保します。ペリスタルティックポンプ、ガンマ検出プローブ、およびスキャナーボアを通過できないその他のデバイスの切断とその後の再接続を確認します。
- 参加者の快適さ、特に頭、首、背骨、腰、脚の屈曲の位置に適したクッションを確保します。フォームヘッドレストを自由に配置して快適な頭の位置を確保し、頭の動きを避けるように参加者にリマインダーとして、伸縮性のある自己接着性自己取り外し可能なラッピングで参加者の額をガントリーテーブルに固定します。熱的快適性のために十分な毛布を確保してください。CTおよびPETスキャン全体で頭の動きを避ける必要性についての参加者の理解を確認します。
注: ヘッドレストと伸縮性のあるラッピングは、認知障害のある参加者でも頭の動きを大幅に制限します。 - ガントリーテーブルがスキャナーボアを通過し、参加者の四肢と胴体がCTガントリーを越え、参加者の頭がCTガントリの中央に来るまで、スキャナーボアを通過することを確認します。CTガントリーに入るときに、参加者のカントミータルラインを垂直レーザーマーカーに合わせ、あごの角度を少し下に置きます。以下の説明に従ってCTを行います。このポジショニングがPET視野内の大脳と小脳全体を捉えていることをCTで確認します。
- ガントリーテーブルがスキャナーの穴を通って、参加者の頭がPETガントリーの中央に来るまで続くことを確認します。動脈および静脈ラインへの適切なアクセスと、橈骨動脈カニューレ挿入に対応するための適切な手首の延長を確保します。天井の排気口が、PETガントリーの端近くで誤って吐き出された放射性トレーサーガスを効果的に除去できることを確認します。以下の手順6.3〜6.5で説明するようにCTとPETを実行します。
- PET中に参加者を定期的に監視し、スキャン中の最小限の口頭コミュニケーションで参加者の快適さを評価します。
注:足先でのポジショニングにより、放射性トレーサーガスの投与が容易になり、通信が改善され、吸入チューブの操作が改善されます。ただし、ほとんどのガントリーテーブルでは、足を優先して配置することは、熱可塑性ヘッドリテーションマスクの使用と互換性がない場合があります。足優先のポジショニングは、頭より下の体から発生する放出から頭を保護するデバイスと互換性がない場合もあります。このようなシールドは、そうでなければ、体から発生するランダムを減らすことができます。
- 減衰補正用CT
- 減衰補正に適した低線量頭部CTを受診する。参加者がスキャン中に休憩を必要とし、スキャナーを離れる場合は、PETセッションを再開する前にCTスキャンを繰り返して、その後のPETイメージングをコンソールベースで再構築できるようにします。有用なCTパラメータには、真空管電流75mA、回転時間0.5秒、スパイラルピッチ1.5、真空管電圧120kVpが含まれ、ベンダー推奨の畳み込みカーネルを使用し、512 x 512 x 88マトリックス、0.98 x 0.98 x 3.00 mm3分解能に再構成します。
- ガス状放射性医薬品の投与
- 最初のガス投与の前に、鼻から呼吸するのではなく、チューブから吸い込みと吐き出すことに重点を置いて、吸入の手順について参加者に指示します。
- ピコ電流計の線量校正器を装備したシールド付きガス貯蔵容器を準備します。ガス容器内では、サイクロトロンからの硬質狭径ナイロンラインと、投与中以外はクランプされたままの半硬質大径プラスチックポリマーチューブに拡張可能なベローズを接続します。Covid-19パンデミック用に策定された感染管理要件に従って、大口径チューブに沿ってウイルス捕捉パティキュレートフィルターを配置します。チューブの端に使い捨てのプラスチック製マウスピースを取り付けます。
- サイクロトロン施設にガス状放射性医薬品をガス容器に届けるよう要請する。
- すべてのガス状放射性医薬品をボーラスとして投与する準備をします。.吸入の手順はすべての場合で同じです。
- 拡張ベローズに供給される各ガスの活動をピークまで監視し、放射能が放射性薬物研究委員会が許可する最大線量(55 mCi)を下回るのを待ちます。ピコ電流計の線量校正器を使用して活動を監視します。スキャナーによるエミッションの取得を開始します。
- 吸入開始の直前にスキャンを開始して、時間活動曲線の開始を確実に取得します。3 秒フレーム x 23、5 秒フレーム x 6、10 秒フレーム x 20、スキャンの残りの部分で 30 秒フレームで 6 〜 7 分のエミッションを取得します。
- 参加者に完全に息を吐き、参加者のマスクを下げるように指示します。
- マウスピースを参加者の口の中に入れます。参加者にマウスピースの周りに唇でしっかりと密閉するように依頼し、できるだけ多く吸い込みます。参加者に数秒間息を止めて、肺がガス状の放射性医薬品を吸収するのを促進するように依頼します。
- 参加者にチューブから再び息を吐き出し、残留ガス状の放射性医薬品をふいごに戻します。チューブを再度クランプし、参加者から取り出します。
- 吸入開始から呼気終了まで、ベローズ内のガス活動を監視します。活動の差によって総投与量を計算します。総投与量が20 mCiを超えることを目標とします。
- [15O]CO を 1 回投与します。動脈測定が技術的に不十分な場合は、[15O]COの補充用量を投与し、血管内[15O]COを定常状態にするまで、約1〜2分かかります17。
- [15O]O2を2回連続して投与します。公称時間活動曲線の動脈測定値を監視します。
注:この手順は、軽度の認知障害のある参加者でも堅牢です。ただし、重度の認知障害または顔の衰弱のためにこの手順を実行できない参加者は、不十分な放射性トレーサー投与のリスクと呼気中の周囲空気へのガスの漏出のリスクを最小限に抑えるために除外されます。ガス状放射性トレーサーを清掃するためのマスクの継続的な投与および使用については、井口らによって報告および参照された代替方法を参照してください.24 [15O]O2 で一般的に得られる信号対雑音比 (好ましくないノイズ等価カウント) が低いため、[15O]O2 を二重に投与を繰り返すことが推奨されます。
- 注射された放射性医薬品の投与
- サイクロトロン施設に、静脈内放射性医薬品をスキャナーベイに配送するように依頼します。
- すべての静脈内放射性医薬品をボーラスとして投与する準備をします。.静脈内注射の手順は、すべてのケースで似ています。
- 最大許容値([15O]H2Oの場合は25 mCi、[18F]FDGの場合は6 mCi)を下回るまで、ウェルカウンター線量計で線量を監視します。.
- 静脈内注射の直前にスキャンを開始して、時間活動曲線の開始を確実に取得します。[15O]H2O の場合、スキャンの残りの部分で、3 秒フレーム x 23、5 秒フレーム x 6、10 秒フレーム x 20、30 秒フレームで 6 〜 7 分間の放出を取得します。[18F]FDG の場合、3 s フレーム x 23、5 s フレーム x 24、20 s フレーム x 9、60 s フレーム x 13、300 s フレーム x 7、351 s フレーム x 1 で 60 分間の放射を取得します。
- 速やかに静脈内投与を注射してください。シリンジ内の残留放射能を測定し、差による投与量を計算します。総投与量が許容される最小用量を下回っていないことを確認してください ([15O]H2O の場合は 15 mCi、[18F]FDG の場合は 4 mCi)。
- 公称時間活動曲線の動脈測定値を監視します。[15O]H2Oの場合、動脈測定が技術的に不十分な場合は、補充用量を投与します。.
注:[15O]H2Oの投与は、前者が静脈内に注入できるため、いくつかの点でガスの投与よりも簡単です。ただし、[15O]H2Oの半減期が短いため、PETスキャナーの位置や[15O]H2Oが生成および取得される場所によっては、慎重なオーケストレーションが必要です。
7. 動脈測定
- 研究参加者をスキャナーに配置した後、放射性医薬品活動の動脈測定に必要なすべてのデバイスを準備します。
- 橈骨動脈血管カテーテル、硬性圧力ライン、ストップコック、生理食塩水を供給するための加圧バッグ、ガンマ検出器用の延長カテーテルセット、蠕動ポンプ用の延長カテーテルセットとの間の接続の完全性を確保します。橈骨動脈に気泡が入り込まないように、また気泡が動脈血抽出のための蠕動ポンプを妨げないように、正しいプライミングを確保してください。
- ガンマ検出器には、長さが48 cm以下、プライミング容量が0.6 mL以下のマイクロボアカテーテル延長セットを使用します。
- 蠕動ポンプの場合、最大許容閉塞圧力制限を設定します。
- 蠕動ポンプが逆流方向で動作する輸液ポンプである場合は、容器を開いたままにするための最小流量(KVO)を選択します。
- 橈骨動脈血管カテーテル、硬性圧力ライン、ストップコック、生理食塩水を供給するための加圧バッグ、ガンマ検出器用の延長カテーテルセット、蠕動ポンプ用の延長カテーテルセットとの間の接続の完全性を確保します。橈骨動脈に気泡が入り込まないように、また気泡が動脈血抽出のための蠕動ポンプを妨げないように、正しいプライミングを確保してください。
- 放射性医薬品を投与する直前に、活栓を圧力バッグと圧力モニターに閉じ、ポンプを300mL/hで運転してください。橈骨動脈からの血液の抽出と、ガンマ検出器用の延長カテーテルセットとポンプ用の延長カテーテルセットを通過することを確認します。動脈循環25を通る放射性医薬品のボーラス通過全体にわたるガンマ検出器における放射性医薬品活性の連続測定を確認する。
- PETスキャナーからの時間活動曲線の同時取得を確認します。
- 300 mL/h でポンピングを続け、[15O]CO 吸入後少なくとも 300 秒、[15O]O2 吸入後 120 秒、[15O]H2O 注入後 120 秒、[18F]FDG 注入後 300 秒、ガンマ検出器での放射性医薬品活性の測定値を確認します。
- [18F]FDG の場合、PET スキャンが終了するまで、 20 mL/h 以上の低ポンプ速度で血液の送り出しを続けます。
- 各動脈測定の後、橈骨動脈カテーテルを洗い流すように動脈ラインを再構成します。次に、ガンマ検出器とポンプに供給するライン回路をフラッシュします。ポンプを通る絶縁回路の場合、ポンプ速度を 300 mL/hに設定します。必要に応じて、ヘパリン化生理食塩水の2番目のバッグを重力下で使用して、ポンプから血液を排出するための追加の流れを提供します。
注: 長期にわたるイメージング プロトコルと動脈血の繰り返しサンプリングを考えると、ライン閉塞のリスクが高くなる可能性があり、治験責任医師チームと看護師による継続的な警戒が必要です。厳格な滅菌対策を使用し、活栓のみで構成された閉回路を維持します。
8. 静脈サンプリング
- スキャンに先立って、静脈内アクセスのための 2 つの部位、放射性医薬品注射のための橈骨動脈カニューレ挿入の反対側と、静脈サンプリングのための橈骨動脈カニューレ挿入の同側を確立します。肘前アクセスを優先します。
- スキャンに先立って、シリンジとシリンジキャップを準備します。シリンジとキャップに消えない印をつけ、すべてのシリンジにキャップをし、分析天秤でキャップ付きシリンジを0.0001gの精度で計量します。少なくとも 2 mL の採血の開始時と完了時の静脈サンプリングの記録時間。室温(20〜25°C)で、血液1 mLをRCF3,300 × g で少なくとも60秒間遠心分離して、血漿を抽出します。全血および血漿中の活性を、68 Ge 用に較正されたウェルカウンターを使用してカウントします。
注:静脈サンプリングは、注射後30〜60分の[18F] FDGの測定に最も適しています。 15Oスキャン中に得られた静脈サンプルは、技術的に非常に困難で制御が難しく、動脈サンプルとの相関が良好ではありません。
9. PET画像の再構成とデータ保存
- PET-CTから画像を再構築し、5つのサブセット、TOF、遅延ランダム、モデルベースの絶対散乱スケーリング、減衰補正、オールパスフィルタリング(フィルタリングなし)、点像分布関数モデルなし、スキャン開始への減衰補正、Bq mL-1への再スケーリング、マトリックスサイズ220、ズーム2、および1.65mmの等方性ボクセルによる期待値最大化(OSEM)の3D通常ポアソン順序サブセットを優先します 長さ。
注:ズーム2は、画像再構成の横方向の視野を半分に縮小するため、参加者の頭とPET検出器リングとの間の周囲空間が無視されます。記載されているパラメータは、[15O]O2 ガスの開始値であり、散乱変動の影響を非常に受けやすく、モデルベースの絶対散乱スケーリングが必要です。歴史的に、散乱のモデルの選択は、 15Oトレーサーの再構成の品質に強く影響してきました。さらに、ベンダーが実装した散乱モデルと他のモデル(点像分布関数モデルなど)との相互作用は、現在のところ十分に理解されていません。したがって、このプロトコルは、点像分布モデルのない散乱モデルのみを実装します。 - スキャナーコンソールで再構築されたPETデータを確認し、適切な放射性トレーサーの投与と最小限の動きを確認します。
- 再構築されたPET、CT、normsデータ、およびlistmodeデータのDICOMファイルを保存します。
注: リストモードデータは、最適化された再構築に不可欠ですが、これは計算コストが高く、通常はスキャナーコンソールでは実行できません。Listmode のデータは非常に大きい (PET セッションあたり >40 GB) ため、適切なストレージデバイスを予約する必要があります。
- 再構築されたPET、CT、normsデータ、およびlistmodeデータのDICOMファイルを保存します。
10. 退院と参加者のフォローアップ
- 行の削除
- 滅菌技術を使用して橈骨動脈カテーテルを取り外し、手動で直接橈骨動脈圧を加えます(これは資格のある医療専門家が行う必要があります)。
- 橈骨動脈閉塞のリスクを最小限に抑えるために、特許止血技術を使用して15分間圧力をかけます。
- カテーテルの先端に血栓や骨折がないか調べます。
- 十分な止血が達成されたことを確認した後、滅菌ガーゼと弾性自己接着ラッピングで圧迫ドレッシングを塗布します。手の色、温度、感覚、または機能の変化がないか手を点検します。
- 在宅介護の指示
- 退院後2時間、圧迫ドレッシングを維持するように参加者に指示します。
- 参加者に、2時間後にカニューレ挿入部位に出血や打撲傷がないか調べてから、市販の包帯を貼るように指示します。
- 影響を受けた手首/腕を曲げたり濡らしたりしないように参加者に指示し、手首/腕を含む激しい活動を 48 時間避けます。
- 退院後48時間以内に、影響を受けた手首/腕に感染、怪我、または出血の兆候がないか検査するように参加者に指示します。
- 必要に応じて、研究チームに連絡する複数の方法を提供します。
- 軽度の打撲傷や一過性の不快感の一般的な合併症に安心感を与えます。
- 退院の24〜48時間後に研究参加者に連絡して、追加の合併症が発生していないことを確認してください。
- 退院後2時間、圧迫ドレッシングを維持するように参加者に指示します。
11. キャリブレーション
- クロスキャリブレーション
- 68Geまたは22Naのロッド基準源を使用して、ウェルカウンターの絶対校正を行います。
- その後、10-37 MBq の [18F]FDG を 30-670 mL の水に 2% アセトニトリルまたは類似の有機溶媒溶媒溶媒溶媒溶媒溶媒溶媒溶媒に溶かし、10-37 MBq のガンマ線の減衰が無視できるほど放射能を封じ込める硬質培地ボトル(ポリエチレンテレフタレートまたは高密度ポリエチレン)を使用してください。スキャナーボアでのクロスキャリブレーションの作業を減らすために、小容量のボトルを使用します。ボトルから抽出したアリコートを使用して、他のすべてのガンマ検出装置をクロスキャリブレーションします。
- カテーテルのキャリブレーション
- カテーテルの使用から生じる分散と遅延、および橈骨動脈とガンマ検出プローブの間のラインのキャリブレーション研究を実施します。
- 地元の血液銀行からの期限切れの血液製剤を使用し、温度制御された浴槽、および血液製剤のヘマトクリット値の制御されたバリエーションを使用します。
- コンパートメントデバイスを組み立てて、非標識血液製剤と[18F]FDG標識血液製剤を迅速に交互に行い、カテーテル、ライン、ガンマ線検出器プローブ、および蠕動ポンプの組み立てに送達します。Heavisideの「ステップファンクション」入力をアセンブリに供給し、経時的な放射能を測定します。
- 分散と遅延について畳み込みカーネルを推定します。カーネルをヘマトクリット値で変化するようにパラメータ化します。血液製剤の供給源を37°Cですべてのキャリブレーションを行います。 カーネルは、同一のアセンブリを使用するすべてのヒト研究で再利用します。
注:これらのキャリブレーションは、外部ラインアセンブリを介した分散と遅延のみを考慮し、内部の解剖学的構造は考慮していません。
- カテーテルの使用から生じる分散と遅延、および橈骨動脈とガンマ検出プローブの間のラインのキャリブレーション研究を実施します。
結果
このプロトコルの最も技術的に困難な側面のいくつかは、動脈ラインからのデータを構成、管理、および成功裏に収集しながら、同時に短い半減期の放射性トレーサーを投与し、スキャナーを実行することです。図1は、現在のセットアップを俯瞰した視点で示したもので、スタディコーディネーター、インターベンショナリスト、看護士、技術者、研究者から必要とされる組織と運用ワークフローをまとめています。上述の放射性医薬品は、標準化摂取値(SUVR)の比率の計算など、特定の活性の非定量的マップ(図2)に容易に組み込むことができます。全脳の時間活動曲線(図3)は、活動曲線の不連続性を生じさせる有意な頭部運動を特定するのに役立ち、120秒での[15O]COの予想されるプラトーとその結果としての腎排泄、脳組織によって抽出され、放射性標識[15O]H2に代謝されるボーラス通過後の[15O]O 2のプラトーなど、活動曲線の不連続性を生じさせる有意な頭部運動を特定するのに役立ちますO、注入された[15O]H2Oの単調な減少は、全身の分布容積が増加するにつれて、および18Fの生涯にわたる脳内のヘキソキナーゼを介した[18F]FDGの漸進的な取り込みおよびリン酸化である。
血管内分散の考慮を省略し、排出データの堅牢な特徴を強調する、より単純な多項式現象学は、Herscovitch et al26,27によって提唱されました。この作品の模範は、この後者の現象学のみを酸素代謝に利用しています。遠位橈骨動脈をカニューレするカテーテルからのガンマ検出によって記録された動脈入力機能は、かなりの分散と遅延を伴いますが、これをデコンボリューションする必要があります。我々は、一連のガンマ分布のモデルのパラメータ推定と指数関数的に上昇する定常項28のベイズ法を支持してきた。図 4 は、[15O]CO、[15O]O2、[15O]H2O、および [18F]FDG の結果を示しています。[15O]O2の結果は、代謝の[15O]H2Oの出現も示しています。図5は、CBV、CBF、CMRO2、CMRGlc、およびAGの統計パラメータマップを示しており、これらは古典的な解糖系のモルバランスであると定義しています。

図 1: セットアップと運用ワークフローの概要。 (A)スキャナーベイに必要な重要な機器と部品の概略図。スキャナーの穴が長いPET-CTスキャナーの場合、参加者の足先の位置付けは、ガス供給装置の操作性を高め、参加者との言語的および非言語的コミュニケーションを改善することにより、ガス状放射性医薬品の投与を改善します。ガス供給システム(シアンとブルー)は、サイクロトロンからの狭径ナイロンチューブで構成され、ガス状放射性医薬品の輸送のための排気ガスの下にあります。拡張可能なベローズとピコ電流計線量校正器を含むシールドされたガス貯蔵チャンバー。ウイルス粒子を捕捉するのに適した微粒子フィルターと、クランプとプラスチックマウスピースが取り付けられた端子大口径プラスチックポリマーチューブ。呼吸器飛沫にさらされるすべての部品は使い捨てまたは滅菌手順に適合しています。動脈血測定用の機器と部品(赤と濃い灰色)は、橈骨動脈カニューレを維持するための加圧生理食塩水、511 keVの消滅光子の一致のためのコンパクトなガンマ検出、動脈血回収用の蠕動ポンプ、および採取された血液の収集のための容器を提供します。静脈内注射用の放射性医薬品には、サイクロトロンから供給される[15O]O2ガスから[15O]H2Oを生成するための合成モジュール、またはサイクロトロン放射性医薬品(緑)からの空気圧チューブ送達のための合成モジュールが必要です。放射性医薬品の静脈内投与には、臨床グレードの線量測定(マゼンタ)が必要です。全血および血漿中の活性の測定には、ウェルカウンター、分析天びん、および微量遠心分離機(赤)が必要です。(B)ガス供給システムの注釈付きおよび詳細ビュー。略称:PET-CT = 陽電子放出断層撮影-コンピューター断層撮影。この図の拡大版を表示するには、ここをクリックしてください。

図 2: [15O]CO、[15O]O2、[15O]H2O、および [18F]FDG の代表的な静止画像で、側頭骨のウィンドウ CT に ~25% の透明度でオーバーレイされています。15個のO放射性トレーサーのスキャンにより、参加者は足先に配置され、伸縮性のある自己接着ラップのみが頭部をガントリーテーブルに固定しました。[18F]FDGのスキャンは、スキャンを中断した後、参加者をほぼ元の足優先の位置に戻しました。略語:CO =一酸化炭素。FDG =フルデオキシグルコース;CT = コンピューター断層撮影。この図の拡大版を表示するには、ここをクリックしてください。
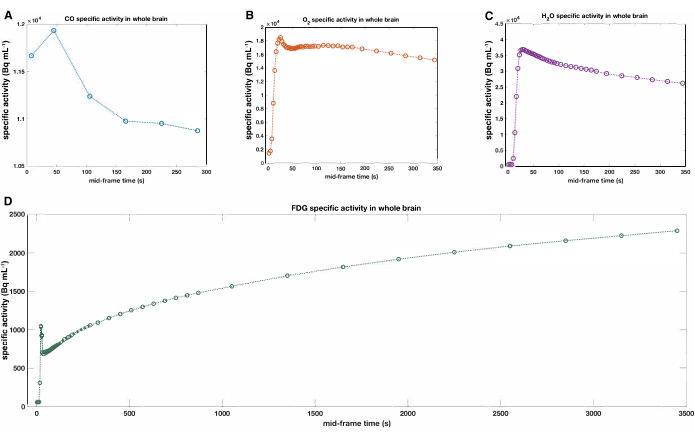
図3:全脳の代表的なトレーサー活動曲線 ((A)[15O]CO、(B)[15O]O2、(C)[15O]H2O、および(D)[18F]FDG。全脳は、解剖学的MPRAGEのマスキングによって定義されました。投与されたトレーサーのボーラスの到着は、パネル A および Bの最初のPETフレームのタイミングに先行するか、または一致します。略語:CO =一酸化炭素。FDG =フルデオキシグルコース;PET = 陽電子放出断層撮影;MPRAGE = 磁化準備された高速取得グラジエントエコー。 この図の拡大版を表示するには、ここをクリックしてください。

図4:橈骨動脈から連続的にサンプリングされた代表的なトレーサー活性曲線と、ラインアセンブリの分散液と遅延のデコンボリューション。模範は、(A)[15O]CO、(B)[15O]O2、(C)[15O]H2O、および(D)[18F]FDGを記述します。青い丸は、動脈血を通す狭くループしたカテーテルを囲む偶然検出プローブによって測定されたデータです。プローブからの偶然のカウントには、周囲の光子(100nsのデバイスタイミングウィンドウ内に収まる広スペクトルランダム)に応答するLYSO結晶のベースラインシンチレーションが含まれます。動脈血は、蠕動ポンプの遠位作用により、橈骨動脈からプローブを通って通過します。紫色の破線は、プロトコルセクション11.2で説明されている分散と遅延に関するカーネルの経験的推定値です。黄色の線は、分散と遅延を補正したトレーサーの活動曲線を示しています。シミュレーテッド アニーリングは、黄色の線の一般化ガンマ分布のパラメーターを推定し、推定されたカーネルと一致し、一致検出からのデータと一致します。適合したデータは赤い線で表示されます。パネル(B)は、Mintunらによって記述された線形特性を有すると仮定された[15O]O2の代謝からの[15O]H2Oも示している15。略語:CO =一酸化炭素。FDG =フルデオキシグルコース;PET = 陽電子放出断層撮影;LYSO = ルテチウム - イットリウム オキシオルトケイ酸塩。この図の拡大版を表示するには、ここをクリックしてください。

図5:CBV、CBF、CMRO 2、CMRGlc、およびAGのマップ。 CBVは、CMRO2、CMRGlc、およびAGの定量的推定に必要です。しかし、静脈洞からの活動は、CMRGlcとAGにとって交絡しています。その結果、静脈洞はマスキングによってCMRO2 およびCMRGlcから除去されました。小脳と新皮質のコントラストは、AGの以前の研究と一致しています。略語:CBV =脳血液量;CBF = 脳血流;CMRO2 = 脳の酸素代謝率;CMRGlc = グルコースの脳代謝率;AG = 好気性解糖系。 この図の拡大版を表示するには、ここをクリックしてください。
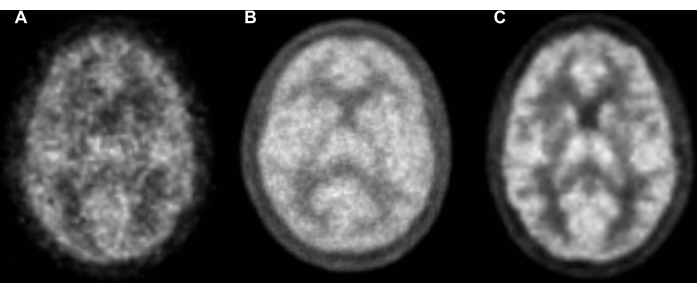
図6:3世代のPETスキャナーでスキャンした健康な対照研究参加者からの[15O]H2Oの静電気放出の例。 すべての再構成では、遅延ランダム、減衰補正、およびオールパスフィルタリング(フィルタリングなし)を備えた3D OP-OSEMを使用しました。すべての再構成は、効率的な臨床ワークフローに適したパラメータを備えたスキャナーコンソールから行われます。追加の数値処理、修正、またはぼかしは使用されていません。比較のために、すべてのスキャナーの結果は、1.0 mm3 の解像度で MNI152 アトラスに剛体変換とトリリニア補間を行った後に示しています。(A)BGOクリスタルシンチレータを備えたPET専用スキャナー、4回の反復と16のサブセットを備えたOP-OSEM、2.0 x 2.0 x 2.4 mm3 ボクセル、6分間のエミッション、減衰マッピング用のGe / Gaによる透過スキャン、および単一散乱シミュレーション。(B)LYSOクリスタルシンチレータを備えたPET-MRスキャナー、4回の反復と16のサブセットを備えたOP-OSEM、2.1 x 2.1 x 2.0 mm3 ボクセル、10分間の放出、減衰マッピング用の外部取得CT、およびモデルベースの絶対散乱スケーリング。(C)LYSOクリスタルシンチレータ、Time-of-Flight検出、8回の反復と5つのサブセットを持つOP-OSEM、1.65 x 1.65 x 1.65 mm3 ボクセル、6分間の放射、減衰マッピング用の統合CT、モデルベースの絶対散乱スケーリングを備えたPET-CTスキャナー。略語:PET =陽電子放出断層撮影;CT = コンピューター断層撮影;MR =磁気共鳴;OP-OSEM = 期待値最大化の通常のポアソン順序部分集合;BGO = ビスマスゲルマン酸塩;LYSO = ルテチウム - イットリウム オキシオルトケイ酸塩。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
吸入 [15O]CO および [15O]O2 ガスを使用した酸素およびグルコース代謝の PET イメージング、[15O]H2O の静脈内注射、および [18F]FDG の静脈内注射は、古い世代の PET スキャナー 14,15,16,17,26,27 から蓄積されたイメージングに基づく有意な歴史的事前性を持っています.これらのデータは、減衰マッピング、発光制限付きゲルマネートビスマス(BGO)シンチレータアレイ、高活性ドージング、および限られたシンチレータ発光に対応するためのリングセプタムによる2D取得、および計算コストの低いフィルタリングされたバックプロジェクション再構成のためのゲルマニウム/ガリウム源による透過スキャンに一般的に依存していました。このプロトコルに記載されているものを含む新しいスキャナーは、減衰補正のための高解像度CT、空間的に高密度のシンチレータ構成に配置された高発光ルテチウム-イットリウムオキシオルトケイ酸(LYSO)シンチレータアレイ、光子検出の効率を多重化する3D取得、消滅イベントの空間的局在を改善するTOF検出エレクトロニクス、および3D正規ポアソン順序サブセットによる計算的に高度な再構成方法を使用します。期待値最大化 (OP-OSEM)。新しいスキャナーは、29,30という低い放射線量で優れた画質を提供します。3世代のPETスキャナーから得られる同等の例を図6に詳しく説明します。
このプロトコルは、新しいスキャナからのPETスキャンからの情報の品質を向上させるために、いくつかの追加の変更を利用しています:足優先の位置決め、細心の注意を払った用量投与、および自動化された動脈入力機能測定25。これらにより、2〜3時間のスキャンセッション内で、酸素とグルコース代謝の4つの異なるトレーサーの動脈入力機能と脳放出データを収集できます。その後、これらのデータを従来の動的モデリング法や新しい速度論的モデリング法、および部分体積補正アルゴリズムに提出して、脳代謝の高解像度で高精度の定量的推定値を生成できます。重要なことに、このプロトコルは、脳の酸素とグルコース代謝の定量的測定を可能にするだけでなく、脳のAGの計算も可能にします。特に、最先端のスキャナーからの優れた画像品質により、より現実的な画像由来の動脈入力機能が可能になり、以前は動脈サンプリングと脳放出のタイミングの違いに対するノイズや感度によって制限されていた新しい分析アプローチが可能になります19。
特に、15O 放射性トレーサーでは、[18F]FDG よりも画像品質の向上が困難です。122 秒の半減期が 15O の一時的なものであるため、情報が大幅に失われます。ただし、ガスが参加者の頭とPET-CTの検出リングとの間の周囲空間に蓄積する可能性があるため、ガス状放射性トレーサーの使用も適切である可能性があります。そこでは、放射性トレーサーガスからの放出がランダムと散乱の重要な発生源を形成する可能性があるため、空気であると特定された領域と比較して散乱源の相対的なスケーリングを使用するベンダー実装の散乱補正方法が混乱します。静脈内注射された[15O]H2Oでさえ、かなりの量が[15O]H2O蒸気として吐き出されると困難をもたらす可能性があります。ガス状放射性トレーサーを除去する方法は報告されています24が、この研究では実装されていません。従来の散乱補正モデルは、15O放射性トレーサーのイメージングには不十分であり、これらのトレーサーの最高の性能は、視野内の消滅光子の絶対的な発生源を考慮し、再スケーリングせずに、減衰の正確なマップと組み合わせた散乱モデルに依存していました。PET-MRスキャナーのヘッドコイルに取り付けられたミラーなど、ハードウェアのわずかな省略でさえ、15Oガスが一般的に凝縮物を形成するため、エミッションの再構築でかなりのアーティファクトが発生する可能性があります。参加者の動きに続く減衰のマップの不一致から生じる関連するアーティファクトも報告されています31。散乱モデルとガス状放射性トレーサーの点像分布特性との相互作用はまだ十分に特徴付けられていないため、この研究では、高解像度PETに不可欠な点像拡散モデリング手法を省略しています。各トレーサーのリストモードの再構成パラメータを最適化することがベストプラクティスですが、この作業では、プロトコルセクション9.1で説明されているように、可能な限りすべてのトレーサーに同じように適用された単純なコンソール再構成を使用した例を提供します。模範は必然的に、トレーサー速度論的時間スケールの変動性に適応したフレームタイミングスケジュールを示します。この例は、単純さ、カウント統計の比較可能性、各トレーサーで利用可能な効果的な空間分解能、および各トレーサーの再構成パラメーターを最適化しながら発生する可能性のあるバイアスの最小化を強調しています。15Oの既存の研究との比較可能性のために、この研究の代表的な結果は、飛行時間取得30,32を伴う現代のPET-CTに適していると以前に報告された5つのサブセットの8回の反復を使用しています。Time-of-Flightは、5つのサブセットを4回繰り返すことでイメージング解像度が向上する可能性があり、これらの最適化は、この研究で説明されているトレーサーについて積極的に研究されています。
最新のPET-CTスキャナーの長いスキャナーボアは、放射性トレーサーガスを提供する研究者の邪魔になります。ガントリーの形状が閉じ込められていると、ガスの投与、参加者への指示の伝達、ガス投与装置が放射性トレーサーを周囲空間に漏らさないようにする際に、参加者の口に到達するのが難しくなります。これにより、参加者の足優先のポジショニングが利点を発揮します。ほとんどのスキャナーハードウェアでは、足を優先するポジショニングは、通常、参加者の首を囲み、参加者の頭を体から仕切るリードシールドを配置するニューロシールドデバイスの配置と互換性がありません。ニューロシールドは、体から視野に入るランダムを減らします。周囲ガス放射性トレーサーの回避と比較したニューロシールドの相対的な利点は、現在のところよく理解されていません。
脳代謝の定量化
本論文は、Raichle et al. (CBF)16 および Martin et al. (CBV)17 によって記述された血行動態の従来のモデルと、Mintun et al. (CMRO2)15 および Huang et al. (CMRGlc)14 によって記述された代謝の従来のモデルを用いた解析結果を示しています。これらの分析では、この論文で説明されているプロトコルを使用して測定された動脈入力関数と排出量データを利用します。画像由来の方法など、動脈入力機能を測定するための代替手段が積極的に追求され、侵襲的な方法に対してテストされています。従来のモデルでは、動的イメージングもフルに活用して、動的モデルのパラメーターを推定します。我々は、CBFとCMRO226,27の多項式表現の使用を好んできた。CMRGlcの推定にはHuangらの方法を支持していますが、ベイジアンパラメータ推定28,33を採用しています。AGは、最近では、解糖系に入るが、酸化的リン酸化以外の細胞機能に寄与するグルコースの尺度として考案されました4。脳AGの計算には、CMRGlcとCMRO2をモル当量に変換し、前者から後者の6分の1を減算するだけでよい。
部分的なボリューム補正
私たちは通常、対称幾何学的伝達行列アルゴリズム(sGTM)34を使用して、SUVR画像に対して局所的な部分体積補正を行います。これは、MRIによって取得された高解像度データに依存しており、解剖学的配列のみを含めることができますが、現在のプロトコルでは、より正確な局所パーセル化のためにHuman Connectome Project(HCP)のような配列も取得します。解剖学的アトラス(Desikan-Killiany35など)と機能的アトラス(Schaeffer36 やGlasser37など)の両方を使用しました。前者のアトラスは、多くの場合、低解像度で取得されたPET画像に適した大きな関心領域を持ち、以前のPET研究でより広く使用されています。しかし、新しいアトラスは、機能的にも細胞構造的にもより明確に定義されており、Siemens Visionスキャナーで得られるような高解像度のPETイメージングにより適している可能性があります。 15OスキャンのSUVR画像は、前述のように計算され、全脳値4を参照しています。次に、全脳のCMRGlcとCMRO2 を上記の速度論モデリングを使用して計算し、SUVR画像を絶対定量値に変換します。これにより、部分体積補正された地域AGを計算できます。ダイナミックエミッションイメージングの模範は、プレゼンテーションのシンプルさのために部分的な体積補正を示していませんが、動的イメージングを考慮した部分的な体積補正法は現在積極的に研究されています。
プロトコールの一般化可能性と適応性
このプロトコルは、ヒトのPETによる酸素およびグルコース代謝の測定から達成可能な最高の精度、精度、再現性、および解釈可能性を取得することに関連する方法論の詳細を説明しています。既知の最高の測定精度と精度は、動脈入力機能の直接測定、高解像度構造MRIとの同時レジストレーションによる関心領域の決定、統計モデルのための非常に要求の厳しい計算リソースの使用など、トレーサーキネティクスの原理と実践に基づく分析に属しています。特に、侵襲的な橈骨動脈カニューレ挿入術と、連続的に繰り返される排出スキャンによるその維持は、費用がかかり、臨床的に経験豊富なチームの関与を必要とする重傷のリスクが有限です。 15Oに基づくトレーサーの使用は、サイクロトロンとそのサポートチームにとってさらに別の課題です。これらは、ヒトで歴史的に報告された代謝測定値に対応し、定量的所見の解釈が以前に蓄積された情報に基づいて構築されることを保証します。しかし、これらの詳細で侵襲的な手段は、ヒトの代謝に関する多くの問題に対して十分な、より侵襲性が低く、要求の少ない方法を検証する手段も提供します。適切な検証に続いて、橈骨動脈カニューレ挿入は、多くの専門研究のために、入力関数38 の画像由来のソースに適切に置き換えられる可能性がある。橈骨動脈カニューレ挿入を避けると、[15O]O2の主要な代謝産物、すなわち[15O]H2Oの直接測定も不可能になります。これは、血漿からの代謝の[15O]H2Oおよび遠心分離された赤血球からの[15O]O2 を推定するために遠心分離された橈骨動脈のサンプルから推定できます。しかし、計算集約的な方法を使用して、動脈循環における代謝[15O]H2Oの出現をパラメトリックに解決することができ、その線形モデルはMintunらによって提案されています15。SUVRを使用する多くの方法論は、侵襲的に取得されたデータとの比較後の検証にも適している可能性があります。現在、活発な研究プログラムは、血中酸素濃度依存効果に基づく酸素化推定値の検証を求めており、 15Oとの同時測定はさらなる検証を提供することができる39。さらに、このプロトコルでは例示なしに言及されているだけですが、listmodeからの画像再構成の詳細な最適化は、代謝の測定の品質を向上させる可能性があります。さらに、リストモードデータの動き補正や部分体積補正などの多くの特殊な方法は、研究の質問がそれらを必要とする場合、たとえば、時折参加者が過度の頭の動きをしたり、皮質萎縮の研究が脳脊髄液との部分体積平均化によって交絡したりする場合に努力する価値があるかもしれません。
PETスキャンに関する注意事項
このプロトコルは、参加者を電離ガンマ線にさらします。ここで説明する全PETセッション( 15Oスキャンを4回から6回、FDGスキャンを1回含む)を受けた参加者の放射線量の現在の推定値では、すべての放射性トレーサー投与を含む平均総実効線量は約7 mSv(0.7 rem)である。これは、研究や臨床診療で使用される他の放射性トレーサーの放射線量に匹敵し、放射線従事者が1年間に許容する総放射線量の14%に相当します。すべての参加者(および/または法的に認められた代理人)は、研究登録の同意を得る前に、書面と口頭の両方で潜在的な放射線リスクについて慎重に通知されます。
幹線に関する注意事項
動脈カニューレ挿入の合併症には、打撲傷(一般的)、痛み、腫れ、血腫(まれ)、挿入部位の出血、血管痙攣、血栓症(まれ)、および使用時のヘパリン化生理食塩水への反応(非常にまれ)が含まれます。私たちは定期的にインターベンショナルラジオロジーサービスを利用して、動脈ラインを配置し、合併症が発生した場合に管理しています。
MRIに関するご注意
米国食品医薬品局(FDA)は、MRIスキャナーの磁場に入るすべての医療機器に、標準化された安全性試験を受けることを義務付けています。参加者のデバイスに MRI Safeのラベルが付けられている場合、FDAが承認した標準的なスキャン条件を使用して、参加者に追加のリスクを与えることなく続行できます。参加者のデバイスが MRI条件付きの場合、デバイスの製造元、メーカー、モデルを確認し、それに応じてMRIスキャン手順を調整します。また、画像検査には偶発的な所見が明らかになる潜在的なリスクがあり、不安、追加の精密検査による経済的損失、まれに、その後の臨床的に示された侵襲的処置から生じる合併症などの追加のリスクが発生する可能性があります。
制限事項の概要
酸素とグルコース代謝の測定には避けられない制限があり、放射性トレーサー自体に特有のものです。 15名Oトレーサーは半減期が短いため、高度に専門化されアクセス可能なサイクロトロン施設の存在など、このプロトコルの最も厳しい要件の多くが規定されています。Gaseous 15O-トレーサーは、呼気ガスの掃気24 や散乱補正のための特殊な方法など、ガス管理の複雑さを導入する。[18ファイル]FDGは、[11C]-グルコーストレーサーの代謝物を追跡するという大きな課題を、集中定数推定による交絡のために交換します。このプロトコルには、統合されたPET-CTスキャナーの限られた形状から生じる制限もあります。参加者の足優先のポジショニングは閉じ込めの問題を改善しますが、神経シールドデバイスの使用とは互換性がない場合があります。最後に、侵襲的な橈骨動脈カニューレ挿入の使用は、それ自体が大きな制限です。橈骨動脈は、脳の主要な動脈供給の代理です。ただし、橈骨動脈は、動脈供給から脳への流れ特性に不一致がある場合があります。さらに、侵襲的で痛みを伴う手順は、研究参加者の認知状態を変化させ、このプロトコルで追求できる神経画像研究の範囲と一般化可能性を制限します。
開示事項
著者とこの論文の内容との間には、金銭的またはその他の利益相反はありません。
謝辞
特に、研究参加者の利他性には感謝しています。この研究を可能にしてくれたNeuroimaging Labs Research Center、Knight Alzheimer's Disease Research Center、Center for Clinical Imaging Research(CCIR)、およびWashington Universityサイクロトロン施設のディレクターとスタッフに感謝します。NIH R01AG053503、R01AG057536、RF1AG073210、RF1AG074992、1S10OD025214、Mallinckrodt Institute of Radiology、およびワシントン大学のMcDonnell Foundation for Systems Neuroscienceからの研究資金提供に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 3/16" outer diameter 1/8" innner diameter nylaflow tubing | Nylaflow Tubing, Zazareth, PA | ||
| 4 x 4 in. gauze | McKesson MedSurg | 16-4242 | |
| Analytical balance | Fisher Scientific/OHUAS | Pioneer Exal Model 90 mm platform #PA84 | |
| Bacterial/Viral filter | Hudson RCI, Teleflex, Perak, Malaysia | REF 1605 (IPN042652) | |
| BD SmartSite Needle-Free Valve | Becton Dickinson | 2000E | |
| Biograph mMR | Siemens, Erlangen, Germany | ||
| Biograph Vision 600 Edge | Siemens, Erlangen, Germany | ||
| Caprac wipe counter | Mirion Medical (Capintec), Florham Park, NJ | from 1991 or newer | NaI drilled well crystal |
| Coban self-adhesive wrap | 3M | commonly used in intensive care units | |
| dressing, tegaderm, 4 x 4" | 3M Health Care | #1626 | |
| ECAT EXACT HR+ | CTI PET Systems, Knoxville, TN | ||
| Edwards TruWave 3 cc/84 in (210 cm) | Edwards Lifescience | PX284R | |
| extension catheter 48 cm length, 0.642 mL priming volume | Braun | V5424 | |
| heparin sodium, solution 2 U/mL, 1,000 mL | Hospira Worldwide | #409762059 | |
| I.V. armboard flexible 4 x 9 in. adult | DeRoyal | M8125-A | |
| Keithley pico-ammeter | Tekronix | ||
| Magnetom Prisma fit | Siemens, Erlangen, Germany | 3T | |
| male-male adapter for Luer valves | Argon Medical Co. | 040184000A | |
| MiniSpin Personal Microcentrifuge | Eppendorf, Hamburg, Germany | EP-022620151 | |
| Mouthpiece 15 mm ID, 22 mm OD | Hudson RCI, Teleflex, Perak, Malaysia | REF 1565 (IPN042595) | |
| MRIdium | Iradmed, Winter Springs, FL | 3860+ | |
| Nalgene square PET media bottle with closure, 650 mL | Thermo Scientific | #3420400650 | for cross-calibration |
| pressure infusion bag with bulb, accommodating 1,000 mL | Health Care Logi | #10401 | |
| pressure monitoring tray polyethylene catheter; 2.5Fr (2.5 cm) angiocath; 0.015" 15 cm wire; 22G (2 cm) needle | Cook Medical | C-P MSY-250, G02854 | |
| RDS 11 MeV Cyclotron | Siemens, Erlangen, Germany | proton bombardment of 15N to generate 15O | |
| sodium chloride IV solution 0.9%, 1,000 mL | B. Braun Medical | E8000 | |
| steri-strips (closure, skin reinf LF 1/2x4") | McKesson MecSurg | #3010 | |
| Twilite II | Swisstrace, Zurich, Switzerland | ||
| Uninterruptible Power Supply battery backup and surge protector | APC | BR1500MS2 |
参考文献
- Goyal, M. S., Hawrylycz, M., Miller, J. A., Snyder, A. Z., Raichle, M. E. Aerobic glycolysis in the human brain is associated with development and neotenous gene expression. Cell Metabolism. 19 (1), 49-57 (2014).
- Magistretti, P. J. Imaging brain aerobic glycolysis as a marker of synaptic plasticity. Proceedings of the National Academy of Sciences. 113 (26), 7015-7016 (2016).
- Shannon, B. J., et al. Brain aerobic glycolysis and motor adaptation learning. Proceedings of the National Academy of Sciences of the United States of America. 113 (26), E3782-E3791 (2016).
- Vaishnavi, S. N., et al. Regional aerobic glycolysis in the human brain. Proceedings of the National Academy of Sciences. 107 (41), 17757-17762 (2010).
- Powers, W. J., Dagogo-Jack, S., Markham, J., Larson, K. B., Dence, C. S. Cerebral transport and metabolism of 1-11C-D-glucose during stepped hypoglycemia. Annals of Neurology. 38 (4), 599-609 (1995).
- Locasale, J. W., Cantley, L. C. Metabolic flux and the regulation of mammalian cell growth. Cell Metabolism. 14 (4), 443-451 (2011).
- Lunt, S. Y., Vander Heiden, M. G. Aerobic glycolysis: meeting the metabolic requirements of cell proliferation. Annual Review of Cell and Developmental Biology. 27 (1), 441-464 (2011).
- Vlassenko, A. G., Raichle, M. E. Brain aerobic glycolysis functions and Alzheimer's disease. Clinical and Translational Imaging. 3 (1), 27-37 (2015).
- Goyal, M. S., et al. Loss of brain aerobic glycolysis in normal human aging. Cell Metabolism. 26 (2), 353-360 (2017).
- Goyal, M. S., et al. Spatiotemporal relationship between subthreshold amyloid accumulation and aerobic glycolysis in the human brain. Neurobiology of Aging. 96, 165-175 (2020).
- Goyal, M. S., et al. Brain aerobic glycolysis and resilience in Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 120 (7), 2212256120 (2023).
- Segarra-Mondejar, M., et al. Synaptic activity-induced glycolysis facilitates membrane lipid provision and neurite outgrowth. EMBO Journal. 37 (9), 97368 (2018).
- Harris, R. A., et al. Aerobic glycolysis is required for spatial memory acquisition but not memory retrieval in mice. Eneuro. 6 (1), (2019).
- Huang, S. C., et al. Noninvasive determination of local cerebral metabolic rate of glucose in man. American Journal of Physiology-Endocrinology and Metabolism. 238 (1), E69-E82 (1980).
- Mintun, M. A., Raichle, M. E., Martin, W. R. W., Herscovitch, P. Brain oxygen utilization measured with O-15 radiotracers and positron emission tomography. Journal of Nuclear Medicine. 25 (2), 177-187 (1984).
- Raichle, M. E., Martin, W. R., Herscovitch, P., Mintun, M. A., Markham, J. Brain blood flow measured with intravenous H2(15)O. II. Implementation and validation. Journal of nuclear medicine. 32 (15), 790-798 (1983).
- Martin, W. R. W., Powers, W. J., Raichle, M. E. Cerebral blood volume measured with inhaled C15O and positron emission tomography. Journal of Cerebral Blood Flow & Metabolism. 7 (4), 421-426 (1987).
- Hooker, J. M., Carson, R. E. Human positron emission tomography neuroimaging. Annual Review of Biomedical Engineering. 21, 551-581 (2019).
- Fan, A. P., et al. Quantification of brain oxygen extraction and metabolism with [(15)O]-gas PET: A technical review in the era of PET/MRI. Neuroimage. 220, 117136 (2020).
- Tisdall, M. D., et al. Volumetric navigators for prospective motion correction and selective reacquisition in neuroanatomical MRI. Magnetic Resonance in Medicine. 68 (2), 389-399 (2012).
- Greve, D. N., et al. Cortical surface-based analysis reduces bias and variance in kinetic modeling of brain PET data. NeuroImage. 92, 225-236 (2014).
- Greve, D. N., et al. Different partial volume correction methods lead to different conclusions: An 18F-FDG-PET study of aging. NeuroImage. 132, 334-343 (2016).
- Iguchi, S., et al. System evaluation of automated production and inhalation of (15)O-labeled gaseous radiopharmaceuticals for the rapid (15)O-oxygen PET examinations. EJNMMI Physics. 5 (15), 37 (2018).
- Alf, M. F., et al. Quantification of brain glucose metabolism by 18F-FDG PET with real-time arterial and image-derived input function in mice. Journal of Nuclear Medicine. 54 (1), 132-138 (2013).
- Herscovitch, P., Mintun, M. A., Raichle, M. E. Brain oxygen utilization measured with oxygen-15 radiotracers and positron emission tomography: generation of metabolic images. Journal of Nuclear Medicine. 26, 416-417 (1985).
- Videen, T. O., Perlmutter, J. S., Herscovitch, P., Raichle, M. E. Brain blood volume, flow, and oxygen utilization Measured with 15O radiotracers and positron emission tomography: revised metabolic computations. Journal of Cerebral Blood Flow & Metabolism. 7 (4), 513-516 (1987).
- Lee, J. J., et al. Dynamic susceptibility contrast MRI with localized arterial input functions. Magnetic Resonance in Medicine. 63 (5), 1305-1314 (2010).
- Kunnen, B., Beijst, C., Lam, M., Viergever, M. A., de Jong, H. Comparison of the Biograph Vision and Biograph mCT for quantitative (90)Y PET/CT imaging for radioembolisation. EJNMMI Physics. 7 (1), 14 (2020).
- van Sluis, J., et al. Performance characteristics of the digital Biograph Vision PET/CT system. Journal of Nuclear Medicine. 60 (7), 1031-1036 (2019).
- Lodge, M. A., Mhlanga, J. C., Cho, S. Y., Wahl, R. L. Effect of patient arm motion in whole-body PET/CT. Journal of Nuclear Medicine. 52 (12), 1891-1897 (2011).
- Prenosil, G. A., et al. Performance characteristics of the Biograph Vision Quadra PET/CT system with a long axial field of view using the NEMA NU 2-2018 Standard. Journal of Nuclear Medicine. 63 (3), 476-484 (2022).
- Lee, J. J., et al. Dissociation between hormonal counterregulatory responses and cerebral glucose metabolism during hypoglycemia. Diabetes. 66 (12), 2964-2972 (2017).
- Sattarivand, M., Kusano, M., Poon, I., Caldwell, C. Symmetric geometric transfer matrix partial volume correction for PET imaging: principle, validation and robustness. Physics in Medicine and Biology. 57 (21), 7101-7116 (2012).
- Desikan, R. S., et al. An automated labeling system for subdividing the human cerebral cortex on MRI scans into gyral based regions of interest. Neuroimage. 31 (3), 968-980 (2006).
- Schaefer, A., et al. Local-global parcellation of the human cerebral cortex from intrinsic functional connectivity MRI. Cerebral Cortex. 28 (9), 3095-3114 (2018).
- Glasser, M. F., et al. A multi-modal parcellation of human cerebral cortex. Nature. 536 (7615), 171-178 (2016).
- Zanotti-Fregonara, P., Chen, K., Liow, J. -. S., Fujita, M., Innis, R. B. Image-derived input function for brain PET studies: many challenges and few opportunities. Journal of Cerebral Blood Flow & Metabolism. 31 (10), 1986-1998 (2011).
- Rodgers, Z. B., Detre, J. A., Wehrli, F. W. MRI-based methods for quantification of the cerebral metabolic rate of oxygen. Journal of Cerebral Blood Flow & Metabolism. 36 (7), 1165-1185 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
ISSN 1940-087X
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。