Method Article
Multi-Tracer-Studien des Sauerstoff- und Glukosestoffwechsels im Gehirn mit einem Flugzeit-Positronen-Emissions-Tomographie-Computertomographen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Quantitative Messungen des Sauerstoff- und Glukosestoffwechsels mittels PET sind etablierte Technologien, aber Details zu praktischen Protokollen werden in der Literatur nur spärlich beschrieben. In diesem Beitrag wird ein praktisches Protokoll vorgestellt, das erfolgreich auf einem hochmodernen Positronen-Emissions-Tomographie-Computertomographen implementiert wurde.
Zusammenfassung
Die Autoren haben ein Paradigma entwickelt, das die Positronen-Emissions-Tomographie (PET) mit mehreren radiopharmazeutischen Tracern verwendet und Messungen des zerebralen Stoffwechsels von Glukose (CMRGlc), des zerebralen Stoffwechsels von Sauerstoff (CMRO2), des zerebralen Blutflusses (CBF) und des zerebralen Blutvolumens (CBV) kombiniert, was in Schätzungen der aeroben Glykolyse des Gehirns (AG) gipfelt. Diese in vivo Schätzungen des oxidativen und nicht-oxidativen Glukosestoffwechsels sind relevant für die Erforschung des menschlichen Gehirns in Gesundheit und Krankheit. Die neuesten Positronen-Emissions-Tomographie-Computertomographie-Scanner (PET-CT) bieten eine Time-of-Flight-Bildgebung (TOF) und entscheidende Verbesserungen bei der räumlichen Auflösung und der Reduzierung von Artefakten. Dies hat zu einer deutlich verbesserten Bildgebung mit niedrigeren Radiotracer-Dosen geführt.
Optimierte Methoden für die neuesten PET-CT-Scanner umfassen die Verabreichung einer Sequenz von inhalativem 15O-markiertem Kohlenmonoxid (CO) und Sauerstoff (O2), intravenös 15O-markiertem Wasser (H2O) und 18F-Desoxyglukose (FDG) – alles innerhalb von 2-stündigen oder 3-stündigen Scansitzungen, die hochauflösende, quantitative Messungen von CMRGlc, CMRO2 liefern, CBF, CBV und AG. Dieses Methodenpapier beschreibt praktische Aspekte des Scannens zur Quantifizierung des Hirnstoffwechsels mit Tracer-kinetischen Modellen und arteriellen Blutproben und enthält Beispiele für bildgebende Messungen des menschlichen Gehirnstoffwechsels.
Einleitung
Das menschliche Gehirn ist ein starker Verbraucher von Sauerstoff und Glukose für den Stoffwechsel. Ein Teil des Glukosestoffwechsels im gesunden menschlichen Gehirn findet außerhalb des Sauerstoffverbrauchs statt, die als aerobe Glykolyse (AG) des Gehirns bekannt ist und deren Zwecke intensiv untersucht werden 1,2,3,4,5. Frühere Studien an Tiermodellen und Menschen berichten über einen Zusammenhang zwischen AG und Entwicklung und Alterung, synaptischer und Neuritenentwicklung, Gedächtnis, Amyloidablagerung bei der Alzheimer-Krankheit und Funktion und Krankheit der weißen Substanz 1,6,7,8,9,10,11,12,13 . Daher besteht ein anhaltendes Interesse an der Erforschung von AG und anderen Aspekten des Gehirnstoffwechsels, um das menschliche Gehirn besser zu verstehen, wenn es altert und Verletzungen und Krankheiten erleidet.
Gegenwärtig erfordern Methoden zur Bewertung der AG des menschlichen Gehirns in vivo eine PET-Bildgebung mit mehreren Sauerstoff- und Glukoseradiotracern, um den zerebralen Stoffwechsel von Glukose (CMRGlc)14, den zerebralen Stoffwechsel von Sauerstoff (CMRO2)15, den zerebralen Blutfluss (CBF)16 und das zerebrale Blutvolumen (CBV)17 zu messen. Neben der Bildgebung erfordert die quantitative Messung des Hirnstoffwechsels mit PET andere Komplexitäten, einschließlich der Bewertung der arteriellen Eingangsfunktion, typischerweise durch invasive arterielle Kanülierung und Probenahme; Sicherstellung, dass die Teilnehmer die Anweisungen für die Inhalation von Radiotracern genau befolgen und gleichzeitig die Kopfbewegung einschränken; sicherer und effektiver Umgang mit Radiotracern mit sehr kurzen Halbwertszeiten (2 min); Verwaltung großer Datensätze; und Durchführung fortschrittlicher Analysemethoden zur genauen Berechnung von Stoffwechselparametern. Bemerkenswert sind auch die Einschränkungen bei der Verwendung von [18F]FDG für die Schätzung von CMRGlc 5,14.
Dieses Protokoll befasst sich mit praktischen Fragen, die unserer Erfahrung nach für die erfolgreiche Messung des quantitativen Hirnstoffwechsels am wichtigsten sind. Dieses Protokoll enthält eine Beschreibung der wichtigsten Verfahren und Warnhinweise zur Vermeidung häufiger Fehler. Es wird eine sorgfältige Diskussion allgemeinerer Prinzipien des Stoffwechsels, der Neurowissenschaften, der Bildgebung, der Tracer-Kinetik und der Methoden der Inferenz aus der Radiotracer-PET-Bildgebung aufgeschoben. Die Zielgruppe umfasst sowohl Neulinge in der Stoffwechselmessung mit PET als auch erfahrenere PET-Forscher und Kliniker, die am Einsatz von 15-O-Radiotracern interessiert sind. Dieses Protokoll setzt die Vertrautheit mit bildgebenden Untersuchungen am Menschen, invasiven medizinischen Verfahren, Radiotracern und quantitativen Inferenzmethoden voraus. Es gibt zahlreiche, hervorragende Referenzen für die PET-Bildgebung des Gehirns im Allgemeinen18 und für 15O-Sauerstoff-PET im Besonderen19. Für [18F]FDG sowie für andere praktische Fragen der Durchführung von PET bietet das Turku PET Centre wertvolles Referenzmaterial sowie Links zur umfangreichen Primärforschungsliteratur20.
Die Protokollabschnitte beginnen mit relevanten Überlegungen zur Teilnehmerauswahl, die für die Einhaltung der Vorschriften und das erfolgreiche Scannen unerlässlich sind. Als nächstes skizziert das Protokoll Aspekte im Zusammenhang mit dem unterstützenden Scannen mit MRT für die Neuroanatomie. Als nächstes beschreibt das Protokoll klinische Laboraufträge, die Messungen enthalten, die für die Quantifizierung des Sauerstoff- und Glukosestoffwechsels wichtig sind. Als nächstes listet das Protokoll Fragen auf, die das Zyklotron und die Verabreichung von Radiopharmazeutika betreffen. Die Beschreibungen nehmen lediglich die Perspektive von Untersuchern ein, die am Behandlungsort in der Bildgebungseinrichtung arbeiten, und lassen Überlegungen aus, die an die Zyklotroneinrichtungen und das Personal erforderlich sind. Als nächstes beschreibt das Protokoll die Vorbereitung und Behandlung von arteriellen Zugängen. Die Einrichtung und Aufrechterhaltung von arteriellen Zugängen erfordert die Erfüllung institutionenspezifischer Compliance-Kriterien, und das Protokoll beschreibt erfolgreiche Arbeitsabläufe. Als nächstes enthält das Protokoll die wesentlichen Betriebsverfahren für das Scannen mit PET, einschließlich Details zur Positionierung der Teilnehmer, CT zur Dämpfungskorrektur, Verabreichung von Radiopharmazeutika und Durchführung arterieller Messungen. Bei der venösen Probenahme werden mögliche Alternativen zur arteriellen Probenahme bei Messungen der CMRGlc mit [18F]FDG diskutiert. Ein Abschnitt über PET-Bildrekonstruktion und Datenspeicherung beschreibt Softwareparameter und praktische Fragen der Informationstechnologie. Der Abschnitt über die Entlassung und die Nachverfolgung der Teilnehmer enthält wichtige Mitteilungen für die Sicherheit der Teilnehmer. Wichtige Kalibrieraktivitäten werden ebenfalls besprochen. Viele geeignete Analysemethoden und kinetische Modelle sind in veröffentlichten wissenschaftlichen Berichten und ihre zahlreichen Vorläufer gut beschrieben; Somit leitet dieses Protokoll den Leser weitgehend auf Verweise auf veröffentlichte Ansätze weiter. Repräsentative Ergebnisse verdeutlichen die erfolgreiche Implementierung von Protokollen. Der Diskussionsteil befasst sich mit vorteilhaften Aspekten und Grenzen des Protokolls, seinem Potenzial für die menschlichen Neurowissenschaften und Fragen der Sicherheit.
Protokoll
HINWEIS: Das Institutional Review Board und das Radioactive Drug Research Committee der Washington University School of Medicine genehmigten alle Studien, die auf dem unten beschriebenen Protokoll basieren. Alle menschlichen Teilnehmer gaben vor der Teilnahme an Forschungsstudien auf der Grundlage des untenstehenden Protokolls eine schriftliche Einverständniserklärung ab. In der Materialtabelle finden Sie Details zu allen Geräten, Materialien und Reagenzien, die in diesem Protokoll verwendet werden.
1. Auswahl der Teilnehmer
- Einschlusskriterien
- Es dürfen nur erwachsene Teilnehmer einbezogen werden. Stellen Sie sicher, dass die Teilnehmer die Studienverfahren befolgen können, einschließlich der Anweisungen für die Inhalation radiopharmazeutischer Gase, und dass sie in der Lage sind, eine Einwilligungserklärung nach Aufklärung zu erteilen oder eine entsprechende Ersatzeinwilligung zu erteilen. Stellen Sie sicher, dass die Teilnehmer sich bis zu 2-3 Stunden lang mit Pausen in Rückenlage und 60 Minuten lang ohne Pausen kontinuierlich einer Bildgebung unterziehen können.
- Ausschlusskriterien
- Ausschluss von Teilnehmern, die Kontraindikationen für die radioaktive Arzneimittelforschung haben, wie z. B. eine Schwangerschaft zum Zeitpunkt der PET. Schließen Sie Teilnehmer mit Kontraindikationen für die MRT aus, da die MRT für die anatomische Bildregistrierung, die räumliche Normalisierung und die partielle Volumenkorrektur erforderlich ist.
- Schließen Sie Teilnehmer mit einer Kontraindikation für eine Kanülierung der Arteria radialis aus, wenn eine Kanülierung der Arteria radialis durchgeführt werden soll. Ausschließen von Teilnehmern mit signifikanter Anämie oder die kürzlich Blutprodukte gespendet haben, da eine invasive arterielle Probenahme zu einem Gesamtblutvolumenverlust führt, der 100 ml überschreiten kann.
- Teilnehmer mit signifikanten Lungenerkrankungen sind auszuschließen, da ihre Fähigkeit, mit den gekennzeichneten [15O]O 2 und [15O]CO in der Lunge erfolgreich zu inhalieren und auszutauschen, beeinträchtigt sein kann. Schließen Sie Personen mit laufenden medizinischen Erkrankungen aus, die über die interessierenden hinausgehen und von denen erwartet wird, dass sie den Hirnstoffwechsel und den Blutfluss signifikant verändern.
HINWEIS: Dies hängt von den spezifischen Zielen und Vorgaben eines bestimmten Projekts ab, z. B. wenn sich das Projekt auf gesundes Altern konzentriert, können große Schlaganfälle oder Sichelzellenanämie zu den Ausschlusskriterien gehören. - Teilnehmer ausschließen, die vor der Verabreichung von [18F]FDG keinen Blutzuckerspiegel unter 165 mg/dl erreichen können.
2. MRT für die Neuroanatomie
- Planen Sie die MRT vor der PET-Untersuchung. Stellen Sie sicher, dass ein MRT-Protokoll für einen 3T-Scanner erstellt wird, das eine magnetisierungspräparierte MPRAGE-Pulssequenz (Rapid Gradient Echo) mit einer isotropen Auflösung von 0,8 bis 1,0 mm und idealerweise prospektive Methoden zur Bewegungskorrekturenthält 21.
HINWEIS: Die prospektive Bewegungskorrektur bietet eine zusätzliche Optimierung der T1w-Anatomie für die Verwendung bei der Fusion mit der PET-Bildgebung, aber es ist unwahrscheinlich, dass der Wegfall der prospektiven Bewegungskorrektur für die aktuelle PET-Bildgebung bei Teilnehmern, die sich an die Vermeidung von Kopfbewegungen halten, von großer Bedeutung ist. Eine hochwertige T1w-Anatomie ist für die partielle Volumenkorrektur von PET 22,23 von Bedeutung. - Erwerben Sie eine neuroanatomische MRT für regionale Parzellierungen und Segmentierungen, Atlasregistrierungen und partielle Volumenkorrekturen. Überprüfen Sie die erfolgreiche neuroanatomische MRT, bevor Sie einen Teilnehmer planen und invasiven arteriellen Zugängen und Radiopharmazeutika unterziehen.
3. Laboraufträge
- Bestellen Sie arterielle Blutgase, Hämoglobin, Hämatokrit und Plasmaglukose bei klinisch zertifizierten Labors. Bestellen Sie quantitatives Oxyhämoglobin, Carboxyhämoglobin und Methämoglobin für Raucher und Menschen mit Erkrankungen, die mit veränderten Hämoglobinen verbunden sind.
- Messen Sie die Pulsoximetrie mit validierten Geräten, z. B. solchen, die für die Intensivmedizin entwickelt wurden.
4. Lieferung von Radiopharmazeutika
HINWEIS: Die Messung des Sauerstoffstoffwechsels und der AG im Gehirn mit PET erfordert eine Zyklotronanlage, die in der Lage ist, 15O Radiopharmazeutika mit einer Halbwertszeit von 122 s herzustellen und zu liefern. Der Transport von Radiopharmazeutika zwischen der Zyklotronanlage und dem PET-Scanner muss ausreichend und zuverlässig schnell erfolgen, um zum Zeitpunkt der Radiotracer-Verabreichung eine angemessene Dosierung zu gewährleisten.
- Stellen Sie sicher, dass alle Radioaktivitätsdosiskalibratoren mit Strom versorgt werden, und lassen Sie Zeit für eine ausreichende Aufwärmphase des Instruments (in der Regel mindestens 60 Minuten).
- Positionieren Sie bei gasförmigen Radiopharmazeutika einen Schutzgasbehälter und den darin integrierten Piko-Amperemeter-Dosiskalibrator in der Nähe des PET-Portals des PET-Scanners. Gewährleisten Sie die sichere Befestigung von sterilisierten, erweiterbaren Faltenbälgen, Partikelfiltern, Kunststoff-Polymerschläuchen mit großem Durchmesser, Klemmen und Einweg-Mundstücken. Siehe Abbildung 1.
- Vollständige Qualitätssicherungsverfahren für Nylongasleitungen mit einem Innendurchmesser von 1/8 Zoll unter Abluft aus dem Zyklotron für die Abgabe von [15O]CO und [15O]O2. Vollständige Qualitätssicherung von gereinigten Wasserstoffquellen und Prozesseinheiten zur Erzeugung von radiopharmazeutischem [15O]H2O als Derivat von [15O]O2 für die anschließende Injektion. Siehe Abbildung 1.
5. Arterielle Leitungen
- Vermittlung und Management
- Kanülieren Sie die Arteria radialis in Absprache mit einem Arzt mit Fachausbildung für die routinemäßige Platzierung von arteriellen Zugängen, z. B. interventionelle Radiologie, Anästhesiologie oder Intensivmedizin.
- Stellen Sie ein Ultraschallgerät mit einer Sonde zur Verfügung, die für die Darstellung der Arteria radialis geeignet ist.
- Stellen Sie dem interventionellen Arzt seine bevorzugten Verbrauchsmaterialien für die Platzierung des arteriellen Zugangs zur Verfügung, in der Regel ein Kit mit einem Führungsdraht, der die Seldinger-Technik implementiert.
- Bemühen Sie sich, den Angiokatheter in die nicht dominante Hand des Teilnehmers einzuführen.
- Bewerten und betreuen Sie den Teilnehmer während der Kanülierung der Arteria radialis mit den Diensten einer erfahrenen Krankenschwester oder einer gleichwertigen medizinischen Fachkraft.
- Stellen Sie die arterielle Kollateralzirkulation der Hand durch Ultraschall sicher.
- Bereiten Sie das sterile Feld während der arteriellen Kanülierung vor und verwalten Sie es.
- Unterstützen Sie den interventionellen Arzt bei sterilen Kanülenverfahren.
- Entlüften Sie starre Druckleitungen und versorgen Sie normale Kochsalzlösung mit einem Druck von 300 mm Hg.
- Durchführung eines kontinuierlichen Managements der arteriellen Zuleitungen während des 2-3-stündigen Protokolls, einschließlich der routinemäßigen Überwachung der arteriellen Druckwellenformen und der Manipulation der arteriellen Zuleitungskreise. Für eine kontinuierliche arterielle Probenahme stellen Sie die Inline-Absperrhähne von der Versorgung der Arteria radialis auf die Extraktion von arteriellem Blut durch peristaltisches Pumpen auf das Spülen und den Aufrechterhalten des Zugangs zur Arteria radialis um. Bei der Grundierung von Liniensegmenten, die nie in die Arteria radialis fließen, spülen Sie sie mit heparinisierten Lösungen (bis zu 10 U/ml), um die Durchgängigkeit zu erhalten.
HINWEIS: Minimieren Sie die Verwendung von Heparin, wenn möglich, um den Katheter der Arteria radialis angesichts der unsicheren Beweise für seine Wirksamkeit zu erhalten und das Risiko einer Heparin-induzierten Thrombozytopenie zu vermeiden. - Verwenden Sie ein formbares, aber starres Armbrett, um den Katheter und die Leitungen der Arteria radialis zu sichern. Achten Sie darauf, dass wiederholte Manipulationen an den Absperrhähnen den Arteria radialis-Katheter nicht stören.
- Bestätigen Sie die normalen arteriellen Druckwellenformen vor jeder Radiotracer-Verabreichung, um die Durchgängigkeit des Arterienkatheters radialis sicherzustellen.
- Kanülieren Sie die Arteria radialis in Absprache mit einem Arzt mit Fachausbildung für die routinemäßige Platzierung von arteriellen Zugängen, z. B. interventionelle Radiologie, Anästhesiologie oder Intensivmedizin.
- Gamma-Detektoren für arterielle Proben
HINWEIS: Verwenden Sie eine Gamma-Detektionssonde und eine Peristaltikpumpe für die Messung der arteriellen Eingangsfunktion. Obwohl handgezogene Proben für [18F]FDG und andere Radiotracer mit längerer Halbwertszeit machbar sind, wird die Verwendung einer Sequenz von vier schnellen 15-O-Scans durch die automatisierte Probenahme unter Verwendung einer peristaltischen Pumpe und eines Gammadetektors, der kompakt genug ist, um neben der Hand des Teilnehmers platziert zu werden, erheblich erleichtert.- Positionieren Sie die arteriellen Leitungsanordnungen so nah wie möglich am Katheter der Arteria radialis, um Messungen mit minimaler Dispersion und Verzögerung an der Gamma-Detektionssonde durchzuführen. Stellen Sie sicher, dass der Pfad von der Kanülenstelle durch die Leitungsanordnungen zur Gamma-Detektionssonde mit den für die Leitungsanordnung verfügbaren Kalibrierdaten übereinstimmt.
- Liefern Sie kontinuierliche Stromversorgung durch eine unterbrechungsfreie Stromversorgung, um die Stabilität von Photomultipliern für Koinzidenz-Gamma-Detektoren zu gewährleisten. Verwenden Sie für die Koinzidenzerkennung Zeitfenster von 100 ns und stellen Sie sicher, dass die nominale Nachweisempfindlichkeit mindestens 2,4 cps kBq-1 mL-1 mit einer Linearität von <1 % über 10 kcps beträgt.
HINWEIS: Mit Flüssigkeit gefüllte Wellenleiter für die Koinzidenzerkennung sind zerbrechlich und erfordern Vorsicht bei der Handhabung und beim Transport von den Lagerbereichen zur PET-Suite.
6. Scannen
- Minimieren Sie Kopfbewegungen
- Klären Sie den Teilnehmer vor dem Scannen darüber auf, wie wichtig es ist, Kopfbewegungen während des Scannens zu vermeiden.
- Positionierung der Studienteilnehmer
- Stellen Sie sicher, dass die PET-CT-Hardware- und Softwarekonfigurationen das Scannen mit dem Kopf voran oder mit den Füßen voran des Studienteilnehmers ermöglichen. Wann immer möglich, bevorzugen Sie bei PET eine Positionierung mit den Füßen vorab, so dass die Extremitäten und der Rumpf des Teilnehmers außerhalb der PET-Gantry liegen, der Kopf des Teilnehmers in der PET-Gantry zentriert bleibt und die CT-Gantry unbesetzt bleibt (Abbildung 1).
- Führen und positionieren Sie den Teilnehmer so, dass er auf dem abgesenkten Gantry-Tisch liegt, in Übereinstimmung mit allen bereits vorhandenen Protokollen für PET-CT-Scans beim Menschen, wie z. B. das Sicherstellen einer kürzlichen Harnentleerung, das Tragen geeigneter Kleidung und das Entfernen von Brillen, Schmuck oder Haarschmuck, die mit dem Scanner nicht kompatibel sind.
- Stellen Sie sicher, dass alle arteriellen und venösen Zugänge unversehrt sind, während sich der Gantry-Tisch in die Scannerbohrung bewegt. Sicherstellung einer kontinuierlichen Verbindung der arteriellen Leitungen mit unter Druck stehenden Kochsalzquellen. Stellen Sie sicher, dass Peristaltikpumpen, Gamma-Detektionssonden und alle anderen Geräte, die nicht durch die Scannerbohrung gelangen können, abgeschaltet und anschließend wieder angeschlossen werden.
- Sorgen Sie für den Komfort des Teilnehmers, insbesondere für die Positionierung von Kopf, Nacken, Wirbelsäule, Hüfte und Beinbeugung. Sorgen Sie für eine bequeme Kopfpositionierung bei frei positionierbaren Schaumstoffkopfstützen und befestigen Sie dann die Stirn des Teilnehmers mit einer elastischen, selbstklebenden, selbstabnehmbaren Umwicklung auf dem Portaltisch, um den Teilnehmer daran zu erinnern, Kopfbewegungen zu vermeiden. Sorgen Sie für ausreichend Decken für thermischen Komfort. Bestätigen Sie, dass der Teilnehmer verstanden hat, dass es notwendig ist, Kopfbewegungen während des gesamten CT- und PET-Scans zu vermeiden.
HINWEIS: Die Kopfstützen und die elastische Umhüllung schränken die Kopfbewegung auch bei kognitiv beeinträchtigten Teilnehmern erheblich ein. - Stellen Sie sicher, dass der Gantry-Tisch durch die Scannerbohrung geführt wird, bis die Extremitäten und der Rumpf des Teilnehmers außerhalb der CT-Gantry liegen und der Kopf des Teilnehmers in der CT-Gantry zentriert ist. Richten Sie die Kanthomeatallinie des Teilnehmers beim Eintritt in die CT-Gantry mit vertikalen Lasermarkierern aus und winkeln Sie dann das Kinn leicht nach unten an. Führen Sie die CT wie unten beschrieben durch. Bestätigen Sie auf der CT, dass diese Positionierung das gesamte Großhirn und Kleinhirn innerhalb des PET-Sichtfelds erfasst.
- Stellen Sie sicher, dass der Gantry-Tisch durch die Scannerbohrung geführt wird, bis der Kopf des Teilnehmers in der PET-Gantry zentriert ist. Stellen Sie einen angemessenen Zugang zu den arteriellen und venösen Leitungen sowie eine angemessene Streckung des Handgelenks sicher, um die Kanüle der Arteria radialis aufzunehmen. Stellen Sie sicher, dass Deckenabluftöffnungen versehentlich ausgeatmete Radiotracergase in der Nähe des Randes des PET-Portals effektiv entfernen können. Führen Sie CT und PET wie unten in den Schritten 6.3-6.5 beschrieben durch.
- Überwachen Sie den Teilnehmer routinemäßig während der PET und beurteilen Sie den Komfort des Teilnehmers mit minimaler verbaler Kommunikation während des Scans.
HINWEIS: Die Positionierung mit den Füßen voran erleichtert die Verabreichung von Radiotracergasen mit verbesserter Kommunikation und verbesserter Manipulation des Inhalationsschlauchs. Bei den meisten Portaltischen kann die Positionierung mit den Füßen voran jedoch nicht mit der Verwendung von thermoplastischen Kopfhaltemasken vereinbar sein. Die Positionierung mit den Füßen voran kann auch nicht mit Geräten kompatibel sein, die den Kopf vor Emissionen schützen, die vom Körper ausgehen, der dem Kopf untergeordnet ist. Solche Schilde können andernfalls Zufallsereignisse reduzieren, die vom Körper ausgehen.
- CT zur Dämpfungskorrektur
- Besorgen Sie sich ein CT mit niedrigem Strahlendosiskopf, das für die Dämpfungskorrektur geeignet ist. Wenn der Teilnehmer während des Scanvorgangs eine Pause einlegt und den Scanner verlässt, wiederholen Sie den CT-Scan, bevor Sie die PET-Sitzung fortsetzen, um eine konsolenbasierte Rekonstruktion der nachfolgenden PET-Bildgebung zu ermöglichen. Zu den nützlichen CT-Parametern gehören ein Röhrenstrom von 75 mA, eine Rotationszeit von 0,5 s, eine Spiralsteigung von 1,5 und eine Röhrenspannung von 120 kVp mit den vom Hersteller empfohlenen Faltungskernen und der Rekonstruktion auf eine Auflösung von 512 x 512 x 88 mm,eine Auflösung von 0,98 x 0,98 x 3,00 mm .
- Verabreichung von gasförmigen Radiopharmazeutika
- Weisen Sie die Teilnehmer vor der ersten Gasverabreichung in das Verfahren der Inhalation ein, wobei der Schwerpunkt auf dem Ein- und Ausatmen durch den Schlauch liegt und nicht auf dem Atmen durch die Nase.
- Bereiten Sie den Schutzgasbehälter vor, der mit einem Pico-Amperemeter-Dosiskalibrator ausgestattet ist. Verbinden Sie den expandierbaren Faltenbalg innerhalb des Gasbehälters mit der starren Nylonleitung mit schmalem Durchmesser vom Zyklotron sowie an ein halbstarres Polymerrohr aus Kunststoff mit großem Durchmesser, das außer während der Verabreichung festgeklemmt bleibt. Platzieren Sie einen Partikelfilter zum Einfangen von Viren in einer Linie mit dem Rohr mit großem Durchmesser gemäß den für die Covid-19-Pandemie formulierten Anforderungen zur Infektionskontrolle. Befestigen Sie ein Einweg-Mundstück aus Kunststoff am Ende des Schlauchs.
- Fordern Sie die Zyklotronanlage auf, gasförmige Radiopharmazeutika in den Gasbehälter zu liefern.
- Bereiten Sie sich auf die Verabreichung aller gasförmigen Radiopharmaka als Boli vor. Das Verfahren zur Inhalation ist in allen Fällen identisch.
- Überwachen Sie die Aktivität jedes Gases, das an den expandierbaren Faltenbalg abgegeben wird, bis zur Spitzenaktivität und warten Sie dann, bis die Aktivität unter die vom Radioactive Drug Research Committee zugelassene Höchstdosis (55 mCi) fällt. Überwachen Sie die Aktivitäten mit Pico-Amperemeter-Dosiskalibratoren. Initiieren Sie die Erfassung der Emissionen durch den Scanner.
- Beginnen Sie mit dem Scannen unmittelbar vor Beginn der Inhalation, um sicherzustellen, dass der Beginn der Zeitaktivitätskurve erfasst wird. Erzielen Sie 6-7 Minuten Emissionen mit 3 s Frames x 23, 5 s Frames x 6, 10 s Frames x 20 und dann 30 s Frames für den Rest des Scans.
- Weisen Sie den Teilnehmer an, vollständig auszuatmen und die Maske des Teilnehmers zu senken.
- Legen Sie das Mundstück in den Mund des Teilnehmers. Bitten Sie den Teilnehmer, mit den Lippen einen dichten Verschluss um das Mundstück zu bilden und dann so viel wie möglich einzuatmen. Bitten Sie den Teilnehmer, einige Sekunden lang den Atem anzuhalten, damit die Lungen das gasförmige Radiopharmakon leichter aufnehmen können.
- Bitten Sie den Teilnehmer, erneut durch den Schlauch auszuatmen und das restliche gasförmige Radiopharmakon in den Blasebalg zurückzublasen. Klemmen Sie das Rohr wieder ein und holen Sie es vom Teilnehmer heraus.
- Überwachen Sie die Gasaktivität im Faltenbalg vom Beginn der Einatmung bis zum Ende der Ausatmung. Berechnen Sie die verabreichte Gesamtdosis anhand der Differenz der Aktivitäten. Streben Sie an, dass die verabreichte Gesamtdosis 20 mCi überschreitet.
- Verabreichen Sie eine Dosis [15O]CO. Überwachen Sie die arteriellen Messungen auf nominale Zeitaktivitätskurven. Wenn arterielle Messungen technisch unzureichend sind, ist eine Ersatzdosis von [15O]CO zu verabreichen. Lassen Sie intravaskuläres [15O]CO in einen stabilen Zustand versetzen, was etwa 1-2 Minuten dauert17.
- Verabreichen Sie zwei aufeinanderfolgende Dosen von [15O]O2. Überwachen Sie arterielle Messungen auf nominale Zeitaktivitätskurven.
HINWEIS: Dieses Verfahren ist auch bei leicht kognitiv beeinträchtigten Teilnehmern robust. Teilnehmer, die aufgrund schwerer kognitiver Beeinträchtigungen oder Gesichtsschwäche nicht in der Lage sind, dieses Verfahren durchzuführen, werden jedoch ausgeschlossen, um das Risiko einer unzureichenden Verabreichung von Radiotracern und des Austretens von Gas in die Umgebungsluft während der Ausatmung zu minimieren. Für die kontinuierliche Verabreichung und Verwendung von Masken zum Abfangen gasförmiger Radiotracer konsultieren Sie alternative Methoden, über die von Iguchi et al. berichtet und auf die verwiesen wird.24 Die Wiederholung der Dosierung von [15O]O2 in doppelter Ausführung wird aufgrund der niedrigeren Signal-Rausch-Verhältnisse (ungünstige Rauschäquivalentzahlen) empfohlen, die typischerweise mit [15O]O2 erzielt werden.
- Verabreichung von injizierten Radiopharmaka
- Fordern Sie an, dass die Zyklotronanlage intravenöse Radiopharmazeutika an den Scannerschacht liefert.
- Bereiten Sie sich darauf vor, alle intravenösen Radiopharmaka als Boli zu verabreichen. Das Verfahren zur intravenösen Injektion ist in allen Fällen ähnlich.
- Überwachen Sie die Dosis in einem Brunnendosimeter, bis sie unter den maximal zulässigen Wert fällt (25 mCi für [15O]H,2O und 6 mCi für [18F]FDG).
- Beginnen Sie mit dem Scannen unmittelbar vor der intravenösen Injektion, um sicherzustellen, dass der Beginn der Zeitaktivitätskurve erfasst wird. Für [15O]H2O erhalten Sie 6-7 min Emissionen mit 3 s Frames x 23, 5 s Frames x 6, 10 s Frames x 20 und dann 30 s Frames für den Rest des Scans. Für [18F]FDG erhalten Sie 60 min Emissionen mit 3 s Frames x 23, 5 s Frames x 24, 20 s Frames x 9, 60 s Frames x 13, 300 s Frames x 7 und einem 351 s Frame x 1.
- Injizieren Sie sofort die intravenöse Dosis. Messen Sie die Restradioaktivität in der Spritze, um die verabreichte Dosis anhand von Differenzen zu berechnen. Stellen Sie sicher, dass die verabreichte Gesamtdosis nicht unter der zulässigen Mindestdosis liegt (15 mCi für [15O]H,2O und 4 mCi für [18F]FDG).
- Überwachen Sie arterielle Messungen auf nominale Zeitaktivitätskurven. Bei [15O]H2O, wenn die arteriellen Messungen technisch unzureichend sind, ist eine Ersatzdosis zu verabreichen.
HINWEIS: Die Verabreichung von [15O]H2O ist in mancher Hinsicht einfacher als die Verabreichung von Gasen, da erstere intravenös injiziert werden können. Aufgrund der kurzen Halbwertszeit von [15O]H2O erfordert dies jedoch immer noch eine sorgfältige Orchestrierung, abhängig vom Standort des PET-Scanners und davon, wo [15O]H2O hergestellt und gewonnen wird.
7. Arterielle Messungen
- Nachdem Sie den Studienteilnehmer in den Scanner positioniert haben, bereiten Sie alle Geräte vor, die für die arterielle Messung der radiopharmazeutischen Aktivitäten benötigt werden.
- Stellen Sie die Unversehrtheit der Verbindungen zwischen dem Angiokather der Arteria radialis, starren Druckleitungen, Absperrhähnen, einem Druckbeutel für die Versorgung mit normaler Kochsalzlösung, Verlängerungskatheter-Sets für Gamma-Detektoren und Verlängerungskatheter-Sets für Peristaltikpumpen sicher. Achten Sie auf eine korrekte Grundierung, damit keine Luftblasen in die Arteria radialis eingeführt werden können und dass keine Luftblasen das peristaltische Pumpen zur Entnahme von arteriellem Blut beeinträchtigen.
- Verwenden Sie für den Gamma-Detektor Microbore-Katheter-Verlängerungssets mit einer Länge von nicht mehr als 48 cm und einem Priming-Volumen von nicht mehr als 0,6 mL.
- Stellen Sie für die Schlauchpumpe die maximal zulässige Okklusionsdruckgrenze ein.
- Wenn es sich bei der Peristaltikpumpe um eine Infusionspumpe handelt, die mit umgekehrter Durchflussrichtung arbeitet, wählen Sie die minimale Durchflussrate, um das Gefäß offen zu halten (KVO).
- Stellen Sie die Unversehrtheit der Verbindungen zwischen dem Angiokather der Arteria radialis, starren Druckleitungen, Absperrhähnen, einem Druckbeutel für die Versorgung mit normaler Kochsalzlösung, Verlängerungskatheter-Sets für Gamma-Detektoren und Verlängerungskatheter-Sets für Peristaltikpumpen sicher. Achten Sie auf eine korrekte Grundierung, damit keine Luftblasen in die Arteria radialis eingeführt werden können und dass keine Luftblasen das peristaltische Pumpen zur Entnahme von arteriellem Blut beeinträchtigen.
- Schließen Sie unmittelbar vor der Verabreichung von Radiopharmaka den Absperrhahn zum Druckbeutel und zum Druckwächter und betreiben Sie die Pumpe mit 300 mL/h. Bestätigen Sie die Entnahme von Blut aus der Arteria radialis und dessen Passage durch Verlängerungskathetersätze für Gammadetektoren und Verlängerungskathetersätze für die Pumpe. Bestätigung der kontinuierlichen Messungen der radiopharmazeutischen Aktivität in den Gammadetektoren während des Bolusdurchgangs von Radiopharmazeutika durch den arteriellen Kreislauf25.
- Überprüfen Sie die gleichzeitige Erfassung von Zeitaktivitätskurven vom PET-Scanner.
- Pumpen Sie weiter bei 300 mL/h und überprüfen Sie die Messungen der radiopharmazeutischen Aktivität in den Gammadetektoren für mindestens 300 s nach der Inhalation von [15O]CO, 120 s nach der Inhalation von [15O]O2, 120 s nach der Injektion von [15O]H2O und 300 s nach der Injektion von [18F]FDG.
- Bei [18F]FDG ist das Blutpumpen mit reduzierten Pumpraten von nicht weniger als 20 mL/h bis zum Ende des PET-Scans fortzusetzen.
- Nach jeder arteriellen Messung konfigurieren Sie die arteriellen Leitungen neu, um den Katheter der Arteria radialis zu spülen. Spülen Sie dann den Leitungskreis, der die Gamma-Detektoren und die Pumpe versorgt. Stellen Sie für den isolierten Kreislauf durch die Pumpe die Pumpleistung auf 300 mL/h ein. Optional können Sie einen zweiten Beutel mit heparinisierter Kochsalzlösung unter Schwerkraft verwenden, um zusätzliche Flüsse für die Entfernung des Blutes aus der Pumpe bereitzustellen.
HINWEIS: Aufgrund des langwierigen Bildgebungsprotokolls und der wiederholten Probenahme des arteriellen Blutes kann das Risiko eines Leitungsverschlusses hoch sein und erfordert eine ständige Wachsamkeit durch das Prüfarztteam und das Pflegepersonal. Verwenden Sie strenge Sterilitätsmaßnahmen und halten Sie einen geschlossenen Kreislauf aufrecht, der nur durch Absperrhähne konfiguriert wird.
8. Venöse Probenahme
- Legen Sie vor der Untersuchung zwei Stellen für den intravenösen Zugang fest: kontralateral zur Kanüle der Arteria radialis für die radiopharmazeutische Injektion und die Kanülierung von ipsilateral zu radialis für die venöse Probenahme. Bevorzugen Sie einen antekubitalen Zugang.
- Bereiten Sie vor dem Scannen Spritzen und Spritzenverschlüsse vor. Markieren Sie Spritzen und Kappen unauslöschlich, verschließen Sie alle Spritzen und wiegen Sie verschlossene Spritzen mit einer analytischen Waage mit einer Genauigkeit von 0,0001 g. Rekordzeiten für die venöse Probenahme zu Beginn und Abschluss der Entnahme von mindestens 2 ml Blut. Bei Raumtemperatur (20-25 °C) wird 1 ml Blut bei einer RCF von 3.300 × g mindestens 60 s lang zentrifugiert, um Plasma zu extrahieren. Zählen Sie die Aktivitäten in Vollblut und Plasma mit einem für 68 Ge kalibrierten Vertiefungszähler.
HINWEIS: Die venöse Probenahme ist am besten geeignet für Messungen von [18F]FDG 30-60 min nach der Injektion. Venöse Proben, die während der 15-O-Untersuchung gewonnen werden, sind technisch sehr anspruchsvoll und schwer zu kontrollieren und korrelieren nicht gut mit arteriellen Proben.
9. PET-Bildrekonstruktion und Datenspeicherung
- Rekonstruktion von Bildern aus dem PET-CT unter Berücksichtigung von 3D-gewöhnlichen Poisson-geordneten Teilmengen der Erwartungsmaximierung (OSEM) mit 4-8 Iterationen von fünf Teilmengen, TOF, verzögerten Randoms, modellbasierter absoluter Streuskalierung, Dämpfungskorrektur, Allpass-Filterung (keine Filterung), ohne Punkt-Spread-Funktionsmodelle, Abklingkorrektur bis zum Beginn des Scannings, Neuskalierung auf Bq mL-1, Matrixgröße von 220, Zoom 2 und isotrope Voxel von 1,65 mm Länge.
HINWEIS: Zoom 2 reduziert das transversale Sichtfeld der Bildrekonstruktion um die Hälfte, wodurch der Umgebungsraum zwischen dem Kopf des Teilnehmers und den PET-Detektorringen ignoriert wird. Bei den angegebenen Parametern handelt es sich um Startwerte für [15O]O2-Gas , das sehr anfällig für Streuvariabilität ist und eine modellbasierte absolute Streuskalierung erfordert. Historisch gesehen hat die Wahl der Streumodelle die Qualität der Rekonstruktion von 15O-Tracern stark beeinflusst. Darüber hinaus sind die Wechselwirkungen von herstellerimplementierten Streumodellen mit anderen Modellen, wie z. B. Punkt-Spread-Funktionsmodellen, derzeit nur unzureichend verstanden. Folglich implementiert dieses Protokoll nur Streumodelle ohne Punkt-Spread-Modelle. - Überprüfen Sie rekonstruierte PET-Daten auf der Scannerkonsole, um eine angemessene Radiotracer-Verabreichung und minimale Bewegungen zu gewährleisten.
- Speichern Sie DICOM-Dateien für rekonstruiertes PET, CT, Normdaten und Listmode-Daten.
HINWEIS: Listmode-Daten sind für optimierte Rekonstruktionen unerlässlich, die rechenintensiv sind und in der Regel nicht an der Scannerkonsole durchgeführt werden können. Die Listmode-Daten sind sehr groß (>40 GB pro PET-Sitzung) und es müssen geeignete Speichermedien reserviert werden.
- Speichern Sie DICOM-Dateien für rekonstruiertes PET, CT, Normdaten und Listmode-Daten.
10. Entlassung und Nachsorge der Teilnehmer
- Entfernen von Linien
- Entfernen Sie den arteriellen Radialkatheter in steriler Technik und üben Sie manuell direkten Druck auf die Arteria radialis aus (dies sollte von einem qualifizierten Arzt durchgeführt werden).
- Üben Sie 15 Minuten lang Druck mit der patentierten Hämostase-Technik aus, um das Risiko eines Verschlusses der Arteria radialis zu minimieren.
- Untersuchen Sie die Katheterspitze auf Gerinnsel oder Brüche.
- Nachdem Sie sich vergewissert haben, dass eine ausreichende Blutstillung erreicht wurde, legen Sie einen Druckverband mit steriler Gaze und einer elastischen selbstklebenden Umhüllung an. Untersuchen Sie die Hand auf Veränderungen in Farbe, Temperatur, Empfindung oder Funktion.
- Anweisungen zur häuslichen Pflege
- Weisen Sie die Teilnehmer an, nach der Entlassung 2 Stunden lang Druckverbände aufrechtzuerhalten.
- Weisen Sie die Teilnehmer an, die Kanülenstelle nach 2 Stunden auf Blutungen oder Blutergüsse zu untersuchen und dann einen rezeptfreien Verband anzulegen.
- Weisen Sie die Teilnehmer an, das betroffene Handgelenk/den betroffenen Arm 24 Stunden lang nicht zu beugen oder zu benetzen und anstrengende Aktivitäten mit dem Handgelenk/Arm für 48 Stunden zu vermeiden.
- Weisen Sie die Teilnehmer an, ihr betroffenes Handgelenk/Arm während der 48 Stunden nach der Entlassung auf Anzeichen von Infektionen, Verletzungen oder Blutungen zu untersuchen.
- Geben Sie bei Bedarf mehrere Methoden zur Kontaktaufnahme mit dem Studienteam an.
- Bieten Sie Sicherheit für die häufigen Komplikationen von leichten Blutergüssen und vorübergehenden Beschwerden.
- Kontaktieren Sie den Studienteilnehmer 24-48 h nach der Entlassung, um sicherzustellen, dass keine zusätzlichen Komplikationen aufgetreten sind.
- Weisen Sie die Teilnehmer an, nach der Entlassung 2 Stunden lang Druckverbände aufrechtzuerhalten.
11. Kalibrierungen
- Kreuz-Kalibrierung
- Verwenden Sie Stabreferenzquellen von 68Ge oder 22Na für die absolute Kalibrierung von Bohrlochzählern.
- Danach wird eine Kreuzkalibrierung unter Verwendung von Lösungen von 10-37 MBq [18F]FDG in 30-670 ml Wasser mit 2 % Acetonitril oder einem ähnlichen organischen Lösungsmittel durchgeführt. Verwenden Sie Flaschen mit starren Medien (Polyethylenterephthalat oder Polyethylen hoher Dichte), die eine Radioaktivitätseindämmung mit vernachlässigbarer Gammadämpfung bieten. Verwenden Sie Flaschen mit kleinerem Volumen, um weniger Aktivität für die Kreuzkalibrierung in der Scannerbohrung unterzubringen. Kreuzkalibrieren Sie alle anderen Gamma-Detektionsinstrumente mit Aliquoten, die aus der Flasche entnommen werden.
- Katheter-Kalibrierung
- Durchführung von Kalibrierungsstudien der Dispersion und Verzögerung, die sich aus der Verwendung von Kathetern und Leitungen zwischen der Arteria radialis und der Gamma-Detektionssonde ergeben.
- Verwenden Sie abgelaufene Blutprodukte aus der örtlichen Blutbank, ein kontrolliertes Temperaturbad und eine kontrollierte Variation des Hämatokrits von Blutprodukten.
- Montieren Sie kompartimentelle Geräte, um schnell zwischen unmarkierten und [18F]FDG-markierten Blutprodukten zu wechseln, die der Montage von Kathetern, Leitungen, Gammadetektorsonde und Peristaltikpumpe zugeführt werden. Liefern Sie Heaviside-Eingänge mit "Stufenfunktion" an die Baugruppe und messen Sie die Radioaktivität im Zeitverlauf.
- Schätzen Sie den Faltungskern für Dispersion und Verzögerung. Parametrisieren Sie die Kerne, um mit Hämatokrit zu variieren. Führen Sie alle Kalibrierungen mit der Quelle der Blutprodukte bei 37 °C durch. Verwenden Sie den Kernel für alle Humanstudien, in denen die identische Assemblierung verwendet wird.
HINWEIS: Diese Kalibrierungen berücksichtigen nur die Dispersion und Verzögerung durch externe Leitungsbaugruppen, nicht die interne Anatomie.
- Durchführung von Kalibrierungsstudien der Dispersion und Verzögerung, die sich aus der Verwendung von Kathetern und Leitungen zwischen der Arteria radialis und der Gamma-Detektionssonde ergeben.
Ergebnisse
Zu den technisch anspruchsvollsten Aspekten dieses Protokolls gehören die Konfiguration, Verwaltung und erfolgreiche Erfassung von Daten von arteriellen Leitungen bei gleichzeitiger Verabreichung von Radiotracern mit kurzer Halbwertszeit und dem Betrieb des Scanners. Abbildung 1 zeigt eine Vogelperspektive des aktuellen Setups, die die Organisation und die betrieblichen Arbeitsabläufe zusammenfasst, die von Studienkoordinatoren, Interventionalisten, Pflegekräften, Technologen und Prüfärzten verlangt werden. Die oben beschriebenen Radiopharmazeutika lassen sich leicht in nicht-quantitative Karten spezifischer Aktivitäten einbeziehen (Abbildung 2), einschließlich der Berechnung von Verhältnissen des standardisierten Aufnahmewerts (SUVR). Zeitaktivitätskurven des gesamten Gehirns (Abbildung 3) helfen bei der Identifizierung signifikanter Kopfbewegungen, die zu Diskontinuitäten der Aktivitätskurve führen würden, und liefern charakteristische Merkmale von Tracern nach der Zerfallskorrektur, wie z. B. das erwartete Plateau von [15O]CO bei 120 s und die daraus resultierende renale Ausscheidung, das Plateau von [15O]O2 nach der Boluspassage, wie es vom Hirngewebe extrahiert und zu radioaktiv markierten [15O]H2 metabolisiert wirdO, die monotone Abnahme von injiziertem [15O]H2O mit zunehmendem Verteilungsvolumen im Körper und die fortschreitende Aufnahme und Phosphorylierung von [18F]FDG über Hexokinase im Gehirn über die Lebensdauer von 18F. Detaillierte Modellschätzungen von metabolischem [15O]H2O wurden ursprünglich von Mintun et al.beschrieben 15.
Eine einfachere polynomiale Phänomenologie, die Überlegungen zu intravaskulären Dispersionen auslässt und robuste Merkmale in den Emissionsdaten betont, wurde von Herscovitch et al.befürwortet 26,27. Die Beispiele dieser Arbeit nutzen nur diese letztere Phänomenologie für den Sauerstoffstoffwechsel. Die arteriellen Eingangsfunktionen, die durch Gammadetektion von Kathetern aufgezeichnet werden, die die distale Arteria radialis kanülieren, weisen eine erhebliche Dispersion und Verzögerung auf, die dekonvolviert werden müssen. Wir haben Bayes'sche Methoden zur Parameterschätzung von Modellen von Reihen von Gammaverteilungen und exponentiell steigenden stetigen Termen bevorzugt28. Abbildung 4 zeigt die Ergebnisse für [15O]CO, [15O]O2, [15O]H2O und [18F]FDG. Die Ergebnisse für [15O]O2 verdeutlichen auch die Entstehung von [15O]H2O des Stoffwechsels. Abbildung 5 zeigt statistische Parameterkarten von CBV, CBF, CMRO2, CMRGlc und AG, die wir als molare Balance der klassischen Glykolyse definieren: CMRGlc - CMRO2/6.

Abbildung 1: Zusammenfassung der Setup- und Betriebsabläufe. (A) Schematische Darstellung der wichtigsten Instrumente und Teile, die im Scannerschacht benötigt werden. Bei PET-CT-Scannern mit langen Scannerbohrungen verbessert die Positionierung der Teilnehmer mit den Füßen voran die Verabreichung von gasförmigen Radiopharmaka, indem die Manövrierfähigkeit der Gasabgabegeräte erhöht und die verbale und nonverbale Kommunikation mit dem Teilnehmer verbessert wird. Das Gasversorgungssystem (cyan und blau) besteht aus Nylonschläuchen mit schmalem Durchmesser, die vom Zyklotron unter dem Abgas für den Transport gasförmiger Radiopharmazeutika entstehen. eine Schutzgasspeicherkammer mit einem erweiterbaren Faltenbalg und einem Pico-Amperemeter-Dosiskalibrator; einen Partikelfilter, der zum Auffangen von Viruspartikeln geeignet ist; und ein Anschluss aus Kunststoff-Polymer-Schlauch mit großem Durchmesser, der mit einer Klemme und einem Kunststoffmundstück ausgestattet ist. Alle Teile, die Atemtröpfchen ausgesetzt sind, sind Einwegteile oder mit Sterilisationsverfahren kompatibel. Instrumente und Teile für arterielle Blutmessungen (rot und dunkelgrau) bieten eine Druckkochsalzlösung zur Aufrechterhaltung der Kanüle der Arteria radialis, eine kompakte Gamma-Detektion für das Zusammentreffen von 511 keV-Annihilationsphotonen, eine peristaltische Pumpe für die arterielle Blutentnahme und einen Behälter für die Entnahme von entnommenem Blut. Radiopharmazeutika für die intravenöse Injektion erfordern Synthesemodule zur Erzeugung von [15O]H2 O ausZyklotrongas [15O]O2 oder Rohrpost aus der Zyklotron-Radiopharmazie (grün). Die intravenöse Verabreichung von Radiopharmaka erfordert eine Dosimetrie in klinischer Qualität (Magenta). Für Messungen der Aktivität im Vollblut und Plasma sind ein Brunnenzähler, eine Analysenwaage und eine Mikrozentrifuge (rot) erforderlich. (B) Kommentierte und detaillierte Ansichten des Gasversorgungssystems. Abkürzung: PET-CT = Positronen-Emissions-Tomographie-Computertomographie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Repräsentative statische Bilder für [15O]CO, [15O]O2, [15O]H2O und [18F]FDG, überlagert mit ~25 % Transparenz auf CT mit Fenstern für Schläfenbein. Scans von 15O Radiotracern positionierten den Teilnehmer mit den Füßen voran, wobei der Kopf nur mit einer elastischen, selbstklebenden Umhüllung am Gantry-Tisch befestigt war. Der Scan von [18F]FDG folgte auf eine Pause vom Scannen und brachte den Teilnehmer dann ungefähr in die ursprüngliche Position mit den Füßen voran zurück. Abkürzungen: CO = Kohlenmonoxid; FDG = Fludesoxyglukose; CT = Computertomographie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
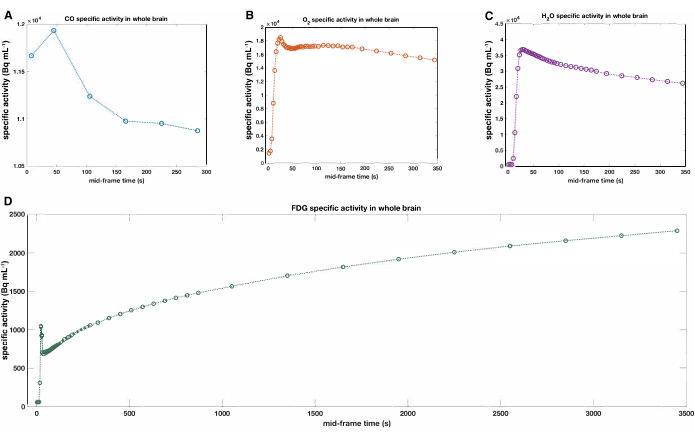
Abbildung 3: Repräsentative Tracer-Aktivitätskurven des gesamten Gehirns. (A) [15O]CO, (B) [15O]O2, (C) [15O]H2O und (D) [18F]FDG. Das gesamte Gehirn wurde durch Maskierung von anatomischem MPRAGE definiert. Die Ankunft eines Bolus aus verabreichtem Tracer geht dem Zeitpunkt der ersten PET-Rahmen in den Panels A und B voraus oder fällt mit ihm zusammen. Abkürzungen: CO = Kohlenmonoxid; FDG = Fludesoxyglukose; PET = Positronen-Emissions-Tomographie; MPRAGE = magnetisierungsvorbereitetes Gradientenecho mit schneller Erfassung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Repräsentative Tracer-Aktivitätskurven, kontinuierlich aus der Arteria radialis entnommen und Dekonvolutionen von Dispersionen und Verzögerungen in Linienanordnungen. Beispiele beschreiben (A) [15O]CO, (B) [15O]O2, (C) [15O]H2O und (D) [18F]FDG. Blaue Kreise sind Daten, die von einer Koinzidenzdetektionssonde gemessen werden, die einen eng geschlungenen Katheter umgibt, der arterielles Blut durchlässt. Die Koinzidenzzählung von der Sonde umfasst die Basislinienszintillation von LYSO-Kristallen, die auf Umgebungsphotonen reagieren (Breitspektrum-Randoms, die innerhalb des Zeitfensters des Geräts von 100 ns liegen). Arterielles Blut fließt von der Arteria radialis durch die Sonde durch die distale Wirkung einer peristaltischen Pumpe. Die violette gestrichelte Linie ist die empirische Schätzung des Kernels für Dispersion und Verzögerung, die in Protokollabschnitt 11.2 beschrieben ist. Die gelbe Linie beschreibt die um Dispersion und Verzögerung korrigierte Traceraktivitätskurve. Simuliertes Abkühlen schätzt Parameter einer verallgemeinerten Gammaverteilung für die gelbe Linie, die mit dem geschätzten Kern und den Daten aus der Koinzidenzerkennung übereinstimmt. Die angepassten Daten werden als rote Linie angezeigt. Panel (B) zeigt auch [15O]H2O aus dem Metabolismus von [15O]O2 an, von dem angenommen wird, dass es lineare Eigenschaften aufweist, die von Mintun et al. beschrieben wurden.15. Abkürzungen: CO = Kohlenmonoxid; FDG = Fludesoxyglukose; PET = Positronen-Emissions-Tomographie; LYSO = Lutetium-Yttrium-Oxyorthosilikat. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Karten von CBV, CBF, CMRO2, CMRGlc und AG. CBV ist für die quantitative Abschätzung von CMRO2, CMRGlc und AG erforderlich. Die Aktivität der venösen Nasennebenhöhlen ist jedoch für CMRGlc und AG verwirrend. Folglich wurden die venösen Nasennebenhöhlen aus CMRO2 und CMRGlc durch Maskierung entfernt. Der Kontrast zwischen dem Kleinhirn und dem Neokortex stimmt mit früheren Studien über AG überein. Abkürzungen: CBV = zerebrales Blutvolumen; CBF = zerebraler Blutfluss; CMRO2 = zerebraler Stoffwechsel von Sauerstoff; CMRGlc = zerebraler Stoffwechsel von Glukose; AG = aerobe Glykolyse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
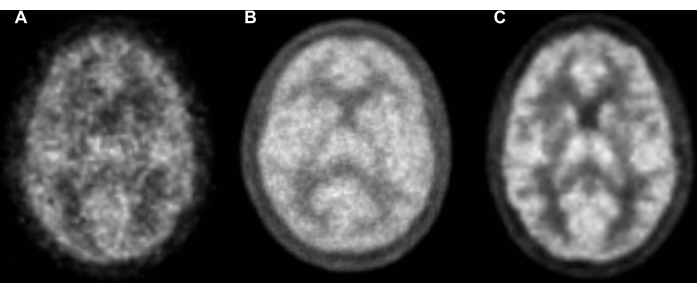
Abbildung 6: Beispiele für statische Emissionen von [15O]H2O von gesunden Kontrollstudienteilnehmern, die auf drei Generationen von PET-Scannern gescannt wurden. Alle Rekonstruktionen verwendeten 3D OP-OSEM mit verzögerten Randoms, Dämpfungskorrektur und Allpass-Filterung (keine Filterung). Alle Rekonstruktionen erfolgen von Scannerkonsolen mit Parametern, die für effiziente klinische Arbeitsabläufe geeignet sind. Es wurden keine zusätzlichen numerischen Verarbeitungen, Korrekturen oder Unschärfen verwendet. Aus Gründen der Vergleichbarkeit werden alle Scannerergebnisse nach Starrkörpertransformation und trilinearer Interpolation auf den MNI152-Atlas mit einer Auflösung von 1,0 mm3 dargestellt. (A) Ein reiner PET-Scanner mit BGO-Kristallszintillatoren, OP-OSEM mit 4 Iterationen und 16 Teilmengen, 2,0 x 2,0 x 2,4 mm,3 Voxeln, 6 min Emissionen, Transmissionscan mit Ge/Ga für die Dämpfungskartierung und Einzelstreusimulationen. (B) Ein PET-MR-Scanner mit LYSO-Kristallszintillatoren, OP-OSEM mit 4 Iterationen und 16 Teilmengen, 2,1 x 2,1 x 2,0 mm,3 Voxeln, 10 min Emissionen, extern erfasster CT für die Dämpfungskartierung und modellbasierter absoluter Streuskalierung. (C) Ein PET-CT-Scanner mit LYSO-Kristallszintillatoren, Flugzeiterkennung, OP-OSEM mit 8 Iterationen und 5 Teilmengen, 1,65 x 1,65 x 1,65 mm,3 Voxeln, 6 min Emissionen, integriertem CT für Dämpfungskartierung und modellbasierter absoluter Streuskalierung. Abkürzungen: PET = Positronen-Emissions-Tomographie; CT = Computertomographie; MR = Magnetresonanz; OP-OSEM = gewöhnliche Poisson-geordnete Teilmengen der Erwartungsmaximierung; BGO = Wismutgermanat; LYSO = Lutetium-Yttrium-Oxyorthosilikat. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die PET-Bildgebung des Sauerstoff- und Glukosestoffwechsels mit inhalativen [15O]CO und [15O]O2 Gasen, die intravenöse Injektion von [15O]H2O und die intravenöse Injektion von [18F]FDG haben signifikante historische Vorgeschichten, die auf der Bildgebung älterer Generationen von PET-Scannern basieren 14,15,16,17,26,27. Diese Daten stützten sich in der Regel auf Transmissionsscans mit Germanium/Gallium-Quellen für die Dämpfungskartierung, lumineszenzbegrenzte Bismutgermanat (BGO)-Szintillatorarrays, hochaktive Dosierung und 2D-Erfassungen mit ringförmigen Septen, um eine begrenzte Szintillatorlumineszenz und gefilterte Rückprojektionsrekonstruktionen zu ermöglichen, die rechenintensiv sind. Neuere Scanner, einschließlich der in diesem Protokoll beschriebenen, verwenden hochauflösende CT zur Dämpfungskorrektur, hochlumineszierende Lutetium-Yttrium-Oxyorthosilikat (LYSO)-Szintillator-Arrays, die in räumlich dichten Szintillatorkonfigurationen angeordnet sind, 3D-Erfassungen, die die Effizienz der Photonendetektion multiplizieren, TOF-Detektionselektronik, die die räumliche Lokalisierung von Annihilationsereignissen verbessert, und computergestützte fortschrittliche Rekonstruktionsmethoden mit 3D-gewöhnlichen Poisson-geordneten Teilmengen von Maximierung der Erwartung (OP-OSEM). Neue Scanner bieten eine überlegene Bildqualität bei geringerer Strahlendosis29,30. Vergleichbare Exemplare aus drei Generationen von PET-Scannern sind in Abbildung 6 dargestellt.
Dieses Protokoll nutzt mehrere zusätzliche Modifikationen, um die Qualität der Informationen aus dem PET-Scannen von neueren Scannern zu verbessern: Positionierung mit den Füßen vorab, sorgfältig getaktete Dosisverabreichungen und automatisierte Messungen der arteriellen Eingangsfunktion25. Diese ermöglichen die Erfassung von arteriellen Eingangsfunktionen und Hirnemissionsdaten für vier verschiedene Tracer des Sauerstoff- und Glukosestoffwechsels innerhalb einer 2-3-stündigen Scan-Sitzung. Diese Daten können dann an traditionelle und neuartige kinetische Modellierungsmethoden sowie partielle Volumenkorrekturalgorithmen übermittelt werden, um hochauflösende und hochgenaue quantitative Schätzungen des Gehirnstoffwechsels zu erstellen. Wichtig ist, dass dieses Protokoll nicht nur quantitative Messungen des Sauerstoff- und Glukosestoffwechsels im Gehirn ermöglicht, sondern auch die Berechnung der AG im Gehirn. Insbesondere die überlegene Bildqualität modernster Scanner ermöglicht realistischere, aus Bildern abgeleitete arterielle Eingabefunktionen sowie neuartige analytische Ansätze, die bisher durch Rauschen oder die Empfindlichkeit gegenüber zeitlichen Unterschieden zwischen arterieller Probenahme und Hirnemissionen eingeschränkt waren19.
Bemerkenswert ist, dass es schwieriger ist, die Bildqualität mit 15-O-Radiotracern zu verbessern als mit [18F]FDG. Die ephemere 122-s-Halbwertszeit von 15O führt zu einem starken Informationsverlust. Aber auch der Einsatz von gasförmigen Radiotracern kann sinnvoll sein, da sich Gase im Umgebungsraum zwischen dem Kopf des Teilnehmers und den Detektionsringen des PET-CT ansammeln können. Dort können Emissionen von Radiotracergasen signifikante Quellen für Zufalls- und Streuungen bilden, wodurch die von Anbietern implementierten Streuungskorrekturmethoden verwirrt werden, die eine relative Skalierung von Streuquellen im Vergleich zu Regionen verwenden, die als Luft identifiziert wurden. Selbst intravenös injizierte [15O]H2O kann Schwierigkeiten bereiten, wenn signifikante Mengen als [15O]H2O Dampf ausgeatmet werden. Methoden zum Abfangen gasförmiger Radiotracer wurden berichtet24, aber in dieser Arbeit nicht implementiert. Herkömmliche Streukorrekturmodelle können für die Abbildung von 15-O-Radiotracern ungeeignet sein, und die beste Leistung für diese Tracer hing von Streumodellen ab, die die absoluten Quellen von Annihilationsphotonen im Sichtfeld ohne Neuskalierung berücksichtigen, gepaart mit genauen Karten der Abschwächung. Selbst geringfügige Auslassungen von Hardware, wie z. B. Spiegel, die an den Kopfspulen von PET-MR-Scannern befestigt sind und auf denen 15-O-Gase häufig Kondensate bilden, können bei der Emissionsrekonstruktion zu erheblichen Artefakten führen. Verwandte Artefakte, die sich aus nicht übereinstimmenden Karten der Dämpfung nach der Bewegung der Teilnehmer ergaben, wurden ebenfalls berichtet31. Da die Wechselwirkungen von Streumodellen mit Punktspreizungseigenschaften gasförmiger Radiotracer noch wenig charakterisiert sind, wurden in dieser Arbeit Punktspreizungsmodellierungsmethoden ausgelassen, die ansonsten für hochauflösende PET unerlässlich sind. Die Optimierung der Rekonstruktionsparameter für den listmode für jeden Tracer ist die beste Vorgehensweise, aber diese Arbeit liefert Beispiele mit einfachen Konsolenrekonstruktionen, die so identisch wie möglich auf alle Tracer angewendet wurden, wie in Protokollabschnitt 9.1 beschrieben. Die Beispiele zeigen notwendigerweise Frame-Timing-Zeitpläne, die an die Variabilität von Tracer-kinetischen Zeitskalen angepasst wurden. Die Beispiele betonen die Einfachheit, die Vergleichbarkeit der Zählstatistiken und die effektiven räumlichen Auflösungen, die für jeden Tracer verfügbar sind, sowie die Minimierung von Verzerrungen, die auftreten könnten, während die Rekonstruktionsparameter für jeden Tracer optimiert werden. Für die Vergleichbarkeit mit bestehenden Studien mit 15O verwenden die repräsentativen Ergebnisse dieser Arbeit 8 Iterationen von 5 Untergruppen, von denen zuvor berichtet wurde, dass sie für moderne PET-CT mit Flugzeiterfassungen geeignet sind30,32. Die Flugzeit kann mit 4 Iterationen von 5 Teilmengen zu einer verbesserten Bildauflösung führen, und diese Optimierungen werden derzeit aktiv für die in dieser Arbeit beschriebenen Tracer untersucht.
Die längere Scannerbohrung moderner PET-CT-Scanner belastet die Untersucher bei der Verabreichung von Radiotracergasen. Enge Gantry-Geometrien erschweren es, den Mund des Teilnehmers bei der Verabreichung von Gasen zu erreichen, Anweisungen an die Teilnehmer zu übermitteln und sicherzustellen, dass Gasverabreichungsgeräte keine Radiotracer in den Umgebungsraum abgeben. Dabei zeigt die Positionierung der Teilnehmer mit den Füßen voran Vorteile. Die meisten Scanner-Hardware macht die Positionierung mit den Füßen voran unvereinbar mit der Platzierung von Neuroshielding-Geräten, bei denen in der Regel eine Bleiabschirmung platziert wird, die den Hals des Teilnehmers umgibt und den Kopf des Teilnehmers vom Körper trennt. Neuroshielding reduziert das Eindringen von Zufallsstoffen aus dem Körper in das Sichtfeld. Die relativen Vorteile von Neuroshielding im Vergleich zur Vermeidung von Radiotracern aus der Umgebung sind derzeit nur unzureichend verstanden.
Quantifizierung des Gehirnstoffwechsels
Diese Arbeit zeigt die Ergebnisse von Analysen unter Verwendung traditioneller Modelle für die Hämodynamik, die von Raichle et al. (CBF)16 und Martin et al. (CBV)17 beschrieben wurden, und für den Metabolismus, die von Mintun et al. (CMRO2)15 und Huang et al. (CMRGlc)14 beschrieben wurden. Diese Analysen nutzen die arteriellen Eingabefunktionen und Emissionsdaten, die mit dem in dieser Arbeit beschriebenen Protokoll gemessen wurden. Alternative Mittel zur Messung der arteriellen Eingangsfunktion, wie z.B. eine bildgewonnene Methode, werden aktiv verfolgt und gegen die invasive Methode getestet. Herkömmliche Modelle nutzen auch die dynamische Bildgebung in vollem Umfang, um kinetische Modellparameter zu schätzen. Wir haben die Verwendung von polynomialen Darstellungen von CBF und CMRO bevorzugt226,27. Wir haben die Methoden von Huang et al. zur Schätzung von CMRGlc bevorzugt, aber die Bayes'sche Parameterschätzung verwendet28,33. AG wurde in jüngerer Zeit als Maß für Glukose konzipiert, die in glykolytische Stoffwechselwege eintritt, aber zu anderen zellulären Funktionen als der oxidativen Phosphorylierung beiträgt4. Die Berechnung der Gehirn-AG erfordert dann einfach die Umrechnung von CMRGlc und CMRO2 in molare Äquivalente und die Subtraktion von einem Sechstel des letzteren von den ersteren Äquivalenten.
Partielle Lautstärkekorrektur
Wir führen üblicherweise eine regionale Teilvolumenkorrektur an SUVR-Bildern mit dem symmetrischen geometrischen Transfermatrix-Algorithmus (sGTM)34 durch. Dies beruht auf den hochauflösenden Daten der MRT, die nur anatomische Sequenzen enthalten können, obwohl das aktuelle Protokoll auch HCP-ähnliche Sequenzen für eine genauere regionale Parzellierung erhält. Wir haben sowohl anatomische (z. B. Desikan-Killiany35) als auch funktionale (z. B. Schaeffer36 oder Glasser37) Atlanten verwendet. Die ersteren Atlanten haben oft größere Bereiche von Interesse, die besser für PET-Bilder mit geringerer Auflösung geeignet sind und in früheren PET-Forschungen häufiger verwendet wurden. Die neueren Atlanten sind jedoch funktionell und zytoarchitektonisch besser definiert und eignen sich nun möglicherweise besser für PET-Bildgebung mit höherer Auflösung, wie sie mit dem Siemens Vision Scanner erstellt wurde. SUVR-Bilder für 15O-Scans werden wie zuvor beschrieben berechnet und auf die Werte des gesamten Gehirnsbezogen 4. CMRGlc und CMRO2 des gesamten Gehirns werden dann unter Verwendung der kinetischen Modellierung wie oben beschrieben berechnet, um die SUVR-Bilder in absolute quantitative Werte umzuwandeln. Daraus können dann teilweise volumenkorrigierte regionale AG berechnet werden. Während unsere Beispiele für die dynamische Emissionsbildgebung aus Gründen der Einfachheit der Darstellung keine partielle Volumenkorrektur demonstrieren, werden derzeit Methoden zur partiellen Volumenkorrektur, die die dynamische Bildgebung berücksichtigen, aktiv untersucht.
Generalisierbarkeit und Anpassungsfähigkeit des Protokolls
Dieses Protokoll beschreibt methodische Details, die relevant sind, um die höchste erreichbare Genauigkeit, Präzision, Reproduzierbarkeit und Interpretierbarkeit von Messungen des Sauerstoff- und Glukosestoffwechsels durch PET beim Menschen zu erreichen. Die höchste bekannte Genauigkeit und Präzision von Messungen gehören zu Analysen, die auf Prinzipien und Praktiken der Tracerkinetik basieren, zu denen direkte Messungen von arteriellen Eingangsfunktionen, die Bestimmung von interessierenden Regionen durch Co-Registrierung mit hochauflösender struktureller MRT und der sehr anspruchsvolle Einsatz von Rechenressourcen für statistische Modelle gehören. Insbesondere die invasive Kanülierung der Arteria radialis und ihre Aufrechterhaltung gegenüber seriell wiederholten Emissionsscans ist kostspielig und birgt begrenzte Risiken für schwere Verletzungen, die die Einbeziehung klinisch erfahrener Teams erfordern. Der Einsatz von Tracern auf Basis von 15O ist eine weitere Herausforderung für Zyklotrone und ihre Support-Teams. Diese stellen eine Übereinstimmung mit historisch berichteten metabolischen Messungen beim Menschen her und stellen sicher, dass Interpretationen quantitativer Befunde auf zuvor gesammelten Informationen aufbauen. Diese detaillierten und invasiven Maßnahmen bieten aber auch die Möglichkeit, weniger invasive, weniger anspruchsvolle Methoden zu validieren, die für viele Fragen des menschlichen Stoffwechsels ausreichend sein können. Nach entsprechender Validierung kann die Kanülierung der Arteria radialis für viele spezialisierte Studien in geeigneter Weise durch bildabgeleitete Quellen für Eingabefunktionen38 ersetzt werden. Die Vermeidung einer Kanülierung der Arteria radialis schließt auch direkte Messungen des primären Stoffwechselprodukts von [15O]O2 aus, nämlich [15O]H2O, das aus Proben der Arteria radialis geschätzt werden kann, die zentrifugiert wurden, um [15O]H2O des Metabolismus aus Plasma und [15O]O2 aus zentrifugierten roten Blutkörperchen zu schätzen. Es können jedoch rechenintensive Methoden verwendet werden, um die Entstehung von metabolischem [15O]H2O im arteriellen Kreislauf parametrisch zu lösen, wovon ein lineares Modell von Mintun et al.vorgeschlagen wurde 15. Viele Methoden, die SUVR verwenden, können auch nach Vergleichen mit invasiv gewonnenen Daten validiert werden. Derzeit wird in aktiven Forschungsprogrammen die Validierung von Sauerstoffschätzungen auf der Grundlage des von der Blutsauerstoffversorgung abhängigen Effekts angestrebt, und gleichzeitige Messungen mit 15O können eine weitere Validierung liefern39. Darüber hinaus dürften detaillierte Optimierungen von Bildrekonstruktionen aus dem Listmode, obwohl sie in diesem Protokoll ohne Beispiele erwähnt werden, die Qualität der Messungen des Stoffwechsels verbessern. Darüber hinaus können viele spezialisierte Methoden, wie z. B. die Bewegungskorrektur von Listmode-Daten und partielle Volumenkorrekturen, eine Anstrengung wert sein, wenn Studienfragen dies erfordern, z. B. wenn gelegentliche Teilnehmer übermäßige Kopfbewegungen haben oder Studien über kortikale Atrophie durch partielle Volumenmittelung mit zerebraler Rückenmarksflüssigkeit verwechselt werden.
Vorsichtsmaßnahmen für PET-Scans
Dieses Protokoll setzt die Teilnehmer ionisierender Gammastrahlung aus. Die aktuellen Schätzungen der Strahlung bei Teilnehmern, die sich der hier beschriebenen gesamten PET-Sitzung unterzogen haben (einschließlich vier bis sechs 15-O-Scans und eines FDG-Scans), ergeben eine durchschnittliche effektive Gesamtdosis, einschließlich aller Radiotracer-Verabreichungen, von etwa 7 mSv (0,7 rem). Dies ist vergleichbar mit der Strahlendosis anderer Radiotracer, die in Forschung und klinischer Praxis verwendet werden, und entspricht 14 % der gesamten Strahlendosis, die einem Strahlenarbeiter in einem Jahr zusteht. Alle Teilnehmer (und/oder deren gesetzlich zulässiger Vertreter) werden vor Einholung ihrer Einwilligung zur Studieneinschreibung sowohl schriftlich als auch mündlich sorgfältig über die möglichen Strahlenrisiken informiert.
Vorsichtsmaßnahmen für arterielle Leitungen
Zu den Komplikationen der arteriellen Kanülierung gehören Blutergüsse (häufig), Schmerzen, Schwellungen, Hämatome (gelegentlich), Blutungen an der Einführstelle, Vasospasmus, Thrombose (selten) und Reaktion auf heparinisierte Kochsalzlösung bei Anwendung (sehr selten). Wir beauftragen routinemäßig einen interventionellen Radiologiedienst, um arterielle Zugänge zu platzieren und eventuelle Komplikationen zu behandeln, falls diese auftreten sollten.
Vorsichtsmaßnahmen für die MRT
Die US-amerikanische Food and Drug Administration verlangt, dass alle Medizinprodukte, die in das Magnetfeld eines MRT-Scanners eindringen, standardisierten Sicherheitstests unterzogen werden. Wenn das Gerät eines Teilnehmers als MRT-sicher gekennzeichnet ist, können wir unter den von der FDA zugelassenen Standard-Scanbedingungen ohne zusätzliche Risiken für den Teilnehmer vorgehen. Wenn das Gerät eines Teilnehmers bedingt MRT ist, überprüfen wir den Hersteller, die Marke und das Modell des Geräts und passen dann die MRT-Scanverfahren entsprechend an. In der Bildgebung besteht auch das potenzielle Risiko, dass Zufallsbefunde aufgedeckt werden, die zusätzliche Risiken wie Angstzustände, finanzielle Verluste durch zusätzliche Aufarbeitungen und in seltenen Fällen Komplikationen durch spätere, klinisch indizierte invasive Eingriffe mit sich bringen können.
Zusammenfassung der Einschränkungen
Unvermeidbare Einschränkungen bei der Messung des Sauerstoff- und Glukosestoffwechsels sind spezifisch für den Radiotracer selbst. Nr. 15O-Tracer haben kurze Halbwertszeiten, die viele der anspruchsvollsten Anforderungen dieses Protokolls erfordern, einschließlich des Vorhandenseins hochspezialisierter und zugänglicher Zyklotronanlagen. Gasförmige 15-O-Tracer führen in die Komplexität des Gasmanagements ein, wie z. B. das Auffangen abgelaufener Gase24 und spezielle Methoden zur Streuungskorrektur. [18F]FDG tauscht die erheblichen Herausforderungen bei der Verfolgung von Metaboliten in [11C]-Glukose-Tracern gegen Verwirrung durch Lumped-Constant-Schätzungen aus. Dieses Protokoll hat auch Einschränkungen, die sich aus der engen Geometrie der integrierten PET-CT-Scanner ergeben. Während die Positionierung des Teilnehmers mit den Füßen voran die Einsperrprobleme lindert, kann dies mit der Verwendung von Neuroshielding-Geräten unvereinbar sein. Schließlich stellt die Verwendung einer invasiven Kanülierung der Arteria radialis an sich schon eine erhebliche Einschränkung dar. Die Arteria radialis ist ein Stellvertreter für die primäre arterielle Versorgung des Gehirns. Die Arteria radialis kann jedoch abweichende Flusseigenschaften von der arteriellen Versorgung des Gehirns aufweisen. Darüber hinaus verändern invasive und schmerzhafte Verfahren den kognitiven Zustand der Studienteilnehmer, was den Umfang und die Generalisierbarkeit von Neuroimaging-Studien, die mit diesem Protokoll durchgeführt werden können, einschränken.
Offenlegungen
Es gibt keine Interessenkonflikte, weder finanziell noch anderweitig, zwischen den Autoren und dem Inhalt dieses Papiers.
Danksagungen
Besonders dankbar sind wir unseren Forschungsteilnehmern für ihren Altruismus. Wir danken den Direktoren und Mitarbeitern des Neuroimaging Labs Research Center, des Knight Alzheimer's Disease Research Center, des Center for Clinical Imaging Research (CCIR) und der Zyklotronanlage der Washington University dafür, dass sie diese Forschung möglich gemacht haben. Wir danken für die Forschungsförderung durch NIH R01AG053503, R01AG057536, RF1AG073210, RF1AG074992 und 1S10OD025214, das Mallinckrodt Institute of Radiology und die McDonnell Foundation for Systems Neuroscience an der Washington University.
Materialien
| Name | Company | Catalog Number | Comments |
| 3/16" outer diameter 1/8" innner diameter nylaflow tubing | Nylaflow Tubing, Zazareth, PA | ||
| 4 x 4 in. gauze | McKesson MedSurg | 16-4242 | |
| Analytical balance | Fisher Scientific/OHUAS | Pioneer Exal Model 90 mm platform #PA84 | |
| Bacterial/Viral filter | Hudson RCI, Teleflex, Perak, Malaysia | REF 1605 (IPN042652) | |
| BD SmartSite Needle-Free Valve | Becton Dickinson | 2000E | |
| Biograph mMR | Siemens, Erlangen, Germany | ||
| Biograph Vision 600 Edge | Siemens, Erlangen, Germany | ||
| Caprac wipe counter | Mirion Medical (Capintec), Florham Park, NJ | from 1991 or newer | NaI drilled well crystal |
| Coban self-adhesive wrap | 3M | commonly used in intensive care units | |
| dressing, tegaderm, 4 x 4" | 3M Health Care | #1626 | |
| ECAT EXACT HR+ | CTI PET Systems, Knoxville, TN | ||
| Edwards TruWave 3 cc/84 in (210 cm) | Edwards Lifescience | PX284R | |
| extension catheter 48 cm length, 0.642 mL priming volume | Braun | V5424 | |
| heparin sodium, solution 2 U/mL, 1,000 mL | Hospira Worldwide | #409762059 | |
| I.V. armboard flexible 4 x 9 in. adult | DeRoyal | M8125-A | |
| Keithley pico-ammeter | Tekronix | ||
| Magnetom Prisma fit | Siemens, Erlangen, Germany | 3T | |
| male-male adapter for Luer valves | Argon Medical Co. | 040184000A | |
| MiniSpin Personal Microcentrifuge | Eppendorf, Hamburg, Germany | EP-022620151 | |
| Mouthpiece 15 mm ID, 22 mm OD | Hudson RCI, Teleflex, Perak, Malaysia | REF 1565 (IPN042595) | |
| MRIdium | Iradmed, Winter Springs, FL | 3860+ | |
| Nalgene square PET media bottle with closure, 650 mL | Thermo Scientific | #3420400650 | for cross-calibration |
| pressure infusion bag with bulb, accommodating 1,000 mL | Health Care Logi | #10401 | |
| pressure monitoring tray polyethylene catheter; 2.5Fr (2.5 cm) angiocath; 0.015" 15 cm wire; 22G (2 cm) needle | Cook Medical | C-P MSY-250, G02854 | |
| RDS 11 MeV Cyclotron | Siemens, Erlangen, Germany | proton bombardment of 15N to generate 15O | |
| sodium chloride IV solution 0.9%, 1,000 mL | B. Braun Medical | E8000 | |
| steri-strips (closure, skin reinf LF 1/2x4") | McKesson MecSurg | #3010 | |
| Twilite II | Swisstrace, Zurich, Switzerland | ||
| Uninterruptible Power Supply battery backup and surge protector | APC | BR1500MS2 |
Referenzen
- Goyal, M. S., Hawrylycz, M., Miller, J. A., Snyder, A. Z., Raichle, M. E. Aerobic glycolysis in the human brain is associated with development and neotenous gene expression. Cell Metabolism. 19 (1), 49-57 (2014).
- Magistretti, P. J. Imaging brain aerobic glycolysis as a marker of synaptic plasticity. Proceedings of the National Academy of Sciences. 113 (26), 7015-7016 (2016).
- Shannon, B. J., et al. Brain aerobic glycolysis and motor adaptation learning. Proceedings of the National Academy of Sciences of the United States of America. 113 (26), E3782-E3791 (2016).
- Vaishnavi, S. N., et al. Regional aerobic glycolysis in the human brain. Proceedings of the National Academy of Sciences. 107 (41), 17757-17762 (2010).
- Powers, W. J., Dagogo-Jack, S., Markham, J., Larson, K. B., Dence, C. S. Cerebral transport and metabolism of 1-11C-D-glucose during stepped hypoglycemia. Annals of Neurology. 38 (4), 599-609 (1995).
- Locasale, J. W., Cantley, L. C. Metabolic flux and the regulation of mammalian cell growth. Cell Metabolism. 14 (4), 443-451 (2011).
- Lunt, S. Y., Vander Heiden, M. G. Aerobic glycolysis: meeting the metabolic requirements of cell proliferation. Annual Review of Cell and Developmental Biology. 27 (1), 441-464 (2011).
- Vlassenko, A. G., Raichle, M. E. Brain aerobic glycolysis functions and Alzheimer's disease. Clinical and Translational Imaging. 3 (1), 27-37 (2015).
- Goyal, M. S., et al. Loss of brain aerobic glycolysis in normal human aging. Cell Metabolism. 26 (2), 353-360 (2017).
- Goyal, M. S., et al. Spatiotemporal relationship between subthreshold amyloid accumulation and aerobic glycolysis in the human brain. Neurobiology of Aging. 96, 165-175 (2020).
- Goyal, M. S., et al. Brain aerobic glycolysis and resilience in Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 120 (7), 2212256120 (2023).
- Segarra-Mondejar, M., et al. Synaptic activity-induced glycolysis facilitates membrane lipid provision and neurite outgrowth. EMBO Journal. 37 (9), 97368 (2018).
- Harris, R. A., et al. Aerobic glycolysis is required for spatial memory acquisition but not memory retrieval in mice. Eneuro. 6 (1), (2019).
- Huang, S. C., et al. Noninvasive determination of local cerebral metabolic rate of glucose in man. American Journal of Physiology-Endocrinology and Metabolism. 238 (1), E69-E82 (1980).
- Mintun, M. A., Raichle, M. E., Martin, W. R. W., Herscovitch, P. Brain oxygen utilization measured with O-15 radiotracers and positron emission tomography. Journal of Nuclear Medicine. 25 (2), 177-187 (1984).
- Raichle, M. E., Martin, W. R., Herscovitch, P., Mintun, M. A., Markham, J. Brain blood flow measured with intravenous H2(15)O. II. Implementation and validation. Journal of nuclear medicine. 32 (15), 790-798 (1983).
- Martin, W. R. W., Powers, W. J., Raichle, M. E. Cerebral blood volume measured with inhaled C15O and positron emission tomography. Journal of Cerebral Blood Flow & Metabolism. 7 (4), 421-426 (1987).
- Hooker, J. M., Carson, R. E. Human positron emission tomography neuroimaging. Annual Review of Biomedical Engineering. 21, 551-581 (2019).
- Fan, A. P., et al. Quantification of brain oxygen extraction and metabolism with [(15)O]-gas PET: A technical review in the era of PET/MRI. Neuroimage. 220, 117136 (2020).
- Tisdall, M. D., et al. Volumetric navigators for prospective motion correction and selective reacquisition in neuroanatomical MRI. Magnetic Resonance in Medicine. 68 (2), 389-399 (2012).
- Greve, D. N., et al. Cortical surface-based analysis reduces bias and variance in kinetic modeling of brain PET data. NeuroImage. 92, 225-236 (2014).
- Greve, D. N., et al. Different partial volume correction methods lead to different conclusions: An 18F-FDG-PET study of aging. NeuroImage. 132, 334-343 (2016).
- Iguchi, S., et al. System evaluation of automated production and inhalation of (15)O-labeled gaseous radiopharmaceuticals for the rapid (15)O-oxygen PET examinations. EJNMMI Physics. 5 (15), 37 (2018).
- Alf, M. F., et al. Quantification of brain glucose metabolism by 18F-FDG PET with real-time arterial and image-derived input function in mice. Journal of Nuclear Medicine. 54 (1), 132-138 (2013).
- Herscovitch, P., Mintun, M. A., Raichle, M. E. Brain oxygen utilization measured with oxygen-15 radiotracers and positron emission tomography: generation of metabolic images. Journal of Nuclear Medicine. 26, 416-417 (1985).
- Videen, T. O., Perlmutter, J. S., Herscovitch, P., Raichle, M. E. Brain blood volume, flow, and oxygen utilization Measured with 15O radiotracers and positron emission tomography: revised metabolic computations. Journal of Cerebral Blood Flow & Metabolism. 7 (4), 513-516 (1987).
- Lee, J. J., et al. Dynamic susceptibility contrast MRI with localized arterial input functions. Magnetic Resonance in Medicine. 63 (5), 1305-1314 (2010).
- Kunnen, B., Beijst, C., Lam, M., Viergever, M. A., de Jong, H. Comparison of the Biograph Vision and Biograph mCT for quantitative (90)Y PET/CT imaging for radioembolisation. EJNMMI Physics. 7 (1), 14 (2020).
- van Sluis, J., et al. Performance characteristics of the digital Biograph Vision PET/CT system. Journal of Nuclear Medicine. 60 (7), 1031-1036 (2019).
- Lodge, M. A., Mhlanga, J. C., Cho, S. Y., Wahl, R. L. Effect of patient arm motion in whole-body PET/CT. Journal of Nuclear Medicine. 52 (12), 1891-1897 (2011).
- Prenosil, G. A., et al. Performance characteristics of the Biograph Vision Quadra PET/CT system with a long axial field of view using the NEMA NU 2-2018 Standard. Journal of Nuclear Medicine. 63 (3), 476-484 (2022).
- Lee, J. J., et al. Dissociation between hormonal counterregulatory responses and cerebral glucose metabolism during hypoglycemia. Diabetes. 66 (12), 2964-2972 (2017).
- Sattarivand, M., Kusano, M., Poon, I., Caldwell, C. Symmetric geometric transfer matrix partial volume correction for PET imaging: principle, validation and robustness. Physics in Medicine and Biology. 57 (21), 7101-7116 (2012).
- Desikan, R. S., et al. An automated labeling system for subdividing the human cerebral cortex on MRI scans into gyral based regions of interest. Neuroimage. 31 (3), 968-980 (2006).
- Schaefer, A., et al. Local-global parcellation of the human cerebral cortex from intrinsic functional connectivity MRI. Cerebral Cortex. 28 (9), 3095-3114 (2018).
- Glasser, M. F., et al. A multi-modal parcellation of human cerebral cortex. Nature. 536 (7615), 171-178 (2016).
- Zanotti-Fregonara, P., Chen, K., Liow, J. -. S., Fujita, M., Innis, R. B. Image-derived input function for brain PET studies: many challenges and few opportunities. Journal of Cerebral Blood Flow & Metabolism. 31 (10), 1986-1998 (2011).
- Rodgers, Z. B., Detre, J. A., Wehrli, F. W. MRI-based methods for quantification of the cerebral metabolic rate of oxygen. Journal of Cerebral Blood Flow & Metabolism. 36 (7), 1165-1185 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten