Method Article
マウスにおける腹腔組織常在マクロ ファージの 効率的な遺伝子およびマイクロRNA調節のためのレンチウイルスベクター調製
要約
私たちは、レンチウイルスベクターを使用して、 in vivoで腹膜組織に常在するマクロファージの遺伝子機能を調べるための段階的なプロトコルを示します。
要約
腹膜組織に常在するマクロファージは、恒常性の維持に広範な機能を持ち、局所組織および隣接組織内の病状に関与しています。それらの機能は、微小環境の手がかりによって決定されます。したがって、 in vivo の生理学的ニッチにおける彼らの行動を調査することが不可欠です。現在、特定の腹膜マクロファージターゲティング方法論は、マウス全体のトランスジェニックモデルを採用しています。ここでは、レンチウイルス粒子を用いて腹膜マクロファージにおけるmRNAおよびsmall RNA種(例えば、microRNA)発現の効果的な in vivo 調節のためのプロトコルについて説明します。レンチウイルス製剤はHEK293T細胞で作製し、単一のスクロース層で精製しました。腹腔内注射後のレンチウイルスの有効性の in vivo 検証により、局所組織に限定されたマクロファージの主な感染が明らかになりました。腹膜マクロファージの標的化は、ホメオスタシスおよびチオグリコール酸誘発性腹膜炎において成功しました。レンチウイルスの腹腔内送達によって誘発される低レベルの炎症や、潜在的な実験の時間制限など、プロトコルの限界について説明します。全体として、この研究は、 in vivo の腹膜マクロファージにおける遺伝子機能を迅速に評価するための迅速でアクセス可能なプロトコルを示しています。
概要
組織常在性マクロファージ(Mφ)は、侵入する病原体を感知して応答する食作用免疫細胞の不均一な集団です1,2。さらに、それらは組織の発達、リモデリング、および恒常性の維持において重要な役割を果たします1,3。多くの組織Mφは、胚形成中に卵黄嚢前駆細胞に由来し、生涯を通じて組織に持続します4,5。これらの細胞の表現型と機能は、特定の転写因子と局所微小環境との協調的および階層的な相互作用によって決定される6,7,8,9。この依存性についての理解が深まるにつれ、生理学的に重要なニッチ内でMφを遺伝子操作するための効果的なin vivo法の必要性が高まっています。
レンチウイルスベクターは、in vivo 10,11,12の特定の細胞集団における核酸の操作に頻繁に使用されるツールであり、特に分裂細胞と非分裂細胞の両方に感染し、宿主ゲノムに安定して統合する能力があるためです13,14。過去20年間で、レンチウイルス送達技術は最適化され、系統特異的なターゲティングを増やすために代替エンベロープと合成プロモーターが調査されてきた8,15。その広範な細胞親和性により、水疱性口内炎ウイルスエンベロープ糖タンパク質(VSV-G)16,17は、レンチウイルス技術で使用される「ゴールドスタンダード」エンベロープとなっています。
このプロトコル18では、VSV-Gシュードタイプレンチウイルス粒子を使用して、短いヘアピンRNA(shRNA)およびマイクロRNA(miR)のマウス腹膜Mφ(pMφ)への定常状態でのインビボへの標的化および効果的な送達を実証する。導入遺伝子の発現は、脾臓焦点形成ウイルス(SFFV)プロモーターによって駆動されました。細胞の生産感染は、レンチウイルス由来の増強緑色蛍光タンパク質(GFP)の発現によって定義されました。このアプローチを利用することで、in vivoレンチウイルス実験の読み出しが容易になり、最適な用量と実験期間を定義することができました。最後に、チオグリコール酸誘発性炎症中のマウスのin vivoレンチウイルスチャレンジにより、選択的pMφ感染の自然な傾向が明らかになりました。
プロトコル
すべての動物の作業は、機関および英国内務省のガイドラインに従って行われました。
注:レンチウイルスを用いたすべての in vivo 研究は、研究における動物の倫理的使用に関する地域および国のガイドラインに従って実施し、カテゴリーIIの感染性物質の使用に関連するすべての規制を遵守する必要があります。動物福祉も地域の規制に従って監視する必要があります。このステップでは、レンチウイルス粒子や鋭利物を扱う際には細心の注意を払う必要があります。
1. トランスフェクション用HEK293T細胞の調製
注:これらの手順は、滅菌組織培養生物学的安全キャビネットの下で行ってください。
- 450 mLのDMEMを10%(v / v)のウシ胎児血清(50 mL)および最終濃度100 U / mLのペニシリン/ストレプトマイシンと組み合わせて、HEK293T細胞用の完全なダルベッコ修正イーグル培地(cDMEM)を調製します。
- 予定されているトランスフェクションの少なくとも1週間前にHEK293T細胞を解凍してください。健康な成長条件を維持し、トリプシン+ EDTAを使用して2〜3日ごとに通過し、フラスコから細胞を分離します。
- トランスフェクションの1日前に、細胞から増殖培地を慎重に吸引し、滅菌DPBSで細胞を穏やかに洗浄します。1〜5mLのトリプシンをフラスコに加え、5%CO2 インキュベーターで37°Cで2〜5分間インキュベートします。
- 5〜10mLのcDMEMを加え、細胞を350 x g で5分間遠心します。液体を取り出し、細胞ペレットを10 mLのcDMEMに再懸濁します。細胞をカウントし、20 mLのcDMEM中のT175フラスコあたり10-11 x 106 の生HEK293T細胞を播種します。
- 5% CO2 インキュベーターで37°Cで一晩インキュベートし、HEK293T細胞が70%〜80%のコンフルエントに達するようにします。
- 翌日、光学顕微鏡で細胞のコンフルエンシーを確認します。
- 細胞単層を乱さずに、25 mLの血清学的ストリペットでフラスコから培地を取り出します。
- DPBSを10mLをやさしく加え、プレートを揺らして細胞を洗浄し、細胞単層を乱さないように注意してください。
- 25mLの血清学的ストリペットでDPBSを除去します。
- 細胞単層を乱さないように、T175フラスコごとに壁に15 mLの新しいcDMEMを追加し、プレートを37°Cのインキュベーターに戻します。
2. 非リポソーム脂質トランスフェクション試薬を用いたHEK293T細胞のトランスフェクション
- 15 mLの遠心チューブで、レンチウイルス成分(2 μgのレンチウイルスプラスミド、1.5 μgのpΔ8.91(pCMV-Δ8.91)、および1 μgのpMD2.G(pCMV-MD2.G)とBuffer EC(トランスフェクション試薬キット)を最終容量600 μLまで調製します。
- 36 μLのエンハンサー溶液を加えます。1mLのピペットを使用して、液体の一部を繰り返し吸い上げ、残りの溶液に直接一滴ずつ戻すことにより、成分を混合します。室温(RT)で5分間放置します。
- トランスフェクション試薬120μLを加え、上記のように約20回混合します。室温で10分間インキュベートします。
- 5.2 mLのcDMEMを加え、上記のように5 mLの血清学的ストリペットと混合します。.
- 使い捨てのトランスファーピペットを使用して、トランスフェクションミックスをHEK293T細胞単層に直接滴下し(フラスコ壁を避け)、フラスコ内のさまざまな場所にミックスを広げます。
- フラスコを左右に静かに揺らしてプラスミドを分配します。フラスコの蓋に液体が入らないようにしてください。
- フラスコを37°Cで5%CO2 インキュベーターで48時間インキュベートします。細胞イメージング蛍光顕微鏡でモニターしたトランスフェクションから24時間以内の蛍光マーカー(ここではGFP)の出現により、HEK293T細胞の効果的なトランスフェクションを確認します。
注:蛍光マーカーのないコンストラクトの場合、HEK293T細胞は、使用されるマーカー遺伝子の存在について、または適切な技術、例えばqPCRによる目的の遺伝子/タンパク質の発現変化によって試験されなければならない。あるいは、トランスフェクションの成功は、上記の技術により、プロトコルの後期のJurkat細胞上のレンチウイルスコレクションの試験中に間接的に確認することができます。
注意:トランスフェクションされたHEK293T細胞は感染性があると考えられており、これらの細胞を取り扱う際には適切な安全対策を講じる必要があります。通常、カテゴリーIIの生物学安全キャビネットの下での作業、二重手袋の使用、消毒のための適切な除染液(廃漂白剤の濃度の増加(2,000ppm)または施設のバイオセーフティガイドラインに従った同等の溶液など)を含む、現地の規則に従う必要があります。レンチウイルス製剤と接触するすべての溶液とプラスチックは、施設のバイオセーフティ手順に従って消毒する必要があります。
3. レンチウイルス粒子の回収
- 除染液、高濃度(2,000ppm)漂白剤(次亜塩素酸ナトリウム)溶液、または施設のバイオセーフティガイドラインに基づく同等の薬剤をバケツに調製し、バイオ安全キャビネットに入れます。
- 空のチューブラックなどの余分なアイテムをすべて取り外して、生物学安全キャビネットを準備します。
- T175 HEK293T細胞フラスコごとに50 mLの遠心チューブを事前に標識し、遠心チューブから蓋を取り外します。チューブを安定したラックに置きます。
- インキュベーターからフラスコを取り出し、488 nmレーザーを搭載した蛍光顕微鏡を使用してGFPの発現を確認します(図1A)。シグナルの強度は、手順と使用するコンストラクトのトランスフェクション効率によって異なります。
- 細胞から培地を標識済みの50 mL遠心チューブに集めます。トランスフェクションされた細胞を入れたT175 HEK293Tフラスコを傾けて、培地がフラスコの底部の角に集まるようにします。25 mLの血清学的ストリペットを使用して、細胞単層を乱さずに培地を回収します。この時点で、一部のフローティング セルが表示される場合があります。培地を清潔な50 mL遠心チューブに移し、蓋を閉めます。
- 25 mLの血清学的ストリペットを使用して、25 mLの新鮮で温かいcDMEMをフラスコに加えます。細胞単層を乱さないように、媒体の流れをフラスコの壁に向けるようにしてください。トランスフェクションしたHEK293T細胞を入れたフラスコをインキュベーター(37°C、5%CO2)に戻します。
注:レンチウイルスの2回目のコレクションとさらなる精製は、上記の手順で概説した手順に従ってさらに24時間後に実行できます。
- 25 mLの血清学的ストリペットを使用して、25 mLの新鮮で温かいcDMEMをフラスコに加えます。細胞単層を乱さないように、媒体の流れをフラスコの壁に向けるようにしてください。トランスフェクションしたHEK293T細胞を入れたフラスコをインキュベーター(37°C、5%CO2)に戻します。
- 24時間または48時間後にレンチウイルスの収集が完了したら、細胞に除染液を追加し、細胞単層を覆うようにします。フラスコを次の24時間水平に保ち、適切なカテゴリーIIの規制に従って廃棄します。
4. レンチウイルスの精製
- ステップ3.5から培地を収集します。
- プランジャーを 50 mL シリンジから取り外し、低タンパク質結合ポリエーテルスルホンまたはポリフッ化ビニリデン 0.45 μm 滅菌フィルターをシリンジの端に挿入します。25 mLの血清学的ストリペットを使用して、ステップ3.5.1で収集した培地をシリンジに加え、プランジャーを静かに戻します。
- プラグをゆっくりと押して、培地をフィルターに通し、新しい50 mL遠心チューブに入れます。流量が大幅に減少する場合は、フィルターを上に向けてシリンジを配置し、プランジャーを十分に引き出してフィルターから媒体を取り除きます。
- シリンジのフィルターを慎重に新しいものと交換し、使用済みのフィルターは除染液に廃棄してください。中程度のろ過を続けます。終了したら、フィルターを水没させ、シリンジに除染液を充填して、フィルターとシリンジを除染します。
- 温度を4°Cに設定して超遠心分離機を予冷し、蓋を閉めて温度が順応するまで待ちます。
- 20%ショ糖溶液(超純水に20%w/v、0.22μmフィルターで滅菌)を3mLの円錐形超遠心チューブの底に加えます。
- 25 mLの血清学的ストリペットを使用して、スクロース層の上にろ過した培地を重ね、層を乱さないように注意します。
- ピペットボーイの最低速度設定を使用してください。円錐形の超遠心チューブを約45°に傾け、ステップ4.1でろ過したレンチウイルス含有培地をチューブ壁にゆっくりと加えます。培地とショ糖が混ざらないようにし、層がはっきりと分離していることを確認してください(図1B)。中層の体積が増加するにつれて、超遠心チューブをゆっくりと傾けて直立位置に戻します。
- 超遠心チューブ内のショ糖と培地を含む総容量が29 mL未満の場合は、スピン中にチューブが崩壊しないように、新しいcDMEMを補充します。複数のT175 mLコレクションの場合は、ろ過した培地調製物を混合し、複数の超遠心チューブを使用します。必要に応じて、最終的な超遠心チューブに培地を補充します。
- 超遠心分離機のバケットが汚れていないことを確認します。バケツの底やキャップに中程度の残留物はありません。必要に応じて、~70%のアルコールで拭き取ってください。各バケツの底に適切なチューブアダプターを入れ(図1C)、超遠心チューブをバケツにゆっくりと下げます。
- バケツをしっかりと閉じ、スピンアウトローターの割り当てられたスペースに吊るします。
- バケットが同じ量のショ糖と培地でバランスが取れていることを確認します。スピンアウトローターは、バケツなしで運転してはなりませんが、反対側のバケツは空のままにすることができます20 (図1D)。
- ローターを超遠心分離機に慎重に挿入し、真空をオンにします。超遠心分離機の加速速度と減速速度を最低に設定し、レンチウイルス調製を85,000 x g で4°Cで90分間実行します。
- 超遠心分離機が必要な速度(約3〜5分)に達するのを待ってから立ち去り、ローターが適切に挿入され、スピンが終了しないことを確認します。
- 超遠心分離機の運転中に、カテゴリーIIの安全要件に従って作業スペースを清掃し、次のステップのためのスペースを準備します。
- スピンが終了したら、バキュームを無効にし、サンプルを乱さないようにローターを慎重に取り外します。
- 超遠心分離機にこぼれがないか調査し、バケツから漏れがないことを確認します。こぼれた場合は、二重手袋をはめ、遠心分離機とバケツの外面を抗ウイルス製品で除染します。
- 超遠心分離機からバケツを取り外し、バケツをカテゴリーIIの生物学安全キャビネットに慎重に輸送します。
注:レンチウイルス粒子は超遠心チューブの底に集まります。ペレットは肉眼では見えません。 - スクロースと培地を1回の滑らかな動きで、除染溶液と一緒に廃棄物容器に直接注ぎます。
- 超遠心チューブを逆さまにした状態で、組織の二重層に移し、10分間乾燥させます。その間に、バケツの内側を水に浸したティッシュで拭き、逆さまにして風乾します。
- 超遠心チューブの縁に残っている液体をティッシュで慎重に乾かしてから、直立させます。ティッシュとその下の表面を消毒します。
- ウイルスペレットを1 mLの無血清培地またはさらなる実験に必要な溶液に再懸濁し、溶液を静かにピペッティングします。カテゴリーIIの生物学安全キャビネット内のRTで15分間放置します。
- 1 mLピペットを使用してレンチウイルス調製物を穏やかに混合してから、1.5 mLスクリュートップチューブ(クライオチューブなど)に分注します。 in vivo 研究用(多重度 100 μL)およびJurkat T細胞のレンチウイルス力価用(1 x 20 μL)用のアリコートを調製します(ステップ5を参照)。
- 凍結融解サイクルは避けてください。レンチウイルス製剤は、-80°Cで最大6ヶ月間保存でき、感染力に悪影響を与えることはありません。
5. Jurkat T細胞におけるレンチウイルス産生の滴定
- 500 mL の RPMI-1640 に 10% (v/v) の子牛胎児血清を補給し、最終濃度 100 U/mL のペニシリン/ストレプトマイシンを補給することにより、Jurkat T 細胞用の完全なロズウェル パーク メモリアル インスティテュート 1640 培地 (cRPMI-1640) を準備します。
- Jurkat T細胞の健康な培養を確保するために、感染前の最大1週間、細胞を培養中に維持してください。
- レンチウイルス滴定の日に、cRPMI-1640のウェルあたり200 μLの2 x 105 細胞/ウェルの24ウェルプレートで生存可能なJurkat T細胞をプレートアウトします。
- 採取したばかりのレンチウイルスを使用するか、20μLの入ったレンチウイルスバイアルを氷上で解凍し、ピペッティングで上下させて穏やかに混合します。
- cRPMI-1640の段階希釈を使用して、0.25 μL、0.5 μL、1 μL、2.5 μL、5 μL、および10 μLのレンチウイルスストックをJurkat T細胞に感染させます。プレートを静かに揺らして、レンチウイルスが均等に分布するようにします。非感染Jurkat T細胞は、ネガティブコントロールとして機能します。
- プレートを37°Cでインキュベートします。 4時間後、各ウェルにcRPMIを合計400 μLまで補充し、プレートを37°Cのインキュベーターに3日間戻します。
- 感染後48時間後、蛍光イメージングシステム下でGFPの発現を確認します。
- 感染の3日後、24ウェルプレートの各ウェルを別々の1.5 mLコレクションチューブに集め、細胞を350 x g 、4°Cで5分間遠心分離します。
- 上清を捨てます。DPBSで2%(w / v)調製した2%パラホルムアルデヒド(PFA)の300μLにペレットを再懸濁し、暗所の氷上に15分間放置します。
- 細胞を350 x g 、4°Cで5分間遠心分離し、ペレットを蛍光活性化セルソーティング(FACS)バッファー(滅菌DPBS + 4% FCS + 1 mM 滅菌EDTA)に再懸濁します。
- フローサイトメトリーを使用して、感染したレンチウイルスとその制御細胞のGFP発現頻度と平均蛍光強度を解析します(図2)。
6. 組織常在性腹膜マクロファージの in vivo レンチウイルス感染
- カテゴリーIIの生物学的安全キャビネットに、必要量のレンチウイルスを含む総容量200μLの無血清培地をインスリン針に装填します(動物福祉と針の体液損失を避けるために、30Gの使い捨て針を使用してください)。
- 片手スクープ技術を使用して、針シースを針に戻します。針を氷の上に置いて、30分以内に注入します。
- 動物施設では、注射前にカテゴリーIIの生物学的安全キャビネットを設置します(図1E)。
- きれいなティッシュペーパーのシートを置きます。レンチウイルスを含むインスリン針の鞘を緩めます。.
- ティッシュの小片とグルコン酸クロルヘキシジンベースの消毒剤が入ったシャーレ、除染液(漂白剤溶液2,000ppm)が入った50mLチューブ、鋭利で安全な容器を準備します。
- 首筋21の皮膚をつかむことでマウスを拘束する。適切に拘束されたマウスは動かず、これは安全のために必要です。
- 腹部を上に向けて、動物の頭を少し下に向けます。レンチウイルスを腹腔の右下象限に腹腔内に注入します。.これは、腹腔臓器への注射を避けるためです。
- マウスを放す前に、シリンジに除染液を入れ、鋭利な金庫に安全に廃棄してください。
- マウスの腹部の注射部位を消毒剤に浸した組織で拭き、動物をケージに戻します。
- レンチウイルスを注入したマウスを、カテゴリーIIのスキャンテーナーまたは個別換気ケージ(IVC)(高効率の空気ろ過を備えた隔離ケージ)に注射後最低72時間収容します。ケージの前面に適切な情報カードを置きます。
- 感染後72時間後にマウスを新しいカテゴリーI保持ケージに移動します(現地の安全承認によります)。マウスを注射から合計3日間毎日監視します。
7. レンチウイルス感染マウスの腹膜細胞の採取
注意:レンチウイルス注射後72時間以内のコレクションについては、施設のカテゴリーIIの生物学的安全規則に従ってください。.レンチウイルス注射後最初の72時間に感染した動物が保管されていた寝床および保持ケージは、施設のカテゴリーII生物学的安全規則に従って除染する必要があります。
- 施設の規制に従って、例えば、増加したCO2濃度を吸入することによりマウスを安楽死させ、続いて子宮頸部脱臼による死亡を確認します。
- マウスの腹部を70%イソプロパノールで洗浄し、慎重に皮膚を切って腹腔膜を露出させます。
- 10 mLのシリンジと23 Gの針を使用して、6 mLの氷冷FACSバッファーで腹腔を洗浄します。.臓器に穴を開けることは避けてください。
- 腹膜を優しくマッサージして、細胞をFACSバッファーに取り除きます。
- 同じ注射器と針を使用して腹液を採取します。
- 針を取り外し、細胞を15 mLの遠心チューブに移します。
- 腹膜洗浄液を氷の上に保ちます。
- 他の必要な臓器を収集し、研究に応じてそれらを保管します。
- 動物の死骸は、地域の動物および安全ガイドラインに従って処分してください。
8. 腹膜細胞の染色と解析
- 腹膜洗浄液を350 x g 、4°Cで5分間遠心分離し、上清を除染液中に捨て、細胞を1 mLのFACS緩衝液に再懸濁します。
- 収集した細胞をカウントし、V底96ウェルプレートでウェルあたり4 x 105 細胞をプレート化します。
- メーカーの指示に従って、固定可能な試薬(例:ここで使用するFixable Near-IR Dead Cell Stain Kit)を使用して生存率染色を行います。
- 細胞が過去72時間以内に感染した場合は、細胞を氷上で2%PFAに15分間固定します。等量の冷たくしたDPBSを添加し、再度350 x g 、4°Cで5分間遠心分離します。
- ブロッキングバッファーを調製する:表面染色用のFACSバッファー中の10%(v/v)ラット血清中の4 μg/mL 2.4G2抗体を混合するか、細胞内染色用の透過化バッファーを混合します。
- 細胞ペレットを含む各ウェルを50 μLのブロッキングバッファーに再懸濁し、4°Cで15分間インキュベートします。
- 各サンプルにつき、50 μLのFACSバッファー(表面染色用)または透過化バッファー(細胞内染色用)のいずれかで抗体ミックスを調製します。各サンプルの最終的な染色量は100 μLで、これにはブロッキングバッファー50 μLが含まれます。それに応じて抗体濃度を計算します(表1)。
- サンプルに50 μLの抗体ミックスを、コントロールサンプルに50 μLのアイソタイプコントロールおよびコントロールバッファーを加えます。サンプルを暗所の氷上で30分間インキュベートします。必要に応じて、未染色の細胞とアイソタイプコントロールを含めます。
- 各ウェルを100〜200 μLの氷冷DPBSで洗浄し、プレートを350 x g 、4°Cで5分間遠心分離します。この手順を繰り返して、結合していない抗体を洗い流します。フローサイトメーターでサンプルを分析します。
9. 臓器からの細胞の抽出
- 臓器あたり1 mLの消化ミックスを調製します:ハンク平衡塩溶液(HBSS)、2 mg / mLコラゲナーゼIV型、および0.03 mg / mL DNase I(肺消化用のヒアルロニダーゼ1.5 mg / mLを含む)を混合します。.
- 採取した臓器を消化液1mLに移し、ハサミでみじん切りにします。
- 40 μmのストレーナで細胞をろ過し、350 x g 、4°C、5分間遠心分離します。
- 肺、脾臓、または肝臓から細胞を単離する場合は、ACK溶解バッファー(150 mM NH4Cl、10 mM KHCO3、0.1 mM Na2EDTA pH = 7.4)を使用して赤血球を溶解します。40 μmのストレーナで細胞をろ過し、350 x g 、4°C、5分間遠心分離します。
- セクション8で説明されているように、細胞を染色および分析します。
結果
完全かつ正しく従うと、このプロトコルは、1回の調製物あたり合計1.5mLの高品質レンチウイルスストックが得られ、この研究で決定された最適な量で12回の in vivo 注射に十分です18。トランスフェクションの成功は、プロトコールの早い段階で評価できます。健康でコンフルエントなHEK293T細胞は、プラスミド中に存在する場合、プラスミドトランスフェクションの48時間後に容易に検出可能なマーカーシグナル(例:この研究で使用したGFP)を示すはずです(図1A)。シグナルの強度が低いこと、細胞が過剰に剥離すること、およびプロトコールの初期段階でのコンフルエンシーが低いことは、細胞死を示している可能性があり、レンチウイルス調製物の収率が低下します。オプションの収集 II (手順 3.5.1.) の前のセルの分離の一部は表示され、予期されます。
このプロトコルでは、レンチウイルス粒子の生成に3つのプラスミドが使用されます:構造HIV-1タンパク質(Gag)をコードするpCMV-ΔR8.91パッケージングプラスミド、アクセサリータンパク質TatおよびRev、および逆転写酵素ポリメラーゼ(Pol)22;CMVプロモーター13の下でVSV-GエンベロープをエンコードするpMD2.G;およびpHR'SIN-cPPT-SEWプラスミド(増強GFPマーカーをコードする)19 をshRNAまたはmicroRNAの発現に応じて修飾します。
レンチウイルス製剤は、その高い感染力のためにJurkat T細胞株で滴定されます23。レンチウイルスの調製が成功すると、わずか5μLの用量で95%を超える感染率を達成します(図2A)。感染細胞の平均蛍光強度は、高用量で増加し続けます(図2B、C)。必要に応じて、統合されたウイルス成分(SFFVプロモーターなど)のリアルタイムPCRを使用してウイルス力価を測定できます。これは、GFP発現細胞の割合と直線的に相関し、GFP MFIと対数的に相関していました(図2D)。コンストラクト、特に大きなインサート24を有するコンストラクトによっては、一部のレンチウイルス調製物は、この研究で使用されたCre−GFPコンストラクトについて実証されたように、Jurkat T細胞において感染力の低下を示すことがある(図2E、F)。このような場合、レンチウイルス粒子の複数の調製物を組み合わせ、1mLに再懸濁することができます。実験の前に、これらの調製物に対する免疫応答を in vivo で検証することをお勧めします。当然のことながら、ここで使用されているVSV-Gの代替侵入受容体を持つレンチウイルス製剤は、細胞上の受容体発現に応じて、Jurkat T細胞株で異なる感染効率を示す可能性があります。滴定に使用される細胞株は、レンチウイルス粒子が細胞に侵入するために使用する受容体を発現し、制限因子25の発現が優先的に欠如するか、または非常に低いように選択されるべきである。
レンチウイルス粒子の産生の成功は、pMφ(CD11b+ F4/80+およびTim4+集団として定義される)18の感染によってさらに証明される(図3A)。100 μL のレンチウイルス製剤(全量 200 μL の無血清培地)の腹腔内注射は、これらの細胞における GFP シグナルの割合と強度が最も高いと判断しました(図 3B、C)。高用量(150 μLおよび200 μLのレンチウイルス製剤)の注射は、pMφのGFP発現に有益な影響を与えませんでした。100 μL レンチウイルスの腹腔内(i.p)注射後 4 時間、3 日後、7 日後、および 14 日目の経時変化実験では、3 日目と 7 日目に GFP 発現常在 pMφ がかなりの割合で存在し、続いて 14 日目に感染集団が消失したことが明らかになりました (図 3D、E)。興味深いことに、GFPを発現するpMφは、GFPマーカーの免疫認識もあって、感染後14日目までにほとんど消失します。実際、T-Reg選択的Foxp3-DTR-eGFPマウスのGFPマーカーを用いたレンチウイルス実験では、少なくとも21日目までは感染した常在pMφの拒絶反応が妨げられます(図3F)。Jurkat細胞での有効性が低下したレンチウイルス製剤の場合、in vivoで予想される感染率を達成するためには、より多くの量が必要になります。しかし、Cre-GFPレンチウイルス調製物で示されたように、コンストラクトの設計によっては、i.p注射後7日目に300μLの用量であっても、不良な結果をもたらす可能性があります(図3G)。私たちはこれまでに、レンチウイルスshRNAを介したMap3k8およびGata6ノックダウン、およびGata6の過剰発現19を含む、マウスpMφのin vivoでの遺伝子の過剰発現およびノックダウンにこのプロトコルを成功裏に使用することを実証しました。ここでは、このプロトコールがマウスマイクロRNA 146b(mmu-miR-146b)の過剰発現や、常在pMφ(図3H、I)のレンチウイルス由来shRNAを用いた細胞間接着分子1(ICAM1、CD54)のノックダウンにもうまく使用できることを示します。
マクロファージなどの初代細胞への感染は、おそらくこれらの細胞に制限因子が存在するため、より高いレンチウイルスのインプットを必要とします。制限因子は、逆転写や統合など、ウイルスのライフサイクルステップを妨害する細胞の自然な保護メカニズムであり、コンストラクトからの遺伝子発現の阻害につながります。
さらに、プロトコールの in vivo での検証では、腹膜免疫細胞の生存率に対するi.p lentivirus送達の影響は示されず(図4A)、常在pMφ亜集団(CD73およびTim4マーカーの発現によって定義される)の明確な感染性が示されました(図4B、C)。重要なことに、生産的なレンチウイルス感染は、チャレンジ後7日後に腸間膜リンパ節(mLN)、肺、肝臓、または脾臓Mφに有意なGFP発現が見られなかったことからも明らかなように、注射部位の常在型Mφに限定されていました(図4D)。多くの場合、炎症条件下でMφの遺伝的標的化を行う必要があることを考慮し、0.1mLの4%チオグリコール酸で腹腔内投与したマウスでこのプロトコルの有効性を調査しました。チオグリコール酸注射は、炎症性単球由来のMφ細胞および単球細胞の流入を引き起こし、これらは5つの異なる集団に分けることができます(図4E)。フローサイトメトリー解析により、単球様細胞(Ly6Chi 集団1および2)のレンチウイルス感染に対する難治性の表現型が明らかになり、ヒト細胞における以前の知見と一致している26。対照的に、常在Mφと単球(グループ3-5)は、最も感染しやすいままでした(図4F)。
詳細なフローサイトメトリー解析により、主に常在性腹膜Mφおよび主要組織適合遺伝子複合体(MHC)クラスII+ 常在型pMφ(MHCII+ F4/80+ Tim4+)(注射後3日目に最大60%)でGFP発現が検出されました(図5A)。骨髄由来の腹膜Mφs/DC(MHCII+、CD11b+、CD11c+)、B細胞(CD19+)、T細胞(CD3+)、肥満細胞(CD11b-、FcεR1+)、好酸球(Siglec-F+)、NK細胞(CD19-、NK1.1+)、好中球(Ly6G+)など、他の腹膜細胞集団ではGFPシグナルはほとんど検出されませんでした(図5A、B)。すべての集団におけるGFP発現の寿命(図5C)は、常在性腹膜Mφ(図1D)のこれに続きました。好中球頻度の一時的な増加は、レンチウイルスの100μL(無血清培地の総量200μL)のi.p注入後4時間後に記録され(図5D)、問題のある動物に早期の軽度の炎症が存在することを示しました。最後に、常在型pMφは、感染後7日目から14日目の間に頻度の大幅な低下を経験しました(図5E)ことから、注射後3日目から7日目までの実験期間が最適であることが示唆されました。

図1:HEK293T細胞におけるレンチウイルス産生(A)トランスフェクション成功48時間後のHEK293T細胞の代表的な免疫蛍光写真(蛍光顕微鏡[488 nm励起ピーク、510 nm発光ピーク]、倍率20倍、スケールバー=400 μm)。(B)20%ショ糖の層(下、透明)とトランスフェクションされたHEK293T細胞から採取した培地の層(上、赤)を含む超遠心コニカルチューブの写真。(C)アダプターを含むバケツに円錐形超遠心分離機を正しく挿入している写真。(D)超遠心ローターの正しいバランスと間違ったバランスを示す写真。(E)Cat IIキャビネットの最適なセットアップと右利きの個人のためのin vivo注射用の材料の写真。この図は、Ipseiz N et al.18の許可を得て変更されています。この図の拡大版を表示するには、ここをクリックしてください。

(A)GFPプラスミドを含むレンチウイルスの増量投与による感染後72時間後のJurkat T細胞の代表的なフローサイトメトリー解析により、GFP+細胞(GFP+)の割合、(B)GFP+細胞の平均蛍光強度(MFI)、および(C)GFP発現の代表的なヒストグラムを示す。(D)MFI(左Y)とGFP発現レンチウイルスに感染した細胞の割合(右Y)とDNAのpgあたりに検出されたウイルスのコピー数(x軸)を示す散布図。(E)最適でないCre-GFPレンチウイルス(Cre-GFP LV)調製および制御GFPレンチウイルス(GFP LV)によるJurkat T細胞感染の代表的なヒストグラム、および(F)Cre-GFPレンチウイルス感染Jurkat T細胞(GFP +)の割合を示す要約データ。この図は、Ipseiz N et al.18の許可を得て変更されています。この図の拡大版を表示するには、ここをクリックしてください。
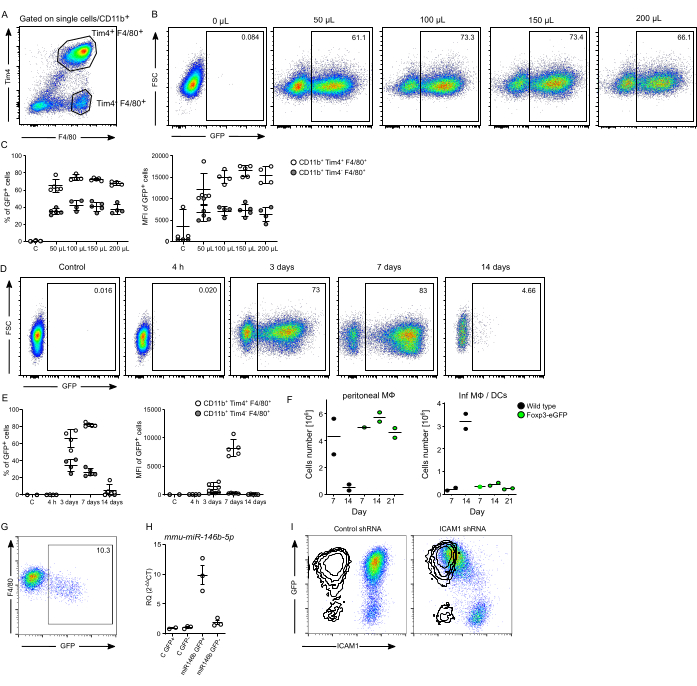
図3:常在型pMФの感染効率。 (A)常在pMφ(CD11b+、Tim4+、F4/80+)およびTim4-、F4/80+細胞のゲーティング戦略。細胞をシングレットでゲーティングし、続いてCD11b+でゲーティングしました。(B)代表的なドットプロット、および(C)異なる量のGFPレンチウイルス調製物を用いたin vivo感染の3日後に単離されたGFP+細胞の感染頻度(%GFP+細胞)および強度(MFI)の要約。(D)代表的なドットプロット、および(E)in vivo感染後の異なる時点で単離されたGFP+細胞の感染頻度(%GFP+細胞)と強度(MFI)の要約 in in vivo by in injection with 100 μL of serum-free media medium in total volume of 200 μL of serum-free medium 。(F)Foxp3-DTR-eGFPマウスにおけるGFP発現レンチウイルスの腹腔内送達後7日目、14日目、および21日目の細胞数の要約で、GFP発現pMφおよび炎症性マクロファージおよび樹状細胞(InfMØs/DCs[F480low])の数を示すもの。(n = グループあたり 1-2)。(G)I.p注射の7日後におけるGata6-KO mye 19常在型pMφと300μLのCre-GFPレンチウイルスの最適でないin vivo感染の代表的なドットプロット。(H)マウスmicroRNA-146b(miR-146b)またはコントロール(C)をコードする100μLレンチウイルスを用いてin vivoで挑戦した常在性腹膜Mφのmmu-miR-146b-5p発現のRT-qPCR定量。常在pMφ(白丸)およびTim4-、F4/80+細胞(灰色の円)。(I)雌129S6マウスのpMφ上で、標的shRNAを標的とするレンチウイルスのi.p注射の7日後に、ICAM1のダウンレギュレーションに成功したことの代表的なドットプロット。コントロールshRNAが示されています。オーバーレイはアイソタイプコントロールを示しています。データは平均±SEM、n≥2マウスで表されます。この図は、Ipseiz N et al.18の許可を得て変更されています。この図の拡大版を表示するには、ここをクリックしてください。

図4:常在pMφ亜集団の感染効率。 (A)100 μLの無血清培地(-)またはGFPレンチウイルス(+)i.p注射の7日後に生存可能な全単一細胞および常在Mφの割合。(B)in vivoで見つかったpMφの4つの主要な集団、CD73+Tim4+、CD73-Tim4-、CD73+Tim4-、CD73-Tim4+、および(C)これらの集団の対応する感染頻度(GFP+細胞の割合)と強度(GFP+細胞のMFI)を示すゲーティング戦略。(D)100μLレンチウイルスi.p注射の7日後の複数の臓器のGFP+細胞の割合。略語:mLN、腸間膜リンパ節。(E)マウスに4%チオグリコール酸0.1mLを5日間i.p.注射した後、レンチウイルスをi.p.注射した。pMφと単球のゲーティング戦略は、レンチウイルスi.p注射後3日後です。(F)GFP+単球(Ly6C+)およびMφ(Ly6C-)の感染頻度、MFI、および細胞数解析。データは平均±SEM、n≥3マウスで表されます。この図は、Ipseiz N et al.18の許可を得て変更されています。この図の拡大版を表示するには、ここをクリックしてください。

図5:腹膜の炎症に対するレンチウイルス注射の影響。 マウスに、レンチウイルスを発現するGFPを in vivo i.p.で注射しました。(A)レンチウイルスをさまざまな量(50 μL、100 μL、150 μL、または200 μL)注射した後の腹腔内の細胞集団の感染頻度。(B)I.p注射後7日目の生産的に感染した細胞集団におけるGFP発現の強度。(C)I.p注射後のさまざまな時点での腹腔内の細胞集団の感染頻度。(D)および(E)i.p注入後のさまざまな時点での細胞の割合。すべてのレンチウイルス注射は、無血清培地培地で完了した同じ総容量 200 μL で行いました。特に指定のない限り、100μLのレンチウイルスを使用しました。対照マウス(「C」)は、200 μLのニート無血清培地を投与されました。データは平均±SEM、n≥3マウスで表されます。この図は、Ipseiz N et al.18の許可を得て変更されています。 この図の拡大版を表示するには、ここをクリックしてください。
| 抗体ターゲット | フルオロフォア | クローン | 使用した希釈 | 最終濃度 [μg/mL] |
| HIV-1コア抗原 | RD1の | FH190-1-1 | 1/100 | 1 |
| アイ・ア・アイ・イー | PerCpCy5.5 | M5/114.15.2 | 1/400 | 0.5 |
| ライ6G | PerCpCy5.5 | 1A8 | 1/400 | 0.5 |
| CD3e | PerCpCy5.5 | 17A2の | 1/200 | 1 |
| CD3e | PE/Cy7 | 500A2の | 1/400 | 0.5 |
| CD11c | PE/Cy7 | N418さん | 1/800 | 0.25 |
| CD11c | BV605 | N418さん | 1/400 | 0.5 |
| CD226 | AF647 | 10 E 5 | 1/400 | 1.25 |
| ティム4 | AF647 | RTM4-54 | 1/600 | 0.83 |
| CD4の | APCの | GK1.5 | 1/400 | 0.5 |
| CD11bの | AF700シリーズ | M1/70 | 1/700 | 0.71 |
| CD11bの | PerCpCy5.5 | M1/70 | 1/400 | 0.5 |
| F4/80 | パシフィックブルー | BM8の | 1/700 | 0.71 |
| F4/80 | BV605 | BM8の | 1/400 | 0.25 |
| F4/80 | BV711 | BM8の | 1/400 | 0.5 |
| CD73の | イーフルオロ450 | タイ/11.8 | 1/400 | 2.5 |
| CD19の | V450の | 1D3 | 1/400 | 0.5 |
| CD19の | APCの | 1D3 | 1/400 | 0.5 |
| CD8aの | イーフルオロ450 | 53-6.7 | 1/400 | 0.5 |
| シグレックF | BV421 | E50-2440 | 1/400 | 0.5 |
| NK1.1 | APC/Cy7 | PK136 | 1/400 | 0.5 |
| FceR1の | イーフルオロ450 | 3月1日 | 1/400 | 0.5 |
| ICAM1の | PEの | 1A29 | 1/100 | 2 |
| ラットIgG1、κアイソタイプコントロール | PEの | 1/100 | 2 |
表1:抗体のリスト
ディスカッション
組織に常在するマクロファージは、その生理学的環境6,7,8,9によって決定されるさまざまな恒常性および炎症性の組織特異的機能1,2を実行します。このプロトコルでは、レンチウイルス粒子を使用してin vivoで腹膜に常在するマクロファージを操作するための効果的な方法18を導入し、それらの生物学的微小環境におけるマクロファージの機能を調査しました。
プロトコールを成功させるためには、健康なHEK293T細胞を使用することが不可欠です。このプロトコールの開始の少なくとも1週間前に細胞を解凍して、細胞の回収率と良好な数を確保することがベストプラクティスです。細胞は、計画されたトランスフェクションの1日前に適切な量の培地に播種し、トランスフェクションの日に約80%のコンフルエントに達する必要があります。細胞調製物がコンフルエントでない、またはコンフルエントすぎると、レンチウイルスの収量が減少します。最良の結果を得るために、メーカーの指示に従ってトランスフェクション試薬を使用してHEK293T細胞をトランスフェクションすることをお勧めします。トランスフェクションの重要なステップには、プラスミドと試薬の適切な混合、およびHEK293T細胞単層への混合物の直接の滴下添加が含まれます。HEK293T細胞27,28のリン酸カルシウムトランスフェクションは、このプロトコルにおいて用いることができる。ただし、この方法の有効性はさまざまであり、トランスフェクション効率が低下する可能性があることに留意する必要があります。
HEK293T細胞トランスフェクションの日から、プロトコールでは安全上の注意を考慮する必要があります。これには、カテゴリーIIの安全キャビネットでの作業、汚染物の取り扱い時に二重手袋を着用すること、汚染物の適切な漂白(除染液、例えば2,000ppmの漂白剤溶液を使用)を最低4時間行うことが含まれます。ユーザーは、カテゴリーIIの病原体および廃棄物の取り扱いに関する機関の規制を参照する必要があります。
このプロトコルでは、レンチウイルス調製物を最初に0.45μmフィルターを使用して精製し、細胞の破片HEK293T除去します。より小さなフィルター(0.22 μm)やセルロースエステルメンブレンの使用は、レンチウイルス粒子の損失につながるため、避けるべきです。低タンパク質結合性ポリエーテルスルホンまたはポリフッ化ビニリデンフィルター29を使用することが推奨される。第2の精製ステップは、超遠心分離機で単一の20%スクロース層に対して実行され、残りの不純物を除去しますが、これはレンチウイルス調製物の in vivo 投与の結果としての特に重要です。超遠心分離機が利用できない施設では、他の30 機関が標準的な実験室用遠心分離機を使用したショ糖ベースのレンチウイルス精製について説明しています。これは、代替としてこのプロトコルに実装できます。レンチウイルス調製物は、マーカーシグナル(例えば、このプロトコルで使用されるGFP)の発現について、Jurkat T細胞で滴定されます。マーカーのないコンストラクトの場合、物理的なレンチウイルス粒子は、ELISAキット31によるHIV−1 p24gagタンパク質の定量化、HIV−1コア抗原18のフローサイトメトリー分析、または標的遺伝子への変化の測定(例えば、フローサイトメトリーまたは顕微鏡法など、個々の細胞の変化の測定を可能にする方法を優先的に使用)によって評価することができる。Jurkat T細胞でコントロールとレンチウイルスの滴定が大きく異なる場合、 in vivo 研究に使用される容量を調整して、レンチウイルス製剤間で最も同等の感染に到達することができます。
プロトコルの主な制限は、i.p lentivirus注射から14日以内にGFP + 常在腹膜Mφの観察された消失です。長期研究のためには、特定の細胞型または組織に安定した遺伝的変化を有するマウス系統を考慮すべきである32。例えば、腹膜マクロファージはFoxp3(T-Regタンパク質)を発現しないため、Foxp3-DTR-eGFPマウス33 を用いて、感染後21日で腹膜MφでGFPの発現が維持されることを確認した(図3F)。ただし、レンチウイルスには他の外来成分が含まれており、Foxp3-DTR-GFPマウスの感染細胞の持続性のこの延長は永続的ではない可能性があることに注意することが重要です。この方法のさらなる弱点は、注入後4時間での好中球の流入によって見られるように、レンチウイルス注射後の腹腔内で観察できる低レベルの炎症であり(図5D)、これは、感染を繰り返すと、GFP発現する常在性腹膜Mφの炎症関連損失が加速することを意味する可能性があります。腹腔内でI型インターフェロン(IFN)は検出されていませんが、VSV-G疑似型レンチウイルス粒子は、検出可能なIFNがない場合にヒトMφでIFN刺激遺伝子の一部を誘導することが以前に実証されました34。このことは、抗ウイルス免疫応答を調査する実験にこのプロトコルを使用する際に考慮する必要があります。レンチウイルス製剤のi.p注射後の急性および持続的な炎症の発生は、製剤の汚染を示している可能性があります。.
トラブルシューティングの領域には、1)レンチウイルス力価が低い場合、HEK293T細胞の健康状態と効果的なトランスフェクション(例:HEK293T細胞にマーカー発現が存在する場合)を確認します。感染率が低いままの場合は、コンストラクトのサイズを考慮してください。より大きなインサートまたはより複雑な二次構造を持つコンストラクトは、最終的なレンチウイルスの力価と感染性に影響を与える可能性があります24。したがって、各コンストラクトは独立して、それぞれの制御ベクトルと並行してテストする必要があります。2)レンチウイルスを大量に必要とする場合は、HEK293T細胞のT175フラスコを複数調製し、それに応じて生産をスケールアップすることをお勧めします。レンチウイルス製剤のばらつきを避けるために、分注および保存する前に最終コレクションを統合することがベストプラクティスです。このような大規模な生産では、プラスミドミックス(セクション2)を50 mLチューブで調製し、成分の効果的な混合を確保する必要があります。
その広範な指向性にもかかわらず、VSV-G偽型レンチウイルス粒子は、以前に肺胞35で実証されたように、主に組織マクロファージを標的とし、ここではpMФに対して、それぞれの経路で投与された場合に標的となります。レンチウイルス粒子のエンベロープの変更は、場合によっては、in vivoでのマクロファージの形質導入の減少をもたらす可能性があり36、このプロトコルには不要です。マクロファージにおけるin vivo遺伝子操作のための他のウイルスアプローチ(37の文献でレビュー)と比較して、レンチウイルスベクターの使用は、組織マクロファージ35における導入遺伝子の安定した統合、効率的な導入遺伝子発現、および最大のベクターサイズ制限(約8Kb)を提供する。
腹膜Mφは、腹部がん、膵炎、腹膜炎などのさまざまな疾患の予防、発症、進行、および解決に重要な役割を果たします38。このプロトコルは、マウスpMφの遺伝子改変に効果的なツールであり、生理学的に関連する微小環境内でこれらの病状の背後にある生物学的プロセスを調査することを可能にします。レンチウイルスベクター自体が臨床介入の関心ツールになりつつある一方で、免疫不全ウイルスに由来し、安定したゲノム統合があるため、安全性への懸念が治療の実施を妨げています。レンチウイルス遺伝子調節に対するマクロファージの応答についてさらに理解することで、この非常に効果的なツールの臨床現場での応用が進む可能性があります。
開示事項
著者は何も開示していません。
謝辞
この研究は、全体的または部分的に、Wellcome Trust Investigator Award [107964/Z/15/Z] によって資金提供されました。PRTは、英国認知症研究所の支援も受けています。M.A.C.は、Biotechnology and Biological Sciences Research Council Discovery Fellowship(BB/T009543/1)の支援を受けています。オープンアクセスの目的で、著者は、この提出から生じる著者受理原稿バージョンにCC BY公開著作権ライセンスを適用しています。L.C.D.は、スウォンジー大学の講師であり、カーディフ大学の名誉研究員です。この研究は、Ipseiz et al. 2020,18.
資料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1x) (Trypsin 500 mg/L or 0.02 mM) | Thermo Fisher Scientific | 25300054 | |
| 0.22 μm sterile millex GP filter | Merck | SLGS033SS | |
| 0.45 μm sterile millex GP filter | Merck | SLHP033RS | |
| 0.5 mL U-100 insulin syringe with needle, 0.33 mm x 12.7 mm (29 G) | BD | 324892 | |
| 1 Litre Sharps Container | N/A | N/A | |
| 2.4G2 antibody (TruStain FcX anti-mouse CD16/32) | Biolegend | 101320 | |
| 40 μm strainer | Thermo Fisher Scientific | 22363547 | |
| AimV medium (research grade), AlbuMax Supplement | Thermo Fisher Scientific | 31035025 | |
| Blocking buffer | prepared in house | ||
| Brewer thioglycolate medium | Sigma-Aldrich | B2551 | 4% stock solution prepared in water, autoclaved and kept frozen. |
| CD11b | Biolegend | 101222 | Refer to Table 1 for the dilution and concentration |
| CD11b | BD | 550993 | Refer to Table 1 for the dilution and concentration |
| CD11c | Biolegend | 117317 | Refer to Table 1 for the dilution and concentration |
| CD11c | Biolegend | 117333 | Refer to Table 1 for the dilution and concentration |
| CD19 | BD | 560375 | Refer to Table 1 for the dilution and concentration |
| CD19 | Biolegend | 152410 | Refer to Table 1 for the dilution and concentration |
| CD226 | Biolegend | 128808 | Refer to Table 1 for the dilution and concentration |
| CD3e | BD | 560527 | Refer to Table 1 for the dilution and concentration |
| CD3e | Biolegend | 152313 | Refer to Table 1 for the dilution and concentration |
| CD4 | Biolegend | 100412 | Refer to Table 1 for the dilution and concentration |
| CD73 | eBioscience | 16-0731-82 | Refer to Table 1 for the dilution and concentration |
| CD8a | eBioscience | 48-0081-82 | Refer to Table 1 for the dilution and concentration |
| Cell culture flask (T175 fask, 175 cm2, 550 mL) | Greiner Bio One | 658175 | |
| Centrifuge tubes, conical bottom tubes 25 mm x 89 mm | Beckman Coulter | 358126 | |
| Centrifuges | Beckman Coulter | Ultracentrifuge and TC centrifuge | |
| Collagenase type IV | Sigma-Aldrich | C5138 | |
| Conical centrifuge tubes (15 mL and 50 mL) | Greiner Bio One | 11512303 & 11849650 | |
| Cryotubes | Greiner Bio One | 123277 | or cryotubes |
| DMEM medium (1x) + 4.5g/L D-glucose, 400 µM L-glutamine | Thermo Fisher Scientific | 41965-062 | |
| Dnase I | Sigma-Aldrich | 11284932001 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| F4/80 | Biolegend | 123123 | Refer to Table 1 for the dilution and concentration |
| F4/80 | Biolegend | 123133 | Refer to Table 1 for the dilution and concentration |
| F4/80 | Biolegend | 123147 | Refer to Table 1 for the dilution and concentration |
| FceR1 | eBioscience | 48-5898-80 | Refer to Table 1 for the dilution and concentration |
| Fetal calf serum (FCS) | Thermo Fisher Scientific | 10270-106 | heat inactivated for 30 min at 56 °C and sterile filtered through 0.22 μm filter |
| Flow cytometer | Thermo Fisher Scientific | Attune NxT | |
| Flow cytometry (FACS) buffer | prepared in house | ||
| Fluorescent tissue culture microscope | Thermo Fisher Scientific | EVOS FL | |
| Forceps | N/A | N/A | User preference |
| Hank's balanced salt solution (HBSS) | Gibco, Life Technologies | 14175-053 | |
| HEK293T cell line | grown for at least a week prior transfection. Mycoplasma free | ||
| HIV-1 Core antigen | Beckman Coulter | 6604667 | |
| Hyaluronidase | Sigma-Aldrich | H3506 | |
| Hydrex surgical scrub, chlorhexiding gluconate 4% w/v skin cleanser | Ecolab | 3037170 | |
| I-A/I-E | Biolegend | 107625 | Refer to Table 1 for the dilution and concentration |
| ICAM1 | Becton Dickinson | 554970 | Refer to Table 1 for the dilution and concentration |
| Jurkat T cell line | grown for at least a week prior use. Mycoplasma free | ||
| LIVE/DEAD fixable near-IR dead cell stain kit | Thermo Fisher Scientific | L34975 | |
| Ly6G | Biolegend | 127615 | Refer to Table 1 for the dilution and concentration |
| Mice | here used C57BL/6 females, aged 8-12 weeks (Charles Rivers), unless specified differently | ||
| Microcapillary pipettes (volume range 0.5-1,000 μL) | Fisher Scientific & Starlab | 11963466 & 11943466 & 11973466 & S1111-3700 | |
| NK1.1 | Biolegend | 108724 | Refer to Table 1 for the dilution and concentration |
| Paraformaldehyde | Sigma-Aldrich | P6148-500G | prepared to 2% w/v in PBS |
| pCMV-ΔR8.91 packaging plasmid | Zuffrey, R., et al. 1997 | encodes Gag-Pol HIV protein driven by cytomegalovirus promoter. Ampicilin resistance. | |
| Penicillin/Streptomycin (100x, 10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Petri dish | Greiner Bio One | 664160 | |
| pHR'SIN-cPPT-SEW plasmid | Rosas, M. et al. 2014 | modified for shRNA and miR expression studies. Encodes EGFP marker downstream SFFV promoter and upstream of the Woodchuck hepatitiv virus enhancer. Ampicilin resistance. | |
| pMD2.G plasmid | Naldini, L. et al. 1996 | encodes vesicular stomatis virus g-glycoprotein (VSV-G) envelope. Ampicilin resistance. | |
| Rat IgG1, κ isotype control | Becton Dickinson | 550617 | Refer to Table 1 for the dilution and concentration |
| Rat serum | Sigma-Aldrich | R9759-10ML | |
| Red blood ACK lysis buffer | prepared in house | ||
| RPMI 1640 medium (1x) + 400 uM L-glutamine | Thermo Fisher Scientific | 21875-091 | |
| Saponin | Sigma-Aldrich | S4521 | |
| SiglecF | BD | 562681 | Refer to Table 1 for the dilution and concentration |
| Sodium hypochlorite Tablets (bleach, 2,000 ppm) | Guest Medical | H8818 | |
| Sterile 24-well cell culture plate | Greiner Bio One | 662160 | |
| Sterile Dulbecco's PBS (DPBS) (1x) Mg++ and Ca2+ - free | Thermo Fisher Scientific | 14190144 | |
| Sterile EDTA | Thermo Fisher Scientific | 15575020 | |
| Sterile VWR disposable transfer pipets (23.0 mL, 30 cm) | VWR | 612-4515 | |
| Sucrose | Thermo Fisher Scientific | 15503022 | |
| surgical scissors | N/A | N/A | User preference |
| Syringes (50 mL and 1 0mL) | Fisher Scientific | 10084450 & 768160 | |
| Tim4 | Biolegend | 130007 | Refer to Table 1 for the dilution and concentration |
| U-bottom 96-well cell culture plate | Greiner Bio One | 650180 |
参考文献
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Jantsch, J., Binger, K. J., Muller, D. N., Titze, J. Macrophages in homeostatic immune function. Front Physiol. 5, 146(2014).
- Wynn, T. A., Vannella, K. M. Macrophages in tissue repair, regeneration, and fibrosis. Immunity. 44 (3), 450-462 (2016).
- Ginhoux, F., Guilliams, M. Tissue-resident macrophage ontogeny and homeostasis. Immunity. 44 (3), 439-449 (2016).
- Epelman, S., Lavine, K. J., Randolph, G. J. Origin and functions of tissue macrophages. Immunity. 41 (1), 21-35 (2014).
- Amit, I., Winter, D. R., Jung, S. The role of the local environment and epigenetics in shaping macrophage identity and their effect on tissue homeostasis. Nat Immunol. 17 (1), 18-25 (2016).
- Gosselin, D., et al. Environment drives selection and function of enhancers controlling tissue-specific macrophage identities. Cell. 159 (6), 1327-1340 (2014).
- Lavin, Y., et al. Tissue-resident macrophage enhancer landscapes are shaped by the local microenvironment. Cell. 159 (6), 1312-1326 (2014).
- Davies, L. C., et al. Peritoneal tissue-resident macrophages are metabolically poised to engage microbes using tissue-niche fuels. Nat Commun. 8 (1), 2047(2017).
- Shi, J., Hua, L., Harmer, D., Li, P., Ren, G. Cre driver mice targeting macrophages. Methods Mol Biol. 1784, 263-275 (2018).
- Wang, X., et al. Recent advances in lentiviral vectors for gene therapy. Sci China Life Sci. 64 (11), 1842-1857 (2021).
- Kosaka, Y., et al. Lentivirus-based gene delivery in mouse embryonic stem cells. Artif Organs. 28 (3), 271-277 (2004).
- Naldini, L., et al. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272 (5259), 263-267 (1996).
- Yamashita, M., Emerman, M. Capsid is a dominant determinant of retrovirus infectivity in nondividing cells. J Virol. 78 (11), 5670-5678 (2004).
- Wilson, A. A., et al. Lentiviral delivery of RNAi for in vivo lineage-specific modulation of gene expression in mouse lung macrophages. Mol Ther. 21 (4), 825-833 (2013).
- Burns, J. C., Friedmann, T., Driever, W., Burrascano, M., Yee, J. K. Vesicular stomatitis virus G glycoprotein pseudotyped retroviral vectors: concentration to very high titer and efficient gene transfer into mammalian and nonmammalian cells. Proc Natl Acad Sci U S A. 90 (17), 8033-8037 (1993).
- Finkelshtein, D., Werman, A., Novick, D., Barak, S., Rubinstein, M. LDL receptor and its family members serve as the cellular receptors for vesicular stomatitis virus. Proc Natl Acad Sci U S A. 110 (18), 7306-7311 (2013).
- Ipseiz, N., et al. Effective in vivo gene modification in mouse tissue-resident peritoneal macrophages by intraperitoneal delivery of lentiviral vectors. Mol Ther Methods Clin Dev. 16, 21-31 (2020).
- Rosas, M., et al. The transcription factor Gata6 links tissue macrophage phenotype and proliferative renewal. Science. 344 (6184), 645-648 (2014).
- BeckmanCoulter. , https://www.mybeckman.uk/resources/technologies/centrifugation/principles/rotor-balancing (2023).
- JoVE Science Education Database. Lab Animal Research. Rodent Handling and Restraint Techniques. , JoVE, Cambridge, MA. (2023).
- Zufferey, R., Nagy, D., Mandel, R. J., Naldini, L., Trono, D. Multiply attenuated lentiviral vector achieves efficient gene delivery in vivo. Nat Biotechnol. 15 (9), 871-875 (1997).
- Nasri, M., Karimi, A., Allahbakhshian Farsani, M. Production, purification and titration of a lentivirus-based vector for gene delivery purposes. Cytotechnology. 66 (6), 1031-1038 (2014).
- Optimized production and concentration of lentiviral vectors containing large inserts. J Gene Med. al Yacoub, N., Romanowska, M., Haritonova, N., Foerster, J. 9 (7), 579-584 (2007).
- Malim, M. H., Bieniasz, P. D. HIV restriction factors and mechanisms of evasion. Cold Spring Harb Perspect Med. 2 (5), a006940(2012).
- Sonza, S., et al. Susceptibility of human monocytes to HIV type 1 infection in vitro is not dependent on their level of CD4 expression. AIDS Res Hum Retroviruses. 11 (7), 769-776 (1995).
- Kingston, R. E., Chen, C. A., Rose, J. K. Calcium phosphate transfection. Curr Protoc Mol Biol. Chapter 9, Unit 9.1(2003).
- Brown, L. Y., Dong, W., Kantor, B. An Improved protocol for the production of lentiviral vectors. STAR Protoc. 1 (3), 100152(2020).
- Moce-Llivina, L., Jofre, J., Muniesa, M. Comparison of polyvinylidene fluoride and polyether sulfone membranes in filtering viral suspensions. J Virol Methods. 109 (1), 99-101 (2003).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Sci Rep. 5, 13875(2015).
- Czubala, M. A., et al. TGFbeta induces a SAMHD1-independent post-entry restriction to HIV-1 infection of human epithelial langerhans cells. J Invest Dermatol. 136 (10), 1981-1989 (2016).
- Bouabe, H., Okkenhaug, K. Gene targeting in mice: a review. Methods Mol Biol. 1064, 315-336 (2013).
- Kim, J. M., Rasmussen, J. P., Rudensky, A. Y. Regulatory T cells prevent catastrophic autoimmunity throughout the lifespan of mice. Nat Immunol. 8 (2), 191-197 (2007).
- Decalf, J., et al. Sensing of HIV-1 entry triggers a Type I Interferon response in human primary macrophages. J Virol. 91 (15), e00147-e00217 (2017).
- Wilson, A. A., et al. Amelioration of emphysema in mice through lentiviral transduction of long-lived pulmonary alveolar macrophages. J Clin Invest. 120 (1), 379-389 (2010).
- Markusic, D. M., van Til, N. P., Hiralall, J. K., Elferink, R. P., Seppen, J. Reduction of liver macrophage transduction by pseudotyping lentiviral vectors with a fusion envelope from Autographa californica GP64 and Sendai virus F2 domain. BMC Biotechnol. 9, 85(2009).
- Burke, B., Sumner, S., Maitland, N., Lewis, C. E. Macrophages in gene therapy: cellular delivery vehicles and in vivo targets. J Leukoc Biol. 72 (3), 417-428 (2002).
- Bain, C. C., Jenkins, S. J. The biology of serous cavity macrophages. Cell Immunol. 330, 126-135 (2018).
- Milone, M. C., O'Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved