Method Article
小鼠 体内 腹膜腔组织驻留巨噬细胞高效基因和 MicroRNA 调控的慢病毒载体制备
摘要
我们展示了使用慢病毒载体在 体内研究腹膜组织驻留巨噬细胞基因功能的分步方案。
摘要
腹膜组织驻留巨噬细胞在维持体内平衡方面具有广泛的功能,并参与局部和邻近组织的病理。它们的功能由微环境线索决定;因此,必须研究它们在 体内生理 生态位中的行为。目前,特定的腹膜巨噬细胞靶向方法采用全小鼠转基因模型。在这里,描述了一种使用慢病毒 颗粒在腹 膜巨噬细胞中有效调节 mRNA 和小 RNA 种类(例如,microRNA)表达的方案。在HEK293T细胞中制备慢病毒制剂,并在单个蔗糖层上纯化。腹膜内注射后慢病毒有效性的 体内 验证显示,巨噬细胞的主要感染仅限于局部组织。在体内平衡和巯基乙酸盐诱导的腹膜炎期间,靶向腹膜巨噬细胞是成功的。讨论了该方案的局限性,包括由慢病毒腹膜内递送诱导的低水平炎症和潜在实验的时间限制。总体而言,本研究提出了一种快速且可访问的方案,用于快速评估 体内腹膜巨噬细胞的基因功能。
引言
组织驻留巨噬细胞 (Mφ) 是吞噬免疫细胞的异质性群体,可感知并响应入侵的病原体 1,2。此外,它们在组织发育、重塑和维持体内平衡中起着重要作用 1,3。许多组织 Mφ 来自胚胎发生过程中的卵黄囊祖细胞,并在整个生命过程中持续存在于组织中 4,5。这些细胞的表型和功能由特定转录因子和局部微环境的协作和分层相互作用决定 6,7,8,9。对这种依赖性的日益了解增加了对其生理相关生态位内 Mφ 基因操作的有效体内方法的需求。
慢病毒载体是体内特定细胞群中核酸操作的常用工具 10,11,12,特别是因为它们能够感染分裂和非分裂细胞并稳定整合到宿主基因组中13,14。在过去的二十年中,慢病毒递送技术得到了优化,并且已经研究了替代包膜和合成启动子,以增加谱系特异性靶向 8,15。由于其广泛的细胞嗜性,水泡性口炎病毒包膜糖蛋白 (VSV-G)16,17 已成为慢病毒技术中使用的"金标准"包膜。
在该方案18 中,采用 VSV-G 假型慢病毒颗粒来证明短发夹 RNA (shRNA) 和 microRNA (miR) 在稳态下在 体内 靶向和有效地递送到小鼠腹膜 Mφ (pMφ)19。转基因表达由脾病灶形成病毒 (SFFV) 启动子驱动。通过慢病毒衍生的增强型绿色荧光蛋白 (GFP) 的表达来定义细胞的生产性感染。利用这种方法可以轻松读取 体内 慢病毒实验,以确定最佳剂量和实验时间范围。最后,在巯基乙酸盐诱导的炎症期间小鼠的 体内 慢病毒攻击揭示了选择性 pMφ 感染的自然倾向。
研究方案
所有动物工作均按照机构和英国内政部的指导方针进行。
注意 :所有慢 病毒体内研究都应根据当地和国家关于在研究中道德使用动物的指导方针进行,并遵守与使用 II 类传染性材料相关的所有规定。还应根据当地法规监控动物福利。在协议的这一步中,使用慢病毒颗粒和尖锐物时需要格外小心。
1. 制备用于转染的 HEK293T 细胞
注:在无菌组织培养生物安全柜下执行这些步骤。
- 通过将 450 mL DMEM 与 10% (v/v) 胎牛血清 (50 mL) 和终浓度为 100 U/mL 青霉素/链霉素混合,制备用于 HEK293T 细胞的 Dulbecco 改良 Eagle 完全培养基 (cDMEM)。
- 在计划转染前至少 1 周解冻 HEK293T 细胞。保持健康的生长条件,每 2-3 天使用胰蛋白酶 + EDTA 传代一次,将细胞从培养瓶中分离出来。
- 转染前一天,小心地从细胞中吸出生长培养基,并用无菌 DPBS 轻轻洗涤细胞。向培养瓶中加入 1-5 mL 胰蛋白酶,并在 37 °C 下在 5% CO2 培养箱中孵育 2-5 分钟。
- 加入 5-10 mL cDMEM,并以 350 x g 的离心方式旋转细胞 5 分钟。去除液体并将细胞沉淀重悬于 10 mL cDMEM 中。对细胞进行计数,并在 20 mL cDMEM 中接种每个 T175 培养瓶 10-11 x 106 个 HEK293T 活细胞。
- 在 37 °C 下在 5% CO2 培养箱中孵育过夜,以使HEK293T细胞达到 70%-80% 汇合。
- 第二天,在光学显微镜下确认细胞的汇合度。
- 用 25 mL 血清条纹从培养瓶中取出培养基,而不会干扰细胞单层。
- 轻轻加入 10 mL DPBS 并摇动板以洗涤细胞,注意不要干扰细胞单层。
- 用 25 mL 血清条纹去除 DPBS。
- 在每个 T175 培养瓶的壁上加入 15 mL 新的 cDMEM,以免干扰细胞单层,并将板放回 37 °C 的培养箱中。
2. 使用非脂质体脂质体转染试剂转染 HEK293T 细胞
- 在 15 mL 离心管中,制备慢病毒组分:2 μg 慢病毒质粒、1.5 μg pΔ8.91 (pCMV-Δ8.91) 和 1 μg pMD2.G (pCMV-MD2.G) 和缓冲液 EC(转染试剂盒),最终体积为 600 μL。
- 加入 36 μL 增强剂溶液。使用 1 mL 移液器混合组分,反复吸取一部分液体并将其直接滴回剩余的溶液上。在室温 (RT) 下放置 5 分钟。
- 加入 120 μL 转染试剂,按上述方式混合约 20 次。在 RT 孵育 10 分钟。
- 加入 5.2 mL cDMEM,如上所述与 5 mL 血清条纹混合。
- 使用一次性移液管,将转染混合物直接滴加到HEK293T细胞单层上(避开培养瓶壁),将混合物涂抹在培养瓶的不同位置。
- 通过轻轻地左右摇动培养瓶来分布质粒。避免让任何液体进入培养瓶盖。
- 将培养瓶在 37 °C 下在 5% CO2 培养箱中孵育 48 小时。在细胞成像荧光显微镜下监测转染后 24 小时内,通过荧光标记物(此处为 GFP)的出现确认HEK293T细胞的有效转染。
注:对于没有荧光标记物的构建体,必须通过适当的技术(例如 qPCR)检测HEK293T细胞是否存在所用标记基因或通过目标基因/蛋白质的表达变化。或者,在实验步骤的后期阶段,在测试慢病毒收集的 Jurkat 细胞期间,可以通过上述技术间接验证成功的转染。
注意:转染的 HEK293T 细胞被认为具有传染性,在处理这些细胞时应采取适当的安全预防措施。应遵循当地规则,通常包括在 II 类生物安全柜下工作、使用双层手套以及适当的消毒去污溶液,例如,根据机构生物安全指南增加废弃漂白剂 (2,000 ppm) 或等效溶液的浓度。所有与慢病毒制剂接触的溶液和塑料都应根据机构生物安全程序进行消毒。
3. 慢病毒颗粒的收集
- 根据机构生物安全指南,在桶中准备去污溶液、高浓度 (2,000 ppm) 漂白剂(次氯酸钠)溶液或等效剂,并将其放入生物安全柜中。
- 通过移除任何多余的物品(例如空试管架等)来准备生物安全柜。
- 每个 T175 HEK293T 细胞培养瓶预先标记 50 mL 离心管,然后取下离心管的盖子。将试管放在稳定的架子上。
- 从培养箱中取出培养瓶,并使用带有 488 nm 激光的荧光显微镜确认 GFP 表达(图 1A)。信号的强度取决于程序和所用构建体的转染效率。
- 将细胞中的培养基收集到预先标记的 50 mL 离心管中。倾斜装有转染细胞的 T175 HEK293T培养瓶,使培养基聚集在培养瓶的底角。使用 25 mL 血清条纹,在不干扰细胞单层的情况下收集培养基。此时可能会看到一些浮动单元格。将培养基转移至干净的 50 mL 离心管中,然后盖上盖子。
- 使用 25 mL 血清学条带,向培养瓶中加入 25 mL 新鲜、温暖的 cDMEM。确保将培养基流引导到培养瓶壁上,以免干扰细胞单层。将装有转染HEK293T细胞的培养瓶放回培养箱(37 °C,5% CO2 )。
注意:按照上述步骤中概述的程序,可以在额外 24 小时后进行第二次慢病毒收集和进一步纯化。
- 使用 25 mL 血清学条带,向培养瓶中加入 25 mL 新鲜、温暖的 cDMEM。确保将培养基流引导到培养瓶壁上,以免干扰细胞单层。将装有转染HEK293T细胞的培养瓶放回培养箱(37 °C,5% CO2 )。
- 当慢病毒收集在 24 小时或 48 小时后完成时,向细胞中加入去污溶液,确保其覆盖细胞单层。在接下来的 24 小时内保持烧瓶水平,然后按照适当的 II 类规定丢弃。
4. 慢病毒的纯化
- 过滤器收集步骤 3.5 中的培养基。
- 从 50 mL 注射器中取出柱塞,将低蛋白结合聚醚砜或聚偏二氟乙烯 0.45 μm 无菌过滤器插入注射器端。使用 25 mL 血清条带,将步骤 3.5.1 中收集的培养基添加到注射器中,然后轻轻放回柱塞。
- 缓慢推动塞子,使培养基通过过滤器进入新的 50 mL 离心管中。如果流量明显减少,请将注射器置于过滤器朝上的位置,并拉出柱塞,以清除过滤器中的介质。
- 小心地将注射器上的过滤器更换为新的过滤器,并将用过的过滤器丢弃在去污溶液中。继续培养基过滤。完成后,将过滤器浸入过滤器中,并将去污溶液填充注射器,对过滤器和注射器进行去污。
- 将温度设置为 4 °C 以预冷超速离心机,然后盖上盖子以让温度适应。
- 将 3 mL 20% 蔗糖溶液(20% w/v 超纯水溶液,使用 0.22 μm 过滤器过滤灭菌)添加到锥形超速离心管底部。
- 使用 25 mL 血清条纹,将过滤后的培养基覆盖在蔗糖层的顶部,注意不要干扰各层。
- 使用 Pipette boy 上的最低速度设置。将锥形超速离心管倾斜至约 45°,然后将步骤 4.1 中过滤的含慢病毒的培养基缓慢添加到管壁上。确保培养基和蔗糖不混合,并且可以看到层的清晰分离(图 1B)。随着培养基层体积的增加,慢慢将超速离心管倾斜回直立位置。
- 如果超速离心管中的总体积(包括蔗糖和培养基)小于 29 mL,请加满新鲜的 cDMEM,以避免离心管在离心过程中塌陷。对于多次 T175 mL 收集,混合过滤后的培养基制剂并使用多个超速离心管。根据需要用培养基加满最终的超速离心管。
- 确保超速离心机桶清洁;桶底部或瓶盖上没有介质残留物。如果需要,用 ~70 % 的酒精擦去。将适当的管适配器放在每个桶的底部(图 1C),然后轻轻地将超速离心管放入桶中。
- 牢固地关闭桶,并将它们挂在旋出转子上分配的空间上。
- 确保桶与相同体积的蔗糖和培养基平衡。旋出转子绝不能在没有桶的情况下运行,尽管相对的桶可能留空20 (图 1D)。
- 小心地将转子插入超速离心机并打开真空。将超速离心机加速和减速速率设置为最低设置,并在 4 °C 下以 85,000 x g 的速度运行慢病毒制备物 90 分钟。
- 等待超速离心机达到所需速度(约 3-5 分钟)后再离开,以确保转子正确插入且离心不会终止。
- 在超速离心机运行时,根据 II 类安全要求清理工作区,并为后续步骤准备空间。
- 离心完成后,关闭真空并小心地取下转子,以免干扰样品。
- 检查超速离心机是否有任何溢出,并确认吊篮没有泄漏。如果溢出,请戴上双层手套,并用抗病毒产品对离心机和桶的外表面进行消毒。
- 从超速离心机中取出吊篮,小心地将吊篮运送到 II 类生物安全柜中。
注:慢病毒颗粒聚集在超速离心管的底部。肉眼看不到颗粒。 - 将蔗糖和培养基平稳地直接倒入装有去污溶液的废液容器中。
- 保持超速离心管倒置,将其转移到双层组织中并干燥 10 分钟。同时,用浸水的纸巾擦拭桶的内部,然后倒置风干。
- 在将超速离心管直立之前,小心地擦干带有组织超速离心管边缘的任何残留液体。对纸巾和下面的表面进行消毒。
- 通过轻轻上下吹打溶液,将病毒沉淀重悬于 1 mL 无血清培养基或进一步实验所需的溶液中。在 II 类生物安全柜内的 RT 中放置 15 分钟。
- 使用 1 mL 移液管轻轻混合慢病毒制剂,然后分装到 1.5 mL 螺口管(例如冻存管)中。准备用于 体内 工作(倍数为 100 μL)和 Jurkat T 细胞中慢病毒滴度的等分试样 (1 x 20 μL)(参见步骤 5)。
- 避免冻融循环;慢病毒制剂可在 -80 °C 下储存长达 6 个月,而不会对传染性产生负面影响。
5. Jurkat T 细胞中慢病毒生产的滴定
- 通过补充 500 mL RPMI-1640 和 10% (v/v) 胎牛血清和终浓度为 100 U/mL 青霉素/链霉素,为 Jurkat T 细胞制备完整的罗斯威尔公园纪念研究所 1640 培养基 (cRPMI-1640)。
- 为确保 Jurkat T 细胞的健康培养,请在感染前将细胞在培养物中维持长达 1 周。
- 在慢病毒滴定当天,以 2 x 105 个细胞/孔的浓度,每孔 200 μL cRPMI-1640 的 cRPMI-1640 细胞,在 24 孔板中接种活的 Jurkat T 细胞。
- 使用新鲜收集的慢病毒或在冰上解冻含有 20 μL 的慢病毒瓶,然后通过上下吹打轻轻混匀。
- 在 cRPMI-1640 中使用连续稀释,用 0.25 μL、0.5 μL、1 μL、2.5 μL、5 μL 和 10 μL 慢病毒原液感染 Jurkat T 细胞。轻轻摇动板以确保慢病毒均匀分布。未感染的 Jurkat T 细胞用作阴性对照。
- 将板在 37 °C 下孵育。 4 小时后,用 cRPMI 加满每个孔至总体积为 400 μL。将板放回 37 °C 的培养箱中 3 天。
- 感染后 48 小时后,在荧光成像系统下确认 GFP 表达。
- 感染后 3 天,将 24 孔板的每个孔收集到单独的 1.5 mL 收集管中,并在 4 °C 下以 350 x g 离心细胞 5 分钟。
- 丢弃上清液。将沉淀重悬于 300 μL 制备至 2% (w/v) 的 DPBS 中制备的 2% 多聚甲醛 (PFA) 中,并在黑暗中在冰上放置 15 分钟。
- 将细胞在 4 °C 下以 350 x g 离心 5 分钟,并将沉淀重悬于荧光激活细胞分选 (FACS) 缓冲液(无菌 DPBS + 4% FCS + 1 mM 无菌 EDTA)中。
- 使用流式细胞术分析感染的慢病毒及其对照细胞的 GFP 表达频率和平均荧光强度(图 2)。
6. 组织驻留腹膜巨噬细胞的 体内 慢病毒感染
- 在 II 类生物安全柜中,加载总体积为 200 μL 的无血清培养基培养基的胰岛素针头,其中含有所需量的慢病毒(使用一次性针头,30 G,用于动物福利并避免针头中的液体流失)。
- 使用单手舀技术将针套放回针头上。将针头放在冰上并在 30 分钟内注射。
- 在动物设施中,在注射前设置一个 II 类生物安全柜(图 1E)。
- 铺一张干净的纸巾。松开含有慢病毒的胰岛素针头上的护套。
- 准备一个装有小块组织和葡萄糖酸氯己定基消毒剂的培养皿、一个装有去污溶液(2,000 ppm 漂白剂溶液)的 50 mL 管和一个锋利的安全容器。
- 通过抓住后颈的皮肤来约束鼠标21.适当约束的鼠标是固定的,这是安全所必需的。
- 腹部朝上,将动物的头部略微向下。将慢病毒腹膜内注射到腹腔的右下象限。这是为了避免注射到任何腹膜腔器官中。
- 在释放鼠标之前,请在注射器中装满去污溶液,并将其安全地丢弃在锋利的保险箱中。
- 用浸泡在消毒剂中的纸巾擦拭小鼠腹部的注射部位,然后将动物放回笼子中。
- 注射慢病毒的小鼠在 II 类笼子或单独通风的笼子 (IVC)(具有高效空气过滤的隔离笼)中注射至少 72 小时。将适当的信息卡放在笼子的前面。
- 感染后 72 小时后,根据当地安全批准,将鼠标移至新的 I 类保持笼中。每天监测小鼠,注射后总共 3 天。
7. 从慢病毒感染的小鼠中收集腹膜细胞
注意:对于慢病毒注射后 72 小时内的收集,请遵循机构 II 类生物安全规则。在慢病毒注射后前 72 小时内饲养受感染动物的垫料和笼子必须根据机构 II 类生物安全规则进行净化。
- 按照机构规定对小鼠实施安乐死,例如,通过吸入浓度增加的 CO2,然后通过颈椎脱位确认死亡。
- 用 70% 异丙醇清洁小鼠的腹部,并小心切开皮肤以露出腹膜。
- 使用 6 mL 注射器和 10 G 针头用 23 mL 冰冷的 FACS 缓冲液灌洗腹膜腔。避免刺穿任何器官。
- 轻轻按摩腹膜,使细胞移到 FACS 缓冲液中。
- 使用相同的注射器和针头收集腹膜液。
- 取下针头,将细胞转移到 15 mL 离心管中。
- 将腹膜灌洗液保持在冰上。
- 收集其他必需的器官并根据研究情况储存它们。
- 根据当地动物和安全指南处理动物尸体。
8. 腹膜细胞染色和分析
- 将腹膜灌洗液在 4 °C 下以 350 x g 离心 5 分钟,弃去污溶液中的上清液,并将细胞重悬于 1 mL FACS 缓冲液中。
- 对收集的细胞进行计数,并在 V 形底 96 孔板中每孔 4 x 105 个细胞接种。
- 根据制造商的说明,使用可固定试剂(例如,此处使用的 Fixable Near-IR 死细胞染色试剂盒)进行活力染色。
- 如果细胞在最后 72 小时内被感染,请将细胞在 2% PFA 中在冰上固定 15 分钟。加入等体积的冷 DPBS,并在 4 °C 下以 350 x g 再次离心 5 分钟。
- 制备封闭缓冲液:将 4 μg/mL 2.4G2 抗体与 FACS 缓冲液中的 10% (v/v) 大鼠血清混合用于表面染色,或将透化缓冲液用于细胞内染色。
- 将每个含有细胞沉淀的孔重悬于 50 μL 封闭缓冲液中,并在 4 °C 下孵育 15 分钟。
- 每个样品在 50 μL FACS 缓冲液(用于表面染色)或透化缓冲液(用于细胞内染色)中制备抗体混合物。每个样品的最终染色体积为 100 μL,包括 50 μL 封闭缓冲液。相应地计算抗体浓度(表 1)。
- 向样品中加入 50 μL 抗体混合物,向对照样品中加入 50 μL 同种型对照和对照缓冲液。将样品在黑暗中的冰上孵育 30 分钟。根据需要包括未染色的细胞和同种型对照。
- 用 100-200 μL 冰冷的 DPBS 洗涤每个孔,并在 4 °C 下以 350 x g 的速度离心板 5 分钟。重复此步骤以洗去任何未结合的抗体。在流式细胞仪上分析样品。
9. 从器官中提取细胞
- 每个器官准备 1 mL 消化混合物:混合汉克平衡盐溶液 (HBSS)、2 mg/mL IV 型胶原酶和 0.03 mg/mL DNase I(包括 1.5 mg/mL 用于肺消化的透明质酸酶)。
- 将收集的器官转移到 1 mL 消化混合物中,并用剪刀切碎。
- 通过 40 μm 过滤器过滤细胞,并在 4 °C 下以 350 x g 离心 5 分钟。
- 如果从肺、脾或肝脏中分离细胞,请使用 ACK 裂解缓冲液(150 mM NH4Cl、10 mM KHCO3、0.1 mM Na2EDTA pH = 7.4)裂解红细胞。通过 40 μm 过滤器过滤细胞,并在 4 °C 下以 350 x g 离心 5 分钟。
- 如第 8 节所述对细胞进行染色和分析。
结果
当完全正确地遵循该方案时,每次制备总共产生 1.5 mL 的高质量慢病毒原液,足以以本研究中确定的最佳体积进行 12 次 体内 注射18。可以在实验方案的早期评估转染的成功。质粒转染后 48 小时后,健康和汇合的 HEK293T 细胞(如果存在在质粒中)应显示易于检测的标记信号(例如,本研究中使用的 GFP)(图 1A)。信号强度低、细胞过度脱离和方案早期步骤的低汇合度可能表明细胞死亡,并会导致慢病毒制剂的产量低。在可选集合 II(步骤 3.5.1.)之前,一些单元格分离是可见的和预期的。
该方案中使用三种质粒来生成慢病毒颗粒:pCMV-ΔR8.91包装质粒编码结构HIV-1蛋白(Gag),辅助蛋白Tat和Rev以及逆转录酶聚合酶(Pol)22;在 CMV 启动子13 下编码 VSV-G 包络的 pMD2.G;和 pHR'SIN-cPPT-SEW 质粒(编码增强的 GFP 标记)19 针对 shRNA 或 microRNA 的表达进行相应修饰。
由于慢病毒制剂具有高传染性,因此在 Jurkat T 细胞系中滴定23。成功的慢病毒制备将以低至 5 μL 的剂量实现超过 95% 的感染率(图 2A)。感染细胞的平均荧光强度随着剂量的增加而继续增加(图 2B,C)。如果需要,可以使用整合病毒成分的实时 PCR 来测量病毒滴度,例如 SFFV 启动子,它与表达 GFP 的细胞百分比线性相关,与 GFP MFI 呈对数相关(图 2D)。根据构建体,特别是那些具有大插入片段24 的构建体,一些慢病毒制剂在 Jurkat T 细胞中的感染性会降低,如本研究中使用的 Cre-GFP 构建体所示(图 2E,F)。在这种情况下,可以将多种制备的慢病毒颗粒合并并重悬于 1 mL 中。我们建议在实验前在体内验证对这些制剂的免疫反应。自然地,此处使用的具有 VSV-G 替代进入受体的慢病毒制剂在 Jurkat T 细胞系中可能显示出不同的感染效率,具体取决于细胞上的受体表达。应选择用于滴定的细胞系,使其表达慢病毒颗粒进入细胞的受体,并且优先缺乏或具有非常低的限制因子表达25。
pMφ 感染(定义为 CD11b+ F4/80+ 和 Tim4 + 群体)18 进一步证明了慢病毒颗粒的成功生产(图 3A)。我们确定腹膜内注射 100 μL 慢病毒制剂(总体积为 200 μL 无血清培养基)在这些细胞中产生最高百分比和强度的 GFP 信号(图 3B、C)。注射较高剂量 (150 μL 和 200 μL 慢病毒制剂) 对 pMφ 中 GFP 的表达没有有益影响。腹膜内 (ip) 注射 100 μL 慢病毒后 4 小时、3 天、7 天和 14 天的时程实验显示,在第 3 天和第 7 天表达 GFP 的常驻 pMφ 有很大比例,随后在第 14 天感染人群消失(图 3D,E)。有趣的是,表达 GFP 的 pMφ 在感染后第 14 天大多消失,部分原因是对 GFP 标志物的免疫识别。事实上,在 T-Reg 选择性 Foxp3-DTR-eGFP 小鼠中使用 GFP 标记的慢病毒实验至少在第 21 天之前可以防止对感染的常驻 pMφ 的排斥反应(图 3F)。对于在 Jurkat 细胞中效果减弱的慢病毒制剂,需要更高的量才能达到预期的体内感染率。然而,正如 Cre-GFP 慢病毒制备所证明的那样,根据构建体设计,即使在腹腔注射后 7 天服用 300 μL 的剂量也可能产生不良结果(图 3G)。我们之前已经证明该方案在小鼠 pMφ 中成功用于体内基因的过表达和敲低,包括慢病毒 shRNA 介导的 Map3k8 和 Gata6 敲低,以及 Gata6 过表达19。在这里,我们表明该方案也可以成功地用于小鼠 microRNA 146b (mmu-miR-146b) 的过表达和在常驻 pMφ 中使用慢病毒衍生的 shRNA 敲低细胞间粘附分子 1 (ICAM1, CD54) (图 3H,I)。
原代细胞(如巨噬细胞)的感染需要更高的慢病毒输入,这可能是由于这些细胞中存在限制因子。限制因子是细胞的天然保护机制,会干扰病毒的生命周期步骤,例如逆转录或整合,从而抑制构建体的基因表达。
该方案的进一步体内验证表明 ip慢病毒递送对腹膜免疫细胞活力没有影响(图 4A),并表明常驻 pMφ 亚群(由 CD73 和 Tim4 标志物的表达定义)的不同感染性(图 4B,C)。重要的是,生产性慢病毒感染仅限于注射部位的常驻 Mφ,攻击后 7 天后肠系膜淋巴结 (mLN)、肺、肝脏或脾脏 Mφ 中缺乏显着的 GFP 表达证明(图 4D)。考虑到在许多情况下,需要在炎症条件下进行 Mφ 的遗传靶向,我们研究了该方案在用 0.1 mL 4% 巯基乙酸盐腹膜内攻击的小鼠中的有效性。巯基乙酸盐注射触发炎症性单核细胞衍生的 Mφ 和单核细胞的流入,这些细胞可分为 5 个不同的群体(图 4E)。流式细胞术分析显示单核细胞样细胞 (Ly6Chi 群体 1 和 2) 对慢病毒感染的难治性表型,与之前在人类细胞中的发现一致26。相比之下,常驻 Mφ 和单核细胞(第 3-5 组)仍然最容易受到感染(图 4F)。
详细的流式细胞术分析检测到 GFP 表达主要在常驻腹膜 Mφ 和主要组织相容性复合体 (MHC) II 类 + 常驻 pMφ (MHCII+ F4/80+ Tim4+) 中表达(注射后第 3 天高达 60%)(图 5A)。在其他腹膜细胞群中几乎没有检测到 GFP 信号,包括骨髓来源的腹膜 Mφs/DCs(MHCII+、CD11b+、CD11c+)、B 细胞 (CD19+)、T 细胞 (CD3+)、肥大细胞(CD11b-、FcεR1+)、嗜酸性粒细胞 (Siglec-F+)、NK 细胞 (CD19-、NK1.1+) 和中性粒细胞 (Ly6G+) (图 5A、B)。所有种群的 GFP 表达寿命(图 5C)都遵循常驻腹膜 Mφ 的寿命(图 1D)。腹腔注射 100 μL(总体积为 200 μL 无血清培养基)慢病毒后 4 小时后,记录到中性粒细胞频率的瞬时增加(图 5D),表明攻击动物中存在早期轻度炎症。最后,常驻 pMφ 在感染后第 7 天和第 14 天之间的频率显着下降(图 5E),表明注射后第 3 天和第 7 天之间的最佳实验窗口。

图 1:HEK293T细胞中慢病毒的产生。 (A) 成功转染 48 小时后HEK293T细胞的代表性免疫荧光图片(荧光显微镜 [488 nm 激发峰,510 nm 发射峰],20 倍放大倍率,比例尺 = 400 μm)。(B) 超速离心锥形管的照片,其中含有一层 20% 蔗糖(底部,透明)和一层从转染的 HEK293T 细胞中收集的培养基(顶部,红色)。(C) 锥形超速离心机正确插入吊篮的照片,包括适配器。(D) 显示超速离心机转子平衡正确和错误的照片。(E) 右撇子 体内注射的 Cat II 柜和材料的最佳设置照片。此图经 Ipseiz N 等人18 许可修改。 请单击此处查看此图的较大版本。

图 2:Jurkat T 细胞中的慢病毒滴定。 (A) 感染后 72 小时使用增加剂量的含有 GFP 质粒的慢病毒对 Jurkat T 细胞进行代表性流式细胞术分析,显示 GFP + 细胞 (GFP + ) 的百分比,(B) GFP + 细胞的平均荧光强度 (MFI) 和 (C) GFP 表达的代表性直方图。(D) 散点图显示 MFI(左 Y)和感染 GFP 表达慢病毒的细胞百分比(右 Y)与每 pg DNA 检测到的病毒拷贝数(x 轴)。(E) 次优 Cre-GFP 慢病毒 (Cre-GFP LV) 制备和对照 GFP 慢病毒 (GFP LV) 的 Jurkat T 细胞感染的代表性直方图和 (F) 显示 Cre-GFP 慢病毒感染的 Jurkat T 细胞百分比的摘要数据 (GFP+)。此图经 Ipseiz N 等人18 许可修改。 请单击此处查看此图的较大版本。
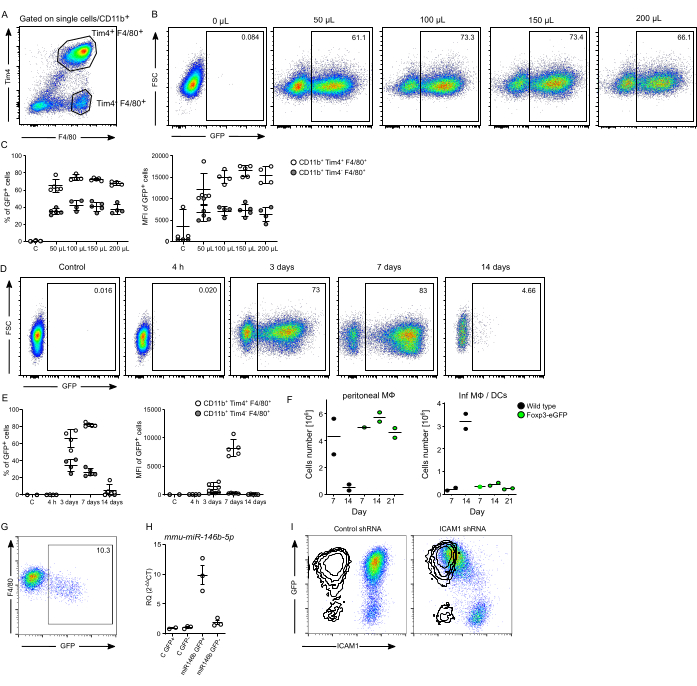
图 3:常驻 pMФ 的感染效率。 (A) 常驻 pMφ (CD11b+, Tim4+, F4/80+) 和 Tim4-, F4/80+ 细胞的门控策略。细胞在单重体上设门,然后是 CD11b+。(B) 代表性点图,以及 (C) 用不同量的 GFP 慢病毒制剂体内感染 3 天分离的 GFP+ 细胞的感染频率(% GFP + 细胞)和强度 (MFI) 的摘要。(D) 代表性点图,以及 (E) 在总体积为 200 μL 的无血清培养基中用 100 μL 慢病毒体内感染后在不同时间点分离的 GFP+ 细胞的感染频率(% GFP+ 细胞)和强度 (MFI) 的摘要。(F) 在 Foxp3-DTR-eGFP 小鼠腹膜内递送表达 GFP 的慢病毒后第 7 天、第 14 天和第 21 天的细胞数量总结,显示表达 GFP 的 pMφ 和炎性巨噬细胞和树突状细胞的数量 (InfMØs/DC [F480低])。(每组 n= 1-2)。(G) 腹腔注射后 7 天,Gata6-KO mye 19 驻留 pMφ 与 300 μL Cre-GFP 慢病毒的次优体内感染的代表性点图。(H) 用 100 μL 编码小鼠 microRNA-146b (miR-146b) 或对照 (C) 的慢病毒在体内攻击常驻腹膜 Mφ 表达的 RT-qPCR 定量。常驻 pMφ(白色圆圈)和 Tim4-、F4/80+ 细胞(灰色圆圈)。(I) 腹腔注射含有靶向 shRNA 的慢病毒后 7 天,雌性 129S6 小鼠在 pMφ 上成功下调 ICAM1 的代表性点图。显示对照 shRNA。叠加层显示同种型对照。数据表示为 ± SEM 平均值,n≥2 只小鼠。此图经 Ipseiz N 等人18 许可修改。请单击此处查看此图的较大版本。

图 4:常驻 pMφ 亚群的感染效率。 (A) 100 μL 无血清培养基 (-) 或 GFP 慢病毒 (+) 腹腔注射后 7 天活细胞总数和常驻 Mφ 活细胞的百分比。(B) 显示体内发现的四个主要 pMφ 群体的门控策略:CD73+Tim4+、CD73-Tim4-、CD73+Tim4-、CD73-Tim4+,以及 (C) 这些群体的相应感染频率(% GFP+ 细胞)和强度(GFP+ 细胞的 MFI)。(D) 腹腔注射 100 μL 慢病毒后 7 天多个器官中 GFP + 细胞的百分比。缩写:mLN,肠系膜淋巴结。(E) 小鼠腹腔注射 0.1 mL 4% 巯基乙酸盐 5 天,然后腹腔注射慢病毒。慢病毒腹腔注射后 3 天后 pMφ 和单核细胞的门控策略。(F) GFP + 单核细胞 (Ly6C+) 和 Mφ (Ly6C-) 的感染频率、MFI 和细胞数量分析。数据表示为 ± SEM 平均值,n≥3 只小鼠。此图经 Ipseiz N 等人18 许可修改。请单击此处查看此图的较大版本。

图 5:慢病毒注射对腹膜炎症的影响。 小鼠 体内 腹腔注射表达 GFP 的慢病毒。(A) 不同量慢病毒注射后腹膜腔中细胞群的感染频率(50 μL、100 μL、150 μL 或 200 μL)。(B) 腹腔注射后 7 天生产性感染细胞群中 GFP 表达强度。(C) 腹腔注射后不同时间点腹膜腔内细胞群的感染频率。(D) 和 (E) ip注射后不同时间点的细胞百分比。所有慢病毒注射均以相同的总体积 200 μL 进行,并使用无血清培养基完成。除非另有说明,否则使用 100 μL 慢病毒剂量。对照小鼠 ("C") 接受 200 μL 纯无血清培养基。数据表示为 ± SEM 平均值,n≥3 只小鼠。此图经 Ipseiz N 等人18 许可修改。 请单击此处查看此图的较大版本。
| 抗体靶标 | 荧光基团 | 克隆 | 使用的稀释度 | 终浓度 [μg/mL] |
| HIV-1 核心抗原 | RD1 | FH190-1-1 | 1/100 | 1 |
| I-A/I-E | PerCpCy5.5 | M5/114.15.2 号 | 1/400 | 0.5 |
| LY6G | PerCpCy5.5 | 1A8 | 1/400 | 0.5 |
| CD3e | PerCpCy5.5 | 17A2 | 1/200 | 1 |
| CD3e | PE/Cy7 系列 | 500A2 | 1/400 | 0.5 |
| CD11c | PE/Cy7 系列 | 编号 N418 | 1/800 | 0.25 |
| CD11c | BV605 系列 | 编号 N418 | 1/400 | 0.5 |
| CD226的 | AF647 系列 | 10 E 5 | 1/400 | 1.25 |
| 蒂姆4 | AF647 系列 | RTM4-54 系列 | 1/600 | 0.83 |
| CD4 | APC公司 | GK1.5 | 1/400 | 0.5 |
| CD11乙 | AF700 系列 | M1/70 系列 | 1/700 | 0.71 |
| CD11乙 | PerCpCy5.5 | M1/70 系列 | 1/400 | 0.5 |
| F4/80 | 太平洋蓝 | BM8 系列 | 1/700 | 0.71 |
| F4/80 | BV605 系列 | BM8 系列 | 1/400 | 0.25 |
| F4/80 | BV711 系列 | BM8 系列 | 1/400 | 0.5 |
| CD73的 | eFluor450 系列 | TY/11.8 | 1/400 | 2.5 |
| CD19的 | V450 系列 | 1天3 | 1/400 | 0.5 |
| CD19的 | APC公司 | 1天3 | 1/400 | 0.5 |
| CD8a型 | eFluor450 系列 | 53-6.7 | 1/400 | 0.5 |
| 西格莱克F | BV421型 | 编号 E50-2440 | 1/400 | 0.5 |
| NK1.1 | APC/Cy7 系列 | PK136 系列 | 1/400 | 0.5 |
| FceR1 | eFluor450 系列 | 三月 1 | 1/400 | 0.5 |
| ICAM1 | 体育 | 编号 1A29 | 1/100 | 2 |
| 大鼠 IgG1,κ 同种型对照 | 体育 | 1/100 | 2 |
表 1:抗体列表
讨论
组织驻留巨噬细胞执行一系列稳态和炎性组织特异性功能 1,2,由其生理环境决定 6,7,8,9。在该方案中,引入了一种使用慢病毒颗粒在体内操纵腹膜驻留巨噬细胞的有效方法18,以研究巨噬细胞在其生物微环境中的功能。
使用健康的 HEK293T 细胞对于方案的成功至关重要。最佳做法是在本方案开始前至少一周解冻细胞,以确保细胞恢复和良好的数量。应在计划转染前一天将细胞接种在适当体积的培养基中,并在转染当天达到约 80% 的汇合度。细胞制备物汇合不足或过度融合会导致慢病毒产量降低。我们建议根据制造商的说明使用转染试剂转染HEK293T细胞,以获得最佳结果。转染的基本步骤包括质粒和试剂的适当混合,以及将混合物直接滴加到HEK293T细胞单层中。该方案可以采用 HEK293T 细胞27,28 的磷酸钙转染。但是,用户应注意,这种方法的有效性可能会有所不同,并且可能导致转染效率降低。
从细胞转染之日起,HEK293T方案中应考虑安全预防措施。这些措施包括在 II 类安全柜中工作,在处理受污染材料时戴上双层手套,以及对受污染材料进行适当漂白(使用去污溶液,例如 2,000 ppm 漂白剂溶液)至少 4 小时。用户应参考其关于处理 II 类病原体和废物的机构规定。
在该方案中,首先使用 0.45 μm 过滤器纯化慢病毒制剂以去除HEK293T细胞碎片。应避免使用较小的过滤器 (0.22 μm) 和纤维素酯膜,因为这会导致慢病毒颗粒的损失。建议使用低蛋白结合聚醚砜或聚偏二氟乙烯过滤器29.第二个纯化步骤是在超速离心机中对单个 20% 蔗糖层进行,以去除残留的杂质,这对于随后的慢病毒制剂的 体内 给药尤为重要。在没有超速离心机的机构中,其他30 个机构描述了使用标准实验室离心机进行基于蔗糖的慢病毒纯化。这可以在此协议中作为替代方案实现。在 Jurkat T 细胞中根据标志物信号的表达滴定慢病毒制剂(例如,本方案中使用的 GFP)。对于没有标记物的构建体,可以通过 ELISA 试剂盒31 定量 HIV-1 p24gag 蛋白、HIV-1 核心抗原18 的流式细胞术分析或测量目标基因的变化来评估物理慢病毒颗粒(优先使用允许测量单个细胞变化的方法,例如流式细胞术或显微镜检查)。如果 Jurkat T 细胞中对照和慢病毒的滴定显着不同,则可以调整用于 体内 研究的体积以达到慢病毒制剂之间最可比的感染。
该方案的主要限制是在腹腔注射慢病毒后 14 天内观察到 GFP + 驻留腹膜 Mφ 消失。对于长期研究,应考虑在特定细胞类型或组织中具有稳定遗传改变的小鼠品系32.例如,由于腹膜巨噬细胞不表达 Foxp3(一种 T-Reg 蛋白),我们利用了 Foxp3-DTR-eGFP 小鼠33 并证实 GFP 的表达在感染后 21 天维持在腹膜 Mφ 中(图 3F)。然而,重要的是要注意慢病毒含有其他外来成分,并且感染细胞在 Foxp3-DTR-GFP 小鼠中持续存在的这种延伸可能不是永久性的。这种方法的另一个弱点是慢病毒注射后可以在腹膜腔中观察到低水平的炎症,注射后 4 小时中性粒细胞的流入证明了这一点(图 5D),这可能意味着反复感染会加速炎症相关的丢失表达 GFP 的常驻腹膜 Mφ。虽然我们尚未在腹膜腔中检测到 I 型干扰素 (IFN),但 VSV-G 假型慢病毒颗粒先前已被证明可以在没有可检测的 IFN 的情况下诱导人 Mφ 中的一些 IFN 刺激的基因34。当使用此方案进行研究抗病毒免疫反应的实验时,应考虑这一点。腹腔注射慢病毒制剂后急性和持续炎症的发生可能表明制剂受到污染。
故障排除领域包括:1) 对于低慢病毒滴度,确保HEK293T细胞的健康和有效转染(例如,HEK293T细胞中的标志物表达(如果存在),则进行转染)。如果感染率仍然很低,请考虑构建体的大小。具有较大插入片段或更复杂的二级结构的构建体会影响最终的慢病毒滴度和感染性24。因此,每个构建体应独立测试,并与其各自的对照载体平行测试;2) 如果需要大量的慢病毒,建议制备多个 HEK293T 细胞的 T175 培养瓶,并相应地扩大生产规模。为避免慢病毒制剂的变化,最佳做法是在等分和储存之前合并最终集合。对于这种更大规模的生产,应在 50 mL 试管中制备质粒混合物(第 2 部分),以确保组分的有效混合。
尽管具有广泛的趋向性,但 VSV-G 假型慢病毒颗粒主要靶向组织巨噬细胞,如先前证明的肺泡35 和此处的pMФ 18 当通过相应途径给药时。在某些情况下,慢病毒颗粒上包膜的改变会导致体内巨噬细胞转导减少 36,并且对于该方案来说是不必要的。与巨噬细胞体内基因操作的其他病毒方法(37 中综述)相比,使用慢病毒载体可在组织巨噬细胞中稳定整合转基因35、高效的转基因表达和最大的载体大小限制(约 8 Kb)。
腹膜 Mφ 在包括腹部癌、胰腺炎和腹膜炎在内的各种疾病的预防、发生、进展和消退中起着重要作用38。该协议描述了小鼠 pMφ 中基因修饰的有效工具,允许在生理相关的微环境中研究这些病理背后的生物过程。虽然慢病毒载体本身正在成为临床干预感兴趣的工具39,但由于免疫缺陷病毒的起源和稳定的基因组整合,安全性问题阻碍了其治疗实施。进一步了解巨噬细胞对慢病毒基因调节的反应可以促进这种高效工具在临床中的应用。
披露声明
作者没有什么可披露的。
致谢
这项研究全部或部分由惠康信托调查员奖 [107964/Z/15/Z] 资助。P.R.T 还得到了英国痴呆症研究所的支持。M.A.C 得到了生物技术和生物科学研究委员会发现奖学金 (BB/T009543/1) 的支持。出于开放获取的目的,作者已将 CC BY 公共版权许可应用于本提交内容产生的任何作者接受的手稿版本。L.C.D 是斯旺西大学的讲师和卡迪夫大学的名誉研究员。这项工作得到了 Ipseiz 等人进行的工作的支持,2020年 18。
材料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1x) (Trypsin 500 mg/L or 0.02 mM) | Thermo Fisher Scientific | 25300054 | |
| 0.22 μm sterile millex GP filter | Merck | SLGS033SS | |
| 0.45 μm sterile millex GP filter | Merck | SLHP033RS | |
| 0.5 mL U-100 insulin syringe with needle, 0.33 mm x 12.7 mm (29 G) | BD | 324892 | |
| 1 Litre Sharps Container | N/A | N/A | |
| 2.4G2 antibody (TruStain FcX anti-mouse CD16/32) | Biolegend | 101320 | |
| 40 μm strainer | Thermo Fisher Scientific | 22363547 | |
| AimV medium (research grade), AlbuMax Supplement | Thermo Fisher Scientific | 31035025 | |
| Blocking buffer | prepared in house | ||
| Brewer thioglycolate medium | Sigma-Aldrich | B2551 | 4% stock solution prepared in water, autoclaved and kept frozen. |
| CD11b | Biolegend | 101222 | Refer to Table 1 for the dilution and concentration |
| CD11b | BD | 550993 | Refer to Table 1 for the dilution and concentration |
| CD11c | Biolegend | 117317 | Refer to Table 1 for the dilution and concentration |
| CD11c | Biolegend | 117333 | Refer to Table 1 for the dilution and concentration |
| CD19 | BD | 560375 | Refer to Table 1 for the dilution and concentration |
| CD19 | Biolegend | 152410 | Refer to Table 1 for the dilution and concentration |
| CD226 | Biolegend | 128808 | Refer to Table 1 for the dilution and concentration |
| CD3e | BD | 560527 | Refer to Table 1 for the dilution and concentration |
| CD3e | Biolegend | 152313 | Refer to Table 1 for the dilution and concentration |
| CD4 | Biolegend | 100412 | Refer to Table 1 for the dilution and concentration |
| CD73 | eBioscience | 16-0731-82 | Refer to Table 1 for the dilution and concentration |
| CD8a | eBioscience | 48-0081-82 | Refer to Table 1 for the dilution and concentration |
| Cell culture flask (T175 fask, 175 cm2, 550 mL) | Greiner Bio One | 658175 | |
| Centrifuge tubes, conical bottom tubes 25 mm x 89 mm | Beckman Coulter | 358126 | |
| Centrifuges | Beckman Coulter | Ultracentrifuge and TC centrifuge | |
| Collagenase type IV | Sigma-Aldrich | C5138 | |
| Conical centrifuge tubes (15 mL and 50 mL) | Greiner Bio One | 11512303 & 11849650 | |
| Cryotubes | Greiner Bio One | 123277 | or cryotubes |
| DMEM medium (1x) + 4.5g/L D-glucose, 400 µM L-glutamine | Thermo Fisher Scientific | 41965-062 | |
| Dnase I | Sigma-Aldrich | 11284932001 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| F4/80 | Biolegend | 123123 | Refer to Table 1 for the dilution and concentration |
| F4/80 | Biolegend | 123133 | Refer to Table 1 for the dilution and concentration |
| F4/80 | Biolegend | 123147 | Refer to Table 1 for the dilution and concentration |
| FceR1 | eBioscience | 48-5898-80 | Refer to Table 1 for the dilution and concentration |
| Fetal calf serum (FCS) | Thermo Fisher Scientific | 10270-106 | heat inactivated for 30 min at 56 °C and sterile filtered through 0.22 μm filter |
| Flow cytometer | Thermo Fisher Scientific | Attune NxT | |
| Flow cytometry (FACS) buffer | prepared in house | ||
| Fluorescent tissue culture microscope | Thermo Fisher Scientific | EVOS FL | |
| Forceps | N/A | N/A | User preference |
| Hank's balanced salt solution (HBSS) | Gibco, Life Technologies | 14175-053 | |
| HEK293T cell line | grown for at least a week prior transfection. Mycoplasma free | ||
| HIV-1 Core antigen | Beckman Coulter | 6604667 | |
| Hyaluronidase | Sigma-Aldrich | H3506 | |
| Hydrex surgical scrub, chlorhexiding gluconate 4% w/v skin cleanser | Ecolab | 3037170 | |
| I-A/I-E | Biolegend | 107625 | Refer to Table 1 for the dilution and concentration |
| ICAM1 | Becton Dickinson | 554970 | Refer to Table 1 for the dilution and concentration |
| Jurkat T cell line | grown for at least a week prior use. Mycoplasma free | ||
| LIVE/DEAD fixable near-IR dead cell stain kit | Thermo Fisher Scientific | L34975 | |
| Ly6G | Biolegend | 127615 | Refer to Table 1 for the dilution and concentration |
| Mice | here used C57BL/6 females, aged 8-12 weeks (Charles Rivers), unless specified differently | ||
| Microcapillary pipettes (volume range 0.5-1,000 μL) | Fisher Scientific & Starlab | 11963466 & 11943466 & 11973466 & S1111-3700 | |
| NK1.1 | Biolegend | 108724 | Refer to Table 1 for the dilution and concentration |
| Paraformaldehyde | Sigma-Aldrich | P6148-500G | prepared to 2% w/v in PBS |
| pCMV-ΔR8.91 packaging plasmid | Zuffrey, R., et al. 1997 | encodes Gag-Pol HIV protein driven by cytomegalovirus promoter. Ampicilin resistance. | |
| Penicillin/Streptomycin (100x, 10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Petri dish | Greiner Bio One | 664160 | |
| pHR'SIN-cPPT-SEW plasmid | Rosas, M. et al. 2014 | modified for shRNA and miR expression studies. Encodes EGFP marker downstream SFFV promoter and upstream of the Woodchuck hepatitiv virus enhancer. Ampicilin resistance. | |
| pMD2.G plasmid | Naldini, L. et al. 1996 | encodes vesicular stomatis virus g-glycoprotein (VSV-G) envelope. Ampicilin resistance. | |
| Rat IgG1, κ isotype control | Becton Dickinson | 550617 | Refer to Table 1 for the dilution and concentration |
| Rat serum | Sigma-Aldrich | R9759-10ML | |
| Red blood ACK lysis buffer | prepared in house | ||
| RPMI 1640 medium (1x) + 400 uM L-glutamine | Thermo Fisher Scientific | 21875-091 | |
| Saponin | Sigma-Aldrich | S4521 | |
| SiglecF | BD | 562681 | Refer to Table 1 for the dilution and concentration |
| Sodium hypochlorite Tablets (bleach, 2,000 ppm) | Guest Medical | H8818 | |
| Sterile 24-well cell culture plate | Greiner Bio One | 662160 | |
| Sterile Dulbecco's PBS (DPBS) (1x) Mg++ and Ca2+ - free | Thermo Fisher Scientific | 14190144 | |
| Sterile EDTA | Thermo Fisher Scientific | 15575020 | |
| Sterile VWR disposable transfer pipets (23.0 mL, 30 cm) | VWR | 612-4515 | |
| Sucrose | Thermo Fisher Scientific | 15503022 | |
| surgical scissors | N/A | N/A | User preference |
| Syringes (50 mL and 1 0mL) | Fisher Scientific | 10084450 & 768160 | |
| Tim4 | Biolegend | 130007 | Refer to Table 1 for the dilution and concentration |
| U-bottom 96-well cell culture plate | Greiner Bio One | 650180 |
参考文献
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Jantsch, J., Binger, K. J., Muller, D. N., Titze, J. Macrophages in homeostatic immune function. Front Physiol. 5, 146(2014).
- Wynn, T. A., Vannella, K. M. Macrophages in tissue repair, regeneration, and fibrosis. Immunity. 44 (3), 450-462 (2016).
- Ginhoux, F., Guilliams, M. Tissue-resident macrophage ontogeny and homeostasis. Immunity. 44 (3), 439-449 (2016).
- Epelman, S., Lavine, K. J., Randolph, G. J. Origin and functions of tissue macrophages. Immunity. 41 (1), 21-35 (2014).
- Amit, I., Winter, D. R., Jung, S. The role of the local environment and epigenetics in shaping macrophage identity and their effect on tissue homeostasis. Nat Immunol. 17 (1), 18-25 (2016).
- Gosselin, D., et al. Environment drives selection and function of enhancers controlling tissue-specific macrophage identities. Cell. 159 (6), 1327-1340 (2014).
- Lavin, Y., et al. Tissue-resident macrophage enhancer landscapes are shaped by the local microenvironment. Cell. 159 (6), 1312-1326 (2014).
- Davies, L. C., et al. Peritoneal tissue-resident macrophages are metabolically poised to engage microbes using tissue-niche fuels. Nat Commun. 8 (1), 2047(2017).
- Shi, J., Hua, L., Harmer, D., Li, P., Ren, G. Cre driver mice targeting macrophages. Methods Mol Biol. 1784, 263-275 (2018).
- Wang, X., et al. Recent advances in lentiviral vectors for gene therapy. Sci China Life Sci. 64 (11), 1842-1857 (2021).
- Kosaka, Y., et al. Lentivirus-based gene delivery in mouse embryonic stem cells. Artif Organs. 28 (3), 271-277 (2004).
- Naldini, L., et al. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272 (5259), 263-267 (1996).
- Yamashita, M., Emerman, M. Capsid is a dominant determinant of retrovirus infectivity in nondividing cells. J Virol. 78 (11), 5670-5678 (2004).
- Wilson, A. A., et al. Lentiviral delivery of RNAi for in vivo lineage-specific modulation of gene expression in mouse lung macrophages. Mol Ther. 21 (4), 825-833 (2013).
- Burns, J. C., Friedmann, T., Driever, W., Burrascano, M., Yee, J. K. Vesicular stomatitis virus G glycoprotein pseudotyped retroviral vectors: concentration to very high titer and efficient gene transfer into mammalian and nonmammalian cells. Proc Natl Acad Sci U S A. 90 (17), 8033-8037 (1993).
- Finkelshtein, D., Werman, A., Novick, D., Barak, S., Rubinstein, M. LDL receptor and its family members serve as the cellular receptors for vesicular stomatitis virus. Proc Natl Acad Sci U S A. 110 (18), 7306-7311 (2013).
- Ipseiz, N., et al. Effective in vivo gene modification in mouse tissue-resident peritoneal macrophages by intraperitoneal delivery of lentiviral vectors. Mol Ther Methods Clin Dev. 16, 21-31 (2020).
- Rosas, M., et al. The transcription factor Gata6 links tissue macrophage phenotype and proliferative renewal. Science. 344 (6184), 645-648 (2014).
- BeckmanCoulter. , https://www.mybeckman.uk/resources/technologies/centrifugation/principles/rotor-balancing (2023).
- JoVE Science Education Database. Lab Animal Research. Rodent Handling and Restraint Techniques. , JoVE, Cambridge, MA. (2023).
- Zufferey, R., Nagy, D., Mandel, R. J., Naldini, L., Trono, D. Multiply attenuated lentiviral vector achieves efficient gene delivery in vivo. Nat Biotechnol. 15 (9), 871-875 (1997).
- Nasri, M., Karimi, A., Allahbakhshian Farsani, M. Production, purification and titration of a lentivirus-based vector for gene delivery purposes. Cytotechnology. 66 (6), 1031-1038 (2014).
- Optimized production and concentration of lentiviral vectors containing large inserts. J Gene Med. al Yacoub, N., Romanowska, M., Haritonova, N., Foerster, J. 9 (7), 579-584 (2007).
- Malim, M. H., Bieniasz, P. D. HIV restriction factors and mechanisms of evasion. Cold Spring Harb Perspect Med. 2 (5), a006940(2012).
- Sonza, S., et al. Susceptibility of human monocytes to HIV type 1 infection in vitro is not dependent on their level of CD4 expression. AIDS Res Hum Retroviruses. 11 (7), 769-776 (1995).
- Kingston, R. E., Chen, C. A., Rose, J. K. Calcium phosphate transfection. Curr Protoc Mol Biol. Chapter 9, Unit 9.1(2003).
- Brown, L. Y., Dong, W., Kantor, B. An Improved protocol for the production of lentiviral vectors. STAR Protoc. 1 (3), 100152(2020).
- Moce-Llivina, L., Jofre, J., Muniesa, M. Comparison of polyvinylidene fluoride and polyether sulfone membranes in filtering viral suspensions. J Virol Methods. 109 (1), 99-101 (2003).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Sci Rep. 5, 13875(2015).
- Czubala, M. A., et al. TGFbeta induces a SAMHD1-independent post-entry restriction to HIV-1 infection of human epithelial langerhans cells. J Invest Dermatol. 136 (10), 1981-1989 (2016).
- Bouabe, H., Okkenhaug, K. Gene targeting in mice: a review. Methods Mol Biol. 1064, 315-336 (2013).
- Kim, J. M., Rasmussen, J. P., Rudensky, A. Y. Regulatory T cells prevent catastrophic autoimmunity throughout the lifespan of mice. Nat Immunol. 8 (2), 191-197 (2007).
- Decalf, J., et al. Sensing of HIV-1 entry triggers a Type I Interferon response in human primary macrophages. J Virol. 91 (15), e00147-e00217 (2017).
- Wilson, A. A., et al. Amelioration of emphysema in mice through lentiviral transduction of long-lived pulmonary alveolar macrophages. J Clin Invest. 120 (1), 379-389 (2010).
- Markusic, D. M., van Til, N. P., Hiralall, J. K., Elferink, R. P., Seppen, J. Reduction of liver macrophage transduction by pseudotyping lentiviral vectors with a fusion envelope from Autographa californica GP64 and Sendai virus F2 domain. BMC Biotechnol. 9, 85(2009).
- Burke, B., Sumner, S., Maitland, N., Lewis, C. E. Macrophages in gene therapy: cellular delivery vehicles and in vivo targets. J Leukoc Biol. 72 (3), 417-428 (2002).
- Bain, C. C., Jenkins, S. J. The biology of serous cavity macrophages. Cell Immunol. 330, 126-135 (2018).
- Milone, M. C., O'Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。