Method Article
Preparación de vectores lentivirales para la modulación eficiente de genes y microARN de macrófagos residentes en el tejido de la cavidad peritoneal in vivo en ratones
En este artículo
Resumen
Demostramos un protocolo paso a paso para la investigación de la función génica en macrófagos residentes en tejido peritoneal in vivo, utilizando vectores lentivirales.
Resumen
Los macrófagos residentes en el tejido peritoneal tienen amplias funciones en el mantenimiento de la homeostasis y están implicados en patologías dentro de los tejidos locales y vecinos. Sus funciones están dictadas por señales microambientales; Por lo tanto, es esencial investigar su comportamiento en un nicho fisiológico in vivo . En la actualidad, las metodologías específicas de focalización de macrófagos peritoneales emplean modelos transgénicos de ratón entero. En este trabajo se describe un protocolo para la modulación eficaz in vivo de la expresión de ARNm y especies pequeñas de ARN (por ejemplo, microARN) en macrófagos peritoneales utilizando partículas de lentivirus. Las preparaciones de lentivirus se elaboraron en células HEK293T y se purificaron en una sola capa de sacarosa. La validación in vivo de la efectividad del lentivirus después de la inyección intraperitoneal reveló una infección predominante de macrófagos restringida al tejido local. La focalización de los macrófagos peritoneales fue exitosa durante la homeostasis y la peritonitis inducida por tioglicolato. Se discuten las limitaciones del protocolo, incluida la inflamación de bajo nivel inducida por la administración intraperitoneal de lentivirus y las restricciones de tiempo para posibles experimentos. En general, este estudio presenta un protocolo rápido y accesible para la evaluación rápida de la función génica en macrófagos peritoneales in vivo.
Introducción
Los macrófagos residentes en los tejidos (Mφ) son una población heterogénea de células inmunitarias fagocíticas que detectan y responden a patógenos invasores 1,2. Además, desempeñan un papel esencial en el desarrollo de los tejidos, la remodelación y el mantenimiento de la homeostasis 1,3. Muchos Mφ tisulares derivan de los progenitores del saco vitelino durante la embriogénesis y persisten en el tejido durante toda la vida 4,5. El fenotipo y las funciones de estas células están dictados por interacciones colaborativas y jerárquicas de factores de transcripción específicos y el microambiente local 6,7,8,9. Una creciente comprensión de esta dependencia aumenta la necesidad de métodos in vivo efectivos para la manipulación génica de Mφ dentro de su nicho fisiológicamente relevante.
Los vectores lentivirales son una herramienta frecuentemente empleada para la manipulación de ácidos nucleicos en poblaciones celulares específicas in vivo 10,11,12, particularmente debido a su capacidad para infectar tanto a las células en división como a las que no se dividen y para integrarse de manera estable en el genoma del huésped 13,14. En las últimas dos décadas, se ha optimizado la tecnología de administración de lentivirus y se han investigado sobres alternativos y promotores sintéticos para aumentar la focalización específica del linaje 8,15. Debido a su amplio tropismo celular, la glicoproteína envolvente del virus de la estomatitis vesicular (VSV-G)16,17 se ha convertido en la envoltura "estándar de oro" utilizada en la tecnología de lentivirus.
En este protocolo18, se emplean partículas lentivirales pseudotipadas de VSV-G para demostrar la entrega dirigida y efectiva de ARN de horquilla corta (shRNA) y microARN (miR) al Mφ peritoneal (pMφ) de ratón in vivo, en estado estacionario19. La expresión del transgén fue impulsada por el promotor del virus formador de foco del bazo (SFFV). La infección productiva de las células se definió por la expresión de la proteína verde fluorescente mejorada (GFP) derivada de lentivirus. La utilización de este enfoque permitió una lectura fácil de los experimentos in vivo con lentivirus para definir la dosis óptima y el marco temporal experimental. Por último, el desafío lentiviral in vivo de ratones durante la inflamación inducida por tioglicolato reveló la propensión natural a la infección selectiva por pMφ.
Protocolo
Todo el trabajo con animales se llevó a cabo de acuerdo con las directrices institucionales y del Ministerio del Interior del Reino Unido.
NOTA: Todos los estudios in vivo con lentivirus deben realizarse de acuerdo con las directrices locales y nacionales sobre el uso ético de animales en la investigación, así como cumplir con todas las regulaciones asociadas con el uso de materiales infecciosos de categoría II. El bienestar animal también debe controlarse de acuerdo con las regulaciones locales. En este paso del protocolo, se debe tener mucho cuidado al trabajar con partículas lentivirales y objetos punzantes.
1. Preparación de las células HEK293T para la transfección
NOTA: Realice estos pasos bajo una cabina de seguridad biológica para cultivo de tejidos estériles.
- Prepare el medio Eagle Modificado (cDMEM) completo de Dulbecco para células HEK293T combinando los 450 mL de DMEM con un 10% (v/v) de suero fetal de ternero (50 mL) y una concentración final de 100 U/mL de penicilina/estreptomicina.
- Descongele HEK293T células al menos 1 semana antes de la transfección planificada. Mantener unas condiciones de crecimiento saludables y pasar cada 2-3 días utilizando tripsina + EDTA para separar las células del matraz.
- Un día antes de la transfección, aspire cuidadosamente el medio de crecimiento de las células y lave suavemente las células con DPBS estéril. Añadir 1-5 mL de tripsina al matraz e incubar a 37 °C en una incubadora de CO2 al 5% durante 2-5 min.
- Añadir 5-10 mL de cDMEM y centrifugar las células a 350 x g durante 5 min. Retire el líquido y vuelva a suspender el pellet celular en 10 mL de cDMEM. Cuente las células y la semilla de 10-11 x 106 células HEK293T viables por matraz T175 en 20 mL de cDMEM.
- Incubar a 37 °C en una incubadora de 5% de CO2 durante la noche para permitir que las células HEK293T alcancen una confluencia del 70%-80%.
- Al día siguiente, confirme la confluencia de células bajo un microscopio óptico.
- Retire el medio del matraz con una tireta serológica de 25 ml sin alterar la monocapa celular.
- Agregue suavemente 10 ml de DPBS y balancee la placa para lavar las células, teniendo cuidado de no alterar la monocapa celular.
- Retire el DPBS con una tira serológica de 25 ml.
- Añada 15 mL de nuevo cDMEM en la pared por matraz T175 para no perturbar la monocapa celular, y devuelva la placa a la incubadora a 37 °C.
2. Transfección de células HEK293T utilizando reactivo de transfección lipídica no liposomal
- En un tubo de centrífuga de 15 mL, prepare los componentes lentivirales: 2 μg de plásmido lentiviral, 1,5 μg de pΔ8.91 (pCMV-Δ8.91) y 1 μg de pMD2.G (pCMV-MD2.G) con tampón EC (kit de reactivos de transfección) hasta un volumen final de 600 μL.
- Añadir 36 μL de solución potenciadora. Mezcle los componentes con una pipeta de 1 ml aspirando repetidamente una parte del líquido y volviéndola a colocar gota a gota directamente sobre la solución restante. Dejar actuar 5 min a temperatura ambiente (RT).
- Añada 120 μL de reactivo de transfección y mezcle como se indica arriba aproximadamente 20 veces. Incubar durante 10 min en RT.
- Añadir 5,2 mL de cDMEM y mezclar como se indica arriba con una tireta serológica de 5 mL.
- Con una pipeta de transferencia desechable, añadir la mezcla de transfección gota a gota directamente sobre la monocapa de células HEK293T (evitando las paredes del matraz), extendiendo la mezcla en diferentes puntos del matraz.
- Distribuya el plásmido balanceando suavemente el matraz de lado a lado. Evite que entre líquido en la tapa del matraz.
- Incubar el matraz a 37 °C en una incubadora con 5 % de CO2 durante 48 h. Confirmar la transfección efectiva de las células HEK293T mediante la aparición de un marcador fluorescente, en este caso GFP, dentro de las 24 h posteriores a la transfección monitoreada bajo un microscopio fluorescente de imagen celular.
NOTA: En el caso de las construcciones sin el marcador fluorescente, las células HEK293T deben analizarse para detectar la presencia del gen marcador utilizado o mediante un cambio en la expresión del gen/proteína de interés mediante técnicas adecuadas, por ejemplo, qPCR. Alternativamente, la transfección exitosa puede verificarse indirectamente durante las pruebas de la colección de lentivirus en las células Jurkat en las últimas etapas del protocolo mediante las técnicas anteriores.
PRECAUCIÓN: Las células HEK293T transfectadas se consideran infecciosas y se deben implementar las precauciones de seguridad adecuadas al manipular estas células. Se deben seguir las reglas locales, que generalmente pueden incluir trabajar bajo un gabinete de seguridad biológica de categoría II, el uso de guantes dobles y una solución de descontaminación adecuada para la desinfección, por ejemplo, una mayor concentración de lejía de desecho (2,000 ppm) o una solución equivalente de acuerdo con las pautas institucionales de bioseguridad. Todas las soluciones y plásticos que entren en contacto con la preparación de lentivirus deben desinfectarse de acuerdo con los procedimientos institucionales de bioseguridad.
3. Recolección de partículas lentivirales
- Prepare la solución de descontaminación, una solución de lejía (hipoclorito de sodio) de alta concentración (2.000 ppm) o un agente equivalente de acuerdo con los lineamientos institucionales de bioseguridad en un balde y colóquela en el gabinete de seguridad biológica.
- Prepare el armario de seguridad biológica eliminando cualquier exceso de elementos, como bastidores de tubos vacíos, etc.
- Etiquete previamente un tubo de centrífuga de 50 ml por matraz de celdas de HEK293T T175 y retire la tapa del tubo de centrífuga. Coloque los tubos en una rejilla estable.
- Recupere el matraz de la incubadora y confirme la expresión de GFP utilizando un microscopio fluorescente con un láser de 488 nm (Figura 1A). La intensidad de la señal depende de la eficiencia de la transfección del procedimiento y de los constructos utilizados.
- Recoja los medios de las células en el tubo de centrífuga de 50 ml preetiquetado. Incline el matraz de HEK293T T175 con células transfectadas para que el medio se acumule en la esquina inferior del matraz. Con una tireta serológica de 25 mL, recoja el medio sin alterar la monocapa celular. Algunas celdas flotantes pueden ser visibles en este punto. Transfiera el medio a un tubo de centrífuga limpio de 50 ml y cierre la tapa.
- Con una tireta serológica de 25 mL, añada 25 mL de cDMEM fresco y tibio al matraz. Asegúrese de dirigir el flujo del medio sobre las paredes del matraz para no perturbar la monocapa de la célula. Devolver el matraz con células HEK293T transfectadas a la incubadora (37 °C, 5% CO2).
NOTA: Se puede realizar una segunda recolección de lentivirus y una purificación adicional después de 24 horas adicionales siguiendo el procedimiento descrito en los pasos anteriores.
- Con una tireta serológica de 25 mL, añada 25 mL de cDMEM fresco y tibio al matraz. Asegúrese de dirigir el flujo del medio sobre las paredes del matraz para no perturbar la monocapa de la célula. Devolver el matraz con células HEK293T transfectadas a la incubadora (37 °C, 5% CO2).
- Cuando se complete la recolección de lentivirus después de 24 h o 48 h, agregue solución de descontaminación a las células, asegurándose de que cubra la monocapa celular. Mantenga el matraz en posición horizontal durante las siguientes 24 h, luego deséchelo siguiendo las regulaciones apropiadas de la categoría II.
4. Purificación de lentivirus
- Filtre el medio de recolección del paso 3.5.
- Retire el émbolo de la jeringa de 50 ml e inserte un filtro estéril de poliéter sulfona o fluoruro de polivinilideno de baja unión a proteínas de 0,45 μm en el extremo de la jeringa. Con una tira serológica de 25 ml, añada el medio recogido del paso 3.5.1 a la jeringa y devuelva suavemente el émbolo.
- Empuje el tapón lentamente para hacer pasar el medio a través del filtro a un tubo de centrífuga nuevo de 50 ml. Si el flujo se reduce significativamente, coloque la jeringa con el filtro apuntando hacia arriba y extraiga el émbolo lo suficiente como para eliminar el medio del filtro.
- Con cuidado, reemplace el filtro de la jeringa por uno nuevo y deseche el filtro usado en la solución de descontaminación. Continúe con la filtración del medio. Cuando termine, descontamine el filtro y la jeringa sumergiendo el filtro y llenando la jeringa con la solución de descontaminación.
- Enfríe previamente la ultracentrífuga ajustando la temperatura a 4 °C y cierre la tapa para permitir que la temperatura se aclimate.
- Añadir 3 mL de solución de sacarosa al 20 % (20 % p/v en agua ultrapura, esterilizada con filtro con un filtro de 0,22 μm) en el fondo del tubo cónico de ultracentrífuga.
- Usando una tireta serológica de 25 mL, superponga el medio filtrado sobre la capa de sacarosa, teniendo cuidado de no alterar las capas.
- Utilice el ajuste de velocidad más bajo en el chico de pipetas. Incline el tubo de ultracentrífuga cónico a unos 45° y añada lentamente el medio filtrado que contiene lentivirus desde el paso 4.1 hasta la pared del tubo. Asegúrese de que el medio y la sacarosa no se mezclen, y que se vea una clara separación de las capas (Figura 1B). A medida que aumenta el volumen de la capa media, incline lentamente el tubo de ultracentrífuga hacia atrás a una posición vertical.
- Si el volumen total, incluyendo la sacarosa y el medio, en el tubo de la ultracentrífuga es inferior a 29 ml, rellene con cDMEM nuevo para evitar que el tubo colapse durante el centrifugado. Para múltiples colecciones de T175 mL, mezcle preparaciones de medio filtrado y use varios tubos de ultracentrífuga. Rellene el tubo de ultracentrífuga final con el medio según sea necesario.
- Asegúrese de que los cubos de ultracentrífuga estén limpios; No hay residuos medianos en el fondo del cubo ni en las tapas. Si es necesario, limpie con ~ 70 % de alcohol. Coloque los adaptadores de tubo apropiados en el fondo de cada cubo (Figura 1C) y baje suavemente los tubos de ultracentrífuga en los cubos.
- Cierre los cubos de forma segura y cuélguelos en los espacios asignados en el rotor giratorio.
- Asegúrese de que los cubos estén equilibrados con los mismos volúmenes de sacarosa y medio. Un rotor giratorio nunca debe funcionar sin cucharones, aunque los cucharones opuestos pueden dejarse vacíos20 (Figura 1D).
- Inserte con cuidado el rotor en la ultracentrífuga y encienda la aspiradora. Ajuste la velocidad de aceleración y desaceleración de la ultracentrífuga al ajuste más bajo y ejecute las preparaciones de lentivirus a 85.000 x g durante 90 minutos a 4 °C.
- Espere a que la ultracentrífuga alcance la velocidad requerida (aproximadamente 3-5 minutos) antes de alejarse para asegurarse de que el rotor esté insertado correctamente y que el giro no termine.
- Mientras la ultracentrífuga está funcionando, limpie el espacio de trabajo de acuerdo con los requisitos de seguridad de la categoría II y prepare el espacio para los siguientes pasos.
- Cuando termine el centrifugado, desactive el vacío y retire con cuidado el rotor para no perturbar las muestras.
- Investigue la ultracentrífuga en busca de derrames y confirme que no haya fugas en los cubos. En caso de derrame, doble guante y descontamine la centrífuga y la superficie externa de los cubos con productos antivirales.
- Retire los cubos de la ultracentrífuga y transpórtelos con cuidado al armario de seguridad biológica de categoría II.
NOTA: Las partículas de lentivirus se acumulan en el fondo del tubo de ultracentrífuga. El perdigón no es visible a simple vista. - Vierta la sacarosa y el medio con un movimiento suave directamente en el contenedor de residuos con la solución de descontaminación.
- Manteniendo el tubo de ultracentrífuga invertido, transfiéralo a la doble capa de tejido y déjelo secar durante 10 min. Mientras tanto, limpie el interior de los cubos con un pañuelo de papel empapado en agua y séquelo al aire boca abajo.
- Seque cuidadosamente cualquier líquido restante del borde del tubo de ultracentrífuga con un pañuelo de papel antes de ponerlo en posición vertical. Desinfecte el pañuelo y la superficie que se encuentra debajo.
- Vuelva a suspender la pastilla de virus en 1 ml de medio o solución sin suero necesaria para una mayor experimentación pipeteando suavemente la solución hacia arriba y hacia abajo. Déjalo durante 15 min en RT dentro del gabinete de seguridad de biología de categoría II.
- Mezcle suavemente las preparaciones de lentivirus con una pipeta de 1 mL antes de alícuotas en tubos de rosca de 1,5 mL (por ejemplo, criotubos). Prepare las alícuotas para el trabajo in vivo (multiplicidad de 100 μL) y para el título de lentivirus en células T Jurkat (1 x 20 μL) (ver paso 5).
- Evite los ciclos de congelación y descongelación; Las preparaciones lentivirales pueden almacenarse a -80 °C durante un máximo de 6 meses sin que ello afecte negativamente a la infectividad.
5. Titulación de la producción de lentivirus en células T Jurkat
- Prepare el medio completo Roswell Park Memorial Institute 1640 (cRPMI-1640) para las células T Jurkat suplementando 500 mL de RPMI-1640 con suero fetal de ternero al 10% (v/v) y una concentración final de 100 U/mL de penicilina/estreptomicina.
- Para garantizar un cultivo saludable de células T Jurkat, mantenga las células en cultivo hasta 1 semana antes de la infección.
- El día de la titulación de lentivirus, extraiga las células T Jurkat viables en una placa de 24 pocillos a 2 x 105 células/pocillo en 200 μL por pocillo de cRPMI-1640.
- Utilice lentivirus recién recogido o descongele el vial de lentivirus que contiene 20 μL en hielo y mezcle suavemente pipeteando hacia arriba y hacia abajo.
- Utilizando la dilución en serie en cRPMI-1640, infecta las células T de Jurkat con 0,25 μL, 0,5 μL, 1 μL, 2,5 μL, 5 μL y 10 μL de caldo de lentivirus. Agite suavemente la placa para asegurar una distribución equitativa del lentivirus. Las células T Jurkat no infectadas sirven como control negativo.
- Incubar la placa a 37 °C. Después de 4 h, rellene cada pocillo con cRPMI hasta un volumen total de 400 μL. Vuelva a colocar la placa en la incubadora a 37 °C durante 3 días.
- Después de 48 h después de la infección, confirme la expresión de GFP bajo un sistema de imagen fluorescente.
- 3 días después de la infección, recoja cada pocillo de la placa de 24 pocillos en tubos de recolección separados de 1,5 ml y centrifugue las células a 350 x g a 4 °C durante 5 min.
- Deseche el sobrenadante. Vuelva a suspender el pellet en 300 μL de paraformaldehído (PFA) al 2% (PFA) preparado al 2% (p/v) en DPBS y déjelo durante 15 min en hielo en la oscuridad.
- Centrifugar las células a 350 x g a 4 °C durante 5 min y resuspender el pellet en un tampón de clasificación celular activado por fluorescencia (FACS) (DPBS estéril + 4% FCS + EDTA estéril de 1 mM).
- Analizar la frecuencia de expresión de GFP y la intensidad fluorescente media del lentivirus infectado y sus células control mediante citometría de flujo (Figura 2).
6. Infección in vivo por lentivirus de macrófagos peritoneales residentes en tejidos
- En un armario de seguridad biológica de categoría II, cargue las agujas de insulina con un volumen total de 200 μL de medio libre de suero que contenga la cantidad necesaria de lentivirus (utilice agujas de un solo uso, 30 G para el bienestar animal y para evitar la pérdida de líquidos en la aguja).
- Vuelva a colocar la funda de la aguja en la aguja utilizando la técnica de la cuchara con una sola mano. Mantenga la aguja en hielo e inyecte dentro de los 30 minutos.
- En el animalario, instale un gabinete de seguridad biológica de categoría II antes de las inyecciones (Figura 1E).
- Coloque una hoja de pañuelo de papel limpio. Afloje la vaina de la aguja de insulina que contiene lentivirus.
- Prepare una placa de Petri que contenga pequeños trozos de tejido y desinfectante a base de gluconato de clorhexidina, un tubo de 50 ml que contenga solución de descontaminación (2,000 ppm de solución de lejía) y un recipiente seguro para objetos punzantes.
- Sujete al ratón agarrando la piel por la nuca21. El mouse correctamente sujeto está inmóvil, y esto es necesario por seguridad.
- Con el abdomen hacia arriba, apunta la cabeza del animal ligeramente hacia abajo. Inyectar el lentivirus por vía intraperitoneal en el cuadrante inferior derecho de la cavidad abdominal. Esto es para evitar la inyección en cualquier órgano de la cavidad peritoneal.
- Antes de soltar el ratón, llene la jeringa con solución descontaminante y deséchela de forma segura en la caja fuerte afilada.
- Limpie el lugar de la inyección en el abdomen del ratón con un pañuelo empapado en desinfectante y devuelva el animal a la jaula.
- Alojar el ratón inyectado con lentivirus en jaulas de categoría II o en jaulas con ventilación individual (IVC) (jaulas aisladas con filtración de aire de alta eficiencia) durante un mínimo de 72 h después de la inyección. Coloque una tarjeta de información apropiada en la parte delantera de la jaula.
- Mueva el ratón a la nueva jaula de retención de categoría I después de 72 h después de la infección, según las aprobaciones de seguridad locales. Monitoree los ratones diariamente durante un total de 3 días desde la inyección.
7. Recolección de células peritoneales de ratones infectados con lentivirus
PRECAUCIÓN: Para las colecciones dentro de las 72 horas posteriores a la inyección de lentivirus, siga las reglas institucionales de seguridad biológica de categoría II. El lecho y la jaula de espera donde se mantuvieron los animales infectados en las primeras 72 horas después de la inyección de lentivirus deben descontaminarse de acuerdo con las normas institucionales de seguridad biológica de categoría II.
- Sacrificar ratones siguiendo las regulaciones institucionales, por ejemplo, mediante la inhalación de una concentración creciente de CO2, seguida de la confirmación de la muerte por dislocación cervical.
- Limpiar el abdomen del ratón con isopropanol al 70% y cortar cuidadosamente la piel para exponer la membrana de la cavidad peritoneal.
- Lave la cavidad peritoneal con 6 mL de tampón FACS helado utilizando una jeringa de 10 mL y una aguja de 23 G. Evite perforar cualquier órgano.
- Masajee suavemente el peritoneo para desalojar las células del tampón FACS.
- Recoja el líquido peritoneal con la misma jeringa y aguja.
- Retire la aguja y transfiera las células a un tubo de centrífuga de 15 ml.
- Mantener los lavados peritoneales en hielo.
- Recolectar otros órganos necesarios y almacenarlos según corresponda para el estudio.
- Deseche los cadáveres de los animales de acuerdo con las pautas locales de seguridad y animales.
8. Tinción y análisis de células peritoneales
- Centrifugar el lavado peritoneal a 350 x g a 4 °C durante 5 min, desechar el sobrenadante en la solución de descontaminación y resuspender las células en 1 mL de tampón FACS.
- Cuente las celdas recolectadas y coloque 4 x 105 celdas por pocillo en una placa de 96 pocillos con fondo en V.
- Realice la tinción de viabilidad utilizando un reactivo reutilizable (por ejemplo, el kit de tinción de células muertas de infrarrojo cercano fijable utilizado aquí) de acuerdo con las instrucciones del fabricante.
- Si las células se infectaron en las últimas 72 h, fije las células en PFA al 2% durante 15 minutos en hielo. Añadir un volumen igual de DPBS frío y volver a centrifugar a 350 x g a 4 °C durante 5 min.
- Prepare el tampón de bloqueo: Mezcle 4 μg/mL de anticuerpo 2.4G2 en suero de rata al 10% (v/v) en tampón FACS para tinción superficial o tampón de permeabilización para tinción intracelular.
- Vuelva a suspender cada pocillo que contenga gránulo celular en 50 μL de tampón de bloqueo e incube a 4 °C durante 15 min.
- Prepare la mezcla de anticuerpos en 50 μL de tampón FACS (para tinción superficial) o tampón de permeabilización (para tinción intracelular) por cada muestra. El volumen final de tinción para cada muestra será de 100 μL, incluyendo 50 μL de tampón de bloqueo. Calcular las concentraciones de anticuerpos en consecuencia (Tabla 1).
- Añada 50 μL de mezcla de anticuerpos a las muestras y 50 μL de controles de isotipo y tampón de control a las muestras de control. Incubar las muestras durante 30 minutos en hielo en la oscuridad. Incluya células sin teñir y controles de isotipo según sea necesario.
- Lave cada pocillo con 100-200 μL de DPBS helado y centrifugue la placa a 350 x g a 4 °C durante 5 min. Repita este paso para lavar los anticuerpos no unidos. Analice las muestras en un citómetro de flujo.
9. Extracción de células de órganos
- Prepare 1 mL de mezcla para la digestión por órgano: Mezcle la solución salina balanceada de Hank (HBSS), 2 mg/mL de colagenasa tipo IV y 0,03 mg/mL de DNasa I (incluye 1,5 mg/mL de hialuronidasa para la digestión pulmonar).
- Transfiera el órgano recolectado a 1 ml de mezcla de digestión y píquelo con unas tijeras.
- Filtrar las células a través de un colador de 40 μm y centrifugar a 350 x g a 4 °C durante 5 min.
- Si aísla células del pulmón, el bazo o el hígado, lise los glóbulos rojos con tampón de lisis ACK (150 mM NH4Cl, 10 mM KHCO3, 0,1 mM Na2EDTA pH = 7,4). Filtrar las células a través de un colador de 40 μm y centrifugar a 350 x g a 4 °C durante 5 min.
- Tiñir y analizar las células como se describe en la sección 8.
Resultados
Cuando se sigue completa y correctamente, este protocolo produce un total de 1,5 mL de stock de lentivirus de alta calidad por preparado individual, suficiente para doce inyecciones in vivo al volumen óptimo determinado en este estudio18. El éxito de la transfección se puede evaluar en una fase temprana del protocolo. Las células HEK293T sanas y confluentes deben mostrar, si están presentes en los plásmidos, una señal de marcador fácilmente detectable (por ejemplo, GFP utilizada en este estudio) después de 48 h después de la transfección del plásmido (Figura 1A). La baja intensidad de la señal, el desprendimiento excesivo de células y la baja confluencia en las primeras etapas del protocolo podrían indicar la muerte celular y resultarán en un bajo rendimiento de la preparación de lentivirus. Parte del desprendimiento de la célula antes de la recolección opcional II (paso 3.5.1.) es visible y esperado.
En este protocolo se utilizan tres plásmidos para la generación de partículas de lentivirus: pCMV-ΔR8.91 que empaqueta plásmidos que codifican la proteína estructural del VIH-1 (Gag), las proteínas accesorias Tat y Rev, y la polimerasa con transcriptasa inversa (Pol)22; pMD2.G que codifica la envoltura VSV-G bajo el promotor13 de CMV; y el plásmido pHR'SIN-cPPT-SEW (marcador GFP mejorado codificante)19 modificado en consecuencia para la expresión de shRNA o microRNA.
Las preparaciones de lentivirus se titulan en la línea de células T Jurkat debido a su alta infectividad23. La preparación exitosa de lentivirus logrará una tasa de infección de más del 95% con una dosis tan pequeña como 5 μL (Figura 2A). La intensidad fluorescente media de las células infectadas continúa aumentando con las dosis más altas (Figura 2B,C). Si es necesario, los títulos virales se pueden medir utilizando PCR en tiempo real de componentes virales integrados, por ejemplo, el promotor de SFFV, que se correlacionó linealmente con el porcentaje de células que expresan GFP y logarítmicamente con GFP MFI (Figura 2D). Dependiendo del constructo, particularmente aquellos con un insertogrande 24, algunas preparaciones de lentivirus pueden mostrar una infectividad reducida en las células T Jurkat, como se demostró para el constructo Cre-GFP utilizado en este estudio (Figura 2E, F). En tal caso, se podrían combinar múltiples preparaciones de partículas de lentivirus y resuspenderlas en 1 mL. Recomendamos validar las respuestas inmunitarias a esas preparaciones in vivo antes de la experimentación. Naturalmente, las preparaciones de lentivirus con receptores de entrada alternativos al VSV-G utilizadas aquí podrían mostrar una eficiencia de infección diferente en la línea de células T Jurkat, dependiendo de la expresión del receptor en las células. Las líneas celulares utilizadas para la titulación deben seleccionarse de manera que expresen el receptor utilizado por las partículas de lentivirus para entrar en las células y que preferentemente carezcan o tengan una expresión muy baja de los factores de restricción25.
La producción exitosa de partículas lentivirales se evidencia aún más por la infección de pMφ (definida como población CD11b+ , F4/80+ y Tim4+ )18 (Figura 3A). Determinamos que la inyección intraperitoneal de 100 μL de lentivirus (en un volumen total de 200 μL de medio libre de suero) produce el mayor porcentaje e intensidad de la señal GFP en estas células (Figura 3B, C). Las inyecciones de dosis más altas (150 μL y 200 μL de preparación de lentivirus) no tuvieron ningún impacto beneficioso sobre la expresión de GFP en el pMφ. Los experimentos de evolución temporal a las 4 h, 3 días, 7 días y 14 días después de la inyección intraperitoneal (i.p) con 100 μL de lentivirus revelaron un porcentaje significativo de pMφ residente que expresaba GFP en los días 3 y 7, seguido de la desaparición de la población infectada en el día 14 (Figura 3D, E). Curiosamente, la pMφ que expresa GFP desaparece en su mayoría el día 14 después de la infección, debido en parte al reconocimiento inmunológico del marcador GFP. De hecho, los experimentos de lentivirus con el marcador GFP en ratones Foxp3-DTR-eGFP selectivos T-Reg previenen el rechazo de la pMφ residente infectada hasta al menos el día 21 (Figura 3F). En el caso de los preparados de lentivirus con eficacia disminuida en las células Jurkat, se necesitaría una cantidad mayor para alcanzar la tasa de infección esperada in vivo. Sin embargo, como se demostró con la preparación de lentivirus Cre-GFP, dependiendo del diseño del constructo, incluso una dosis de 300 μL a los 7 días después de la inyección de i.p podría producir un mal resultado (Figura 3G). Anteriormente hemos demostrado el uso exitoso de este protocolo para la sobreexpresión y la eliminación de genes in vivo en pMφ de ratón, incluida la eliminación de Map3k8 y Gata6 mediada por shRNA lentiviral, y la sobreexpresión de Gata6 19. Aquí, demostramos que este protocolo también se puede emplear con éxito para la sobreexpresión del microARN murino 146b (mmu-miR-146b) y para la eliminación de la molécula de adhesión intercelular 1 (ICAM1, CD54) utilizando shRNA derivado lentiviral en pMφ residente (Figura 3H, I).
La infección de células primarias, como los macrófagos, requiere un mayor aporte de lentivirus, presumiblemente debido a la presencia de factores de restricción en estas células. Los factores de restricción son mecanismos protectores naturales de las células que interfieren con los pasos del ciclo de vida de los virus, como la transcripción inversa o la integración, lo que conduce a la inhibición de la expresión génica de las construcciones.
La validación in vivo del protocolo no demostró ningún efecto de la administración de lentivirus i.p sobre la viabilidad de las células inmunitarias peritoneales (Figura 4A) e indicó una infectividad distinta de las subpoblaciones residentes de pMφ (definida por la expresión de los marcadores CD73 y Tim4) (Figura 4B,C). Es importante destacar que la infección productiva por lentivirus se limitó a Mφ residente en el lugar de la inyección, como lo demuestra la falta de expresión significativa de GFP en Mφ de ganglios linfáticos mesentéricos (mLN), pulmón, hígado o bazo después de 7 días después de la provocación (Figura 4D). Teniendo en cuenta que, en muchos casos, se requiere que la orientación genética de Mφ se realice en condiciones inflamatorias, investigamos la efectividad de este protocolo en ratones desafiados intraperitonealmente con 0,1 mL de tioglicolato al 4%. La inyección de tioglicolato desencadena una afluencia de células monocíticas y Mφ derivadas de monocitos inflamatorios que se pueden dividir en 5 poblaciones distintas (Figura 4E). El análisis de citometría de flujo reveló un fenotipo refractario de células monocíticas (Ly6Chi poblaciones 1 y 2) a la infección por lentivirus, en línea con los hallazgos previos en células humanas26. Por el contrario, los Mφ residentes y los monocitos (grupos 3-5) siguieron siendo los más susceptibles a la infección (Figura 4F).
El análisis detallado de citometría de flujo detectó la expresión de GFP predominantemente en Mφ peritoneal residente y pMφ residente del complejo de histocompatibilidad mayor (MHC) clase II+ (MHCII+ F4/80+ Tim4+) (hasta el 60 % en el día 3 después de la inyección) (Figura 5A). Se detectó poca o ninguna señal de GFP en otras poblaciones de células peritoneales, incluidas las Mφ/DC peritoneales derivadas de la médula ósea (MHCII+, CD11b+, CD11c+), las células B (CD19+), las células T (CD3+), los mastocitos (CD11b-, FcεR1+), los eosinófilos (Siglec-F+), las células NK (CD19-, NK1.1+) y los neutrófilos (Ly6G+) (Figura 5A,B). La longevidad de la expresión de GFP (Figura 5C) en todas las poblaciones siguió a la de la Mφ peritoneal residente (Figura 1D). Se registró un aumento transitorio en la frecuencia de neutrófilos después de 4 h después de la inyección de 100 μL (en un volumen total de 200 μL de medio libre de suero) de lentivirus (Figura 5D), lo que indica una inflamación leve temprana presente en los animales desafiados. Por último, las pMφ residentes experimentaron una importante disminución de la frecuencia entre los días 7 y 14 post-infección (Figura 5E), lo que sugiere la mejor ventana experimental entre los días 3 y 7 post-inyección.

Figura 1: Producción de lentivirus en células HEK293T. (A) Imágenes representativas de inmunofluorescencia de células HEK293T 48 h después de una transfección exitosa (microscopio fluorescente [pico de excitación de 488 nm, pico de emisión de 510 nm], aumento de 20x, barra de escala = 400 μm). (B) Fotografía del tubo cónico de la ultracentrífuga que contiene una capa de sacarosa al 20% (abajo, transparente) y una capa de medio recogido de células HEK293T transfectadas (arriba, rojo). (C) Fotografía de la correcta inserción de la ultracentrífuga cónica en el cubo, incluido el adaptador. (D) Fotografías que muestren el equilibrado correcto e incorrecto del rotor de la ultracentrífuga. (E) Fotografía de la configuración óptima del gabinete Cat II y materiales para inyecciones in vivo para una persona diestra. Esta figura ha sido modificada con permiso de Ipseiz N et al.18. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Titulación de lentivirus en células T Jurkat. (A) Análisis citométrico de flujo representativo de células T Jurkat 72 h después de la infección con dosis crecientes de lentivirus que contienen un plásmido GFP que muestra el porcentaje de células GFP+ (GFP+), (B) intensidad de fluorescencia media (MFI) de células GFP+ y (C) un histograma representativo de la expresión de GFP. (D) Diagrama de dispersión que muestra MFI (izquierda Y) y el porcentaje de células infectadas con un lentivirus que expresa GFP (derecha Y) en comparación con el número de copias del virus detectadas por pg de ADN (eje x). (E) Un histograma representativo de la infección de células T Jurkat con preparación y control subóptimos de lentivirus Cre-GFP (Cre-GFP LV) y datos resumidos (F) que muestran el porcentaje de células T Jurkat infectadas con lentivirus Cre-GFP (GFP+). Esta figura ha sido modificada con permiso de Ipseiz N et al.18. Haga clic aquí para ver una versión más grande de esta figura.
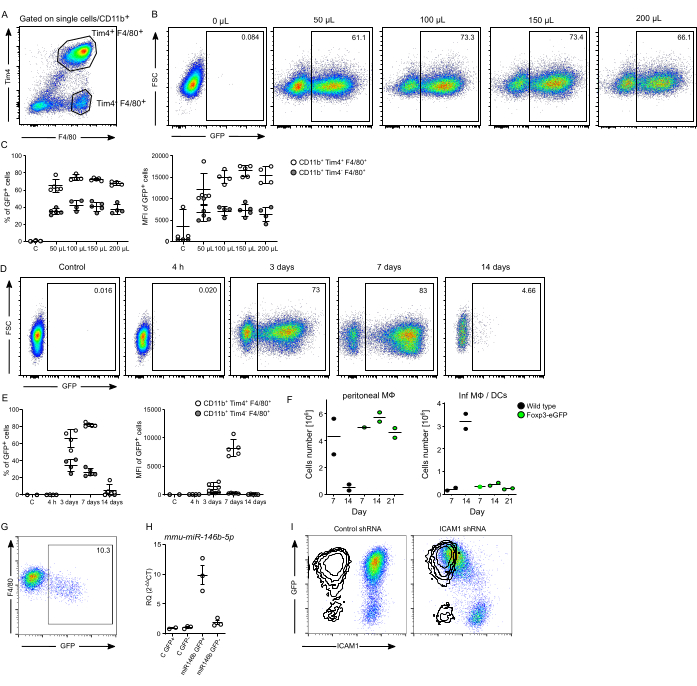
Figura 3: Eficiencia de infección del pMФ residente. (A) Estrategia de compuerta de las células residentes pMφ (CD11b+, Tim4+, F4/80+) y Tim4-, F4/80+ . Las células se comprimieron en singletes, seguidas de CD11b+. (B) diagramas de puntos representativos, y (C) un resumen de la frecuencia de infección (% de células GFP+) y la intensidad (MFI) de las células GFP+ aisladas 3 días después de la infección in vivo con diferentes cantidades de preparación de lentivirus GFP. (D) Diagrama de puntos representativo, y (E) un resumen de la frecuencia de infección (% de células GFP+) y la intensidad (MFI) de las células GFP+ aisladas en diferentes momentos después de la infección in vivo con 100 μL de lentivirus en un volumen total de 200 μL de medio libre de suero. (F) Un resumen del número de células a los días 7, 14 y 21 después de la administración intraperitoneal de lentivirus que expresa GFP en ratones Foxp3-DTR-eGFP que muestra el número de pMφ que expresan GFP y macrófagos inflamatorios y células dendríticas (InfMØs/DCs [F480low]). (n= 1-2 por grupo). (G) Diagrama de puntos representativo de la infección in vivo subóptima de Gata6-KO mye 19 pMφ residente con 300 μL de lentivirus Cre-GFP 7 días después de la inyección de i.p. (H) Cuantificación por RT-qPCR de la expresión de mmu-miR-146b-5p de Mφ peritoneal residente desafiada in vivo con 100 μL de lentivirus que codifica microRNA-146b murino (miR-146b) o control (C). Células residentes pMφ (círculos blancos) y células Tim4-, F4/80+ (círculos grises). (I) Un diagrama de puntos representativo de la regulación negativa exitosa de ICAM1 en pMφ en ratones hembra 129S6, 7 días después de la inyección i.p de lentivirus que contiene shRNA dirigido. Se muestra el shRNA de control. La superposición muestra el control del isotipo. Datos expresados como media ± SEM, n≥2 ratones. Esta figura ha sido modificada con permiso de Ipseiz N et al.18. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Eficiencia de infección de las subpoblaciones residentes de pMφ. (A) Porcentaje del total de células individuales y Mφ residentes viables 7 días después de la inyección de 100 μL de medios libres de suero (-) o lentivirus GFP (+) i.p. (B) Estrategia de compuerta que muestra cuatro poblaciones principales de pMφ encontradas in vivo: CD73 + Tim4+, CD73-Tim4-, CD73 + Tim4-, CD73-Tim4+, y (C) la frecuencia de infección correspondiente (% de células GFP+) e intensidad (MFI de células GFP+) de estas poblaciones. (D) Porcentaje de células GFP+ en múltiples órganos 7 días después de la inyección de 100 μL de lentivirus i.p. Abreviaturas: mLN, ganglio linfático mesentérico. (E) A los ratones se les inyectó i.p 0,1 mL de tioglicolato al 4% durante 5 días, seguido de una inyección i.p con lentivirus. Estrategia de activación de pMφ y monocitos después de 3 días después de la inyección de lentivirus i.p. (F) Análisis de frecuencia de infección, MFI y número de células de monocitos GFP+ (Ly6C+) y Mφ (Ly6C-). Datos expresados como media ± SEM, n≥3 ratones. Esta figura ha sido modificada con permiso de Ipseiz N et al.18. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Impacto de la inyección de lentivirus en la inflamación peritoneal. A los ratones se les inyectó in vivo i.p GFP que expresaba lentivirus. (A) Frecuencia de infección de las poblaciones celulares en la cavidad peritoneal después de varias cantidades de inyecciones de lentivirus (50 μL, 100 μL, 150 μL o 200 μL). (B) Intensidad de la expresión de GFP en poblaciones de células infectadas productivamente a los 7 días después de la inyección de i.p. (C) Frecuencia de infección de las poblaciones de células en la cavidad peritoneal en varios puntos de tiempo después de la inyección de i.p. (D) y (E) Porcentaje de células en varios puntos de tiempo después de la inyección de i.p. Todas las inyecciones de lentivirus se realizaron con el mismo volumen total de 200 μL completado por un medio libre de suero. A menos que se especificara lo contrario, se utilizó una dosis de lentivirus de 100 μL. Los ratones control ("C") recibieron 200 μL de medio medio puro y libre de suero. Datos expresados como media ± SEM, n≥3 ratones. Esta figura ha sido modificada con permiso de Ipseiz N et al.18. Haga clic aquí para ver una versión más grande de esta figura.
| Objetivo de anticuerpos | Fluoróforo | Clon | Dilución utilizada | concentración final [μg/mL] |
| Antígeno central del VIH-1 | RD1 | FH190-1-1 | 1/100 | 1 |
| I-A/I-E | PerCpCy5.5 | M5/114.15.2 | 1/400 | 0.5 |
| Ly6G | PerCpCy5.5 | 1A8 | 1/400 | 0.5 |
| CD3e | PerCpCy5.5 | 17A2 | 1/200 | 1 |
| CD3e | PE/Cy7 | 500A2 | 1/400 | 0.5 |
| CD11c | PE/Cy7 | N418 | 1/800 | 0.25 |
| CD11c | BV605 | N418 | 1/400 | 0.5 |
| CD226 | AF647 | 10 E 5 | 1/400 | 1.25 |
| Tim4 | AF647 | RTM4-54 | 1/600 | 0.83 |
| CD4 | APC | GK1.5 | 1/400 | 0.5 |
| CD11b | AF700 | M1/70 | 1/700 | 0.71 |
| CD11b | PerCpCy5.5 | M1/70 | 1/400 | 0.5 |
| F4/80 | Azul Pacífico | BM8 | 1/700 | 0.71 |
| F4/80 | BV605 | BM8 | 1/400 | 0.25 |
| F4/80 | BV711 | BM8 | 1/400 | 0.5 |
| CD73 | eFluor450 | TY/11.8 | 1/400 | 2.5 |
| CD19 | V450 | 1D3 | 1/400 | 0.5 |
| CD19 | APC | 1D3 | 1/400 | 0.5 |
| CD8a | eFluor450 | 53-6.7 | 1/400 | 0.5 |
| SiglecF | BV421 | E50-2440 | 1/400 | 0.5 |
| NK1.1 | APC/Cy7 | PK136 | 1/400 | 0.5 |
| FceR1 | eFluor450 | MAR-1 | 1/400 | 0.5 |
| ICAM1 | PEI | 1A29 | 1/100 | 2 |
| Rata IgG1, control de isotipo κ | PEI | 1/100 | 2 |
Tabla 1: Lista de anticuerpos
Discusión
Los macrófagos residentes en los tejidos realizan una serie de funciones homeostáticas e inflamatorias específicas de los tejidos 1,2 dictadas por su entorno fisiológico 6,7,8,9. En este protocolo, se introdujo un método eficaz18 para la manipulación de macrófagos residentes peritoneales in vivo utilizando partículas de lentivirus para investigar la función de los macrófagos en su microambiente biológico.
Es esencial para el éxito del protocolo utilizar células HEK293T sanas. La mejor práctica es descongelar las células al menos una semana antes del inicio de este protocolo para garantizar la recuperación de las células y un buen número. Las células deben sembrarse en un volumen adecuado de medio un día antes de la transfección planificada y deben alcanzar aproximadamente el 80% de confluencia el día de la transfección. Las preparaciones de células subconfluentes o excesivamente confluentes darán como resultado una reducción del rendimiento de lentivirus. Recomendamos transfectar HEK293T células con el reactivo de transfección de acuerdo con las instrucciones del fabricante para obtener los mejores resultados. Los pasos esenciales de la transfección incluyen la mezcla adecuada de los plásmidos y reactivos y la adición gota a gota de la mezcla directamente a la monocapa de células HEK293T. La transfección de fosfato de calcio de las célulasHEK293T 27,28 podría emplearse en este protocolo. Sin embargo, el usuario debe ser consciente de que la eficacia de este método puede variar y puede resultar en una disminución de la eficiencia de la transfección.
Las precauciones de seguridad deben tenerse en cuenta en el protocolo desde el día de HEK293T transfección celular. Estos incluyen trabajar en un gabinete de seguridad de categoría II, usar guantes dobles cuando se manipule material contaminado y un blanqueo adecuado del material contaminado (con solución de descontaminación, por ejemplo, 2.000 ppm de solución de lejía) durante un mínimo de 4 h. Los usuarios deben consultar su normativa institucional en relación con el trabajo con patógenos y residuos de categoría II.
En este protocolo, la preparación de lentivirus se purifica primero utilizando un filtro de 0,45 μm para eliminar HEK293T restos celulares. Debe evitarse el uso de filtros más pequeños (0,22 μm) y membranas de éster de celulosa, ya que provocará la pérdida de partículas de lentivirus. Se recomienda el uso de filtros de poliéter sulfona o fluoruro de polivinilideno de baja unión a proteínas29. El segundo paso de purificación se realiza en la capa única de sacarosa al 20% en una ultracentrífuga para eliminar las impurezas restantes, lo que es particularmente importante para la consiguiente administración in vivo de la preparación de lentivirus. En las instituciones donde no se dispone de una ultracentrífuga, otras30 han descrito la purificación de lentivirus a base de sacarosa utilizando una centrífuga de laboratorio estándar. Esto podría implementarse en este protocolo como una alternativa. La preparación de lentivirus se titula en las células T Jurkat en función de la expresión de la señal marcador (por ejemplo, GFP utilizada en este protocolo). En el caso de las construcciones sin marcadores, las partículas físicas de lentivirus podrían evaluarse mediante la cuantificación de la proteína p24gag del VIH-1 mediante el kit ELISA31, el análisis de citometría de flujo del antígenocentral 18 del VIH-1 o la medición de los cambios en el gen objetivo (preferentemente utilizando los métodos que permiten la medición de los cambios en células individuales, por ejemplo, citometría de flujo o microscopía). Si la titulación del control y el lentivirus difieren significativamente en las células T Jurkat, los volúmenes utilizados para los estudios in vivo pueden ajustarse para alcanzar la infección más comparable entre las preparaciones de lentivirus.
La principal limitación del protocolo es la desaparición observada de la Mφ peritoneal residente en GFP+ a los 14 días de la inyección de lentivirus i.p. Para estudios a largo plazo, se deben considerar líneas de ratón con alteración genética estable en un tipo de célula o tejidos específicos32. Por ejemplo, dado que los macrófagos peritoneales no expresan Foxp3 (una proteína T-Reg), utilizamos ratones Foxp3-DTR-eGFP33 y confirmamos que la expresión de GFP se mantiene en Mφ peritoneal a los 21 días después de la infección (Figura 3F). Sin embargo, es importante tener en cuenta que los lentivirus contienen otros componentes extraños, y esta extensión en la persistencia de las células infectadas en los ratones Foxp3-DTR-GFP puede no ser permanente. Una debilidad adicional de este método es un bajo nivel de inflamación que se puede observar en la cavidad peritoneal después de la inyección de lentivirus, como lo demuestra la afluencia de neutrófilos a las 4 h después de la inyección (Figura 5D), lo que puede significar que las infecciones repetidas acelerarían la pérdida asociada a la inflamación de Mφ peritoneal residente que expresa GFP. Aunque no hemos detectado interferones de tipo I (IFN) en la cavidad peritoneal, se demostró previamente que las partículas de lentivirus pseudotipadas por VSV-G inducen algunos de los genes estimulados por IFN en Mφ humano en ausencia de IFN detectables34. Esto debe tenerse en cuenta cuando se utiliza este protocolo para experimentos que investigan respuestas inmunitarias antivirales. La aparición de inflamación aguda y sostenida después de la inyección i.p de la preparación de lentivirus podría indicar contaminación de la preparación.
Las áreas de solución de problemas incluyen: 1) para un título bajo de lentivirus, garantizar la salud de las células HEK293T y una transfección efectiva (por ejemplo, expresión de marcadores, si están presentes, en HEK293T células). Si la tasa de infección sigue siendo baja, considere el tamaño del constructo. Las construcciones con insertos más grandes o estructuras secundarias más complejas pueden afectar el título final de lentivirus y la infectividad24. Por lo tanto, cada constructo debe probarse de forma independiente y en paralelo a su respectivo vector de control; 2) Si se requiere una gran cantidad de lentivirus, se recomienda preparar varios frascos T175 de células HEK293T y aumentar la producción en consecuencia. Para evitar la variación de las preparaciones de lentivirus, es una buena práctica fusionar las colecciones finales antes de la alícuota y el almacenamiento. Para una producción tan grande, la mezcla de plásmidos (sección 2) debe prepararse en tubos de 50 ml para garantizar una mezcla efectiva de los componentes.
A pesar de su amplio tropismo, las partículas lentivirales pseudotipadas de VSV-G se dirigen predominantemente a los macrófagos tisulares, como se demostró anteriormente para el alveolar35, y aquí18 para pMФ cuando se administran por las vías respectivas. Las alteraciones de la envoltura de las partículas de lentivirus pueden, en algunos casos, dar lugar a una disminución de la transducción de macrófagos in vivo36 y son innecesarias para este protocolo. En comparación con otros enfoques virales para la manipulación génica in vivo en macrófagos (revisado en37), el uso de vectores lentivirales ofrece una integración estable del transgén en los macrófagos tisulares35, una expresión transgénica eficiente y el límite de tamaño de vector más grande (aproximadamente 8 Kb).
Los Mφ peritoneales desempeñan un papel importante en la prevención, aparición, progresión y resolución de diversas enfermedades, como los cánceres abdominales, la pancreatitis y la peritonitis38. Este protocolo describe una herramienta eficaz para la modificación génica en pMφ murinos, que permite investigar los procesos biológicos detrás de estas patologías dentro de un microambiente fisiológicamente relevante. Si bien los vectores lentivirales en sí mismos se están convirtiendo en una herramienta de interés para las intervenciones clínicas39, debido al origen del virus de la inmunodeficiencia y a una integración estable del genoma, las preocupaciones de seguridad impiden su implementación terapéutica. Una mayor comprensión de las respuestas de los macrófagos a la modulación de genes lentivirales podría avanzar en la aplicación de esta herramienta altamente efectiva en un entorno clínico.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación fue financiada, en su totalidad o en parte, por el Wellcome Trust Investigator Award [107964/Z/15/Z]. P.R.T también cuenta con el apoyo del Instituto de Investigación de la Demencia del Reino Unido. M.A.C cuenta con el apoyo de la beca Discovery del Consejo de Investigación en Biotecnología y Ciencias Biológicas (BB/T009543/1). A los efectos del acceso abierto, el autor ha aplicado una licencia pública de derechos de autor CC BY a cualquier versión del manuscrito aceptado por el autor que surja de este envío. L.C.D es profesor en la Universidad de Swansea e investigador honorario en la Universidad de Cardiff. Este trabajo se apoya en el trabajo realizado por Ipseiz et al. 202018.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1x) (Trypsin 500 mg/L or 0.02 mM) | Thermo Fisher Scientific | 25300054 | |
| 0.22 μm sterile millex GP filter | Merck | SLGS033SS | |
| 0.45 μm sterile millex GP filter | Merck | SLHP033RS | |
| 0.5 mL U-100 insulin syringe with needle, 0.33 mm x 12.7 mm (29 G) | BD | 324892 | |
| 1 Litre Sharps Container | N/A | N/A | |
| 2.4G2 antibody (TruStain FcX anti-mouse CD16/32) | Biolegend | 101320 | |
| 40 μm strainer | Thermo Fisher Scientific | 22363547 | |
| AimV medium (research grade), AlbuMax Supplement | Thermo Fisher Scientific | 31035025 | |
| Blocking buffer | prepared in house | ||
| Brewer thioglycolate medium | Sigma-Aldrich | B2551 | 4% stock solution prepared in water, autoclaved and kept frozen. |
| CD11b | Biolegend | 101222 | Refer to Table 1 for the dilution and concentration |
| CD11b | BD | 550993 | Refer to Table 1 for the dilution and concentration |
| CD11c | Biolegend | 117317 | Refer to Table 1 for the dilution and concentration |
| CD11c | Biolegend | 117333 | Refer to Table 1 for the dilution and concentration |
| CD19 | BD | 560375 | Refer to Table 1 for the dilution and concentration |
| CD19 | Biolegend | 152410 | Refer to Table 1 for the dilution and concentration |
| CD226 | Biolegend | 128808 | Refer to Table 1 for the dilution and concentration |
| CD3e | BD | 560527 | Refer to Table 1 for the dilution and concentration |
| CD3e | Biolegend | 152313 | Refer to Table 1 for the dilution and concentration |
| CD4 | Biolegend | 100412 | Refer to Table 1 for the dilution and concentration |
| CD73 | eBioscience | 16-0731-82 | Refer to Table 1 for the dilution and concentration |
| CD8a | eBioscience | 48-0081-82 | Refer to Table 1 for the dilution and concentration |
| Cell culture flask (T175 fask, 175 cm2, 550 mL) | Greiner Bio One | 658175 | |
| Centrifuge tubes, conical bottom tubes 25 mm x 89 mm | Beckman Coulter | 358126 | |
| Centrifuges | Beckman Coulter | Ultracentrifuge and TC centrifuge | |
| Collagenase type IV | Sigma-Aldrich | C5138 | |
| Conical centrifuge tubes (15 mL and 50 mL) | Greiner Bio One | 11512303 & 11849650 | |
| Cryotubes | Greiner Bio One | 123277 | or cryotubes |
| DMEM medium (1x) + 4.5g/L D-glucose, 400 µM L-glutamine | Thermo Fisher Scientific | 41965-062 | |
| Dnase I | Sigma-Aldrich | 11284932001 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| F4/80 | Biolegend | 123123 | Refer to Table 1 for the dilution and concentration |
| F4/80 | Biolegend | 123133 | Refer to Table 1 for the dilution and concentration |
| F4/80 | Biolegend | 123147 | Refer to Table 1 for the dilution and concentration |
| FceR1 | eBioscience | 48-5898-80 | Refer to Table 1 for the dilution and concentration |
| Fetal calf serum (FCS) | Thermo Fisher Scientific | 10270-106 | heat inactivated for 30 min at 56 °C and sterile filtered through 0.22 μm filter |
| Flow cytometer | Thermo Fisher Scientific | Attune NxT | |
| Flow cytometry (FACS) buffer | prepared in house | ||
| Fluorescent tissue culture microscope | Thermo Fisher Scientific | EVOS FL | |
| Forceps | N/A | N/A | User preference |
| Hank's balanced salt solution (HBSS) | Gibco, Life Technologies | 14175-053 | |
| HEK293T cell line | grown for at least a week prior transfection. Mycoplasma free | ||
| HIV-1 Core antigen | Beckman Coulter | 6604667 | |
| Hyaluronidase | Sigma-Aldrich | H3506 | |
| Hydrex surgical scrub, chlorhexiding gluconate 4% w/v skin cleanser | Ecolab | 3037170 | |
| I-A/I-E | Biolegend | 107625 | Refer to Table 1 for the dilution and concentration |
| ICAM1 | Becton Dickinson | 554970 | Refer to Table 1 for the dilution and concentration |
| Jurkat T cell line | grown for at least a week prior use. Mycoplasma free | ||
| LIVE/DEAD fixable near-IR dead cell stain kit | Thermo Fisher Scientific | L34975 | |
| Ly6G | Biolegend | 127615 | Refer to Table 1 for the dilution and concentration |
| Mice | here used C57BL/6 females, aged 8-12 weeks (Charles Rivers), unless specified differently | ||
| Microcapillary pipettes (volume range 0.5-1,000 μL) | Fisher Scientific & Starlab | 11963466 & 11943466 & 11973466 & S1111-3700 | |
| NK1.1 | Biolegend | 108724 | Refer to Table 1 for the dilution and concentration |
| Paraformaldehyde | Sigma-Aldrich | P6148-500G | prepared to 2% w/v in PBS |
| pCMV-ΔR8.91 packaging plasmid | Zuffrey, R., et al. 1997 | encodes Gag-Pol HIV protein driven by cytomegalovirus promoter. Ampicilin resistance. | |
| Penicillin/Streptomycin (100x, 10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Petri dish | Greiner Bio One | 664160 | |
| pHR'SIN-cPPT-SEW plasmid | Rosas, M. et al. 2014 | modified for shRNA and miR expression studies. Encodes EGFP marker downstream SFFV promoter and upstream of the Woodchuck hepatitiv virus enhancer. Ampicilin resistance. | |
| pMD2.G plasmid | Naldini, L. et al. 1996 | encodes vesicular stomatis virus g-glycoprotein (VSV-G) envelope. Ampicilin resistance. | |
| Rat IgG1, κ isotype control | Becton Dickinson | 550617 | Refer to Table 1 for the dilution and concentration |
| Rat serum | Sigma-Aldrich | R9759-10ML | |
| Red blood ACK lysis buffer | prepared in house | ||
| RPMI 1640 medium (1x) + 400 uM L-glutamine | Thermo Fisher Scientific | 21875-091 | |
| Saponin | Sigma-Aldrich | S4521 | |
| SiglecF | BD | 562681 | Refer to Table 1 for the dilution and concentration |
| Sodium hypochlorite Tablets (bleach, 2,000 ppm) | Guest Medical | H8818 | |
| Sterile 24-well cell culture plate | Greiner Bio One | 662160 | |
| Sterile Dulbecco's PBS (DPBS) (1x) Mg++ and Ca2+ - free | Thermo Fisher Scientific | 14190144 | |
| Sterile EDTA | Thermo Fisher Scientific | 15575020 | |
| Sterile VWR disposable transfer pipets (23.0 mL, 30 cm) | VWR | 612-4515 | |
| Sucrose | Thermo Fisher Scientific | 15503022 | |
| surgical scissors | N/A | N/A | User preference |
| Syringes (50 mL and 1 0mL) | Fisher Scientific | 10084450 & 768160 | |
| Tim4 | Biolegend | 130007 | Refer to Table 1 for the dilution and concentration |
| U-bottom 96-well cell culture plate | Greiner Bio One | 650180 |
Referencias
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Jantsch, J., Binger, K. J., Muller, D. N., Titze, J. Macrophages in homeostatic immune function. Front Physiol. 5, 146 (2014).
- Wynn, T. A., Vannella, K. M. Macrophages in tissue repair, regeneration, and fibrosis. Immunity. 44 (3), 450-462 (2016).
- Ginhoux, F., Guilliams, M. Tissue-resident macrophage ontogeny and homeostasis. Immunity. 44 (3), 439-449 (2016).
- Epelman, S., Lavine, K. J., Randolph, G. J. Origin and functions of tissue macrophages. Immunity. 41 (1), 21-35 (2014).
- Amit, I., Winter, D. R., Jung, S. The role of the local environment and epigenetics in shaping macrophage identity and their effect on tissue homeostasis. Nat Immunol. 17 (1), 18-25 (2016).
- Gosselin, D., et al. Environment drives selection and function of enhancers controlling tissue-specific macrophage identities. Cell. 159 (6), 1327-1340 (2014).
- Lavin, Y., et al. Tissue-resident macrophage enhancer landscapes are shaped by the local microenvironment. Cell. 159 (6), 1312-1326 (2014).
- Davies, L. C., et al. Peritoneal tissue-resident macrophages are metabolically poised to engage microbes using tissue-niche fuels. Nat Commun. 8 (1), 2047 (2017).
- Shi, J., Hua, L., Harmer, D., Li, P., Ren, G. Cre driver mice targeting macrophages. Methods Mol Biol. 1784, 263-275 (2018).
- Wang, X., et al. Recent advances in lentiviral vectors for gene therapy. Sci China Life Sci. 64 (11), 1842-1857 (2021).
- Kosaka, Y., et al. Lentivirus-based gene delivery in mouse embryonic stem cells. Artif Organs. 28 (3), 271-277 (2004).
- Naldini, L., et al. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272 (5259), 263-267 (1996).
- Yamashita, M., Emerman, M. Capsid is a dominant determinant of retrovirus infectivity in nondividing cells. J Virol. 78 (11), 5670-5678 (2004).
- Wilson, A. A., et al. Lentiviral delivery of RNAi for in vivo lineage-specific modulation of gene expression in mouse lung macrophages. Mol Ther. 21 (4), 825-833 (2013).
- Burns, J. C., Friedmann, T., Driever, W., Burrascano, M., Yee, J. K. Vesicular stomatitis virus G glycoprotein pseudotyped retroviral vectors: concentration to very high titer and efficient gene transfer into mammalian and nonmammalian cells. Proc Natl Acad Sci U S A. 90 (17), 8033-8037 (1993).
- Finkelshtein, D., Werman, A., Novick, D., Barak, S., Rubinstein, M. LDL receptor and its family members serve as the cellular receptors for vesicular stomatitis virus. Proc Natl Acad Sci U S A. 110 (18), 7306-7311 (2013).
- Ipseiz, N., et al. Effective in vivo gene modification in mouse tissue-resident peritoneal macrophages by intraperitoneal delivery of lentiviral vectors. Mol Ther Methods Clin Dev. 16, 21-31 (2020).
- Rosas, M., et al. The transcription factor Gata6 links tissue macrophage phenotype and proliferative renewal. Science. 344 (6184), 645-648 (2014).
- . Available from: https://www.mybeckman.uk/resources/technologies/centrifugation/principles/rotor-balancing (2023)
- JoVE Science Education Database. Lab Animal Research. Rodent Handling and Restraint Techniques. , (2023).
- Zufferey, R., Nagy, D., Mandel, R. J., Naldini, L., Trono, D. Multiply attenuated lentiviral vector achieves efficient gene delivery in vivo. Nat Biotechnol. 15 (9), 871-875 (1997).
- Nasri, M., Karimi, A., Allahbakhshian Farsani, M. Production, purification and titration of a lentivirus-based vector for gene delivery purposes. Cytotechnology. 66 (6), 1031-1038 (2014).
- al Yacoub, N., Romanowska, M., Haritonova, N., Foerster, J. Optimized production and concentration of lentiviral vectors containing large inserts. J Gene Med. 9 (7), 579-584 (2007).
- Malim, M. H., Bieniasz, P. D. HIV restriction factors and mechanisms of evasion. Cold Spring Harb Perspect Med. 2 (5), a006940 (2012).
- Sonza, S., et al. Susceptibility of human monocytes to HIV type 1 infection in vitro is not dependent on their level of CD4 expression. AIDS Res Hum Retroviruses. 11 (7), 769-776 (1995).
- Kingston, R. E., Chen, C. A., Rose, J. K. Calcium phosphate transfection. Curr Protoc Mol Biol. Chapter 9, Unit 9.1 (2003).
- Brown, L. Y., Dong, W., Kantor, B. An Improved protocol for the production of lentiviral vectors. STAR Protoc. 1 (3), 100152 (2020).
- Moce-Llivina, L., Jofre, J., Muniesa, M. Comparison of polyvinylidene fluoride and polyether sulfone membranes in filtering viral suspensions. J Virol Methods. 109 (1), 99-101 (2003).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Sci Rep. 5, 13875 (2015).
- Czubala, M. A., et al. TGFbeta induces a SAMHD1-independent post-entry restriction to HIV-1 infection of human epithelial langerhans cells. J Invest Dermatol. 136 (10), 1981-1989 (2016).
- Bouabe, H., Okkenhaug, K. Gene targeting in mice: a review. Methods Mol Biol. 1064, 315-336 (2013).
- Kim, J. M., Rasmussen, J. P., Rudensky, A. Y. Regulatory T cells prevent catastrophic autoimmunity throughout the lifespan of mice. Nat Immunol. 8 (2), 191-197 (2007).
- Decalf, J., et al. Sensing of HIV-1 entry triggers a Type I Interferon response in human primary macrophages. J Virol. 91 (15), e00147-e00217 (2017).
- Wilson, A. A., et al. Amelioration of emphysema in mice through lentiviral transduction of long-lived pulmonary alveolar macrophages. J Clin Invest. 120 (1), 379-389 (2010).
- Markusic, D. M., van Til, N. P., Hiralall, J. K., Elferink, R. P., Seppen, J. Reduction of liver macrophage transduction by pseudotyping lentiviral vectors with a fusion envelope from Autographa californica GP64 and Sendai virus F2 domain. BMC Biotechnol. 9, 85 (2009).
- Burke, B., Sumner, S., Maitland, N., Lewis, C. E. Macrophages in gene therapy: cellular delivery vehicles and in vivo targets. J Leukoc Biol. 72 (3), 417-428 (2002).
- Bain, C. C., Jenkins, S. J. The biology of serous cavity macrophages. Cell Immunol. 330, 126-135 (2018).
- Milone, M. C., O'Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados