Method Article
Preparazione di vettori lentivirali per un'efficiente modulazione di geni e microRNA di macrofagi residenti nei tessuti della cavità peritoneale in vivo nei topi
In questo articolo
Riepilogo
Dimostriamo un protocollo passo-passo per lo studio della funzione genica nei macrofagi residenti nel tessuto peritoneale in vivo, utilizzando vettori lentivirali.
Abstract
I macrofagi residenti nel tessuto peritoneale hanno ampie funzioni nel mantenimento dell'omeostasi e sono coinvolti in patologie all'interno dei tessuti locali e limitrofi. Le loro funzioni sono dettate da segnali microambientali; Pertanto, è essenziale indagare il loro comportamento in una nicchia fisiologica in vivo . Attualmente, specifiche metodologie di targeting dei macrofagi peritoneali impiegano modelli transgenici di topo intero. Qui, viene descritto un protocollo per un'efficace modulazione in vivo dell'espressione di mRNA e piccole specie di RNA (ad esempio, microRNA) nei macrofagi peritoneali utilizzando particelle di lentivirus. I preparati di lentivirus sono stati realizzati in cellule HEK293T e purificati su un singolo strato di saccarosio. La convalida in vivo dell'efficacia del lentivirus dopo l'iniezione intraperitoneale ha rivelato un'infezione predominante dei macrofagi limitata al tessuto locale. Il targeting dei macrofagi peritoneali ha avuto successo durante l'omeostasi e la peritonite indotta da tioglicolati. Vengono discussi i limiti del protocollo, tra cui l'infiammazione di basso livello indotta dalla somministrazione intraperitoneale di lentivirus e le restrizioni temporali per potenziali esperimenti. Nel complesso, questo studio presenta un protocollo rapido e accessibile per la valutazione rapida della funzione genica nei macrofagi peritoneali in vivo.
Introduzione
I macrofagi residenti nei tessuti (Mφ) sono una popolazione eterogenea di cellule immunitarie fagocitiche che percepiscono e rispondono ai patogeni invasori 1,2. Inoltre, svolgono un ruolo essenziale nello sviluppo dei tessuti, nel rimodellamento e nel mantenimento dell'omeostasi 1,3. Molti Mφ tissutali derivano dai progenitori del sacco vitellino durante l'embriogenesi e persistono nel tessuto per tutta la vita 4,5. Il fenotipo e le funzioni di queste cellule sono dettate dalle interazioni collaborative e gerarchiche di specifici fattori di trascrizione e del microambiente locale 6,7,8,9. Una crescente comprensione di questa dipendenza aumenta la necessità di metodi efficaci in vivo per la manipolazione genica di Mφ all'interno della loro nicchia fisiologicamente rilevante.
I vettori lentivirali sono uno strumento frequentemente impiegato per la manipolazione degli acidi nucleici in specifiche popolazioni cellulari in vivo 10,11,12, in particolare grazie alla loro capacità di infettare sia le cellule in divisione che quelle non in divisione e di integrarsi stabilmente nel genoma dell'ospite 13,14. Negli ultimi due decenni, la tecnologia di somministrazione dei lentivirus è stata ottimizzata e sono stati studiati involucri alternativi e promotori sintetici per aumentare il targeting specifico del lignaggio 8,15. A causa del suo ampio tropismo cellulare, la glicoproteina dell'involucro del virus della stomatite vescicolare (VSV-G)16,17 è diventata l'involucro "gold standard" utilizzato nella tecnologia dei lentivirus.
In questo protocollo18, le particelle lentivirali pseudotipizzate VSV-G sono impiegate per dimostrare la somministrazione mirata ed efficace di RNA a forcina corta (shRNA) e microRNA (miR) a Mφ peritoneale di topo (pMφ) in vivo, allo stato stazionario19. L'espressione del transgene è stata guidata dal promotore del virus della formazione del fuoco della milza (SFFV). L'infezione produttiva delle cellule è stata definita dall'espressione della proteina fluorescente verde potenziata (GFP) derivata dal lentivirus. L'utilizzo di questo approccio ha permesso una facile lettura per esperimenti in vivo sul lentivirus per definire la dose ottimale e il periodo di tempo sperimentale. Infine, la provocazione lentivirale in vivo dei topi durante l'infiammazione indotta da tioglicolato ha rivelato la naturale propensione all'infezione selettiva da pMφ.
Protocollo
Tutto il lavoro sugli animali è stato condotto in conformità con le linee guida istituzionali e del Ministero degli Interni del Regno Unito.
NOTA: Tutti gli studi in vivo con lentivirus devono essere eseguiti secondo le linee guida locali e nazionali sull'uso etico degli animali nella ricerca, nonché aderendo a tutte le normative associate all'uso di materiali infettivi di categoria II. Anche il benessere degli animali deve essere monitorato in conformità con le normative locali. In questa fase del protocollo, è necessario prestare la massima attenzione quando si lavora con particelle lentivirali e taglienti.
1. Preparazione delle cellule HEK293T per la trasfezione
NOTA: Eseguire questi passaggi sotto una cappa di sicurezza biologica per colture tissutali sterili.
- Preparare il Dulbecco's Modified Eagle Medium (cDMEM) completo per HEK293T cellule combinando i 450 ml di DMEM con il 10% (v/v) di siero fetale di vitello (50 ml) e una concentrazione finale di 100 U/mL di penicillina/streptomicina.
- Scongelare HEK293T celle almeno 1 settimana prima della trasfezione pianificata. Mantenere sane le condizioni di crescita e il passaggio ogni 2-3 giorni utilizzando tripsina + EDTA per staccare le cellule dal pallone.
- Un giorno prima della trasfezione, aspirare con cura il terreno di coltura dalle cellule e lavare delicatamente le cellule con DPBS sterile. Aggiungere 1-5 mL di tripsina al pallone e incubare a 37 °C in un incubatore al 5% di CO2 per 2-5 minuti.
- Aggiungere 5-10 mL di cDMEM e centrifugare le cellule a 350 x g per 5 minuti. Rimuovere il liquido e risospendere il pellet cellulare in 10 mL di cDMEM. Contare le cellule e seminare 10-11 x 106 cellule HEK293T vitali per matraccio T175 in 20 mL di cDMEM.
- Incubare a 37 °C in un incubatore al 5% di CO2 per una notte per consentire alle cellule HEK293T di raggiungere la confluenza del 70%-80%.
- Il giorno seguente, confermare la confluenza delle cellule al microscopio ottico.
- Rimuovere il terreno dal pallone con una stripette sierologica da 25 mL senza disturbare il monostrato cellulare.
- Aggiungere delicatamente 10 mL di DPBS e agitare la piastra per lavare le cellule, facendo attenzione a non disturbare il monostrato cellulare.
- Rimuovere la DPBS con una stripette sierologica da 25 ml.
- Aggiungere 15 mL di nuovo cDMEM sulla parete per ogni matraccio T175 in modo da non disturbare il monostrato cellulare e rimettere la piastra nell'incubatore a 37 °C.
2. Trasfezione di cellule HEK293T utilizzando reagente di trasfezione lipidica non liposomiale
- In una provetta da centrifuga da 15 mL, preparare i componenti lentivirali: 2 μg di plasmide lentivirale, 1,5 μg di pΔ8.91 (pCMV-Δ8.91) e 1 μg di pMD2.G (pCMV-MD2.G) con Buffer EC (kit di reagenti di trasfezione) fino a un volume finale di 600 μL.
- Aggiungere 36 μl di soluzione potenziatrice. Miscelare i componenti utilizzando una pipetta da 1 mL aspirando ripetutamente una parte del liquido e rimettendola goccia a goccia direttamente sulla soluzione rimanente. Lasciare agire per 5 min a temperatura ambiente (RT).
- Aggiungere 120 μl di reagente di trasfezione e mescolare come sopra circa 20 volte. Incubare per 10 minuti a RT.
- Aggiungere 5,2 mL di cDMEM e mescolare come sopra con una stripette sierologica da 5 mL.
- Utilizzando una pipetta di trasferimento monouso, aggiungere la miscela di trasfezione goccia a goccia direttamente sul monostrato di cellule HEK293T (evitando le pareti del pallone), distribuendo la miscela in diversi punti del pallone.
- Distribuire il plasmide facendo oscillare delicatamente il pallone da un lato all'altro. Evitare di far entrare liquidi nel coperchio del pallone.
- Incubare il matraccio a 37 °C in un incubatore al 5 % di CO2 per 48 ore. Confermare l'efficace trasfezione delle cellule HEK293T mediante la comparsa di un marcatore fluorescente, in questo caso GFP, entro 24 ore dalla trasfezione monitorata al microscopio fluorescente per imaging cellulare.
NOTA: Per i costrutti senza il marcatore fluorescente, le cellule HEK293T devono essere testate per la presenza del gene marcatore utilizzato o per modifica dell'espressione nel gene/proteina di interesse con tecniche appropriate, ad esempio qPCR. In alternativa, il successo della trasfezione può essere verificato indirettamente durante il test della raccolta di lentivirus su cellule Jurkat nelle fasi successive del protocollo con le tecniche di cui sopra.
ATTENZIONE: Le cellule HEK293T trasfettate sono considerate infettive e devono essere implementate adeguate precauzioni di sicurezza quando si maneggiano queste cellule. Dovrebbero essere seguite le regole locali, che in genere potrebbero includere il lavoro sotto una cabina di sicurezza biologica di categoria II, l'uso di doppi guanti e un'appropriata soluzione di decontaminazione per la disinfezione, ad esempio un aumento della concentrazione di candeggina di scarto (2.000 ppm) o una soluzione equivalente secondo le linee guida istituzionali sulla biosicurezza. Tutte le soluzioni e le plastiche che entrano in contatto con il preparato di lentivirus devono essere disinfettate secondo le procedure istituzionali di biosicurezza.
3. Raccolta di particelle lentivirali
- Preparare una soluzione di decontaminazione, una soluzione di candeggina ad alta concentrazione (2.000 ppm) (ipoclorito di sodio) o un agente equivalente secondo le linee guida istituzionali sulla biosicurezza in un secchio e posizionarla nell'armadio di sicurezza per la biologia.
- Preparare l'armadio di sicurezza per la biologia rimuovendo eventuali oggetti in eccesso, come rack per provette vuoti, ecc.
- Pre-etichettare una provetta da centrifuga da 50 ml per pallone da HEK293T cellule T175 e rimuovere il coperchio dalla provetta da centrifuga. Posizionare le provette in una griglia stabile.
- Recuperare il pallone dall'incubatore e confermare l'espressione di GFP utilizzando un microscopio a fluorescenza con un laser a 488 nm (Figura 1A). L'intensità del segnale dipende dall'efficienza di trasfezione della procedura e dai costrutti utilizzati.
- Raccogliere il terreno dalle cellule nella provetta da centrifuga da 50 ml pre-marcata. Inclinare il pallone HEK293T T175 con celle trasfettate in modo che il fluido si raccolga nell'angolo inferiore del pallone. Utilizzando una stripette sierologica da 25 mL, raccogliere il terreno senza disturbare il monostrato cellulare. A questo punto potrebbero essere visibili alcune celle galleggianti. Trasferire il terreno in una provetta da centrifuga pulita da 50 ml e chiudere il coperchio.
- Utilizzando una stripette sierologica da 25 mL, aggiungere 25 mL di cDMEM fresco e caldo al pallone. Assicurarsi di dirigere il flusso del fluido sulle pareti del pallone per non disturbare il monostrato di celle. Rimettere il matraccio con le cellule HEK293T trasfettate nell'incubatore (37 °C, 5% CO2).
NOTA: Una seconda raccolta di lentivirus e un'ulteriore purificazione possono essere eseguite dopo ulteriori 24 ore seguendo la procedura descritta nei passaggi precedenti.
- Utilizzando una stripette sierologica da 25 mL, aggiungere 25 mL di cDMEM fresco e caldo al pallone. Assicurarsi di dirigere il flusso del fluido sulle pareti del pallone per non disturbare il monostrato di celle. Rimettere il matraccio con le cellule HEK293T trasfettate nell'incubatore (37 °C, 5% CO2).
- Quando la raccolta del lentivirus è completata dopo 24 ore o 48 ore, aggiungere la soluzione di decontaminazione alle cellule, assicurandosi che copra il monostrato cellulare. Tenere il pallone in posizione orizzontale per le successive 24 ore, quindi gettarlo seguendo le norme di categoria II appropriate.
4. Purificazione del lentivirus
- Filtra il mezzo di raccolta dal passaggio 3.5.
- Rimuovere lo stantuffo dalla siringa da 50 ml e inserire un filtro sterile da 0,45 μm in polietere sulfone o fluoruro di polivinilidene a basso legame proteico nell'estremità della siringa. Utilizzando una stripette sierologica da 25 mL, aggiungere il terreno raccolto dal passaggio 3.5.1 alla siringa e rimettere delicatamente lo stantuffo.
- Spingere lentamente il tappo per far passare il fluido attraverso il filtro in una provetta da centrifuga fresca da 50 ml. Se il flusso si riduce in modo significativo, posizionare la siringa con il filtro rivolto verso l'alto ed estrarre lo stantuffo quanto basta per eliminare il fluido dal filtro.
- Sostituire con cautela il filtro della siringa con uno nuovo e smaltire il filtro usato nella soluzione decontaminante. Continuare la filtrazione media. Al termine, decontaminare il filtro e la siringa immergendo il filtro e riempiendo la siringa con la soluzione decontaminante.
- Preraffreddare l'ultracentrifuga impostando la temperatura a 4 °C e chiudere il coperchio per consentire alla temperatura di acclimatarsi.
- Aggiungere 3 mL di soluzione di saccarosio al 20% (20% p/v in acqua ultrapura, filtro sterilizzato con un filtro da 0,22 μm) sul fondo della provetta conica per ultracentrifuga.
- Utilizzando una stripette sierologica da 25 mL, sovrapporre il terreno filtrato sopra lo strato di saccarosio, facendo attenzione a non disturbare gli strati.
- Utilizzare l'impostazione della velocità più bassa sul braccio della pipetta. Inclinare la provetta conica per ultracentrifuga a circa 45° e aggiungere lentamente il terreno filtrato contenente lentivirus dal passaggio 4.1 alla parete della provetta. Assicurarsi che il terreno e il saccarosio non si mescolino e che sia visibile una chiara separazione degli strati (Figura 1B). Man mano che il volume dello strato di terreno aumenta, inclinare lentamente la provetta dell'ultracentrifuga in posizione verticale.
- Se il volume totale, compreso il saccarosio e il terreno, nella provetta per ultracentrifuga è inferiore a 29 ml, rabboccare con cDMEM fresco per evitare che la provetta collassi durante la centrifuga. Per più raccolte di T175 mL, miscelare le preparazioni con terreno filtrato e utilizzare più provette per ultracentrifuga. Rabboccare la provetta finale dell'ultracentrifuga con il mezzo secondo necessità.
- Assicurarsi che i secchi dell'ultracentrifuga siano puliti; Non ci sono residui medi sul fondo del secchio o sui tappi. Se necessario, asciugare con ~70% di alcol. Inserire gli adattatori per provette appropriati sul fondo di ciascun secchio (Figura 1C) e abbassare delicatamente le provette per ultracentrifuga nei secchi.
- Chiudere saldamente i secchi e appenderli agli spazi assegnati sul rotore spin-out.
- Assicurarsi che i secchi siano bilanciati con gli stessi volumi di saccarosio e terreno. Un rotore spin-out non deve mai funzionare senza benne, anche se le benne opposte possono essere lasciate vuote20 (Figura 1D).
- Inserire con cautela il rotore nell'ultracentrifuga e accendere l'aspirapolvere. Impostare la velocità di accelerazione e decelerazione dell'ultracentrifuga sull'impostazione più bassa ed eseguire le preparazioni del lentivirus a 85.000 x g per 90 minuti a 4 °C.
- Attendere che l'ultracentrifuga raggiunga la velocità richiesta (circa 3-5 minuti) prima di allontanarsi per assicurarsi che il rotore sia inserito correttamente e che la centrifuga non termini.
- Mentre l'ultracentrifuga è in funzione, pulire l'area di lavoro in base ai requisiti di sicurezza di categoria II e preparare lo spazio per i passaggi successivi.
- Al termine della centrifuga, disabilitare il vuoto e rimuovere con cautela il rotore per non disturbare i campioni.
- Esaminare l'ultracentrifuga per eventuali fuoriuscite e verificare che non vi siano perdite dai secchi. In caso di fuoriuscita, indossare il guanto doppio e decontaminare la centrifuga e la superficie esterna dei secchi con prodotti antivirali.
- Rimuovere i secchi dall'ultracentrifuga e trasportarli con cura nell'armadio di sicurezza per biologia di categoria II.
NOTA: Le particelle di lentivirus si accumulano sul fondo della provetta dell'ultracentrifuga. Il pallino non è visibile ad occhio nudo. - Versare il saccarosio e il terreno con un movimento fluido direttamente nel contenitore dei rifiuti con la soluzione decontaminante.
- Mantenendo la provetta dell'ultracentrifuga capovolta, trasferirla sul doppio strato di tessuto e lasciarla asciugare per 10 minuti. Nel frattempo, pulisci l'interno dei secchi con un fazzoletto imbevuto d'acqua e asciugalo all'aria a testa in giù.
- Asciugare accuratamente il liquido rimanente dal bordo della provetta dell'ultracentrifuga con un fazzoletto prima di girarla in posizione verticale. Disinfettare il fazzoletto e la superficie sottostante.
- Risospendere il pellet virale in 1 mL di terreno o soluzione priva di siero necessari per ulteriori sperimentazioni pipettando delicatamente la soluzione verso l'alto e verso il basso. Lasciare agire per 15 minuti a RT all'interno dell'armadio di sicurezza per biologia di categoria II.
- Mescolare delicatamente i preparati di lentivirus utilizzando una pipetta da 1 ml prima di aliquotare in provette con tappo a vite da 1,5 ml (ad es. crioprovette). Preparare le aliquote per il lavoro in vivo (molteplicità di 100 μL) e per il titolo del lentivirus nelle cellule T Jurkat (1 x 20 μL) (vedere fase 5).
- Evitare cicli di gelo-disgelo; I preparati lentivirali possono essere conservati a -80 °C per un massimo di 6 mesi senza un effetto negativo sull'infettività.
5. Titolazione della produzione di lentivirus in cellule T Jurkat
- Preparare il terreno completo del Roswell Park Memorial Institute 1640 (cRPMI-1640) per le cellule T Jurkat integrando 500 ml di RPMI-1640 con il 10% (v/v) di siero fetale di vitello e la concentrazione finale di 100 U/mL di penicillina/streptomicina.
- Per garantire una coltura sana di cellule T Jurkat, mantenere le cellule in coltura fino a 1 settimana prima dell'infezione.
- Il giorno della titolazione del lentivirus, prelevare le cellule T Jurkat vitali in una piastra da 24 pozzetti a 2 x 105 cellule/pozzetto in 200 μL per pozzetto di cRPMI-1640.
- Utilizzare il lentivirus appena raccolto o scongelare la fiala di lentivirus contenente 20 μl di ghiaccio e mescolare delicatamente pipettando su e giù.
- Utilizzando la diluizione seriale in cRPMI-1640, infettare le cellule T Jurkat con 0,25 μL, 0,5 μL, 1 μL, 2,5 μL, 5 μL e 10 μL di stock di lentivirus. Scuotere delicatamente la piastra per garantire una distribuzione uniforme del lentivirus. Le cellule T Jurkat non infette fungono da controllo negativo.
- Incubare la piastra a 37 °C. Dopo 4 ore, rabboccare ogni pozzetto con cRPMI fino a un volume totale di 400 μl. Rimettere la piastra nell'incubatore a 37 °C per 3 giorni.
- Dopo 48 ore dall'infezione, confermare l'espressione della GFP con un sistema di imaging fluorescente.
- 3 giorni dopo l'infezione, raccogliere ciascun pozzetto della piastra a 24 pozzetti in provette di raccolta separate da 1,5 mL e centrifugare le cellule a 350 x g a 4 °C per 5 minuti.
- Scartare il surnatante. Risospendere il pellet in 300 μL di paraformaldeide (PFA) al 2% preparata al 2% (p/v) in DPBS e lasciarlo per 15 minuti in ghiaccio al buio.
- Centrifugare le cellule a 350 x g a 4 °C per 5 minuti e risospendere il pellet in tampone di selezione cellulare attivato da fluorescenza (FACS) (DPBS sterile + 4% FCS + 1 mM EDTA sterile).
- Analizzare la frequenza di espressione della GFP e l'intensità fluorescente media del lentivirus infetto e delle sue cellule di controllo utilizzando la citometria a flusso (Figura 2).
6. Infezione da lentivirus in vivo di macrofagi peritoneali residenti nei tessuti
- In una cabina di sicurezza biologica di categoria II, caricare aghi per insulina con un volume totale di 200 μl di terreno privo di siero contenente la quantità richiesta di lentivirus (utilizzare aghi monouso, 30 G per il benessere degli animali e per evitare la perdita di liquidi nell'ago).
- Riposizionare la guaina dell'ago sull'ago utilizzando la tecnica della paletta con una sola mano. Tenere l'ago sul ghiaccio e iniettare entro 30 minuti.
- Nella struttura per animali, allestire una cabina di sicurezza biologica di categoria II prima delle iniezioni (Figura 1E).
- Stendi un foglio di fazzoletto pulito. Allentare la guaina dell'ago per insulina contenente lentivirus.
- Preparare una capsula di Petri contenente piccoli pezzi di tessuto e un disinfettante a base di clorexidina gluconato, una provetta da 50 ml contenente una soluzione di decontaminazione (2.000 ppm di soluzione di candeggina) e un contenitore affilato e sicuro.
- Trattenere il topo afferrando la pelle all'altezza della nuca21. Il mouse adeguatamente trattenuto è immobile e questo è necessario per la sicurezza.
- Con l'addome rivolto verso l'alto, punta leggermente la testa dell'animale verso il basso. Iniettare il lentivirus per via intraperitoneale nel quadrante inferiore destro della cavità addominale. Questo per evitare l'iniezione in qualsiasi organo della cavità peritoneale.
- Prima di rilasciare il topo, riempire la siringa con la soluzione decontaminante e smaltirla in modo sicuro nella cassetta di sicurezza affilata.
- Pulire il sito di iniezione sull'addome del topo con un fazzoletto imbevuto di disinfettante e rimettere l'animale nella gabbia.
- Alloggiare il topo iniettato con lentivirus in gabbie di categoria II o in gabbie ventilate individualmente (IVC) (gabbie isolate con filtrazione dell'aria ad alta efficienza) per un minimo di 72 ore dopo l'iniezione. Posizionare un'apposita scheda informativa sulla parte anteriore della gabbia.
- Spostare il mouse nella nuova gabbia di contenimento di categoria I dopo 72 ore dall'infezione, a seconda delle approvazioni di sicurezza locali. Monitorare i topi quotidianamente per un totale di 3 giorni dall'iniezione.
7. Raccolta di cellule peritoneali da topo infetto da lentivirus
ATTENZIONE: Per le raccolte entro 72 ore dall'iniezione di lentivirus, seguire le norme di sicurezza biologica istituzionali di categoria II. La lettiera e la gabbia di detenzione in cui sono stati tenuti gli animali infetti nelle prime 72 ore dopo l'iniezione di lentivirus devono essere decontaminate secondo le norme istituzionali di sicurezza biologica di categoria II.
- Eutanasia dei topi seguendo le normative istituzionali, ad esempio, mediante inalazione di una concentrazione crescente di CO2, seguita dalla conferma della morte per lussazione cervicale.
- Pulire l'addome del topo con isopropanolo al 70% e tagliare accuratamente la pelle per esporre la membrana della cavità peritoneale.
- Lavare la cavità peritoneale con 6 mL di tampone FACS ghiacciato utilizzando una siringa da 10 mL e un ago da 23 G. Evita di perforare gli organi.
- Massaggiare delicatamente il peritoneo per rimuovere le cellule nel tampone FACS.
- Raccogliere il liquido peritoneale utilizzando la stessa siringa e ago.
- Rimuovere l'ago e trasferire le cellule in una provetta da centrifuga da 15 mL.
- Conservare i lavandi peritoneali su ghiaccio.
- Raccogliere gli altri organi necessari e conservarli in modo appropriato per lo studio.
- Smaltire le carcasse di animali secondo le linee guida locali per gli animali e la sicurezza.
8. Colorazione e analisi delle cellule peritoneali
- Centrifugare il lavaggio peritoneale a 350 x g a 4 °C per 5 minuti, scartare il surnatante nella soluzione di decontaminazione e risospendere le cellule in 1 mL di tampone FACS.
- Contare le cellule raccolte e la piastra 4 x 105 celle per pozzetto in una piastra a 96 pozzetti con fondo a V.
- Eseguire la colorazione di vitalità utilizzando un reagente fissabile (ad esempio, il kit di colorazione a cellule morte Fixable Near-IR utilizzato qui) secondo le istruzioni del produttore.
- Se le cellule sono state infettate nelle ultime 72 ore, fissare le cellule in PFA al 2% per 15 minuti su ghiaccio. Aggiungere un volume uguale di DPBS freddo e centrifugare nuovamente a 350 x g a 4 °C per 5 min.
- Preparare il tampone bloccante: Miscelare 4 μg/mL di anticorpo 2.4G2 in siero di ratto al 10% (v/v) nel tampone FACS per la colorazione superficiale o nel tampone di permeabilizzazione per la colorazione intracellulare.
- Risospendere ogni pozzetto contenente pellet di cellule in 50 μl di tampone bloccante e incubare a 4 °C per 15 minuti.
- Preparare la miscela di anticorpi in 50 μl di tampone FACS (per la colorazione superficiale) o tampone di permeabilizzazione (per la colorazione intracellulare) per ciascun campione. Il volume di colorazione finale per ciascun campione sarà di 100 μl, inclusi 50 μl di tampone bloccante. Calcolare le concentrazioni di anticorpi di conseguenza (Tabella 1).
- Aggiungere 50 μl di miscela di anticorpi ai campioni e 50 μl di controlli isotipici e tampone di controllo ai campioni di controllo. Incubare i campioni per 30 minuti su ghiaccio al buio. Includere cellule non colorate e controlli isotipici come richiesto.
- Lavare ogni pozzetto con 100-200 μL di DPBS ghiacciato e centrifugare la piastra a 350 x g a 4 °C per 5 minuti. Ripetere questo passaggio per eliminare eventuali anticorpi non legati. Analizzare i campioni su un citometro a flusso.
9. Estrazione di cellule dagli organi
- Preparare 1 ml di miscela per la digestione per organo: mescolare la soluzione salina bilanciata di Hank (HBSS), 2 mg/mL di collagenasi di tipo IV e 0,03 mg/mL di DNasi I (includere 1,5 mg/mL di ialuronidasi per la digestione polmonare).
- Trasferire l'organo raccolto in 1 ml di miscela per la digestione e tritarlo con le forbici.
- Filtrare le celle con un colino da 40 μm e centrifugare a 350 x g a 4 °C per 5 minuti.
- Se si isolano cellule dal polmone, dalla milza o dal fegato, lisare i globuli rossi utilizzando il tampone di lisi ACK (150 mM NH4Cl, 10 mM KHCO3, 0,1 mM Na2EDTA pH = 7,4). Filtrare le celle con un colino da 40 μm e centrifugare a 350 x g a 4 °C per 5 minuti.
- Colorare e analizzare le cellule come descritto nella sezione 8.
Risultati
Se seguito in modo completo e corretto, questo protocollo produce un totale di 1,5 ml di stock di lentivirus di alta qualità per singola preparazione, sufficiente per dodici iniezioni in vivo al volume ottimale determinato in questo studio18. Il successo della trasfezione può essere valutato all'inizio del protocollo. Le cellule HEK293T sane e confluenti dovrebbero mostrare, se presenti nei plasmidi, un segnale marcatore facilmente rilevabile (ad esempio, GFP utilizzato in questo studio) dopo 48 ore dalla trasfezione plasmidica (Figura 1A). La bassa intensità del segnale, l'eccessivo distacco cellulare e la bassa confluenza nelle prime fasi del protocollo potrebbero indicare la morte cellulare e risulteranno in una bassa resa del preparato di lentivirus. Parte del distacco di cellule prima della raccolta opzionale II (passaggio 3.5.1.) è visibile e previsto.
Tre plasmidi sono utilizzati in questo protocollo per la generazione di particelle di lentivirus: pCMV-ΔR8.91 che codifica per la proteina strutturale dell'HIV-1 (Gag), le proteine accessorie Tat e Rev e la trascrittasi polimerasi inversa (Pol)22; pMD2.G che codifica l'inviluppo VSV-G sotto il promotoreCMV 13; e il plasmide pHR'SIN-cPPT-SEW (marcatore GFP potenziato codificante)19 modificato di conseguenza per l'espressione di shRNA o microRNA.
I preparati di lentivirus sono titolati nella linea cellulare T di Jurkat a causa della loro elevata infettività23. Una preparazione di lentivirus di successo raggiungerà un tasso di infezione superiore al 95% con una dose di soli 5 μL (Figura 2A). L'intensità media fluorescente delle cellule infette continua ad aumentare con le dosi più elevate (Figura 2B, C). Se necessario, i titoli virali possono essere misurati utilizzando la PCR in tempo reale di componenti virali integrati, ad esempio il promotore SFFV, che correla linearmente con la percentuale di cellule che esprimono GFP e logaritmicamente con GFP MFI (Figura 2D). A seconda del costrutto, in particolare quelli con un grande inserto24, alcune preparazioni di lentivirus possono mostrare una ridotta infettività nelle cellule T Jurkat, come dimostrato per il costrutto Cre-GFP utilizzato in questo studio (Figura 2E, F). In tal caso, più preparazioni di particelle di lentivirus potrebbero essere combinate e risospese in 1 mL. Si consiglia di convalidare le risposte immunitarie a tali preparati in vivo prima della sperimentazione. Naturalmente, i preparati di lentivirus con recettori di ingresso alternativi al VSV-G utilizzati qui potrebbero mostrare una diversa efficienza di infezione nella linea cellulare T di Jurkat, a seconda dell'espressione del recettore sulle cellule. Le linee cellulari utilizzate per la titolazione devono essere selezionate in modo che esprimano il recettore utilizzato dalle particelle di lentivirus per entrare nelle cellule e preferenzialmente manchino o abbiano un'espressione molto bassa dei fattori di restrizione25.
Il successo della produzione di particelle lentivirali è ulteriormente evidenziato dall'infezione da pMφ (definita come popolazione CD11b+ , F4/80+ e Tim4+ )18 (Figura 3A). Abbiamo determinato che l'iniezione intraperitoneale di 100 μL di preparazione di lentivirus (in un volume totale di 200 μL di terreno privo di siero) produce la più alta percentuale e intensità del segnale GFP in queste cellule (Figura 3B, C). Le iniezioni di dosi più elevate (150 μL e 200 μL di preparato di lentivirus) non hanno avuto alcun impatto benefico sull'espressione di GFP nel pMφ. Gli esperimenti sull'andamento temporale a 4 ore, 3 giorni, 7 giorni e 14 giorni dopo l'iniezione intraperitoneale (i.p) con 100 μL di lentivirus hanno rivelato una percentuale significativa di pMφ residente che esprime GFP ai giorni 3 e 7, seguita dalla scomparsa della popolazione infetta al giorno 14 (Figura 3D, E). È interessante notare che la pMφ che esprime GFP scompare per lo più entro il giorno 14 dopo l'infezione, in parte a causa del riconoscimento immunitario del marcatore GFP. Infatti, esperimenti sui lentivirus con marcatore GFP in topi Foxp3-DTR-eGFP selettivi per T-Reg prevengono il rigetto del pMφ residente infetto almeno fino al giorno 21 (Figura 3F). Per i preparati di lentivirus con efficacia ridotta nelle cellule Jurkat, sarebbe necessaria una quantità maggiore per raggiungere il tasso di infezione previsto in vivo. Tuttavia, come dimostrato con la preparazione del lentivirus Cre-GFP, a seconda del design del costrutto, anche una dose di 300 μl a 7 giorni dopo l'iniezione i.p potrebbe produrre un risultato sfavorevole (Figura 3G). Abbiamo precedentemente dimostrato l'uso efficace di questo protocollo per la sovraespressione e il knockdown di geni in vivo nel pMφ di topo, tra cui il knockdown di Map3k8 e Gata6 mediato da shRNA lentivirale e la sovraespressione di Gata6 19. Qui, mostriamo che questo protocollo può essere impiegato con successo anche per la sovraespressione del microRNA murino 146b (mmu-miR-146b) e per il knockdown della molecola di adesione intercellulare 1 (ICAM1, CD54) utilizzando shRNA derivato lentivirale in pMφ residente (Figura 3H, I).
L'infezione delle cellule primarie, come i macrofagi, richiede un maggiore apporto di lentivirus, presumibilmente a causa della presenza di fattori di restrizione in queste cellule. I fattori di restrizione sono meccanismi protettivi naturali delle cellule che interferiscono con le fasi del ciclo di vita dei virus, come la trascrizione inversa o l'integrazione, portando all'inibizione dell'espressione genica dai costrutti.
Inoltre, la validazione in vivo del protocollo ha dimostrato l'assenza di effetti della somministrazione di lentivirus i.p sulla vitalità delle cellule immunitarie peritoneali (Figura 4A) e ha indicato una distinta infettività delle sottopopolazioni pMφ residenti (definite dall'espressione dei marcatori CD73 e Tim4) (Figura 4B, C). È importante sottolineare che l'infezione produttiva da lentivirus era limitata al Mφ residente nel sito di iniezione, come evidenziato dalla mancanza di un'espressione significativa di GFP nel linfonodo mesenterico (mLN), nel polmone, nel fegato o nella milza Mφ dopo 7 giorni dal test (Figura 4D). Considerando che in molti casi, il targeting genetico di Mφ deve essere eseguito in condizioni infiammatorie, abbiamo studiato l'efficacia di questo protocollo in topi sottoposti a test intraperitoneali con 0,1 mL di tioglicolato al 4%. L'iniezione di tioglicolato innesca un afflusso di cellule infiammatorie Mφ derivate da monociti e monocitiche che possono essere suddivise in 5 popolazioni distinte (Figura 4E). L'analisi della citometria a flusso ha rivelato un fenotipo refrattario di cellule monocitiche (Ly6Chi popolazioni 1 e 2) all'infezione da lentivirus, in linea con i precedenti risultati nelle cellule umane26. Al contrario, i Mφ residenti e i monociti (gruppi 3-5) sono rimasti i più suscettibili all'infezione (Figura 4F).
L'analisi dettagliata della citofluorimetria ha rilevato l'espressione di GFP prevalentemente nel Mφ peritoneale residente e nel complesso maggiore di istocompatibilità (MHC) di classe II+ pMφ residente (MHCII+ F4/80+ Tim4+) (fino al 60% al giorno 3 dopo l'iniezione) (Figura 5A). Il segnale GFP è stato rilevato poco o nessun segnale GFP in altre popolazioni di cellule peritoneali, tra cui Mφs/DC peritoneali derivate dal midollo osseo (MHCII+, CD11b+, CD11c+), cellule B (CD19+), cellule T (CD3+), mastociti (CD11b-, FcεR1+), eosinofili (Siglec-F+), cellule NK (CD19-, NK1.1+) e neutrofili (Ly6G+) (Figura 5A, B). La longevità dell'espressione di GFP (Figura 5C) in tutte le popolazioni ha seguito quella del Mφ peritoneale residente (Figura 1D). Un aumento transitorio della frequenza dei neutrofili è stato registrato dopo 4 ore dopo l'iniezione di 100 μL (in un volume totale di 200 μL di terreno privo di siero) di lentivirus (Figura 5D), indicando una lieve infiammazione precoce presente negli animali sfidati. Infine, la pMφ residente ha sperimentato un forte calo della frequenza tra i giorni 7 e 14 dopo l'infezione (Figura 5E), suggerendo la migliore finestra sperimentale tra i giorni 3 e 7 dopo l'iniezione.

Figura 1: Produzione di lentivirus in cellule HEK293T. (A) Immagini rappresentative in immunofluorescenza di cellule HEK293T 48 ore dopo la trasfezione riuscita (microscopio a fluorescenza [picco di eccitazione di 488 nm, picco di emissione di 510 nm], ingrandimento 20x, barra di scala = 400 μm). (B) Fotografia di una provetta conica per ultracentrifuga contenente uno strato di saccarosio al 20% (in basso, trasparente) e uno strato di terreno raccolto da cellule HEK293T trasfettate (in alto, in rosso). (C) Fotografia del corretto inserimento dell'ultracentrifuga conica nel secchio, compreso l'adattatore. (D) Fotografie che mostrino il corretto ed errato bilanciamento del rotore dell'ultracentrifuga. (E) Fotografia della configurazione ottimale dell'armadio Cat II e dei materiali per le iniezioni in vivo per un individuo destrorso. Questa cifra è stata modificata con il permesso di Ipseiz N et al.18. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Titolazione del lentivirus nelle cellule T di Jurkat. (A) Analisi citofluorimetrica rappresentativa delle cellule T di Jurkat 72 ore dopo l'infezione con dosi crescenti di lentivirus contenenti un plasmide GFP che mostra la percentuale di cellule GFP+ (GFP+), (B) intensità media di fluorescenza (MFI) delle cellule GFP+ e (C) un istogramma rappresentativo dell'espressione di GFP. (D) Grafico a dispersione che mostra l'MFI (Y sinistro) e la percentuale di cellule infettate da un lentivirus che esprime GFP (Y destro) rispetto al numero di copie del virus rilevato per pg di DNA (asse x). (E) Un istogramma rappresentativo dell'infezione da cellule T di Jurkat con preparazione e controllo subottimali del lentivirus Cre-GFP (Cre-GFP LV) e (F) dati riassuntivi che mostrino la percentuale di lentivirus Cre-GFP infettati da cellule T di Jurkat (GFP+). Questa cifra è stata modificata con il permesso di Ipseiz N et al.18. Clicca qui per visualizzare una versione più grande di questa figura.
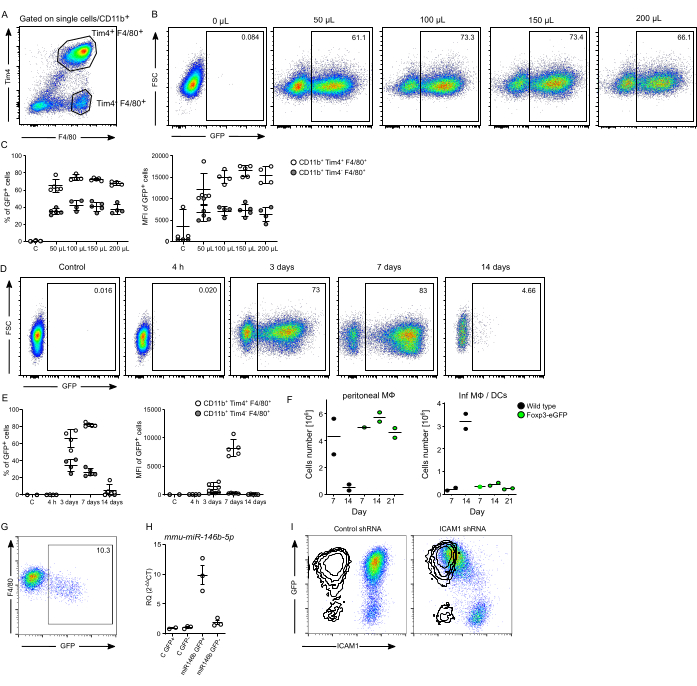
Figura 3: Efficienza dell'infezione del pMФ residente. (A) Strategia di gating delle celle pMφ residenti (CD11b+, Tim4+, F4/80+) e Tim4-, F4/80+ . Le cellule sono state gated su singoletto, seguite da CD11b+. (B) Dot plot rappresentativi e (C) un riepilogo della frequenza di infezione (% di cellule GFP+) e dell'intensità (MFI) delle cellule GFP+ isolate 3 giorni dopo l'infezione in vivo con diverse quantità di preparato di lentivirus GFP. (D) Dot plot rappresentativo e (E) un riepilogo della frequenza di infezione (% di cellule GFP+) e dell'intensità (MFI) delle cellule GFP+ isolate in diversi momenti dopo l'infezione in vivo con 100 μL di lentivirus in un volume totale di 200 μL di terreno privo di siero. (F) Un riassunto del numero di cellule ai giorni 7, 14 e 21 dopo la somministrazione intra-peritoneale di lentivirus che esprime GFP in topi Foxp3-DTR-eGFP che mostra il numero di pMφ che esprimono GFP e macrofagi infiammatori e cellule dendritiche (InfMØs/DCs [F480low]). (n= 1-2 per gruppo). (G) Dot plot rappresentativo dell'infezione in vivo subottimale di Gata6-KO mye 19 pMφ residente con 300 μL di lentivirus Cre-GFP 7 giorni dopo l'iniezione di i.p. (H) Quantificazione RT-qPCR dell'espressione di mmu-miR-146b-5p di Mφ peritoneale residente sfidato in vivo con 100 μL di lentivirus che codifica per microRNA-146b murino (miR-146b) o di controllo (C). pMφ residente (cerchi bianchi) e celle Tim4-, F4/80+ (cerchi grigi). (I) Un dot plot rappresentativo della sottoregolazione di ICAM1 su pMφ in topi femmina 129S6, 7 giorni dopo l'iniezione i.p di lentivirus contenente shRNA mirato. Viene mostrato l'shRNA di controllo. La sovrapposizione mostra il controllo dell'isotipo. Dati espressi come media ± SEM, n≥2 topi. Questa cifra è stata modificata con il permesso di Ipseiz N et al.18. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Efficienza dell'infezione delle sottopopolazioni residenti di pMφ. (A) Percentuale di singole cellule totali e Mφ residenti vitali 7 giorni dopo 100 μL di terreno privo di siero (-) o GFP lentivirus (+) i.p iniezione. (B) Strategia di gating che mostra quattro principali popolazioni di pMφ trovate in vivo: CD73+Tim4+, CD73-Tim4-, CD73+Tim4-, CD73-Tim4+, e (C) corrispondente frequenza di infezione (% di cellule GFP+) e intensità (MFI delle cellule GFP+) di queste popolazioni. (D) Percentuale di cellule GFP+ in più organi 7 giorni dopo l'iniezione di 100 μL di lentivirus i.p. Abbreviazioni: mLN, linfonodo mesenterico. (E) Ai topi è stata iniettata i.p 0,1 mL di tioglicolato al 4% per 5 giorni, seguita da iniezione i.p con lentivirus. Strategia di gating di pMφ e monociti dopo 3 giorni dall'iniezione di lentivirus i.p. (F) Analisi della frequenza di infezione, dell'MFI e del numero di cellule dei monociti GFP+ (Ly6C+) e Mφ (Ly6C-). Dati espressi come media ± SEM, n≥3 topi. Questa cifra è stata modificata con il permesso di Ipseiz N et al.18. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Impatto dell'iniezione di lentivirus sull'infiammazione peritoneale. Ai topi è stato iniettato in vivo i.p con lentivirus che esprime GFP. (A) Frequenza di infezione delle popolazioni cellulari nella cavità peritoneale a seguito di varie quantità di iniezioni di lentivirus (50 μL, 100 μL, 150 μL o 200 μL). (B) Intensità dell'espressione della GFP in popolazioni cellulari infettate in modo produttivo a 7 giorni dall'iniezione di i.p. (C) Frequenza di infezione delle popolazioni cellulari nella cavità peritoneale in vari punti temporali dopo l'iniezione i.p. (D) e (E) Percentuale di cellule in vari momenti dopo l'iniezione i.p. Tutte le iniezioni di lentivirus sono state eseguite con lo stesso volume totale di 200 μL completato da terreno privo di siero. Se non diversamente specificato, è stata utilizzata una dose di lentivirus da 100 μl. I topi di controllo ("C") hanno ricevuto 200 μL di terreno di coltura pulito e privo di siero. Dati espressi come media ± SEM, n≥3 topi. Questa cifra è stata modificata con il permesso di Ipseiz N et al.18. Clicca qui per visualizzare una versione più grande di questa figura.
| Bersaglio anticorpale | Fluoroforo | Clone | Diluizione utilizzata | concentrazione finale [μg/mL] |
| Antigene centrale dell'HIV-1 | RD1 | FH190-1-1 | 1/100 | 1 |
| I-A/I-E | PerCpCy5.5 | M5/114.15.2 | 1/400 | 0.5 |
| Ly6G | PerCpCy5.5 | 1A8 | 1/400 | 0.5 |
| CD3e | PerCpCy5.5 | 17A2 | 1/200 | 1 |
| CD3e | PE/Cy7 | 500A2 | 1/400 | 0.5 |
| CD11c | PE/Cy7 | N418 | 1/800 | 0.25 |
| CD11c | BV605 | N418 | 1/400 | 0.5 |
| CD226 | AF647 | 10 E 5 | 1/400 | 1.25 |
| Tim4 | AF647 | RTM4-54 | 1/600 | 0.83 |
| CD4 | APC | GK1.5 | 1/400 | 0.5 |
| CD11b | AF700 | M1/70 | 1/700 | 0.71 |
| CD11b | PerCpCy5.5 | M1/70 | 1/400 | 0.5 |
| F4/80 | Blu Pacifico | BM8 | 1/700 | 0.71 |
| F4/80 | BV605 | BM8 | 1/400 | 0.25 |
| F4/80 | BV711 | BM8 | 1/400 | 0.5 |
| CD73 | eFluor450 | TY/11.8 | 1/400 | 2.5 |
| CD19 | V450 | 1D3 | 1/400 | 0.5 |
| CD19 | APC | 1D3 | 1/400 | 0.5 |
| CD8a | eFluor450 | 53-6.7 | 1/400 | 0.5 |
| SiglecF | BV421 | E50-2440 | 1/400 | 0.5 |
| NK1.1 | APC/Cy7 | PK136 | 1/400 | 0.5 |
| FceR1 | eFluor450 | MAR-1 | 1/400 | 0.5 |
| ICAM1 | PE | 1A29 | 1/100 | 2 |
| IgG1 di ratto, controllo dell'isotipo κ | PE | 1/100 | 2 |
Tabella 1: Elenco degli anticorpi
Discussione
I macrofagi residenti nei tessuti svolgono una serie di funzioni tessuto-specifiche omeostatiche e infiammatorie 1,2 dettate dal loro ambiente fisiologico 6,7,8,9. In questo protocollo, è stato introdotto un metodo efficace18 per la manipolazione di macrofagi residenti peritoneali in vivo utilizzando particelle di lentivirus per studiare la funzione dei macrofagi nel loro microambiente biologico.
È essenziale per il successo del protocollo utilizzare cellule HEK293T sane. È buona norma scongelare le celle almeno una settimana prima dell'inizio di questo protocollo per garantire il recupero delle cellule e un buon numero. Le cellule devono essere seminate in un volume appropriato di terreno un giorno prima della trasfezione pianificata e devono raggiungere circa l'80% di confluenza il giorno della trasfezione. Le preparazioni cellulari sotto- o troppo confluenti si tradurranno in una riduzione della resa dei lentivirus. Si consiglia di trasfezionare le cellule HEK293T con il reagente di trasfezione secondo le istruzioni del produttore per ottenere i migliori risultati. Le fasi essenziali della trasfezione includono l'appropriata miscelazione dei plasmidi e dei reagenti e l'aggiunta goccia a goccia della miscela direttamente al monostrato di cellule HEK293T. La trasfezione con fosfato di calcio di cellule HEK293T27,28 potrebbe essere impiegata in questo protocollo. Tuttavia, l'utente deve essere consapevole che l'efficacia di questo metodo può variare e può comportare una diminuzione dell'efficienza di trasfezione.
Le precauzioni di sicurezza devono essere prese in considerazione nel protocollo a partire dal giorno della HEK293T trasfezione cellulare. Questi includono il lavoro in un armadio di sicurezza di categoria II, l'uso di doppi guanti quando si maneggia materiale contaminato e l'appropriato sbiancamento del materiale contaminato (con soluzione di decontaminazione, ad esempio, 2.000 ppm di soluzione di candeggina) per almeno 4 ore. Gli utenti devono fare riferimento alle loro normative istituzionali relative al lavoro con agenti patogeni e rifiuti di categoria II.
In questo protocollo, la preparazione di lentivirus viene prima purificata utilizzando un filtro da 0,45 μm per rimuovere i detriti cellulari HEK293T. L'uso di filtri più piccoli (0,22 μm) e membrane di esteri di cellulosa dovrebbe essere evitato in quanto comporterebbe la perdita di particelle di lentivirus. Si consiglia di utilizzare filtri a basso contenuto proteico in polietere sulfone o fluoruro di polivinilidene29. La seconda fase di purificazione viene eseguita sul singolo strato di saccarosio al 20% in un'ultracentrifuga per rimuovere le impurità residue, particolarmente importante per la conseguente somministrazione in vivo del preparato di lentivirus. Nelle istituzioni in cui non è disponibile un'ultracentrifuga, altre30 hanno descritto la purificazione del lentivirus a base di saccarosio utilizzando una centrifuga da laboratorio standard. Ciò potrebbe essere implementato in questo protocollo in alternativa. La preparazione del lentivirus viene titolata in cellule T Jurkat sull'espressione del segnale del marcatore (ad esempio, GFP utilizzata in questo protocollo). Per i costrutti senza marcatori, le particelle fisiche del lentivirus potrebbero essere valutate mediante quantificazione della proteina p24gag dell'HIV-1 mediante kit ELISA31, analisi con citometria a flusso dell'antigene18 del core dell'HIV-1 o misurazione dei cambiamenti nel gene bersaglio (preferibilmente utilizzando i metodi che consentono la misurazione dei cambiamenti nelle singole cellule, ad esempio citometria a flusso o microscopia). Se la titolazione del controllo e del lentivirus differisce in modo significativo nelle cellule T Jurkat, i volumi utilizzati per gli studi in vivo possono essere aggiustati per raggiungere l'infezione più comparabile tra i preparati di lentivirus.
La principale limitazione del protocollo è la scomparsa osservata di Mφ peritoneale residente in GFP+ entro 14 giorni dall'iniezione di lentivirus i.p. Per gli studi a lungo termine, dovrebbero essere prese in considerazione linee murine con alterazione genetica stabile in un tipo di cellula o tessuto specifico32. Ad esempio, poiché i macrofagi peritoneali non esprimono Foxp3 (una proteina T-Reg), abbiamo utilizzato topi Foxp3-DTR-eGFP33 e abbiamo confermato che l'espressione di GFP è mantenuta in Mφ peritoneale a 21 giorni dopo l'infezione (Figura 3F). Tuttavia, è importante notare che i lentivirus contengono altri componenti estranei e questa estensione della persistenza delle cellule infette nei topi Foxp3-DTR-GFP potrebbe non essere permanente. Un ulteriore punto debole di questo metodo è un basso livello di infiammazione che può essere osservato nella cavità peritoneale dopo l'iniezione di lentivirus, come testimoniato dall'afflusso di neutrofili a 4 ore dopo l'iniezione (Figura 5D), il che può significare che infezioni ripetute accelererebbero la perdita associata all'infiammazione di Mφ peritoneale residente che esprime GFP. Sebbene non siano stati rilevati interferoni di tipo I (IFN) nella cavità peritoneale, è stato precedentemente dimostrato che le particelle di lentivirus pseudotipizzate VSV-G inducono alcuni dei geni stimolati con IFN nella Mφ umana in assenza di IFN34 rilevabili. Questo dovrebbe essere considerato quando si utilizza questo protocollo per esperimenti che studiano le risposte immunitarie antivirali. L'insorgenza di infiammazione acuta e prolungata dopo l'iniezione i.p di un preparato di lentivirus potrebbe indicare la contaminazione del preparato.
Le aree di risoluzione dei problemi includono: 1) per un basso titolo di lentivirus, garantire la salute delle cellule HEK293T e una trasfezione efficace (ad esempio, l'espressione del marcatore, se presente, nelle cellule HEK293T). Se il tasso di infezione rimane basso, considerare le dimensioni del costrutto. I costrutti con inserti più grandi o strutture secondarie più complesse possono influenzare il titolo finale del lentivirus e l'infettività24. Pertanto, ogni costrutto dovrebbe essere testato in modo indipendente e in parallelo al rispettivo vettore di controllo; 2) Se è richiesta un'elevata quantità di lentivirus, si raccomanda di preparare più fiasche T175 di cellule HEK293T e di aumentare la produzione di conseguenza. Per evitare variazioni delle preparazioni di lentivirus, è consigliabile unire le raccolte finali prima dell'aliquotazione e dello stoccaggio. Per una produzione così ampia, la miscela di plasmidi (sezione 2) deve essere preparata in provette da 50 mL per garantire un'efficace miscelazione dei componenti.
Nonostante il suo ampio tropismo, le particelle lentivirali pseudotipizzate VSV-G colpiscono prevalentemente i macrofagi tissutali, come dimostrato in precedenza per l'alveolare35, e qui18 per il pMФ quando somministrate per le rispettive vie. Alterazioni dell'involucro delle particelle di lentivirus possono, in alcuni casi, comportare una diminuzione della trasduzione dei macrofagi in vivo36 e non sono necessarie per questo protocollo. Rispetto ad altri approcci virali per la manipolazione genica in vivo nei macrofagi (rivisti in37), l'uso di vettori lentivirali offre un'integrazione stabile del transgene nei macrofagi tissutali35, un'espressione efficiente del transgene e il limite di dimensione del vettore più grande (circa 8 Kb).
Le Mφ peritoneali svolgono un ruolo importante nella prevenzione, insorgenza, progressione e risoluzione di varie malattie, tra cui i tumori addominali, la pancreatite e la peritonite38. Questo protocollo descrive uno strumento efficace per la modificazione genica nella pMφ murina, consentendo di studiare i processi biologici alla base di queste patologie all'interno di un microambiente fisiologicamente rilevante. Mentre i vettori lentivirali stessi stanno diventando uno strumento di interesse per gli interventi clinici39, a causa dell'origine dal virus dell'immunodeficienza e di un'integrazione stabile del genoma, i problemi di sicurezza ne impediscono l'implementazione terapeutica. Un'ulteriore comprensione delle risposte dei macrofagi alla modulazione genica lentivirale potrebbe far progredire l'applicazione di questo strumento altamente efficace in ambito clinico.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata finanziata, in tutto o in parte, dal Wellcome Trust Investigator Award [107964/Z/15/Z]. La PRT è supportata anche dal Dementia Research Institute del Regno Unito. Il Master è supportato dalla Biotechnology and Biological Sciences Research Council Discovery Fellowship (BB/T009543/1). Ai fini dell'Open Access, l'autore ha applicato una licenza di copyright pubblica CC BY a qualsiasi versione del manoscritto accettato dall'autore derivante da questa presentazione. L.C.D è docente presso l'Università di Swansea e ricercatore onorario presso l'Università di Cardiff. Questo lavoro è supportato dal lavoro svolto da Ipseiz et al. 202018.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1x) (Trypsin 500 mg/L or 0.02 mM) | Thermo Fisher Scientific | 25300054 | |
| 0.22 μm sterile millex GP filter | Merck | SLGS033SS | |
| 0.45 μm sterile millex GP filter | Merck | SLHP033RS | |
| 0.5 mL U-100 insulin syringe with needle, 0.33 mm x 12.7 mm (29 G) | BD | 324892 | |
| 1 Litre Sharps Container | N/A | N/A | |
| 2.4G2 antibody (TruStain FcX anti-mouse CD16/32) | Biolegend | 101320 | |
| 40 μm strainer | Thermo Fisher Scientific | 22363547 | |
| AimV medium (research grade), AlbuMax Supplement | Thermo Fisher Scientific | 31035025 | |
| Blocking buffer | prepared in house | ||
| Brewer thioglycolate medium | Sigma-Aldrich | B2551 | 4% stock solution prepared in water, autoclaved and kept frozen. |
| CD11b | Biolegend | 101222 | Refer to Table 1 for the dilution and concentration |
| CD11b | BD | 550993 | Refer to Table 1 for the dilution and concentration |
| CD11c | Biolegend | 117317 | Refer to Table 1 for the dilution and concentration |
| CD11c | Biolegend | 117333 | Refer to Table 1 for the dilution and concentration |
| CD19 | BD | 560375 | Refer to Table 1 for the dilution and concentration |
| CD19 | Biolegend | 152410 | Refer to Table 1 for the dilution and concentration |
| CD226 | Biolegend | 128808 | Refer to Table 1 for the dilution and concentration |
| CD3e | BD | 560527 | Refer to Table 1 for the dilution and concentration |
| CD3e | Biolegend | 152313 | Refer to Table 1 for the dilution and concentration |
| CD4 | Biolegend | 100412 | Refer to Table 1 for the dilution and concentration |
| CD73 | eBioscience | 16-0731-82 | Refer to Table 1 for the dilution and concentration |
| CD8a | eBioscience | 48-0081-82 | Refer to Table 1 for the dilution and concentration |
| Cell culture flask (T175 fask, 175 cm2, 550 mL) | Greiner Bio One | 658175 | |
| Centrifuge tubes, conical bottom tubes 25 mm x 89 mm | Beckman Coulter | 358126 | |
| Centrifuges | Beckman Coulter | Ultracentrifuge and TC centrifuge | |
| Collagenase type IV | Sigma-Aldrich | C5138 | |
| Conical centrifuge tubes (15 mL and 50 mL) | Greiner Bio One | 11512303 & 11849650 | |
| Cryotubes | Greiner Bio One | 123277 | or cryotubes |
| DMEM medium (1x) + 4.5g/L D-glucose, 400 µM L-glutamine | Thermo Fisher Scientific | 41965-062 | |
| Dnase I | Sigma-Aldrich | 11284932001 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| F4/80 | Biolegend | 123123 | Refer to Table 1 for the dilution and concentration |
| F4/80 | Biolegend | 123133 | Refer to Table 1 for the dilution and concentration |
| F4/80 | Biolegend | 123147 | Refer to Table 1 for the dilution and concentration |
| FceR1 | eBioscience | 48-5898-80 | Refer to Table 1 for the dilution and concentration |
| Fetal calf serum (FCS) | Thermo Fisher Scientific | 10270-106 | heat inactivated for 30 min at 56 °C and sterile filtered through 0.22 μm filter |
| Flow cytometer | Thermo Fisher Scientific | Attune NxT | |
| Flow cytometry (FACS) buffer | prepared in house | ||
| Fluorescent tissue culture microscope | Thermo Fisher Scientific | EVOS FL | |
| Forceps | N/A | N/A | User preference |
| Hank's balanced salt solution (HBSS) | Gibco, Life Technologies | 14175-053 | |
| HEK293T cell line | grown for at least a week prior transfection. Mycoplasma free | ||
| HIV-1 Core antigen | Beckman Coulter | 6604667 | |
| Hyaluronidase | Sigma-Aldrich | H3506 | |
| Hydrex surgical scrub, chlorhexiding gluconate 4% w/v skin cleanser | Ecolab | 3037170 | |
| I-A/I-E | Biolegend | 107625 | Refer to Table 1 for the dilution and concentration |
| ICAM1 | Becton Dickinson | 554970 | Refer to Table 1 for the dilution and concentration |
| Jurkat T cell line | grown for at least a week prior use. Mycoplasma free | ||
| LIVE/DEAD fixable near-IR dead cell stain kit | Thermo Fisher Scientific | L34975 | |
| Ly6G | Biolegend | 127615 | Refer to Table 1 for the dilution and concentration |
| Mice | here used C57BL/6 females, aged 8-12 weeks (Charles Rivers), unless specified differently | ||
| Microcapillary pipettes (volume range 0.5-1,000 μL) | Fisher Scientific & Starlab | 11963466 & 11943466 & 11973466 & S1111-3700 | |
| NK1.1 | Biolegend | 108724 | Refer to Table 1 for the dilution and concentration |
| Paraformaldehyde | Sigma-Aldrich | P6148-500G | prepared to 2% w/v in PBS |
| pCMV-ΔR8.91 packaging plasmid | Zuffrey, R., et al. 1997 | encodes Gag-Pol HIV protein driven by cytomegalovirus promoter. Ampicilin resistance. | |
| Penicillin/Streptomycin (100x, 10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Petri dish | Greiner Bio One | 664160 | |
| pHR'SIN-cPPT-SEW plasmid | Rosas, M. et al. 2014 | modified for shRNA and miR expression studies. Encodes EGFP marker downstream SFFV promoter and upstream of the Woodchuck hepatitiv virus enhancer. Ampicilin resistance. | |
| pMD2.G plasmid | Naldini, L. et al. 1996 | encodes vesicular stomatis virus g-glycoprotein (VSV-G) envelope. Ampicilin resistance. | |
| Rat IgG1, κ isotype control | Becton Dickinson | 550617 | Refer to Table 1 for the dilution and concentration |
| Rat serum | Sigma-Aldrich | R9759-10ML | |
| Red blood ACK lysis buffer | prepared in house | ||
| RPMI 1640 medium (1x) + 400 uM L-glutamine | Thermo Fisher Scientific | 21875-091 | |
| Saponin | Sigma-Aldrich | S4521 | |
| SiglecF | BD | 562681 | Refer to Table 1 for the dilution and concentration |
| Sodium hypochlorite Tablets (bleach, 2,000 ppm) | Guest Medical | H8818 | |
| Sterile 24-well cell culture plate | Greiner Bio One | 662160 | |
| Sterile Dulbecco's PBS (DPBS) (1x) Mg++ and Ca2+ - free | Thermo Fisher Scientific | 14190144 | |
| Sterile EDTA | Thermo Fisher Scientific | 15575020 | |
| Sterile VWR disposable transfer pipets (23.0 mL, 30 cm) | VWR | 612-4515 | |
| Sucrose | Thermo Fisher Scientific | 15503022 | |
| surgical scissors | N/A | N/A | User preference |
| Syringes (50 mL and 1 0mL) | Fisher Scientific | 10084450 & 768160 | |
| Tim4 | Biolegend | 130007 | Refer to Table 1 for the dilution and concentration |
| U-bottom 96-well cell culture plate | Greiner Bio One | 650180 |
Riferimenti
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Jantsch, J., Binger, K. J., Muller, D. N., Titze, J. Macrophages in homeostatic immune function. Front Physiol. 5, 146(2014).
- Wynn, T. A., Vannella, K. M. Macrophages in tissue repair, regeneration, and fibrosis. Immunity. 44 (3), 450-462 (2016).
- Ginhoux, F., Guilliams, M. Tissue-resident macrophage ontogeny and homeostasis. Immunity. 44 (3), 439-449 (2016).
- Epelman, S., Lavine, K. J., Randolph, G. J. Origin and functions of tissue macrophages. Immunity. 41 (1), 21-35 (2014).
- Amit, I., Winter, D. R., Jung, S. The role of the local environment and epigenetics in shaping macrophage identity and their effect on tissue homeostasis. Nat Immunol. 17 (1), 18-25 (2016).
- Gosselin, D., et al. Environment drives selection and function of enhancers controlling tissue-specific macrophage identities. Cell. 159 (6), 1327-1340 (2014).
- Lavin, Y., et al. Tissue-resident macrophage enhancer landscapes are shaped by the local microenvironment. Cell. 159 (6), 1312-1326 (2014).
- Davies, L. C., et al. Peritoneal tissue-resident macrophages are metabolically poised to engage microbes using tissue-niche fuels. Nat Commun. 8 (1), 2047(2017).
- Shi, J., Hua, L., Harmer, D., Li, P., Ren, G. Cre driver mice targeting macrophages. Methods Mol Biol. 1784, 263-275 (2018).
- Wang, X., et al. Recent advances in lentiviral vectors for gene therapy. Sci China Life Sci. 64 (11), 1842-1857 (2021).
- Kosaka, Y., et al. Lentivirus-based gene delivery in mouse embryonic stem cells. Artif Organs. 28 (3), 271-277 (2004).
- Naldini, L., et al. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272 (5259), 263-267 (1996).
- Yamashita, M., Emerman, M. Capsid is a dominant determinant of retrovirus infectivity in nondividing cells. J Virol. 78 (11), 5670-5678 (2004).
- Wilson, A. A., et al. Lentiviral delivery of RNAi for in vivo lineage-specific modulation of gene expression in mouse lung macrophages. Mol Ther. 21 (4), 825-833 (2013).
- Burns, J. C., Friedmann, T., Driever, W., Burrascano, M., Yee, J. K. Vesicular stomatitis virus G glycoprotein pseudotyped retroviral vectors: concentration to very high titer and efficient gene transfer into mammalian and nonmammalian cells. Proc Natl Acad Sci U S A. 90 (17), 8033-8037 (1993).
- Finkelshtein, D., Werman, A., Novick, D., Barak, S., Rubinstein, M. LDL receptor and its family members serve as the cellular receptors for vesicular stomatitis virus. Proc Natl Acad Sci U S A. 110 (18), 7306-7311 (2013).
- Ipseiz, N., et al. Effective in vivo gene modification in mouse tissue-resident peritoneal macrophages by intraperitoneal delivery of lentiviral vectors. Mol Ther Methods Clin Dev. 16, 21-31 (2020).
- Rosas, M., et al. The transcription factor Gata6 links tissue macrophage phenotype and proliferative renewal. Science. 344 (6184), 645-648 (2014).
- BeckmanCoulter. , https://www.mybeckman.uk/resources/technologies/centrifugation/principles/rotor-balancing (2023).
- JoVE Science Education Database. Lab Animal Research. Rodent Handling and Restraint Techniques. , JoVE, Cambridge, MA. (2023).
- Zufferey, R., Nagy, D., Mandel, R. J., Naldini, L., Trono, D. Multiply attenuated lentiviral vector achieves efficient gene delivery in vivo. Nat Biotechnol. 15 (9), 871-875 (1997).
- Nasri, M., Karimi, A., Allahbakhshian Farsani, M. Production, purification and titration of a lentivirus-based vector for gene delivery purposes. Cytotechnology. 66 (6), 1031-1038 (2014).
- Optimized production and concentration of lentiviral vectors containing large inserts. J Gene Med. al Yacoub, N., Romanowska, M., Haritonova, N., Foerster, J. 9 (7), 579-584 (2007).
- Malim, M. H., Bieniasz, P. D. HIV restriction factors and mechanisms of evasion. Cold Spring Harb Perspect Med. 2 (5), a006940(2012).
- Sonza, S., et al. Susceptibility of human monocytes to HIV type 1 infection in vitro is not dependent on their level of CD4 expression. AIDS Res Hum Retroviruses. 11 (7), 769-776 (1995).
- Kingston, R. E., Chen, C. A., Rose, J. K. Calcium phosphate transfection. Curr Protoc Mol Biol. Chapter 9, Unit 9.1(2003).
- Brown, L. Y., Dong, W., Kantor, B. An Improved protocol for the production of lentiviral vectors. STAR Protoc. 1 (3), 100152(2020).
- Moce-Llivina, L., Jofre, J., Muniesa, M. Comparison of polyvinylidene fluoride and polyether sulfone membranes in filtering viral suspensions. J Virol Methods. 109 (1), 99-101 (2003).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Sci Rep. 5, 13875(2015).
- Czubala, M. A., et al. TGFbeta induces a SAMHD1-independent post-entry restriction to HIV-1 infection of human epithelial langerhans cells. J Invest Dermatol. 136 (10), 1981-1989 (2016).
- Bouabe, H., Okkenhaug, K. Gene targeting in mice: a review. Methods Mol Biol. 1064, 315-336 (2013).
- Kim, J. M., Rasmussen, J. P., Rudensky, A. Y. Regulatory T cells prevent catastrophic autoimmunity throughout the lifespan of mice. Nat Immunol. 8 (2), 191-197 (2007).
- Decalf, J., et al. Sensing of HIV-1 entry triggers a Type I Interferon response in human primary macrophages. J Virol. 91 (15), e00147-e00217 (2017).
- Wilson, A. A., et al. Amelioration of emphysema in mice through lentiviral transduction of long-lived pulmonary alveolar macrophages. J Clin Invest. 120 (1), 379-389 (2010).
- Markusic, D. M., van Til, N. P., Hiralall, J. K., Elferink, R. P., Seppen, J. Reduction of liver macrophage transduction by pseudotyping lentiviral vectors with a fusion envelope from Autographa californica GP64 and Sendai virus F2 domain. BMC Biotechnol. 9, 85(2009).
- Burke, B., Sumner, S., Maitland, N., Lewis, C. E. Macrophages in gene therapy: cellular delivery vehicles and in vivo targets. J Leukoc Biol. 72 (3), 417-428 (2002).
- Bain, C. C., Jenkins, S. J. The biology of serous cavity macrophages. Cell Immunol. 330, 126-135 (2018).
- Milone, M. C., O'Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon