Method Article
完全精製成分を用いたMsp1抽出活性の再構成
要約
ここでは、定義されたプロテオリポソームにおける完全に精製された成分を用いたMsp1抽出活性の再構成のための詳細なプロトコルを提示する。
要約
酸化リン酸化とアポトーシス調節の中心として、ミトコンドリアは人間の健康に重要な役割を果たします。適切なミトコンドリア機能は、タンパク質ホメオスタシス(プロテオスタシス)を維持するための堅牢な品質管理システムに依存します。ミトコンドリアプロテオスタシスの低下は、癌、老化、神経変性、および他の多くの疾患に関連している。Msp1は、ミトコンドリア外膜に固定されたAAA+ATPaseであり、誤局化したテールアンカータンパク質を除去することによってプロテオスタシスを維持します。精製した成分をプロテオリポソームに再構成し、Msp1が脂質二重層からモデルのテールアンカータンパク質を抽出するのに十分であることを示しました。当社の簡略化された再構成システムは、膜タンパク質抽出の詳細な研究を妨げている技術的障壁のいくつかを克服します。ここでは、リポソームの生成、膜タンパク質の再構成、Msp1抽出アッセイの詳細な方法を提供します。
概要
適切な細胞機能は、機能的タンパク質が正しい濃度と細胞位置1であることを保証するプロテオスタシスと呼ばれるプロセスに依存します。プロテオスタシスの障害は、オルガネラ機能の低下を招き、多くの神経変性疾患2、3、4に関連している。膜タンパク質は、疎水性膜貫通ドメイン(TM)5からの凝集を避けながら、正しい膜を標的としなければならないプロテオスタシスネットワークに固有の課題を提示する。その結果、特殊化された機械は、疎水性TMDをサイトゾルから保護し、適切な細胞膜6、7、8、9、10、11、12、13、14、15への標的化と挿入を容易にするために進化しました。
ミトコンドリアは細胞の代謝ハブであり、酸化リン酸化、鉄硫黄クラスター生成、アポトーシスレギュレーション16、17など、数多くの必須細胞プロセスに関与している。これらの子宮内生体オルガネラは、ミトコンドリア膜(IMM)および外ミトコンドリア膜(OMM)と呼ばれる2つの膜を含む。1,500個のヒトミトコンドリアタンパク質の99%以上が核ゲノムにコードされており、1つまたは2つの異なる膜18、19に渡ってトランスロケーションする必要がある。したがって、適切なミトコンドリア機能は、タンパク質ターゲティングまたは転座の誤差を修正するために、堅牢なプロテオスタシスネットワークに依存します。
私たちの研究室では、非常にC末に20、21、22、23、24の単一の膜貫通ドメインを有する、尾アンカー(TA)タンパク質と呼ばれるミトコンドリア膜タンパク質のサブセットに焦点を当てています。TAタンパク質は、アポトーシス、小胞輸送、およびタンパク質転座25などの多くの必須プロセスに関与している。TAタンパク質のユニークなトポロジーは、尾アンカー(GET)またはエンドパラムレチラム膜タンパク質複合体(EMC)経路によって導付入り(GET)によって小胞体(ER)で起こる、または十分に特徴付けの経路20、26、27、28によってOMMに起こる翻訳後挿入を必要とする。TMDの生物物理学的性質は、TAタンパク質を正しい膜29に導くために必要であり、十分である。定義された配列モチーフではなく生物物理学的特徴の認識は、標的経路5の忠実さを制限する。したがって、TAタンパク質の誤局在化は、プロテオスタシスネットワークに対する一般的なストレスである。細胞ストレスは、GET経路の阻害などの、これらのタンパク質が速やかに除去されない限りOMMおよびミトコンドリア機能障害に対するタンパク質の誤局在化の増加を引き起こす30,31。
膜プロテオスタシスの一般的なテーマは、AAA+ (細胞A ctivitiesでソシエ化されたTPase A)タンパク質を使用して、脂質二重層1、32、33、34、35、36、37、38から古い、損傷した、または誤局化したタンパク質を除去することです。 .AAA+タンパク質は、六方体環を形成し、基板を改造するためにATP依存的な動きを受ける分子モーターであり、しばしば狭い軸孔39、40を通して転位することによって。AAA+ATPasesによる膜タンパク質の抽出の研究には多大な努力が必要であったが、再構成は複雑であるか、脂質と洗剤41,42の混合物を含み、脂質二重層からの基質抽出のメカニズムを調べる実験力を制限する。
Msp1は、OMMおよびペルオキシソームに固定された高度に保存されたAAA+ATPaseであり、誤局化したTAタンパク質43、44、45、46、47を除去することによって膜プロテオスタシスにおいて重要な役割を果たす。Msp1は、OMM48を横断する転座の間に失速する膜タンパク質を除去することによって、ミトコンドリアタンパク質のインポートストレスを軽減することも最近示された。Msp1またはヒトホモログATAD1の喪失は、ミトコンドリア断片化、酸化リン酸化の障害、発作、脳卒中後の傷害の増加、および早期死亡31、49、50、51、52、53、54、55、56をもたらす。
我々は、TAタンパク質をMsp1と共再構成し、脂質二重層57からの抽出を検出することが可能であることを示した。この簡略化されたシステムは、完全に精製されたタンパク質を、OMM(図1)58、59を模倣する定義されたリポソームに再構成して使用する。このレベルの実験的制御は、他のAAA+タンパク質を含むより複雑な再構成で実験的に難解な基質抽出の詳細な機械学的な質問に対処することができます。ここでは、リポソーム調製法、膜タンパク質再構成法、抽出アッセイの方法を詳述した実験的プロトコルを提供します。これらの実験の詳細が、膜プロテオスタシスの本質的だが十分に理解されていないプロセスのさらなる研究を促進することを期待しています。
プロトコル
1. リポソーム製剤
- 適切な比率で脂質のクロロホルムストックを組み合わせて、外のミトコンドリア膜を模倣します。
- 脂質混合物の25mgを調製します。ミトコンドリア膜を模倣する脂質の既に確立された混合物を使用し、 鶏卵ホスファチジルコリン(PC)、鶏卵ホスファチジルエタノールアミン(PE)、ウシ肝臓ホスファチジルイノシトール(PI)、合成1,2-ジオレオイルの48:28:10:10:4モル比から成る -sn-グリセロ-3-ホスホ-L-セリン(DOPS)、および合成1',3'-ビス[1,2-ジオレオイル-sn-グリセロ-3-ホスホ]グリセロール(TOCL)58,59.サンプル計算は、表 1に示されています。
- これは凝縮を制限するので、開く前に室温にすべての脂質ストックを持参してください。ほとんどの研究室では脂質の濃度を正確に測定する方法がないため、クロロホルムストックによって吸収される水は、脂質ストックの濃度を変化させ、従ってアッセイで使用される脂質の比率を変化させます。
- 脂質ストックがガラスアンプルに入ってくるので、必要な量の脂質を1mLのシリンジを使用してガラスバイアルに移します。バイアルにジチオトレイトール(DTT)を2mg加え、脂質酸化を防ぎます。クロロホルムの蒸発が脂質の濃度を変化させますように迅速に作業します。
- 残った脂質を別のガラスバイアルに移し、PFTEセプタと合わせます。2mgのDTTをバイアルに加え、パラフィルムで包み、-20°Cで保存して脂質酸化を防ぎます。バイアルへの移写から3ヶ月以内に脂質を使用するようにしてください。マーカー流出によるクロロホルムストックの潜在的な汚染を防ぐには、マーカーでラベルを付けるのではなく、元のアンプルからガラスバイアルにステッカーを転送します。
- ガスフードでガラスバイアルを手で連続して回転させながら、窒素の非常に穏やかな流れの下でクロロホルムを蒸発させ、本質的に手動ロトバップとして機能します。バイアルを一貫した速度(20~40 rpm)で回転させ、脂質を動かし続けます。目標は、すべてのクロロホルムを蒸発させ、ガラスバイアル全体に脂質の均一なコーティングを取得することです。
注意:クロロホルムは神経毒性であり、このステップはヒュームフードで行われるべきです。- 窒素管に新鮮なパスツールピペットを取り付けます。バイアルからまたはパスツールピペットに脂質を飛び出させないでください。空気が底から跳ね返り、バイアルの中心に向かって脂質を押し上げるので、バイアルの底部の先端を目指します。コーナーやキャップの蓄積を避けながら、バイアル全体に均一なコーティングを取得します。このプロセス全体は約5分かかります。
- 混合物が脂質の「ビーズ」に厚くなるにつれて、バイアルの角度を変えることによってバイアルの中心に導きます。ビーズが小さくなり始めたら、窒素気流をわずかに上げてビーズを分散させ、バイアルから脂質が吹き出さなくなることを保証します。
- 残りのクロロホルムを真空下で取り除きます。
- ガラスバイアルをハウス真空またはダイヤフラム真空ポンプに1時間置き、残留クロロホルムの大部分を除去します。これらの真空は、一般的にクロロホルムのすべてを除去するのに十分な強度ではありませんが、回転無駄な真空よりも少量の溶媒を許容することができます。
- 強い真空(<1 mTorr)にバイアルを12〜16時間置き、残留クロロホルムをすべて除去します。このプロセス中にバイアルのぶつかりは避けてください。
- リポソーム緩衝液の1.25 mLに脂質を再懸濁する(50 mM HEPES KOH pH 7.5、15%グリセロール、1 mM DTT)。25 mg の脂質から始めたように、20 mg/mL の濃度になります。目に見える塊のない脂質を完全に再中断する。バイアルの隅に脂質が溜まった場合、これは長いプロセスになる可能性があります。
- サンプルが乳白色になるまで、バイアルを激しく渦液化します。クロロホルム蒸発が前の晩に適切に行われた場合、このプロセスは約5〜10分かかることがわかります。
- 脂質の完全な再懸濁を確実にするため、室温で車輪を3時間~80rpmで回転させます。1時間に1回バイアルを取り出し、1分間の渦を取り除き、均一に混合します。
- 脂質をクリーンな1.5 mLマイクロ遠心チューブに慎重に移します。液体窒素を使用して凍結し、30°Cのヒートブロックを使用して解凍します。このステップは、多層小胞をユニラメラ小胞に変換するのに役立ちます。
- 脂質を押し出す。
- 凍結解凍サイクル中に、ミニ押出機を準備します。10 mmフィルターサポートと所望の細孔サイズのポリカーボネート膜でミニ押出機を組み立てます(我々は200 nmを使用します)。フィルターのサイズはリポソームのサイズに影響を与え、再構成に必要なタンパク質の濃度に影響を与える(ステップ2.3)。
- ミニ押出機をホットプレートに置き、押出機の温度を60°Cまで下ろします。
- 脂質を1 mLのガスタイトガラスシリンジに引き上げ、ミニ押出機の一端に慎重に入れます。空のガス密着注射器をミニ押出機の反対側に入れる。脂質を押出機スタンド温度に5~10分間平衡させます。
- 充填したシリンジのプランジャーを軽く押して、脂質を代替シリンジに移します。代替シリンジから元のシリンジに溶液を押し込みます。この前後のプロセスを15回繰り返し、15回目 に脂質が代替シリンジで終わるようにします。各パスのボリュームを監視して、リークがないことを確認します。
- 脂質の単一使用アリコートを準備し、液体窒素でフラッシュフリーズし、-80°Cで保存します。 リポソームは、数ヶ月間-80°Cで安定しています。再構成には一度に10μLのリポソームが必要です(ステップ2.3.4)ので、10μLまたは20μLのアリコートを調製するのが便利です。
2 Msp1およびモデルTAタンパク質の再構成
- 再構成バッファーを準備する:50 mM HEPES pH 7.5、200 mM酢酸カリウム、7 mM酢酸マグネシウム、2 mM DTT、10%スクロース、0.01%アジドナトリウム、0.2-0.8%デオキシビッグチャップス(DBC)。
- リポソームの新しいバッチの再構成条件を最適化します。最適な再構成に必要なDBCおよびバイオビーズの濃度は、使用されるリポソームのバッチによって異なります。準備のばらつきを制限するには、すべての実験に同じ DBC を使用します。DBC の多くを変更する場合は、最適化プロセスを繰り返します。
- リポソームの新しいバッチが調製されるたびに、DBC(0.2%-0.8%)およびバイオビーズ(25mg - 100mg)の異なる濃度の一連の再構成を設定する。DBCを0.12%の臨界ミセル濃度(CMC)以下に落とさないことが重要である。条件が最適化されたら、同じリポソーム準備条件と再構成条件を使用してすべてのデータを収集することをお勧めします。
- 工程3に記載の抽出アッセイを用いて種々の再構成条件の有効性をアッセイする。
- 250 mg/mL の最終濃度でバイオビーズを調製します。
- 乾燥したバイオビーズの2.7gを計量し、50 mLの遠心分離管で100%メタノール(約45mL)を再懸濁して、ビーズを湿潤させます。最初は、空気がビーズの毛穴に閉じ込められるのを防ぐためにメタノールでバイオビーズを濡らします。メタノールに入ると、バイオビーズに閉じ込められた空気が洗剤を吸収する能力を変えるため、バイオビーズを濡らしてください。
- 約45mLの超純水(18.2mΩ)でビーズ8xを洗浄してメタノールを除去し、以下、3,200 x gで1分間回転させてddH2O.ペレットビーズと呼びます。液体をデスキャンし、ddH2Oで再中断する。
- 洗浄後、0.02%のアジドナトリウムで10mlのddH2Oで再懸濁し、4°Cで保管します。 バイオビーズは、4°Cで数ヶ月間保存することができます。洗浄工程中に0.2gが失われると想定される250mg/mLです。
- リポソームのサイズとTAタンパク質の分子の所望の数とリポソーム当たりのMsp1を計算します。これにより、再構成に必要なMsp1およびTAタンパク質の濃度が決定されます。
- まず、dがリポソームの
 直径、hが二重層の厚さ、およびaが脂質ヘッドグループ領域である式を用いて、ユニラメラリポソーム当たりの脂質分子数(N total)を計算する。
直径、hが二重層の厚さ、およびaが脂質ヘッドグループ領域である式を用いて、ユニラメラリポソーム当たりの脂質分子数(N total)を計算する。- DLSでリポソーム径を測定します。この例では、リポソーム径(d)に対して70nmの値が得られた。
- h の場合は 5 nm、ホスファチジルコリンのヘッドグループ サイズである aの場合は 0.71 nm2の値を使用します。この特定の状況では、Nの合計は37,610です。
- 次に、混合物中の脂質の平均分子量を用いて脂質M脂質のモル濃度を算出する。この例では、脂質の濃度は20mg/mL(ステップ1.4)であり、脂質の平均分子量は810g/molである(表1)。この結果、M Lipid の値は 0.0247 Mになります。
- 次に、リポソームMリポソームのモル濃度を計算し、
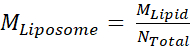 ステップ2.3.2からMLipidが脂質のモル濃度である式を用いて、Nの合計はステップ2.3.1で計算したリポソーム当たりの脂質の総数である。この例では、リポソームの20mg/mLストック濃度は約660nMである。
ステップ2.3.2からMLipidが脂質のモル濃度である式を用いて、Nの合計はステップ2.3.1で計算したリポソーム当たりの脂質の総数である。この例では、リポソームの20mg/mLストック濃度は約660nMである。 - 100 μL再構成反応に必要なMsp1およびTAタンパク質の量を計算します。
注:再構成中の脂質の最終的な濃度は2mg /mLであり、これはリポソームストックの10倍の希釈である。これは66 nMの最終的なリポソーム濃度を与える。Msp1の最終濃度は792 nMで、リポソーム当たり平均12コピー(2機能ヘキサマー)を与えます。TAタンパク質の最終的な濃度は660 nMであり、これはリポソーム当たり平均10コピーを与える。
- まず、dがリポソームの
- PCR チューブで、精製された Msp1、TA タンパク質、リポソームを再構成バッファーに混ぜ合わせます。添加の順序は、バッファー、タンパク質、リポソーム最後です。総容積は100 μLである。混合物を10分間氷の上に座るようにします。Msp1およびTAタンパク質を、前述の57と同様に精製する。
- 初めてアッセイを確立する際には、よく特徴付けられるTAタンパク質His-Flag-相撲Sec22を正の対照基質として使用してください。この構成体は、容易な精製のためのHisタグ、ウェスタンブロットによる検出用の3xフラグタグ、溶解度を高める相撲ドメイン、およびMsp1による再構成と認識のためのER-TAタンパク質Sec22のTMDを有する。
- Msp1とTAタンパク質の両方のストック溶液が約100μMであることを確認し、タンパク質精製によるN-ドデシルβ-D-マルトシド(DDM)の再構成に対する影響を最小限に抑えます。精製Msp1は20 mM HEPES pH 7.5で、 100 mM 塩化ナトリウム、0.1 mM トリス(2-カルボキセチル)ホスフィン塩酸塩(TCEP)、0.05%DDM、精製TAタンパク質は50 mMトリスpH 7.4、150mMM塩化ナトリウム、10mM塩化マグネシウム、5mm βメルカプトエタノール、10%グリセロール、0.1%約100 μM TAタンパク質およびMsp1モノマーのストックソリューションにより、これらの成分が最終的な再構成量の5%<を確実に確保し、CMC以下のDDMの希釈が生じます。
- サンプルに必要量のバイオビーズを加えるし、洗剤を除去します。
- p200ピペットチップの先端を直径約1/8インチ に切り、ビーズが先端に収まるようにします。バイオビーズチューブを完全に渦巻きし、均一な混合物を得て、バイオビーズが落ち着く前に蓋とピペットをボリュームまで素早く取り除きます。生物ビーズを空のPCRチューブに移します。
- 再構成が氷の上で10分間のインキュベーションを終えたら、ノーカットピペットチップを使用してバイオビーズからすべての液体を取り除きます。その後、100 μL 再構成をバイオビーズと一緒にチューブに移します。これは、バイオビーズが空気をトラップしないように迅速に行う必要があり、ビーズが浮かび上がる原因となります。
- 4°Cで16時間、80rpm程度で車輪の上で再構成を行います。
- バイオビーズから再構成された材料を除去する。ピコフゲで素早くスピンしてバイオビーズをペレット化し、未カットのピペットチップを使用して再構成された材料をクリーンなPCRチューブに移します。サンプルにバイオビーズが残らないまで、このプロセスを1〜2回繰り返します。氷の上で再構成を保ちます。
- リポソームに再構成できなかったタンパク質を除去するために再構成された物質を事前にクリアする。
- 抽出バッファーを準備する: 50 mM HEPES pH 7.5, 200 mM 酢酸カリウム, 7 mM 酢酸マグネシウム, 2 mM DTT, 100 nM 塩化カルシウム.
- メーカーの指示に従って抽出バッファーでグルタチオンスピンカラムを平衡化.これは通常、バッファの400 μLで洗浄を3ラウンドし、その後、バッファーを除去するために室温で2分間700 x gで遠心分離を行います。
- 再構成された材料に各シャペロン(GST-SGTAおよびGST-カルモジュリン)の5μMを加える。これらのシャペロンは、リポソームに再構成できなかったタンパク質のTMDに結合します。シャペロンの精製は、前に6,57を説明した。
注:これらのシャペロンは市販されていますが、コストと品質を制御するために社内で浄化することを好みます。両方のタンパク質は20 mMトリスpH 7.5、100 mM塩化ナトリウム、および0.1 mM TCEPにあり、約160 μMのストック濃度を有します。SGTAは、高疎水性TMDを有する基質を認識し、カルモジュリンはTMDを適度な疎水性6,29と結合する。一緒に、このシャペロンカクテルは、基質の広い範囲を認識することができます。 - 100 μL の抽出バッファーを再構成された材料に加え、最大 200 μL までボリュームを持たせて下さいます。平衡グルタチオンスピンカラムにこれを追加します。.グルタチオンスピンカラムは、事前クリアボリュームが200~400μLの場合、最高のサンプル回収を提供します。
- スピンカラムを差し込み、4°Cで約80rpmで30分間回転させ、シャペロンを樹脂に結合させます。
- 700 x g でカラムを室温で 2 分間回転させます。流れは凝集した蛋白質の枯渇される前にクリアされた材料である。氷の上に材料を保ち、抽出アッセイで直接進みます。
3. 抽出アッセイ
- SDS PAGE分析用のチューブを準備します。各反応には、入力(I)、フロースルー(FT)、WASH(W)、エルテ(E)の4つのチューブがあります。
- 45 μLの ddH2O サンプルを入力チューブに、40 μL の ddH2O をフロースルーチューブに、そして 0 μL を WASH および ELUTE チューブに加えます。
注: このアッセイで最適な信号対雑音比は、WASH および ELUTE サンプルが INPUT および FLOW THROUGH サンプルに対して 5 倍集中している場合に得られます。この場合、アッセイ中の希釈液により、INPUTサンプル用に5μLのサンプル、フロースルーサンプル用のサンプル10μL、WASHサンプルおよびELUTEサンプル用に50μLのサンプルを採取する必要があります。 - 各チューブに16.6 μLの4X SDS PAGEローディングバッファを追加します。各サンプルの総容量は、SDS PAGEローディングバッファの前に50 μLです。最終ボリュームは66.6 μL(50 μLサンプル+ 4x SDS PAGEローディングバッファの16.6 μL)です。
- 45 μLの ddH2O サンプルを入力チューブに、40 μL の ddH2O をフロースルーチューブに、そして 0 μL を WASH および ELUTE チューブに加えます。
- 抽出アッセイを組み立てます。
- 60 μLのプレクリアプロテオリポソーム、5 μMのGST-SGTA、5 μMのGST-カルモジュリン、および2 mM ATPを含む抽出反応を調製します。反応を開始するために使用されるATPを除くすべての試薬を組み合わせます。抽出バッファーを使用して、最終ボリューム 200 μL にします。
注:抽出アッセイごとに60μLのサンプルが使用されるため、3種類の抽出アッセイに1つの再構成を使用できます。同じ再構成から材料に対して正と負のコントロール(+ATPと-ATP)を実行します。 - 30°Cヒートブロックで2分間の予熱抽出アッセイ。
- 60 μLのプレクリアプロテオリポソーム、5 μMのGST-SGTA、5 μMのGST-カルモジュリン、および2 mM ATPを含む抽出反応を調製します。反応を開始するために使用されるATPを除くすべての試薬を組み合わせます。抽出バッファーを使用して、最終ボリューム 200 μL にします。
- ATPを2mMの最終濃度に加え、タイマーを開始して抽出アッセイを開始します。
- 反応にATPを混合するために、ピソフゲに5秒のスピンを与えます。30°Cで30分間インキュベート反応する。
- インキュベーション中に5 μLの反応を取り、INPUTチューブに加えます。このタイミングは柔軟です。
- このインキュベーション期間中、抽出アッセイ中の各サンプルについて1つのグルタチオンスピンカラムを平衡化する。
- シャペロンを引き下げて抽出した材料を分離します。
- 30分間のインキュベーションが終了したら、200 μlの抽出バッファーをチューブに加え、合計体積を 400 μL にします。平衡グルタチオン樹脂に加え、4°Cで30分間車輪に結合させます。
- 700 x g でカラムを室温で 2 分間回転し、流れを集めます。フロースルーチューブに10 μLを取ります。このサンプルには、脂質二重層にまだ一体化されている基質が含まれています。
- 400 μLの抽出バッファーで樹脂を 2 回洗浄し、流れを廃棄します。3回目の洗浄では、流れを通し、洗浄チューブに50 μLを取ります。
- 抽出バッファーで 5 mM の最終濃度に還元されたグルタチオンを加えることによって溶出バッファーの 5 mL を準備します。.このバッファを毎回新鮮に準備します。
- 200 μL の溶出バッファーをスピンカラムに追加します。室温で5分間インキュベートします。700 x g で室温で 2 分間回転して溶出させます。流れを通し続ける。溶出量の合計が400μLになるように、このプロセスを2回目に繰り返します。
- 溶出サンプルから50 μLのサンプルを取り出し、ELUTEチューブに加えます。
- SDS-PAGEとウェスタンブロットを使用して抽出活性を分析します。
注:ウェスタンブロットはかなり標準的な手順であるため、このアッセイに固有の詳細のいくつかを強調する基本的なプロトコルが提供されています。- サンプルを無染色ポリアクリルアミドゲル(4%スタッキング、15%分離)にロードし、トリスグリシンバッファーで200 Vで50分間実行します。スペースが許す場合は、染色されていないラダーと染色されたラダーの両方を使用して、染色フリーのゲルイメージャーで視覚化し、PVDF膜にそれぞれ転送することができます。染色フリーゲルは、紫外線で活性化したときにタンパク質を含むトリプトファンを定量的に可視化し、ゲルをウェスタンブロットに使用することを可能にする。
- 染色フリーのゲルをイメージして、すべてのサンプルに等しい負荷があることを確認します。これは、ウェスタンブロットによって検出された信号の変化が可変タンパク質ローディングの結果ではないことを保証する不可欠なコントロールです。入力およびELUTIONサンプルには、シャペロン(GST-カルモジュリンおよびGST-SGTA)の可視バンドのみが存在する必要があります。ELUTE サンプルは、INPUT サンプルよりも集中します。
- 45 μm PVDF膜を使用してウェスタンブロットカセットを組み立てます。60分間300mAの一定電流で転送します。
- 膜を遮断した後、16時間の一次抗体を4°Cで16時間、穏やかな揺れ〜15rpmで結合する。1:1,000希釈でウサギアンチフラッグを持つ基質用ブロット。
注:使用される一次抗体と二次抗体は基質特異的であり、使用濃度を最適化する必要があるかもしれません。 - 洗浄膜と二次抗体でインキュベートし、ヤギの抗ウサギを1:10,000希釈で、室温で1時間穏やかに揺れる。
- ウエスタンブロッティング検出剤を用いた分析用の洗浄膜及び画像。
結果
結果を正しく解釈するには、染色フリーゲルとウェスタンブロットを一緒に見る必要があります。染色フリーゲルは、すべてのサンプルで等しい負荷を保証します。染色フリーゲルを見ると、シャペロン(GST-カルモドゥリンおよびGST-SGTA)がINPUT(I)およびELUTE(E)レーンに表示されます。これらのバンドの強度がすべての INPUT サンプルで均一であることを再確認します。同様に、輝度が ELUTE サンプル全体で均一であることを確認します。ELUTEはINPUTよりも5倍の濃縮値を持っており、この強度の差はゲルに見えます。
染色フリーゲルを使用して適切なローディングを確認した後、ウェスタンブロットを調べて抽出活性を決定します。抽出活性を測定するには、INPUT(I)分数に対するELUTE(E)分数中の基材の量を比較する。フロースルー(FT)の信号は、ある程度の変動性を示していますが、一般的にはINPUTの端数に似ています。WASH(W)の分数にシグナルが存在しないはずです。典型的には、陰性対照における陽性対照と1〜2%の抽出効率に対して〜10%の抽出効率がある(図2)。ELUTEの分数はINPUT分率と同じ5倍の強さなので、抽出効率を判断する際に考慮する必要があります。再構成条件が最適化されていない場合は、+ ATP サンプルと - ATP サンプル ( 図3) の両方に、通常は同等の抽出レベルがあります。 この結果は、Msp1が効率的に再構成できなかったことに起因し、機能的なMsp1ヘキサマーを持たない多数のプロテオリポソームをもたらす。
| 脂質 | モル % | MW | 平均MW | 25 mg で μmol | mg で 25 mg | クロルストック(mg/mL) | 25 mg の μL |
| パソコン | 48% | 770 | 369.6 | 14.82 | 11.41 | 25 | 456.4 |
| PE | 28% | 746 | 208.88 | 8.64 | 6.45 | 25 | 258.0 |
| 円周率 | 10% | 902 | 90.2 | 3.09 | 2.78 | 10 | 278.5 |
| ドップ | 10% | 810 | 81 | 3.09 | 2.50 | 10 | 250.1 |
| TOCL | 4% | 1502 | 60.08 | 1.23 | 1.85 | 25 | 74.2 |
| コンク・コル・アヴMW | 809.76 | ||||||
| 25 mg で μmol | 30.87 | ||||||
表1:リポソーム製剤のサンプル計算 この表の主な目的は、脂質混合物の濃度補正平均分子量とリポソームを作るために必要な各脂質ストックの体積を計算することです。MWと在庫濃度は製品ラベルから取得されます。脂質とモル % はユーザーによって選択されます。

図1:抽出アッセイのカートゥーンと主要なステップのリスト。この図のより大きなバージョンを見るにはここをクリックしてください。
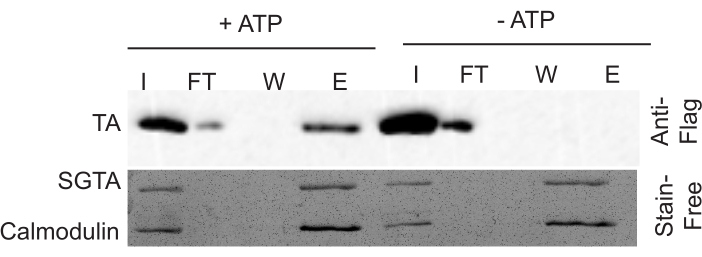
図2:正しく機能するアッセイを示す代表的なデータ。 抽出効率は、ELUTE分率中の基板の量をINPUT画分と比較することによって決定される。ゲルは、INPUT 分数に対して ELUTE 分数が 5 倍高くなることを思い出してください。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:再構成および抽出アッセイの失敗の代表的なデータ ここで、+ATPサンプルにおける活性は-ATPサンプルの活性と同等である。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
適切なミトコンドリア機能は、堅牢なタンパク質の品質管理システムに依存します。TAタンパク質ターゲティング経路の忠実度に固有の限界のために、誤局化TAタンパク質はミトコンドリアのストレスの一定の源です。ミトコンドリアプロテオスタシスネットワークの重要な成分はMsp1であり、これはOMMから誤局的なTAタンパク質を除去する膜固定AAA+ATPaseである。ここでは、プロテオリポソームを調製する方法について、Msp1とモデルTAタンパク質を共同再構成し、抽出アッセイを行う方法について述べた。我々は以前、このアッセイを用いて、Msp1が誤局性TAタンパク質を直接認識し、これらのタンパク質を補助タンパク質または補因子57を使用せずに脂質二重層から抽出できることを実証した。
アッセイの欠点は、再構成プロセスに多少のばらつきがあることです。準備から準備への可変性を制御するために、我々は常に我々のアッセイが意図したとおりに動作していることを確認するために、同じゲル/ウェスタンブロットに正と負のコントロールを含めます。異なる日に行われた再構成の比較や、異なる西部のブロット間の比較を避けます。私たちが行う唯一の比較は、並列に再構成され、同じゲル/ウェスタンブロットで実行されるサンプルです。また、データの解釈も非常に保守的です。ImageJを用いて抽出効率を定量化することは可能ですが、我々は通常、完全な活性、中間活性、または活性を有さないと我々の実験を記述する。
変動の一つの源は、再構成されたタンパク質の総量である。非組み込みタンパク質の大部分は、事前清算プロセスによって除去されるが、Msp1の完全な再構成効率よりも少ないは、基質抽出の観察された効率に大きな影響を及ぼすことができる。この効果は、Msp1がホモヘキサマーとして機能するという事実から生じるが、モノマー57として精製する。Msp1の6xコピー以外のものを含むリポソームは非アクティブになります。たとえば、Msp1 のコピーが 5 部しかないリポソームは非アクティブになります。安定した全長Msp1ヘキサマーを形成する唯一の方法は、非加水分解性ATPアナログ(ATPγS)または不活性化E193QウォーカーB突然変異体でATPase活性を不活性化することですが、どちらも活性アッセイと互換性がありません。この技術的なハードルを克服することは、当研究室での積極的な研究の分野です。
活発な研究のもう一つの分野は、抽出アッセイをより定量的にすることに焦点を当てています。現在の方法は、プルダウンとウェスタンブロッティングによるシグナル検出に依存しており、どちらも半定量的でアッセイのばらつきを示す。抽出された基質の共有結合的な修飾はプルダウンから生じる変動性を除去するであろう。同様に、基質上で放射性標識または蛍光標識を使用すると、ウェスタンブロットの必要性と関連する変動性がなくなります。
アッセイの主な強みは、システムが完全に定義されているということです。膜タンパク質は組換え発現され精製され、Msp1と基質の両方で定義された変異体を作り、反応の特定の局面を研究することができる。プロテオスタシスにおける脂質環境の役割は、これを詳細に研究するという技術的な課題のためにほとんど無視されてきた。我々のアッセイは、定義された脂質組成を有するリポソームを使用するため、脂質環境の完全な実験的制御が可能になる。脂質流動性、二重層厚さ、ヘッドグループの同一性、リポソームサイズなどの因子を簡単に調節できます。Msp1活性に対する脂質環境の役割を調べるために、アッセイの活用に積極的に取り組んでいます。ここで説明する インビトロ 再構成と抽出アッセイは、脂質二重層からの膜タンパク質のAAA+ATPase媒介抽出の共通の細胞プロセスを研究するための簡略化されたモデルシステムとして役立つことを願っています。
開示事項
何一つ
謝辞
MLWは、シカゴ大学のロバート・キーナン博士との博士後期研究中に、このプロトコルの一部を開発しました。
この作業は、NIH助成金1R35GM137904-01 MLWに資金を提供しています。
資料
| Name | Company | Catalog Number | Comments |
| Biobeads | Bio-Rad | 1523920 | |
| Bovine liver phosphatidyl inositol | Avanti | 840042C | PI |
| Chicken egg phosphatidyl choline | Avanti | 840051C | PC |
| Chicken egg phosphatidyl ethanolamine | Avanti | 840021C | PE |
| ECL Select western blotting detection reagent | GE | RPN2235 | |
| Filter supports | Avanti | 610014 | |
| Glass vial | VWR | 60910L-1 | |
| Glutathione spin column | Thermo Fisher | PI16103 | |
| Goat anti-rabbit | Thermo Fisher | NC1050917 | |
| Mini-Extruder | Avanti | 610020 | |
| Polycarbonate membrane | Avanti | 610006 | 200 nM |
| PVDF membrane | Thermo Fisher | 88518 | 45 µM |
| Rabbit anti-FLAG | Sigma-Aldrich | F7245 | |
| Synthetic 1,2-dioleoyl-sn-glycero-3-phospho-L-serine | Avanti | 840035C | DOPS |
| Synthetic 1',3'-bis[1,2-dioleoyl-sn-glycero-3-phospho]-glycerol | Avanti | 710335C | TOCL |
| Syringe, 1 mL | Norm-Ject | 53548-001 | |
| Syringe, 1 mL, gas-tight | Avanti | 610017 |
参考文献
- Song, J., Herrmann, J. M., Becker, T. Quality control of the mitochondrial proteome. Nature Reviews Molecular Cell Biology. 22, 54-70 (2021).
- Phillips, B. P., Miller, E. A. Membrane protein folding and quality control. Current Opinion in Structural Biology. 69, 50-54 (2021).
- Jiang, H. Quality control pathways of tail-anchored proteins. Biochimica et Biophysica Acta - Molecular Cell Research. 1868, 118922 (2020).
- McKenna, M. J., et al. The endoplasmic reticulum P5A-ATPase is a transmembrane helix dislocase. Science. 369, (2020).
- Hegde, R. S., Zavodszky, E. Recognition and Degradation of Mislocalized Proteins in Health and Disease. Cold Spring Harbor Perspectives in Biology. 11, 033902 (2019).
- Shao, S., Hegde, R. S. A calmodulin-dependent translocation pathway for small secretory proteins. Cell. 147, 1576-1588 (2011).
- Samuelson, J. C., et al. YidC mediates membrane protein insertion in bacteria. Nature. 406, 637-641 (2000).
- Anghel, S. A., McGilvray, P. T., Hegde, R. S., Keenan, R. J. Identification of Oxa1 Homologs Operating in the Eukaryotic Endoplasmic Reticulum. Cell Reports. 21, 3708-3716 (2017).
- Aviram, N., et al. The SND proteins constitute an alternative targeting route to the endoplasmic reticulum. Nature. 540, 134-138 (2016).
- Voorhees, R. M., Hegde, R. S. Structure of the Sec61 channel opened by a signal sequence. Science. 351, 88-91 (2016).
- Cichocki, B. A., Krumpe, K., Vitali, D. G., Rapaport, D. Pex19 is involved in importing dually targeted tail-anchored proteins to both mitochondria and peroxisomes. Traffic. 19, 770-785 (2018).
- Mateja, A., et al. Protein targeting. Structure of the Get3 targeting factor in complex with its membrane protein cargo. Science. 347, 1152-1155 (2015).
- Chacinska, A., Koehler, C. M., Milenkovic, D., Lithgow, T., Pfanner, N. Importing mitochondrial proteins: machineries and mechanisms. Cell. 138, 628-644 (2009).
- Chitwood, P. J., Hegde, R. S. An intramembrane chaperone complex facilitates membrane protein biogenesis. Nature. , (2020).
- Chitwood, P. J., Juszkiewicz, S., Guna, A., Shao, S., Hegde, R. S. EMC Is Required to Initiate Accurate Membrane Protein Topogenesis. Cell. 175, 1-30 (2018).
- Bock, F. J., Tait, S. W. G. Mitochondria as multifaceted regulators of cell death. Nature Reviews Molecular Cell Biology. 21, 85-100 (2020).
- Pfanner, N., Warscheid, B., Wiedemann, N. Mitochondrial proteins: from biogenesis to functional networks. Nature Reviews Molecular Cell Biology. 20, (2019).
- Bykov, Y. S., Rapaport, D., Herrmann, J. M., Schuldiner, M. Cytosolic Events in the Biogenesis of Mitochondrial Proteins. Trends in Biochemical Sciences. 45, 650-667 (2020).
- Pfanner, N., Warscheid, B., Wiedemann, N. Mitochondrial proteins: from biogenesis to functional networks. Nature Reviews Molecular Cell Biology. 427, 1135 (2019).
- Borgese, N., Coy-Vergara, J., Colombo, S. F., Schwappach, B. The Ways of Tails: the GET Pathway and more. The Protein Journal. , 1-17 (2019).
- Mateja, A., Keenan, R. J. A structural perspective on tail-anchored protein biogenesis by the GET pathway. Current Opinion in Structural Biology. 51, 195-202 (2018).
- Chio, U. S., Cho, H., Shan, S. Mechanisms of Tail-Anchored Membrane Protein Targeting and Insertion. Annual review of cell and developmental biology. 33, 417-438 (2017).
- Denic, V. A portrait of the GET pathway as a surprisingly complicated young man. Trends in biochemical sciences. , (2012).
- Hegde, R. S., Keenan, R. J. Tail-anchored membrane protein insertion into the endoplasmic reticulum. Nature Reviews Molecular Cell Biology. 12, 787-798 (2011).
- Kalbfleisch, T., Cambon, A., Wattenberg, B. W. A bioinformatics approach to identifying tail-anchored proteins in the human genome. Traffic. 8, 1687-1694 (2007).
- Doan, K. N., et al. The Mitochondrial Import Complex MIM Functions as Main Translocase for α-Helical Outer Membrane Proteins. Cell Reports. 31, (2020).
- McDowell, M. A., et al. Structural Basis of Tail-Anchored Membrane Protein Biogenesis by the GET Insertase Complex. Molecular Cell. 80, (2020).
- Guna, A., Volkmar, N., Christianson, J. C., Hegde, R. S. The ER membrane protein complex is a transmembrane domain insertase. Science. 591, 3099 (2017).
- Rao, M., et al. Multiple selection filters ensure accurate tail-anchored membrane protein targeting. eLife. 5, 21301 (2016).
- Schuldiner, M., et al. The GET complex mediates insertion of tail-anchored proteins into the ER membrane. Cell. 134, 634-645 (2008).
- Chen, Y. -. C., et al. Msp1/ATAD1 maintains mitochondrial function by facilitating the degradation of mislocalized tail-anchored proteins. The EMBO journal. 33, 1548-1564 (2014).
- Wu, X., Rapoport, T. A. Translocation of Proteins through a Distorted Lipid Bilayer. Trends in Cell Biology. , (2021).
- Phillips, B. P., Gomez-Navarro, N., Miller, E. A. Protein quality control in the endoplasmic reticulum. Current Opinion in Cell Biology. 65, 96-102 (2020).
- van de Weijer, M. L., et al. Quality Control of ER Membrane Proteins by the RNF185/Membralin Ubiquitin Ligase Complex. Molecular Cell. 79, (2020).
- Weir, N. R., Kamber, R. A., Martenson, J. S., Denic, V. The AAA protein Msp1 mediates clearance of excess tail-anchored proteins from the peroxisomal membrane. eLife. 6, 28507 (2017).
- Gardner, B. M., et al. The peroxisomal AAA-ATPase Pex1/Pex6 unfolds substrates by processive threading. Nature communications. 9, 135 (2018).
- Puchades, C., et al. Unique Structural Features of the Mitochondrial AAA+ Protease AFG3L2 Reveal the Molecular Basis for Activity in Health and Disease. Molecular Cell. , (2019).
- Castanzo, D. T., LaFrance, B., Martin, A. The AAA+ ATPase Msp1 is a processive protein translocase with robust unfoldase activity. Proceedings of the National Academy of Sciences of the United States of America. 117, 14970-14977 (2020).
- Wang, L., Myasnikov, A., Pan, X., Walter, P. Structure of the AAA protein Msp1 reveals mechanism of mislocalized membrane protein extraction. eLife. 9, (2020).
- Puchades, C., Sandate, C. R., Lander, G. C. The molecular principles governing the activity and functional diversity of AAA+ proteins. Nature Reviews Molecular Cell Biology. , 1-16 (2019).
- Yang, Y., et al. Folding-Degradation Relationship of a Membrane Protein Mediated by the Universally Conserved ATP-Dependent Protease FtsH. Journal of the American Chemical Society. , 10 (2018).
- Baldridge, R. D., Rapoport, T. A. Autoubiquitination of the Hrd1 Ligase Triggers Protein Retrotranslocation in ERAD. Cell. 166, 394-407 (2016).
- Fresenius, H. L., Wohlever, M. L. Sorting out how Msp1 maintains mitochondrial membrane proteostasis. Mitochondrion. 49, 128-134 (2019).
- Wang, L., Walter, P. Msp1/ATAD1 in Protein Quality Control and Regulation of Synaptic Activities. Annual Review of Cell and Developmental Biology. 36, 1-24 (2020).
- Dederer, V., et al. Cooperation of mitochondrial and ER factors in quality control of tail-anchored proteins. eLife. 8, 1126 (2019).
- Matsumoto, S., et al. Msp1 Clears Mistargeted Proteins by Facilitating Their Transfer from Mitochondria to the ER. Molecular Cell. , (2019).
- Li, L., Zheng, J., Wu, X., Jiang, H. Mitochondrial AAA-ATPase Msp1 detects mislocalized tail-anchored proteins through a dual-recognition mechanism. EMBO Reports. 20, (2019).
- Weidberg, H., Amon, A. MitoCPR - a surveillance pathway that protects mitochondria in response to protein import stress. Science. 360, (2018).
- Okreglak, V., Walter, P. The conserved AAA-ATPase Msp1 confers organelle specificity to tail-anchored proteins. Proceedings of the National Academy of Sciences of the United States of America. 111, (2014).
- Piard, J., et al. A homozygous ATAD1 mutation impairs postsynaptic AMPA receptor trafficking and causes a lethal encephalopathy. Brain. , (2018).
- Zhang, J., et al. The AAA+ ATPase Thorase regulates AMPA receptor-dependent synaptic plasticity and behavior. Cell. 145, 284-299 (2011).
- Prendergast, J., et al. Ganglioside regulation of AMPA receptor trafficking. The Journal of Neuroscience. 34, 13246-13258 (2014).
- Umanah, G. K. E., et al. Thorase variants are associated with defects in glutamatergic neurotransmission that can be rescued by Perampanel. Science Translational Medicine. 9, 4985 (2017).
- Pignatelli, M., et al. Synaptic Plasticity onto Dopamine Neurons Shapes Fear Learning. Neuron. 93, 425-440 (2017).
- Zhang, J., et al. The AAA Thorase is neuroprotective against ischemic injury. Journal of Cerebral Blood Flow and Metabolism. , 271678 (2018).
- Umanah, G. K. E., et al. AMPA Receptor Surface Expression Is Regulated by S-Nitrosylation of Thorase and Transnitrosylation of NSF. Cell Reports. 33, 108329 (2020).
- Wohlever, M. L., Mateja, A., McGilvray, P. T., Day, K. J., Keenan, R. J. Msp1 Is a Membrane Protein Dislocase for Tail-Anchored Proteins. Molecular Cell. 67, 194-202 (2017).
- Lovell, J. F., et al. Membrane binding by tBid initiates an ordered series of events culminating in membrane permeabilization by Bax. Cell. 135, 1074-1084 (2008).
- Leshchiner, E. S., Braun, C. R., Bird, G. H., Walensky, L. D. Direct activation of full-length proapoptotic BAK. Proceedings of the National Academy of Sciences of the United States of America. 110, 986-995 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved