Method Article
إعادة تشكيل نشاط استخراج Msp1 مع مكونات منقى بالكامل
In This Article
Summary
هنا، نقدم بروتوكول مفصل لإعادة تشكيل نشاط استخراج Msp1 مع مكونات نقية بالكامل في البروتيوليبوسومات المحددة.
Abstract
كمركز للفوسفور التأكسدي والتنظيم المبرمج، تلعب الميتوكوندريا دورا حيويا في صحة الإنسان. تعتمد وظيفة الميتوكوندريا المناسبة على نظام مراقبة جودة قوي للحفاظ على التوازن البروتيني (داء البروتيستاسيس). وقد تم ربط الانخفاض في البروتيستاسيس الميتوكوندريا للسرطان, الشيخوخة, تنكس الأعصاب, والعديد من الأمراض الأخرى. Msp1 هو AAA + ATPase الراسية في الغشاء الميتوكوندريا الخارجي الذي يحافظ على البروتيوستاسيس عن طريق إزالة البروتينات التي ترتكز على الذيل معكوسة بشكل خاطئ. باستخدام المكونات المنقى المعاد تشكيلها في البروتيوليبوسومات، أظهرنا أن Msp1 ضروري وكافية لاستخراج بروتين نموذجي يرتكز على الذيل من طبقة ثنائية الدهون. لدينا نظام مبسط إعادة تشكيلها يتغلب على العديد من الحواجز التقنية التي أعاقت دراسة مفصلة لاستخراج البروتين الغشاء. هنا، ونحن نقدم أساليب مفصلة لتوليد الليبوسومات، وإعادة تشكيل البروتين الغشاء، واستخراج Msp1 المقايسة.
Introduction
تعتمد الوظيفة الخلوية المناسبة على عملية تسمى البروتيوستازي ، والتي تضمن أن البروتينات الوظيفية هي في التركيز الصحيح والموقع الخلوي1. الفشل في البروتيوستاسيس يؤدي إلى ضعف وظيفة العضيات وترتبط مع العديد من الأمراض العصبية2,3,4. البروتينات الغشاء تمثل تحديات فريدة من نوعها لشبكة البروتيوستازي كما يجب أن تكون موجهة إلى الغشاء الصحيح مع تجنب التجميع من المجالات transmembrane الكاره للماء (TMDs)5. وبالتالي، تطورت الآلات المتخصصة لحماية TMD الكاره للماء من السيتوسول وتسهيل الاستهداف والإدخال في الغشاء الخلوي المناسب6و7و8و9و10و11و12و13و14و15.
الميتوكوندريا هي محور الأيض للخلية وتشارك في العديد من العمليات الخلوية الأساسية مثل: الفوسفور التأكسدي، وتوليد كتلة الحديد والكبريت، وتنظيم أبوتوبوتيك16،17. تحتوي هذه العضيات التكافلية على غشاءين، يشار إليهما باسم غشاء الميتوكوندريا الداخلي (IMM) والغشاء الميتوكوندريا الخارجي (OMM). أكثر من 99٪ من بروتينات الميتوكوندريا البشرية 1500 مشفرة في الجينوم النووي وتحتاج إلى نقلها عبر واحد أو اثنين من أغشية مختلفة18،19. وبالتالي تعتمد وظيفة الميتوكوندريا المناسبة على شبكة بروتيوستاستاس قوية لتصحيح أي أخطاء في استهداف البروتين أو نقله.
يركز مختبرنا على مجموعة فرعية من بروتينات الغشاء الميتوكوندريا تسمى بروتينات الذيل الراسية (TA) ، والتي لها مجال واحد عبر الميمبران في C-terminus20و21و22و23و24. وتشارك بروتينات TA في عدد من العمليات الأساسية، مثل موت الخلايا المبرمج، ونقل الحوييل، ونقل البروتين25. طوبولوجيا فريدة من نوعها من البروتينات TA يتطلب الإدراج بعد الترجمة، والذي يحدث في reticulum endoplasmic (ER) من قبل دخول الموجه من الذيل الراسية (GET) أو مسارات بروتين الغشاء الشبكي الإنتوبلازمي (EMC) أو في OMM من قبل مسار سيئة الخصائص20،26،27،28. الخصائص الفيزيائية الحيوية للMMD ضرورية وكافية لتوجيه بروتينات TA إلى الغشاء الصحيح29. الاعتراف بالخصائص الفيزيائية الحيوية بدلا من عزر تسلسل محدد يحد من إخلاص مسارات الاستهداف5. وبالتالي ، فإن سوء تقدير بروتينات TA هو إجهاد شائع لشبكات البروتيوستاسي. الإجهاد الخلوي، مثل تثبيط مسار GET، يسبب زيادة في سوء حساب البروتين إلى OMM والخلل الوظيفي الميتوكوندريا ما لم تتم إزالة هذه البروتينات على الفور30،31.
وهناك موضوع مشترك في بروتيوستسيس الغشاء هو استخدام AAA + (ATPase Aالمرتبطة الخلوية Activities) البروتينات لإزالة البروتينات القديمة، التالفة، أو مغلوطة من طبقة الدهون1،32،33،34،35،36،37،38 . البروتينات AAA + هي المحركات الجزيئية التي تشكل حلقات سداسية وتخضع لحركات تعتمد على ATP لإعادة تشكيل الركيزة ، وغالبا عن طريق النقل من خلال المسام المحورية الضيقة39،40. على الرغم من أن جهدا كبيرا قد كرس لدراسة استخراج البروتينات الغشاء من قبل AAA + ATPases، وإعادة تشكيل معقدة أو تنطوي على خليط من الدهون والمنظفات41،42، مما يحد من القوة التجريبية لفحص آلية استخراج الركيزة من طبقة ثنائية الدهون.
Msp1 هو AAA + ATPase المحفوظة للغاية الراسية في OMM والبيروكسيسومات التي تلعب دورا حاسما في بروتيوستاسي الغشاء عن طريق إزالة بروتينات TAمغلوطة 43،44،45،46،47. Msp1 كما تبين مؤخرا لتخفيف التوتر استيراد البروتين الميتوكوندريا عن طريق إزالة البروتينات الغشاء التي المماطلة أثناء النقل عبر OMM48. فقدان Msp1 أو الإنسان homolog ATAD1 النتائج في تجزئة الميتوكوندريا، والفشل في الفوسفور التأكسدي، والمضبوطات، وزيادة الإصابة بعد السكتة الدماغية، والموت المبكر31،49،50،51،52،53،54،55،56.
لقد أظهرنا أنه من الممكن إعادة تشكيل بروتينات TA مع Msp1 والكشف عن الاستخراج من طبقة ثنائية الدهون57. يستخدم هذا النظام المبسط بروتينات نقية بالكامل أعيد تشكيلها في ليبوسومات محددة تحاكي OMM (الشكل 1)58،59. يمكن لهذا المستوى من التحكم التجريبي معالجة الأسئلة الميكانيكية التفصيلية لاستخراج الركيزة التي هي مستعصية تجريبيا مع إعادة تشكيل أكثر تعقيدا تنطوي على بروتينات AAA + أخرى. هنا، نقدم بروتوكولات تجريبية تفصل أساليبنا لإعداد الليبوسوم، وإعادة تشكيل بروتين الغشاء، ومقايسة الاستخراج. ونأمل أن تسهل هذه التفاصيل التجريبية إجراء مزيد من الدراسة لعملية البروتيستاسيس الغشائية الأساسية ولكن غير المفهومة جيدا.
Protocol
1. إعداد الليبوسوم
- الجمع بين مخزونات الكلوروفورم من الدهون في نسب مناسبة لمحاكاة الغشاء الميتوكوندريا الخارجي.
- إعداد 25 ملغ من خليط الدهون. نحن نستخدم خليطا من الدهون التي تم إنشاؤها سابقا والتي تحاكي أغشية الميتوكوندريا، تتكون من 48:28:10:10:4 نسبة الأضراس من الكولين بيض الدجاج فوسفاتيديل (PC), الدجاج البيض فوسفاتيديل الإيثانولامين (PE), الأبقار الكبد فوسفاتيديل إينوزيتول (PI), الاصطناعية 1,2-ديوليويل-s 1-glycero-3-فوسفو-L-سيرين (DOPS)، والاصطناعية 1'،3'-bis[1،2-ديوليويل-سن-غليسيرو-3-فوسفو]-غليسيرول (TOCL)58،59. تظهر عينة الحسابات في الجدول 1.
- جلب جميع المخزونات الدهنية إلى درجة حرارة الغرفة قبل الافتتاح لأن هذا سوف يحد من التكثيف. وبما أن معظم المختبرات ليس لديها طريقة دقيقة لقياس تركيز الدهون، فإن أي ماء يمتصه مخزون الكلوروفورم سيغير تركيز مخزون الدهون وبالتالي نسبة الدهون المستخدمة في المقايسة.
- كما المخزونات الدهون تأتي في أمبولات الزجاج، ونقل الكمية المطلوبة من الدهون إلى قارورة زجاجية باستخدام حقنة 1 مل. إضافة 2 ملغ من ديثيوثيريتول (DTT) إلى القارورة لمنع أكسدة الدهون. العمل بسرعة كما تبخر الكلوروفورم سوف تغير تركيز الدهون.
- نقل أي الدهون المتبقية إلى قارورة زجاجية منفصلة وتناسب مع الحاجز PFTE. إضافة 2 ملغ من DTT إلى القارورة، والتفاف مع البارافيلم وتخزينها في -20 درجة مئوية لمنع أكسدة الدهون. حاول استخدام الدهون في غضون 3 أشهر من نقلها إلى القنينات. لمنع التلوث المحتمل لمخزونات الكلوروفورم عن طريق الجريان السطحي للعلامة ، قم بنقل الملصقات من ال ampules الأصلية إلى قوارير الزجاج بدلا من التسمية مع علامة.
- تبخر الكلوروفورم تحت تيار لطيف جدا من النيتروجين في حين الغزل قارورة الزجاج باستمرار باليد في غطاء الدخان، وتعمل أساسا بمثابة rotovap اليدوي. تدور القارورة بسرعة ثابتة (20-40 دورة في الدقيقة) باليد للحفاظ على الدهون تتحرك. والهدف من ذلك هو تبخر كل الكلوروفورم والحصول على طلاء حتى من الدهون على قارورة الزجاج بأكمله.
تنبيه: الكلوروفورم هو سام للأعصاب، وينبغي تنفيذ هذه الخطوة في غطاء الدخان.- إرفاق ماصة باستور جديدة إلى أنبوب النيتروجين. لا تدع أي من الدهون دفقة من القارورة أو على ماصة باستور. الهدف غيض في الجزء السفلي من القارورة حتى الهواء يرتد من أسفل ويدفع الدهون نحو مركز القارورة. الحصول على طلاء حتى على قارورة كاملة مع تجنب أي تراكم في زوايا أو من قبل الغطاء. تستغرق هذه العملية بأكملها حوالي 5 دقائق.
- كما يثخن الخليط في "حبة" من الدهون، وتوجيهه إلى وسط القارورة عن طريق تغيير زاوية القارورة. بمجرد أن تبدأ الخرزة في أن تصبح أصغر ، قم بتشغيل تيار النيتروجين قليلا لتفريق الخرز ، مما يضمن عدم انفجار أي من الدهون من القارورة.
- إزالة أي الكلوروفورم المتبقية تحت فراغ.
- وضع قارورة الزجاج على فراغ المنزل أو مضخة فراغ الحجاب الحاجز لمدة 1 ساعة لإزالة معظم الكلوروفورم المتبقية. هذه الفراغات عموما ليست قوية بما يكفي لإزالة كل من الكلوروفورم، لكنها يمكن أن تتسامح مع كميات صغيرة من المذيبات أفضل من الفراغات الدوارة عبثا.
- وضع قارورة على فراغ قوي (<1 mTorr) لمدة 12-16 ساعة لإزالة كلوروفورم المتبقية. تأكد من تجنب ارتطام القارورة أثناء هذه العملية.
- Resuspend الدهون في 1.25 مل من العازلة الليبوزوم (50 م HEPES KOH pH 7.5, 15٪ الجلسرين, 1 MM DTT). كما بدأنا مع 25 ملغ من الدهون, وهذا يؤدي إلى تركيز 20 ملغم / مل. إعادة إنفاق الدهون بالكامل مع عدم وجود قطع مرئية. إذا تجمع الدهون في زاوية القارورة، يمكن أن تكون هذه عملية طويلة.
- دوامة القارورة بقوة حتى تكون العينة ناعمة حليبي. نجد أنه إذا تم التبخر الكلوروفورم بشكل صحيح في الليلة السابقة ، فإن هذه العملية تستغرق حوالي 5-10 دقائق.
- لضمان إعادة تأمين كاملة من الدهون، تدوير على عجلة في درجة حرارة الغرفة لمدة 3 ساعات في ~ 80 دورة في الدقيقة. إزالة قارورة من عجلة القيادة مرة واحدة كل ساعة لمدة 1 دقيقة من دوامة لضمان خلط حتى.
- نقل الدهون بعناية إلى أنبوب طرد مركزي صغير نظيف سعة 1.5 مل. قم بإجراء 5 دورات تجميد-ذوبان باستخدام النيتروجين السائل للتجميد وكتلة حرارة 30 درجة مئوية للذوبان. هذه الخطوة تساعد على تحويل الحويصلات متعددة المصابيح إلى الحويصلات unilamellar.
- اقذف الدهون.
- أثناء دورات ذوبان الجليد تجميد، وإعداد الطارد مصغرة. تجميع مصغرة البثق مع 10 مم مرشح يدعم وغشاء البولي من حجم المسام المطلوب (نستخدم 200 نانومتر). سيؤثر حجم الفلتر على حجم الليبوسوم ، مما سيؤثر على تركيز البروتينات المطلوبة لإعادة تشكيلها(الخطوة 2.3).
- ضع الطارد الصغير على طبق ساخن واحضر درجة حرارة الطارد إلى 60 درجة مئوية.
- وضع الدهون في حقنة زجاجية ضيقة الغاز 1 مل ووضع بعناية في نهاية واحدة من الطارد مصغرة. ضع الحقنة الفارغة الضيقة بالغاز في الجانب الآخر من الطارد الصغير. السماح للدهون إلى equilibrate إلى درجة حرارة موقف البثق لمدة 5-10 دقائق.
- نقل الدهون إلى حقنة بديلة عن طريق دفع بلطف المكبس من حقنة مملوءة. دفع الحل من حقنة بديلة في الحقنة الأصلية. كرر هذه العملية ذهابا وإيابا 15 مرة، بحيث في تمرير15 th تنتهي الدهون في حقنة بديلة. مراقبة وحدة التخزين في كل تمريرة للتأكد من عدم وجود أي تسرب.
- إعداد aliquots استخدام واحد من الدهون، وتجميد فلاش في النيتروجين السائل وتخزينها في -80 درجة مئوية. الليبوسومات مستقرة عند -80 درجة مئوية لعدة أشهر. تتطلب إعادة التشكيل 10 ميكرولتر من الليبوسومات في كل مرة (الخطوة 2.3.4) ، لذلك من المناسب إعداد 10 ميكرولتر أو 20 ميكرولتر من الاقتباسات.
2 إعادة تشكيل Msp1 ونموذج بروتين TA
- إعداد العازلة إعادة تشكيل: 50 mM HEPES pH 7.5، 200 mM خلات البوتاسيوم، 7 mM خلات المغنيسيوم، 2 MM DTT، 10٪ السكروز، 0.01٪ azide الصوديوم، 0.2-0.8٪ Deoxy الفصول الكبيرة (DBC).
- تحسين ظروف إعادة تشكيل الدفعة الجديدة من الليبوسومات. تركيز DBC والخرز الحيوي المطلوب لإعادة التشكيل الأمثل يختلف تبعا لدفعة من الليبوسومات المستخدمة. للحد من الإعدادية لتقلب الإعدادية، واستخدام نفس الكثير من DBC لجميع التجارب. عند تغيير الكثير من DBC، كرر عملية التحسين.
- إعداد سلسلة من إعادة تشكيل مع تركيزات مختلفة من DBC (0.2٪ - 0.8٪) والخرز الحيوي (25 ملغ - 100 ملغ) في كل مرة يتم فيها إعداد دفعة جديدة من الليبوسومات. من المهم عدم إسقاط DBC تحت تركيز micelle الحرجة (CMC) ~ 0.12٪. بمجرد تحسين الظروف، نوصي بجمع جميع البيانات باستخدام نفس الشروط الإعدادية وإعادة التشكيل.
- ازبر فعالية ظروف إعادة التشكيل المختلفة باستخدام المقايسة الاستخراجية الموضحة في الخطوة 3.
- إعداد الخرز الحيوي بتركيز نهائي قدره 250 ملغم/مل.
- تزن 2.7 غرام من الخرز الحيوي المجفف وإعادة الإنفاق في أنبوب الطرد المركزي 50 مل من الميثانول 100٪ (حوالي 45 مل) لتبلل الخرز. في البداية الرطب الخرز الحيوي في الميثانول لمنع الهواء من المحاصرين في مسام الخرز. مرة واحدة في الميثانول، والحفاظ على الخرز الحيوي الرطب كما أي الهواء المحاصرين من قبل الخرز الحيوي سوف يغير قدرتها على امتصاص المنظفات.
- إزالة الميثانول عن طريق غسل الخرز 8x مع حوالي 45 مل من المياه فائقة البور (18.2 mΩ)، ويشار إليها فيما بعد باسم ddH2O. بيليه الخرز عن طريق الغزل في 3200 × ز لمدة 1 دقيقة. decant السائل وإعادة الإنفاق في ddH2O.
- بعد الغسيل، ريسوسبند في 10 مل من DDH2O مع 0.02٪ من أزيد الصوديوم وتخزينها في 4 درجة مئوية. يمكن تخزين الخرز الحيوي عند درجة حرارة 4 درجات مئوية لعدة أشهر. هذا المخزون هو 250 ملغ / مل كما يفترض ~ 0.2 غ يضيع خلال خطوات الغسيل.
- حساب حجم الليبوسوم والعدد المطلوب من جزيئات بروتين TA و Msp1 لكل ليبوسوم. وهذا سيحدد تركيز Msp1 و TA البروتين اللازم لإعادة تشكيل.
- أولا، حساب عدد جزيئات الدهون لكل ليبوسوم unilamellar(Nالمجموع)باستخدام المعادلة
 حيث د هو قطر الليبوسوم، ح هو سمك طبقة ثنائية، و هو منطقة مجموعة الرأس الدهون.
حيث د هو قطر الليبوسوم، ح هو سمك طبقة ثنائية، و هو منطقة مجموعة الرأس الدهون.- قياس قطر الليبوسوم بواسطة DLS. في مثالنا، تم الحصول على قيمة 70 نانومتر القطر الليبوزوم(د).
- استخدام قيمة 5 نانومتر ل h و 0.71 نانومتر2 ل,وهو حجم مجموعة الرأس لفوسفاتيديلكولين. وفي هذه الحالة بالذات، يبلغ المجموع الوطني 610 37.
- بعد ذلك، حساب تركيز الضرس من الدهون Mالدهون باستخدام متوسط الوزن الجزيئي للدهون في الخليط. في هذا المثال، تركيز الدهون هو 20 ملغم/مل (الخطوة 1.4) ومتوسط الوزن الجزيئي للدهون هو 810 غرام/مول(الجدول 1). وهذا يؤدي إلى قيمة 0.0247 M ل Mالدهون.
- بعد ذلك، حساب تركيز الضرس من الليبوسومات، MLiposome،وذلك باستخدام المعادلة
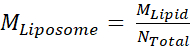 حيث M الدهون هو تركيز الضرس من الدهون من الخطوة 2.3.2،ومجموع N هو العدد الإجمالي للدهون لكل ليبوسوم محسوبة في الخطوة 2.3.1. في هذا المثال، تركيز الأسهم 20 ملغم/مل من الليبوسومات هو حوالي 660 nM.
حيث M الدهون هو تركيز الضرس من الدهون من الخطوة 2.3.2،ومجموع N هو العدد الإجمالي للدهون لكل ليبوسوم محسوبة في الخطوة 2.3.1. في هذا المثال، تركيز الأسهم 20 ملغم/مل من الليبوسومات هو حوالي 660 nM. - حساب كمية Msp1 و TA البروتين المطلوب لرد فعل إعادة تشكيل 100 ميكرولتر.
ملاحظة: التركيز النهائي للدهون في إعادة التشكيل هو 2 ملغم / مل ، وهو تخفيف 10x من مخزون الدهون. وهذا يعطي تركيز الدهون النهائي من 66 nM. التركيز النهائي من Msp1 هو 792 nM، والذي يعطي في المتوسط 12 نسخة إجمالية (2 هيكسامتر وظيفية) لكل ليبوسوم. التركيز النهائي للبروتين TA هو 660 nM، والذي يعطي في المتوسط 10 نسخ لكل ليبوسوم.
- أولا، حساب عدد جزيئات الدهون لكل ليبوسوم unilamellar(Nالمجموع)باستخدام المعادلة
- في أنبوب PCR، اخلطي معا Msp1 المنقى، بروتين TA، والليبوسومات في عازل إعادة التشكيل. ترتيب الإضافة هو العازلة والبروتينات، والدهون الماضي. يبلغ الحجم الإجمالي 100 ميكرولتر. اتركي الخليط يجلس على الثلج لمدة 10 دقائق. تنقية البروتين Msp1 و TA كما سبق وصفه57.
- استخدام بروتين TA نموذج جيد الخصائص له العلم-سومو-Sec22 كركيزة التحكم الإيجابية عند إنشاء أول المقايسة. يحتوي هذا البناء على علامة له لسهولة تنقية ، علامة 3x-Flag للكشف عنها بواسطة لطخة غربية ، ومجال سومو لزيادة الذوبان ، و TMD من بروتين ER-TA Sec22 لإعادة تشكيله والاعتراف به من قبل Msp1.
- تأكد من أن حلول المخزون من كل من Msp1 وبروتين TA هي حوالي 100 ميكرومتر لتقليل تأثير N-Dodecyl β-D-maltoside (DDM) من تنقية البروتين على إعادة التشكيل. تنقية Msp1 هو في 20 mM HEPES درجة الحموضة 7.5، 100 mM كلوريد الصوديوم، 0.1 mM تريس (2-carboxyethyl)فوسفين هيدروكلوريد (TCEP)، 0.05٪ DDM في حين أن البروتين TA النقي هو في 50 mM تريس pH 7.4، 150 مليون كلوريد الصوديوم، 10 mM كلوريد المغنيسيوم، 5 mM β ميركابتوثانول، 10٪ الجلسرين، 0.1٪ DDM. حلول المخزون من ما يقرب من 100 ميكرومتر بروتين TA ومونومير Msp1 يضمن أن هذه المكونات سوف تشكل < 5٪ من حجم إعادة التشكيل النهائي، مما أدى إلى تخفيف DDM تحت CMC.
- أضف الكمية المطلوبة من الخرز الحيوي إلى العينة لإزالة المنظفات.
- قطع غيض من طرف ماصة P200 إلى حوالي1/8 بوصة في القطر بحيث يمكن أن يصلح الخرز من خلال طرف. دوامة أنبوب الخرز الحيوي جيدا للحصول على خليط موحد وإزالة الغطاء بسرعة وماصة تصل وحدة التخزين قبل أن يستقر الخرز الحيوي. نقل الخرز الحيوي إلى أنبوب PCR فارغة.
- عندما تنتهي إعادة التشكيل من حضانتها لمدة 10 دقائق على الجليد ، استخدم طرف ماصة غير مقطوع لإزالة جميع السائل من الخرز الحيوي. ثم نقل 100 ميكرولتر إعادة تشكيل في أنبوب مع الخرز الحيوي. يجب أن يتم ذلك بسرعة حتى لا تحبس الخرز الحيوي الهواء ، مما سيؤدي إلى تعويم الخرز.
- السماح لإعادة تشكيل لتدوير على عجلة في ~ 80 دورة في الدقيقة لمدة 16 ساعة في 4 درجة مئوية.
- إزالة المواد المعاد تشكيلها من الخرز الحيوي. القيام تدور سريعة في picofuge بيليه الخرز الحيوي، ومن ثم استخدام طرف pipet غير المصقول لنقل المواد المعاد تشكيلها إلى أنبوب PCR نظيفة. كرر هذه العملية 1-2 مرات حتى لا توجد حبات بيولوجية متبقية في العينة. استمر في إعادة تشكيل الثلج.
- مسح مسبق للمواد المعاد تشكيلها لإزالة أي بروتينات فشلت في إعادة تشكيلها في الليبوسومات.
- تحضير المخزن المؤقت للاستخراج: 50 mM HEPES pH 7.5، 200 mM خلات البوتاسيوم، خلات المغنيسيوم 7 mM، 2 mM DTT، 100 nM كلوريد الكالسيوم.
- توازن الأعمدة تدور الجلوتاثيون مع استخراج المخزن المؤقت وفقا لتوجيهات الشركة المصنعة. وهذا ينطوي عادة على 3 جولات من الغسيل مع 400 ميكرولتر من العازلة ومن ثم الطرد المركزي في 700 × ز لمدة 2 دقيقة في درجة حرارة الغرفة لإزالة العازلة.
- إضافة 5 ميكرومتر من كل مرافق (GST-SGTA و GST-Calmodulin) إلى المواد المعاد تشكيلها. هذه المرافقين سوف ربط TMD من أي البروتينات التي فشلت في إعادة تشكيلها في الليبوسومات. ووصف تنقية المرافقين سابقا6،57.
ملاحظة: هذه المرافقين متوفرة تجاريا، ولكننا نفضل تنقية في المنزل للسيطرة على التكلفة والجودة. كلا البروتينين في 20 mM تريس درجة الحموضة 7.5، 100 mM كلوريد الصوديوم، و 0.1 M TCEP، ولها تركيز المخزون حوالي 160 ميكرومتر. SGTA يتعرف على الركائز مع TMD مسعور للغاية في حين يربط Calmodulin TMDs مع رهاب الماء المعتدل6،29. معا، يمكن لهذا الكوكتيل المرافق التعرف على مجموعة واسعة من الركائز. - إضافة 100 ميكرولتر من المخزن المؤقت للاستخراج إلى المواد المعاد تشكيلها، ليصل حجم يصل إلى 200 ميكرولتر. أضف هذا إلى أعمدة الدوران الغلوتاثيونية متساوية الأضلاع. لاحظ أن أعمدة الدوران الجلوتاثيون توفر أعلى استرداد للعينة عندما يكون حجم ما قبل المقاصة 200 - 400 ميكرولتر.
- قم بتوصيل أعمدة الدوران وقم بالتناوب عند ~80 دورة في الدقيقة عند 4 درجات مئوية لمدة 30 دقيقة للسماح للمرافقين بربط الراتنج.
- تدور الأعمدة في 700 × ز لمدة 2 دقيقة في درجة حرارة الغرفة. التدفق من خلال المواد التي تم مسحها مسبقا التي استنفدت من البروتينات المجمعة. إبقاء المواد على الجليد والمضي قدما مباشرة مع المقايسة استخراج.
3. استخراج المقايسة
- إعداد أنابيب لتحليل صفحة SDS. سيكون لكل رد فعل 4 أنابيب: INPUT (I) ، FLOW Through (FT) ، WASH (W) ، و ELUTE (E).
- أضف 45 ميكرولتر من عينة DDH2O إلى أنبوب INPUT، و40 ميكرولتر من ddH2O إلى أنبوب FLOW THROUGH، و0 ميكرولتر إلى أنابيب WASH و ELUTE.
ملاحظة: يتم الحصول على أفضل نسبة إشارة إلى الضوضاء في هذا المقايسة عندما تكون عينات WASH و ELUTE مركزة 5x نسبة إلى عينات INPUT و FLOW THROUGH. بسبب التخفيفات أثناء الفحص ، يتطلب ذلك أخذ 5 ميكرولتر من العينة لعينة INPUT ، و 10 ميكرولتر من العينة لعينة FLOW THROUGH ، و 50 ميكرولتر من العينة لعينات WASH و ELUTE. - إضافة 16.6 ميكرولتر من 4x SDS الصفحة تحميل المخزن المؤقت لكل أنبوب. حجم الإجمالي لكل عينة هو 50 ميكرولتر قبل SDS PAGE تحميل المخزن المؤقت. حجم النهائي هو 66.6 ميكرولتر (50 μL عينة + 16.6 ميكرولتر من 4x SDS الصفحة تحميل المخزن المؤقت).
- أضف 45 ميكرولتر من عينة DDH2O إلى أنبوب INPUT، و40 ميكرولتر من ddH2O إلى أنبوب FLOW THROUGH، و0 ميكرولتر إلى أنابيب WASH و ELUTE.
- تجميع المقايسة استخراج.
- إعداد رد فعل استخراج تحتوي على 60 ميكرولتر من البروتيوليبوسومات تطهيرها مسبقا، 5 ميكرومتر من GST-SGTA، 5 ميكرومتر من GST-Calmodulin، و 2 M ATP. الجمع بين جميع الكواشف باستثناء ATP، والذي يستخدم لبدء رد الفعل. إحضار إلى وحدة تخزين نهائية من 200 ميكرولتر مع "المخزن المؤقت للاستخراج".
ملاحظة: كما يتم استخدام 60 ميكرولتر من عينة لكل المقايسة استخراج، يمكن استخدام إعادة تشكيل واحد لثلاثة المقايسات استخراج مختلفة. تنفيذ عناصر تحكم موجبة وسلبية (+ATP و-ATP) على المواد من نفس إعادة التشكيل. - المقايسة استخراج ما قبل الدافئة في كتلة الحرارة 30 درجة مئوية لمدة 2 دقيقة.
- إعداد رد فعل استخراج تحتوي على 60 ميكرولتر من البروتيوليبوسومات تطهيرها مسبقا، 5 ميكرومتر من GST-SGTA، 5 ميكرومتر من GST-Calmodulin، و 2 M ATP. الجمع بين جميع الكواشف باستثناء ATP، والذي يستخدم لبدء رد الفعل. إحضار إلى وحدة تخزين نهائية من 200 ميكرولتر مع "المخزن المؤقت للاستخراج".
- بدء المقايسة استخراج بإضافة ATP إلى التركيز النهائي من 2 mM وبدء الموقت.
- إعطاء تدور 5 ثانية في picofuge لخلط ATP في رد الفعل. احتضان رد الفعل عند 30 درجة مئوية لمدة 30 دقيقة.
- أثناء الحضانة ، خذ 5 ميكرولتر من التفاعل وأضف إلى أنبوب INPUT. وتوقيت ذلك مرن.
- خلال فترة الحضانة هذه، توازن عمود دوران الجلوتاثيون واحد لكل عينة في المقايسة استخراج.
- تنفيذ سحب لأسفل على المرافقين لعزل المواد المستخرجة.
- وبمجرد الانتهاء من الحضانة لمدة 30 دقيقة، أضف 200 ميكرولتر من العازلة الاستخراج إلى الأنبوب ليصل إجمالي حجم إلى 400 ميكرولتر. أضف إلى راتنج الجلوتاثيون المتساوي الأضلاع واتركه يربط على عجلة القيادة عند درجة حرارة 4 درجات مئوية لمدة 30 دقيقة.
- تدور الأعمدة في 700 × ز لمدة 2 دقيقة في درجة حرارة الغرفة لجمع تدفق من خلال. خذ 10 ميكرولتر للتدفق من خلال أنبوب. تحتوي هذه العينة على ركائز لا تزال مدمجة في طبقة الدهون الثنائية.
- غسل الراتنج مرتين مع 400 ميكرولتر من العازلة استخراج، والتخلص من تدفق من خلال. في الغسيل الثالث، حافظ على التدفق من خلال واتخاذ 50 ميكرولتر للأنبوب WASH.
- إعداد 5 مل من Elution العازلة بإضافة الجلوتاثيون خفض إلى تركيز النهائي من 5 MM في استخراج العازلة. قم بإعداد هذا المخزن المؤقت طازجا في كل مرة.
- إضافة 200 ميكرولتر من المخزن المؤقت Elution إلى العمود تدور. احتضان في درجة حرارة الغرفة لمدة 5 دقائق. تدور في 700 × ز لمدة 2 دقيقة في درجة حرارة الغرفة إلى elute. الحفاظ على تدفق من خلال. كرر العملية مرة ثانية بحيث يكون إجمالي حجم elution 400 ميكرولتر.
- خذ 50 ميكرولتر من العينة من عينة Elution وأضفها إلى أنبوب ELUTE.
- تحليل نشاط الاستخراج باستخدام SDS-PAGE ولطخة الغربية.
ملاحظة: كما blot الغربية إجراء قياسي إلى حد ما، يتم توفير بروتوكول أساسي الذي يبرز بعض التفاصيل فريدة من نوعها لهذا المقايسة.- تحميل عينات في هلام البولي أكريلاميد خالية من وصمة عار (4٪ التراص، 15٪ فصل) وتشغيلها في 200 V لمدة 50 دقيقة في مخزن مؤقت تريس الجليسين. إذا سمحت المساحة بذلك، استخدم سلما غير ملطخ وملطخ للسماح بالتصور على صور هلام خالية من البقع ونقلها إلى غشاء PVDF على التوالي. هلام وصمة عار الحرة يسمح التصور الكمي من التربتوفان التي تحتوي على البروتينات عند التنشيط مع الأشعة فوق البنفسجية، في حين لا يزال يسمح هلام لاستخدامها للطخة الغربية.
- صورة هلام وصمة عار خالية للتأكد من أن هناك تحميل على قدم المساواة عبر جميع العينات. هذا هو عنصر تحكم أساسي يضمن أي تغييرات في إشارة الكشف عن طريق وصمة عار الغربية ليست نتيجة لتحميل البروتين متغير. يجب أن يكون هناك فقط نطاقات مرئية للمرافقين (GST-calmodulin و GST-SGTA) في عينات INPUT و ELUTION. تذكر أن نموذج ELUTE سيكون أكثر تركيزا من نموذج INPUT.
- تجميع كاسيت لطخة الغربية باستخدام غشاء PVDF 45 ميكرومتر. نقل في تيار ثابت من 300 م.م لمدة 60 دقيقة.
- بعد سد الغشاء، ربط إلى الأجسام المضادة الأولية لمدة 16 ساعة في 4 درجة مئوية مع اهتزاز لطيف ~ 15 دورة في الدقيقة. لطخة للركيزة مع أرنب مكافحة العلم في تخفيف 1:1،000.
ملاحظة: الأجسام المضادة الأولية والثانوية المستخدمة ستكون ركيزة محددة والتركيز للاستخدام قد تحتاج إلى تحسين. - غسل الغشاء واحتضان مع الأجسام المضادة الثانوية، الماعز المضادة للأرنب في تخفيف 1:10،000، مع اهتزاز لطيف لمدة 1 ساعة في درجة حرارة الغرفة.
- غسل الغشاء والصورة للتحليل باستخدام عامل الكشف عن النشاف الغربي.
النتائج
لتفسير النتائج بشكل صحيح ، يجب النظر إلى الجل الخالي من البقع واللطخة الغربية معا. يضمن الجل الخالي من البقع التحميل المتساوي عبر جميع العينات. عند عرض هلام وصمة عار خالية، والمرافقين (GST-calmodulin وGST-SGTA) سوف تكون مرئية في INPUT (I) وEUTE (E) الممرات. تحقق من أن كثافة هذه النطاقات موحدة عبر جميع عينات INPUT. وبالمثل، تأكد من أن كثافة موحدة عبر عينات ELUTE. وEUTE هو 5x أكثر تركيزا من INPUT وهذا الفرق في كثافة سوف تكون مرئية في المواد الهلامية.
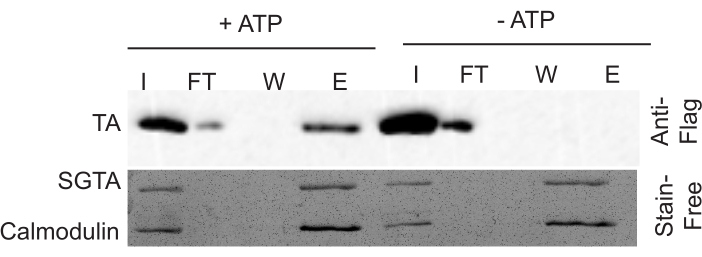
بعد استخدام هلام خالية من وصمة عار لتأكيد التحميل السليم، وفحص لطخة الغربية لتحديد نشاط الاستخراج. قياس نشاط الاستخراج بمقارنة مقدار الركيزة في الكسر ELUTE (E) نسبة إلى الكسر INPUT (I). تظهر الإشارة في Flow Through (FT) بعض التباين، ولكنها تشبه بشكل عام كسر INPUT. يجب ألا تكون هناك إشارة في كسر WASH (W). عادة، هناك ~ 10٪ كفاءة استخراج للسيطرة الإيجابية وكفاءة استخراج 1-2٪ في السيطرة السلبية(الشكل 2). تذكر أن كسر ELUTE هو 5x مكثفة مثل كسر INPUT، لذلك هذا يحتاج إلى أن تؤخذ في الاعتبار عند الحكم على كفاءة الاستخراج. إذا لم يتم تحسين ظروف إعادة التشكيل، فهناك عادة مستويات استخراج قابلة للمقارنة في كل من + ATP و- عينات ATP (الشكل 3). وتعزى هذه النتيجة إلى فشل Msp1 في إعادة تشكيل بكفاءة، مما أدى إلى العديد من البروتيوليبوسومات دون سداسي Msp1 وظيفية.
| الدهون | الخلد ٪ | ميغاواط | متوسط ميغاواط | ميكرومول في 25 ملغ | ملغ في 25 ملغ | مخزون الكلور (ملغم/مل) | μL ل 25 ملغ |
| كمبيوتر شخصي | 48% | 770 | 369.6 | 14.82 | 11.41 | 25 | 456.4 |
| PE | 28% | 746 | 208.88 | 8.64 | 6.45 | 25 | 258.0 |
| PI | 10% | 902 | 90.2 | 3.09 | 2.78 | 10 | 278.5 |
| المنشطات | 10% | 810 | 81 | 3.09 | 2.50 | 10 | 250.1 |
| توكلي | 4% | 1502 | 60.08 | 1.23 | 1.85 | 25 | 74.2 |
| كونك كور متوسط MW | 809.76 | ||||||
| ميكرومول في 25 ملغ | 30.87 | ||||||
الجدول 1: عينة من الحسابات لإعداد الليبوسوم. الأهداف الرئيسية لهذا الجدول هي لحساب تركيز تصحيح متوسط الوزن الجزيئي للخليط الدهون وحجم كل مخزون الدهون المطلوبة لجعل الليبوسومات. ميغاواط وتركيز المخزون تأتي من تسميات المنتج. يتم اختيار الدهون والخلد ٪ من قبل المستخدم.

الشكل 1: الرسوم المتحركة من المقايسة استخراج وقائمة الخطوات الرئيسية. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 2: بيانات تمثيلية تظهر فحصا يعمل بشكل صحيح. يتم تحديد كفاءة الاستخراج بمقارنة مقدار الركيزة في الكسر ELUTE مع كسر INPUT. أذكر أن الجل لديه 5x تحميل أعلى من كسر ELUTE بالنسبة إلى كسر INPUT. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3:البيانات التمثيلية لم يتم إعادة تشكيلها واستخراجها. هنا، النشاط في نموذج + ATP قابلة للمقارنة مع النشاط في - نموذج ATP. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تعتمد وظيفة الميتوكوندريا المناسبة على نظام قوي لمراقبة جودة البروتين. نظرا للحدود المتأصلة في إخلاص مسارات استهداف بروتين TA ، فإن بروتينات TA غير المعايرة هي مصدر ثابت للإجهاد للميتوكوندريا. أحد المكونات الرئيسية لشبكة البروتيوستازي الميتوكوندريا هو Msp1 ، وهو غشاء راسي AAA + ATPase يزيل بروتينات TA غير المعايرة من OMM. هنا، لقد وصفنا كيفية إعداد البروتيوليبوسومات، وإعادة تشكيل Msp1 ونموذج بروتين TA، وإجراء فحص الاستخراج. استخدمنا هذا المقايسة سابقا لإثبات أن Msp1 تعترف مباشرة ببروتينات TA غير المقيسة بشكل خاطئ وقادرة على استخراج هذه البروتينات من طبقة ثنائية الدهون دون أي بروتينات ملحقة أو مساعدين57.
ومن عيوب المقايسة أن هناك بعض التباين في عملية إعادة التشكيل. للسيطرة على تقلب الإعدادية إلى الإعدادية، ونحن دائما تشمل السيطرة الإيجابية والسلبية على نفس هلام / وصمة عار الغربية لضمان أن المقايسة لدينا يعمل على النحو المنشود. نحن نتجنب إجراء مقارنات بين إعادة التشكيل التي تمت في أيام مختلفة أو إجراء مقارنات بين البقع الغربية المختلفة. المقارنات الوحيدة التي نقوم بها هي لعينات أعيد تشكيلها بالتوازي وتشغيلها على نفس الجل / وصمة عار الغربية. كما أننا متحفظون للغاية في تفسير البيانات لدينا. على الرغم من أنه من الممكن تحديد كفاءة الاستخراج باستخدام ImageJ ، فإننا عادة ما نصف تجاربنا بأنها ذات نشاط كامل أو نشاط وسيط أو أي نشاط.
أحد مصادر التباين هو الكمية الإجمالية للبروتين المعاد تشكيله. في حين تتم إزالة غالبية البروتينات غير المدمجة من خلال عملية ما قبل المقاصة ، فإن كفاءة إعادة تشكيل Msp1 الأقل من الكمال يمكن أن يكون لها تأثير كبير على الكفاءة الملحوظة لاستخراج الركيزة. هذا التأثير ينشأ من حقيقة أن Msp1 يعمل ك homohexamer ، ولكنه ينقي كمونومر57. الليبوسومات التي تحتوي على أي شيء آخر غير نسخ 6x من Msp1 ستكون غير نشطة. على سبيل المثال، سيكون الليبوسوم الذي به 5 نسخ فقط من Msp1 غير نشط. الطريقة الوحيدة لتشكيل مستقرة كاملة الطول Msp1 hexamers هو تعطيل نشاط ATPase مع غير قابلة للتحلل ATP التناظرية (ATPγS) أو تعطيل E193Q ووكر B متحولة، وأيا منها لا تتوافق مع فحص النشاط. التغلب على هذه العقبة التقنية هو مجال من مجالات البحوث النشطة في مختبرنا.
مجال آخر من البحوث النشطة يركز على جعل المقايسة استخراج أكثر كمية. تعتمد الطريقة الحالية على السحب والنشاف الغربي للكشف عن الإشارات ، وكلاهما شبه كمي فقط ويظهران تقلبا في المقايسة. ومن شأن التعديل التساهمي للركائز المستخرجة أن يقضي على التباين الذي ينشأ عن عمليات السحب. وبالمثل، فإن استخدام الملصقات المشعة أو الفلورية على الركائز من شأنه أن يلغي الحاجة إلى البقع الغربية وما يرتبط بها من تقلب.
وقوة رئيسية للمقاسة هي أن النظام محدد تماما. يتم التعبير عن بروتينات الغشاء وتنقيتها بشكل مكومب ومن الممكن صنع متحولات محددة في كل من Msp1 والركيزة لدراسة جوانب محددة من التفاعل. تم تجاهل دور بيئة الدهون في البروتيوستازي إلى حد كبير بسبب التحديات التقنية لدراسة هذا بطريقة مفصلة. لأن المقايسة لدينا يستخدم الليبوسومات مع تكوين الدهون محددة، وهذا يسمح للسيطرة التجريبية الكاملة للبيئة الدهون. يمكننا بسهولة تعديل عوامل مثل: سيولة الدهون، سمك ثنائي الطبقات، هوية مجموعة الرأس، وحجم الدهون. نحن نعمل بنشاط على استخدام المقايسة لدينا لدراسة دور بيئة الدهون على نشاط Msp1. نأمل أن يكون إعادة تشكيل المختبر واستخراج المقايسة الموصوفة هنا بمثابة نظام نموذجي مبسط لدراسة العملية الخلوية الشائعة لاستخراج AAA + ATPase بوساطة من بروتينات الأغشية من طبقة ثنائية الدهون.
Disclosures
اي
Acknowledgements
وقد طور MLW جزءا من هذا البروتوكول خلال دراساته بعد الدكتوراه مع الدكتور روبرت كينان في جامعة شيكاغو.
يتم تمويل هذا العمل من قبل المعاهد القومية للصحة منحة 1R35GM137904-01 إلى MLW.
Materials
| Name | Company | Catalog Number | Comments |
| Biobeads | Bio-Rad | 1523920 | |
| Bovine liver phosphatidyl inositol | Avanti | 840042C | PI |
| Chicken egg phosphatidyl choline | Avanti | 840051C | PC |
| Chicken egg phosphatidyl ethanolamine | Avanti | 840021C | PE |
| ECL Select western blotting detection reagent | GE | RPN2235 | |
| Filter supports | Avanti | 610014 | |
| Glass vial | VWR | 60910L-1 | |
| Glutathione spin column | Thermo Fisher | PI16103 | |
| Goat anti-rabbit | Thermo Fisher | NC1050917 | |
| Mini-Extruder | Avanti | 610020 | |
| Polycarbonate membrane | Avanti | 610006 | 200 nM |
| PVDF membrane | Thermo Fisher | 88518 | 45 µM |
| Rabbit anti-FLAG | Sigma-Aldrich | F7245 | |
| Synthetic 1,2-dioleoyl-sn-glycero-3-phospho-L-serine | Avanti | 840035C | DOPS |
| Synthetic 1',3'-bis[1,2-dioleoyl-sn-glycero-3-phospho]-glycerol | Avanti | 710335C | TOCL |
| Syringe, 1 mL | Norm-Ject | 53548-001 | |
| Syringe, 1 mL, gas-tight | Avanti | 610017 |
References
- Song, J., Herrmann, J. M., Becker, T. Quality control of the mitochondrial proteome. Nature Reviews Molecular Cell Biology. 22, 54-70 (2021).
- Phillips, B. P., Miller, E. A. Membrane protein folding and quality control. Current Opinion in Structural Biology. 69, 50-54 (2021).
- Jiang, H. Quality control pathways of tail-anchored proteins. Biochimica et Biophysica Acta - Molecular Cell Research. 1868, 118922 (2020).
- McKenna, M. J., et al. The endoplasmic reticulum P5A-ATPase is a transmembrane helix dislocase. Science. 369, (2020).
- Hegde, R. S., Zavodszky, E. Recognition and Degradation of Mislocalized Proteins in Health and Disease. Cold Spring Harbor Perspectives in Biology. 11, 033902 (2019).
- Shao, S., Hegde, R. S. A calmodulin-dependent translocation pathway for small secretory proteins. Cell. 147, 1576-1588 (2011).
- Samuelson, J. C., et al. YidC mediates membrane protein insertion in bacteria. Nature. 406, 637-641 (2000).
- Anghel, S. A., McGilvray, P. T., Hegde, R. S., Keenan, R. J. Identification of Oxa1 Homologs Operating in the Eukaryotic Endoplasmic Reticulum. Cell Reports. 21, 3708-3716 (2017).
- Aviram, N., et al. The SND proteins constitute an alternative targeting route to the endoplasmic reticulum. Nature. 540, 134-138 (2016).
- Voorhees, R. M., Hegde, R. S. Structure of the Sec61 channel opened by a signal sequence. Science. 351, 88-91 (2016).
- Cichocki, B. A., Krumpe, K., Vitali, D. G., Rapaport, D. Pex19 is involved in importing dually targeted tail-anchored proteins to both mitochondria and peroxisomes. Traffic. 19, 770-785 (2018).
- Mateja, A., et al. Protein targeting. Structure of the Get3 targeting factor in complex with its membrane protein cargo. Science. 347, 1152-1155 (2015).
- Chacinska, A., Koehler, C. M., Milenkovic, D., Lithgow, T., Pfanner, N. Importing mitochondrial proteins: machineries and mechanisms. Cell. 138, 628-644 (2009).
- Chitwood, P. J., Hegde, R. S. An intramembrane chaperone complex facilitates membrane protein biogenesis. Nature. , (2020).
- Chitwood, P. J., Juszkiewicz, S., Guna, A., Shao, S., Hegde, R. S. EMC Is Required to Initiate Accurate Membrane Protein Topogenesis. Cell. 175, 1-30 (2018).
- Bock, F. J., Tait, S. W. G. Mitochondria as multifaceted regulators of cell death. Nature Reviews Molecular Cell Biology. 21, 85-100 (2020).
- Pfanner, N., Warscheid, B., Wiedemann, N. Mitochondrial proteins: from biogenesis to functional networks. Nature Reviews Molecular Cell Biology. 20, (2019).
- Bykov, Y. S., Rapaport, D., Herrmann, J. M., Schuldiner, M. Cytosolic Events in the Biogenesis of Mitochondrial Proteins. Trends in Biochemical Sciences. 45, 650-667 (2020).
- Pfanner, N., Warscheid, B., Wiedemann, N. Mitochondrial proteins: from biogenesis to functional networks. Nature Reviews Molecular Cell Biology. 427, 1135 (2019).
- Borgese, N., Coy-Vergara, J., Colombo, S. F., Schwappach, B. The Ways of Tails: the GET Pathway and more. The Protein Journal. , 1-17 (2019).
- Mateja, A., Keenan, R. J. A structural perspective on tail-anchored protein biogenesis by the GET pathway. Current Opinion in Structural Biology. 51, 195-202 (2018).
- Chio, U. S., Cho, H., Shan, S. Mechanisms of Tail-Anchored Membrane Protein Targeting and Insertion. Annual review of cell and developmental biology. 33, 417-438 (2017).
- Denic, V. A portrait of the GET pathway as a surprisingly complicated young man. Trends in biochemical sciences. , (2012).
- Hegde, R. S., Keenan, R. J. Tail-anchored membrane protein insertion into the endoplasmic reticulum. Nature Reviews Molecular Cell Biology. 12, 787-798 (2011).
- Kalbfleisch, T., Cambon, A., Wattenberg, B. W. A bioinformatics approach to identifying tail-anchored proteins in the human genome. Traffic. 8, 1687-1694 (2007).
- Doan, K. N., et al. The Mitochondrial Import Complex MIM Functions as Main Translocase for α-Helical Outer Membrane Proteins. Cell Reports. 31, (2020).
- McDowell, M. A., et al. Structural Basis of Tail-Anchored Membrane Protein Biogenesis by the GET Insertase Complex. Molecular Cell. 80, (2020).
- Guna, A., Volkmar, N., Christianson, J. C., Hegde, R. S. The ER membrane protein complex is a transmembrane domain insertase. Science. 591, 3099 (2017).
- Rao, M., et al. Multiple selection filters ensure accurate tail-anchored membrane protein targeting. eLife. 5, 21301 (2016).
- Schuldiner, M., et al. The GET complex mediates insertion of tail-anchored proteins into the ER membrane. Cell. 134, 634-645 (2008).
- Chen, Y. -. C., et al. Msp1/ATAD1 maintains mitochondrial function by facilitating the degradation of mislocalized tail-anchored proteins. The EMBO journal. 33, 1548-1564 (2014).
- Wu, X., Rapoport, T. A. Translocation of Proteins through a Distorted Lipid Bilayer. Trends in Cell Biology. , (2021).
- Phillips, B. P., Gomez-Navarro, N., Miller, E. A. Protein quality control in the endoplasmic reticulum. Current Opinion in Cell Biology. 65, 96-102 (2020).
- van de Weijer, M. L., et al. Quality Control of ER Membrane Proteins by the RNF185/Membralin Ubiquitin Ligase Complex. Molecular Cell. 79, (2020).
- Weir, N. R., Kamber, R. A., Martenson, J. S., Denic, V. The AAA protein Msp1 mediates clearance of excess tail-anchored proteins from the peroxisomal membrane. eLife. 6, 28507 (2017).
- Gardner, B. M., et al. The peroxisomal AAA-ATPase Pex1/Pex6 unfolds substrates by processive threading. Nature communications. 9, 135 (2018).
- Puchades, C., et al. Unique Structural Features of the Mitochondrial AAA+ Protease AFG3L2 Reveal the Molecular Basis for Activity in Health and Disease. Molecular Cell. , (2019).
- Castanzo, D. T., LaFrance, B., Martin, A. The AAA+ ATPase Msp1 is a processive protein translocase with robust unfoldase activity. Proceedings of the National Academy of Sciences of the United States of America. 117, 14970-14977 (2020).
- Wang, L., Myasnikov, A., Pan, X., Walter, P. Structure of the AAA protein Msp1 reveals mechanism of mislocalized membrane protein extraction. eLife. 9, (2020).
- Puchades, C., Sandate, C. R., Lander, G. C. The molecular principles governing the activity and functional diversity of AAA+ proteins. Nature Reviews Molecular Cell Biology. , 1-16 (2019).
- Yang, Y., et al. Folding-Degradation Relationship of a Membrane Protein Mediated by the Universally Conserved ATP-Dependent Protease FtsH. Journal of the American Chemical Society. , 10 (2018).
- Baldridge, R. D., Rapoport, T. A. Autoubiquitination of the Hrd1 Ligase Triggers Protein Retrotranslocation in ERAD. Cell. 166, 394-407 (2016).
- Fresenius, H. L., Wohlever, M. L. Sorting out how Msp1 maintains mitochondrial membrane proteostasis. Mitochondrion. 49, 128-134 (2019).
- Wang, L., Walter, P. Msp1/ATAD1 in Protein Quality Control and Regulation of Synaptic Activities. Annual Review of Cell and Developmental Biology. 36, 1-24 (2020).
- Dederer, V., et al. Cooperation of mitochondrial and ER factors in quality control of tail-anchored proteins. eLife. 8, 1126 (2019).
- Matsumoto, S., et al. Msp1 Clears Mistargeted Proteins by Facilitating Their Transfer from Mitochondria to the ER. Molecular Cell. , (2019).
- Li, L., Zheng, J., Wu, X., Jiang, H. Mitochondrial AAA-ATPase Msp1 detects mislocalized tail-anchored proteins through a dual-recognition mechanism. EMBO Reports. 20, (2019).
- Weidberg, H., Amon, A. MitoCPR - a surveillance pathway that protects mitochondria in response to protein import stress. Science. 360, (2018).
- Okreglak, V., Walter, P. The conserved AAA-ATPase Msp1 confers organelle specificity to tail-anchored proteins. Proceedings of the National Academy of Sciences of the United States of America. 111, (2014).
- Piard, J., et al. A homozygous ATAD1 mutation impairs postsynaptic AMPA receptor trafficking and causes a lethal encephalopathy. Brain. , (2018).
- Zhang, J., et al. The AAA+ ATPase Thorase regulates AMPA receptor-dependent synaptic plasticity and behavior. Cell. 145, 284-299 (2011).
- Prendergast, J., et al. Ganglioside regulation of AMPA receptor trafficking. The Journal of Neuroscience. 34, 13246-13258 (2014).
- Umanah, G. K. E., et al. Thorase variants are associated with defects in glutamatergic neurotransmission that can be rescued by Perampanel. Science Translational Medicine. 9, 4985 (2017).
- Pignatelli, M., et al. Synaptic Plasticity onto Dopamine Neurons Shapes Fear Learning. Neuron. 93, 425-440 (2017).
- Zhang, J., et al. The AAA Thorase is neuroprotective against ischemic injury. Journal of Cerebral Blood Flow and Metabolism. , 271678 (2018).
- Umanah, G. K. E., et al. AMPA Receptor Surface Expression Is Regulated by S-Nitrosylation of Thorase and Transnitrosylation of NSF. Cell Reports. 33, 108329 (2020).
- Wohlever, M. L., Mateja, A., McGilvray, P. T., Day, K. J., Keenan, R. J. Msp1 Is a Membrane Protein Dislocase for Tail-Anchored Proteins. Molecular Cell. 67, 194-202 (2017).
- Lovell, J. F., et al. Membrane binding by tBid initiates an ordered series of events culminating in membrane permeabilization by Bax. Cell. 135, 1074-1084 (2008).
- Leshchiner, E. S., Braun, C. R., Bird, G. H., Walensky, L. D. Direct activation of full-length proapoptotic BAK. Proceedings of the National Academy of Sciences of the United States of America. 110, 986-995 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved