Method Article
超高速フォースクランプ分光法によるミオシンのメカノ酵素的性質の解剖
Erratum Notice
要約
ここでは、処理ミオシン-5モーターで超高速フォースクランプ実験を行うための包括的なプロトコルを提示し、他のクラスのプロセスモーターの研究に簡単に拡張できます。プロトコルは、実験装置のセットアップからサンプル調製、データ収集、分析まで、必要なすべてのステップを詳述しています。
要約
超高速フォースクランプ分光法(UFFCS)は、レーザーピンセットに基づく単一分子技術であり、前例のない時間分解能で負荷がかかった状態での従来型および非従来型ミオシンの両方の化学力学の研究を可能にします。特に、アクチン-ミオシン結合形成直後に一定の力でミオシンモーターをプローブする可能性は、フォースフィードバックの高速レート(200kHz)とともに、UFFCSがミオシン作業ストロークなどの高速ダイナミクスの負荷依存性を研究するための貴重なツールであることを示しています。さらに、UFFCSは、プロセス的および非プロセス的なミオシン-アクチン相互作用が、加えられた力の強度と方向によってどのように影響を受けるかの研究を可能にします。
このプロトコルに従うことで、プロセスミオシン-5モーターやさまざまな非従来型ミオシンで超高速フォースクランプ実験を行うことが可能になります。いくつかの調整により、プロトコルは、キネシンやダイニンなどの他のクラスの処理モーターの研究にも簡単に拡張できます。プロトコルには、実験装置のセットアップからサンプル調製、校正手順、データ取得、分析まで、必要なすべてのステップが含まれています。
概要
過去数十年にわたり、光ピンセットは、立体構造変化と酵素速度論の同時操作と測定の顕著な可能性により、単一分子レベルでタンパク質相互作用のメカノケミストリーを解明するための貴重なツールでした1,2。特に、細胞内の分子モーターが及ぼす力の範囲の力を適用および測定する能力と、サブナノメートルの構造変化を測定する能力により、光ピンセットは、モータータンパク質の化学力学的特性とその機械的制御を解明するためのユニークな単一分子ツールになりました。
超高速フォースクランプ分光法(UFFCS)は、3ビーズ形状の負荷下での分子モーターの高速速度論を研究するために開発された、ピンセットに基づく単一分子力分光法です(図1a)3,4。UFFCSは、モータータンパク質への力の加わるタイムラグを光ピンセットの物理的限界、すなわちシステムの機械的緩和時間まで短縮し、ミオシンの実行開始後(数十マイクロ秒)に迅速に力を加えることを可能にします3。この能力を利用して、高速骨格3および心臓5筋ミオシンの初期の機械的イベントを調査し、パワーストロークの負荷依存性、弱結合状態と強結合状態、および生化学的(Pi)および機械的(パワーストローク)イベントの順序を明らかにしました。
3ビード形状は通常、非加工モーターの研究に採用され、フォースクランプを備えた単一ビーズ形状は、ミオシンVa6などの加工型非従来型ミオシンの研究に一般的に使用されています。ただし、プロセシブミオシンに対しても3ビーズUFFCSアッセイを好む理由はいくつかあります。第一に、アクチン-ミオシン結合直後の荷重の迅速な適用により、非プロセスモーターと同様に力発生の初期事象の測定が可能になります。さらに、処理型モータの場合、モータの走行距離と走行時間を一定の力で正確に測定することもできます(図1b)。さらに、フォースフィードバックのレートが高いため、システムはミオシン作業ストロークなどの位置の急速な変化中に力を一定に保つことができ、それによってモーターステッピング中の一定の負荷を保証します。システムの高時間分解能により、サブms相互作用の検出が可能になり、ミオシンのアクチンへの弱い結合を調査する可能性が開かれます。最後に、アッセイ形状は、力がアクチンフィラメントに沿って加えられることを保証し、力の横方向および垂直方向の成分はごくわずかです。垂直方向の力成分がモータの動力学7,8の負荷依存性に大きく影響することが示されているので、この点は特に関連性がある。この手法を用いることで、加工ミオシン-5Bにさまざまな補助荷重と抵抗荷重を適用し、広範囲の力に対する処理能力の荷重依存性を直接測定することができました4。
図1aに示すように、このシステムでは、単一のアクチンフィラメントが、二重光ピンセット(「ダンベル」)の焦点に閉じ込められた2つのポリスチレンビーズの間に吊り下げられています。不均衡な正味力F = F1-F 2は、高速フィードバックシステムを介してフィラメントに課され、フィラメントは、正味の力が反対方向に反転するユーザー定義の反転点に到達するまで、一方向に等速で移動します。モータータンパク質がフィラメントと相互作用していないとき、ダンベルは単一のモータータンパク質が付着している台座ビーズにまたがる三角形の波状(図1b、下のパネル)で自由に前後に動きます。相互作用が確立されると、ダンベルによって運ばれる力はモータータンパク質に非常に急速に伝達され、モーターはミオシンがアクチンから分離するまで、相互作用時にフィードバックシステムによって加えられた力の強さと方向の下でステップすることによってフィラメントを移動させ始めます。トラップされたアクチンフィラメントの極性に依存するモーターのステッピングによって生成される変位であるため、負荷は、加えられた力の方向に応じて、補助的、つまりモーター変位と同じ方向に押す(図1b上のパネルを押す)、または抵抗性、つまりモーターの変位に対して反対方向に引っ張る(図1bの引っ張り)のいずれかになります。 上パネル)は、加えられた負荷の強度と方向性の両方によって運動処理能力の化学力学的調節を研究することを可能にする。
次のセクションでは、1)光学セットアップのセットアップ、光学トラップのアライメントとキャリブレーションの手順、2)サンプルチャンバー内のすべてのコンポーネントの準備とそれらのアセンブリ、3)測定手順、 4)ランレングス、ステップサイズ、モータータンパク質の速度などの重要な物理的パラメータを抽出するための代表的なデータとデータ分析。
プロトコル
1.光学セットアップ
注意: 実験セットアップは、ナノメートルのポインティング安定性と<1%のレーザー強度変動を備えた二重光ピンセットで構成されています。これらの条件下では、典型的なトラップ剛性(0.1 pN/nm)と張力(1 pN - 数十 pN)の下で、ナノメートルレベルでのダンベルの安定性が保証されます。 図2 は、光学セットアップの詳細なスキームを示しています。
- 光ピンセットの設計と建設 9,10,11.
- セットアップのすべてのコンポーネントを 、図2のスキームに従って光学テーブルに配置します。光学テーブルには、機械的振動を最小限に抑えるためのアクティブアイソレータが含まれていることに注意してください。さらに、顕微鏡構造はエラストマーアイソレータに取り付けられ、音響ノイズと機械的共振を吸収します。
- 光アイソレータをレーザー光源( 図2の「OI」)の近くに挿入して、光フィードバックによるランダムな振幅変動を回避します。
- レーザーポインティングの安定性に影響を与える可能性のある気流や乱流を減らすために、パス全体を閉じたボックスに密閉します。
- 偏光ビームスプリッター(PBS)を使用して、メインレーザー光源(Nd:YAGレーザー、図2の波長1,064nm)を直交偏光の 2つの分岐に分割して、二重光ピンセットを作成します。タイムシェアトラップは、張力12の下でダンベルの振動を誘発するため、避ける必要があります。
- ダイレクトデジタルシンセサイザ(DDS)によって駆動される2つの音響光学偏向器(図2のAOD)を使用して、フィールドプログラマブルゲートアレイFPGAボードからのデジタル出力を介してDDSを直接駆動することにより、2つのトラップの微細で迅速な動きとアクチン張力の正確な調整を可能にします(図2を参照)。
注:測定中に、非結合状態、ミオシン相互作用、動きなど、両方のトラップを迅速に補正して一定の力を維持するには、全体的なフィードバック応答時間を<10μsにする必要があります。このためには、位置検出器の帯域幅は>= 100kHzで、データは>= 200kHzのサンプルレートで集録する必要があります。集録されたデータポイント(5μsのアクイジション時間)ごとに、2つのトラップの比例補正がFPGAによって計算され、AODを駆動する2つのDDSに送信されます。AODの応答時間は、必要なフィードバック応答時間を満たすために5μs未満でなければなりません。 - トラップされたビーズ位置をnm検出するには、コンデンサの後焦点面に2つの象限フォトダイオード検出器( 図2のQPD)を配置します。コンデンサーの後焦点面に共役した面内のQPDと、対物レンズの後方焦点面に共役した面内のAODを正確に位置合わせすることで、QPD信号がAOD周波数に依存しないことが保証されます。
- AODをマイクロメータドライブのリニアトランスレータに取り付け、結晶の端がレーザービームに近づくまで配置します。次に、対物レンズを螺山付き対物レンズハウジングを中心としたアイリスに交換し、対物レンズの背面開口部サイズに合わせて絞りを調整します。
- ピエゾ結晶によってブロックされたビームの部分がアイリスの後に見えるまでトランスレータをレーザービームに向かって動かし、トランスレータを少し後方に回して、ビームがアイリス開口部を再び完全に埋めるようにします。
- 2 番目の AOD に対して手順 1.1.7-1.1.8 を繰り返します。カバーガラス13の表面に貼り付けられたビード上のビームを急速に移動させながら、QPDからのタイムラグを測定することにより、フィードバックループの応答時間を確認します。
注意: 上記の3つのステップ(1.1.7-1-1-9)は、AOD結晶の慎重な位置合わせにつながります。これらのステップは、ビーム偏向およびフィードバック13の両方の時間応答を最適化するために重要である。
- フォトダイオードを使用して、顕微鏡入口でのトラップレーザーの強度変動を測定しますが、これは1%未満でなければなりません。フォトダイオードの帯域幅はイメージングレートよりも大きくなければならないことに注意してください。
- 両方のトラップのポインティング安定性を確認します。
- 20 μLのシリカビーズ(1.2 μm、10%固形分)を1 mLのアセトンで希釈し、30秒間超音波処理し、短時間ボルテックスし、19,000 x gで2分間遠心分離することにより、リン酸緩衝液(PB)でシリカビーズを調製します。
- 上清を取り除き、1 mLのアセトンに再懸濁し、洗浄を繰り返します。1 mLの50 mM PBに再懸濁し、2回洗浄します。最後に、100 μLの50 mM PBに再懸濁します。
- シリカビーズで光学ピンセット校正を行い、両面テープ(厚さ約60μm)で顕微鏡スライドにカバーガラスを貼り付けてフローチャンバーを構築します。チャンバーに1 mg/mL BSA(ウシ血清アルブミンタンパク質)を入れ、3分間待ちます。
- PB中のシリカビーズの1:1000希釈液をチャンバーに流します。シリコングリースで満たされたシリンジを使用して、チャンバーを慎重に密閉します。各トラップに単一のビーズをトラップし、パワースペクトル法14 を適用してそれらを較正します。
- 20μLのシリカビーズ(直径1.2μm、固体10%)を1〜1.5mLのアセトン、ボルテックスに溶解し、30秒間超音波処理することにより、酢酸ペンチル(室温)中のシリカビーズを調製する。
- 18,500 x g で2分間遠心分離します。上清を捨て、1 mLのアセトンに再懸濁してから、洗浄を繰り返します。1 mLの酢酸ペンチルに再懸濁し、酢酸ペンチルで洗浄(遠心分離機と再懸濁)を2回繰り返します。ペレットを100 μLのニトロセルロース1%および900 μLの酢酸ペンチルに再懸濁します。4°Cで2ヶ月間保存します。
- 24 x 24 mmのガラスカバーガラスを取り、純粋なエタノールに浸した紙で慎重に拭きます。次に、きれいなピンセットで保持しながら、純粋なエタノールで直接洗ってもう一度すすぎます。穏やかな窒素の流れの下で乾かします。必要に応じて、この操作を繰り返して、ガラス表面の目に見える残留物をすべて取り除きます。
- シリカビーズストックを取り、それを渦巻き、~30秒間短時間超音波処理します。
- 2番目のカバーガラス(24 x 60 mm)を洗浄した後、それを使用してカバーガラスの片面に2 μLのシリカビーズ溶液を塗りつけ、乾くのを待ちます。
- フローチャンバーの作成に使用する顕微鏡スライド(26 x 76 mm)を注意深く清掃します。
- 図3に示すように、二重粘着テープ(~3mm、厚さ60-100μm)を2本切り取り、顕微鏡スライドの片面に貼り付けます。
- きれいなピンセットを使用して、 図3aに示すように、ニトロセルロース+ビーズ層をチャンバーの内側に向けて、コーティングされたカバーガラス(1.3.9)を粘着テープラインに接触させてチャンバーを閉じます(最終容量約20μL)。フローチャンバーに50 mMリン酸バッファーを満たし、シリコングリースで密封します。
- >1.4メガピクセルの電荷結合素子(CCD)または相補型金属酸化膜半導体(CMOS)カメラを使用して、>200倍の倍率で明視野顕微鏡で単一のシリカビーズを画像化します。フィードバックソフトウェアを使用してピエゾステージを(ナノメートル以上の精度で)動かし、熱ドリフトを補正します10。
- 左側のトラップの中心をビードの中心と重ね合わせます(QPDからのx-y信号レベルはキャリブレーションからのx-y信号レベルと一致する必要があります)。次に、このトラップの位置ノイズと位置信号の標準偏差を測定します。
- 右のトラップ15 に対して前の手順を繰り返します。
- トラップ位置キャリブレーション:MHzからnm
- カバーガラス表面にシリカビーズ(1.3.5-1.3.12)と浮遊ポリスチレンビーズ(次のセクション2.1のように調製したα-アクチニン結合ビーズを使用)を備えたフローチャンバーを準備します。
- 視野(FOV)の中心からわずかに偏角した(~5μm)カバーガラス表面にシリカビーズを集束させ、FOVの画像を取得します。ピエゾステージを使用してビーズをFOV中心に向かって10μm移動し、2番目の画像を取得します。重心アルゴリズムなどを使用して2つの画像のビーズの中心を計算し、2つのビーズ間の距離をピクセル単位で計算して、明視野カメラのnm /ピクセルキャリブレーションを取得します。
- 1 つの浮遊パーティクルを 1 つのトラップにトラップします。次に、AODを使用してトラップを小さなステップ(0.2MHz)で移動させ、粒子の画像と各ステップのAODの対応する周波数を取得します。前と同じように重心アルゴリズムを使用してFOV内の粒子の位置を計算し、前の手順で取得したnm/ピクセルキャリブレーションを使用してnmに変換します。
- 周波数位置データに線形フィットを実行し、校正定数をnm/MHzで計算します。
- 2番目のトラップのキャリブレーションを繰り返します
- トラップパワーと剛性のキャリブレーション(MHz対W)、QPD(MHz対pN/nm)
- カバーガラス表面にシリカビーズ(1.3.5-1.3.12)を取り付けたフローチャンバーと浮遊ポリスチレンビーズ(次のセクション2.1のように調製したα-アクチニン結合ビーズを使用)を準備し、1つのトラップに単一粒子をトラップします。次に、両方のトラップをAODを介して小さなステップ(0.2 MHz)で変位させ、QPDとAODの対応する周波数を使用して、両方のトラップ内の粒子のブラウン運動を記録します。
- 各位置の検出器の平均パワーを計算し、記録されたブラウン運動のパワースペクトルにローレンツ関数を当てはめることにより、トラップ剛性とQPDキャリブレーション定数ベータを取得します13。
2. サンプル調製
- α-アクチニン結合蛍光ビーズの調製
- コンジュゲーション16の実行:アミノ官能化ポリスチレンビーズ(直径1 μm、固形分2.5%)を取り、500 μLの蒸留水で2回洗浄し、500 μLのPBS(pH 7.0)に再懸濁します。1 mM HaloTagスクシンイミジルエステルO2 リガンドを添加し、室温で1時間インキュベートします。500 μLのPBSで3回洗浄し、100-200 μMのHaloTag α-アクチニンで再懸濁します。37°Cで1時間インキュベートし、500 μLのPBSで3回洗浄します(1.5週間以内にビーズを使用するか、液体窒素で瞬間凍結して-80°Cで保存します)。
- 標識:200 μLのビーズ溶液をローダミン-BSAとともに最終濃度5 μg/mLで10分間インキュベートします。50 mM PBで3回洗浄し、500 μLのPB 50 mMに再懸濁します。これは、-80°Cで数ヶ月間アリコートで保存できます)。
- 先に述べたようにビオチン化ミオシン-5Bを発現および精製する4,17。
- F-アクチン13を重合して標識する:
- F-アクチン重合:69 μLの超純水、10 μLのアクチン重合バッファー10x(100 mM Tris HCl、20 mM MgCl2、500 mM KCl、10 mM ATP、50 mM 炭酸グアニジンpH 7.5)、20 μLのG-アクチン10 mg/mL、および1 μLのDL-ジチオスレイトール(DTT)1 Mを混合します。
- ローダミンによるF-アクチン標識(例/Em:546/575 nm):25 μLの重合F-アクチンを取り、19.5 μLの超純水、2.5 μLのアクチン重合バッファー10x(100 mM Tris HCl、20 mM MgCl 2、500 mM KCl、10 mM ATP、50 mM 炭酸グアニジンpH 7.5)、1 μLの1 M DTT、および2 μLの250 μLローダミンファロイジンを加えます。氷の上に置いて一晩放置します。トラップ実験のために、ローダミンF-アクチンは氷上に保存し、1週間以内に使用することができます。
- サンプル組立
- フローチャンバー(1.3.5-1.3.12)を取り、1 mg/mLのビオチン化BSAを5分間インキュベートします。ABバッファー(25 mM MOPS、25 mM KCl、4 mM MgCl 2、1 mM EGTA、1 mM DTT、pH7.2)で洗浄した後、1 mg/mLストレプトアビジンを5分間インキュベートし、ABバッファーで再度洗浄します。ビオチン化ミオシン-5B重メロミオシンをM5Bバッファー(10 mM MOPS pH 7.3、0.5 M NaCl、0.1 mM EGTA、3 mM NaN 3)中で3 nM濃度で2 μMカルモジュリン(CaM)とともに5分間インキュベートします。AB溶液に2 μM CaMを添加した1 mg/mLのビオチン化BSAを3回投与して洗浄し、3分間インキュベートします。
- インキュベート中に、反応ミックス(RM):0.005%α-アクチニン官能化ビーズ(セクション2.1)、1 nMローダミンF-アクチン(セクション2.3)をイメージングバッファー(IB:実験に必要な濃度で1.2 μMグルコースオキシダーゼ、0.2 μMカタラーゼ、17 mMグルコース、20 mM DTT、2 μM CaMおよびATPを含むABバッファー)で調製します。
- RMで洗浄し、シリコングリースでチャンバーを密封します。これで、サンプルを顕微鏡で観察する準備が整いました。
3. 測定
- ダンベルを組み立てます。
- 長距離トランスレータを使用してサンプルを移動して浮遊αアクチニンビーズを探し、1つのトラップをオンにして1つのビーズをトラップします。
- 最初のトラップが占有されたら、トランスレータを動かしてトラップされたビードをカバーガラス表面の近くに配置して複数のビーズをトラップしないようにし、別のビードを2番目のトラップにトラップします。
- AOD音波のパワーを調整して、2つのトラップを同じ剛性に調整します。剛性は通常0.03〜0.14 pN/nmの間で設定されます。剛性が小さいほど、特に低力での力のノイズは小さくなります。
- 次に、電動ミラーM(図2)を反転させて蛍光顕微鏡に切り替え、長距離トランスレータ13を通してサンプルを移動させて溶液中に浮遊するアクチンフィラメントを探します。長いフィラメント(>5μm)を好むのは、処理ミオシンがそれを変位させ、剥離する前に数ミクロンの間動かすからです。
- サンプルを移動して、トラップされたビーズの1つが互いに付着するまでフィラメントの一方の端に近づきます。次に、ビーズ距離をおおよそのフィラメント長に調整し、ステージをその方向に動かして、結合されていない第2のビーズの方向に流れを作ります。フィラメントは流れによって引き伸ばされ、最終的にはそれに結合します13。ビーズ - アクチン - ビーズ複合体は「ダンベル」と呼ばれます。
- アクチン - ミオシン接触を確立する。
- 2つのトラップをゆっくりと離してフィラメントを約3pNまでプリテンションし、2つのAODのうちの1つの周波数を変更して1つのトラップを三角波で振動させ、その結果、位置信号を介して後続ビードにモーションが伝達されることを確認することで、ダンベルの剛性を調べます。
- ステージを移動してダンベルを台座シリカビーズの近くに置き、トラップされたビーズの中心の高さをシリカビーズの直径よりわずかに低く調整することにより、フィラメントとビーズ表面に付着したタンパク質との接触を許可します。次に、トラップされたビーズの間にシリカビーズの中心を配置します。
- フォースクランプとnm安定化フィードバック:
- 2〜3 pNの力と200 nmの振動で超高速フォースクランプのスイッチを入れ、アクチンフィラメントに垂直な方向に約20〜30 nmの離散ステップでペデスタルビーズをスキャンします。各位置で相互作用が発生するのを待ち(数秒)、相互作用が観察されない場合は先に進んでください。タンパク質とフィラメントの相互作用が確立されたら、相互作用がより頻繁に発生する位置を探します。
- プロセッシブミオシンがアクチンフィラメントの一端(通常は+末端)に向かって移動すると、+末端に付着したトラップビーズがシリカビーズに向かって移動することを確認します。ミオシンが結合していないときにシリカビーズがフィラメントの端に付着したトラップされたビーズにできるだけ近くなるようにステージをフィラメントの端に向かって移動し、ナノメートル安定化フィードバックを開始します。そうすることで、フィラメントの+端に取り付けられたトラップされたビーズがシリカビーズに衝突する可能性が最小限に抑えられます。
- データを記録します。
4. データ分析4
注:説明されている分析方法では、ミオシンステッピングによって引き起こされるダンベル速度の変化に基づいて、プロセス実行と高速ステッピングイベントを検出および測定できます。加工工程の分析は、参考文献3、4、13に記載の非加工モータのデータ解析方法に基づいて行われる。
- 速度変化のしきい値を設定して、ステッピング イベントの検出を可能にします。この場合、順方向と逆方向の両方のステップが予想されるため、しきい値の交差は両方向で受け入れられます。
- 各ステップを対応する実行に割り当てる:2つの連続するステップ間の時間間隔が3ミリ秒より短く、ステップの振幅が90nm<場合、ステップは同じ実行に割り当てられ、それ以外の場合はステップが異なる実行に割り当てられます4。
- 補助部隊の正しいランレングス4.
- 次の式(Dは振動範囲)から測定された平均ランレングス値<RLm>から実際のランレングス値RLを計算することにより、補助力の下でのランレングスを修正します。

注:この方程式の導出に関する詳細は、参考文献4に記載されています。
- 次の式(Dは振動範囲)から測定された平均ランレングス値<RLm>から実際のランレングス値RLを計算することにより、補助力の下でのランレングスを修正します。
結果
代表的なデータは、図 4 に示すように、時間の経過に伴う位置レコードで構成されます。位置レコードには、2種類の変位が表示されます。まず、ミオシンモーターがアクチンフィラメントと相互作用していないとき、トラップされたビーズは溶液の粘性抗力に対して等速で移動しており、三角波3でオペレーターが設定した振動範囲内で振動する線形変位を示しています(時間スケールが長いため、図4では見えません)。第二に、ミオシンモーターがフィラメントと相互作用すると、移動するフィラメントによって運ばれる力が非常に急速にタンパク質に伝達され、システム速度はゼロに低下し(図4の赤い線)、ステッピングイベントは実行の終わりまで一定の力の下で発生します。図5に示すように、フィードバックシステムによって力が正の方向から負の方向(またはその逆に)切り替えられ、ビードがユーザーが設定した発振範囲の端に達すると力の方向が切り替わります。場合によっては、ミオシンがフィラメントを正の方向に結合して変位させると、ビーズが振動範囲の(上)端に向かって押し出されることがあります。これが補助力の下で起こる場合(すなわち、図5の正の変位、プッシュに向けられた場合)、ミオシンのランは振動エッジでの力方向反転によって中断され(図5の矢印)、ランの長さはダンベル振動Dの振幅に制限されます。 これには、補助力の場合のランレングスの修正が必要です(4.3.1)。

図1:プロセシブミオシン-5Bモーターに適用されたUFFCSの概略図。 (a)単一のミオシン-5B分子がストレプトアビジン-ビオチンリンクを介してガラスビーズ台座に結合している。単一のアクチンフィラメントは、αアクチニンコーティングされたビーズ(いわゆる「スリービーズ」形状)の間に吊り下げることによってトラップされます。黒矢印は右(F1)と左ビード(F2)に挟持された力を表し、赤矢印はダンベルに挟持された力(F)を表す。Fは、ミオシンがアクチンに結合していない場合、ダンベルを限られた振動範囲内に維持するために前後に交互に行われます。(b)ダンベル振動、ミオシン-5B付着、および補助(プッシュ)および抵抗(プル)荷重下での処理実行の対応する段階での変位と力を示すトレースの例。この図は4 から変更されました。200kHzのサンプルレートで集録された生データがプロットされます。力の標準偏差は約0.27 pNです。この図の拡大版を表示するには、ここをクリックしてください。
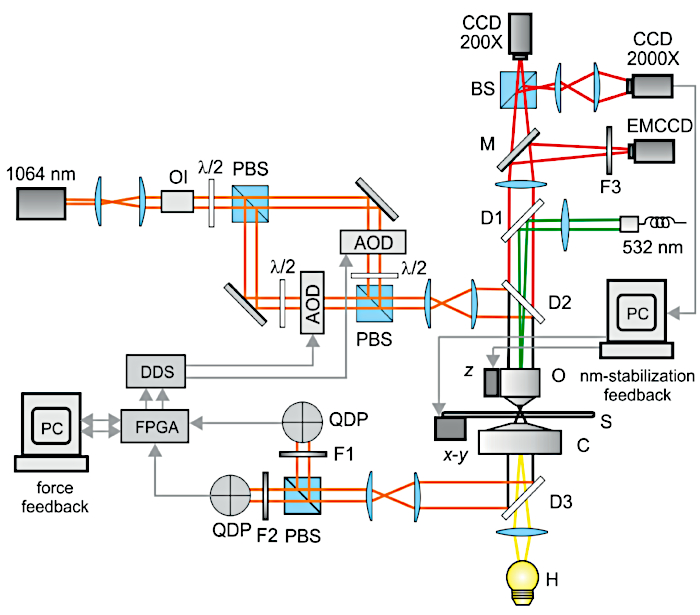
図2:実験セットアップの光学スキーム。 光学顕微鏡は、ハロゲンランプ(H)、コンデンサー(C)、サンプル(S)、ピエゾトランスレータ(x-yおよびz)、対物レンズ(O)、低倍率カメラ(CCD 200X)、およびnm安定化フィードバックに使用される高倍率カメラ(CCD 2000X)で構成されています。二重光ピンセットは、ダイクロイックミラー(D2およびD3)を介して顕微鏡の光軸から挿入および抽出され、Nd:YAGレーザー(1064 nm)、光アイソレーター(OI)、λ/2波長板、偏光ビームスプリッターキューブ(PBS)、音響光学偏向器(AOD)、1064 nm干渉フィルター(F1およびF2)、象限検出器フォトダイオード(QDP)。QDPからの信号はFPGAで精緻化され、AOD(フォースフィードバック)を駆動する2つのカスタムビルドのダイレクトデジタルシンセサイザ(DDS)に送信されました。蛍光励起は、複製されたNd:YAGレーザー(532 nm)と電子増倍カメラ(EMCCD)に投影された画像によって提供されました。Mは可動ミラー、F3は発光フィルターである。この数値は 3 から変更されました。 この図の拡大版を表示するには、ここをクリックしてください。
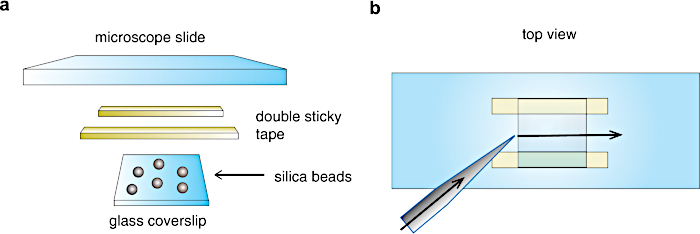
図3:フローチャンバーアセンブリ 。 (a)チャンバーの準備。シリカビーズを塗ったガラスカバーガラスを、二重粘着テープストライプを通して顕微鏡スライド上に取り付け、約20μL容量のフローセルを形成します。 b) フローセルの上面図。溶液はチャンバーの片側からピペットで飛ばされ、反対側からろ紙を通して吸引され、矢印方向に沿った流れを作り出します。 この図の拡大版を表示するには、ここをクリックしてください。
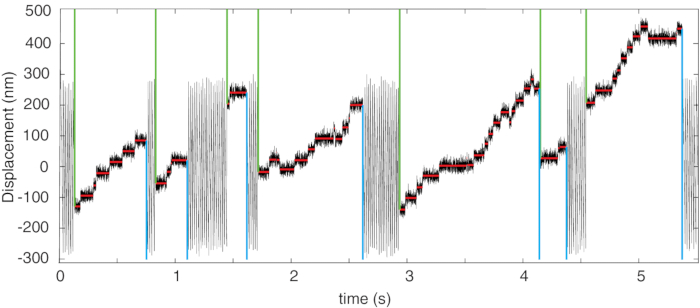
図4:代表位置の記録。 ミオシン-5Bプロセッシングランおよびステップアンドラン検出アルゴリズムを示す位置記録。検出された各実行の開始と終了は、それぞれ緑とシアンの縦線で示されます。赤い水平線は、検出されたステップを示します。この図は4 から変更されました。 この図の拡大版を表示するには、ここをクリックしてください。

図5:ミオシン実行中の強制反転。 ミオシンが結合し、補助力(プッシュ)でフィラメントを正の方向に動かすと、力が逆転する振動範囲の端に到達し(矢印で示す)、補助力下でのミオシンの実行が中断される可能性があります。逆に、抵抗力(引っ張り)の下では、ミオシン処理ステッピングはダンベルが力反転点に到達するのを防ぎます。したがって、後者の場合、ランレングスは抵抗力の振動範囲によって制限されません。この図は4 から変更されました。200kHzのサンプルレートで集録された生データがプロットされます。力の標準偏差は約0.27 pNです。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
3ビーズアッセイなどの単一分子技術は技術的に困難でスループットが低いですが、UFFCSはデータの高いS/N比により分子相互作用の検出を改善します。UFFCSは、モータータンパク質の負荷依存性の研究を可能にし、モーターがフィラメントに結合する際に非常に迅速に力を加えるという主な利点により、制御された力の下での力の生成および弱い結合状態における早期かつ非常に迅速な事象をプローブする。走行中ずっと力を一定に保ち、力の方向性を完全に制御してモーターの依存性を調査します。最後の点に関しては、ここで使用する3ビード形状は、フィラメント方向に沿って力を適用および測定するのに非常に効率的であり、横方向または垂直方向のコンポーネントからの寄与を最小限に抑えます。しかしながら、モータータンパク質が積極的に横方向または垂直方向の力、あるいはトルクさえも生成すると予想される場合、単一ビーズ形状などの他の構成がより適切である2、7、18。さらに、その空間的および時間的分解能のおかげで、UFFCSは、従来の単一分子技術では妨げられる分子相互作用の基本を理解するためのユニークなツールを表しています。実際、UFFCSは、補助力と抵抗力がミオシン-5Bの機械的応答をどのように調節するかを調べることを可能にし、細胞4のアクチンメッシュ内でのその集合的な挙動に関する新しい洞察を与えました。
ただし、これらの実験の成功は、このプロトコルにあるすべての指示に従うことによって非常に注意深く対処しなければならないいくつかの重要な要件を満たすことに依存しています:光学セットアップの正確な位置合わせと分離は、最適な空間分解能に到達するための基本です。加えられた力の値を高精度で決定するには、光学系の慎重な較正が必要です。高速フィードバックシステムの設定は、高い時間分解能に到達するために必要です。最後に、サンプルチャンバー内で組み立てられるすべてのコンポーネントは、サンプルチャンバー内の不純物が実験を損なう可能性があるため、制御された環境で準備し、可能な限り無菌状態に保ち、最適な保管と取り扱いに関するすべての指示を厳密に尊重する必要があります実験プロトコルの成功のために。重要なのは、結果を適切に解釈し、アーチファクトを回避するために、データ分析をさまざまな種類のモーターとフィラメントの相互作用に注意深く適合させることです。
このプロトコルには、実験装置のセットアップからサンプル調製、測定、データ分析まで、プロセスミオシン-5モーターで超高速フォースクランプ実験を実行するためのすべてのステップが含まれており、さまざまな非従来型ミオシンやキネシンやダイニンなどの他のクラスのプロセスモーターの研究に便利に適合できます。
開示事項
著者は競合する利益を宣言しません。
謝辞
この研究は、Laserlab-Europeの助成金契約番号871124に基づく欧州連合のHorizon 2020研究およびイノベーションプログラム、イタリア大学研究省(FIRB「Futuro in Ricerca」2013グラント番号RBFR13V4M2)、およびエンテカッサディリスパルミオディフィレンツェによってサポートされました。A.V. Kashchukは、ヒューマンフロンティアサイエンスプログラムの学際的フェローシップLT008 / 2020-Cの支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Aliphatic Amine Latex Beads | ThermoFisher | A37362 | 1.0-μm diameter, 2% (w/v) |
| Acetone | Sigma | 32201 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | 10X |
| AODs (acousto-optic deflectors) | AA Opto Electronic | DTS-XY 250 | Laser beam deflectors |
| ATP | Sigma | A7699 | |
| Biotinylated-BSA | ThermoFisher | 29130 | |
| BSA | Sigma | B4287 | |
| Calmodulin from porcine brain (CaM) | Merck Millipore | 208783 | |
| Catalase from bovine liver | Sigma | C40 | |
| Condenser | Olympus | OlympusU-AAC, Aplanat, Achromat | NA 1.4, oil immersion |
| Creatine phosphate disodium salt tetrahydrate | Sigma | 27920 | |
| Creatine Phosphokinase from rabbit muscle | Sigma | C3755 | |
| DDs | AA Opto Electronic | AA.DDS.XX | Two-channel digital synthesizer |
| DL-Dithiothreitol (DTT)/td> | Sigma | 43819 | |
| EGTA | Sigma | E4378 | |
| G-actin protein | Cytoskeleton | AKL99 | |
| Glucose | Sigma | G7528 | |
| Glucose Oxidase from Aspergillus niger | Sigma | G7141 | |
| HaloTag succinimidyl ester O2 ligand | Promega | P1691 | |
| High vacuum silicone grease heavy | Merck Millipore | 107921 | |
| KCl | Sigma | P9541 | |
| KH2PO4/K2HPO4 | Sigma | P5379/ P8281 | |
| Labview | National Instruments | version 8.1 | Data acquisition |
| Labview FPGA module | National Instruments | version 8.1 | Fast Force-Clamp |
| Matlab | MathWorks | 2016 | Data analysis |
| MgCl2 | Fluka | 63020 | |
| Microscope Objective | Nikon | Plan-Apo 60X | NA 1.2, WD 0.2 mm, water imm. |
| MOPS | Sigma | M1254 | |
| Nitrocellulose | Sigma | N8267 | 0.45 pore size |
| Pentyl acetate solution | Sigma | 46022 | |
| Pure Ethanol | Sigma | 2860 | |
| QPDs | UDT | DLS-20 | D Position Detecto |
| Rhodamine BSA | Molecular Probes | A23016 | |
| Rhodamine Phalloidin | Sigma | P1951 | |
| Silica beads | Bangslabs | SS04N | 1.21 mm, 10% solids |
| Sodium azide | Sigma | S2002 | |
| Streptavidin protein | Sigma | 189730 |
参考文献
- Ashkin, A., Dziedzic, J. M., Bjorkholm, J. E., Chu, S. Observation of a single-beam gradient force optical trap for dielectric particles. Optical Angular Momentum. 11 (5), 196-198 (2016).
- Capitanio, M., Pavone, F. S. Interrogating biology with force: Single molecule high-resolution measurements with optical tweezers. Biophysical Journal. 105 (6), 1293-1303 (2013).
- Capitanio, M., et al. Ultrafast force-clamp spectroscopy of single molecules reveals load dependence of myosin working stroke. Nature Methods. 9 (10), 1013-1019 (2012).
- Gardini, L., et al. Dissecting myosin-5B mechanosensitivity and calcium regulation at the single molecule level. Nature Communications. 9 (1), (2018).
- Woody, M. S., Winkelmann, D. A., Capitanio, M., Ostap, E. M., Goldman, Y. E. Single molecule mechanics resolves the earliest events in force generation by cardiac myosin. eLife. 8, 49266(2019).
- Clemen, A. E. -M., Vilfan, M., Jaud, J., Zhang, J., Bä, M., Rief, M. Force-dependent stepping kinetics of myosin-V. Biophysical Journal. 88, 4402-4410 (2005).
- Howard, J., Hancock, W. O. Three beads are better than one. Biophysical Journal. 118 (1), 1-3 (2020).
- Pyrpassopoulos, S., Shuman, H., Ostap, E. M. Modulation of kinesin's load-bearing capacity by force geometry and the microtubule track. Biophysical Journal. 118 (1), 243-253 (2020).
- Capitanio, M., Maggi, D., Vanzi, F., Pavone, F. S. FIONA in the trap: The advantages of combining optical tweezers and fluorescence. Journal of Optics A: Pure and Applied Optics. 9 (8), 157(2007).
- Capitanio, M., Cicchi, R., Pavone, F. S. Position control and optical manipulation for nanotechnology applications. European Physical Journal B. 46 (1), 1-8 (2005).
- Capitanio, M. Optical Tweezers. An introduction to Single Molecule Biophysics. , CRC Press. (2017).
- Capitanio, M., Cicchi, R., Saverio Pavone, F. Continuous and time-shared multiple optical tweezers for the study of single motor proteins. Optics and Lasers in Engineering. 45 (4), 450-457 (2007).
- Gardini, L., Tempestini, A., Pavone, F. S., Capitanio, M. High-speed optical tweezers for the study of single molecular motors. Methods in Molecular Biology. 1805, (2018).
- Capitanio, M., et al. Calibration of optical tweezers with differential interference contrast signals. Review of Scientific Instruments. 73 (4), 1687(2002).
- Monico, C., Belcastro, G., Vanzi, F., Pavone, F. S., Capitanio, M. Combining single-molecule manipulation and imaging for the study of protein-DNA interactions. Journal of Visualized Experiments. (90), e51446(2014).
- Greenberg, M. J., Lin, T., Goldman, Y. E., Shuman, H., Ostap, E. M. Myosin IC generates power over a range of loads via a new tension-sensing mechanism. Proceedings of the National Academy of Sciences of the United States of America. 109 (37), 2433-2440 (2012).
- Gardini, L., Arbore, C., Capitanio, M., Pavone, F. S. A protocol for single molecule imaging and tracking of processive myosin motors. MethodsX. 6, 1854-1862 (2019).
- Ramaiya, A., Roy, B., Bugiel, M., Schäffer, E. Kinesin rotates unidirectionally and generates torque while walking on microtubules. Proceedings of the National Academy of Sciences of the United States of America. 114 (41), 10894-10899 (2017).
Erratum
Formal Correction: Erratum: Dissecting Mechanoenzymatic Properties of Processive Myosins with Ultra Force-Clamp Spectroscopy
Posted by JoVE Editors on 8/25/2021. Citeable Link.
An erratum was issued for: Dissecting Mechanoenzymatic Properties of Processive Myosins with Ultra Force-Clamp Spectroscopy. The title was updated.
The title was updated from:
Dissecting Mechanoenzymatic Properties of Processive Myosins with Ultra Force-Clamp Spectroscopy
to:
Dissecting Mechanoenzymatic Properties of Processive Myosins with Ultrafast Force-Clamp Spectroscopy
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved