Method Article
Dissezione delle proprietà meccanoenzimatiche delle miosine processive con spettroscopia ultraveloce a force-clamp
In questo articolo
Erratum Notice
Riepilogo
Presentato qui è un protocollo completo per eseguire esperimenti di force-clamp ultraveloci su motori processivi miosina-5, che potrebbe essere facilmente esteso allo studio di altre classi di motori processivi. Il protocollo descrive in dettaglio tutte le fasi necessarie, dalla messa a punto dell'apparato sperimentale alla preparazione del campione, all'acquisizione dei dati e all'analisi.
Abstract
La spettroscopia force-clamp ultraveloce (UFFCS) è una tecnica a singola molecola basata su pinzette laser che consente lo studio della chemiomeccanica delle miosine convenzionali e non convenzionali sotto carico con una risoluzione temporale senza precedenti. In particolare, la possibilità di sondare motori di miosina sotto forza costante subito dopo la formazione del legame actina-miosina, insieme all'alto tasso di feedback di forza (200 kHz), ha dimostrato che l'UFFCS è un valido strumento per studiare la dipendenza dal carico di dinamiche veloci come la corsa di lavoro della miosina. Inoltre, UFFCS consente lo studio di come le interazioni miosina-actina processive e non processive sono influenzate dall'intensità e dalla direzione della forza applicata.
Seguendo questo protocollo, sarà possibile eseguire esperimenti di force-clamp ultraveloci su motori processivi di miosina-5 e su una varietà di miosine non convenzionali. Con alcuni aggiustamenti, il protocollo potrebbe anche essere facilmente esteso allo studio di altre classi di motori processivi come chinesine e dineine. Il protocollo comprende tutte le fasi necessarie, dalla messa a punto dell'apparato sperimentale alla preparazione del campione, alle procedure di taratura, all'acquisizione e all'analisi dei dati.
Introduzione
Negli ultimi decenni le pinzette ottiche sono state un valido strumento per chiarire la meccanochimica delle interazioni proteiche a livello di singola molecola, grazie alla sorprendente possibilità di manipolazione e misurazione simultanea dei cambiamenti conformazionali e della cinetica enzimatica 1,2. In particolare, la capacità di applicare e misurare forze nell'intervallo di quelle esercitate dai motori molecolari nella cellula, insieme alla capacità di misurare i cambiamenti conformazionali sub-nanometrici, ha reso le pinzette ottiche uno strumento unico a singola molecola per svelare le proprietà chemiomeccaniche delle proteine motorie e la loro regolazione meccanica.
La spettroscopia force-clamp ultraveloce (UFFCS) è una tecnica di spettroscopia di forza a singola molecola basata su pinzette ottiche, sviluppata per studiare la cinetica veloce dei motori molecolari sotto carico in una geometria a tre sfere (Figura 1a)3,4. UFFCS riduce il ritardo temporale per l'applicazione della forza alla proteina motoria al limite fisico delle pinzette ottiche, cioè il tempo di rilassamento meccanico del sistema, consentendo così l'applicazione della forza rapidamente dopo l'inizio di una corsa di miosina (poche decine di microsecondi)3. Questa capacità è stata sfruttata per studiare i primi eventi meccanici nella miosina muscolare scheletrica 3 veloce e nella miosina muscolare cardiaca5 per rivelare la dipendenza dal carico del powerstroke, gli stati di legame debole e forte, nonché l'ordine degli eventi biochimici (Pi) e meccanici (powerstroke).
La geometria a tre sfere viene solitamente impiegata per studiare motori non processivi, una geometria a singola perla con un morsetto di forza è stata comunemente usata per studiare miosine non convenzionali processive come la miosina Va6. Tuttavia, ci sono diversi motivi per preferire un test UFFCS a tre sfere anche per le miosine processive. In primo luogo, la rapida applicazione del carico subito dopo il legame actina-miosina consente la misurazione degli eventi precoci nello sviluppo della forza come nei motori non processivi. Inoltre, nel caso dei motori processivi, consente anche una misurazione accurata delle lunghezze di corsa e della durata di corsa del motore sotto forza costante durante tutta la loro progressione (Figura 1b). Inoltre, a causa dell'elevata velocità di feedback della forza, il sistema può mantenere costante la forza durante rapidi cambi di posizione, come la corsa di lavoro della miosina, garantendo così un carico costante durante il passo del motore. L'elevata risoluzione temporale del sistema consente la rilevazione di interazioni sub-ms, aprendo la possibilità di indagare il legame debole della miosina all'actina. Infine, la geometria del saggio garantisce che la forza venga applicata lungo il filamento di actina, con componenti trasversali e verticali trascurabili della forza. Questo punto è di particolare rilevanza in quanto è stato dimostrato che la componente di forza verticale influenza significativamente la dipendenza dal carico della cinetica del motore 7,8. Utilizzando questa tecnica, potremmo applicare una gamma di carichi assistivi e resistivi alla miosina-5B processiva e misurare direttamente la dipendenza dal carico della sua processività per un'ampia gamma di forze4.
Come mostrato nella figura 1a, in questo sistema un singolo filamento di actina è sospeso tra due perle di polistirene intrappolate nel fuoco di una pinzetta ottica doppia (il "manubrio"). Una forza netta sbilanciata F = F1-F 2 viene imposta sul filamento, attraverso un sistema di feedback veloce, che fa muovere il filamento a velocità costante in una direzione fino a raggiungere un punto di inversione definito dall'utente in cui la forza netta viene invertita nella direzione opposta. Quando la proteina motrice non interagisce con il filamento, il manubrio è libero di muoversi avanti e indietro in una forma d'onda triangolare (Figura 1b, pannello inferiore) che attraversa il tallone del piedistallo su cui è attaccata una singola proteina motoria. Una volta stabilita l'interazione, la forza trasportata dal manubrio viene trasferita molto rapidamente alla proteina motoria e il motore inizia a spostare il filamento passando sotto l'intensità e la direzione della forza che è stata applicata dal sistema di feedback al momento dell'interazione, fino a quando la miosina si stacca dall'actina. Essendo lo spostamento prodotto dal passo del motore dipendente dalla polarità del filamento di actina intrappolato, a seconda della direzione della forza applicata il carico può essere assistivo, cioè spingendo nella stessa direzione dello spostamento del motore (spinta nel pannello superiore della figura 1b), o resistivo, cioè tirando nella direzione opposta rispetto allo spostamento del motore (trazione in figura 1b pannello superiore) che consente di studiare la regolazione chemiomeccanica della processività motoria sia per l'intensità che per la direzionalità del carico applicato.
Nelle sezioni successive vengono descritti in modo completo tutti i passaggi per misurare le interazioni actina-miosina-5B sotto diversi carichi con una configurazione spettroscopica force-clamp ultraveloce, tra cui 1) l'impostazione del setup ottico, l'allineamento delle trappole ottiche e le procedure di calibrazione, 2) la preparazione di tutti i componenti e il loro assemblaggio nella camera del campione, 3) la procedura di misura, 4) dati rappresentativi e analisi dei dati per estrarre importanti parametri fisici, come la lunghezza della corsa, la dimensione del passo e la velocità della proteina motoria.
Protocollo
1. Configurazione ottica
NOTA: La configurazione sperimentale è composta da pinzette ottiche doppie con stabilità di puntamento nanometrica e fluttuazioni < intensità laser dell'1%. In queste condizioni, la stabilità del manubrio a livello nanometrico è garantita in condizioni tipiche di rigidità della trappola (0,1 pN/nm) e tensione (1 pN - poche decine di pN). La Figura 2 mostra uno schema dettagliato della configurazione ottica.
- Progettazione e costruzione pinzette ottiche 9,10,11.
- Posizionare tutti i componenti della configurazione su un tavolo ottico secondo lo schema illustrato nella Figura 2. Si noti che il tavolo ottico include isolatori attivi per ridurre al minimo le vibrazioni meccaniche. Inoltre, la struttura del microscopio è montata su isolatori elastomerici per assorbire il rumore acustico e le risonanze meccaniche.
- Inserire un isolatore ottico vicino alla sorgente laser ("OI" nella Figura 2), per evitare fluttuazioni casuali di ampiezza dovute al feedback ottico.
- Sigillare l'intero percorso in una scatola chiusa per ridurre la corrente d'aria e le turbolenze che potrebbero influire sulla stabilità del puntamento laser.
- Creare le pinzette ottiche doppie dividendo la sorgente laser principale (laser Nd:YAG, lunghezza d'onda 1.064 nm in Figura 2) in due rami con polarizzazioni ortogonali mediante l'uso di beam splitter polarizzanti (PBS). Le trappole condivise nel tempo dovrebbero essere evitate perché inducono l'oscillazione del manubrio sotto tensione12.
- Utilizzare due deflettori acusto-ottici (AOD in Figura 2) pilotati da sintetizzatori digitali diretti (DDS) per consentire movimenti fini e rapidi delle due trappole e una regolazione precisa della tensione di actina pilotando direttamente i DDS attraverso le uscite digitali dalla scheda FPGA gate array programmabile sul campo (vedere Figura 2).
NOTA: Il tempo complessivo di risposta del feedback deve essere di <10 μs per correggere rapidamente e mantenere una forza costante su entrambe le trappole durante le misurazioni, incluso lo stato non legato, l'interazione della miosina e il movimento. A tal fine, i rilevatori di posizione devono avere una larghezza di banda >= 100 kHz e i dati devono essere acquisiti a >= 200 kHz frequenza di campionamento. Per ogni punto dati acquisito (tempo di acquisizione 5 μs), le correzioni proporzionali per le due trappole vengono calcolate dall'FPGA e inviate ai due DDS che guidano gli AOD. Il tempo di risposta AOD deve essere inferiore a 5 μs per soddisfare il tempo di risposta del feedback richiesto. - Per il rilevamento nm della posizione delle perle intrappolate, inserire due rilevatori di fotodiodi a quadrante (QPD nella Figura 2) nel piano focale posteriore del condensatore. L'allineamento accurato dei QPD in un piano coniugato al piano focale posteriore del condensatore, così come gli AOD in un piano coniugato al piano focale posteriore dell'obiettivo, assicurerà che i segnali QPD saranno indipendenti dalla frequenza degli AOD.
- Montare l'AOD su un traslatore lineare con azionamento micrometrico e spostarlo fino a quando il bordo del cristallo non si avvicina al raggio laser. Quindi, sostituisci l'obiettivo con un diaframma, centrato sull'alloggiamento filettato dell'obiettivo, e regola la sua apertura per adattarla alle dimensioni dell'apertura posteriore dell'obiettivo.
- Spostare il traslatore verso il raggio laser fino a quando la porzione del raggio bloccata dal cristallo piezoelettrico è visibile dopo l'iride, ruotare leggermente il traslatore all'indietro per ottenere che il raggio riempia completamente l'apertura del diaframma.
- Ripetere i passaggi 1.1.7-1.1.8 per il secondo AOD. Controllare il tempo di risposta del ciclo di feedback misurando il ritardo dai QPD mentre si sposta rapidamente un raggio su un tallone bloccato sulla superficie del coprivetrino13.
NOTA: I tre passaggi precedenti (1.1.7-1-1-9) portano all'attento allineamento dei cristalli AOD. Questi passaggi sono importanti per ottimizzare la risposta temporale sia della deflessione del fascio che del feedback13.
- Per mezzo di un fotodiodo misurare le fluttuazioni di intensità del laser trappola all'ingresso del microscopio che devono essere inferiori all'1%. Si noti che la larghezza di banda del fotodiodo deve essere maggiore della velocità di imaging.
- Verificate la stabilità di puntamento di entrambe le trappole.
- Preparare le sfere di silice in tampone fosfato (PB) diluendo 20 μL di sfere di silice (1,2 μm, 10% solidi) in 1 mL di acetone, sonicare per 30 s, vortice brevemente e centrifugare per 2 minuti a 19.000 x g.
- Rimuovere il surnatante, risospendere in 1 mL di acetone e ripetere il lavaggio. Risospendere in 1 mL da 50 mM PB, lavare 2 volte. Infine, risospendere in 100 μL di 50 mM PB.
- Eseguire la calibrazione delle pinzette ottiche con perline di silice incollando un vetrino su un vetrino da microscopio con un nastro biadesivo (circa 60 μm di spessore) per costruire una camera di flusso. Riempire la camera con una BSA (proteina dell'albumina sierica bovina) da 1 mg/ml e attendere 3 minuti.
- Far scorrere una diluizione 1:1000 di sfere di silice in PB nella camera. Utilizzare una siringa riempita di grasso di silicio per sigillare accuratamente la camera. Intrappolare una singola perla in ciascuna trappola e applicare il metodo dello spettro di potenza14 per calibrarle.
- Preparare le sfere di silice in acetato di pentile (a temperatura ambiente) sciogliendo 20 μL di sfere di silice (diametro 1,2 μm, 10% solido) in 1-1,5 ml di acetone, vortice e sonicare per 30 s.
- Centrifugare a 18.500 x g per 2 min. Eliminare il surnatante e risospendere in 1 mL di acetone, quindi ripetere il lavaggio. Risospendere in 1 mL di acetato di pentile e ripetere il lavaggio (centrifuga e risospensione) in acetato di pentile 2 volte. Risospendere il pellet in 100 μL di nitrocellulosa 1% e 900 μL di acetato di pentile. Conservare a 4 °C per 2 mesi.
- Prendi un coprislip di vetro 24 x 24 mm e puliscilo accuratamente con carta imbevuta di etanolo puro. Quindi, mentre lo si tiene con una pinzetta pulita, sciacquarlo una seconda volta lavandolo direttamente con etanolo puro. Lasciare asciugare sotto un leggero flusso di azoto. Se necessario, ripetere questa operazione per rimuovere tutti i residui visibili sulla superficie del vetro.
- Prendi il brodo di perline di silice, vorticelo e sonicalo brevemente per ~ 30 s.
- Dopo aver pulito un secondo coprivetrino (24 x 60 mm), utilizzarlo per spalmare 2 μL di soluzione di perline di silice su una superficie del vetrino e attendere che si asciughi.
- Pulire accuratamente un vetrino da microscopio (26 x 76 mm) che verrà utilizzato per creare la camera di flusso.
- Tagliare due linee di nastro adesivo doppio (~ 3 mm di larghezza, 60-100 μm di spessore) e attaccarle su un lato del vetrino del microscopio, come mostrato in Figura 3.
- Usando una pinzetta pulita, chiudere la camera (circa 20 μL di volume finale) mettendo il vetrino di copertura rivestito (1.3.9) a contatto con le linee del nastro adesivo, con lo strato di nitrocellulosa + perline rivolto verso l'interno della camera, come mostrato nella figura 3a. Riempire la camera di flusso con tampone fosfato da 50 mM e sigillarla con grasso al silicio.
- Immagini di una singola perla di silice in microscopia a campo chiaro con ingrandimento >200x utilizzando un dispositivo ad accoppiamento di carica (CCD) o una fotocamera CMOS (metallo-ossido-semiconduttore) complementare con >1,4 megapixel. Utilizzare un software di feedback per spostare lo stadio piezoelettrico (con precisione nanometrica o superiore) per compensare le derive termiche10.
- Sovrapporre il centro della trappola sinistra con il centro del tallone (i livelli del segnale x-y dal QPD devono corrispondere a quelli della calibrazione). Quindi misurare il rumore di posizione e la deviazione standard dei segnali di posizione per questa trappola.
- Ripetere il passaggio precedente per la trappola destra15.
- Calibrazione della posizione della trappola: da MHz a nm
- Preparare una camera di flusso con perle di silice attaccate sulla superficie del vetrino di copertura (1.3.5-1.3.12) e perle di polistirene galleggianti (utilizzare perle coniugate con α-actina preparate come nella seguente sezione 2.1).
- Focalizzare una perla di silice sulla superficie del coprislip leggermente decentrata (~5 μm) dal centro del campo visivo (FOV) e acquisire un'immagine del FOV. Spostare il tallone di 10 μm verso il centro FOV utilizzando lo stadio piezoelettrico e acquisire una seconda immagine. Calcolare il centro del tallone nelle due immagini utilizzando un algoritmo centroide o simile e calcolare la distanza in pixel tra le due perle per ottenere la calibrazione nm/pixel della fotocamera in campo chiaro.
- Intrappola una singola particella galleggiante in una trappola. Quindi, spostare la trappola usando AOD a piccoli passi (0,2 MHz) e acquisire un'immagine della particella e la frequenza corrispondente dell'AOD per ogni passo. Calcolare la posizione della particella nel FOV utilizzando l'algoritmo del centroide come prima e convertirla in nm utilizzando la calibrazione nm/pixel ottenuta nel passaggio precedente.
- Eseguire un adattamento lineare ai dati di posizione della frequenza e calcolare la costante di calibrazione in nm/MHz.
- Ripetere la calibrazione per la seconda trappola
- Calibrazione della potenza e della rigidità dell'intercettazione (MHz vs W), QPD (MHz vs pN/nm)
- Preparare una camera di flusso con perle di silice fissate sulla superficie del vetrino di copertura (1.3.5-1.3.12) e perle di polistirene galleggianti (utilizzare perle coniugate con α-actina preparate come nella seguente sezione 2.1) e intrappolare una singola particella in una trappola. Quindi spostare entrambe le trappole attraverso AOD a piccoli passi (0,2 MHz) e registrare un moto browniano della particella in entrambe le trappole con QPD e la frequenza corrispondente degli AOD.
- Calcolare una potenza media sui rivelatori in ogni posizione e ottenere la rigidità della trappola e la costante di calibrazione QPD beta adattando una funzione lorentziana ad uno spettro di potenza del moto browniano registrato13.
2. Preparazione del campione
- Preparare perle fluorescenti coniugate α-actina
- Eseguire la coniugazione16: prendere perle di polistirene amino-funzionalizzato (diametro 1 μm, 2,5% solidi), lavarle due volte in 500 μL di acqua distillata e risospese in 500 μL di PBS (pH 7,0). Aggiungere 1 mM HaloTag succinimidil estere O2 ligando e incubare a temperatura ambiente per 1 ora. Lavare tre volte con 500 μL di PBS e risospendere con 100-200 μM HaloTag α-actinina. Incubare per 1 ora a 37 °C e lavare tre volte in 500 μL di PBS (utilizzare perline entro 1,5 settimane o congelare in azoto liquido e conservare a -80 °C).
- Etichettatura: Incubare 200 μL di soluzione di perline con Rhodamine-BSA a 5 μg/mL di concentrazione finale per 10 min. Lavare con 50 mM PB tre volte e risospendere in 500 μL di PB 50 mM. Questo può essere conservato in aliquote a - 80 °C per mesi).
- Esprimere e purificare la miosina-5B biotinilata come descritto in precedenza 4,17.
- Polimerizzare ed etichettare F-actina13:
- Polimerizzazione F-actina: Miscelare 69 μL di acqua ultrapura, 10 μL di tampone di polimerizzazione di actina 10x (100 mM Tris HCl, 20 mM MgCl2, 500 mM KCl, 10 mM ATP, 50 mM di carbonato di guanidina pH 7,5), 20 μL di G-actina 10 mg/ml e 1 μL di DL -Ditiotreitolo (DTT) 1 M. Lasciare in ghiaccio per più di 1 ora.
- Marcatura F-actina con rodamina (Ex/Em: 546/575 nm): prendere 25 μL di F-actina polimerizzata e aggiungere 19,5 μL di acqua ultrapura, 2,5 μL di tampone di polimerizzazione dell'actina 10x (100 mM Tris HCl, 20 mM MgCl 2, 500 mM KCl, 10 mM ATP, 50 mM di carbonato di guanidina pH 7,5), 1 μL di 1 M DTT e2 μL di 250 μM di rodamina falloidina. Lascialo in ghiaccio durante la notte. Per gli esperimenti di intrappolamento la rodamina F-actina può essere conservata sul ghiaccio e utilizzata entro una settimana.
- Assemblaggio campione
- Prelevare la camera di flusso (1.3.5-1.3.12) e incubare 1 mg/mL di BSA biotinilato per 5 minuti. Dopo il lavaggio con tampone AB (25 mM MOPS, 25 mM KCl, 4mM MgCl 2, 1 mM EGTA, 1 mM DTT, pH7,2) incubare 1 mg/mL di streptavidina per 5 minuti e lavare nuovamente con tampone AB. Incubare meromiosina pesante di miosina-5B biotinilata a concentrazione di 3 nM in tampone M5B (10 mM MOPS pH 7,3, 0,5 M NaCl, 0,1 mM EGTA, 3 mM NaN3) con 2 μM di calmodulina (CaM) per 5 min. Lavare con tre volumi di 1 mg/mL di BSA biotinilato integrato con 2 μM di CaM in AB e incubare per 3 minuti.
- Durante l'incubazione preparare la miscela di reazione (RM): 0,005% α-actina perline funzionalizzate (sezione 2.1), 1 nM rodamina F-actina (sezione 2.3) in tampone di imaging (IB: tampone AB con 1,2 μM glucosio-ossidasi, 0,2 μM catalasi, 17 mM glucosio, 20 mM DTT, 2 μM CaM e ATP alla concentrazione necessaria per l'esperimento).
- Lavare con RM e sigillare la camera con grasso siliconico. Il campione è ora pronto per essere osservato al microscopio.
3. Misurazione
- Montare il manubrio.
- Cerca le perle galleggianti di α-actina spostando il campione usando traduttori a lungo raggio, accendi una trappola e intrappola una perla.
- Una volta occupata la prima trappola, spostare il traduttore per posizionare il tallone intrappolato vicino alla superficie del coprislip per evitare l'intrappolamento di più perline e intrappolare un altro tallone nella seconda trappola.
- Regolare le due trappole per uniformare le rigidità regolando la potenza delle onde acustiche degli AOD. Le rigidezze sono solitamente impostate tra 0,03 e 0,14 pN/nm. Minore è la rigidità, minore è il rumore di forza, in particolare a basse forze.
- Quindi capovolgere lo specchio motorizzato M (Figura 2) per passare alla microscopia a fluorescenza e cercare un filamento di actina che galleggia in soluzione spostando il campione attraverso traduttori a lungo raggio13. Preferisci filamenti lunghi (>5 μm) poiché la miosina processiva lo sposterà e lo sposterà per alcuni micron prima di staccarsi.
- Spostare il campione per lasciare che una delle perle intrappolate si avvicini a un'estremità del filamento fino a quando non si attaccano l'una all'altra. Quindi, regolate la distanza delle perline in base alla lunghezza approssimativa del filamento e create un flusso nella direzione della seconda perla non legata spostando lo stage nella sua direzione. Il filamento sarà allungato dal flusso e alla fine si legherà ad esso13. Il complesso perlina-actina-perlina è chiamato "manubrio".
- Stabilire il contatto actina-miosina.
- Separare delicatamente le due trappole distanti tra loro per pretensionare il filamento fino a circa 3 pN e sondare la rigidità del manubrio facendo oscillare una trappola in onda triangolare cambiando la frequenza di uno dei due AOD e verificando la conseguente trasmissione del moto al tallone di uscita attraverso il suo segnale di posizione.
- Spostare il palco per posizionare il manubrio in prossimità di una perla di silice a piedistallo e consentire il contatto tra il filamento e la proteina attaccata sulla superficie del tallone regolando l'altezza dei centri delle perline intrappolate leggermente al di sotto del diametro della perla di silice. Quindi posizionare il centro della perla di silice tra le perle intrappolate.
- Morsetto di forza e feedback di stabilizzazione nm:
- Accendere il force-clamp ultraveloce con forza 2-3 pN e oscillazione 200 nm e scansionare il tallone del piedistallo in passi discreti di circa 20-30 nm nella direzione perpendicolare al filamento di actina. Attendi che si verifichino interazioni in ogni posizione (pochi secondi), quindi fai un passo avanti se non si osserva alcuna interazione. Quando viene stabilita l'interazione proteina-filamento, cerca la posizione in cui le interazioni sono più frequenti.
- Assicurarsi che quando la miosina processiva si muove verso un'estremità del filamento di actina (di solito l'estremità +), la perla intrappolata attaccata all'estremità + si muove verso la perla di silice. Spostare lo stadio verso l'estremità del filamento in modo che la sfera di silice si trovi il più vicino possibile alla perla intrappolata attaccata all'estremità del filamento quando la miosina non è legata e avviare il feedback di stabilizzazione nanometrica. In tal modo, la probabilità che il tallone intrappolato attaccato all'estremità + del filamento si schianti nel tallone di silice è ridotta al minimo.
- Registrare i dati.
4. Analisi dei dati4
NOTA: Il metodo di analisi descritto consente il rilevamento e la misurazione di cicli processivi ed eventi di passo rapido in base alle variazioni della velocità del manubrio, causate dallo stepping della miosina. L'analisi dei cicli processivi viene eseguita sulla base di un metodo di analisi dei dati per motori non processivi descritto nei riferimenti 3,4,13.
- Impostare una soglia per le variazioni di velocità per consentire il rilevamento degli eventi di passaggio. Poiché in questo caso sono previsti sia passi avanti che indietro, il superamento della soglia è accettato in entrambe le direzioni.
- Assegnare ogni passo alla corsa corrispondente: se l'intervallo di tempo tra due passi successivi è inferiore a 3 ms e l'ampiezza dei passi è < 90 nm, i passi vengono assegnati alla stessa corsa, altrimenti i passi vengono assegnati a run diverse4.
- Lunghezza corretta della corsa per le forze di assistenza4.
- Correggere le lunghezze di corsa sotto le forze di assistenza calcolando il valore reale della lunghezza di corsa RL dal valore medio misurato della lunghezza di corsa <RLm> dalla seguente equazione, dove D è l'intervallo di oscillazione:

NOTA: I dettagli sulla derivazione di questa equazione sono disponibili nel riferimento4.
- Correggere le lunghezze di corsa sotto le forze di assistenza calcolando il valore reale della lunghezza di corsa RL dal valore medio misurato della lunghezza di corsa <RLm> dalla seguente equazione, dove D è l'intervallo di oscillazione:
Risultati
I dati rappresentativi consistono in record di posizione nel tempo, come mostrato nella Figura 4. Nel record di posizione sono visibili due tipi di spostamento. In primo luogo, quando il motore della miosina non interagisce con il filamento di actina, le sfere intrappolate si muovono a velocità costante contro la forza di trascinamento viscoso della soluzione mostrando uno spostamento lineare oscillante all'interno dell'intervallo di oscillazione impostato dall'operatore in un'onda triangolare3 (non visibile nella Figura 4 a causa della lunga scala temporale). In secondo luogo, una volta che il motore della miosina interagisce con il filamento, la forza trasportata dal filamento in movimento viene trasferita molto rapidamente alla proteina, la velocità del sistema scende a zero (linee rosse in Figura 4) e gli eventi di passo si verificano sotto forza costante fino alla fine della corsa. Come mostrato in Figura 5, la forza viene commutata dalla direzione positiva a quella negativa (e viceversa) dal sistema di feedback, che cambia la direzione della forza quando il tallone raggiunge il bordo dell'intervallo di oscillazione impostato dall'utente. In alcuni casi, può accadere che, quando la miosina si lega e sposta il filamento verso la direzione positiva, spinge il tallone verso il bordo (superiore) del range di oscillazione. Se ciò avviene sotto forza assistiva (cioè diretta verso lo spostamento positivo, la spinta, nella figura 5), la corsa della miosina sarà interrotta dall'inversione della direzione della forza sul bordo di oscillazione (frecce nella figura 5), limitando così la lunghezza della corsa all'ampiezza dell'oscillazione del manubrio D. Ciò richiede una correzione della lunghezza della corsa in caso di forza assistiva (4.3.1).

Figura 1: Schema dell'UFFCS applicato ad un motore processivo di miosina-5B. (a) Una singola molecola di miosina-5B è attaccata a un piedistallo di perle di vetro attraverso un legame streptavidina-biotina. Un singolo filamento di actina viene intrappolato sospendendolo tra le perle rivestite di α-actina (la cosiddetta geometria "a tre perle"). Le frecce nere rappresentano la forza bloccata sul tallone destro (F1) e sinistro (F2), la freccia rossa rappresenta la forza netta (F) sul manubrio. F è alternato avanti e indietro per mantenere il manubrio entro un intervallo di oscillazione limitato quando la miosina non è legata all'actina. (b) Traccia di esempio che mostra lo spostamento e la forza durante le fasi corrispondenti dell'oscillazione del manubrio, dell'attacco della miosina-5B e delle corse processive sotto carichi assistivi (push) e resistivi (pull). Questa cifra è stata modificata da4. Vengono tracciati i dati grezzi acquisiti a una frequenza di campionamento di 200 kHz. Lo sviluppo della forza è di circa 0,27 pN. Fare clic qui per visualizzare una versione ingrandita di questa figura.
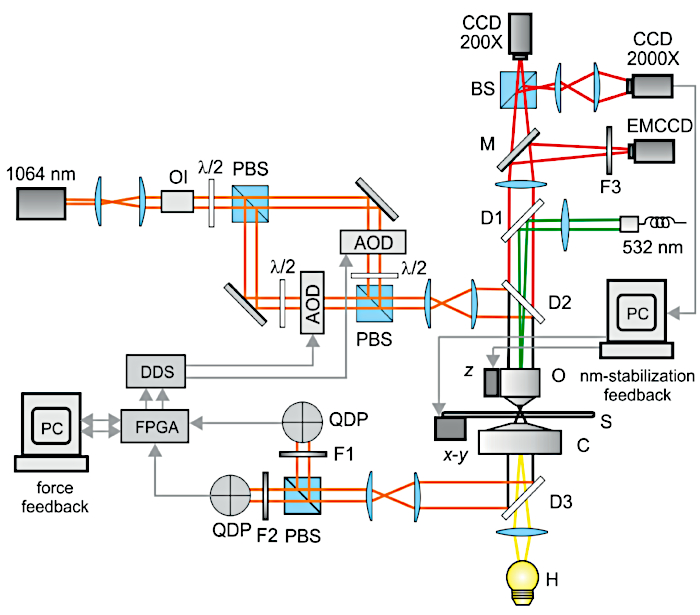
Figura 2: Schema ottico del setup sperimentale. Il microscopio ottico è costituito da: lampada alogena (H), condensatore (C), campione (S), trasduttori piezoelettrici (x-y e z), obiettivo (O), una telecamera a basso ingrandimento (CCD 200X) e una telecamera ad alto ingrandimento (CCD 2000X) utilizzate per il feedback di stabilizzazione nm. Le pinzette ottiche doppie vengono inserite ed estratte dall'asse ottico del microscopio attraverso specchi dicroici (D2 e D3) e comprendono: laser Nd:YAG (1064 nm), isolatore ottico (OI), placche d'onda λ/2, cubi polarizzanti beam splitter (PBS), deflettori acusto-ottici (AOD), filtri interferenziali 1064 nm (F1 e F2), fotodiodi rivelatori di quadrante (QDP). I segnali provenienti dai QDP sono stati elaborati con un FPGA, inviati a due sintetizzatori digitali diretti (DDS) personalizzati che guidano gli AOD (force feedback). L'eccitazione della fluorescenza è stata fornita da un laser Nd:YAG duplicato (532 nm) e l'immagine proiettata su una telecamera a moltiplicazione elettronica (EMCCD). M è uno specchio mobile, F3 un filtro di emissione. Questa cifra è stata modificata da 3. Fare clic qui per visualizzare una versione ingrandita di questa figura.
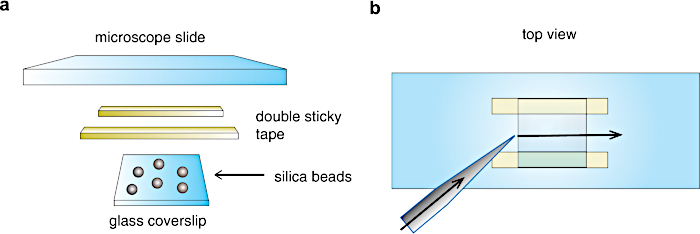
Figura 3: Assemblaggio della camera di flusso . (a) Preparazione della camera. Un vetrino di vetro, imbrattato di perle di silice, è attaccato su un vetrino da microscopio attraverso doppie strisce di nastro adesivo per formare una cella di flusso di circa 20 μL di volume. b) Vista dall'alto della cella di flusso. Le soluzioni vengono fatte volare da un lato della camera con una pipetta e aspirate dall'altro lato attraverso una carta da filtro per creare un flusso lungo la direzione della freccia. Fare clic qui per visualizzare una versione ingrandita di questa figura.
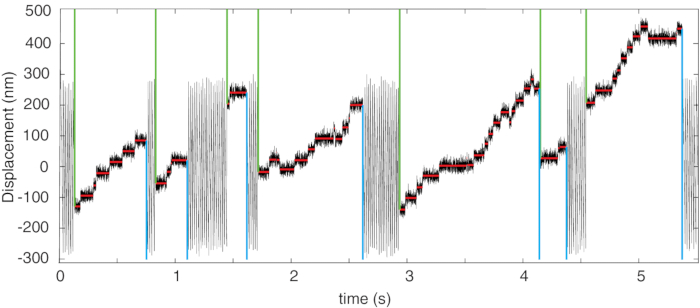
Figura 4: Registrazione della posizione rappresentativa. Registrazione della posizione che mostra le corse processive della miosina-5B e l'algoritmo di rilevamento step and run. L'inizio e la fine rilevati di ogni corsa sono indicati rispettivamente da linee verticali verdi e ciano. Le linee orizzontali rosse indicano i passaggi rilevati. Questa cifra è stata modificata da4. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: Inversione della forza durante le esecuzioni della miosina. Quando la miosina lega e muove il filamento in direzione positiva sotto forza assistiva (spinta), può accadere che raggiunga il bordo del range di oscillazione dove la forza è invertita (indicata dalle frecce), in modo che la corsa della miosina sotto forza assistiva venga interrotta. Al contrario, sotto forza resistiva (trazione), il passo processivo della miosina impedisce al manubrio di raggiungere il punto di inversione della forza. Pertanto, in quest'ultimo caso, le lunghezze di corsa non sono limitate dall'intervallo di oscillazione per le forze resistive. Questa cifra è stata modificata da4. Vengono tracciati i dati grezzi acquisiti a una frequenza di campionamento di 200 kHz. Lo sviluppo della forza è di circa 0,27 pN. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Sebbene le tecniche a singola molecola, come il saggio a tre perline, siano tecnicamente impegnative e a basso rendimento, UFFCS migliora il rilevamento delle interazioni molecolari grazie all'elevato rapporto segnale-rumore dei dati. UFFCS permette lo studio della carico-dipendenza delle proteine motorie, con i principali vantaggi di applicare la forza molto rapidamente al momento del legame del motore al filamento per sondare eventi precoci e molto rapidi nella produzione di forza e stati di legame deboli sotto forza controllata; Mantenere la forza costante per tutta la corsa e sondare la dipendenza del motore con pieno controllo sulla direzionalità della forza. Per quanto riguarda l'ultimo punto, la geometria a tre sfere come usiamo qui è molto efficiente nell'applicare e misurare le forze lungo la direzione del filamento, riducendo al minimo i contributi dei componenti trasversali o verticali. Tuttavia, quando ci si aspetta che la proteina motoria produca attivamente forze trasversali o verticali, o anche coppie, altre configurazioni come la geometria a singola perla sono più appropriate 2,7,18. Inoltre, grazie alla sua risoluzione spaziale e temporale, UFFCS rappresenta uno strumento unico per la comprensione delle basi delle interazioni molecolari che altrimenti sarebbero ostacolate dalle tecniche convenzionali a singola molecola. In effetti, UFFCS ha permesso di studiare come le forze assistive e resistive regolano la risposta meccanica della miosina-5B, fornendo così nuove informazioni sul suo comportamento collettivo all'interno della maglia di actina nella cellula4.
Tuttavia, il successo di questi esperimenti dipende dal soddisfacimento di alcuni importanti requisiti che devono essere affrontati con molta attenzione seguendo tutte le istruzioni presenti in questo protocollo: il preciso allineamento e isolamento del setup ottico è fondamentale per raggiungere una risoluzione spaziale ottimale; è necessaria un'attenta calibrazione del sistema ottico per determinare i valori delle forze applicate con alta precisione; l'impostazione di un sistema di feedback rapido è necessaria per raggiungere l'alta risoluzione temporale; Infine tutti i componenti che vengono assemblati nella camera di campionamento devono essere preparati in ambiente controllato, mantenendoli il più sterili possibile, poiché qualsiasi impurità nella camera di campionamento potrebbe compromettere l'esperimento, e tutte le indicazioni sulla loro conservazione e manipolazione ottimale devono essere rigorosamente rispettate per la buona riuscita del protocollo sperimentale. È importante sottolineare che l'analisi dei dati dovrebbe essere attentamente adattata ai diversi tipi di interazioni motore-filamento per interpretare correttamente i risultati ed evitare artefatti.
In questo protocollo sono inclusi tutti i passaggi per eseguire esperimenti di force-clamp ultraveloci su motori processivi di miosina-5, dalla messa a punto di apparati sperimentali alla preparazione del campione, alla misura e all'analisi dei dati, che potrebbero essere convenientemente adattati per studiare una varietà di miosine non convenzionali e altre classi di motori processivi come chinesine e dineine.
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto dal programma di ricerca e innovazione Horizon 2020 dell'Unione Europea nell'ambito del Grant Agreement n. 871124 Laserlab-Europe, dal Ministero dell'Università e della Ricerca (FIRB "Futuro in Ricerca" 2013 Grant No. RBFR13V4M2), e dall'Ente Cassa di Risparmio di Firenze. A.V. Kashchuk è stato supportato dalla Human Frontier Science Program Cross-Disciplinary Fellowship LT008/2020-C.
Materiali
| Name | Company | Catalog Number | Comments |
| Aliphatic Amine Latex Beads | ThermoFisher | A37362 | 1.0-μm diameter, 2% (w/v) |
| Acetone | Sigma | 32201 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | 10X |
| AODs (acousto-optic deflectors) | AA Opto Electronic | DTS-XY 250 | Laser beam deflectors |
| ATP | Sigma | A7699 | |
| Biotinylated-BSA | ThermoFisher | 29130 | |
| BSA | Sigma | B4287 | |
| Calmodulin from porcine brain (CaM) | Merck Millipore | 208783 | |
| Catalase from bovine liver | Sigma | C40 | |
| Condenser | Olympus | OlympusU-AAC, Aplanat, Achromat | NA 1.4, oil immersion |
| Creatine phosphate disodium salt tetrahydrate | Sigma | 27920 | |
| Creatine Phosphokinase from rabbit muscle | Sigma | C3755 | |
| DDs | AA Opto Electronic | AA.DDS.XX | Two-channel digital synthesizer |
| DL-Dithiothreitol (DTT)/td> | Sigma | 43819 | |
| EGTA | Sigma | E4378 | |
| G-actin protein | Cytoskeleton | AKL99 | |
| Glucose | Sigma | G7528 | |
| Glucose Oxidase from Aspergillus niger | Sigma | G7141 | |
| HaloTag succinimidyl ester O2 ligand | Promega | P1691 | |
| High vacuum silicone grease heavy | Merck Millipore | 107921 | |
| KCl | Sigma | P9541 | |
| KH2PO4/K2HPO4 | Sigma | P5379/ P8281 | |
| Labview | National Instruments | version 8.1 | Data acquisition |
| Labview FPGA module | National Instruments | version 8.1 | Fast Force-Clamp |
| Matlab | MathWorks | 2016 | Data analysis |
| MgCl2 | Fluka | 63020 | |
| Microscope Objective | Nikon | Plan-Apo 60X | NA 1.2, WD 0.2 mm, water imm. |
| MOPS | Sigma | M1254 | |
| Nitrocellulose | Sigma | N8267 | 0.45 pore size |
| Pentyl acetate solution | Sigma | 46022 | |
| Pure Ethanol | Sigma | 2860 | |
| QPDs | UDT | DLS-20 | D Position Detecto |
| Rhodamine BSA | Molecular Probes | A23016 | |
| Rhodamine Phalloidin | Sigma | P1951 | |
| Silica beads | Bangslabs | SS04N | 1.21 mm, 10% solids |
| Sodium azide | Sigma | S2002 | |
| Streptavidin protein | Sigma | 189730 |
Riferimenti
- Ashkin, A., Dziedzic, J. M., Bjorkholm, J. E., Chu, S. Observation of a single-beam gradient force optical trap for dielectric particles. Optical Angular Momentum. 11 (5), 196-198 (2016).
- Capitanio, M., Pavone, F. S. Interrogating biology with force: Single molecule high-resolution measurements with optical tweezers. Biophysical Journal. 105 (6), 1293-1303 (2013).
- Capitanio, M., et al. Ultrafast force-clamp spectroscopy of single molecules reveals load dependence of myosin working stroke. Nature Methods. 9 (10), 1013-1019 (2012).
- Gardini, L., et al. Dissecting myosin-5B mechanosensitivity and calcium regulation at the single molecule level. Nature Communications. 9 (1), (2018).
- Woody, M. S., Winkelmann, D. A., Capitanio, M., Ostap, E. M., Goldman, Y. E. Single molecule mechanics resolves the earliest events in force generation by cardiac myosin. eLife. 8, 49266(2019).
- Clemen, A. E. -M., Vilfan, M., Jaud, J., Zhang, J., Bä, M., Rief, M. Force-dependent stepping kinetics of myosin-V. Biophysical Journal. 88, 4402-4410 (2005).
- Howard, J., Hancock, W. O. Three beads are better than one. Biophysical Journal. 118 (1), 1-3 (2020).
- Pyrpassopoulos, S., Shuman, H., Ostap, E. M. Modulation of kinesin's load-bearing capacity by force geometry and the microtubule track. Biophysical Journal. 118 (1), 243-253 (2020).
- Capitanio, M., Maggi, D., Vanzi, F., Pavone, F. S. FIONA in the trap: The advantages of combining optical tweezers and fluorescence. Journal of Optics A: Pure and Applied Optics. 9 (8), 157(2007).
- Capitanio, M., Cicchi, R., Pavone, F. S. Position control and optical manipulation for nanotechnology applications. European Physical Journal B. 46 (1), 1-8 (2005).
- Capitanio, M. Optical Tweezers. An introduction to Single Molecule Biophysics. , CRC Press. (2017).
- Capitanio, M., Cicchi, R., Saverio Pavone, F. Continuous and time-shared multiple optical tweezers for the study of single motor proteins. Optics and Lasers in Engineering. 45 (4), 450-457 (2007).
- Gardini, L., Tempestini, A., Pavone, F. S., Capitanio, M. High-speed optical tweezers for the study of single molecular motors. Methods in Molecular Biology. 1805, (2018).
- Capitanio, M., et al. Calibration of optical tweezers with differential interference contrast signals. Review of Scientific Instruments. 73 (4), 1687(2002).
- Monico, C., Belcastro, G., Vanzi, F., Pavone, F. S., Capitanio, M. Combining single-molecule manipulation and imaging for the study of protein-DNA interactions. Journal of Visualized Experiments. (90), e51446(2014).
- Greenberg, M. J., Lin, T., Goldman, Y. E., Shuman, H., Ostap, E. M. Myosin IC generates power over a range of loads via a new tension-sensing mechanism. Proceedings of the National Academy of Sciences of the United States of America. 109 (37), 2433-2440 (2012).
- Gardini, L., Arbore, C., Capitanio, M., Pavone, F. S. A protocol for single molecule imaging and tracking of processive myosin motors. MethodsX. 6, 1854-1862 (2019).
- Ramaiya, A., Roy, B., Bugiel, M., Schäffer, E. Kinesin rotates unidirectionally and generates torque while walking on microtubules. Proceedings of the National Academy of Sciences of the United States of America. 114 (41), 10894-10899 (2017).
Erratum
Formal Correction: Erratum: Dissecting Mechanoenzymatic Properties of Processive Myosins with Ultra Force-Clamp Spectroscopy
Posted by JoVE Editors on 8/25/2021. Citeable Link.
An erratum was issued for: Dissecting Mechanoenzymatic Properties of Processive Myosins with Ultra Force-Clamp Spectroscopy. The title was updated.
The title was updated from:
Dissecting Mechanoenzymatic Properties of Processive Myosins with Ultra Force-Clamp Spectroscopy
to:
Dissecting Mechanoenzymatic Properties of Processive Myosins with Ultrafast Force-Clamp Spectroscopy
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon