Method Article
تشريح الخصائص الميكانيكية الأنزيمية للميوسينات العملية باستخدام التحليل الطيفي فائق السرعة لقوة المشبك
In This Article
Erratum Notice
Summary
يظهر هنا بروتوكول شامل لإجراء تجارب مشبك قوة فائقة السرعة على محركات الميوسين -5 المعالجة ، والتي يمكن تمديدها بسهولة لدراسة فئات أخرى من المحركات العملية. يفصل البروتوكول جميع الخطوات اللازمة ، من إعداد الجهاز التجريبي إلى إعداد العينات والحصول على البيانات وتحليلها.
Abstract
التحليل الطيفي فائق السرعة بمشبك القوة (UFFCS) هو تقنية جزيء واحد تعتمد على ملاقط الليزر التي تسمح بالتحقيق في الميكانيكا الكيميائية لكل من الميوسين التقليدي وغير التقليدي تحت الحمل بدقة زمنية غير مسبوقة. على وجه الخصوص ، أظهرت إمكانية فحص محركات الميوسين تحت قوة ثابتة مباشرة بعد تكوين رابطة الأكتين والميوسين ، جنبا إلى جنب مع المعدل المرتفع لردود الفعل للقوة (200 كيلو هرتز) ، أن UFFCS أداة قيمة لدراسة الاعتماد على الحمل للديناميكيات السريعة مثل شوط عمل الميوسين. علاوة على ذلك ، يتيح UFFCS دراسة كيفية تأثر تفاعلات الميوسين والأكتين الإجرائية وغير العملية بكثافة واتجاه القوة المطبقة.
باتباع هذا البروتوكول ، سيكون من الممكن إجراء تجارب فائقة السرعة على محركات الميوسين -5 المعالجة وعلى مجموعة متنوعة من الميوسينات غير التقليدية. من خلال بعض التعديلات ، يمكن أيضا توسيع البروتوكول بسهولة لدراسة فئات أخرى من المحركات المعالجة مثل kinesins و dyneins. يتضمن البروتوكول جميع الخطوات اللازمة ، من إعداد الجهاز التجريبي إلى إعداد العينات وإجراءات المعايرة والحصول على البيانات وتحليلها.
Introduction
في العقود الأخيرة ، كانت الملقط البصري أداة قيمة لتوضيح الكيمياء الميكانيكية لتفاعلات البروتين على مستوى الجزيء الواحد ، نظرا للإمكانية المذهلة للتلاعب المتزامن وقياس التغيرات التوافقية والحركية الأنزيمية 1,2. على وجه الخصوص ، فإن القدرة على تطبيق وقياس القوى في نطاق تلك التي تمارسها المحركات الجزيئية في الخلية ، جنبا إلى جنب مع القدرة على قياس التغيرات التوافقية دون النانومتر ، جعلت الملقط البصري أداة فريدة من نوعها أحادية الجزيء لكشف الخواص الميكانيكية الكيميائية للبروتينات الحركية وتنظيمها الميكانيكي.
التحليل الطيفي فائق السرعة (UFFCS) هو تقنية التحليل الطيفي للقوة أحادية الجزيء تعتمد على ملاقط بصرية ، تم تطويرها لدراسة الحركية السريعة للمحركات الجزيئية تحت الحمل في هندسة ثلاثية الخرز (الشكل 1 أ) 3,4. يقلل UFFCS من الفارق الزمني لتطبيق القوة على البروتين الحركي إلى الحد المادي للملاقط الضوئية ، أي وقت الاسترخاء الميكانيكي للنظام ، مما يسمح بتطبيق القوة بسرعة بعد بداية تشغيل الميوسين (بضع عشرات من الميكروثانية)3. تم استغلال هذه القدرة للتحقيق في الأحداث الميكانيكية المبكرة في الميوسين العضلي الهيكلي السريع 3 والقلب5 للكشف عن الاعتماد على الحمل لضربة القوة ، وحالات الربط الضعيفة والقوية ، بالإضافة إلى ترتيب الأحداث البيوكيميائية (Pi) والميكانيكية (powerstroke).
عادة ما يتم استخدام هندسة الخرز الثلاثة لدراسة المحركات غير المعالجة ، وقد تم استخدام هندسة حبة واحدة مع مشبك قوة بشكل شائع للتحقيق في الميوسين غير التقليدي مثل الميوسين Va6. ومع ذلك ، هناك عدة أسباب لتفضيل مقايسة UFFCS ثلاثية الخرزات أيضا للميوسينات العملية. أولا ، يسمح التطبيق السريع للحمل مباشرة بعد ربط الأكتين-الميوسين بقياس الأحداث المبكرة في تطور القوة كما هو الحال في المحركات غير المعالجة. بالإضافة إلى ذلك ، في حالة المحركات المعالجة ، فإنه يسمح أيضا بقياس دقيق لأطوال تشغيل المحرك وفترات التشغيل تحت قوة ثابتة طوال تقدمها (الشكل 1 ب). علاوة على ذلك ، نظرا لارتفاع معدل ردود الفعل للقوة ، يمكن للنظام الحفاظ على ثبات القوة أثناء التغييرات السريعة في الموضع ، مثل شوط عمل الميوسين ، وبالتالي ضمان حمل ثابت أثناء خطوة المحرك. تسمح الدقة الزمنية العالية للنظام باكتشاف التفاعلات الفرعية ، مما يفتح إمكانية التحقيق في الارتباط الضعيف للميوسين بالأكتين. أخيرا ، تضمن هندسة الفحص تطبيق القوة على طول خيوط الأكتين ، مع مكونات عرضية ورأسية لا تذكر للقوة. هذه النقطة ذات أهمية خاصة حيث ثبت أن مكون القوة الرأسية يؤثر بشكل كبير على اعتماد الحمل لحركية المحرك 7,8. باستخدام هذه التقنية ، يمكننا تطبيق مجموعة من الأحمال المساعدة والمقاومة على الميوسين 5B المعالج وقياس اعتماد الحمل لعمليته مباشرة لمجموعة واسعة من القوى4.
كما هو موضح في الشكل 1 أ ، في هذا النظام ، يتم تعليق خيوط أكتين واحدة بين حبتين من البوليسترين محبوستين في بؤرة ملاقط بصرية مزدوجة ("الدمبل"). يتم فرض قوة صافية غير متوازنة F = F1-F 2 على الفتيل ، من خلال نظام تغذية مرتدة سريعة ، مما يجعل الفتيل يتحرك بسرعة ثابتة في اتجاه واحد حتى يصل إلى نقطة انعكاس يحددها المستخدم حيث يتم عكس القوة الكلية في الاتجاه المعاكس. عندما لا يتفاعل البروتين الحركي مع الفتيل ، يكون الدمبل حرا في التحرك ذهابا وإيابا في شكل موجة مثلثة (الشكل 1 ب ، اللوحة السفلية) تمتد على حبة القاعدة التي يرتبط بها بروتين محرك واحد. بمجرد إنشاء التفاعل ، يتم نقل القوة التي يحملها الدمبل بسرعة كبيرة إلى البروتين الحركي ويبدأ المحرك في إزاحة الفتيل عن طريق الدوس تحت شدة القوة والاتجاه الذي تم تطبيقه بواسطة نظام التغذية المرتدة في وقت التفاعل ، حتى ينفصل الميوسين عن الأكتين. نظرا لأن الإزاحة الناتجة عن خطوة المحرك تعتمد على قطبية خيوط الأكتين المحاصرة ، وفقا لاتجاه القوة المطبقة ، يمكن أن يكون الحمل إما مساعدا ، أي الدفع في نفس اتجاه إزاحة المحرك (الدفع في اللوحة العلوية الشكل 1 ب) ، أو مقاوما ، أي السحب في الاتجاه المعاكس فيما يتعلق بإزاحة المحرك (السحب في الشكل 1 ب اللوحة العلوية) مما يجعل من الممكن دراسة التنظيم الكيميائي الميكانيكي للعملية الحركية من خلال كل من شدة واتجاه الحمل المطبق.
في الأقسام التالية ، يتم وصف جميع الخطوات لقياس تفاعلات الأكتين-ميوسين-5B تحت أحمال مختلفة مع إعداد التحليل الطيفي فائق السرعة لمشبك القوة بشكل كامل ، بما في ذلك 1) إعداد الإعداد البصري ، ومحاذاة الفخاخ البصرية وإجراءات المعايرة ، 2) الاستعدادات لجميع المكونات وتجميعها في غرفة العينة ، 3) إجراء القياس ، 4) البيانات التمثيلية وتحليل البيانات لاستخراج المعلمات الفيزيائية الهامة ، مثل طول التشغيل وحجم الخطوة وسرعة البروتين الحركي.
Protocol
1. الإعداد البصري
ملاحظة: يتكون الإعداد التجريبي من ملاقط بصرية مزدوجة مع ثبات تأشير نانومتر وتقلبات شدة ليزر < 1٪. في ظل هذه الظروف ، يتم ضمان استقرار الدمبل على مستوى النانومتر تحت صلابة المصيدة النموذجية (0.1 pN / nm) والتوتر (1 pN - بضع عشرات من pN). يوضح الشكل 2 مخططا مفصلا للإعداد البصري.
- ملاقط بصرية تصميم وبناء 9،10،11.
- ضع جميع مكونات الإعداد على طاولة بصرية وفقا للمخطط في الشكل 2. لاحظ أن الجدول البصري يتضمن عوازل نشطة لتقليل الاهتزازات الميكانيكية. بالإضافة إلى ذلك ، يتم تثبيت هيكل المجهر على عوازل مرنة لامتصاص الضوضاء الصوتية والرنين الميكانيكي.
- أدخل عازلا بصريا بالقرب من مصدر الليزر ("OI" في الشكل 2) ، لتجنب تقلبات السعة العشوائية بسبب التغذية المرتدة البصرية.
- أغلق المسار بالكامل في صندوق مغلق لتقليل تيار الهواء والاضطرابات التي يمكن أن تؤثر على استقرار التأشير بالليزر.
- قم بإنشاء ملاقط بصرية مزدوجة عن طريق تقسيم مصدر الليزر الرئيسي (ليزر Nd: YAG ، الطول الموجي 1,064 نانومتر في الشكل 2) إلى فرعين مع استقطابات متعامدة باستخدام مقسمات الحزمة المستقطبة (PBS). يجب تجنب الفخاخ المشتركة مع الوقت لأنها تحفز تذبذب الدمبل تحت التوتر12.
- استخدم اثنين من العاكسات الصوتية البصرية (AODs في الشكل 2) مدفوعة بواسطة أجهزة المزج الرقمية المباشرة (DDSs) للسماح بحركات دقيقة وسريعة للمصيدتين والتنظيم الدقيق لتوتر الأكتين عن طريق قيادة DDSs مباشرة من خلال المخرجات الرقمية من لوحة FPGA لصفيف البوابة القابلة للبرمجة الميدانية (انظر الشكل 2).
ملاحظة: يجب أن يكون وقت الاستجابة الإجمالي للتغذية المرتدة <10 μs لتصحيح القوة الثابتة والحفاظ عليها بسرعة على كلا الفخاخ أثناء القياسات ، بما في ذلك الحالة غير المنضمة وتفاعل الميوسين والحركة. وتحقيقا لهذه الغاية، يجب أن يكون لكاشفات الموضع عرض نطاق >= kHz 100 ويجب الحصول على البيانات بمعدل عينة >= kHz 200. لكل نقطة بيانات تم الحصول عليها (وقت اكتساب 5 μs) ، يتم حساب التصحيحات النسبية للفخين بواسطة FPGA وإرسالها إلى DDS اللذين يقودان AODs. يجب أن يكون وقت استجابة AOD أقل من 5 μs لتلبية وقت استجابة التعليقات المطلوب. - للكشف عن موضع الخرز المحاصر ، ضع كاشفين رباعيين للصمام الثنائي الضوئي (QPDs في الشكل 2) في المستوى البؤري الخلفي للمكثف. ستضمن المحاذاة الدقيقة ل QPDs في مستوى مترافق مع المستوى البؤري الخلفي للمكثف ، وكذلك AODs في مستوى مترافق مع المستوى البؤري الخلفي للهدف ، أن إشارات QPDs ستكون مستقلة عن تردد AODs.
- قم بتركيب AOD على مترجم خطي بمحرك ميكرومتر وقم بإزاحته حتى تقترب الحافة البلورية من شعاع الليزر. بعد ذلك ، استبدل الهدف بقزحية ، تتمحور حول مبيت الهدف الملولب ، وقم بتنظيم فتحته لتناسب حجم الفتحة الخلفية للهدف.
- حرك المترجم نحو شعاع الليزر حتى يصبح جزء الشعاع المسدود بواسطة بلورة بيزو مرئيا بعد القزحية ، أدر المترجم للخلف قليلا لجعل الشعاع يملأ فتحة القزحية بالكامل مرة أخرى.
- كرر الخطوات 1.1.7-1.1.8 ل AOD الثاني. تحقق من وقت استجابة حلقة التغذية الراجعة عن طريق قياس الفارق الزمني من QPDs أثناء تحريك شعاع بسرعة على حبة عالقة على سطح غطاءالغطاء 13.
ملاحظة: تؤدي الخطوات الثلاث المذكورة أعلاه (1.1.7-1-1-9) إلى محاذاة دقيقة لبلورات AOD. هذه الخطوات مهمة لتحسين الاستجابة الزمنية لكل من انحراف الحزمة والتغذية المرتدة13.
- عن طريق الصمام الثنائي الضوئي ، قم بقياس تقلبات شدة ليزر الاصطياد عند مدخل المجهر والتي يجب أن تكون أقل من 1٪. لاحظ أن عرض النطاق الترددي للثنائي الضوئي يجب أن يكون أكبر من معدل التصوير.
- تحقق من استقرار التأشير لكلا الفخاخ.
- تحضير حبات السيليكا في عازلة الفوسفات (PB) عن طريق تخفيف 20 ميكرولتر من حبات السيليكا (1.2 ميكرومتر ، 10٪ مواد صلبة) في 1 مل من الأسيتون ، سونيكات لمدة 30 ثانية ، دوامة لفترة وجيزة ، وأجهزة طرد مركزي لمدة دقيقتين عند 19000 × جم.
- قم بإزالة المادة الطافية ، وأعد تعليقها في 1 مل من الأسيتون ، وكرر الغسيل. إعادة تعليق في 1 مل من 50 مللي متر PB ، وغسل 2 مرات. أخيرا ، أعد التعليق في 100 ميكرولتر من 50 مللي متر بيتابيتا.
- قم بإجراء معايرة الملقط البصري باستخدام حبات السيليكا عن طريق لصق غطاء على شريحة مجهر بشريط على الوجهين (بسمك حوالي 60 ميكرومتر) لبناء غرفة تدفق. املأ الحجرة ب 1 مجم / مل BSA (بروتين ألبومين مصل الأبقار) وانتظر لمدة 3 دقائق.
- تدفق 1: 1000 تخفيف من حبات السيليكا في PB في الغرفة. استخدم حقنة مملوءة بشحم السيليكون لإغلاق الغرفة بعناية. اصطحب حبة واحدة في كل مصيدة وقم بتطبيق طريقة طيف الطاقة14 لمعايرتها.
- تحضير حبات السيليكا في أسيتات البنتيل (في درجة حرارة الغرفة) عن طريق إذابة 20 ميكرولتر من حبات السيليكا (قطر 1.2 ميكرومتر ، 10٪ صلب) في 1-1.5 مل من الأسيتون والدوامة والسونيكات لمدة 30 ثانية.
- جهاز طرد مركزي بسرعة 18,500 × جم لمدة 2 دقيقة. تخلص من المادة الطافية وأعد تعليقها في 1 مل من الأسيتون ، ثم كرر الغسيل. إعادة تعليق في 1 مل من خلات بنتيل وتكرار غسل (أجهزة الطرد المركزي والتعليق) في خلات بنتيل 2 مرات. أعد تعليق الحبيبات في 100 ميكرولتر من النيتروسليلوز 1٪ و 900 ميكرولتر من أسيتات البنتيل. يحفظ في درجة حرارة 4 درجة مئوية لمدة 2 أشهر.
- خذ غطاء زجاجي مقاس 24 × 24 مم وقم بتنظيفه بعناية باستخدام ورق مبلل بالإيثانول النقي. ثم ، أثناء الإمساك به بملاقط نظيفة ، اشطفه مرة ثانية عن طريق غسله مباشرة بالإيثانول النقي. اتركه يجف تحت تدفق لطيف من النيتروجين. إذا لزم الأمر ، كرر هذه العملية لإزالة جميع البقايا المرئية على سطح الزجاج.
- خذ مخزون حبات السيليكا ، دوامة عليه وصوتيك لفترة وجيزة لمدة ~ 30 ثانية.
- بعد تنظيف غطاء الغطاء الثاني (24 × 60 مم) ، استخدمه لتشويه 2 ميكرولتر من محلول خرز السيليكا على سطح واحد من غطاء الغطاء ، وانتظر حتى يجف.
- نظف بعناية شريحة مجهرية (26 × 76 مم) سيتم استخدامها لإنشاء غرفة التدفق.
- اقطع سطرين من الشريط اللاصق المزدوج (~ 3 مم كبير ، سمك 60-100 ميكرومتر) وأرفقهما على جانب واحد من شريحة المجهر ، كما هو موضح في الشكل 3.
- باستخدام ملاقط نظيفة ، أغلق الغرفة (حوالي 20 ميكرولتر الحجم النهائي) عن طريق وضع غطاء الغطاء المطلي (1.3.9) على اتصال مع خطوط الشريط اللاصق ، مع طبقة النيتروسليلوز + الخرز التي تواجه داخل الغرفة ، كما هو موضح في الشكل 3 أ. املأ حجرة التدفق بمحلول فوسفات 50 مللي متر وأغلقها بشحم السيليكون.
- تخيل حبة سيليكا واحدة في الفحص المجهري الساطع بتكبير >200x باستخدام جهاز مقترن بالشحن (CCD) أو كاميرا تكميلية لأشباه الموصلات المعدنية (CMOS) بدقة >1.4 ميجابكسل. استخدم برنامج التغذية المرتدة لتحريك مرحلة بيزو (بدقة نانومتر أو أفضل) للتعويض عن الانجرافات الحرارية10.
- تداخل مركز المصيدة اليسرى مع مركز الخرزة (يجب أن تتطابق مستويات إشارة x-y من QPD مع تلك الموجودة في المعايرة). ثم قم بقياس ضوضاء الموضع والانحراف المعياري لإشارات الموضع لهذا المصيدة.
- كرر الخطوة السابقة للمصيدة الصحيحة15.
- معايرة موضع المصيدة: MHz إلى nm
- قم بإعداد غرفة تدفق مع حبات السيليكا المرفقة على سطح الغطاء (1.3.5-1.3.12) وخرز البوليسترين العائم (استخدم حبات α-actinin المترافقة المعدة كما في القسم التالي 2.1).
- ركز حبة السيليكا على سطح انزلاق الغطاء قليلا (~ 5 ميكرومتر) من مركز مجال الرؤية (FOV) واحصل على صورة ل FOV. حرك الخرزة بمقدار 10 ميكرومتر باتجاه مركز FOV باستخدام مرحلة بيزو واحصل على صورة ثانية. احسب مركز الخرزة في الصورتين باستخدام خوارزمية centroid أو ما شابه ذلك واحسب المسافة بالبكسل بين الخرزتين للحصول على معايرة نانومتر / بكسل لكاميرا برايتفيلد.
- اصطياد جسيم عائم واحد في فخ واحد. بعد ذلك ، حرك المصيدة باستخدام AOD في خطوات صغيرة (0.2 ميجاهرتز) واحصل على صورة للجسيم والتردد المقابل ل AOD لكل خطوة. احسب موضع الجسيم في مجال الرؤية باستخدام خوارزمية النقطه الوسطى كما كان من قبل وقم بتحويله إلى نانومتر باستخدام معايرة نانومتر / بكسل التي تم الحصول عليها في الخطوة السابقة.
- قم بإجراء ملاءمة خطية لبيانات موضع التردد واحسب ثابت المعايرة بالميل الرقمي / ميجاهرتز.
- تكرار المعايرة للمصيدة الثانية
- معايرة قوة المصيدة والصلابة (ميجاهرتز مقابل W) ، QPD (ميجاهرتز مقابل pN / نانومتر)
- قم بإعداد غرفة تدفق مع حبات السيليكا المرفقة على سطح الغطاء (1.3.5-1.3.12) وخرز البوليسترين العائم (استخدم حبات α-actinin المترافقة المحضرة كما في القسم التالي 2.1) وحبس جسيما واحدا في مصيدة واحدة. ثم قم بإزاحة كلا المصيدتين من خلال AODs في خطوات صغيرة (0.2 ميجاهرتز) وسجل حركة براونية للجسيم في كلا الفخاخ باستخدام QPD والتردد المقابل ل AODs.
- احسب متوسط الطاقة على أجهزة الكشف في كل موضع واحصل على صلابة المصيدة وبيتا ثابت معايرة QPD عن طريق تركيب دالة لورنتزيان على طيف طاقة للحركة البراونية المسجلة13.
2. إعداد عينة
- تحضير حبات الفلورسنت المترافقة α الأكتينين
- قم بإجراء الاقتران16: خذ حبات البوليسترين ذات الوظائف الأمينية (قطرها 1 ميكرومتر ، 2.5٪ مواد صلبة) ، واغسلها مرتين في 500 ميكرولتر من الماء المقطر وأعيد تعليقها في 500 ميكرولتر من PBS (درجة الحموضة 7.0). أضف 1 مليمتر HaloTag succinimidyl ester O2 ligand واحتضانه في درجة حرارة الغرفة لمدة 1 ساعة. اغسل ثلاث مرات مع 500 ميكرولتر من PBS وأعيد تعليقه باستخدام 100-200 ميكرومتر HaloTag α-actinin. احتضان لمدة 1 ساعة عند 37 درجة مئوية وغسل ثلاث مرات في 500 ميكرولتر من PBS (استخدم الخرز في غضون 1.5 أسبوع أو المجمد في النيتروجين السائل وخزن في -80 درجة مئوية).
- وضع العلامات: احتضان 200 ميكرولتر من محلول الخرز باستخدام Rhodamine-BSA بتركيز نهائي 5 ميكروغرام / مل لمدة 10 دقائق. اغسل ب 50 مللي متر بيتابايت ثلاث مرات وأعد تعليقه في 500 ميكرولتر من PB 50 مللي متر. يمكن تخزين هذا في القسمة عند - 80 درجة مئوية لعدة أشهر).
- التعبير عن وتنقية البيوتينيل Myosin-5B كما هو موضح سابقا4،17.
- بلمرة وتسمية F-actin13:
- بلمرة F-actin: امزج 69 ميكرولتر من الماء عالي النقاء ، و 10 ميكرولتر من محلول بلمرة الأكتين 10x (100 mM Tris HCl ، 20 mM MgCl2 ، 500 mM KCl ، 10 mM ATP ، 50 mM كربونات guanidine pH 7.5) ، 20 ميكرولتر من G-actin 10 mg / mL ، و 1 μL من DL -Dithiothreitol (DTT) 1 M. اتركه على الثلج لأكثر من 1 ساعة.
- وضع العلامات على F-actin مع الرودامين (Ex / Em: 546/575 نانومتر): خذ 25 ميكرولتر من F-actin المبلمر وأضف 19.5 ميكرولتر من الماء عالي النقاء ، و 2.5 ميكرولتر من محلول بلمرة الأكتين 10x (100 mM Tris HCl ، 20 mM MgCl 2 ، 500 mM KCl ، 10 mM ATP ، 50 mM كربونات الجوانيدين pH 7.5) ، 1 ميكرولتر من 1 M DTT ، و2 ميكرولتر من 250 ميكرومتر من رودامين فالويدين. اتركه على الثلج طوال الليل. لتجارب الاصطياد ، يمكن تخزين رودامين F-actin على الجليد واستخدامه في غضون أسبوع.
- تجميع العينة
- خذ غرفة التدفق (1.3.5-1.3.12) واحتضان 1 ملغ / مل من BSA البيوتينيل لمدة 5 دقائق. بعد الغسيل باستخدام محلول AB (25 ملي مل ممسحة ، 25 مللي مول KCl ، 4 مللي متر MgCl 2 ، 1 مللي متر EGTA ، 1 مللي متر DTT ، درجة حموضة7.2) احتضان 1 ملغ / مل ستربتافيدين لمدة 5 دقائق واغسله مرة أخرى باستخدام AB Buffer. احتضان الميوسين-5B الميروميوسين الثقيل بيوتينيل بتركيز 3 نانومتر في المخزن المؤقت M5B (10 mM MOPS pH 7.3 ، 0.5 M NaCl ، 0.1 mM EGTA ، 3 mM NaN3) مع 2 ميكرومتر كالمودولين (CaM) لمدة 5 دقائق. يغسل بثلاثة كميات من 1 ملغ/مل من البيوتينيل BSA المكمل ب 2 ميكرومتر من الكامي في AB ويحتضن لمدة 3 دقائق.
- أثناء الحضانة ، قم بإعداد مزيج التفاعل (RM): 0.005٪ حبات وظيفية α-أكتينين (القسم 2.1) ، 1 نانومتر رودامين F-Actin (القسم 2.3) في مخزن التصوير (IB: AB عازلة مع 1.2 ميكرومتر جلوكوز أوكسيديز ، 0.2 ميكرومتر كاتلاز ، 17 مللي مول جلوكوز ، 20 مللي مول DTT ، 2 ميكرومتر كام و ATP بالتركيز اللازم للتجربة).
- تغسل مع RM وختم الغرفة مع الشحوم السيليكون. العينة جاهزة الآن للمراقبة تحت المجهر.
3. القياس
- تجميع الدمبل.
- ابحث عن حبات α الأكتينين العائمة عن طريق تحريك العينة باستخدام مترجمين بعيدي المدى ، وقم بتشغيل مصيدة واحدة واصطياد حبة واحدة.
- بمجرد شغل المصيدة الأولى ، حرك المترجم لوضع الخرزة المحاصرة بالقرب من سطح الغطاء لتجنب محاصرة حبات متعددة ، وحبس حبة أخرى في المصيدة الثانية.
- اضبط المصيدتين على صلابة متساوية عن طريق ضبط قوة الموجات الصوتية AODs. عادة ما يتم ضبط الصلابة بين 0.03 و 0.14 pN / nm. كلما كانت الصلابة أصغر ، قل ضجيج القوة ، خاصة عند القوى المنخفضة.
- ثم اقلب المرآة الآلية M (الشكل 2) للتبديل إلى الفحص المجهري الفلوري ، وابحث عن خيوط الأكتين العائمة في المحلول عن طريق إزاحة العينة من خلال مترجمين بعيدي المدى13. تفضل خيوط طويلة (>5 ميكرومتر) لأن الميوسين المعالج سوف يزيحها وينقلها لبضعة ميكرونات قبل الانفصال.
- حرك العينة للسماح لإحدى الخرزات العالقة بالاقتراب من أحد طرفي الفتيل حتى تلتصق بعضها ببعض. بعد ذلك ، اضبط مسافة الخرز على طول الفتيل التقريبي وقم بإنشاء تدفق في اتجاه الخرزة الثانية غير المنضمة عن طريق تحريك المرحلة في اتجاهها. سيتم شد الفتيل بواسطة التدفق وسوف يرتبط به في النهاية13. يسمى مجمع حبة الأكتين "الدمبل".
- إنشاء اتصال الأكتين والميوسين.
- افصل المصيدتين برفق عن بعضهما البعض لشد الفتيل مسبقا حتى حوالي 3 pN وتحقق من صلابة الدمبل عن طريق جعل مصيدة واحدة تتأرجح في موجة مثلثة عن طريق تغيير تردد أحد AODs والتحقق من انتقال الحركة إلى الخرزة الخلفية من خلال إشارة موضعها.
- حرك المسرح لوضع الدمبل بالقرب من حبة السيليكا ذات القاعدة والسماح بالتلامس بين الفتيل والبروتين المتصل بسطح الخرزة عن طريق ضبط ارتفاع مراكز الخرزة المحاصرة أسفل قطر حبة السيليكا بقليل. ثم ضع مركز حبة السيليكا بين الخرز المحاصر.
- قوة المشبك وردود فعل تثبيت نانومتر:
- قم بتشغيل مشبك القوة فائق السرعة بقوة 2-3 pN وتذبذب 200 نانومتر ومسح حبة القاعدة في خطوات منفصلة تبلغ حوالي 20-30 نانومتر في الاتجاه العمودي على خيوط الأكتين. انتظر حتى تحدث التفاعلات في كل موضع (بضع ثوان) ، ثم تقدم للأمام إذا لم يلاحظ أي تفاعل. عند إنشاء تفاعل خيوط البروتين ، ابحث عن الموضع الذي تكون فيه التفاعلات أكثر تكرارا.
- تأكد من أنه عندما يتحرك الميوسين المعالج نحو أحد طرفي خيوط الأكتين (عادة ما يكون الطرف +) ، تتحرك الخرزة المحبوسة المرتبطة بالطرف + نحو حبة السيليكا. حرك المرحلة نحو نهاية الفتيل بحيث تقع حبة السيليكا في أقرب مكان ممكن من الخرزة المحبوسة المرتبطة بنهاية الفتيل عندما لا يكون الميوسين مرتبطا وابدأ التغذية المرتدة لتثبيت النانومتر. عند القيام بذلك ، يتم تقليل احتمال اصطدام الخرزة المحاصرة المرتبطة بنهاية + من الفتيل في حبة السيليكا.
- تسجيل البيانات.
4. تحليل البيانات4
ملاحظة: تسمح طريقة التحليل الموصوفة باكتشاف وقياس عمليات التشغيل العملية وأحداث الخطوات السريعة بناء على التغيرات في سرعة الدمبل ، كما هو ناتج عن خطوة الميوسين. يتم إجراء تحليل عمليات التشغيل التصنيعية بناء على طريقة تحليل البيانات للمحركات غير المعالجة الموضحة في المراجع3،4،13.
- قم بتعيين حد لتغييرات السرعة للسماح باكتشاف الحدث المتدرج. نظرا لأنه في هذه الحالة من المتوقع أن تكون الخطوات الأمامية والخلفية متوقعة ، يتم قبول عبور العتبة في كلا الاتجاهين.
- قم بتعيين كل خطوة إلى التشغيل المقابل: إذا كان الفاصل الزمني بين خطوتين متتاليتين أقصر من 3 مللي ثانية وكانت سعة الخطوات < 90 نانومتر ، يتم تعيين الخطوات لنفس التشغيل ، وإلا يتم تعيين الخطوات إلى عمليات تشغيل مختلفة4.
- طول التشغيل الصحيح للقوات المساعدة4.
- تصحيح أطوال التشغيل تحت القوى المساعدة عن طريق حساب قيمة طول التشغيل الحقيقية RL من متوسط قيمة طول التشغيل المقاسة <RLm> من المعادلة التالية ، حيث D هو نطاق التذبذب:

ملاحظة: يمكن العثور على تفاصيل اشتقاق هذه المعادلة في المرجع4.
- تصحيح أطوال التشغيل تحت القوى المساعدة عن طريق حساب قيمة طول التشغيل الحقيقية RL من متوسط قيمة طول التشغيل المقاسة <RLm> من المعادلة التالية ، حيث D هو نطاق التذبذب:
النتائج
تتكون البيانات التمثيلية في سجلات الموقف بمرور الوقت كما هو موضح في الشكل 4. في سجل الموقف ، يمكن رؤية نوعين من الإزاحة. أولا ، عندما لا يتفاعل محرك الميوسين مع خيوط الأكتين ، تتحرك الحبيبات المحبوسة بسرعة ثابتة مقابل قوة السحب اللزجة للمحلول مما يدل على إزاحة خطية تتأرجح داخل نطاق التذبذب الذي حدده المشغل في موجة مثلثة3 (غير مرئية في الشكل 4 بسبب المقياس الزمني الطويل). ثانيا، بمجرد تفاعل محرك الميوسين مع الفتيلة، تنتقل القوة التي تحملها الفتيل المتحرك بسرعة كبيرة إلى البروتين، وتنخفض سرعة النظام إلى الصفر (الخطوط الحمراء في الشكل 4) وتحدث أحداث التدرج تحت تأثير ثابت حتى نهاية المدى. كما هو موضح في الشكل 5 ، يتم تبديل القوة من الاتجاه الموجب إلى الاتجاه السلبي (والعكس صحيح) بواسطة نظام التغذية المرتدة ، الذي يغير اتجاه القوة عندما تصل الخرزة إلى حافة نطاق التذبذب الذي حدده المستخدم. في بعض الحالات ، يمكن أن يحدث أنه عندما يرتبط الميوسين ويزيح الفتيل نحو الاتجاه الإيجابي ، فإنه يدفع الخرزة نحو الحافة (العلوية) لنطاق التذبذب. إذا حدث هذا تحت القوة المساعدة (أي موجهة نحو الإزاحة الإيجابية ، ادفع ، في الشكل 5) ، فسوف ينقطع تشغيل الميوسين بسبب انعكاس اتجاه القوة عند حافة التذبذب (الأسهم في الشكل 5) ، مما يحد من طول الجري إلى سعة تذبذب الدمبل D. وهذا يتطلب تصحيح طول الجري في حالة القوة المساعدة (4.3.1).

الشكل 1: رسم تخطيطي ل UFFCS مطبق على محرك ميوسين-5B معالجي. (أ) يتم توصيل جزيء ميوسين-5B واحد بقاعدة خرزة زجاجية من خلال وصلة ستربتافيدين - بيوتين. يتم احتجاز خيوط الأكتين الواحدة عن طريق تعليقها بين حبات الأكتينين المطلية ب α (ما يسمى بهندسة "الخرز الثلاث"). تمثل الأسهم السوداء القوة المثبتة على اليمين (F1) والخرزة اليسرى (F2) ، ويمثل السهم الأحمر القوة الصافية (F) على الدمبل. يتناوب F ذهابا وإيابا للحفاظ على الدمبل ضمن نطاق تذبذب محدود عندما لا يكون الميوسين مرتبطا بالأكتين. (ب) مثال على الأثر الذي يبين الإزاحة والقوة خلال المراحل المقابلة من تذبذب الدمبل ، وارتباط الميوسين - 5B ، والتشغيل الإجرائي تحت أحمال مساعدة (دفع) ومقاومة (سحب). تم تعديل هذا الرقم من4. يتم رسم البيانات الخام التي تم الحصول عليها بمعدل عينة 200 كيلو هرتز. Std. Dev. من القوة حوالي 0.27 pN. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
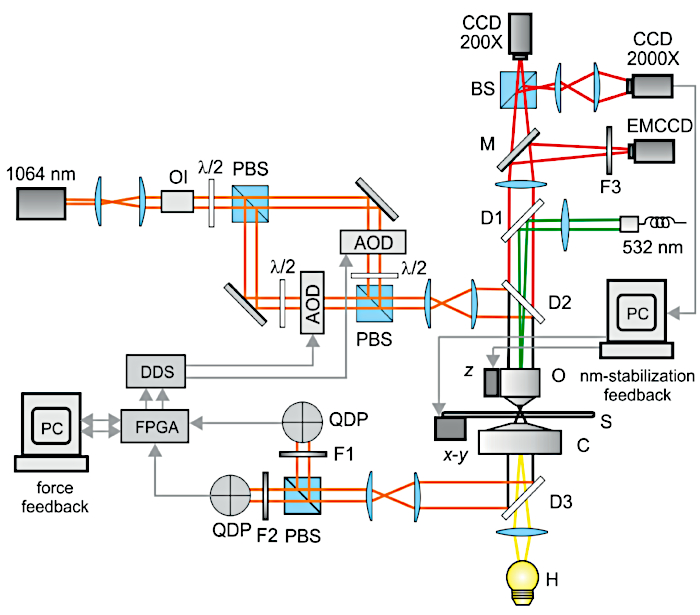
الشكل 2: المخطط البصري للإعداد التجريبي. يتكون المجهر البصري من: مصباح الهالوجين (H) ، المكثف (C) ، العينة (S) ، مترجمو بيزو (x-y و z) ، الهدف (O) ، كاميرا منخفضة التكبير (CCD 200X) وكاميرا عالية التكبير (CCD 2000X) المستخدمة لتغذية مرتدة تثبيت نانومتر. يتم إدخال ملاقط بصرية مزدوجة واستخراجها من المحور البصري للمجهر من خلال مرايا ثنائية اللون (D2 و D3) وتشمل: ليزر Nd: YAG (1064 نانومتر) ، عازل بصري (OI) ، λ / 2 ألواح موجية ، مكعبات تقسيم شعاع الاستقطاب (PBS) ، عواكس صوتية بصرية (AOD) ، مرشحات تداخلية 1064 نانومتر (F1 و F2) ، الثنائيات الضوئية للكاشف الرباعي (QDP). تم تطوير الإشارات من QDPs باستخدام FPGA ، وتم إرسالها إلى اثنين من أجهزة المزج الرقمية المباشرة المصممة خصيصا (DDS) التي تقود AODs (ردود فعل القوة). تم توفير إثارة التألق بواسطة ليزر Nd: YAG مكرر (532 نانومتر) والصورة المسقطة على كاميرا مضاعفة الإلكترون (EMCCD). M هي مرآة متحركة ، F3 مرشح انبعاثات. تم تعديل هذا الرقم من 3. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
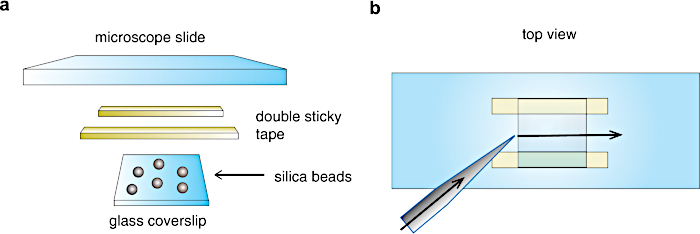
الشكل 3: تجميع غرفة التدفق . (أ) إعداد الغرفة. يتم إرفاق غطاء زجاجي ، ملطخ بخرز السيليكا ، على شريحة مجهرية من خلال خطوط شريط لاصق مزدوجة لتشكيل خلية تدفق بحجم 20 ميكرولتر. ب) منظر علوي لخلية التدفق. يتم نقل المحاليل من جانب واحد من الغرفة باستخدام ماصة ويتم امتصاصها من الجانب الآخر من خلال ورقة ترشيح لإنشاء تدفق على طول اتجاه السهم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
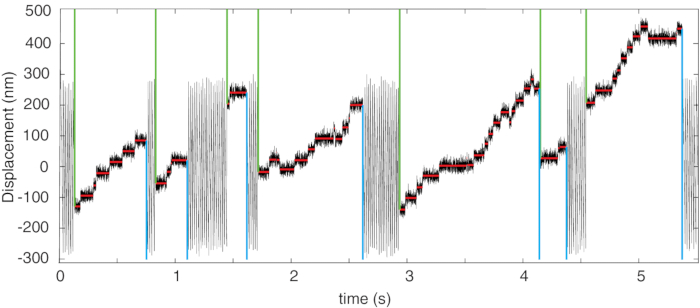
الشكل 4: تسجيل موقف تمثيلي. تسجيل الموضع الذي يظهر عمليات تشغيل عملية myosin-5B وخوارزمية الكشف عن الخطوة والتشغيل. يشار إلى بداية ونهاية كل تشغيل المكتشفة بخطوط عمودية خضراء وسماوية ، على التوالي. تشير الخطوط الأفقية الحمراء إلى الخطوات المكتشفة. تم تعديل هذا الرقم من4. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 5: الانقلاب بالقوة أثناء جري الميوسين. عندما يرتبط الميوسين بالخيوط ويحركها في الاتجاه الموجب تحت تأثير القوة المساعدة (الدفع)، يمكن أن يصل إلى حافة نطاق الاهتزاز حيث تنعكس القوة (المشار إليها بالأسهم)، بحيث ينقطع الميوسين تحت تأثير القوة المساعدة. على العكس من ذلك ، تحت قوة المقاومة (السحب) ، تمنع خطوة الميوسين العملية الدمبل من الوصول إلى نقطة انعكاس القوة. لذلك ، في الحالة الأخيرة ، لا تقتصر أطوال التشغيل على نطاق التذبذب لقوى المقاومة. تم تعديل هذا الرقم من4. يتم رسم البيانات الخام التي تم الحصول عليها بمعدل عينة 200 كيلو هرتز. Std. Dev. من القوة حوالي 0.27 pN. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
على الرغم من أن تقنيات الجزيء الواحد ، مثل الفحص ثلاثي الخرز ، تمثل تحديا تقنيا وإنتاجية منخفضة ، إلا أن UFFCS يحسن اكتشاف التفاعلات الجزيئية بفضل نسبة الإشارة إلى الضوضاء العالية للبيانات. يسمح UFFCS بدراسة الاعتماد على الحمل للبروتينات الحركية ، مع المزايا الرئيسية لتطبيق القوة بسرعة كبيرة عند ربط المحرك بالخيوط لاستكشاف الأحداث المبكرة والسريعة جدا في إنتاج القوة وحالات الربط الضعيفة تحت القوة الخاضعة للرقابة ؛ الحفاظ على ثبات القوة طوال فترة التشغيل والتحقق من الاعتماد الحركي مع التحكم الكامل في اتجاه القوة. فيما يتعلق بالنقطة الأخيرة، فإن هندسة الخرز الثلاث كما نستخدمها هنا فعالة للغاية في تطبيق القوى وقياسها على طول اتجاه الفتيل، مما يقلل المساهمات من المكونات المستعرضة أو الرأسية. ومع ذلك ، عندما يتوقع أن ينتج البروتين الحركي بنشاط قوى عرضية أو رأسية ، أو حتى عزم دوران ، فإن التكوينات الأخرى مثل هندسة الخرزة المفردة تكون أكثر ملاءمة2،7،18. علاوة على ذلك ، بفضل الدقة المكانية والزمانية ، يمثل UFFCS أداة فريدة لفهم أساسيات التفاعلات الجزيئية التي كانت ستعرقل بخلاف ذلك بتقنيات الجزيء الواحد التقليدية. في الواقع ، جعلت UFFCS من الممكن التحقيق في كيفية تنظيم القوى المساعدة والمقاومة للاستجابة الميكانيكية للميوسين -5B ، وبالتالي إعطاء نظرة ثاقبة جديدة لسلوكها الجماعي داخل شبكة الأكتين في الخلية4.
ومع ذلك ، فإن نجاح هذه التجارب يعتمد على تلبية بعض المتطلبات المهمة التي يجب معالجتها بعناية فائقة باتباع جميع التعليمات الموجودة في هذا البروتوكول: المحاذاة الدقيقة وعزل الإعداد البصري أمر أساسي للوصول إلى دقة مكانية مثالية. المعايرة الدقيقة للنظام البصري ضرورية لتحديد قيم القوى المطبقة بدقة عالية ؛ يعد إعداد نظام التغذية المرتدة السريعة ضروريا للوصول إلى الدقة الزمنية العالية ؛ أخيرا ، يجب تحضير جميع المكونات التي يتم تجميعها في غرفة العينة في بيئة خاضعة للرقابة ، مع إبقائها معقمة قدر الإمكان ، لأن أي شوائب في غرفة العينة يمكن أن تعرض التجربة للخطر ، ويجب احترام جميع المؤشرات حول تخزينها والتعامل معها بشكل صارم لنجاح البروتوكول التجريبي. الأهم من ذلك ، يجب تكييف تحليل البيانات بعناية مع الأنواع المختلفة من تفاعلات خيوط المحرك لتفسير النتائج بشكل صحيح وتجنب القطع الأثرية.
في هذا البروتوكول يتم تضمين جميع الخطوات لإجراء تجارب فائقة السرعة على محركات الميوسين -5 المعالجة ، من إعداد الجهاز التجريبي إلى إعداد العينات والقياس وتحليل البيانات ، والتي يمكن تكييفها بسهولة لدراسة مجموعة متنوعة من الميوسين غير التقليدي وفئات أخرى من المحركات العملية مثل kinesins و dyneins.
Disclosures
يعلن المؤلفون عدم وجود مصالح متنافسة.
Acknowledgements
تم دعم هذا العمل من قبل برنامج البحث والابتكار Horizon 2020 التابع للاتحاد الأوروبي بموجب اتفاقية المنحة رقم 871124 Laserlab-Europe ، من قبل وزارة الجامعات والبحوث الإيطالية (FIRB "Futuro in Ricerca" 2013 Grant No. RBFR13V4M2) ، ومن قبل Ente Cassa di Risparmio di Firenze. تم دعم A.V. Kashchuk من قبل زمالة متعددة التخصصات لبرنامج علوم الحدود البشرية LT008 / 2020-C.
Materials
| Name | Company | Catalog Number | Comments |
| Aliphatic Amine Latex Beads | ThermoFisher | A37362 | 1.0-μm diameter, 2% (w/v) |
| Acetone | Sigma | 32201 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | 10X |
| AODs (acousto-optic deflectors) | AA Opto Electronic | DTS-XY 250 | Laser beam deflectors |
| ATP | Sigma | A7699 | |
| Biotinylated-BSA | ThermoFisher | 29130 | |
| BSA | Sigma | B4287 | |
| Calmodulin from porcine brain (CaM) | Merck Millipore | 208783 | |
| Catalase from bovine liver | Sigma | C40 | |
| Condenser | Olympus | OlympusU-AAC, Aplanat, Achromat | NA 1.4, oil immersion |
| Creatine phosphate disodium salt tetrahydrate | Sigma | 27920 | |
| Creatine Phosphokinase from rabbit muscle | Sigma | C3755 | |
| DDs | AA Opto Electronic | AA.DDS.XX | Two-channel digital synthesizer |
| DL-Dithiothreitol (DTT)/td> | Sigma | 43819 | |
| EGTA | Sigma | E4378 | |
| G-actin protein | Cytoskeleton | AKL99 | |
| Glucose | Sigma | G7528 | |
| Glucose Oxidase from Aspergillus niger | Sigma | G7141 | |
| HaloTag succinimidyl ester O2 ligand | Promega | P1691 | |
| High vacuum silicone grease heavy | Merck Millipore | 107921 | |
| KCl | Sigma | P9541 | |
| KH2PO4/K2HPO4 | Sigma | P5379/ P8281 | |
| Labview | National Instruments | version 8.1 | Data acquisition |
| Labview FPGA module | National Instruments | version 8.1 | Fast Force-Clamp |
| Matlab | MathWorks | 2016 | Data analysis |
| MgCl2 | Fluka | 63020 | |
| Microscope Objective | Nikon | Plan-Apo 60X | NA 1.2, WD 0.2 mm, water imm. |
| MOPS | Sigma | M1254 | |
| Nitrocellulose | Sigma | N8267 | 0.45 pore size |
| Pentyl acetate solution | Sigma | 46022 | |
| Pure Ethanol | Sigma | 2860 | |
| QPDs | UDT | DLS-20 | D Position Detecto |
| Rhodamine BSA | Molecular Probes | A23016 | |
| Rhodamine Phalloidin | Sigma | P1951 | |
| Silica beads | Bangslabs | SS04N | 1.21 mm, 10% solids |
| Sodium azide | Sigma | S2002 | |
| Streptavidin protein | Sigma | 189730 |
References
- Ashkin, A., Dziedzic, J. M., Bjorkholm, J. E., Chu, S. Observation of a single-beam gradient force optical trap for dielectric particles. Optical Angular Momentum. 11 (5), 196-198 (2016).
- Capitanio, M., Pavone, F. S. Interrogating biology with force: Single molecule high-resolution measurements with optical tweezers. Biophysical Journal. 105 (6), 1293-1303 (2013).
- Capitanio, M., et al. Ultrafast force-clamp spectroscopy of single molecules reveals load dependence of myosin working stroke. Nature Methods. 9 (10), 1013-1019 (2012).
- Gardini, L., et al. Dissecting myosin-5B mechanosensitivity and calcium regulation at the single molecule level. Nature Communications. 9 (1), (2018).
- Woody, M. S., Winkelmann, D. A., Capitanio, M., Ostap, E. M., Goldman, Y. E. Single molecule mechanics resolves the earliest events in force generation by cardiac myosin. eLife. 8, 49266(2019).
- Clemen, A. E. -M., Vilfan, M., Jaud, J., Zhang, J., Bä, M., Rief, M. Force-dependent stepping kinetics of myosin-V. Biophysical Journal. 88, 4402-4410 (2005).
- Howard, J., Hancock, W. O. Three beads are better than one. Biophysical Journal. 118 (1), 1-3 (2020).
- Pyrpassopoulos, S., Shuman, H., Ostap, E. M. Modulation of kinesin's load-bearing capacity by force geometry and the microtubule track. Biophysical Journal. 118 (1), 243-253 (2020).
- Capitanio, M., Maggi, D., Vanzi, F., Pavone, F. S. FIONA in the trap: The advantages of combining optical tweezers and fluorescence. Journal of Optics A: Pure and Applied Optics. 9 (8), 157(2007).
- Capitanio, M., Cicchi, R., Pavone, F. S. Position control and optical manipulation for nanotechnology applications. European Physical Journal B. 46 (1), 1-8 (2005).
- Capitanio, M. Optical Tweezers. An introduction to Single Molecule Biophysics. , CRC Press. (2017).
- Capitanio, M., Cicchi, R., Saverio Pavone, F. Continuous and time-shared multiple optical tweezers for the study of single motor proteins. Optics and Lasers in Engineering. 45 (4), 450-457 (2007).
- Gardini, L., Tempestini, A., Pavone, F. S., Capitanio, M. High-speed optical tweezers for the study of single molecular motors. Methods in Molecular Biology. 1805, (2018).
- Capitanio, M., et al. Calibration of optical tweezers with differential interference contrast signals. Review of Scientific Instruments. 73 (4), 1687(2002).
- Monico, C., Belcastro, G., Vanzi, F., Pavone, F. S., Capitanio, M. Combining single-molecule manipulation and imaging for the study of protein-DNA interactions. Journal of Visualized Experiments. (90), e51446(2014).
- Greenberg, M. J., Lin, T., Goldman, Y. E., Shuman, H., Ostap, E. M. Myosin IC generates power over a range of loads via a new tension-sensing mechanism. Proceedings of the National Academy of Sciences of the United States of America. 109 (37), 2433-2440 (2012).
- Gardini, L., Arbore, C., Capitanio, M., Pavone, F. S. A protocol for single molecule imaging and tracking of processive myosin motors. MethodsX. 6, 1854-1862 (2019).
- Ramaiya, A., Roy, B., Bugiel, M., Schäffer, E. Kinesin rotates unidirectionally and generates torque while walking on microtubules. Proceedings of the National Academy of Sciences of the United States of America. 114 (41), 10894-10899 (2017).
Erratum
Formal Correction: Erratum: Dissecting Mechanoenzymatic Properties of Processive Myosins with Ultra Force-Clamp Spectroscopy
Posted by JoVE Editors on 8/25/2021. Citeable Link.
An erratum was issued for: Dissecting Mechanoenzymatic Properties of Processive Myosins with Ultra Force-Clamp Spectroscopy. The title was updated.
The title was updated from:
Dissecting Mechanoenzymatic Properties of Processive Myosins with Ultra Force-Clamp Spectroscopy
to:
Dissecting Mechanoenzymatic Properties of Processive Myosins with Ultrafast Force-Clamp Spectroscopy
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved