Method Article
牛の初期のアンタル卵胞からの卵母細胞のための体外培養戦略
要約
開発初期段階で卵巣卵胞から卵母細胞を分離する手順と、完全に成長した段階までの成長と分化をサポートできるインビトロ培養システムのセットアップについて説明する。
要約
成熟した肥沃な卵母細胞の限られた予備は、哺乳類における補助生殖の成功のための主要な障壁を表す。生殖寿命期間中、卵巣成熟および排卵体の卵母細胞の約1%しか存在しない場合、卵巣予備の利用を非排卵卵胞の増加集団に増加させるいくつかの技術が開発されてきた。このような技術は、不妊治療の保存、家畜の選択プログラム、および絶滅危惧種の保全の介入を可能にしました。しかし、卵巣予備軍の広大な可能性はまだほとんど利用されていない。例えば、牛では、特定の発達段階で卵母細胞の体外培養をサポートするいくつかの試みがなされているが、効率的で信頼性の高いプロトコルはまだ開発されていない。ここでは、インビボ中腹葉に対応して、牛初期のアンタル卵胞から完全に成長したステージに集められた生体外成長卵母細胞を開発するために定義された、対応する濾胞期の生理学的条件を再現する培養系について説明する。ホルモンとホスホジエステラーゼ3阻害剤の組み合わせは、タイムリーなmeiotic再開を防ぎ、卵母細胞の分化を導くために使用されました。
概要
生殖寿命期間中、卵巣成熟に存在する卵母細胞のほんの一部は、排卵時に卵管内で放出され、受精して生存可能な胚1に発展するために利用可能である。一方、卵巣内の卵母細胞のほとんどは閉鎖を受け、排卵することはありません。インビトロ胚生産(IVP)技術は、卵巣予備軍22、33の搾取を増加させようとしている。これまでのところ、このような技術は、不妊治療の保存、家畜の選択プログラム、および絶滅危惧種の保全の介入を可能にしてきました。それにもかかわらず、ほとんどのプロトコルは、基本的にアンタル卵巣卵胞内の成長段階を完了した卵母細胞を使用し、したがって完全に成長した卵母細胞と呼ばれる。IVP技術が広く使用されている牛では、完全に成長した卵母細胞は約120μmの最終直径に達し、直径2〜8mm(中角毛)1に及ぶ卵胞から採取される。卵胞から分離すると、そのような卵母細胞は体外成熟し、受精する。その後、ジゴテは胚盤胞期まで培養され、レシピエントまたは凍結保存に移される。牛は、他の多くの種だけでなく、IVPによって提供される可能性にもかかわらず、牛1頭当たりのインビトロ産生胚の数は、過去40年間ほとんど改善されなかった。これは、一定の時間に卵巣を取り出し、標準的なIVP,技術4、5、6に供することができる、完全に成長した卵母細胞の数が4限られているためです。56
初期の角包の中に含まれる卵母細胞、すなわち、直径2mm未満の卵胞は、不妊治療保存プログラム7で使用される潜在的な供給源を表し、卵巣は中型角質8よりも約10倍多い初期のアンタル卵胞を含む。しかし、これらの卵母細胞はまだ成長段階にあり、まだ完全に成長した段階9に達していない。したがって、それらはまだ転写活性であり、後の発達段階のために保存されるmRNAを産生し、そして私がかつて濾胞室10、11,11から隔離された明視を自発的に再開して完了させる能力を母細胞に与えるために必要なすべての分化プロセスをまだ受けていない。したがって、標準の in vitro 成熟 (IVM) プロトコルに直接提出することはできませんが、成長フェーズを完了し、適切に区別できる追加の培養期間が必要です。
成長から完全に成長した段階への移行は、牛で卵胞が初期の角質から中型の角質段階に発達したときに起こる、卵母細胞の発達中の重要なステップの一つである。牛では、いくつかの研究は、vitro,,2、12、13、14、15、16、17、18、1912,13,14,15,16でこれらの出来事18を19再現しようとしました。217しかし、現在までに信頼性の高いプロトコルは開発されておらず、限られた成功しか報告されていません。これまでの研究20によると、これらの成長する卵母細胞は均質な集団を構成する。転写活性であることに加えて、それらのクロマチンは、GV0,2,21という名前の構成で、胚性小胞(GV)に分散される。21逆に、中型の卵胞から得られる完全に成長した卵母細胞の集団は、より不均一であり、クロマチン圧縮の様々な程度(GV1、GV2およびGV3)によってミラーリングされる状態である20を観察することができる。これらの中で、以前のデータは、GV2およびGV3卵母細胞がより良い品質およびより高い胚発生能力20、21、22、23、24によって全体的に特徴付けられることを示している。20,21,22,23,24
上記の観察から始めて、初期の角胞から積雲卵母細胞複合体(COC)として分離された卵母細胞の分化を可能にする卵母細胞(L-IVCO)の5日間の長い培養システムについて説明する。この文化戦略は、私たちの研究室で行われた10年の長い研究から進化し、以前に開発された24-48時間の体外卵母細胞培養(IVCO)2、卵母細胞培養中の準備システム23、25および25卵子培養中の亜鉛補充に基づいて根付いています。卵胞刺激ホルモン(FSH)とホスホジエステラーゼ-3(PDE3)阻害剤の組み合わせにより、積雲-卵母細胞通信2を増強することができ、不時の起血再開2を防止し、かつ支持卵母細胞成長2を使用した。
プロトコル
卵巣は、地元のアバトワール(INALCA S.p.A.、オスペダレット・ロディジアーノ、LO、IT 2270M CE、イタリア)で回収された4〜8歳のホルスタイン乳牛から採取された。
1. メディアの準備
注: すべてのメディアは、使用の少なくとも4時間前に準備する必要があります。炭酸水素ナトリウム緩衝培地は、空気中で38.5°C及び5%CO2、 最大湿度でインキュベートされる。HEPES緩衝媒体はサーモスタットオーブンの38.5 °Cで維持される。
- 卵母細胞(L-IVCO)培地の長いインビトロ培養
- 塩基性培養培地(M199-B)の15 mLを調製する:2 mMグルタミンでM199を補う、 0.4%脂肪酸フリーウシ血清アルブミン(BSA)、0.2mMナトリウムピルビン酸、25mM重炭酸ナトリウム、0.1mMシステアミン、フェノールレッドの21.3 μg/mL、カナマイシン75 μg/mL、ポリビニルピロリドン4%分子量360k分子量。
- 保持媒体(M199-H)の3 mLを準備する:M199-Bに5 μMのクロスタミドを加え、35mmペトリ皿に注ぎます。
- L-IVCO培地(M199-L):0.15 μg/mL Zn硫酸塩、10-4 IU/mL FSH、10 ng/mLエストラジオール、50 ng/mLテストステロン、50 ng/mLプロゲステロンおよび5μMシロトサミドを含むサプリメントM199-B。
- 96ウェルコーティングされたプレートの各ウェルにM199-L培地200 μLを入れる。プレートの4つの縁の井戸に滅菌培養水を充填して、蒸発を補い、培養中に適切な湿度を維持します。
- 38.5 °C、5%CO2で空気中、最大湿度でインキュベーターに96ウェルプレートとM199-H培地をインキュベートします。2
- 解剖媒体
- 解剖媒体(M199-D):0.4%BSA画分V、0.164 mMペニシリン、0.048 mMストレプトマイシン、1790単位/Lヘパリンを含むサプリメントM199。M199-Dは、バルクで調製することができ、20 mLアリコートで分配し、6ヶ月間4°Cで保存することができます。必要に応じて、暖かく、1アリコートを補う。
- 5 μMシロスターミド(M199-Dシロスターミド)を補充したM199-Dの20 mLを調製してください。
2. 卵巣の収集と処理
注:特に明記されていない限り、すべての手順は室温(26°C)で行われます。
- 牛からアバトワールで卵巣を回復します。
- 26 – 28 °Cで無菌生理食い (NaCl, 9 g/L) に卵巣を入れて 100 U/mL とレンサプトマイシン 0.1 mg/mL.
- 4時間以内に暖かい滅菌生理学で実験室に臓器を輸送する。
- 26°Cに維持された無菌生理食糸で卵巣4倍を洗浄する。
- -28 mmHgに真空圧を設定した吸引ポンプに接続された吸引ポンプに接続された18G針を使用して直径2mm以上のすべての卵胞を吸引することによって、すべての中から大きな角胞を取り除き、26°Cで無菌生理食糸を持つビーカーに吸引した卵巣を入れる。
注:卵胞>2ミリメートルの含有量の除去は、実験を「汚染」する完全に成長した卵母細胞の源を可能な限り除去するための重要なステップです。 - 水平層流フードの下に、滅菌ポリテトラフルオロエチレンまつばの上に、一度に1つの卵巣を置きます。メスのハンドルに取り付けられた外科用ブレードNo.22を使用して、卵巣皮質(卵胞を含む卵巣の外側の部分)の切り取りスライス、1.5 - 2 mmの厚さと臓器の長軸と平行。
- 38.5°Cの暖かいプレートに解剖媒体で覆われた無菌ガラスペトリ皿に卵巣皮質のスライスを置きます。
注:これからのすべての手順は、暖かいプレートを使用して38.5°Cで行われます。
3. 卵胞の選択と分離とCOCsの検索
- M199-Dの2-3 mLと60ミリメートルガラスペトリ皿に1卵巣皮質スライスを入れます。
- 解剖顕微鏡を使用して、マイクロメートル装備の接眼を使用して0.5〜2mmの間の卵胞を選択します。
- 体型顕微鏡で健康で非無変性の卵胞を特定します。極度の半透明な外観などの形態学的パラメータを内部に暗いCOCで観察することによって、卵胞閉鎖症を評価します。食痛卵胞を捨て、他のすべてを処理します。
- メスのハンドルに取り付けられた外科用ブレードNo.22を使用して、卵胞が片側に露出するまで、片側の卵胞を取り巻く卵巣組織を取り除く。
- 注射器に取り付けられた26G針を使用して、露出した卵胞壁に慎重にスリットを作ります。この作用は、細胞のCOC、濾胞液および塊を含む濾胞含有量を放出する。
- 顕微鏡下でCOCを特定し、細胞質の凝積完全性、透明体完全性および均質性を調べます。これらの基準が満たされている場合は、P20ピペットを使用してCOCを吸引します。
- 分離したCOCをM199-Dシロスターミドに入れる。
- 30分間、分離手順を続行します。
4. インビトロ培養に供するCOCの選定
- 解剖顕微鏡の下で、ステップ3.6の基準に基づいて健康なCOCsを選択する。
- 60 mm ペトリ皿に、M199-D シロスターミド 20 μL の 16 滴を準備し、1 滴当たり 1 つの健全な COC を配置します (図 1A)。
- カメラに取り付けられた反転顕微鏡を使用して、透明帯を除く卵母細胞径を測定し、カメラに付属のソフトウェアを使用する。
- 卵母細胞の明確な可視化により、透明帯を除く2つの垂直測定を行う(図1B)。
- 透明帯を除く2つの卵母細胞の測定値の平均が100~110μmの範囲内にあるかどうかを確認します。丸みを帯びた形状の卵母細胞を持つCOCsまたは測定できない卵母細胞を廃棄します。
- M199-H培地を含む35mm皿に選択したCOCsを移し、38.5°Cおよび5%CO2の空気中のイン2キュベーターに保管し、ステップ5.1まで最大湿度を保ちます。
- ステップ 3 と 4 を最大 4 倍まで繰り返します。全体の作業時間は 2 時間を超えてはなりません。
5. 卵母細胞の長いインビトロ培養(L-IVCO)
- ステップ1.1.5で準備される96ウェルプレートの井戸の中央に井戸ごとに1 COCを移す。
- 38.5 °Cで5日間、空気中の5%CO2、 最大湿度でプレートをインキュベートします。
- 1日おき(2日目および4日目)は、ステップ1に記載されているように新鮮なM199-Lを準備する。
- 培地100μLを取り除き、100μLの新作M199-Lで交換して、培地の半分を更新します。実体顕微鏡で培地の再生を行い、COCをウェルに移動させないようにします。
6. 文化後のCOC分類
- L-IVCOの終わりに、解剖顕微鏡の下でCOCsの形態を分析する。
- 図 2に示すように分類します。
- COCが積雲膨張と細胞変性の兆候のないコンパクトな積雲セル投資を示す場合は、クラス1として分類します。
- COCが積雲膨張と細胞変性の兆候がなく、積雲塊中のアントラムのような形成を伴うコンパクトな積雲細胞投資を示す場合は、クラス2として分類します。
- COCが積雲の膨張の兆候のない積雲細胞のいくつかの層と積雲細胞の外層のいくつかの分解された細胞を示し、アントラムのような形成がない場合は、クラス3として分類します。
- COCが卵母細胞表面の50%以上に及ぶ積雲細胞の豊富な損失、および細胞変性および細胞デブリの徴候を示すならば、クラス4として分類する。
7. 培養後の大動脈進展の評価
- 卵母細胞の否定
- 各COCを、1ウェルあたり199Dの400 μLを含む4ウェルプレートの単一のウェルに入れる。
- 解剖顕微鏡の下で穏やかに130-140 μLに設定されたピペットを使用してピペット処理を繰り返すことによって、機械的に積Mulus細胞を除去する。
- 卵母細胞が積雲投資を解放したら、199Dを含む別の井戸に移します。
- すべての卵母細胞が完全に否定されるまで、プロセスを繰り返します。
- 卵母細胞核染色
注:これからは、すべての手順が室温で行われます。試薬は室温です。- 1時間の間、リン酸緩衝液生理食塩分(PBS)でパラホルムアルデヒド4%の卵母細胞を固定する。
注意:パラホルムアルデヒドを取り扱う際には個人用保護具を着用し、有害廃棄物処理ガイドラインに従って汚染された材料を廃棄してください。 - 卵母細胞を1%ポリビニルアルコール(PVA)を含有するPBSでそれぞれ5分間3倍洗浄します。
注:サンプルは、すぐに処理するか、最大1週間4°Cで保存することができます。 - 0.1%トリトンXを含むPBSに卵母細胞を10分間入れる。
- 卵母細胞を1%PVAを含むPBSでそれぞれ5分間、卵母細胞を3倍洗います。
- 卵母細胞をスライド上に4',6-ジミディミノ-2-フェニリンドール(DAPI)ジラクテート(1 μg/mL)を添加したアンチフェード培地の5μLの滴に単独で置きます。
- カバースリップを上に置くときに卵母細胞の過度の平坦化を避けるために、スライドの長い側面に沿って両面テープの2つのストリップを置きます。
- カバースリップを上に置き、テープに付着させ、すべてのサンプルを処理しながら暗闇の中に保管します。
- DAPIフィルターを搭載した従来の蛍光顕微鏡(励起/放出:358⁄461)を用いて卵母細胞を分析し、卵母細胞のmeiotic進行を評価します。
- 彼らのMeiotic進行に応じて卵母細胞を分類する:GV - GV内のクロマチン凝縮の異なる程度を有する卵母細胞;MI – GV分解から転移Iへの卵母細胞;退化 – 前の段階のいずれにも存在すると識別できなかった卵母細胞。
- 1時間の間、リン酸緩衝液生理食塩分(PBS)でパラホルムアルデヒド4%の卵母細胞を固定する。
結果
L-IVCOの終わりに、図2に示すように、COCの総形態が変化し、4つのクラスが積雲細胞の外観に基づいて同定された。健康なCOCs11、26、27を選択するために11,26,27一般的に採用された形態学的基準に基づいて、クラス1、2、3は健康であると判断され、卵母細胞を取り巻く積雲細胞の完全な層が存在しないなどの変性の明確な徴候を示したクラス4は、重度に重度におよび将来のIVP設定で下流手順を受けるのに不適当と考えられていた。全体として、5つの生物学的複製物中の74個の卵母細胞が分析され、そのうち9.45%がクラス4にあり、さらなる評価から廃棄された。
図3と図4に示すように、L-IVCOの終わりにのmeioticステージの評価は、卵母細胞の有意に高い割合(78.57±4.43%)を示した未成熟な段階で逮捕されたままで、クロマチンは退化することなくGV内に留まり(したがって、GVステージとも呼ばれる)。その中でも、GV2/3構成の59.43%が占められていた。微分Iステージに到達したわずかな割合の微減期が再開された(13.76±5.85%)または退化(7.67±4.61%)。全体として、5つの生物学的複製物中の67個の卵母細胞が分析された。これらのデータは、L-IVCO培養が5日間のmeiotic再開を防止しながら卵母細胞の生存率をサポートしていることを示しています。
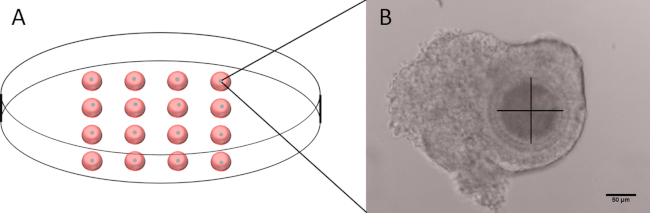
図1:卵母細胞の直径とCOCの代表的な画像を測定するために使用される皿の概要。(A)M199-Dの20 μLの16滴で、それぞれ単一のCOCを含む60 mmペトリ皿の模式図表。(B)直径の測定に使用する軸を持つCOCの代表的な画像。透明帯は含まれていないことに注意してください。スケールバー50 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:収集時およびL-IVCO後のCOCの代表的な画像。(A、B、C、D)上の行 (コレクション) は、検索時の COC を表します。(A', B', C', D')同じCOCは、5日後、L-IVCOの終わりに描かれ、ステップ6.1で報告されたように分類される。下段(5日)は、クラス1に分類されるCOCを表し、膨張および細胞変性の兆候のないコンパクトな積雲セル投資を示す(A');クラス2は、膨張および細胞変性の兆候がなく、積雲塊(B')中のアントルム様形成(矢印)を有するコンパクトな積雲細胞投資を示す。クラス3は、積雲細胞の外層に積雲膨張の兆候がなく、いくつかの分解細胞を有する積雲細胞のいくつかの層を示す(C');クラス4は、卵母細胞表面の50%以上の上に積雲細胞の豊富な損失を示し、細胞変性および細胞デブリの徴候(D')を示す。スケールバー 40 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
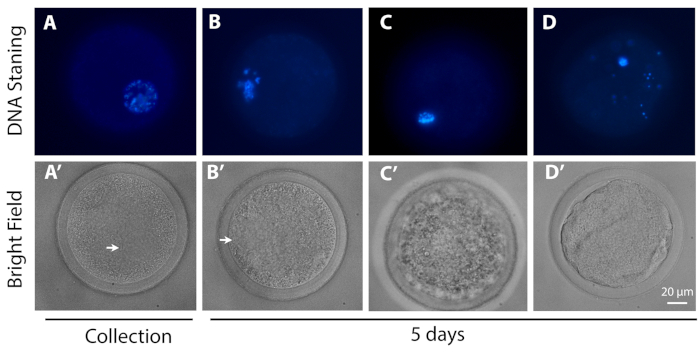
図3:大動脈進行の代表的な画像。上段(DNA染色)は、代表卵母細胞のDNA(青色)を示し、GV0段階および(B)GV2様構成、(C)MIステージおよびC(D)脱退卵細胞、(A)を回収時に(B、C、D)L-IVCOの5日後に示す。A下段は、上段の卵母細胞の明るいフィールドの対応する画像です。矢印は GV を示します。スケールバー20 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:培養終了時における卵母細胞のMの大動脈進行。棒グラフは、L-IVCOの終わりにGVおよびMI段階および退化卵子での卵母細胞の分布を表す。クラス4で以前に分類された卵母細胞は除外された。データは一方向のANOVAによって分析され、続いてTukeyの多重比較検定が行われ、値はSEM±意味である(N=5;P<0.05)。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここでは、卵母細胞の生存率をサポートし、そして、meiotic再開を防止することによって、5日間の卵母細胞の発達を促進する培養システムについて説明する。この後者の側面は、大腸分裂の早期再開によって妨げられる、大腸および胚発生能力22、2020と卵母細胞を与えるために必要な継続的な成長と分化を可能にするために最も重要である。
この培養系を開発する際に、卵胞に生じる生理的成長と分化のいくつかの特徴を考慮に入れた。このセクションでは、この戦略を開発する際に考慮した主な側面の概要を説明します。
まず、ウシ初期の角質卵胞で卵母細胞を成長させると、成長から完全に成長したステージin vivo88,1919への移行を受けるのに約5日かかる。したがって、卵母細胞が24時間2まで培養された私たちの研究室で行われた以前の試みとは対照的に、培養の長さは5日に増加しました。
L-IVCOに含まれるもう一つの要因は、CCSが濾胞液の生理学的粘度を模倣するように培養される培地の粘度の増加であった。これは4%PVPを添加して再現し、コラーゲンIコーティング培養表面を用いて、従来の研究13によって報告されたように、培養物のような3Dの形成を促進した。
シロスターミドは、PDE3阻害剤であり、GV段階で軟膏的に逮捕された卵母細胞を維持するために添加され、卵母,細胞2、19、25、28、2919,内に高レベルの環状ヌクレオチドを保持することによって、起血性の軟骨再開を防28,29ぐ。225我々の結果は、シロスターミドによる5日間の治療がCOCsの健康に大きな影響を及ぼさないことを示し、複合体のほんの一部のみが退化し、またAlamららが得た結果と一致している。
Zn硫酸塩の含み、およびその濃度は、この微量元素が培養30で成長するウシの分化および転写活性を支持する役割を有することを示す最近の結果によって実証される。
最後に、初期のアンタル卵胞31、32、33,32の典型的な生理的ホルモンミリューを密接に模倣するためにホルモンの組み合わせが33導入された。例えばエストラジオールは、卵母細胞の成長を支援する活動を知っています16,,17,,19と顆粒球細胞間の接続17,また、meiotic能力の獲得を促進しながら34.同様に、テストステロンは、エストラジオールの前駆体であることに加えて、濾胞の成長および発達35を刺激する一方、プロゲステロンは主にその抗アポトーシス活性36のために添加された。
重要であり、我々の以前の研究2と一致して、FSHの濃度は、成長期のために生理学的である濃度に保たれた。実際、低いFSH濃度は、卵母細胞と交付された積雲細胞との間のギャップ接合媒介通信を維持することによって卵母細胞の発達を促進し、そして、大動脈再開を誘発することなく転写活性および卵母細胞分化を促進する2。
私たちの経験では、L-IVCOの成功のための鍵の1つは、初期の角胞から来る健康なCOCの均質な集団の選択です。文献中のデータによると、初期の角胞から採取された卵母細胞の80%は、GV020と呼ぶ構成で組織されたクロマチンによって特徴付けられる。この均質性は、原則として培養環境に曝露された場合に細胞が同様に動作することを保証するように、インビトロ培養の利点を表します。このことを念頭に置いて、COCsの収集は、より少ないまたはより高度な分化段階から来るCOCの「汚染」を最小限に抑えるために実行されなければなりません。しかし、皮質スライスの処理は非常に時間がかかり、比較的短時間で行われるべきであるという事実のために、収集/選択ステップはおそらくL-IVCOの最も重要な通路を表す。そのためには、いくつかの重要な考慮事項を念頭に置いておくべきです。
例えば、研究者/技術者は、濾胞閉鎖症の徴候を伴う卵胞を認識して廃棄するように訓練される必要があります。この段階では、非常に明確な半透明の外観や内部の暗いCOCの存在など、不全卵胞を認識するために形態学的パラメータのみを使用できます。食毒の徴候が明確に識別できない他のすべての卵胞は開かれ、そして、孤立したCOCsの形態に基づいてさらに選択を行うべきである22、3、37、38、39。,3,37,38,39これは、積雲細胞の少なくとも4層の存在のような形態学的観察によって再び達成される、グロス球形、無傷のオーレンマおよび均質で細かく粒状の卵母斑11、26、27。11,26,27
COCの分離と操作は、実体顕微鏡下でのマイクロ解剖のための熟練した人員と適切な機器と卵母細胞径の正確な決定を必要とする追加の技術的課題を表しています。この最後のステップは、卵母細胞の均一な集団を選択するために不可欠であり、したがって、他の濾胞段階から来るCOCとの汚染の可能な原因を除外する。このため、取得したCOCsに囲まれた卵母細胞の直径が100~110μm22,4040であることを確認することが重要です。
L-IVCOは卵母細胞の生存率をサポートし、meiotic再開を防ぐだけでなく、卵母細胞の59%でGV0から徐々に凝縮されたGV2およびGV3へのクロマチン構成の移行を促進した。特にGV内のクロマチン縮合は、これまで研究した基本的にすべての哺乳類卵母細胞における、大腸および発達能力の「ゲイン」のマーカーである20。この結果は、特に過去24時間のIVCOシステムと比較した場合、非常に有望です。その研究では、GV内のクロマチン圧縮の最高度に達しておらず、卵母細胞の22%がGV1構成2、完全な大腸能力に関連する段階であるが、まだ発達能力が乏しい20と見なされた。これらの条件であっても、それ以外の無能な成長卵母細胞は、限られた量ではあるが、成熟し、胚を産生することができた。したがって、L-IVCOで観察されたGV2/3段階の一貫した増加は、生存可能な胚を産生する高い可能性と互換性がある。我々は、L-IVCOに由来するCOCSをIVP(体外成熟、受精、胚培養から胚盤胞期まで)に提出することによって、この仮説を実験的に検証中である。確認されれば、L-IVCOは卵巣予備軍のまだ未利用の可能性の一部を解き放ち、女性の生殖能力保存に関心のあるいくつかの分野に重要な意味を持つ。例えば、それは高い遺伝的メリットブリーダーの保存プログラムで使用される受精可能な配偶子の供給源を増加させる。私たちが予見するもう一つのアプリケーションは、ボビッドファミリーの絶滅危惧種の遺伝的救済のためだけでなく、宇宙失礼な品種の広範な拡散のために絶滅の危機に瀕しているか、遺伝的侵食の危険にさらされている地元の品種の遺伝的救済のためである。最後に、L-IVCOは、有能な製液の形成を調節する細胞および分子プロセスを解剖することに興味を持っているすべての科学者のためのツールを表しています。
開示事項
著者らは開示するものは何もない。
謝辞
この作業は、リージョンロンバルディア PSR INNOVA n.201801061529 および UNIMI n.PSR 2019_DIP_027_ALUCI_01によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 4-well dishes | Nunclon | 179830 | |
| 96-well dish | Becton Dickinson Biosciences | 356649 | BioCoat™ Collagen I |
| Bovine Serum Albumin (Fatty acid free) | Sigma | A8806 | |
| Bovine Serum Albumin (Fraction V) | Sigma | A3311 | |
| Cell culture water | Sigma | W3500 | |
| Cilostamide | Sigma | C7971 | |
| Cysteamine | Sigma | M9768 | |
| Digital camera | Nikon Corp | Camera DS-5M | |
| Disodium phosphate | Sigma | S5136 | |
| Estradiol | Sigma | E2758 | |
| Glutamax Supplement | Thermo Fisher Scientific | 35050061 | |
| Gonal F | Merck Serono | ||
| Heparin | Sigma | H3149 | |
| HEPES | Sigma | H3784 | |
| Vacuum pump | Cook-IVF | KMAR-5100 | |
| Incubator | Sanyo | ||
| Kanamycin sulfate from Streptomyces kanamyceticus | Sigma | K1377 | |
| Medium 199 | Sigma | M3769 | Powder for bicarbonate-buffered media |
| Medium 199 | Sigma | M2520 | Powder for HEPES-buffered media |
| Microscope | Nikon Corp | Nikon Diaphot | |
| Microscope | Nikon Corp | Eclipse E 600 | |
| Monopotassium phosphate | Sigma | P5655 | |
| Paraformaldehyde | Sigma | 158127 | |
| Penicilin | Sigma | P3032 | |
| Phenol Red | Sigma | P5530 | |
| Polyvinyl alcohol | Sigma | P8137 | |
| Polyvinylpyrrolidone | Sigma | P5288 | 360k molecular weight |
| Potassium chloride | Sigma | P5405 | |
| Progesterone | Sigma | P8783 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium choride | Sigma | P5886 | |
| Sodium pyruvate | Sigma | P4562 | |
| Streptomycin | Sigma | S9137 | |
| Testosterone | Sigma | 86500 | |
| Triton X | Sigma | T9284 | |
| Vectashield with DAPI | Vector Laboratories | H1200 | |
| Water | Sigma | W3500 | |
| Zinc sulfate heptahydrate | Sigma | Z0251 |
参考文献
- Lonergan, P., Fair, T. Maturation of Oocytes in Vitro. Annual Review of Animal Biosciences. 4, 255-268 (2016).
- Luciano, A. M., Franciosi, F., Modina, S. C., Lodde, V. Gap junction-mediated communications regulate chromatin remodeling during bovine oocyte growth and differentiation through cAMP-dependent mechanism(s). Biology of Reproduction. 85 (6), 1252-1259 (2011).
- McLaughlin, M., Telfer, E. E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Galli, C. Achievements and unmet promises of assisted reproduction technologies in large animals: a per-sonal perspective. Animal Reproduction. 14 (3), 614-621 (2017).
- Luciano, A. M., Sirard, M. A. Successful in vitro maturation of oocytes: a matter of follicular differentiation. Biology of Reproduction. 98 (2), 162-169 (2018).
- Lonergan, P., Fair, T. In vitro-produced bovine embryos: dealing with the warts. Theriogenology. 69 (1), 17-22 (2008).
- Clement, M. D. F., Dalbies-Tran, R., Estienne, A., Fabre, S., Mansanet, C., Monget, P. The ovarian reserve of primordial follicles and the dynamic reserve of antral growing follicles: what is the link. Biology of Reproduction. 90 (4), 85(2014).
- Lussier, J. G., Matton, P., Dufour, J. J. Growth rates of follicles in the ovary of the cow. Journal of Reproduction and Fertility. 81 (2), 301-307 (1987).
- Fair, T., Hulshof, S. C., Hyttel, P., Greve, T., Boland, M. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anatomy and Embryology (Berlin). 195 (4), 327-336 (1997).
- Pavlok, A., Lucas-Hahn, A., Niemann, H. Fertilization and developmental competence of bovine oocytes derived from different categories of antral follicles. Molecular Reproduction and Development. 31 (1), 63-67 (1992).
- Blondin, P., Sirard, M. A. Oocyte and follicular morphology as determining characteristics for developmental competence in bovine oocytes. Molecular Reproduction and Development. 41 (1), 54-62 (1995).
- Harada, M., et al. Bovine oocytes from early antral follicles grow to meiotic competence in vitro: effect of FSH and hypoxanthine. Theriogenology. 48 (5), 743-755 (1997).
- Hirao, Y., et al. In vitro growth and development of bovine oocyte-granulosa cell complexes on the flat substratum: effects of high polyvinylpyrrolidone concentration in culture medium. Biology of Reproduction. 70 (1), 83-91 (2004).
- Alm, H., Katska-Ksiazkiewicz, L., Rynska, B., Tuchscherer, A. Survival and meiotic competence of bovine oocytes originating from early antral ovarian follicles. Theriogenology. 65 (7), 1422-1434 (2006).
- Taketsuru, H., et al. Bovine oocytes in secondary follicles grow in medium containing bovine plasma after vitrification. Journal of Reproduction and Development. 57 (1), 99-106 (2011).
- Endo, M., et al. Estradiol supports in vitro development of bovine early antral follicles. Reproduction. 145 (1), 85-96 (2013).
- Makita, M., Miyano, T. Steroid hormones promote bovine oocyte growth and connection with granulosa cells. Theriogenology. 82 (4), 605-612 (2014).
- Yamamoto, K., et al. Development to live young from bovine small oocytes after growth, maturation and fertilization in vitro. Theriogenology. 52 (1), 81-89 (1999).
- Alam, M. H., Lee, J., Miyano, T. Inhibition of PDE3A sustains meiotic arrest and gap junction of bovine growing oocytes in in vitro growth culture. Theriogenology. 118, 110-118 (2018).
- Lodde, V., Modina, S., Galbusera, C., Franciosi, F., Luciano, A. M. Large-scale chromatin remodeling in germinal vesicle bovine oocytes: interplay with gap junction functionality and developmental competence. Molecular Reproduction and Development. 74 (6), 740-749 (2007).
- Lodde, V., et al. Oocyte morphology and transcriptional silencing in relation to chromatin remodeling during the final phases of bovine oocyte growth. Molecular Reproduction and Development. 75 (5), 915-924 (2008).
- Dieci, C., et al. Differences in cumulus cell gene expression indicate the benefit of a pre-maturation step to improve in-vitro bovine embryo production. Molecular Human Reproduction. 22 (12), 882-897 (2016).
- Soares, A. C. S., et al. Steroid hormones interact with natriuretic peptide C to delay nuclear maturation, to maintain oocyte-cumulus communication and to improve the quality of in vitro-produced embryos in cattle. Reproduction, Fertililty and Development. 29 (11), 2217-2224 (2017).
- Soares, A. C. S., et al. Characterization and control of oocyte large-scale chromatin configuration in different cattle breeds. Theriogenology. 141, 146-152 (2020).
- Franciosi, F., et al. Natriuretic peptide precursor C delays meiotic resumption and sustains gap junction-mediated communication in bovine cumulus-enclosed oocytes. Biology of Reproduction. 91 (3), 61(2014).
- Luciano, A. M., et al. Effect of different levels of intracellular cAMP on the in vitro maturation of cattle oocytes and their subsequent development following in vitro fertilization. Molecular Reproduction and Development. 54 (1), 86-91 (1999).
- Bilodeau-Goeseels, S., Panich, P. Effects of oocyte quality on development and transcriptional activity in early bovine embryos. Animal Reproduction Science. 71 (3-4), 143-155 (2002).
- Dieci, C., et al. The effect of cilostamide on gap junction communication dynamics, chromatin remodeling, and competence acquisition in pig oocytes following parthenogenetic activation and nuclear transfer. Biology of Reproduction. 89 (3), 68(2013).
- Shu, Y. M., et al. Effects of cilostamide and forskolin on the meiotic resumption and embryonic development of immature human oocytes. Human Reproduction. 23 (3), 504-513 (2008).
- Lodde, V., et al. Zinc supports transcription and improves meiotic competence of growing bovine oocytes. Reproduction. 159 (6), 679-691 (2020).
- Henderson, K. M., McNeilly, A. S., Swanston, I. A. Gonadotrophin and steroid concentrations in bovine follicular fluid and their relationship to follicle size. Journal of Reproduction and Fertility. 65 (2), 467-473 (1982).
- Kruip, T. A., Dieleman, S. J. Steroid hormone concentrations in the fluid of bovine follicles relative to size, quality and stage of the oestrus cycle. Theriogenology. 24 (4), 395-408 (1985).
- Sakaguchi, K., et al. Relationships between the antral follicle count, steroidogenesis, and secretion of follicle-stimulating hormone and anti-Mullerian hormone during follicular growth in cattle. Reproductive Biology and Endocrinology. 17 (1), 88(2019).
- Makita, M., Miyano, T. Androgens promote the acquisition of maturation competence in bovine oocytes. Journal of Reproduction and Development. 61 (3), 211-217 (2015).
- Walters, K. A., Allan, C. M., Handelsman, D. J. Androgen actions and the ovary. Biology of Reproduction. 78 (3), 380-389 (2008).
- Luciano, A. M., Pappalardo, A., Ray, C., Peluso, J. J. Epidermal growth factor inhibits large granulosa cell apoptosis by stimulating progesterone synthesis and regulating the distribution of intracellular free calcium. Biology of Reproduction. 51 (4), 646-654 (1994).
- Gordon, I. Laboratory Production of Cattle Embryos, 2nd edn. , CABI Publishing. (2003).
- Telfer, E. E., McLaughlin, M., Ding, C., Thong, K. J. A two-step serum-free culture system supports development of human oocytes from primordial follicles in the presence of activin. Human Reproduction. 23 (5), 1151-1158 (2008).
- McLaughlin, M., Albertini, D. F., Wallace, W. H. B., Anderson, R. A., Telfer, E. E. Metaphase II oocytes from human unilaminar follicles grown in a multi-step culture system. Molecular Human Reproduction. 24 (3), 135-142 (2018).
- Fair, T., Hyttel, P., Greve, T. Bovine oocyte diameter in relation to maturational competence and transcriptional activity. Molecular Reproduction and Development. 42 (4), 437-442 (1995).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved