Method Article
Strategia di coltura in vitro per oociti dal follicolo antralico precoce nel bestiame
In questo articolo
Riepilogo
Descriviamo le procedure per l'isolamento degli ovociti di crescita dai follicoli ovaiosi nelle prime fasi di sviluppo, nonché l'installazione di un sistema di coltura in vitro in grado di sostenere la crescita e la differenziazione fino allo stadio completamente cresciuto.
Abstract
La riserva limitata di oociti maturi e fertilizzanti rappresenta una grande barriera per il successo della riproduzione assistita nei mammiferi. Considerando che durante la durata della vita riproduttiva solo circa l'1% degli ovociti in un ovaio maturo e ovulato, sono state sviluppate diverse tecniche per aumentare lo sfruttamento della riserva ovarica alla crescente popolazione di follicoli non ovulatori. Tali tecnologie hanno permesso interventi di conservazione della fertilità, programmi di selezione nel bestiame e conservazione delle specie in via di estinzione. Tuttavia, il vasto potenziale della riserva ovarica è ancora in gran parte non sfruttato. Nelle mucche, ad esempio, sono stati fatti alcuni tentativi di sostenere la coltura in vitro degli ociociti in fasi di sviluppo specifiche, ma non sono ancora stati sviluppati protocolli efficienti e affidabili. Qui descriviamo un sistema di coltura che riproduce le condizioni fisiologiche del corrispondente stadio follicolare, definito per sviluppare ovociti di crescita in vitro raccolti dai follicoli antrali primi bovini allo stadio completamente cresciuto, corrispondente al follicolo antralco medio in vivo. Una combinazione di ormoni e un inibitore fosfodiesterase 3 è stato utilizzato per prevenire la ripresa meiotica intempestivo e per guidare la differenziazione degli ovociti.
Introduzione
Durante la durata della vita riproduttiva, solo una frazione minima degli oociti che sono presenti in un maturo ovarico, vengono rilasciati nelle tube di Falloppio dopo l'ovulazione e sono disponibili per essere fecondati e svilupparsi in un embrionevitale 1. D'altra parte, la maggior parte degli oociti all'interno di un'ovaia subiscono atresia e non sono mai ovulati. Le tecnologie di produzione di embrioni in vitro (IVP) hanno tentato di aumentare lo sfruttamento della riservaovarica 2,3. Finora, tali tecnologie hanno permesso interventi di conservazione della fertilità, programmi di selezione nel bestiame e conservazione delle specie in via di estinzione. Tuttavia, la maggior parte dei protocolli utilizza oociti che hanno fondamentalmente completato la fase di crescita all'interno del follicolo ovarico astrale, e quindi sono indicati come oociti completamente cresciuti. Nei bovini, dove le tecnologie IVP sono ampiamente utilizzate, gli ovociti completamente cresciuti raggiungono un diametro finale di circa 120 m e vengono raccolti da follicoli che si estendono da 2 a 8 mm di diametro (follicoli antrali medi)1. Dopo l'isolamento dai follicoli, tali oociti sono in vitro maturati e fecondati. Gli zigoti vengono poi rilaccati fino alla fase di blastocisti e trasferiti in un destinatario o crioconservati. Nel bestiame, così come in molte altre specie, nonostante il potenziale offerto dall'IVP, il numero di embrioni prodotti in vitro per mucca non è migliorato in gran parte negli ultimi 40 anni. Ciò è in parte dovuto al numero limitato di ovociti completamente cresciuti che popolano un'ovaia in un dato momento che può essere recuperata e sottoposta a tecniche IVP standard4,5,6.
Gli ovociti racchiusi all'interno dei primi follicoli antrali, cioè quei follicoli di diametro inferiore a 2 mm, rappresentano una potenziale fonte da utilizzare nei programmi di conservazione dellafertilità 7 , poiché un'ovaia contiene approssimativamente 10 volte più follicoli antrali precoci rispetto al medio antral8. Tuttavia, questi oociti sono ancora in fase di crescita e non hanno ancora raggiunto la fase9completamente cresciuta . Come tale, sono ancora trascrizionalmente attivi, producendo mRNA che saranno conservati per fasi successive di sviluppo, e non hanno ancora subito tutto il processo di differenziazione necessario per conferire agli ovociti la capacità di riprendere e completare spontaneamente la meiosi che una volta isolato dal compartimento follicolare10,11. Pertanto, non possono essere sottoposti direttamente ai protocolli standard di maturazione in vitro (IVM), ma richiedono un ulteriore periodo di coltura che permetta loro di completare la fase di crescita e differenziare correttamente.
La transizione dallo stadio di crescita a quello completamente cresciuto, che nel bestiame si verifica quando il follicolo si sviluppa dallo stadio astrale iniziale allo stadio astrale medio, è uno dei passaggi critici durante lo sviluppo degli ovociti. Nel bestiame, diversi studi hanno tentato di ricapitolare questi eventi in vitro2,12,13,14,15,16,17,18,19. Tuttavia, ad oggi non sono stati sviluppati protocolli affidabili e sono stati segnalati solo un successo limitato. Secondo gli studi precedenti20, questi ovociti in crescita costituiscono una popolazione omogenea. Oltre ad essere trascrizionalmente attivo, la loro cromatina è dispersa nel vescicolo germino (GV), in una configurazione denominata GV02,21. Al contrario, la popolazione di oociti completamente cresciuti ottenuti da follicoli antrali medi è più eterogenea, una condizione che si riflette con i vari gradi di compattazione della cromatina (GV1, GV2 e GV3) che possono essere osservati20. Tra questi, i dati precedenti hanno dimostrato che gli oociti GV2 e GV3 sono complessivamente caratterizzati da una migliore qualità e una maggiore competenza dello sviluppoembrionale 20,21,22,23,24.
A partire dalle osservazioni di cui sopra, qui descriviamo un sistema di coltura di 5 giorni di ovociti (L-IVCO) che permette la differenziazione degli ovociti isolati come complessi cumuli-oociti (COC) dai primi follicoli astrali. Questa strategia culturale si è evoluta da 10 anni di studi condotti nel nostro laboratorio e affonda le sue radici sulla 24-48 ore di coltura ociocita in vitro precedentemente sviluppata (IVCO)2, sistemi diprematurazione 23,25 e il completamento dello zinco durante la coltura degli oocidi . Una combinazione di ormone stimolante follicolo (FSH) e un inibitore fosfodiesterase-3 (PDE3), in grado di migliorare la comunicazione cumulus-oocita2, prevenire la ripresa meiotica intempese2, e supporto crescita ovocita2 è stato utilizzato.
Protocollo
Le ovaie sono state raccolte da 4 a 8 anni di vacche da latte Holstein recuperate presso il mattatoio locale (INALCA S.p.A., Ospedaletto Lodigiano, LO, IT 2270M CE, Italia).
1. Preparazione dei supporti
NOTA: tutti i supporti devono essere preparati almeno quattro ore prima dell'uso. I supporti tamponi di bicarbonato di sodio vengono incubati a 38,5 gradi centigradi e al 5% di CO2 nell'aria, massima umidità. I supporti tamponati HEPES sono mantenuti a 38,5 gradi centigradi in forno termostatico.
- Lunga coltura in vitro di oociti (L-IVCO) media
- Preparare 15 mL del mezzo di coltura di base (M199-B): Supplemento M199 con glutammina da 2 mM, 0,4% di albumina di siero bovino senza acido grasso (BSA), piruvato di sodio da 0,2 mM, 25 mM di bicarbonato di sodio, 0,1 mM di cistamina, 21,3 g/mL di rosso fenolo, 75 g/mL di kanamycin e 4% Polyvinylpyrrolidone (PVP; 360 k peso molecolare).
- Preparare 3 mL del supporto di tenuta (M199-H): per M199-B aggiungere 5 cilostamide di mM e versarlo in un piatto Petri da 35 mm.
- Preparare il mezzo L-IVCO (M199-L): Supplemento M199-B con 0,15 g/mL di solfato, 10-4 IU/mL FSH, 10 ng/mL estradiolo, 50 ng/mL di testosterone, 50 ng/mL progesterone e 5 M .
- Mettere 200 L di M199-L in ogni pozzo della piastra ben rivestita 96. Riempire i pozzi nei quattro bordi del piatto con acqua di coltura sterile per compensare l'evaporazione e mantenere l'umidità appropriata durante la coltura.
- Incubare la piastra del pozzo 96 e il mezzo M199-H nell'incubatrice a 38,5 gradi centigradi e 5% di CO2 in aria, umidità massima.
- Media di dissezione
- Preparare il mezzo di dissezione (M199-D): Supplemento M199 con 0,4% BSA frazione V, 0,164 mM penicillina, 0,048 mM streptomicina, 1790 unità/L epaina. M199-D può essere preparato alla rinfusa, erogato in aliquots da 20 mL e conservato a 4 gradi centigradi per 6 mesi. Quando necessario, caldo e supplemento 1 aliquot.
- Preparare 20 mL di M199-D integrato con cilostamide 5 M (cilostamide M199-D).
2. Raccolta e lavorazione delle ovaie
NOTA: Tutte le procedure sono condotte a temperatura ambiente (26 gradi centigradi) se non diversamente indicato.
- Recuperare le ovaie al mattatoio dalle mucche.
- Mettere le ovaie in salina sterile (NaCl, 9 g/L) a 26 – 28 gradi centigradi aggiunti con penicillina 100 U/mL e streptomicina 0,1 mg/mL.
- Trasportare gli organi in laboratorio in calda salina sterile entro 4 h.
- Lavare le ovaie 4x in saline sterile mantenute a 26 gradi centigradi.
- Rimuovere tutti i follicoli astrali medio-grandi aspirando tutti i follicoli di diametro superiore a 2 mm utilizzando un ago da 18 G collegato a una pompa di aspirazione con pressione sottovuoto fissata a -28 mmHg e posizionare le ovaie aspirate in un becher con salina sterile a 26 gradi centigradi.
NOTA: La rimozione del contenuto dei follicoli > 2 mm è un passo fondamentale per rimuovere il più possibile la fonte di ovociti completamente cresciuti che "contaminano" l'esperimento. - Sotto un cappuccio a flusso laminare orizzontale, posizionare un'ovaia al momento su un tagliere sterile di politetrafluoroetilene. Utilizzando una lama chirurgica n. 22 montata su una maniglia del bisturi, tagliare fette di corteccia ovarica (la parte esterna dell'ovaio, che contiene i follicoli), spessa 1,5 – 2 mm e parallela all'asse maggiore dell'organo.
- Mettere le fette di corteccia ovarica in un piatto Petri di vetro sterile coperto con mezzo di sezionazione su un piatto caldo a 38,5 gradi centigradi.
NOTA: D'ora in tempo in tempo in tempo in su tutte le procedure vengono eseguite a 38,5 gradi centigradi utilizzando una piastra calda.
3. Selezione e isolamento dei follicoli e recupero dei COC
- Mettere una sezione di corteccia ovarica in un piatto Petri di vetro da 60 mm con 2-3 mL di M199-D.
- Utilizzando un microscopio di dissezione, selezionare i follicoli tra 0,5 e 2 mm utilizzando un oculare dotato di micrometro.
- Identificare i follicoli sani e non atretici sotto lo stereomicroscopio. Valutare l'atresia follicola osservando parametri morfologici, come un aspetto traslucido molto chiaro, con un COC scuro all'interno. Scartare i follicoli atretici ed elaborare tutti gli altri.
- Utilizzando una lama chirurgica n. 22 montata su una maniglia del bisturi rimuovere il tessuto ovarico che circonda il follicolo su un lato fino a quando il follicolo è esposto su un bordo.
- Utilizzando un ago 26G montato su una siringa, fare con attenzione una fessura nella parete del follicolo esposto. Questa azione rilascerà il contenuto follicolare, che comprende il COC, il liquido follicolare e i grumi di cellule.
- Identificare il COC al microscopio ed esaminare l'integrità del cumulo, l'integrità della zona pellucida e l'omogeneità del citoplasma. Se questi criteri sono soddisfatti, aspirare il COC utilizzando una pipetta P20.
- Posizionare il COC isolato in cilostamide M199-D.
- Continuare la procedura di isolamento per 30 min.
4. Selezione di COC da sottopose alla coltura in vitro
- Sotto il microscopio di dissezione, selezionare COC sani in base ai criteri al punto 3.6.
- In un piatto Petri da 60 mm, preparare 16 gocce di 20 L di cilostamide M199-D e inserire un COC sano per goccia (Figura 1A).
- Utilizzando un microscopio invertito collegato a una telecamera misurare il diametro degli ovociti, escludendo la zona pellucida, utilizzando il software fornito con la fotocamera.
- Con una chiara visualizzazione dell'ovocita, effettuare due misurazioni perpendicolari escludendo la zona pellucida (Figura 1B).
- Assicurarsi se la media della misura dei due ovociti, esclusa la zona pellucida, è compresa in un intervallo di 100 – 110 m. Scartare i COC con ovocita a forma non arrotondata o con ovociti non misurabili.
- Trasferire i COC selezionati in un piatto da 35 mm contenente il mezzo M199-H e conservarli nell'incubatrice a 38,5 gradi centigradi e al 5% di CO2 nell'aria, umidità massima fino al punto 5.1.
- Ripetere i passaggi 3 e 4 fino a 4x. L'orario di lavoro complessivo non deve superare i 2 h.
5. Lunga coltura in vitro degli oociti (L-IVCO)
- Trasferire un COC per pozzo al centro di un pozzo della piastra del pozzo 96 da preparare al punto 1.1.5.
- Incubare la piastra per 5 giorni a 38,5 gradi centigradi e 5% CO2 in aria, umidità massima.
- Ogni due giorni (giorno 2 e giorno 4) preparare M199-L fresco come descritto nel passaggio 1.
- Rinnovare metà del mezzo rimuovendo 100 L di media e sostituendo con 100 L di M199-L appena preparato. Eseguire il rinnovo medio sotto lo stereomicroscopio ed evitare di spostare i COC nel pozzo.
6. Classificazione COC dopo la cultura
- Alla fine del L-IVCO, analizzare la morfologia dei COC sotto il microscopio di dissezione.
- Classificare come illustrato nella Figura 2.
- Classificare come Classe 1 se i COC mostrano un investimento compatto nelle cellule cumulo senza alcun segno di espansione del cumulo e degenerazione cellulare.
- Classificare come Classe 2 se i COC mostrano un investimento compatto delle cellule cumulo senza alcun segno di espansione cumulo e degenerazione cellulare e con formazione simile ad antrum nella massa cumulo.
- Classificare come classe 3 se i COC mostrano diversi strati di cellule cumuli senza alcun segno di espansione del cumulo e alcune cellule disaggrede nello strato esterno delle cellule cumuli e nessuna formazione simile a un antrum.
- Classificare come classe 4 se i COC mostrano un'abbondante perdita di cellule cumuli che si estendono per oltre il 50% della superficie degli oocici e segni di degenerazione cellulare e detriti cellulari.
7. Valutazione della progressione meiotica dopo la cultura
- Denudazione oocita
- Mettere ogni COC in un unico pozzo di una piastra a quattro po ' contenente 400 L di 199D per pozzo.
- Sotto un microscopio di dissezione rimuovere delicatamente le cellule cumuli meccanicamente ripetendo pipetta utilizzando una pipetta impostata a 130-140 L.
- Una volta che gli oociti sono liberi dall'investimento cumulo, trasferirli in un altro pozzo contenente 199D.
- Ripetere il processo fino a quando tutti gli ovociti sono completamente denudati.
- Colorazione nucleare di Oocite
NOTA: D'ora in tempo in tempo in tempo in su tutte le procedure vengono eseguite a temperatura ambiente. I reagenti sono a temperatura ambiente.- Fissare gli oociti in paraformaldeide 4% in fosfato tampone salina (PBS) per 1 h.
CAUTION: Indossare dispositivi di protezione personale durante la movimentazione della paraformaldeide e smaltire i materiali contaminati in conformità con le linee guida per lo smaltimento dei rifiuti pericolosi. - Lavare gli ovociti 3x per 5 minuti ciascuno in PBS contenenti 1% polivinilalcoolo (PVA).
NOTA: I campioni possono essere elaborati immediatamente o conservati a 4 gradi centigradi per un massimo di una settimana. - Inserire gli oociti in PBS contenenti 0,1% Triton X per 10 min.
- Lavare gli ovociti 3x per 5 minuti ciascuno in PBS contenenti 1% PVA.
- Posizionare singolarmente gli ovociti in gocce di 5 L di mezzo antifade integrato con 4',6-diamidino-2-phenylindole (DAPI) dilacato (1 g/mL) su uno scivolo.
- Posizionare due strisce di nastro adesivo su due lati lungo i lati lunghi dello scivolo, per evitare un'eccessiva appiattimento degli oociti quando si mette la slitta di copertura sulla parte superiore.
- Posizionare il coperchio sulla parte superiore, farlo aderire al nastro e tenere al buio durante l'elaborazione di tutti i campioni.
- Analizzare gli oociti utilizzando un microscopio epifluorescenza convenzionale dotato di filtri DAPI (Eccitazione/Emissione: 358-461) per valutare la progressione meiotica degli oociti.
- Classificare gli oociti in base alla loro progressione meiotica: GV - oociti con diversi gradi di condensazione della cromatina all'interno del GV; MI – ovociti da GV che si rompono alla metafazione I; e degenerati – oociti che non potevano essere identificati come in nessuna delle fasi precedenti.
- Fissare gli oociti in paraformaldeide 4% in fosfato tampone salina (PBS) per 1 h.
Risultati
Alla fine del L-IVCO, la morfologia lorda dei COC è cambiata e 4 classi sono state identificate in base all'aspetto delle cellule cumuli, come mostrato nella Figura 2. Sulla base dei criteri morfologici comunemente adottati per selezionare i COCsani 11,26,27, le classi 1, 2 e 3 sono state giudicate sane, mentre la classe 4, che mostrava chiari segni di degenerazione come l'assenza di strati completi di cellule cumuli che circondano gli ovociti, sono stati considerati gravemente compromessi e inadatti a sottoporsi a procedure a valle in un potenziale ambiente IVP. Complessivamente, sono stati analizzati 74 oociti in 5 repliche biologiche, di cui il 9,45% nella classe 4 e sono stati scartati da ulteriori valutazioni.
Come illustrato nella Figura 3 e nella Figura 4, la valutazione della fase meiotica alla fine del L-IVCO ha mostrato che una percentuale significativamente più elevata degli oociti (78,57 ± 4,43%) rimase arrestato nella fase immatura, con la cromatina ancora racchiusa all'interno del GV (quindi, indicato anche come stadio GV), senza degenerare. Tra questi il 59,43% era in una configurazione GV2/3. Una piccola percentuale ha ripreso la meiosi raggiungendo la fase metafsia I (13,76 ± 5,85%) o degenerare (7,67 ± 4,61%). Complessivamente, sono stati analizzati 67 oociti in 5 repliche biologiche. Complessivamente questi dati indicano che la coltura L-IVCO supporta la vitalità degli oocati, impedendo al contempo la ripresa meiotica per 5 giorni.
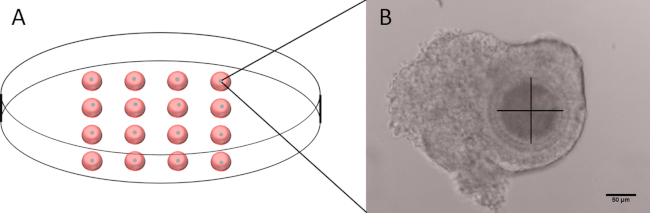
Figura 1: Struttura del piatto utilizzato per misurare il diametro degli ovociti e l'immagine rappresentativa di un COC. (A) Rappresentazione schematica di una piastra Petri da 60 mm con 16 gocce di 20 L di M199-D, ognuna contenente un singolo COC. (B) Immagine rappresentativa di un COC con l'asse utilizzato per misurare il diametro. Si noti che la zona pellucida non è inclusa. Barra della scala 50 m. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Immagini rappresentative di COC al momento della raccolta e dopo L-IVCO. (A, B, C, D) La riga superiore (raccolta) rappresenta i COC al momento del recupero. (A', B', C', D') Lo stesso COC è raffigurato 5 giorni dopo, alla fine di L-IVCO e classificato come riportato al punto 6.1. La riga inferiore (5 giorni) rappresenta i COC classificati come: Classe 1, che mostrano un investimento compatto di cellule cumulo senza alcun segno di espansione e degenerazione cellulare (A'); Classe 2, che mostra un investimento compatto delle cellule cumulo senza alcun segno di espansione e degenerazione cellulare e con formazione a forma di antrum (frecce) nella massa cumulo (B'); Classe 3, che mostra diversi strati di cellule cumuli senza alcun segno di espansione cumulo e alcune cellule disaggregata nello strato esterno delle cellule cumuli (C'); Classe 4, che mostra un'abbondante perdita di cellule cumuli su più del 50% della superficie degli ovociti e segni di degenerazione cellulare e detriti cellulari (D'). Barra della scala 40 m. Fare clic qui per visualizzare una versione più grande di questa figura.
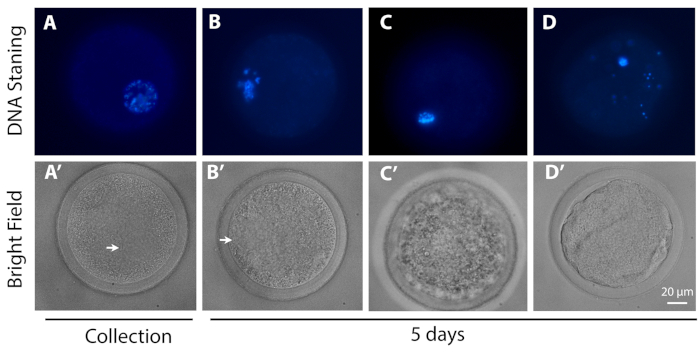
Figura 3: Immagini rappresentative della progressione meiotica. La riga superiore (colorazione del DNA) mostra il DNA (blu) degli ovociti rappresentativi in (A) la configurazione GV0 e (B) GV2-like configuration, (C) MI stage e (D) ovociti degenerati, (A) al momento della raccolta e (B, C, D) dopo 5 giorni di L-IVCO. La riga inferiore è l'immagine corrispondente nel campo luminoso dell'oocato nella riga superiore. La freccia indica il GV. Barra della scala 20 m. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Progressioneeiotica degli oociti alla fine della cultura. Il grafico a barre rappresenta la distribuzione di oociti in fase GV e MI e oociti degenerati alla fine del L-IVCO. Gli oociti precedentemente classificati nella classe 4 sono stati esclusi. I dati sono stati analizzati da ANOVA a senso 1 seguito dal test di confronto multiplo di Tukey e i valori sono mezzi ± SEM (N-5; P<0.05). Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Qui descriviamo un sistema culturale per la crescita degli ovociti che promuove lo sviluppo degli ovociti per 5 giorni sostenendone la vitalità e prevenendo la ripresa meiotica. Quest'ultimo aspetto è di estrema importanza per consentire la continua crescita e differenziazione necessaria per conferire all'ovocita la competenza dello sviluppo meiotico ed embrionale2,20, che sarebbe altrimenti bloccata da una ripresa prematura della divisione meiotica.
Durante lo sviluppo di questo sistema di coltura, abbiamo preso in considerazione diverse caratteristiche della crescita fisiologica e differenziazione che si verifica nel follicolo. In questa sezione viene fornita una panoramica degli aspetti principali che abbiamo considerato durante lo sviluppo di questa strategia.
In primo luogo, la crescita degli ovociti nei follicoli antrali primi bovini richiede circa 5 giorni per subire il passaggio dallo stadio di crescita allo stadio completamente cresciuto in vivo8,19. Pertanto, la lunghezza della cultura è stata aumentata a 5 giorni rispetto ai precedenti tentativi fatti nel nostro laboratorio dove gli ovociti sono stati coltivati fino a 24 h2.
Un altro fattore che abbiamo incluso nel L-IVCO è stata la maggiore viscosità del mezzo in cui i COC sono colturati per imitare la viscosità fisiologica del liquido follicolare. Questo è stato ricreato con l'aggiunta di 4% PVP e, insieme con l'uso di Collagen I superficie coltura rivestita, ha promosso la formazione di una cultura 3D come, come riportato da studiprecedenti 13.
Cilostamide, un inibitore PDE3, è stato aggiunto per mantenere gli ovociti meioticamente arrestati nella fase GV, impedendo una precoce ripresa meiotica mantenendo alti livelli di nucleotidi ciclici all'interno degli ovociti2,19,25,28,29. I nostri risultati indicano che un trattamento di 5 giorni con cilostamide non ha un impatto grossolano sulla salute dei CLC, poiché solo una piccola frazione di complessi è degenerata, anche in accordo con i risultati ottenuti da Alam et al.19.
L'inclusione del solfato di zn, e la sua concentrazione, è corroborata da recenti risultati che dimostrano che questo elemento traccia ha un ruolo nel sostenere la differenziazione e l'attività trascrizionale degli ovociti di coltivazione bovina nellacultura 30.
Infine, è stata introdotta una combinazione di ormoni per imitare da vicino l'ambiente ormonale fisiologico tipico del follicolo antralicoiniziale 31,32,33. Ad esempio, l'estradiol ha conosciuto attività a sostegno della crescita degli oocati16,,17,,19 e delle connessioni tra le celle granulosa17,promuovendo anche l'acquisizione della competenza meiotica34. Allo stesso modo, il testosterone, oltre ad essere un precursore dell'estradiolo, stimola anche la crescita e lo sviluppo follicolare35, mentre il progesterone è stato aggiunto principalmente per la sua attività antiapoptotica36.
Importante e in accordo con il nostro precedente studio2, la concentrazione di FSH è stata mantenuta ad una concentrazione che è fisiologica per la fase di crescita. Infatti, una bassa concentrazione di FSH promuove lo sviluppo degli ovociti sostenendo la comunicazione mediata di giunzione gap tra le cellule ovocite e il cumulo compagno e promuove l'attività trascrizionale e la differenziazione degli ovociti senza indurre la ripresa meiotica2.
Nella nostra esperienza, una delle chiavi per il successo del L-IVCO è la selezione di una popolazione omogenea di COC sani provenienti dai primi follicoli astrali. Secondo i dati della letteratura, l'80% degli oociti raccolti dai primi follicoli antrali sono caratterizzati da cromatina organizzata in una configurazione definita GV020. Questa omogeneità rappresenta un vantaggio per la coltura in vitro, in quanto in linea di principio assicura che le cellule si comportino in modo simile quando esposte all'ambiente di coltura. In quest'ottica, la raccolta dei COC deve essere eseguita cercando di ridurre al minimo la "contaminazione" con COC provenienti da fasi di differenziazione inferiori o più avanzate. Tuttavia, a causa del fatto che l'elaborazione delle fette corticali richiede molto tempo e dovrebbe essere effettuata in un tempo relativamente breve, la fase di raccolta/selezione rappresenta probabilmente il passaggio più critico del L-IVCO. Per raggiungere questo obiettivo, alcune considerazioni chiave dovrebbero essere barba in mente.
Ad esempio, il ricercatore/tecnico deve essere addestrato a riconoscere e scartare i follicoli con segni di atresia follicolare. In questa fase, solo i parametri morfologici possono essere utilizzati per riconoscere i follicoli atretici, come l'aspetto traslucido molto chiaro e la presenza di un COC scuro all'interno. Tutti gli altri follicoli, in cui i segni atretici non possono essere chiaramente distinti, dovrebbero essere aperti e un'ulteriore selezione basata sulla morfologia dei COC isolati dovrebbe essere effettuata per identificare quelli sani2,3,37,38,39. Ciò si ottiene ancora una volta da osservazioni morfologiche come la presenza di almeno quattro strati di cellule cumuli, forma grossolanamente sferica, oolemma intatta e ooplasma omogeneo e finemente granulato11,26,27.
L'isolamento e la manipolazione dei COC rappresentano un'ulteriore sfida tecnica, che richiede personale qualificato e attrezzature adeguate per la microdissione sotto lo stereomicroscopio e una determinazione accurata del diametro degli oocici. Quest'ultimo passo è essenziale per selezionare una popolazione uniforme di ociociti, escludendo così ogni possibile fonte di contaminazione con COC proveniente da altri stadi follicolari. Per questo motivo, è importante assicurarsi che gli oociti racchiusi nei COC recuperati abbiano un diametro compreso tra 100 e 110 m2,40.
Oltre a sostenere la vitalità dell'ovocita e a prevenire la ripresa meiotica, la L-IVCO ha promosso la transizione della configurazione della cromatina da GV0 a GV2 progressivamente più condensata e GV3 nel 59% degli ovociti. In particolare la condensazione della cromatina all'interno del GV è un marcatore di 'guadagno' di competenza meiotica e di sviluppo in fondamentalmente tutti gli ovociti di mammiferi studiatifinora 20. Questo risultato è molto promettente, soprattutto se confrontato con il nostro precedente sistema IVCO 24 ore. In tale studio, il più alto grado di compattazione della cromatina all'interno del GV non è stato raggiunto e il 22% degli oociti sono stati trovati con una configurazioneGV1 2, una fase associata alla piena competenza meiotica ma ancora scarsa competenzadi sviluppo 20. Anche in queste condizioni, gli ovociti in crescita altrimenti incompetenti sono stati in grado di maturare e produrre embrioni, anche se in quantità limitata. L'aumento costante delle fasi di GV2/3 osservate nella L-IVCO è quindi compatibile con un maggiore potenziale di produzione di embrioni vitali. Stiamo testando questa ipotesi sperimentalmente inviando COC derivati da L-IVCO ai seguenti passaggi dell'IVP (maturazione in vitro, fecondazione e coltura embrionale fino allo stadio di blastocità). Se confermata, la L-IVCO scatenerà parte del potenziale ancora non sfruttato della riserva ovarica, con importanti implicazioni su diverse aree di interesse per la conservazione della fertilità femminile. Per esempio, aumenterà la fonte di gameti fertilizzanti da utilizzare nei programmi di conservazione di allevatori di alto merito genetico. Un'altra applicazione che prevediamo è per il recupero genetico di specie minacciate della famiglia bovid e di razze locali che sono in pericolo o a rischio di erosione genetica a causa della diffusione diffusa delle razze cosmopolite. Ultimo ma non meno importante, L-IVCO rappresenta uno strumento per tutti gli scienziati che sono interessati a sezionare i processi cellulari e molecolari che regolano la formazione di un gamete competente.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da Regione Lombardia PSR INNOVA n.201801061529 e UNIMI n.PSR 2019_DIP_027_ALUCI_01
Materiali
| Name | Company | Catalog Number | Comments |
| 4-well dishes | Nunclon | 179830 | |
| 96-well dish | Becton Dickinson Biosciences | 356649 | BioCoat™ Collagen I |
| Bovine Serum Albumin (Fatty acid free) | Sigma | A8806 | |
| Bovine Serum Albumin (Fraction V) | Sigma | A3311 | |
| Cell culture water | Sigma | W3500 | |
| Cilostamide | Sigma | C7971 | |
| Cysteamine | Sigma | M9768 | |
| Digital camera | Nikon Corp | Camera DS-5M | |
| Disodium phosphate | Sigma | S5136 | |
| Estradiol | Sigma | E2758 | |
| Glutamax Supplement | Thermo Fisher Scientific | 35050061 | |
| Gonal F | Merck Serono | ||
| Heparin | Sigma | H3149 | |
| HEPES | Sigma | H3784 | |
| Vacuum pump | Cook-IVF | KMAR-5100 | |
| Incubator | Sanyo | ||
| Kanamycin sulfate from Streptomyces kanamyceticus | Sigma | K1377 | |
| Medium 199 | Sigma | M3769 | Powder for bicarbonate-buffered media |
| Medium 199 | Sigma | M2520 | Powder for HEPES-buffered media |
| Microscope | Nikon Corp | Nikon Diaphot | |
| Microscope | Nikon Corp | Eclipse E 600 | |
| Monopotassium phosphate | Sigma | P5655 | |
| Paraformaldehyde | Sigma | 158127 | |
| Penicilin | Sigma | P3032 | |
| Phenol Red | Sigma | P5530 | |
| Polyvinyl alcohol | Sigma | P8137 | |
| Polyvinylpyrrolidone | Sigma | P5288 | 360k molecular weight |
| Potassium chloride | Sigma | P5405 | |
| Progesterone | Sigma | P8783 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium choride | Sigma | P5886 | |
| Sodium pyruvate | Sigma | P4562 | |
| Streptomycin | Sigma | S9137 | |
| Testosterone | Sigma | 86500 | |
| Triton X | Sigma | T9284 | |
| Vectashield with DAPI | Vector Laboratories | H1200 | |
| Water | Sigma | W3500 | |
| Zinc sulfate heptahydrate | Sigma | Z0251 |
Riferimenti
- Lonergan, P., Fair, T. Maturation of Oocytes in Vitro. Annual Review of Animal Biosciences. 4, 255-268 (2016).
- Luciano, A. M., Franciosi, F., Modina, S. C., Lodde, V. Gap junction-mediated communications regulate chromatin remodeling during bovine oocyte growth and differentiation through cAMP-dependent mechanism(s). Biology of Reproduction. 85 (6), 1252-1259 (2011).
- McLaughlin, M., Telfer, E. E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Galli, C. Achievements and unmet promises of assisted reproduction technologies in large animals: a per-sonal perspective. Animal Reproduction. 14 (3), 614-621 (2017).
- Luciano, A. M., Sirard, M. A. Successful in vitro maturation of oocytes: a matter of follicular differentiation. Biology of Reproduction. 98 (2), 162-169 (2018).
- Lonergan, P., Fair, T. In vitro-produced bovine embryos: dealing with the warts. Theriogenology. 69 (1), 17-22 (2008).
- Clement, M. D. F., Dalbies-Tran, R., Estienne, A., Fabre, S., Mansanet, C., Monget, P. The ovarian reserve of primordial follicles and the dynamic reserve of antral growing follicles: what is the link. Biology of Reproduction. 90 (4), 85(2014).
- Lussier, J. G., Matton, P., Dufour, J. J. Growth rates of follicles in the ovary of the cow. Journal of Reproduction and Fertility. 81 (2), 301-307 (1987).
- Fair, T., Hulshof, S. C., Hyttel, P., Greve, T., Boland, M. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anatomy and Embryology (Berlin). 195 (4), 327-336 (1997).
- Pavlok, A., Lucas-Hahn, A., Niemann, H. Fertilization and developmental competence of bovine oocytes derived from different categories of antral follicles. Molecular Reproduction and Development. 31 (1), 63-67 (1992).
- Blondin, P., Sirard, M. A. Oocyte and follicular morphology as determining characteristics for developmental competence in bovine oocytes. Molecular Reproduction and Development. 41 (1), 54-62 (1995).
- Harada, M., et al. Bovine oocytes from early antral follicles grow to meiotic competence in vitro: effect of FSH and hypoxanthine. Theriogenology. 48 (5), 743-755 (1997).
- Hirao, Y., et al. In vitro growth and development of bovine oocyte-granulosa cell complexes on the flat substratum: effects of high polyvinylpyrrolidone concentration in culture medium. Biology of Reproduction. 70 (1), 83-91 (2004).
- Alm, H., Katska-Ksiazkiewicz, L., Rynska, B., Tuchscherer, A. Survival and meiotic competence of bovine oocytes originating from early antral ovarian follicles. Theriogenology. 65 (7), 1422-1434 (2006).
- Taketsuru, H., et al. Bovine oocytes in secondary follicles grow in medium containing bovine plasma after vitrification. Journal of Reproduction and Development. 57 (1), 99-106 (2011).
- Endo, M., et al. Estradiol supports in vitro development of bovine early antral follicles. Reproduction. 145 (1), 85-96 (2013).
- Makita, M., Miyano, T. Steroid hormones promote bovine oocyte growth and connection with granulosa cells. Theriogenology. 82 (4), 605-612 (2014).
- Yamamoto, K., et al. Development to live young from bovine small oocytes after growth, maturation and fertilization in vitro. Theriogenology. 52 (1), 81-89 (1999).
- Alam, M. H., Lee, J., Miyano, T. Inhibition of PDE3A sustains meiotic arrest and gap junction of bovine growing oocytes in in vitro growth culture. Theriogenology. 118, 110-118 (2018).
- Lodde, V., Modina, S., Galbusera, C., Franciosi, F., Luciano, A. M. Large-scale chromatin remodeling in germinal vesicle bovine oocytes: interplay with gap junction functionality and developmental competence. Molecular Reproduction and Development. 74 (6), 740-749 (2007).
- Lodde, V., et al. Oocyte morphology and transcriptional silencing in relation to chromatin remodeling during the final phases of bovine oocyte growth. Molecular Reproduction and Development. 75 (5), 915-924 (2008).
- Dieci, C., et al. Differences in cumulus cell gene expression indicate the benefit of a pre-maturation step to improve in-vitro bovine embryo production. Molecular Human Reproduction. 22 (12), 882-897 (2016).
- Soares, A. C. S., et al. Steroid hormones interact with natriuretic peptide C to delay nuclear maturation, to maintain oocyte-cumulus communication and to improve the quality of in vitro-produced embryos in cattle. Reproduction, Fertililty and Development. 29 (11), 2217-2224 (2017).
- Soares, A. C. S., et al. Characterization and control of oocyte large-scale chromatin configuration in different cattle breeds. Theriogenology. 141, 146-152 (2020).
- Franciosi, F., et al. Natriuretic peptide precursor C delays meiotic resumption and sustains gap junction-mediated communication in bovine cumulus-enclosed oocytes. Biology of Reproduction. 91 (3), 61(2014).
- Luciano, A. M., et al. Effect of different levels of intracellular cAMP on the in vitro maturation of cattle oocytes and their subsequent development following in vitro fertilization. Molecular Reproduction and Development. 54 (1), 86-91 (1999).
- Bilodeau-Goeseels, S., Panich, P. Effects of oocyte quality on development and transcriptional activity in early bovine embryos. Animal Reproduction Science. 71 (3-4), 143-155 (2002).
- Dieci, C., et al. The effect of cilostamide on gap junction communication dynamics, chromatin remodeling, and competence acquisition in pig oocytes following parthenogenetic activation and nuclear transfer. Biology of Reproduction. 89 (3), 68(2013).
- Shu, Y. M., et al. Effects of cilostamide and forskolin on the meiotic resumption and embryonic development of immature human oocytes. Human Reproduction. 23 (3), 504-513 (2008).
- Lodde, V., et al. Zinc supports transcription and improves meiotic competence of growing bovine oocytes. Reproduction. 159 (6), 679-691 (2020).
- Henderson, K. M., McNeilly, A. S., Swanston, I. A. Gonadotrophin and steroid concentrations in bovine follicular fluid and their relationship to follicle size. Journal of Reproduction and Fertility. 65 (2), 467-473 (1982).
- Kruip, T. A., Dieleman, S. J. Steroid hormone concentrations in the fluid of bovine follicles relative to size, quality and stage of the oestrus cycle. Theriogenology. 24 (4), 395-408 (1985).
- Sakaguchi, K., et al. Relationships between the antral follicle count, steroidogenesis, and secretion of follicle-stimulating hormone and anti-Mullerian hormone during follicular growth in cattle. Reproductive Biology and Endocrinology. 17 (1), 88(2019).
- Makita, M., Miyano, T. Androgens promote the acquisition of maturation competence in bovine oocytes. Journal of Reproduction and Development. 61 (3), 211-217 (2015).
- Walters, K. A., Allan, C. M., Handelsman, D. J. Androgen actions and the ovary. Biology of Reproduction. 78 (3), 380-389 (2008).
- Luciano, A. M., Pappalardo, A., Ray, C., Peluso, J. J. Epidermal growth factor inhibits large granulosa cell apoptosis by stimulating progesterone synthesis and regulating the distribution of intracellular free calcium. Biology of Reproduction. 51 (4), 646-654 (1994).
- Gordon, I. Laboratory Production of Cattle Embryos, 2nd edn. , CABI Publishing. (2003).
- Telfer, E. E., McLaughlin, M., Ding, C., Thong, K. J. A two-step serum-free culture system supports development of human oocytes from primordial follicles in the presence of activin. Human Reproduction. 23 (5), 1151-1158 (2008).
- McLaughlin, M., Albertini, D. F., Wallace, W. H. B., Anderson, R. A., Telfer, E. E. Metaphase II oocytes from human unilaminar follicles grown in a multi-step culture system. Molecular Human Reproduction. 24 (3), 135-142 (2018).
- Fair, T., Hyttel, P., Greve, T. Bovine oocyte diameter in relation to maturational competence and transcriptional activity. Molecular Reproduction and Development. 42 (4), 437-442 (1995).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon