Method Article
Estrategia de cultivo In Vitro para ovocitos del folículo antral temprano en el ganado bovino
En este artículo
Resumen
Describimos los procedimientos para el aislamiento de ovocitos en crecimiento de los folículos ováricos en las primeras etapas de desarrollo, así como la instalación de un sistema de cultivo in vitro que puede apoyar el crecimiento y la diferenciación hasta la etapa completamente adulta.
Resumen
La reserva limitada de ovocitos maduros y fertilizables representa una barrera importante para el éxito de la reproducción asistida en mamíferos. Teniendo en cuenta que durante la vida reproductiva sólo alrededor del 1% de los ovocitos en un ovario maduro y ovulado, se han desarrollado varias técnicas para aumentar la explotación de la reserva ovárica a la creciente población de folículos no ovulatorios. Estas tecnologías han permitido intervenciones de preservación de la fertilidad, programas de selección en ganado y conservación de especies en peligro de extinción. Sin embargo, el enorme potencial de la reserva ovárica sigue siendo en gran medida sin explotar. En las vacas, por ejemplo, se han hecho algunos intentos de apoyar la cultura in vitro de ovocitos en etapas específicas del desarrollo, pero aún no se han desarrollado protocolos eficientes y fiables. Aquí describimos un sistema de cultivo que reproduce las condiciones fisiológicas de la etapa folicular correspondiente, definida para desarrollar ovocitos de crecimiento in vitro recogidos de los folículos antrales tempranos bovinos a la etapa completamente adulta, correspondiente al folículo antral medio in vivo. Se utilizó una combinación de hormonas y un inhibidor de la fosfodiesterasa 3 para prevenir la reanudación meótica prematuramente y para guiar la diferenciación de los ovocitos.
Introducción
Durante la vida reproductiva, sólo una fracción mínima de los ovocitos que están presentes en un ovario maduro, se liberan en las trompas de Falopio tras la ovulación, y están disponibles para ser fertilizados y se convierten en un embrión viable1. Por otro lado, la mayoría de los ovocitos dentro de un ovario se someten a atresia y nunca se ovulan. Las tecnologías de producción in vitro de embriones (IVP) han intentado aumentar la explotación de la reserva ovárica2,3. Hasta ahora, estas tecnologías han permitido intervenciones de preservación de la fertilidad, programas de selección en el ganado y conservación de especies en peligro de extinción. Sin embargo, la mayoría de los protocolos utilizan ovocitos que básicamente han completado la fase de crecimiento dentro del folículo ovárico antral, y por lo tanto se conocen como ovocitos completamente crecidos. En el ganado bovino, donde las tecnologías IVP son ampliamente utilizadas, los ovocitos completamente crecidos alcanzan un diámetro final de aproximadamente 120 m y se recogen de folículos que abarcan de 2 a 8 mm de diámetro (folículos antrales medios)1. Tras el aislamiento de los folículos, estos ovocitos son in vitro madurados y fertilizados. Los cigotos se cultivan hasta la etapa del blastocisto y se transfieren a un receptor o crioconservados. En el ganado bovino, así como en muchas otras especies, a pesar del potencial que ofrecen IVP, el número de embriones producidos in vitro por vaca no mejoró en gran medida durante los últimos 40 años. Esto se debe en parte al número limitado de ovocitos completamente crecidos que pueblan un ovario en un momento dado que se puede recuperar y someter a las técnicas estándar de IVP4,5,6.
Los ovocitos encerrados dentro de los folículos antrales tempranos, es decir, aquellos folículos de menos de 2 mm de diámetro, representan una fuente potencial que se utilizará en los programas de conservación de la fertilidad7, ya que un ovario contiene aproximadamente 10 veces más folículos antrales tempranos que los folículos antrales medios8. Sin embargo, estos ovocitos todavía están en fase de crecimiento y aún no han alcanzado la etapa9completamente cultivada. Como tal, todavía están transcripcionalmente activos, produciendo mRNAs que se almacenarán para pasos posteriores del desarrollo, y todavía no han sido sometidos a todo el proceso de diferenciación necesario para conferir a los ovocitos con la capacidad de reanudar y completar espontáneamente la meiosis que una vez aislado del compartimento folicular10,,11. Por lo tanto, no pueden someterse directamente a los protocolos estándar de maduración in vitro (IVM), pero requieren un período adicional de cultivo que les permita completar la fase de crecimiento y diferenciarse adecuadamente.
La transición de la etapa de crecimiento a la etapa completamente cultivada, que en el ganado se produce cuando el folículo se desarrolla desde la etapa antral temprana a la etapa antral media, es uno de los pasos críticos durante el desarrollo de ovocitos. En bovinos, varios estudios intentaron recapitular estos eventos in vitro2,12,13,14,15,16,17,18,19. Sin embargo, hasta la fecha no se han desarrollado protocolos fiables y sólo se ha informado de un éxito limitado. Según estudios anteriores20, estos ovocitos en crecimiento constituyen una población homogénea. Además de ser transcripcionalmente activa, su cromatina se dispersa en la vesícula germinal (GV), en una configuración que se llama GV02,21. Por el contrario, la población de ovocitos totalmente crecidos obtenida a partir de folículos antrales medios es más heterogénea, una condición que se refleja en los diversos grados de compactación de la cromatina (GV1, GV2 y GV3) que se pueden observar20. Entre ellos, datos anteriores han demostrado que los ovocitos GV2 y GV3 se caracterizan en general por una mejor calidad y una mayor competencia embrionaria de desarrollo20,,21,,22,,23,,24.
Partiendo de las observaciones anteriores, aquí describimos un sistema de cultivo de 5 días de largo de ovocitos (L-IVCO) que permite la diferenciación de los ovocitos aislados como complejos cúmulos-ovocitos (COC) de los folículos antrales tempranos. Esta estrategia de cultivo ha evolucionado a partir de 10 años de estudios realizados en nuestro laboratorio y sus raíces su terreno sobre el cultivo de ovocitos in vitro (IVCO)2,sistemas de23,,25 y la suplementación de zinc durante el cultivo de ovocitos. Se utilizó una combinación de hormona estimulante del folículo (FSH) y un inhibidor de la fosfodiesterasa-3 (PDE3), capaz de mejorar la comunicación cúmulo- ovocitos2,prevenir la reanudación meótica prematura2y apoyar el crecimiento de ovocitos2.
Protocolo
Los ovarios se recogieron de vacas lecheras Holstein de 4 a 8 años recuperadas en el matadero local (INALCA S.p.A., Ospedaletto Lodigiano, LO, IT 2270M CE, Italia).
1. Preparación de medios
NOTA: Todos los medios deben estar preparados al menos cuatro horas antes de su uso. Los medios tamponados de bicarbonato de sodio se incuban a 38,5 oC y 5% deCO2 en aire, humedad máxima. Los medios con amortiguación HEPES se mantienen a 38,5 oC en horno termostático.
- Cultivo in vitro largo de ovocitos (L-IVCO) medio
- Preparar 15 mL del medio de cultivo básico (M199-B): Suplemento M199 con 2 mM de glutamina, 0,4% de albúmina sérica bovina libre de ácidos grasos (BSA), 0,2 mM de piruvato sódico, bicarbonato sódico de 25 mM, cisteamina de 0,1 mM, 21,3 g/ml de rojo fenol, 75 g/ml de kanamicina y 4% de polivinpirrolidona (PVP; 360 k de peso molecular).
- Preparar 3 ml del medio de sujeción (M199-H): A M199-B añadir 5 m de cilostamida y verter en un plato de Petri de 35 mm.
- Preparar el medio L-IVCO (M199-L): Suplemento M199-B con sulfato de Zn de 0,15 g/ml, 10UI/ml FSH, estradiol de 10 ng/ml, testosterona de 50 ng/ml, 50 ng/ml de progesterona y 5 mL de cilostamida.
- Colocar 200 l de medio M199-L en cada pocócil de la placa bien recubierta. Llenar los pozos en los cuatro bordes de la placa con agua de cultivo estéril para compensar la evaporación y mantener la humedad adecuada durante el cultivo.
- Incubar la placa de 96 pozos y el medio M199-H en la incubadora a 38,5oC y 5%CO2 en aire, humedad máxima.
- Medio de disección
- Preparar el medio de disección (M199-D): Suplemento M199 con 0,4% fracción BSA V, 0,164 mM de penicilina, 0,048 mM de estreptomicina, 1790 unidades/L heparina. M199-D se puede preparar a granel, dispensar en alícuotas de 20 ml y almacenarse a 4 oC durante 6 meses. Cuando sea necesario, caliente y suplemente 1 alícuota.
- Preparar 20 mL de M199-D complementado con cilostamida de 5 m (cilostamida M199-D).
2. Recolección y procesamiento de ovarios
NOTA: Todos los procedimientos se llevan a cabo a temperatura ambiente (26 oC) a menos que se indique lo contrario.
- Recuperar los ovarios en el matadero de las vacas.
- Colocar los ovarios en solución salina estéril (NaCl, 9 g/L) a 26 – 28 oC añadidos con penicilina 100 U/ml y estreptomicina 0,1 mg/ml.
- Transportar los órganos al laboratorio en solución salina estéril caliente dentro de 4 h.
- Lavar los ovarios 4x en solución salina estéril mantenida a 26oC.
- Retire todos los folículos antrales de tamaño medio a grande aspirando todos los folículos de más de 2 mm de diámetro utilizando una aguja de 18 G conectada a una bomba de aspiración con presión de vacío establecida en -28 mmHg y coloque los ovarios aspirados en un vaso de precipitados con solución salina estéril a 26 oC.
NOTA: La eliminación del contenido de los folículos > 2 mm es un paso crítico para eliminar en la medida de lo posible la fuente de ovocitos completamente crecidos que 'contaminarían' el experimento. - Bajo una campana de flujo laminar horizontal, coloque un ovario en ese momento en una tabla de cortar de politetrafluoroetileno estéril. Usando una cuchilla quirúrgica No. 22 montada en un mango de bisturí, corte las rodajas de corteza ovárica (la parte externa del ovario, que contiene los folículos), 1,5 – 2 mm de espesor y paralela al eje principal del órgano.
- Colocar las rodajas de corteza ovárica en un plato de petri de vidrio estéril cubierto con medio diseccionante sobre un plato caliente a 38,5 oC.
NOTA: A partir de ahora todos los procedimientos se realizan a 38,5 oC utilizando una placa caliente.
3. Selección y aislamiento de los folículos y recuperación de los COC
- Coloque una rodaja de corteza ovárica en un plato petri de vidrio de 60 mm con 2-3 ml de M199-D.
- Con un microscopio de disección, seleccione los folículos entre 0,5 y 2 mm utilizando un ocular equipado con micrómetros.
- Identifique los folículos sanos y no atériticos debajo del estereomicroscopio. Evaluar la atresia del folículo mediante la observación de parámetros morfológicos, como la apariencia translúcida muy clara, con un COC oscuro en el interior. Deseche los folículos atériticos y procese todos los demás.
- Usando una cuchilla quirúrgica No. 22 montada en un mango de bisturí, retire el tejido ovárico que rodea el folículo en un lado hasta que el folículo se exponga en un borde.
- Con una aguja 26G montada en una jeringa, haga cuidadosamente una hendidura en la pared del folículo expuesto. Esta acción liberará el contenido folicular, que comprende el COC, el líquido folicular y los grupos de células.
- Identificar el COC bajo el microscopio y examinar la integridad del cúmulo, la integridad de la zona pellucida y la homogeneidad del citoplasma. Si se cumplen estos criterios, aspire el COC utilizando una pipeta P20.
- Coloque el COC aislado en cilostamida M199-D.
- Continúe el procedimiento de aislamiento durante 30 min.
4. Selección de COCs a someter a cultivo in vitro
- Bajo el microscopio de disección, seleccione COCs saludables en función de los criterios del paso 3.6.
- En un plato de Petri de 60 mm, prepare 16 gotas de 20 ml de cilostamida M199-D y coloque un COC saludable por gota (Figura 1A).
- El uso de un microscopio invertido conectado a una cámara mide el diámetro de los ovocitos, excluyendo la zona pellucida, utilizando el software proporcionado con la cámara.
- Con una visualización clara del ócito, realice dos mediciones perpendiculares excluyendo la zona pellucida (Figura 1B).
- Asegurar si la media de la medida de los dos ovocitos, excluyendo la zona pellucida, está dentro de un rango de 100 – 110 m. Deseche los COC con ovocitos de forma no redondeada o con ovocitos que no sean medibles.
- Transfiera los COC seleccionados en un plato de 35 mm que contenga el medio M199-H y manténgalos en la incubadora a 38,5 oC y 5%CO2 en aire, humedad máxima hasta el paso 5.1.
- Repita los pasos 3 y 4 hasta 4x. El tiempo de trabajo total no debe exceder 2 h.
5. Cultivo in vitro largo de los ovocitos (L-IVCO)
- Transfiera un COC por pozo en el centro de un pozo de la placa de 96 pozos que se preparará en el paso 1.1.5.
- Incubar la placa durante 5 días a 38,5oC y 5% de CO2 en aire, humedad máxima.
- Cada dos días (día 2 y día 4) preparar M199-L fresco como se describe en el paso 1.
- Renovar la mitad del medio retirando 100 ml de medio y sustituyéndose por 100 l de M199-L recién preparado. Realice la renovación media bajo el estereomicroscopio y evite mover los COC al pozo.
6. Clasificación de COC después del cultivo
- Al final de la L-IVCO, analice la morfología de los COC bajo el microscopio de disección.
- Clasificar como se muestra en la figura 2.
- Clasificar como Clase 1 si los COC muestran una inversión de células cúmulos compactas sin signos de expansión cúmulo y degeneración celular.
- Clasificar como Clase 2 si los COC muestran una inversión celular compacta de cúmulo sin signos de expansión cúmulo y degeneración celular y con formación similar a un raso en la masa cúmulo.
- Clasificar como Clase 3 si los COC muestran varias capas de célula cúmulo sin signo de expansión cúmulo y algunas células desagregadas en la capa externa de las células cúmulos y sin formación similar a un antrum.
- Clasificar como Clase 4 si los COC muestran una pérdida abundante de células cúmulos que se extienden por más del 50% de la superficie de ovocitos, y signos de degeneración celular y desechos celulares.
7. Evaluación de la progresión meótica después de la cultura
- Denudación de ovocitos
- Coloque cada COC en un solo pocó bien de una placa de cuatro pocillos que contenga 400 l de 199D por pocócil.
- Bajo un microscopio de disección, retire suavemente las células cúmulos mecánicamente mediante pipeteo repetido utilizando una pipeta establecida en 130-140 l.
- Una vez que los ovocitos estén libres de la inversión cúmulo, transfieralos a otro pozo que contenga 199D.
- Repita el proceso hasta que todos los ovocitos estén completamente denudados.
- Tinción nuclear de ovocitos
NOTA: A partir de ahora todos los procedimientos se realizan a temperatura ambiente. Los reactivos están a temperatura ambiente.- Fijar los ovocitos en paraformaldehído 4% en solución salina tampón de fosfato (PBS) durante 1 h.
ADVERTENCIA: Use equipo de protección personal al manipular paraformaldehído y deseche los materiales contaminados de acuerdo con las pautas de eliminación de residuos peligrosos. - Lavar los ovocitos 3x durante 5 minutos cada uno en PBS que contenga 1% de polivinilalcohol (PVA).
NOTA: Las muestras se pueden procesar de inmediato o almacenarse a 4 oC durante un máximo de una semana. - Coloque los ovocitos en PBS que contengan 0,1% Tritón X durante 10 min.
- Lavar los ovocitos 3x durante 5 minutos cada uno en PBS que contenga 1% de PVA.
- Colocar los ovocitos singularmente en gotas de 5 ml de medio antifada complementados con 4',6-diamidino-2-fenilindole (DAPI) dilactato (1 g/ml) sobre un portaobjeto.
- Coloque dos tiras de cinta adhesiva de doble cara a lo largo de los lados largos de la corredera, para evitar el aplanamiento excesivo de los ovocitos al colocar el resbalón de la cubierta en la parte superior.
- Coloque el resguardo de la cubierta en la parte superior, hála adherirse a la cinta y manténgala en la oscuridad mientras procesa todas las muestras.
- Analizar los ovocitos utilizando un microscopio de epifluorescencia convencional equipado con filtros DAPI (Excitación/Emisión: 358-461) para evaluar la progresión meótica de los ovocitos.
- Clasificar los ovocitos según su progresión meótica: GV - ovocitos con diferentes grados de condensación de cromatina dentro del GV; MI – ovocitos de GV descomponiendo a metafase I; y degenerados – ovocitos que no podrían ser identificados como estar en cualquiera de las etapas anteriores.
- Fijar los ovocitos en paraformaldehído 4% en solución salina tampón de fosfato (PBS) durante 1 h.
Resultados
Al final de la L-IVCO, la morfología bruta de los COC cambió y 4 clases se identificaron en función de la aparición de las células cúmulos, como se muestra en la Figura 2. Sobre la base de los criterios morfológicos comúnmente adoptados para seleccionar COCs sanos11,26,27, las clases 1, 2 y 3 fueron juzgados sanos, mientras que la clase 4, que mostraba signos claros de degeneración como la ausencia de capas completas de células cúmulos que rodeaban a los ovocitos, se consideraron gravemente comprometidas e inadecuadas para someterse a procedimientos posteriores en un entorno de IVP prospectivo. En total, se analizaron 74 ovocitos en 5 réplicas biológicas, de las cuales el 9,45% estaban en la clase 4 y se descartaron de una evaluación adicional.
Como se muestra en la Figura 3 y la Figura 4, la evaluación de la etapa meticótica al final de la L-IVCO mostró que un porcentaje significativamente mayor de los ovocitos (78,57 ± 4,43%) permanecieron detenidos en la etapa inmadura, con la cromatina todavía encerrada dentro del GV (por lo tanto, también conocida como etapa de GV), sin degenerar. Entre ellos el 59,43% estaban en una configuración GV2/3. Un pequeño porcentaje reanudó la meiosis alcanzando la etapa metafásica I (13,76 ± 5,85%) degenerar (7,67 ± 4,61%). En total, se analizaron 67 ovocitos en 5 réplicas biológicas. En conjunto, estos datos indican que la cultura L-IVCO apoya la viabilidad de los ovocitos, evitando al mismo tiempo la reanudación meótica durante 5 días.
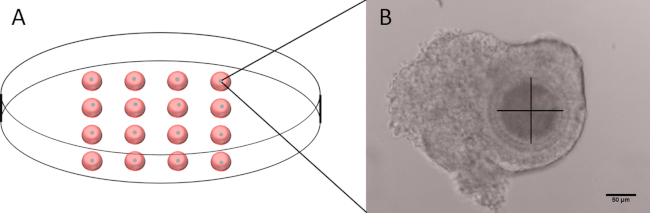
Figura 1: Esquema del plato utilizado para medir el diámetro de los ovocitos y la imagen representativa de un COC. (A) Representación esquemática de un plato Petri de 60 mm con 16 gotas de 20 ml de M199-D, cada una de las que contiene un solo COC. (B) Imagen representativa de un COC con el eje utilizado para medir el diámetro. Tenga en cuenta que la zona pellucida no está incluida. Barra de escala de 50 m. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Imágenes representativas de los COC en el momento de la recogida y después de L-IVCO. (A, B, C, D) La fila superior (Collection) representa los COC en el momento de la recuperación. (A', B', C', D') El mismo COC se muestra 5 días más tarde, al final de L-IVCO y clasificado como reportado en el paso 6.1. La fila inferior (5 días) representa los COC clasificados como: Clase 1, mostrando una inversión celular compacta de cúmulo sin signos de expansión y degeneración celular (A'); Clase 2, que muestra una inversión celular compacta de cúmulo sin signos de expansión y degeneración celular y con formación similar a un raso (flechas) en la masa cúmulo (B'); Clase 3, mostrando varias capas de células cúmulos sin signo de expansión cúmulo y algunas células desagregadas en la capa externa de células cúmulos (C'); Clase 4, mostrando abundante pérdida de células cúmulos en más del 50% de la superficie de ovocitos y signos de degeneración celular y desechos celulares (D'). Barra de escala de 40 m. Haga clic aquí para ver una versión más grande de esta figura.
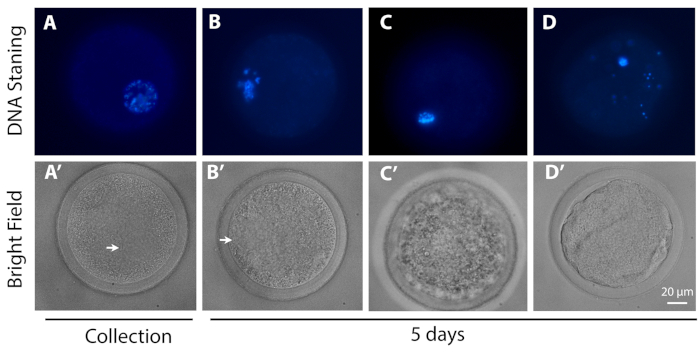
Figura 3: Imágenes representativas de la progresión meótica. La fila superior (tinción de ADN) muestra el ADN (azul) de los ovocitos representativos en (A) la etapa GV0 y (B) GV2-como configuración, (C) etapa MI y (D) ovocitos degenerados, (A) en el momento de la recolección y (B, C, D) después de 5 días de L-IVCO. La fila inferior es la imagen correspondiente en el campo brillante del ócito en la fila superior. La flecha indica el GV. Barra de escala de 20 m. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Mprogresión eiotica de los ovocitos al final de la cultura. El gráfico de barras representa la distribución de ovocitos en la etapa GV y MI y ovocitos degenerados al final de la L-IVCO. Se excluyeron los ovocitos previamente clasificados en la clase 4. Los datos fueron analizados por ANOVA de 1 vía seguido de la prueba de comparación múltiple de Tukey y los valores son medios ± SEM (N-5; P<0.05). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí describimos un sistema de cultivo para el cultivo de ovocitos que promueve el desarrollo de ovocitos durante 5 días apoyando su viabilidad y previniendo la reanudación meótica. Este último aspecto es de suma importancia para permitir el crecimiento y la diferenciación continuos necesarios para conferir el ócito con competencia de desarrollo meótica y embrionaria2,20, que de otro modo quedaría bloqueada por una reanudación prematura de la división meótica.
Al desarrollar este sistema de cultivo, tomamos en consideración varias características del crecimiento fisiológico y la diferenciación que se produce en el folículo. En esta sección ofrecemos una visión general de los principales aspectos que hemos considerado a la hora de desarrollar esta estrategia.
En primer lugar, el cultivo de ovocitos en los folículos antrales tempranos bovinos tarda aproximadamente 5 días en pasar de la etapa de crecimiento a la etapa completamente cultivada in vivo8,,19. Por lo tanto, la duración de la cultura se incrementó a 5 días en comparación con los intentos anteriores realizados en nuestro laboratorio donde los ovocitos fueron cultivados hasta 24 h2.
Otro factor que incluimos en el L-IVCO fue el aumento de la viscosidad del medio en el que se cultivan los COC para imitar la viscosidad fisiológica del fluido folicular. Esto fue recreado añadiendo 4% PVP y, junto con el uso de colágeno I recubierto superficie de cultivo, promovió la formación de una cultura 3D como, como se informó en estudios anteriores13.
La cilostamida, un inhibidor de la PDE3, se añadió para mantener los ovocitos detenidos meiotically en la etapa GV, evitando la reanudación meiótica precoz manteniendo altos niveles de nucleótidos cíclicos dentro de los ovocitos2,,19,25,28,29. Nuestros resultados indican que un tratamiento de 5 días de duración con cilostamida no tiene un impacto bruto en la salud de los COC, ya que sólo una pequeña fracción de complejos degeneró, también de acuerdo con los resultados obtenidos por Alam et al.19.
La inclusión del sulfato de Zn, y su concentración, se basa en los resultados recientes que demuestran que este oligoelemento tiene un papel en el apoyo a la diferenciación y actividad transcripcional de los ovocitos de cultivo bovino en el cultivo30.
Finalmente, se introdujo una combinación de hormonas para imitar de cerca el ambiente hormonal fisiológico típico del folículo antral temprano31,32,33. Por ejemplo, el estradiol ha conocido actividades de apoyo al crecimiento deovocitos 16,,17,19 y las conexiones entre las células granulosas17,al tiempo que promueve la adquisición de la competencia meótica34. Del mismo modo, la testosterona, además de ser un precursor del estradiol, también estimula el crecimiento folicular y el desarrollo35,mientras que la progesterona se añadió principalmente por su actividad antiapoptótica36.
Es importante y de acuerdo con nuestro estudio anterior2, la concentración de FSH se mantuvo en una concentración que es fisiológica para la fase de crecimiento. De hecho, una baja concentración de FSH promueve el desarrollo de ovocitos al mantener la comunicación mediada entre el ócito y las células cúmulos complementarias y promueve la actividad transcripcional y la diferenciación de ovocitos sin inducir la reanudación meótica2.
En nuestra experiencia, una de las claves para el éxito de la L-IVCO es la selección de una población homogénea de COC sanos procedentes de folículos antrales tempranos. Según datos de la literatura, el 80% de los ovocitos recogidos de los folículos antrales tempranos se caracterizan por cromatina organizada en una configuración definida GV020. Esta homogeneidad representa una ventaja para el cultivo in vitro, ya que en principio garantiza que las células se comportarán de manera similar cuando se exponen al entorno de cultivo. Teniendo esto en cuenta, la recogida de COCs debe realizarse tratando de minimizar la "contaminación" con LOS COC procedentes de etapas de diferenciación menos o más avanzadas. Sin embargo, debido al hecho, que el procesamiento de las rebanadas corticales es bastante lento y debe llevarse a cabo en un tiempo relativamente corto, el paso de recolección / selección probablemente representa el pasaje más crítico de la L-IVCO. Para lograrlo, algunas consideraciones clave deben tener en cuenta la barba.
Por ejemplo, el investigador/técnico necesita ser entrenado para reconocer y descartar los folículos con signos de atresia folicular. En esta etapa, sólo se pueden utilizar parámetros morfológicos para reconocer los folículos atíticos, como la apariencia translúcida muy clara, y la presencia de un COC oscuro en el interior. Deben abrirse todos los demás folículos, en los que no se puedan distinguir claramente los signos atíticos, y se debe realizar una selección adicional basada en la morfología de los COC aislados para identificar los sanos2,,3,,37,,38,,39. Esto se logra de nuevo mediante observaciones morfológicas como la presencia de al menos cuatro capas de células cúmulos, forma brusca esférica, oolemma intacto y ooplasmo homogéneo y finamente granulado11,,26,,27.
El aislamiento y la manipulación de los COC representan un desafío técnico adicional, que requiere personal calificado y equipo adecuado para la microdisectación bajo el estereomicroscopio y la determinación precisa del diámetro de los oocitos. Este último paso es esencial para seleccionar una población uniforme de ovocitos, excluyendo así cualquier posible fuente de contaminación con LOS COC procedentes de otras etapas foliculares. Por esta razón, es importante asegurarse de que los ovocitos encerrados en los COC recuperados tienen un diámetro entre 100 y 110 m2,,40.
Además de apoyar la viabilidad de los ovocitos y evitar la reanudación meítica, la L-IVCO promovió la transición de la configuración de cromatina de GV0 a la GV2 y GV3 progresivamente más condensada en el 59% de los ovocitos. En particular, la condensación de cromatina dentro del GV es un marcador de "ganancia" de competencia meótica y de desarrollo en básicamente todos los ovocitos de mamíferos estudiados hasta ahora20. Este resultado es muy prometedor, especialmente en comparación con nuestro sistema IVCO anterior de 24 horas. En ese estudio, no se alcanzó el mayor grado de compactación de cromatina dentro del GV y se encontró el 22% de los ovocitos con una configuración GV12,etapa asociada a la plena competencia meiótica pero aún escasa competencia de desarrollo20. Incluso en esas condiciones, los ovocitos de cultivo incompetentes fueron capaces de madurar y producir embriones, aunque en cantidad limitada. Por lo tanto, el aumento constante de las etapas GV2/3 observadas en la L-IVCO es compatible con un mayor potencial para producir embriones viables. Estamos en el proceso de probar esta hipótesis experimentalmente mediante la presentación de COCs derivados de L-IVCO a los siguientes pasos de IVP (maduración in vitro, fertilización y cultivo embrionario hasta la etapa de blastocisto). Si se confirma, la L-IVCO liberará parte del potencial aún no explotado de la reserva ovárica, con importantes implicaciones en varias áreas de interés para la preservación de la fertilidad femenina. Por ejemplo, aumentará la fuente de gametos fertilizables que se utilizarán en programas de preservación de criadores de alto mérito genético. Otra aplicación que prevemos es para el salvamento genético de especies amenazadas de la familia bovid, así como de razas locales que están en peligro de extinción o en riesgo de erosión genética debido a la difusión generalizada de razas cosmopolíticas. Por último, pero no menos importante, L-IVCO representa una herramienta para todos los científicos que están interesados en diseccionar los procesos celulares y moleculares que regulan la formación de un gameto competente.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por Regione Lombardia PSR INNOVA n.201801061529 y UNIMI n.PSR 2019_DIP_027_ALUCI_01
Materiales
| Name | Company | Catalog Number | Comments |
| 4-well dishes | Nunclon | 179830 | |
| 96-well dish | Becton Dickinson Biosciences | 356649 | BioCoat™ Collagen I |
| Bovine Serum Albumin (Fatty acid free) | Sigma | A8806 | |
| Bovine Serum Albumin (Fraction V) | Sigma | A3311 | |
| Cell culture water | Sigma | W3500 | |
| Cilostamide | Sigma | C7971 | |
| Cysteamine | Sigma | M9768 | |
| Digital camera | Nikon Corp | Camera DS-5M | |
| Disodium phosphate | Sigma | S5136 | |
| Estradiol | Sigma | E2758 | |
| Glutamax Supplement | Thermo Fisher Scientific | 35050061 | |
| Gonal F | Merck Serono | ||
| Heparin | Sigma | H3149 | |
| HEPES | Sigma | H3784 | |
| Vacuum pump | Cook-IVF | KMAR-5100 | |
| Incubator | Sanyo | ||
| Kanamycin sulfate from Streptomyces kanamyceticus | Sigma | K1377 | |
| Medium 199 | Sigma | M3769 | Powder for bicarbonate-buffered media |
| Medium 199 | Sigma | M2520 | Powder for HEPES-buffered media |
| Microscope | Nikon Corp | Nikon Diaphot | |
| Microscope | Nikon Corp | Eclipse E 600 | |
| Monopotassium phosphate | Sigma | P5655 | |
| Paraformaldehyde | Sigma | 158127 | |
| Penicilin | Sigma | P3032 | |
| Phenol Red | Sigma | P5530 | |
| Polyvinyl alcohol | Sigma | P8137 | |
| Polyvinylpyrrolidone | Sigma | P5288 | 360k molecular weight |
| Potassium chloride | Sigma | P5405 | |
| Progesterone | Sigma | P8783 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium choride | Sigma | P5886 | |
| Sodium pyruvate | Sigma | P4562 | |
| Streptomycin | Sigma | S9137 | |
| Testosterone | Sigma | 86500 | |
| Triton X | Sigma | T9284 | |
| Vectashield with DAPI | Vector Laboratories | H1200 | |
| Water | Sigma | W3500 | |
| Zinc sulfate heptahydrate | Sigma | Z0251 |
Referencias
- Lonergan, P., Fair, T. Maturation of Oocytes in Vitro. Annual Review of Animal Biosciences. 4, 255-268 (2016).
- Luciano, A. M., Franciosi, F., Modina, S. C., Lodde, V. Gap junction-mediated communications regulate chromatin remodeling during bovine oocyte growth and differentiation through cAMP-dependent mechanism(s). Biology of Reproduction. 85 (6), 1252-1259 (2011).
- McLaughlin, M., Telfer, E. E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Galli, C. Achievements and unmet promises of assisted reproduction technologies in large animals: a per-sonal perspective. Animal Reproduction. 14 (3), 614-621 (2017).
- Luciano, A. M., Sirard, M. A. Successful in vitro maturation of oocytes: a matter of follicular differentiation. Biology of Reproduction. 98 (2), 162-169 (2018).
- Lonergan, P., Fair, T. In vitro-produced bovine embryos: dealing with the warts. Theriogenology. 69 (1), 17-22 (2008).
- Clement, M. D. F., Dalbies-Tran, R., Estienne, A., Fabre, S., Mansanet, C., Monget, P. The ovarian reserve of primordial follicles and the dynamic reserve of antral growing follicles: what is the link. Biology of Reproduction. 90 (4), 85(2014).
- Lussier, J. G., Matton, P., Dufour, J. J. Growth rates of follicles in the ovary of the cow. Journal of Reproduction and Fertility. 81 (2), 301-307 (1987).
- Fair, T., Hulshof, S. C., Hyttel, P., Greve, T., Boland, M. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anatomy and Embryology (Berlin). 195 (4), 327-336 (1997).
- Pavlok, A., Lucas-Hahn, A., Niemann, H. Fertilization and developmental competence of bovine oocytes derived from different categories of antral follicles. Molecular Reproduction and Development. 31 (1), 63-67 (1992).
- Blondin, P., Sirard, M. A. Oocyte and follicular morphology as determining characteristics for developmental competence in bovine oocytes. Molecular Reproduction and Development. 41 (1), 54-62 (1995).
- Harada, M., et al. Bovine oocytes from early antral follicles grow to meiotic competence in vitro: effect of FSH and hypoxanthine. Theriogenology. 48 (5), 743-755 (1997).
- Hirao, Y., et al. In vitro growth and development of bovine oocyte-granulosa cell complexes on the flat substratum: effects of high polyvinylpyrrolidone concentration in culture medium. Biology of Reproduction. 70 (1), 83-91 (2004).
- Alm, H., Katska-Ksiazkiewicz, L., Rynska, B., Tuchscherer, A. Survival and meiotic competence of bovine oocytes originating from early antral ovarian follicles. Theriogenology. 65 (7), 1422-1434 (2006).
- Taketsuru, H., et al. Bovine oocytes in secondary follicles grow in medium containing bovine plasma after vitrification. Journal of Reproduction and Development. 57 (1), 99-106 (2011).
- Endo, M., et al. Estradiol supports in vitro development of bovine early antral follicles. Reproduction. 145 (1), 85-96 (2013).
- Makita, M., Miyano, T. Steroid hormones promote bovine oocyte growth and connection with granulosa cells. Theriogenology. 82 (4), 605-612 (2014).
- Yamamoto, K., et al. Development to live young from bovine small oocytes after growth, maturation and fertilization in vitro. Theriogenology. 52 (1), 81-89 (1999).
- Alam, M. H., Lee, J., Miyano, T. Inhibition of PDE3A sustains meiotic arrest and gap junction of bovine growing oocytes in in vitro growth culture. Theriogenology. 118, 110-118 (2018).
- Lodde, V., Modina, S., Galbusera, C., Franciosi, F., Luciano, A. M. Large-scale chromatin remodeling in germinal vesicle bovine oocytes: interplay with gap junction functionality and developmental competence. Molecular Reproduction and Development. 74 (6), 740-749 (2007).
- Lodde, V., et al. Oocyte morphology and transcriptional silencing in relation to chromatin remodeling during the final phases of bovine oocyte growth. Molecular Reproduction and Development. 75 (5), 915-924 (2008).
- Dieci, C., et al. Differences in cumulus cell gene expression indicate the benefit of a pre-maturation step to improve in-vitro bovine embryo production. Molecular Human Reproduction. 22 (12), 882-897 (2016).
- Soares, A. C. S., et al. Steroid hormones interact with natriuretic peptide C to delay nuclear maturation, to maintain oocyte-cumulus communication and to improve the quality of in vitro-produced embryos in cattle. Reproduction, Fertililty and Development. 29 (11), 2217-2224 (2017).
- Soares, A. C. S., et al. Characterization and control of oocyte large-scale chromatin configuration in different cattle breeds. Theriogenology. 141, 146-152 (2020).
- Franciosi, F., et al. Natriuretic peptide precursor C delays meiotic resumption and sustains gap junction-mediated communication in bovine cumulus-enclosed oocytes. Biology of Reproduction. 91 (3), 61(2014).
- Luciano, A. M., et al. Effect of different levels of intracellular cAMP on the in vitro maturation of cattle oocytes and their subsequent development following in vitro fertilization. Molecular Reproduction and Development. 54 (1), 86-91 (1999).
- Bilodeau-Goeseels, S., Panich, P. Effects of oocyte quality on development and transcriptional activity in early bovine embryos. Animal Reproduction Science. 71 (3-4), 143-155 (2002).
- Dieci, C., et al. The effect of cilostamide on gap junction communication dynamics, chromatin remodeling, and competence acquisition in pig oocytes following parthenogenetic activation and nuclear transfer. Biology of Reproduction. 89 (3), 68(2013).
- Shu, Y. M., et al. Effects of cilostamide and forskolin on the meiotic resumption and embryonic development of immature human oocytes. Human Reproduction. 23 (3), 504-513 (2008).
- Lodde, V., et al. Zinc supports transcription and improves meiotic competence of growing bovine oocytes. Reproduction. 159 (6), 679-691 (2020).
- Henderson, K. M., McNeilly, A. S., Swanston, I. A. Gonadotrophin and steroid concentrations in bovine follicular fluid and their relationship to follicle size. Journal of Reproduction and Fertility. 65 (2), 467-473 (1982).
- Kruip, T. A., Dieleman, S. J. Steroid hormone concentrations in the fluid of bovine follicles relative to size, quality and stage of the oestrus cycle. Theriogenology. 24 (4), 395-408 (1985).
- Sakaguchi, K., et al. Relationships between the antral follicle count, steroidogenesis, and secretion of follicle-stimulating hormone and anti-Mullerian hormone during follicular growth in cattle. Reproductive Biology and Endocrinology. 17 (1), 88(2019).
- Makita, M., Miyano, T. Androgens promote the acquisition of maturation competence in bovine oocytes. Journal of Reproduction and Development. 61 (3), 211-217 (2015).
- Walters, K. A., Allan, C. M., Handelsman, D. J. Androgen actions and the ovary. Biology of Reproduction. 78 (3), 380-389 (2008).
- Luciano, A. M., Pappalardo, A., Ray, C., Peluso, J. J. Epidermal growth factor inhibits large granulosa cell apoptosis by stimulating progesterone synthesis and regulating the distribution of intracellular free calcium. Biology of Reproduction. 51 (4), 646-654 (1994).
- Gordon, I. Laboratory Production of Cattle Embryos, 2nd edn. , CABI Publishing. (2003).
- Telfer, E. E., McLaughlin, M., Ding, C., Thong, K. J. A two-step serum-free culture system supports development of human oocytes from primordial follicles in the presence of activin. Human Reproduction. 23 (5), 1151-1158 (2008).
- McLaughlin, M., Albertini, D. F., Wallace, W. H. B., Anderson, R. A., Telfer, E. E. Metaphase II oocytes from human unilaminar follicles grown in a multi-step culture system. Molecular Human Reproduction. 24 (3), 135-142 (2018).
- Fair, T., Hyttel, P., Greve, T. Bovine oocyte diameter in relation to maturational competence and transcriptional activity. Molecular Reproduction and Development. 42 (4), 437-442 (1995).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados