Method Article
Stratégie de culture in vitro pour les ovocytes du follicule antral précoce chez les bovins
Dans cet article
Résumé
Nous décrivons les procédures d’isolement des ovocytes croissants des follicules ovariens aux premiers stades de développement, ainsi que la configuration d’un système de culture in vitro qui peut soutenir la croissance et la différenciation jusqu’au stade adulte.
Résumé
La réserve limitée d’ovocytes matures et fertilisables représente un obstacle majeur au succès de la procréation assistée chez les mammifères. Considérant que pendant la durée de vie reproductive seulement environ 1% des ovocytes dans un ovaire mature et ovule, plusieurs techniques ont été développées pour augmenter l’exploitation de la réserve ovarienne à la population croissante de follicules non ovulatoires. Ces technologies ont permis des interventions de préservation de la fertilité, de programmes de sélection dans le bétail et de conservation des espèces en voie de disparition. Cependant, le vaste potentiel de la réserve ovarienne est encore largement inexploité. Chez les vaches, par exemple, certaines tentatives ont été faites pour soutenir la culture in vitro des ovocytes à des stades de développement spécifiques, mais des protocoles efficaces et fiables n’ont pas encore été élaborés. Nous décrivons ici un système de culture qui reproduit les conditions physiologiques du stade folliculaire correspondant, défini pour développer des ovocytes de croissance in vitro prélevés à partir de follicules antrals précoces bovins jusqu’au stade adulte, correspondant au follicule antral moyen in vivo. Une combinaison d’hormones et d’un inhibiteur de la phosphodiestérase 3 a été utilisée pour prévenir la reprise méiotique prématurée et pour guider la différenciation des ovocytes.
Introduction
Au cours de la durée de vie reproductive, seule une fraction minimale des ovocytes qui sont présents dans un ovaire mature, sont libérés dans les trompes de Fallope lors de l’ovulation, et sont disponibles pour être fécondés et se développer en un embryon viable1. D’autre part, la plupart des ovocytes dans un ovaire subissent une atrésie et ne sont jamais ovulés. Les technologies de production d’embryons in vitro (IVP) ont tenté d’accroître l’exploitation de la réserve ovarienne2,3. Jusqu’à présent, ces technologies ont permis des interventions de préservation de la fertilité, de programmes de sélection dans le bétail et de conservation des espèces en voie de disparition. Néanmoins, la plupart des protocoles utilisent des ovocytes qui ont essentiellement terminé la phase de croissance dans le follicule ovarien antral, et sont donc appelés ovocytes adultes. Chez les bovins, où les technologies IVP sont largement utilisées, les ovocytes adultes atteignent un diamètre final d’environ 120 μm et sont prélevés dans des follicules qui s’étendent de 2 à 8 mm de diamètre (follicules antrales moyens)1. Après l’isolement des follicules, ces ovocytes sont in vitro mûris et fécondés. Les zygotes sont ensuite cultivés jusqu’au stade blastocyste et soit transférés dans un destinataire ou cryoconservés. Chez les bovins, ainsi que chez de nombreuses autres espèces, malgré le potentiel offert par ivp, le nombre d’embryons produits in vitro par vache ne s’est pas largement amélioré au cours des 40 dernières années. Cela est dû en partie au nombre limité d’ovocytes adultes qui peuplent un ovaire à un moment donné qui peut être récupéré et soumis aux techniques STANDARD IVP4,5,6.
Les ovocytes enfermés dans les follicules antral précoces, c’est-à-dire les follicules de moins de 2 mm de diamètre, représentent une source potentielle à utiliser dans les programmes de préservation de la fertilité7 , car un ovaire contient environ 10 fois plus de follicules antral précoces que les antrales moyens8. Cependant, ces ovocytes sont encore en phase de croissance et n’ont pas encore atteint le stade9. En tant que tels, ils sont encore transcriptionnellement actifs, produisant des ARNms qui seront stockés pour des étapes ultérieures de développement, et n’ont pas encore subi tout le processus de différenciation nécessaire pour conférer les ovocytes avec la capacité de reprendre spontanément et de compléter la méiose I une fois isolé du compartiment folliculaire10,11. Par conséquent, ils ne peuvent pas être soumis directement aux protocoles standard de maturation in vitro (IVM), mais ils nécessitent une période de culture supplémentaire qui leur permettrait de terminer la phase de croissance et de différencier correctement.
La transition de l’étape de la culture à l’étape adulte, qui chez le bétail se produit lorsque le follicule se développe du stade antral précoce au stade antral moyen, est l’une des étapes critiques du développement des ovocytes. Chez le bétail, plusieurs études ont tenté de récapituler ces événements in vitro2,12,13,14,15,16,17,18,19. Cependant, à ce jour, aucun protocole fiable n’a été élaboré et seul un succès limité a été signalé. Selon des études précédentes20, ces ovocytes croissants constituent une population homogène. En plus d’être transcriptionnellement actives, leur chromatine est dispersée dans la vésicule germinale (GV), dans une configuration qui s’appelle GV02,21. Inversement, la population d’ovocytes adultes obtenus à partir de follicules antral moyens est plus hétérogène, une condition qui se reflète par les différents degrés de compactage de la chromatine (GV1, GV2 et GV3) qui peut être observé20. Parmi ceux-ci, des données antérieures ont montré que les ovocytes GV2 et GV3 sont globalement caractérisés par une meilleure qualité et une meilleure compétence de développement embryonnaire20,21,22,23,24.
À partir des observations ci-dessus, nous décrivons ici un système de culture de 5 jours d’ovocytes (L-IVCO) qui permet la différenciation des ovocytes isolés comme complexes cumulus-oocytes (COC) des follicules antral précoces. Cette stratégie de culture a évolué à partir de 10 ans d’études menées dans notre laboratoire et les racines de son terrain sur les 24-48 heures précédemment développé culture ovocytes (IVCO)2, systèmes de prématuration23,25 et la supplémentation en zinc au cours de la culture des ovocytes . Une combinaison de l’hormone stimulante de follicule (FSH) et d’un inhibiteur de phosphodiestérase-3 (PDE3), capable d’améliorer la communication cumulus-oocyte2, empêchent la reprise méiotique intempestive2, et soutiennent la croissance d’oocyte2 a été employée.
Protocole
Les ovaires ont été prélevés sur des vaches laitières Holstein âgées de 4 à 8 ans récupérées à l’abattoir local (INALCA S.p.A., Ospedaletto Lodigiano, LO, IT 2270M CE, Italie).
1. Préparation des médias
REMARQUE : Tous les supports doivent être préparés au moins quatre heures avant l’utilisation. Les milieux tamponnés de bicarbonate de sodium sont incubés à 38,5 °C et à 5 % de CO2 dans l’air, humidité maximale. Les supports tamponnés HEPES sont maintenus à 38,5 °C dans le four thermostatique.
- Longue culture in vitro des ovocytes (L-IVCO) moyen
- Préparer 15 mL du milieu de culture de base (M199-B): Supplément M199 avec 2 mM glutamine, 0,4 % d’albumine de sérum bovin sans acide gras (BSA), 0,2 m MM de pyruvate de sodium, 25 mM de bicarbonate de sodium, 0,1 mM de cystéamine, 21,3 μg/mL de phénol rouge, 75 μg/mL de kanamycine et 4 % de polyvinylpyrrolidone (PVP; 360 k poids moléculaire).
- Préparer 3 mL du milieu de fixation (M199-H) : Ajouter 5 μM de cilostamide à M199-B et le verser dans une boîte de Pétri de 35 mm.
- Préparer le milieu L-IVCO (M199-L) : Supplément M199-B avec 0,15 μg/mL de sulfate Zn, 10-4 IU/mL FSH, 10 ng/mL estradiol, 50 ng/mL de testostérone, 50 ng/mL progesteronesterone et 5 μM Cilostamide.
- Placer 200 μL de milieu M199-L dans chaque puits de la plaque bien enduite de 96. Remplissez les puits dans les quatre bords de la plaque avec de l’eau de culture stérile pour compenser l’évaporation et pour maintenir l’humidité appropriée pendant la culture.
- Incuber la plaque de puits 96 et le milieu M199-H dans l’incubateur à 38,5 °C et 5% de CO2 dans l’air, humidité maximale.
- Milieu de dissection
- Préparer le milieu de dissection (M199-D) : Supplément M199 avec 0,4 % de fractionnement BSA V, 0,164 mM de pénicilline, 0,048 mM streptomycine, 1790 unités/L héparine. Le M199-D peut être préparé en vrac, distribué en aliquots de 20 mL et stocké à 4 °C pendant 6 mois. Au besoin, réchauffer et compléter 1 aliquot.
- Préparer 20 mL de M199-D complété par 5 μM de cilostamide (Cilostamide M199-D).
2. Collecte et traitement des ovaires
REMARQUE : Toutes les procédures sont effectuées à température ambiante (26 °C) sauf indication contraire.
- Récupérer les ovaires à l’abattoir des vaches.
- Placer les ovaires dans la solution saline stérile (NaCl, 9 g/L) à 26 – 28 °C ajoutés avec de la pénicilline 100 U/mL et de la streptomycine 0,1 mg/mL.
- Transporter les organes au laboratoire en solution saline stérile chaude dans un délai de 4 h.
- Laver les ovaires 4x en solution saline stérile maintenue à 26 °C.
- Retirez tous les follicules antral mi à grands en aspirant tous les follicules de plus de 2 mm de diamètre à l’aide d’une aiguille de 18 G reliée à une pompe d’aspiration avec pression sous vide fixée à -28 mmHg et placez les ovaires aspirés dans un bécher avec une solution saline stérile à 26 °C.
REMARQUE : L’élimination du contenu des follicules > 2 mm est une étape essentielle pour enlever autant que possible la source d’ovocytes adultes qui « contamineraient » l’expérience. - Sous un capot horizontal de flux laminaire, placer un ovaire à l’époque sur une planche à découper stérile en polytétrafluoroéthylène. À l’aide d’une lame chirurgicale no 22 montée sur une poignée de scalpel, couper des tranches du cortex ovarien (la partie externe de l’ovaire, qui contient les follicules), 1,5 à 2 mm d’épaisseur et parallèle à l’axe principal de l’organe.
- Placer les tranches du cortex ovarien dans une boîte de Pétri en verre stérile recouverte d’un milieu de dissection sur une plaque chaude à 38,5 °C.
REMARQUE : Désormais, toutes les procédures sont effectuées à 38,5 °C à l’aide d’une plaque chaude.
3. Sélection et isolement des follicules et récupération des COC
- Placez une tranche de cortex ovarien dans une boîte de Pétri en verre de 60 mm avec 2-3 mL de M199-D.
- À l’aide d’un microscope à dissection, sélectionnez les follicules entre 0,5 et 2 mm à l’aide d’un oculaire équipé d’un micromètre.
- Identifiez les follicules sains et non atrétiques sous le stéréomicroscope. Évaluez l’atrésie du follicule en observant des paramètres morphologiques, tels que l’aspect translucide très clair, avec un COC foncé à l’intérieur. Jetez les follicules atretiques et traitez tous les autres.
- À l’aide d’une lame chirurgicale no 22 montée sur une poignée de scalpel enlever le tissu ovarien entourant le follicule d’un côté jusqu’à ce que le follicule est exposé sur un bord.
- À l’aide d’une aiguille 26G montée sur une seringue, faites soigneusement une fente dans le mur de follicule exposé. Cette action libérera le contenu folliculaire, comprenant le COC, le liquide folliculaire et des amas de cellules.
- Identifiez le COC au microscope et examinez l’intégrité du cumulus, l’intégrité de zona pellucida et l’homogénéité du cytoplasme. Si ces critères sont remplis, aspirate le COC à l’aide d’une pipette P20.
- Placez le COC isolé dans le cilostamide M199-D.
- Poursuivre la procédure d’isolement pendant 30 min.
4. Sélection des COC à soumettre à la culture in vitro
- Sous le microscope de dissection, sélectionnez les COC sains en fonction des critères de l’étape 3.6.
- Dans une boîte de Pétri de 60 mm, préparer 16 gouttes de 20 μL de cidostamide M199-D et placer un COC sain par goutte (Figure 1A).
- À l’aide d’un microscope inversé fixé à une caméra mesurer le diamètre des ovocytes, à l’exclusion de la zona pellucida, en utilisant le logiciel fourni avec la caméra.
- Avec une visualisation claire de l’ovocyte, faire deux mesures perpendiculaires à l’exclusion de la zona pellucida (Figure 1B).
- Assurez-vous si la moyenne de la mesure des deux ovocytes, à l’exclusion de la zona pellucida, se situe dans une fourchette de 100 à 110 μm. Jetez les COC avec des ovocytes de forme non arrondi ou avec des ovocytes qui ne sont pas mesurables.
- Transférer les COC sélectionnés dans un plat de 35 mm contenant un milieu M199-H et les conserver dans l’incubateur à 38,5 °C et 5 % de CO2 dans l’air, humidité maximale jusqu’à l’étape 5.1.
- Répétez les étapes 3 et 4 jusqu’à 4x. Le temps de travail global ne doit pas dépasser 2 h.
5. Longue culture in vitro des ovocytes (L-IVCO)
- Transférer un COC par puits au centre d’un puits de la plaque de puits 96 pour être préparé à l’étape 1.1.5.
- Incuber la plaque pendant 5 jours à 38,5 °C et 5 % de CO2 dans l’air, humidité maximale.
- Tous les deux jours (jour 2 et jour 4) préparer frais M199-L comme décrit à l’étape 1.
- Renouveler la moitié du milieu en enlevant 100 μL de milieu et en remplaçant par 100 μL de M199-L fraîchement préparé. Effectuer le renouvellement moyen sous le stéréomicroscope et éviter de déplacer les COC dans le puits.
6. Classification du COC après la culture
- À la fin du L-IVCO, analysez la morphologie des COC sous le microscope de dissection.
- Classer comme indiqué à la figure 2.
- Classez comme classe 1 si les COC présentent un investissement compact dans les cellules cumulus sans aucun signe d’expansion du cumulus et de dégénérescence cellulaire.
- Classez comme classe 2 si les COC présentent un investissement compact dans les cellules cumulus sans aucun signe d’expansion du cumulus et de dégénérescence cellulaire et avec une formation semblable à une antrum dans la masse cumulus.
- Classez comme classe 3 si les COC présentent plusieurs couches de cellule cumulus sans aucun signe d’expansion du cumulus et quelques cellules ventilées dans la couche externe des cellules cumulus et sans formation antrum- like.
- Classer comme classe 4 si les COC montrent une perte abondante de cellules cumulus s’étendant sur plus de 50% de la surface des ovocytes, et des signes de dégénérescence cellulaire et de débris cellulaires.
7. Évaluation de la progression méiotique après culture
- Dénudation d’ovocytes
- Placer chaque COC dans un seul puits d’une plaque de quatre puits contenant 400 μL de 199D par puits.
- Sous un microscope de dissection retirer doucement les cellules cumulus mécaniquement en tirant à répétition à l’aide d’une pipette réglée à 130-140 μL.
- Une fois que les ovocytes sont exempts de l’investissement cumulus, les transférer à un autre puits contenant 199D.
- Répétez le processus jusqu’à ce que tous les ovocytes soient complètement dénudés.
- Coloration nucléaire d’ovocyte
REMARQUE : Désormais, toutes les procédures sont effectuées à température ambiante. Les réactifs sont à température ambiante.- Fixer les ovocytes dans le paraformaldéhyde 4% dans la solution saline tampon de phosphate (PBS) pendant 1 h.
AVERTISSEMENT : Portez de l’équipement de protection individuelle lors de la manipulation du paraformaldéhyde et éliminez les matières contaminées conformément aux lignes directrices sur l’élimination des déchets dangereux. - Laver les ovocytes 3x pendant 5 min chacun en PBS contenant 1% de polyvinylalcohol (PVA).
REMARQUE : Les échantillons peuvent être traités immédiatement ou conservés à 4 °C pendant une semaine maximale. - Placez les ovocytes dans pbs contenant 0,1% de Triton X pendant 10 min.
- Laver les ovocytes 3x pendant 5 min chacun dans PBS contenant 1% de PVA.
- Placer les ovocytes singulièrement dans des gouttes de 5 μL de milieu antifade complétées par 4',6-diamidino-2-phénylindole (DAPI) dilactate (1 μg/mL) sur une diapositive.
- Placez deux bandes de ruban adhésif à double face le long des longs côtés de la glissière, afin d’éviter l’aplatissement excessif des ovocytes lorsque vous mettez le couvercle sur le dessus.
- Placez le couvercle sur le dessus, faites-le adhérer à la bande et garder dans l’obscurité tout en traitant tous les échantillons.
- Analyser les ovocytes à l’aide d’un microscope à épifluorescence classique équipé de filtres DAPI (Excitation/Émission : 358/461) pour évaluer la progression méiotique des ovocytes.
- Classer les ovocytes en fonction de leur progression méiotique : GV - ovocytes avec différents degrés de condensation de chromatine dans le GV ; MI – ovocytes de GV se décomposent en métaphase I; et dégénéré – ovocytes qui ne pouvaient être identifiés comme étant à aucun des stades précédents.
- Fixer les ovocytes dans le paraformaldéhyde 4% dans la solution saline tampon de phosphate (PBS) pendant 1 h.
Résultats
À la fin du L-IVCO, la morphologie brute des COC a changé et 4 classes ont été identifiées en fonction de l’apparence des cellules cumulus, comme le montre la figure 2. Sur la base des critères morphologiques couramment adoptés pour sélectionner les COC sains11,26,27, les classes 1, 2 et 3 ont été jugées saines, tandis que la classe 4, qui a montré des signes clairs de dégénérescence tels que l’absence de couches complètes de cellules cumulus entourant les ovocytes, ont été considérés comme gravement compromis et inaptes à subir des procédures en aval dans un contexte de pVP prospective. Dans l’ensemble, 74 ovocytes dans 5 répliques biologiques ont été analysés, dont 9,45 % dans la classe 4 et ont été écartés d’une évaluation plus poussée.
Comme le montrent la figure 3 et la figure 4, l’évaluation de l’étape méiotique à la fin du L-IVCO a montré qu’un pourcentage significativement plus élevé des ovocytes (78,57 ± 4,43 %) est resté arrêté au stade immature, avec la chromatine encore enfermé dans le GV (par conséquent, également appelé stade GV), sans dégénérer. Parmi eux, 59,43 % étaient en configuration GV2/3. Un faible pourcentage a repris la méiose atteignant le stade de la métaphase I (13,76 ± 5,85 %) ou dégénéré (7,67 ± 4,61 %). Dans l’ensemble, 67 ovocytes dans 5 répliques biologiques ont été analysés. Au total, ces données indiquent que la culture L-IVCO soutient la viabilité des ovocytes tout en empêchant la reprise méiotique pendant 5 jours.
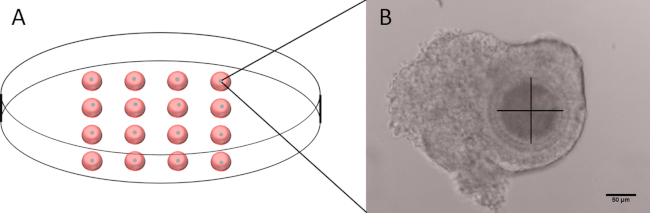
Figure 1 : Contour du plat utilisé pour mesurer le diamètre des ovocytes et l’image représentative d’un COC. (A) Représentation schématique d’une boîte de Pétri de 60 mm avec 16 gouttes de 20 μL de M199-D, chacune contenant un seul COC. BB) Image représentative d’un COC avec l’axe utilisé pour mesurer le diamètre. Notez que la zona pellucida n’est pas incluse. Barre d’échelle 50 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 2 : Images représentatives des COC au moment de la collecte et après L-IVCO. (A, B, C, D) La ligne supérieure (Collection) représente les COC au moment de la récupération. (A', B', C', D') Le même COC est photographié 5 jours plus tard, à la fin de L-IVCO et classé comme indiqué à l’étape 6.1. La ligne inférieure (5 jours) représente les COC classés comme étant : classe 1, montrant un investissement compact dans les cellules cumulus sans aucun signe d’expansion et de dégénérescence cellulaire (A'); Classe 2, montrant un investissement compact de cellules cumulus sans aucun signe d’expansion et de dégénérescence cellulaire et avec une formation en forme d’antrum (flèches) dans la masse de cumulus (B'); classe 3, montrant plusieurs couches de cellule cumulus sans aucun signe d’expansion du cumulus et quelques cellules désagrégées dans la couche externe des cellules cumulus (C'); Classe 4, montrant une perte abondante de cellules cumulus sur plus de 50% de la surface des ovocytes et des signes de dégénérescence cellulaire et de débris cellulaires (D'). Barre d’échelle 40 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
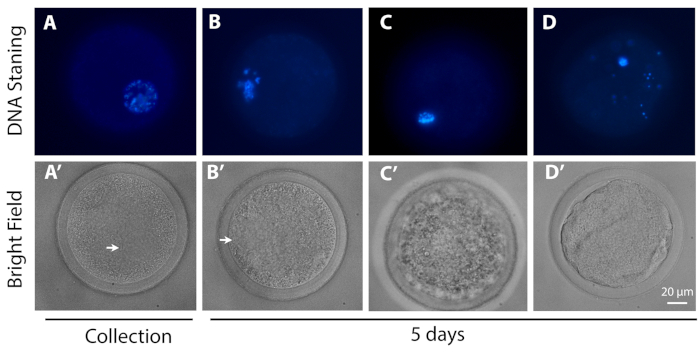
Figure 3 : Images représentatives de la progression méiotique. La rangée supérieure (coloration de l’ADN) montre l’ADN (bleu) des ovocytes représentatifs à (A) l’étape GV0 et (B) GV2-like configuration, (C) MI étape et (D) ovocytes dégénérés, (A) au moment de la collecte et (B, C, D) après 5 jours de L-IVCO. La ligne inférieure est l’image correspondante dans le champ lumineux de l’ovocyte dans la rangée supérieure. La flèche indique le GV. Barre d’échelle 20 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 4 : Progressionéiotique des ovocytes à la fin de la culture. Le graphique à barres représente la distribution des ovocytes au stade GV et MI et les ovocytes dégénérés à la fin du L-IVCO. Les ovocytes précédemment classés dans la classe 4 ont été exclus. Les données ont été analysées par ANOVA à sens unique suivi du test de comparaison multiple de Tukey et les valeurs sont des moyens ± SEM (N=5; P<0,05). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Ici, nous décrivons un système de culture pour la croissance des ovocytes qui favorise le développement des ovocytes pendant 5 jours en soutenant leur viabilité et en empêchant la reprise méiotique. Ce dernier aspect est de la plus haute importance pour permettre la croissance continue et la différenciation nécessaires pour conférer l’ovocyte avec la compétence méiotique et embryonnaire de développement2,20, qui serait autrement bloqué par une reprise prématurée de la division méiotique.
Lors du développement de ce système de culture, nous avons pris en considération plusieurs caractéristiques de la croissance physiologique et de la différenciation qui se produit dans le follicule. Dans cette section, nous donnons un aperçu des principaux aspects que nous avons pris en considération lors de l’élaboration de cette stratégie.
Tout d’abord, la culture des ovocytes dans les follicules antral précoces bovins prend environ 5 jours pour subir la transition de la croissance au stade adulte in vivo8,19. Par conséquent, la durée de la culture a été augmentée à 5 jours par opposition aux tentatives précédentes faites dans notre laboratoire où les ovocytes ont été cultivés pour un jusqu’à 24 h2.
Un autre facteur que nous avons inclus dans le L-IVCO était la viscosité accrue du milieu dans lequel les COC sont cultivés pour imiter la viscosité physiologique du fluide folliculaire. Ceci a été recréé en ajoutant 4% PVP et, avec l’utilisation de collagène j’ai enduit la surface de culture, il a favorisé la formation d’une culture 3D comme, comme rapporté par les études précédentes13.
Le cilostamide, un inhibiteur de LAP3, a été ajouté pour maintenir les ovocytes meiotically arrêtés au stade GV, empêchant la reprise méiotique précoce en gardant des niveaux élevés de nucléotides cycliques dans les ovocytes2,19,25,28,29. Nos résultats indiquent qu’un traitement de 5 jours avec du cilostamide n’a pas d’impact brut sur la santé des COC, car seule une petite fraction de complexes a dégénéré, également en accord avec les résultats obtenus par Alam et al.19.
L’inclusion du sulfate de Zn, et sa concentration, est corroborée par des résultats récents montrant que cet oligo-élément a un rôle à jouer dans la différenciation et l’activité transcriptionnelle des ovocytes de culture bovine dans la culture30.
Enfin, une combinaison d’hormones a été introduite pour imiter étroitement le milieu hormonal physiologique typique du follicule antral précoce31,32,33. Par exemple estradiol a connu des activités dans le soutien de la croissance des ovocytes16,17,19 et les connexions entre les cellules granulosa17, tout en favorisant l’acquisition de la compétence méiotique34. De même, la testostérone, en plus d’être un précurseur de l’estradiol, stimule également la croissance folliculaire et le développement35, tandis que la progestérone a été principalement ajouté pour son activité antiapoptotique36.
Fait important et en accord avec notre étude précédente2, la concentration de FSH a été maintenue à une concentration qui est physiologique pour la phase de croissance. En effet, une faible concentration de FSH favorise le développement des ovocytes en soutenant la communication médiée par la jonction entre les ovocytes et les cellules cumulus compagnons et favorise l’activité transcriptionnelle et la différenciation des ovocytes sans induire la reprise meiotique2.
D’après notre expérience, l’une des clés du succès du L-IVCO est la sélection d’une population homogène de COC en bonne santé provenant de follicules antral précoces. Selon les données de la littérature, 80% des ovocytes recueillis à partir des follicules antral précoces sont caractérisés par la chromatine organisée dans une configuration appelée GV020. Cette homogénéité représente un avantage pour la culture in vitro, car en principe elle garantit que les cellules se comporteront de la même manière lorsqu’elles sont exposées à l’environnement culturel. Dans cette optique, la collecte des COC doit être effectuée en essayant de minimiser la « contamination » des COC provenant d’étapes moins ou plus avancées de différenciation. Toutefois, en raison du fait que le traitement des tranches corticales prend beaucoup de temps et devrait être effectué dans un laps de temps relativement court, l’étape de collecte/sélection représente probablement le passage le plus critique du L-IVCO. Pour y parvenir, certaines considérations clés devraient être la barbe à l’esprit.
Par exemple, le chercheur/technicien doit être formé pour reconnaître et jeter les follicules avec des signes d’atrésie folliculaire. À ce stade, seuls les paramètres morphologiques peuvent être utilisés pour reconnaître les follicules atrétiques, tels que l’apparence translucide très claire, et la présence d’un COC sombre à l’intérieur. Tous les autres follicules, dans lesquels les signes atretiques ne peuvent pas être clairement distingués, doivent être ouverts et une sélection plus poussée basée sur la morphologie des COC isolés doit être effectuée pour identifier les signes sains2,3,37,38,39. Ceci est réalisé à nouveau par des observations morphologiques telles que la présence d’au moins quatre couches de cellules cumulus, la forme grossièrement sphérique, l’oolemma intacte et l’ooplasme homogène et finement granulé11,26,27.
L’isolement et la manipulation des COC représentent un défi technique supplémentaire, qui nécessite un personnel qualifié et un équipement approprié pour la micro-dissection sous le stéréomicroscope et une détermination précise du diamètre des ovocytes. Cette dernière étape est essentielle pour sélectionner une population uniforme d’ovocytes, excluant ainsi toute source possible de contamination par des COC provenant d’autres stades folliculaires. Pour cette raison, il est important de s’assurer que les ovocytes enfermés dans les COC récupérés ont un diamètre compris entre 100 et 110 μm2,40.
Outre le soutien de la viabilité des ovocytes et la prévention de la reprise méiotique, le L-IVCO a favorisé la transition de la configuration de la chromatine de GV0 au GV2 et GV3 progressivement plus condensés dans 59% des ovocytes. Notamment la condensation de chromatine dans le GV est un marqueur de « a » de compétence méiotique et de développement dans fondamentalement tous les ovocytes mammifères étudiés jusqu’à présent20. Ce résultat est très prometteur, surtout par rapport à notre système IVCO de 24 heures. Dans cette étude, le plus haut degré de compactage de chromatine dans le GV n’a pas été atteint et 22% des ovocytes ont été trouvés avec une configuration GV12, une étape associée à la pleine compétence méiotique, mais encore rare compétence développementale20. Même dans ces conditions, les ovocytes de croissance par ailleurs incompétents ont été capables de mûrir et de produire des embryons, bien qu’en quantité limitée. L’augmentation constante des stades GV2/3 observée dans le L-IVCO est donc compatible avec un potentiel plus élevé de production d’embryons viables. Nous sommes en train de tester cette hypothèse expérimentalement en soumettant des COC dérivés du L-IVCO aux étapes suivantes de l’IVP (maturation in vitro, fécondation et culture embryonnaire jusqu’au stade blastocyste). S’il est confirmé, le L-IVCO libérera une partie du potentiel encore inexploité de la réserve ovarienne, avec des implications importantes sur plusieurs domaines d’intérêt pour la préservation de la fertilité féminine. Par exemple, il augmentera la source de gamètes fertilisables à utiliser dans les programmes de préservation des éleveurs à haut mérite génétique. Une autre application que nous prévoyons est pour le sauvetage génétique des espèces menacées de la famille bovid ainsi que des races locales qui sont en voie de disparition ou en danger d’érosion génétique en raison de la diffusion généralisée des races cosmopolites. Last but not the least, L-IVCO représente un outil pour tous les scientifiques qui sont intéressés à disséquer les processus cellulaires et moléculaires qui régulent la formation d’un tteré compétent.
Déclarations de divulgation
Les auteurs n’ont rien à révéler.
Remerciements
Ce travail a été soutenu par Regione Lombardia PSR INNOVA n.201801061529 et UNIMI n.PSR 2019_DIP_027_ALUCI_01
matériels
| Name | Company | Catalog Number | Comments |
| 4-well dishes | Nunclon | 179830 | |
| 96-well dish | Becton Dickinson Biosciences | 356649 | BioCoat™ Collagen I |
| Bovine Serum Albumin (Fatty acid free) | Sigma | A8806 | |
| Bovine Serum Albumin (Fraction V) | Sigma | A3311 | |
| Cell culture water | Sigma | W3500 | |
| Cilostamide | Sigma | C7971 | |
| Cysteamine | Sigma | M9768 | |
| Digital camera | Nikon Corp | Camera DS-5M | |
| Disodium phosphate | Sigma | S5136 | |
| Estradiol | Sigma | E2758 | |
| Glutamax Supplement | Thermo Fisher Scientific | 35050061 | |
| Gonal F | Merck Serono | ||
| Heparin | Sigma | H3149 | |
| HEPES | Sigma | H3784 | |
| Vacuum pump | Cook-IVF | KMAR-5100 | |
| Incubator | Sanyo | ||
| Kanamycin sulfate from Streptomyces kanamyceticus | Sigma | K1377 | |
| Medium 199 | Sigma | M3769 | Powder for bicarbonate-buffered media |
| Medium 199 | Sigma | M2520 | Powder for HEPES-buffered media |
| Microscope | Nikon Corp | Nikon Diaphot | |
| Microscope | Nikon Corp | Eclipse E 600 | |
| Monopotassium phosphate | Sigma | P5655 | |
| Paraformaldehyde | Sigma | 158127 | |
| Penicilin | Sigma | P3032 | |
| Phenol Red | Sigma | P5530 | |
| Polyvinyl alcohol | Sigma | P8137 | |
| Polyvinylpyrrolidone | Sigma | P5288 | 360k molecular weight |
| Potassium chloride | Sigma | P5405 | |
| Progesterone | Sigma | P8783 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium choride | Sigma | P5886 | |
| Sodium pyruvate | Sigma | P4562 | |
| Streptomycin | Sigma | S9137 | |
| Testosterone | Sigma | 86500 | |
| Triton X | Sigma | T9284 | |
| Vectashield with DAPI | Vector Laboratories | H1200 | |
| Water | Sigma | W3500 | |
| Zinc sulfate heptahydrate | Sigma | Z0251 |
Références
- Lonergan, P., Fair, T. Maturation of Oocytes in Vitro. Annual Review of Animal Biosciences. 4, 255-268 (2016).
- Luciano, A. M., Franciosi, F., Modina, S. C., Lodde, V. Gap junction-mediated communications regulate chromatin remodeling during bovine oocyte growth and differentiation through cAMP-dependent mechanism(s). Biology of Reproduction. 85 (6), 1252-1259 (2011).
- McLaughlin, M., Telfer, E. E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Galli, C. Achievements and unmet promises of assisted reproduction technologies in large animals: a per-sonal perspective. Animal Reproduction. 14 (3), 614-621 (2017).
- Luciano, A. M., Sirard, M. A. Successful in vitro maturation of oocytes: a matter of follicular differentiation. Biology of Reproduction. 98 (2), 162-169 (2018).
- Lonergan, P., Fair, T. In vitro-produced bovine embryos: dealing with the warts. Theriogenology. 69 (1), 17-22 (2008).
- Clement, M. D. F., Dalbies-Tran, R., Estienne, A., Fabre, S., Mansanet, C., Monget, P. The ovarian reserve of primordial follicles and the dynamic reserve of antral growing follicles: what is the link. Biology of Reproduction. 90 (4), 85(2014).
- Lussier, J. G., Matton, P., Dufour, J. J. Growth rates of follicles in the ovary of the cow. Journal of Reproduction and Fertility. 81 (2), 301-307 (1987).
- Fair, T., Hulshof, S. C., Hyttel, P., Greve, T., Boland, M. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anatomy and Embryology (Berlin). 195 (4), 327-336 (1997).
- Pavlok, A., Lucas-Hahn, A., Niemann, H. Fertilization and developmental competence of bovine oocytes derived from different categories of antral follicles. Molecular Reproduction and Development. 31 (1), 63-67 (1992).
- Blondin, P., Sirard, M. A. Oocyte and follicular morphology as determining characteristics for developmental competence in bovine oocytes. Molecular Reproduction and Development. 41 (1), 54-62 (1995).
- Harada, M., et al. Bovine oocytes from early antral follicles grow to meiotic competence in vitro: effect of FSH and hypoxanthine. Theriogenology. 48 (5), 743-755 (1997).
- Hirao, Y., et al. In vitro growth and development of bovine oocyte-granulosa cell complexes on the flat substratum: effects of high polyvinylpyrrolidone concentration in culture medium. Biology of Reproduction. 70 (1), 83-91 (2004).
- Alm, H., Katska-Ksiazkiewicz, L., Rynska, B., Tuchscherer, A. Survival and meiotic competence of bovine oocytes originating from early antral ovarian follicles. Theriogenology. 65 (7), 1422-1434 (2006).
- Taketsuru, H., et al. Bovine oocytes in secondary follicles grow in medium containing bovine plasma after vitrification. Journal of Reproduction and Development. 57 (1), 99-106 (2011).
- Endo, M., et al. Estradiol supports in vitro development of bovine early antral follicles. Reproduction. 145 (1), 85-96 (2013).
- Makita, M., Miyano, T. Steroid hormones promote bovine oocyte growth and connection with granulosa cells. Theriogenology. 82 (4), 605-612 (2014).
- Yamamoto, K., et al. Development to live young from bovine small oocytes after growth, maturation and fertilization in vitro. Theriogenology. 52 (1), 81-89 (1999).
- Alam, M. H., Lee, J., Miyano, T. Inhibition of PDE3A sustains meiotic arrest and gap junction of bovine growing oocytes in in vitro growth culture. Theriogenology. 118, 110-118 (2018).
- Lodde, V., Modina, S., Galbusera, C., Franciosi, F., Luciano, A. M. Large-scale chromatin remodeling in germinal vesicle bovine oocytes: interplay with gap junction functionality and developmental competence. Molecular Reproduction and Development. 74 (6), 740-749 (2007).
- Lodde, V., et al. Oocyte morphology and transcriptional silencing in relation to chromatin remodeling during the final phases of bovine oocyte growth. Molecular Reproduction and Development. 75 (5), 915-924 (2008).
- Dieci, C., et al. Differences in cumulus cell gene expression indicate the benefit of a pre-maturation step to improve in-vitro bovine embryo production. Molecular Human Reproduction. 22 (12), 882-897 (2016).
- Soares, A. C. S., et al. Steroid hormones interact with natriuretic peptide C to delay nuclear maturation, to maintain oocyte-cumulus communication and to improve the quality of in vitro-produced embryos in cattle. Reproduction, Fertililty and Development. 29 (11), 2217-2224 (2017).
- Soares, A. C. S., et al. Characterization and control of oocyte large-scale chromatin configuration in different cattle breeds. Theriogenology. 141, 146-152 (2020).
- Franciosi, F., et al. Natriuretic peptide precursor C delays meiotic resumption and sustains gap junction-mediated communication in bovine cumulus-enclosed oocytes. Biology of Reproduction. 91 (3), 61(2014).
- Luciano, A. M., et al. Effect of different levels of intracellular cAMP on the in vitro maturation of cattle oocytes and their subsequent development following in vitro fertilization. Molecular Reproduction and Development. 54 (1), 86-91 (1999).
- Bilodeau-Goeseels, S., Panich, P. Effects of oocyte quality on development and transcriptional activity in early bovine embryos. Animal Reproduction Science. 71 (3-4), 143-155 (2002).
- Dieci, C., et al. The effect of cilostamide on gap junction communication dynamics, chromatin remodeling, and competence acquisition in pig oocytes following parthenogenetic activation and nuclear transfer. Biology of Reproduction. 89 (3), 68(2013).
- Shu, Y. M., et al. Effects of cilostamide and forskolin on the meiotic resumption and embryonic development of immature human oocytes. Human Reproduction. 23 (3), 504-513 (2008).
- Lodde, V., et al. Zinc supports transcription and improves meiotic competence of growing bovine oocytes. Reproduction. 159 (6), 679-691 (2020).
- Henderson, K. M., McNeilly, A. S., Swanston, I. A. Gonadotrophin and steroid concentrations in bovine follicular fluid and their relationship to follicle size. Journal of Reproduction and Fertility. 65 (2), 467-473 (1982).
- Kruip, T. A., Dieleman, S. J. Steroid hormone concentrations in the fluid of bovine follicles relative to size, quality and stage of the oestrus cycle. Theriogenology. 24 (4), 395-408 (1985).
- Sakaguchi, K., et al. Relationships between the antral follicle count, steroidogenesis, and secretion of follicle-stimulating hormone and anti-Mullerian hormone during follicular growth in cattle. Reproductive Biology and Endocrinology. 17 (1), 88(2019).
- Makita, M., Miyano, T. Androgens promote the acquisition of maturation competence in bovine oocytes. Journal of Reproduction and Development. 61 (3), 211-217 (2015).
- Walters, K. A., Allan, C. M., Handelsman, D. J. Androgen actions and the ovary. Biology of Reproduction. 78 (3), 380-389 (2008).
- Luciano, A. M., Pappalardo, A., Ray, C., Peluso, J. J. Epidermal growth factor inhibits large granulosa cell apoptosis by stimulating progesterone synthesis and regulating the distribution of intracellular free calcium. Biology of Reproduction. 51 (4), 646-654 (1994).
- Gordon, I. Laboratory Production of Cattle Embryos, 2nd edn. , CABI Publishing. (2003).
- Telfer, E. E., McLaughlin, M., Ding, C., Thong, K. J. A two-step serum-free culture system supports development of human oocytes from primordial follicles in the presence of activin. Human Reproduction. 23 (5), 1151-1158 (2008).
- McLaughlin, M., Albertini, D. F., Wallace, W. H. B., Anderson, R. A., Telfer, E. E. Metaphase II oocytes from human unilaminar follicles grown in a multi-step culture system. Molecular Human Reproduction. 24 (3), 135-142 (2018).
- Fair, T., Hyttel, P., Greve, T. Bovine oocyte diameter in relation to maturational competence and transcriptional activity. Molecular Reproduction and Development. 42 (4), 437-442 (1995).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon