Method Article
過期治療アプリケーションを用いてラット頸動脈圧制御区分バルーン損傷
要約
ラット頸動脈バルーン傷害は、アテローム硬化性血管の血流を回復させるために行われる臨床血管形成術手順を模倣する。このモデルは、動脈壁を遠ざけ、内皮細胞の内皮層を脱脂することによって動脈損傷応答を誘導し、最終的にはリモデリングおよびインティタル過形成応答を引き起こす。
要約
心血管疾患は、アテローム性動脈硬化症の一部により、世界中の死亡および障害の主な原因であり続けている。動脈硬化性プラークは、動脈の発光表面積を狭くし、器官および遠位組織への十分な血流を減少させる。臨床的には、ステント配置の有無にかかわらずバルーン血管形成術などの血管形成術のような再血管形成手順は、血流を回復させることを目的としている。これらの手順は、プラークの負担を軽減することによって血流を再確立するが、それらは、動脈治癒応答を開始する血管壁を損傷する。長期の治癒応答は動脈の修復、または再狭動を引き起こし、最終的にこれらの再血管化処置の長期的な成功を制限する。したがって、前臨床動物モデルは、レステノーシスを駆動する病態生理学的メカニズムを分析するために不可欠であり、新たな治療戦略をテストする機会を提供する。ネズミモデルは、大型動物モデルよりも安価で操作が簡単です。バルーンまたはワイヤー損傷は、マウスモデルで使用される2つの一般的に受け入れられている傷害モダリティです。特にバルーン傷害モデルは、臨床血管形成術を模倣し、修復の発達のために動脈に十分な損傷を引き起こす。ここでは、改変された、圧力制御されたラット頸動脈バルーン傷害モデルを行い、組織学的に分析するための外科的詳細を説明する。さらに、このプロトコルは、新内皮過形成を阻害するためにどのように治療の局所的な来期適用を使用することができるかを強調する。最後に、3次元で動脈損傷を可視化・可視化するための新しいアプローチとして、光シート蛍光顕微鏡を紹介する。
概要
心血管疾患(CVD)は、世界的に主要な死因である1.アテローム性動脈硬化症は、ほとんどのCVD関連の罹患率および死亡率の根本的な原因である。アテローム性動脈硬化症は、動脈内のプラークの蓄積であり、管腔が狭くなり、臓器および遠位組織への適切な血液灌流を妨げる2。重度のアテローム性動脈硬化症を治療するための臨床介入には、ステント配置の有無にかかわらずバルーン血管形成術が含まれる。この介入は、バルーンカテーテルをプラークの部位に進め、バルーンを膨らませてプラークを動脈壁に圧縮し、明るい領域を広げることを含む。しかし、この手順は動脈損傷応答3を発する動脈に損傷を与える。この傷害応答の長時間の活性化は、動脈の修復、または再狭小化、新内皮過形成および血管リモデリングに二次的に至る。血管形成術の間、内皮層は、即時血小板の形成および局所炎症をもたらす内皮細胞の脱ヌードである。局所シグナル伝達は、血管平滑筋細胞(VSMC)および発着性線維芽細胞における表皮変化を誘発する。これは、内腔へのVSMCおよび線維芽細胞の内向きの移動および増殖につながり、新内皮過形成4、5に至る。循環前駆細胞および免疫細胞も、全量の休止に寄与する。適用可能な場合、薬物溶出ステント(DES)は、残り性化7を阻害するための現在の標準である。しかし、DESは動脈再血管形成を阻害し、従って、後期ステント血栓症8を生じさせるプロ血栓性環境を作り出す。したがって、動物モデルは、再脳炎の病態生理を理解し、再血管化手順の有効性を延長するためのより良い治療戦略を開発するために不可欠である。
この病理を研究するために、大小の動物モデル9がいくつか利用されている。これらは、動脈の光側のバルーン傷害3、10またはワイヤー傷害11、ならびに動脈の周りの部分結紮12またはカフ配置13を含む。バルーンとワイヤーの損傷は、両方とも動脈の内皮層を脱裸にし、血管形成術後に臨床的に起こることを模倣する。特に、バルーン傷害モデルは、臨床設定(すなわちバルーンカテーテル)と同様のツールを利用する。ラット動脈は市販のバルーンカテーテルに適したサイズであるため、バルーン損傷はラットモデルで最もよく行われます。ここで我々は、圧力制御された細分動脈損傷、ラット頸動脈バルーン損傷の確立された、改変されたバージョンを記載する。この圧力制御アプローチは、臨床血管形成術を密接に模倣し、傷害14、15の2週間後に再現可能な新内皮過形成を可能にする。さらに、この圧力制御動脈損傷は手術後2週間までに完全な内皮層復帰をもたらす16.これは、内皮層が完全なカバレッジ3に戻らないクロウズによって記述された元のバルーン傷害モデルと直接対照的です。
手術後、治療はいくつかのアプローチを通じて、損傷した動脈に適用されるか、または向けられ得る。本明細書に記載される方法は、プルロン酸ゲル溶液に埋め込まれた小分子の回来期適用を使用する。具体的には、100μMシンナミックアルデヒドの溶液を25%プルロニックF127ゲルで動脈に塗布し、新内膜過形成を阻害する損傷直後に動脈に塗布する。Pluronic-F127は、制御された方法で薬物を局所的に送達することができる無毒、熱可逆ゲルである17.一方、動脈損傷は局所的であるため、地方行政はオフターゲット効果を最小限に抑えながらアクティブな原則をテストすることを可能にする。それにもかかわらず、この方法を用いた治療の有効な送達は、使用される低分子または生物学的の化学に依存する。
プロトコル
ここに記載されているすべての方法は、ノースカロライナ大学チャペルヒル校の施設動物のケアと使用委員会(IACUC)によって承認されています。
1. 術前の手順
- 手術器具を殺菌する。手術前に手術器具をすべてオートクレーブ。同じ日に複数の手術を行う場合は、乾燥ビーズ滅菌器を使用して手術の間に器具を殺菌します。
- 25%Pluronic-127ゲル(滅菌蒸留水で希釈)で治療を準備します。
- 2F Fogartyバルーンカテーテルをインスフレーターに設置し、生理食音溶液で満たされた1mLシリンジにカテーテルのバルーン端を置きます。
- 5%のイオブルランを有するチャンバーにラットを入れることによって麻酔を誘発する。
- チャンバーからラットを取り出し、ラットの体重を記録します。腹側首領域に毛皮を剃るためにヘアクリッパーを使用してください。
- 5%イソファランでラットをチャンバーに戻し、麻酔の誘導を確実にします。
- ラットの顔が外科医に向かるように、鼻コーンに顔を挿入し、外科用プラットフォーム上にラットの上に置きます。
- 吸入麻酔を1.5%のイオブルランに減らす。4フィートすべてでつま先ピンチ反射で麻酔の深さを確認します。
- 手術用プラットフォームに4本の脚をすべてテープで留めます。
- ヒートランプをオンにします。
- アトロピン(0.01 mg/kg)を皮下に注入して気道分泌物を減らす。
- 予防的な痛みの管理のためにカルプロフェン(5mg/kg)皮下に注入してください。抗炎症薬が実験に受け入れられない場合は、ステップ3.2.2および3.2.3を参照してください。
- 手術中に角膜が乾燥するのを防ぐために、滅菌綿棒を使用して両眼に潤滑剤の眼軟膏を塗布します。
- 70%のエチルアルコールの間で交互に回交する円形の動きで首を3回スワブし、続いて剃った領域の中心から外側にベタジンを回して切開部位を殺菌する。
- 0.25%ブピバカインで切開線s.cを浸潤する。
- 滅菌手術用器具および消耗品を取り扱う前に、無菌の外科用手袋を着用してください。
- 無菌の外科シート上のすべてのオートクレーブ外科器具をレイアウトします。
- 無菌7-0プロレン縫合糸の3つの独立した1インチのストランドをカット。
- 綿棒とガーゼを外科シートに置きます。
- 滅菌された首領域のみを露出する無菌外科シートでラットをドレープする。
- ノーズコーンの一部を露出するシートに小さな開口部を追加で切ります。これは、傷害の間にバルーンカテーテルをテーピングするためのサイトになります。
2. 手術手順
- 外科的処置全体の間に、呼吸数を監視することによって麻酔の深さを評価する(速度は一貫しており、正常とみなされるべきである)、また15分ごとにつまみつまみによって。呼吸数が増加するか、つま先ピンチに対する応答がある場合は、外科的操作を一時停止し、イオブルランを最大2.5%まで増加させる。
- 一般的な頸動脈(CCA)を公開します。
- ラットの顎骨の間に表面的でまっすぐな縦方向のネックライン切開を行います。切開は約1.5~2cmの長さになります。
- 筋肉層が露出するまで、皮膚の下の結合組織を通して切開を行います.皮膚の下の唾液腺を置き換えて、筋肉組織にアクセスする。
- 筋肉層と結合組織の間に閉じたはさみを挿入して筋肉から結合組織を鈍く分離し、皮膚を上方に引っ張りながらはさみをそっと開く。
- 2つの表面筋に垂直に走る第三の筋肉(オモヨイド)が観察されるまで、気管の左側に沿って2つの目に見える筋肉(ステルノヒロイドと胸骨腫)を縦方向に解剖する。
- 鉗子を使用して、この垂直筋肉(オモヨイド)と気管の上を走る縦方向筋(ステルノヒョイド)を分離する窓を作ります。気管への鈍い外傷を防ぐために、この分離を穏やかに行います。
- 垂直筋肉の下の鉗子に到達し、2つの縦筋を分離し、CCAを露出させるために切断する。
- CCAを解剖する。
- 内部頸動脈(ICA)および外頸動脈(ECA)が露出するまで、分岐の近くでCCAを解剖する。
- ECAから分岐する上甲状腺動脈(STA)を解剖する。
- プレカットプロレン縫合糸を使用して、STAとECAをそれぞれの分岐の近くにリゲートします。結び目の片側に縫合糸の大部分を残し、湾曲した止まり糸で各縫合糸をつかむ。
- ICAの周りの解剖を終え、ICAの下および周囲の鉗子に達し、遠位制御を達成するために非破砕の血管クランプを使用する。ICAと一緒に後頭動脈をクランプします。
- CCA近位を分岐に解剖し、迷走神経をCCAから分離することを保証する。
- CCAの下および周囲の鉗子に達し、近位制御を達成するために非破砕の管クランプを使用する。分岐からクランプを5mm以上に配置します。
- バルーン損傷を行います。
- 各連結動脈枝を保持する湾曲した止血を操縦し、ECAと上位枝の間の分岐を露出させる。
- 分岐で組織を穏やかに解剖し、その後、マイクロディションハサミを使用してECAと優れた枝の間の動脈切開を行います。
- 綿棒を使用して、CCAからすべての血液を押し出し、動脈切開部位をクリーンアップします。
- 膨張していないバルーンカテーテルを動脈切開術を通して挿入し、バルーンの近位端が分岐を過ぎるまでCCAに進みます。
- バルーンがインフレ時に動脈から抜け出さないように、鼻コーンにカテーテルをテープで貼ります。
- ゆっくりと圧力の5気圧に気球を膨らませ、動脈損傷を誘発するために5分間CCAに残します。圧力が5分間一定であることを確認します。
- 5分後、バルーンを収縮させ、動脈切開術を通してCCAから静かに取り除きます。
- CCAでクランプを軽く絞ってCCAをフラッシュします。クランプを取り外さない。
- ECA近位を動脈切除術にリゲートし、CCAとICAからクランプを取り外して、CCAからICAへの血流を回復させます。動脈切開術の周りに目に見える出血がなく、CCAが脈動していることを確認してください。
- 100 μLの治療用またはプルロニックゲル車両を、負傷したCCAに沿って単独で回来して塗布します。CCAの左側に50 μLを塗布し、次に50 μLをCCAの右側に塗布して、損傷した動脈のコーティングを確実にします。
- 創傷部位を閉じます。
- 余分なプロレン縫合糸をカットします。
- 結合組織に沿って中断された4-0または6-0のvicryl層を使用して創傷を閉じます。
- 皮膚に沿って4-0ナイロン縫合糸を実行して傷を閉じます。
3. 術後の手順
- ラットを暖房ランプの下にケージの半分を持つきれいなケージに一人で入れ、ラットが胸骨の不通を維持するのに十分な意識を取り戻すまで監視します。動物が完全に警戒し、元のケージに戻す前に移動するまで、別のケージにラットを保管してください。
- 次の3日間、そして安楽死まで週に3回、ラットを毎日監視する。イソフルランの過剰摂取を用いて安楽死させ、続いて後に、後述するように両側性乳房切除術を行う。
- 国立研究研究動物改良&縮小センターを活用して、術後の痛みのレベルを特定します。いずれかの動物が痛みを経験しているか、神経学的妥協を開発しているように見える場合は、すぐに犠牲を払ってください。
- カルプロフェンを受け取らない動物の場合、手術後48時間までに24時間前に飲料水中にアセトアミノフェン6mg/mLを投与する。アセトアミノフェンは、最小限の抗炎症効果と鎮痛を提供します.
- あるいは、抗炎症作用が最小限の他の鎮痛戦略を、ブプレノルフィンまたはブプレノルフィン拡張放出など使用することができる。所属機関の獣医チームに相談してください。
4. 組織の収穫とイメージング
- 手術の2週間後、麻酔の過剰摂取によってラットを安楽死させる(5%イソファラン)。あるいは、早期の時点でラットを安楽死させ、動脈損傷応答の様々な側面を分析する。
- 呼吸停止が終了すると、安楽死の二次的な方法として両側性乳房間術を行う。
- 腹部を横切りし、横隔膜と肋骨を通して上方に切り、胸腔を露出させる。
- 動脈を浸透させ、固定する。
- 左心室を通して重力灌流固定システムに取り付けられた18Gカニューレを挿入します。ベンチトップ(120cmの高さ、91±3 mmHgに相当)に対して灌流システムの高さを印示することによって、ラット間の同等の圧力を維持する。
- 湾曲した止止まりを使用して、心室と一緒にカニューレをクランプします。
- 右心房で切り取り、血管回路を開き、PBSで灌流を開始し、続いて2〜4%パラホルムアルデヒド(それぞれ約250mL)を続けます。
- 犠牲の日、またはせいぜい犠牲の前夜にPBSで希釈したパラホルムアルデヒドを準備します。犠牲の日に準備する場合は、パラホルムアルデヒドが灌流を開始する前に室温まで冷却されていることを確認してください。パラホルムアルデヒドを4°Cで保存する。
- 固定後、左右の頸動脈を抽出し、2〜4%パラホルムアルデヒドで4°Cで2時間保存します。
- 動脈を30%スクロースに移し、4°Cで一晩保管する。
- 16-24時間後、最適な切断温度(OCT)化合物に動脈を埋め込み、OCT組み込み動脈ブロックを凍結する。
- 室温で10分間の10分間の状態動脈。1000で満たされたクリオマールの平面に平行に動脈を置き、動脈分岐が直面しているクライオムドの側面をマークする。液体窒素でスナップフリーズ。
- 冷凍ブロックを-80°Cで長期保存。
- クライオスタットを使用してブロックを凍結セクション。
- スライド1は分岐から始まる、スライドごとに6μmの厚い動脈断面を収集します。
- 過形成が見えなくなるまで、セクション凍結ブロック(約100枚のスライド)。
- ヘマトキシリン&エオシン(H&E)の汚れスライド18
- 分岐から始まる動脈全体に沿って10回に1回のスライドを染色することによって傷害の領域を見つける(例えば、スライド1、10、20、30、40、50、60、70、80、90、および100)。
- 損傷部位の周りに追加のスライドを染色して、ピーク咬合を有するスライドを見つける(例えば、スライド20、30、および40は目に見える過形成を有し、したがって、スライド15、25、35、および45を染色する)。
- ピークオクルージョンスライド前後のピークオクルージョンと等距離スライドでスライドを染色し定量化し(例えば、スライド35で見つかったピークオクルージョン、スライド25、45等)を染色し、ラット当たり合計3〜10枚のスライドを定量する。
- 光シート蛍光顕微鏡画像処理の場合、ステップ4.4で固定後4°Cで動脈を一晩保存します。
- ウサギ抗CD31一次抗体を1:500希釈して3日間の希釈剤(pH7.4)で動脈をプローブする。次に、抗ウサギアレクサフルオール647二次抗体の1:500希釈で動脈に対して2日間19.
- iDISCO+20を使用して動脈をクリアします。
- 光シート蛍光顕微鏡21を用いて動脈を画像化する。ソフトウェア(例えば、イマリス)を使用して画像をレンダリングする19.
- 新内皮過形成を定量化する。可能であれば、ブラインドで定量を行います。
- ImageJソフトウェアを使用して、上で決定した3〜10スライドのそれぞれ上の動脈のインティマ、内部弾性層(IEL)、および外的弾性層(EEL)の周囲を追跡します(ステップ4.8.3)。
- ImageJ でトレースされた各領域の面積を数値化し、これらの値をエクスポートします。インティマ トレースはルーメン領域を生成し、IEL トレースは IEL 領域を生成し、EEL トレースは EEL 領域を生成します。
- ラット頸動脈あたりの平均傷害(%閉塞、インティマ:培地(I:M)比、新内皮過形成)を得るために3-10スライドから得られた値を平均する。
ネオインティマル過形成 = IELエリア - ルーメンエリア
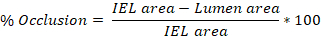
結果
図1は、この手術を行うために使用されるすべての材料および外科用具を示しています。ヘマトキシリン&エオシン(H&E)2週間の損傷した動脈断面の染色は、新内皮肥大の明確な視覚化を可能にする。図2は、健康、負傷、治療された動脈のH&E染色動脈断面の代表的な画像を示しています。図2はまた、画像処理ソフトImageJを用いて、損傷した動脈における新内皮過形成のレベルを定量化する方法を概説する。このアプローチを使用して、ネオインティマの周囲、ならびに内部および外部弾性層層がそれぞれの領域を定量化するために追跡される。我々が記述する圧力制御された区分傷害法は、0.29(2つの異なる外科医およびn=11ラット)の標準偏差を有する0.80のメディア比に対するインティマをもたらすと説明する。PLUROnicにおけるCAの回来期適用による治療は、前に示したように、新内皮過形成の阻害をもたらす(閉塞率の61%減少)15。
図3 は、ECAとSTAの分岐で最適な動脈切除術を作成するための図 を示しています 。CD31染色は、内皮層を裏打ちする内皮細胞を可視化するために、固定動脈上で行うことができる。動脈は、1%アガロースに埋め込まれ、iDISCO+法を用いてクリアして、サンプル20の屈折率を均質化することができる。その後、動脈を光シート蛍光顕微鏡で画像化することができ、I:M比を定量化するためのソフトウェアを使用して画像をレンダリングすることができます。このアプローチを用いて、H&Eの結果と一致する0.86のI:M比を得た。
| セクション番号 | 参照 |
| 10セクション | 27 |
| 8つのセクション | 28 |
| 6-10セクション | 29 |
| 6 つのセクション | 30 |
| 5つのセクション | 31 |
| 3つのセクション | 32 |
表 1.過形成解析のために一般的に使用される動脈断面の数。
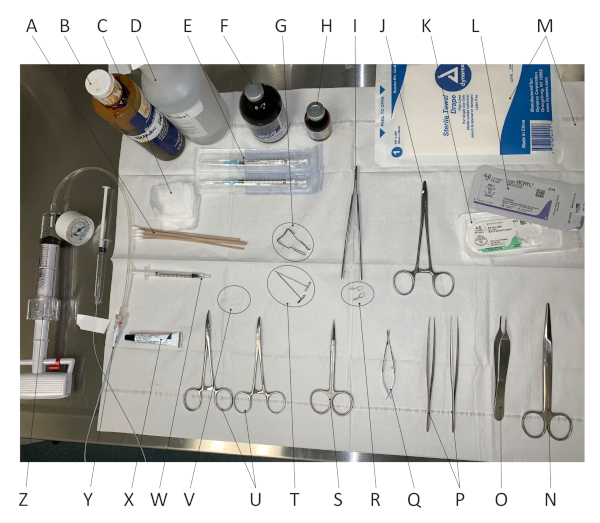
図 1.手術器具とツール。 画像の左上隅から時計回りに開始する順序で: (A) 綿棒;(B)ベタジン溶液;(C) ガーゼ;(D) 70% エチルアルコール溶液;(E)針付き1ccの注射器;(F) アトロピン;(G) リトラクター;ここで使用される曲がったペーパー クリップ。(H) リマディル;(I) 鉗子を適用するマイクロサーリファインクランプ;(J)針ホルダー;(K)4-0ナイロン縫合糸;(L) 4-0 ビクリル縫合糸;(M) 無菌ドレープ;(N)マヨハサミ;(O) 標準鉗子;(P) 微細曲面鉗子;(Q) マイクロディセクセ(R) マイクロセリファインクランプ;(S) 細かいはさみ;(T) T ピン;(U) 湾曲止止(V) 3つの7-0プロレン縫合糸は約1インチに切断される。(W)100 μLの 25% pluronic-127 ゲル;(X) 潤滑眼軟膏;(Y)2フランス風船塞栓カテーテル無菌生理液中;(Z) インスフレーター. この図の大きなバージョンを表示するには、ここをクリックしてください。

図 2.ヘマトキシリン&エオシン(H&E)ラット頸動脈の断面の染色および分析。(A)健康な、怪我をしていない右頸動脈の断面。IEL = 内部弾性薄層、EEL = 外部弾性薄層。(B)2週間の負傷した左頸動脈の断面は、プルロニック-F127車両で治療した。(C)100 μMのシンナミックアルデヒドで治療された2週間の左頸動脈の断面。スケールバー= 100 μm(D) 損傷を定量化するための凍結動脈の断面図。スライド1は分岐から始まり、幅5μmの6つの動脈セクションがスライドごとに取られます。通常、このスライドの前に損傷が発生するので、断面はスライド70に続きます。(E) 負傷した左頸動脈の断面を、プルロニック車両で処置した (B).最も内側の黒い線はネオインティマをトレースし、明るい領域を示します。真ん中の黄色の線は、内部弾性層の領域、またはチュニカのインティマを示します。外側の青い線は、外弾性層、またはチュニカアドベンティシアの領域を表します。スケールバー = 100 μm(F)(E)から得られた測定値に基づいて、パーセントの血管閉塞とインティマ:メディア(I:M)比を測定するために使用される計算。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 3.動脈開管作り。 適切な動脈管を作成し、偽の道を避けるために手順の図。CCA=一般的な頸動脈、ECA=外外頸動脈、ICA=内頸動脈、OA=後頭動脈、STA=優れた甲状腺動脈。ECAとSTAの分岐間の分岐を分離します。この分岐を、領域が明るい色に変わるまで、動脈壁の薄さを示し、その後、マイクロ解剖ハサミを使用して動脈切除術を作成します。細かい鉗子を使って動脈管内開管術を行い、バルーン挿入を補助する。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図 4.動脈損傷を可視化する光シート蛍光顕微鏡。 下に代表的な横断セクションを持つ14週齢のスプレイグ・ドーレーラットからの一般的な頸動脈の長さに沿った縦断断面。動脈はCD31で染色され、AF647で対等化される。(A)健康な、怪我をしていない右頸動脈の断面。白 =CD31、緑=弾性薄層、L =ルーメン、スケールバー=200-500μm.(B)負傷の断面、左頸動脈はプルロニックF127車両で治療した。矢印は、新内皮過形成の領域を示す。(C) インティマ対メディア (I:M) 損傷していない頸動脈の比率, 各グループに正確な値を記載 (n=1). この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ラット頸動脈バルーン損傷は、最も広く使用され、研究されたレステノーシス動物モデルの1つです。元のバルーン傷害モデル3および改変された圧力制御性区分損傷変動10はいずれも、ヒトにおいても起こる動脈損傷応答の多くの側面を知らせており、フィブリンが豊富な血栓はめったに発症せず、局所炎症は高コレステロール血症ウサギまたはブタモデル9,22のような他の傷害モデルと比較して最小限であるという制限はほとんどない。ラットはまた、動脈損傷応答の異なる側面を定量化し、分析するために異なる時点で犠牲にすることができます。例えば、早期の時点で細胞増殖、血管平滑筋細胞の表現型切り替え、早期免疫応答などの傷害に対する早期応答の側面を研究するために使用できます。我々は、白血球の浸潤および細胞増殖が3日から1週間16の間で最大であることを示した。中間の時点は再内皮化の速度を査定するために使用することができる。この時点で動脈がほとんど再内皮化されるとして、2週間のタイムポイントは、新内皮過形成を測定するための最も早い提案された時点である。このモデルを翻訳するための大きな制限は、損傷が健康な動脈で行われるのに対し、この処置はアテローム硬化性疾患の患者で起こる。この制限は、以前の利用可能なラットアテローム性動脈硬化症モデル23、24の欠如のために部分的に存在する。しかし、遺伝子編集技術の進歩により、信頼性の高いアテローム硬化性ラットモデル24の開発が可能となり、レステノーシスの病態生理学を研究する新たな洞察が得られる可能性がある。
比較的、雄ラットは雌ラットよりも強い傷害を生じ、これは通常、エストロゲン25の保護効果のために、より少ないネオインチマル過形成を発症する。しかし、記載されたモデルは、女性の動脈治癒を研究するのにまだ適切である。雄ラットは12〜16週齢、300〜400gの間で最も堅牢で再現性の高い新内皮形成を生み出す。12週齢より若いラットを使用してもよい。しかし、これらの若いラットの動脈は、ラット株に応じて容易に動脈に入るには2Fバルーンには小さすぎる可能性があります。200グラム以下の体重のラットは、バルーンが動脈切開術を通って容易に収まらず、強制された場合に実際に動脈を引き裂くことができるので、このモデルで手術すべきではありません。さらに、16週齢より古いラットを使用すると、新内皮形成において可変的な応答を生じ得る。様々なラット株は、この傷害モデルを実行するために使用することができ、スプレイグ・ドーリーラットは文献26全体で最も頻繁に使用されている。手術を開始するには、まず、顎の骨を感じ、ラットの鼻を使用して正中線を見つけることによって、首の切開部位の適切な位置合わせと向きを得る。最初の切開後、互いに平行に動く2つの縦筋(ステノヒロイドと胸骨腫)が可視化されるまで組織を解剖する。首の筋肉(マッセスター)を操作ウィンドウの下限として、頭に向かって使用します。体に向かって走る平行筋を、これら2つに垂直に走る筋肉が視覚化されるまで、互いに分離する。垂直筋を切断すると、2つの平行筋の容易な引き込みが可能になり、頸動脈が露出する。解剖学は各動物とわずかに異なり、その位置合わせと共に、ICAの上に小動脈枝が存在する可能性がある。このマイナーブランチはICAと一緒にクランプすることができます。ただし、この小さなブランチがクランプされていない場合は、手順の実行に問題はありません。さらに、締め付けと縫合が行われる前に、ICAとCCAの両方から迷走神経を解剖してください。この時点で、優しく、神経の損傷を避けることは重要です。動物がクランプを置いた後にぴくぴくした場合、それは金属クランプに接触する迷走神経の応答である可能性があります。クランプを再入れすることを検討してください。
間違いなく、全体の手順の最もトリッキーなステップは、動脈開管を作っています。これは、動脈切開術を「偽」にすることが可能であり、この「偽」動脈切除術を通してバルーンを挿入すると、バルーンが動脈の内側ではなく、実際に動脈の上を走る原因となるからです。これが起こった場合、CCAでの分岐に近い新しい動脈切除術を可能な解決策であるが、気球が動脈に強制された場合、手術は手間がかからないかもしれない。「偽」動脈切除術を防ぐために(図3)、ECAとSTA分岐で、近くの領域よりも外観が著しく赤くなるまで細かい鉗子を使用して、その側天子層を解剖し、動脈のその部分が突き出ているように見える。その後、マイクロハサミを使用して、分岐のクリア領域にハサミの1本のプロングを素早く挿入し、切断することによって動脈切開を作成します。動脈管を作った後、細かい鉗子を使って動脈の開口部を持ち上げ、バルーンを管腔に押し込みます。バルーンは、動脈切開術を通ってCCAに容易にスライドする必要があります。ラットの位置によっては、細かい鉗子を使用して、バルーンカテーテルをCCAに導きながら、CCAの外側を優しく上方に引っ張ることによって、バルーンをCCAに導くのに役立つことがあります。バルーンをCCAに挿入した後、バルーンが膨張している間に動脈を出ないようにカテーテルをテープダウンします。
治療の周辺アプリケーションは、傷害部位でのみ局所および指示薬物送達を可能にする。このアプローチは、潜在的なオフターゲット効果だけでなく、経口、腹腔内、または静脈内投与によって全身的に提供されたものと比較して投与制限を制限します。Pluronic-F127は熱可逆性であり、室温で冷たい温度で液体、ゲルであることを意味する。これにより、治療は、Pluronicゲルの前に液体溶液中で容易に調製することができ、ゲルは傷害直後に動脈に均等に適用することができます。CCAの上部は、効果的に損傷の領域全体をカバーするために容易にアクセス可能である一方、CCAは、CCAの底部をコーティングするために穏やかに持ち上げるべきです。しかし、研究者は、治療された動物間の潜在的な変動性を考慮するために、研究に適切な力を与えることを確認する必要があります。期待される効果の大きさと結果の標準偏差を推定して、研究に適切な力を与える必要があります。期日受入期の送達方法の制限は、患者の動脈が血管形成術の間に露出しないために臨床的に関連するアプローチではないということであり、これは経皮的処置として行われる。それにもかかわらず、来場期のアプリケーションは、傷害の部位に局所的に送達される分子および生物学的製剤の予備試験を可能にする15,27,28,29,30.
新内皮過形成の現在の標準的な方法は、H&E染色されたスライドの形態学的分析に基づいています。損傷した頸動脈は5μmのスライスのスライドに物理的に切り離される。これらのスライドはH&Eを用いて染色され、画像は光顕微鏡を用いて撮影される。ImageJ ソフトウェアは、インティマ、内部ラミナ、および外部積層によって区切られた領域と境界を測定するために使用されます。我々は、過形成を定量化するために10枚のスライドを使用して精度を上げた報告をしましたが、測定するスライドの数に関するコンセンサスは文献に存在しません。標準偏差 0.29 (n =11) の I:M 比は、この方法論 (範囲: 0.54-1.51) を使用して期待できます。我々および他の人々は以前に報告したライトシート蛍光顕微鏡(LSFM)動脈損傷19、37を視覚化するための新しいアプローチを提供する。LSFMは、x、y、およびz平面における頸動脈全体のイメージングを可能にする。LSFMは、光学スライスが分析のための動脈断面を生成することを可能にし、従来の組織学的アプローチ19,37よりも過形成(変動係数:LSFMによる28%対組織学による41%)の正確な推定値を生み出す。図4に示すように、LSFM(0.86,n=1)によって得られるI:M比は、古典的な組織学的分析(0.8±0.29)を通じて得られた結果と同等である。
結論として、圧力制御された分節損傷は、臨床再血管化処置後に起こる動脈損傷応答を再現し、修復の病態生理学を研究するための理想的なモデルとなる。来期薬の適用は、局所的な薬物送達の治療効果をアッセリングするための有用な概念実証送達方法であり、標的全身薬物送達アプローチの開発を知らせることができる。
開示事項
著者らは、この原稿の出版に関して利益相反はないと宣言している。
謝辞
N.E..Bは、国立環境衛生研究所(5T32ES007126-35、2018)と米国心臓協会の博士前フェローシップ(20PRE35120321)からの訓練助成金によって支援されました。E.S..M.Bは、UNC臨床・トランスレーショナルサイエンス賞K12奨学生プログラム(KL2TR002490、2018)、国立心臓・肺・血液研究所(K01HL145354)の一部の支援を受けたKL2学者でした。著者らは、LSFMを支援してくれたUNC顕微鏡サービス研究所のパブロ・アリエル博士に感謝する。光シート蛍光顕微鏡は顕微鏡サービス研究所で行いました。病理学・検査医学科の顕微鏡サービス研究所は、P30 CA016086がんセンターのコアサポート補助金によって、UNCラインバーガー総合がんセンターに支えられている。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | Fisher | 14955450 | |
| 1 mL Syringe with needle | BD | 309626 | |
| 2 French Fogarty Balloon Embolectomy Catheter | Edwards LifeSciences | 120602F | |
| 4-0 Ethilon (Nylon) Suture | Ethicon Inc | 662H | |
| 4-0 Vicryl Suture | Ethicon Inc | J214H | |
| 7-0 Prolene Suture | Ethicon Inc | 8800H | |
| 70% ethyl alcohol | |||
| Anti-Rabbit Alexa Fluor 647 | Thermo Fisher Scientific | A21245 | |
| Atropine Sulfate | Vedco Inc | for veterinary use | |
| Cotton Swabs | Puritan | 806-WC | |
| Curved Hemostats | Fine Science Tools | 13009-12 | |
| Fine Curved Forceps | Fine Science Tools | 11203-25 | |
| Fine Scissors | Fine Science Tools | 14090-11 | |
| Gauze | Covidien | 2252 | |
| IHC-Tek Diluent (pH 7.4) | IHC World | IW-1000 | |
| Insufflator | Merit Medical | IN4130 | |
| Iodine solution | |||
| Lubricating Eye Ointment | Dechra | for veterinary use | |
| Mayo Scissors | Fine Science Tools | 14010-15 | |
| Micro Serrefines | Fine Science Tools | 18055-05 | |
| Microdissection Scissors | Fine Science Tools | 15004-08 | |
| Micro-Serrefine Clamp Applying Forceps | Fine Science Tools | 18057-14 | |
| Needle Holder | Fine Science Tools | 12003-15 | |
| Pluronic-127 (diluted in sterile water) | Sigma-Aldrich | P2443 | 25% prepared |
| Rabbit Anti-CD31 | Abcam | ab28364 | |
| Retractor | Bent paper clips work well | ||
| Rimadyl (Carprofen) | Zoetis Inc | for veterinary use | |
| Saline solution | |||
| Standard Forceps | Fine Science Tools | 11006-12 | |
| Sterile Drape | Dynarex | 4410 | |
| T-Pins |
参考文献
- American Heart Association. Cardiovascular Disease: A Costly Burden for America, Projections Through 2035. American Heart Association CVD Burden Report. , (2017).
- Singh, R. B., Mengi, S. A., Xu, Y. J., Arneja, A. S., Dhalla, N. S. Pathogenesis of atherosclerosis: A multifactorial process. Experimental and Clinical Cardiology. 7 (1), 40-53 (2002).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Mechanisms of stenosis after arterial injury. Laboratory Investigation. 49 (2), 208-215 (1983).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Kinetics of cellular proliferation after arterial injury. I. Smooth muscle growth in the absence of endothelium. Laboratory Investigation. 49 (3), 327-333 (1983).
- Sartore, S., et al. Contribution of adventitial fibroblasts to neointima formation and vascular remodeling: from innocent bystander to active participant. Circulation Research. 89 (12), 1111-1121 (2001).
- Tanaka, K., et al. Circulating progenitor cells contribute to neointimal formation in nonirradiated chimeric mice. The FASEB Journal. 22 (2), 428-436 (2008).
- Henry, M., et al. Carotid angioplasty and stenting under protection. Techniques, results and limitations. The Journal of Cardiovascular Surgery. 47 (5), Torino. 519-546 (2006).
- Kounis, N. G., et al. Thrombotic responses to coronary stents, bioresorbable scaffolds and the Kounis hypersensitivity-associated acute thrombotic syndrome. Journal of Thoracic Disease. 9 (4), 1155-1164 (2017).
- Jackson, C. L. Animal models of restenosis. Trends in Cardiovascular Medicine. 4 (3), 122-130 (1994).
- Shears, L. L., et al. Efficient inhibition of intimal hyperplasia by adenovirus-mediated inducible nitric oxide synthase gene transfer to rats and pigs in vivo. Journal of the American College of Surgeons. 187 (3), 295-306 (1998).
- Takayama, T., et al. A murine model of arterial restenosis: technical aspects of femoral wire injury. Journal of Visualized Experiments. (97), (2015).
- Zhang, L. N., Parkinson, J. F., Haskell, C., Wang, Y. X. Mechanisms of intimal hyperplasia learned from a murine carotid artery ligation model. Current Vascular Pharmacology. 6 (1), 37-43 (2008).
- Jahnke, T., et al. Characterization of a new double-injury restenosis model in the rat aorta. Journal of Endovascular Therapy. 12 (3), 318-331 (2005).
- Gregory, E. K., et al. Periadventitial atRA citrate-based polyester membranes reduce neointimal hyperplasia and restenosis after carotid injury in rats. American Journal of Physiology-Heart and Circulatory Physiology. 307 (10), 1419-1429 (2014).
- Buglak, N. E., Jiang, W., Bahnson, E. S. M. Cinnamic aldehyde inhibits vascular smooth muscle cell proliferation and neointimal hyperplasia in Zucker Diabetic Fatty rats. Redox Biology. 19, 166-178 (2018).
- Bahnson, E. S., et al. Long-term effect of PROLI/NO on cellular proliferation and phenotype after arterial injury. Free Radical Biology and Medicine. 90, 272-286 (2016).
- Gilbert, J. C. W., Davies, M. C., Hadgraft, J. The behaviour of Pluronic F127 in aqueous solution studied using fluorescent probes. International Journal of Pharmaceutics. 40 (1-2), 93-99 (1987).
- Tulis, D. A. Histological and morphometric analyses for rat carotid balloon injury model. Methods in Molecular Medicine. 139, 31-66 (2007).
- Buglak, N. E., et al. Light Sheet Fluorescence Microscopy as a New Method for Unbiased Three-Dimensional Analysis of Vascular Injury. Cardiovascular Research. , (2020).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Ariel, P. UltraMicroscope II - A User Guide. , (2018).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Xiangdong, L., et al. Animal models for the atherosclerosis research: a review. Protein Cell. 2 (3), 189-201 (2011).
- Chen, H., Li, D., Liu, M. Novel Rat Models for Atherosclerosis. Journal of Cardiology and Cardiovascular Sceinces. 2 (2), 29-33 (2018).
- Xing, D., Nozell, S., Chen, Y. F., Hage, F., Oparil, S. Estrogen and mechanisms of vascular protection. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (3), 289-295 (2009).
- Tulis, D. A. Rat carotid artery balloon injury model. Methods in Molecular Medicine. 139, 1-30 (2007).
- Pellet-Many, C., et al. Neuropilins 1 and 2 mediate neointimal hyperplasia and re-endothelialization following arterial injury. Cardiovascular Research. 108 (2), 288-298 (2015).
- Wu, B., et al. Perivascular delivery of resolvin D1 inhibits neointimal hyperplasia in a rat model of arterial injury. Journal of Vascular Surgery. 65 (1), 207-217 (2017).
- Tan, J., Yang, L., Liu, C., Yan, Z. MicroRNA-26a targets MAPK6 to inhibit smooth muscle cell proliferation and vein graft neointimal hyperplasia. Scientific Reports. 7, 46602(2017).
- Pearce, C. G., et al. Beneficial effect of a short-acting NO donor for the prevention of neointimal hyperplasia. Free Radical Biology and Medicine. 44 (1), 73-81 (2008).
- Cao, T., et al. S100B promotes injury-induced vascular remodeling through modulating smooth muscle phenotype. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1863 (11), 2772-2782 (2017).
- Madigan, M., Entabi, F., Zuckerbraun, B., Loughran, P., Tzeng, E. Delayed inhaled carbon monoxide mediates the regression of established neointimal lesions. Journal of Vascular Surgery. 61 (4), 1026-1033 (2015).
- Khurana, R., et al. Angiogenesis-dependent and independent phases of intimal hyperplasia. Circulation. 110 (16), 2436-2443 (2004).
- Tsihlis, N. D., Vavra, A. K., Martinez, J., Lee, V. R., Kibbe, M. R. Nitric oxide is less effective at inhibiting neointimal hyperplasia in spontaneously hypertensive rats. Nitric Oxide. 35, 165-174 (2013).
- Chen, J., et al. Inhibition of neointimal hyperplasia in the rat carotid artery injury model by a HMGB1 inhibitor. Atherosclerosis. 224 (2), 332-339 (2012).
- Mano, T., Luo, Z., Malendowicz, S. L., Evans, T., Walsh, K. Reversal of GATA-6 downregulation promotes smooth muscle differentiation and inhibits intimal hyperplasia in balloon-injured rat carotid artery. Circulation Research. 84 (6), 647-654 (1999).
- Becher, T., et al. Three-Dimensional Imaging Provides Detailed Atherosclerotic Plaque Morphology and Reveals Angiogenesis after Carotid Artery Ligation. Circulation Research. 126 (5), 619-632 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved