Method Article
إصابة بالون فئلي من ضغط الشريان السباتي الجرذ مع تطبيق علاجي شامل
In This Article
Summary
إصابة بالون الشريان السباتي الفئران يحاكي إجراء قسطرة سريرية تنفيذها لاستعادة تدفق الدم في الأوعية تصلب الشرايين. هذا النموذج يحفز استجابة إصابة الشرايين عن طريق اخلع جدار الشريان, وdenuding طبقة إينييتال من الخلايا البطانية, مما تسبب في نهاية المطاف إعادة عرض واستجابة فرط اللدائنية في الايحاء.
Abstract
ولا تزال أمراض القلب والأوعية الدموية السبب الرئيسي للوفاة والعجز في جميع أنحاء العالم، ويرجع ذلك جزئيا إلى تصلب الشرايين. تضيّق اللويحة الثرثرائية منطقة السطح الإنارة في الشرايين، مما يقلل من تدفق الدم الكافي إلى الأعضاء والأنسجة البعيدة. سريريا، إجراءات إعادة الأوعية مثل قسطرة البالون مع أو بدون وضع الدعامات تهدف إلى استعادة تدفق الدم. على الرغم من أن هذه الإجراءات إعادة تدفق الدم عن طريق الحد من عبء البلاك، فإنها تضر جدار السفينة، الذي يبدأ استجابة الشفاء الشرياني. تسبب استجابة الشفاء المطولة إعادة الأوعية الدموية الشريانية، أو إعادة تضييق، في نهاية المطاف الحد من النجاح على المدى الطويل من هذه الإجراءات revascularization. لذلك ، تعتبر نماذج الحيوانات قبل الكلينيكية جزءًا لا يتجزأ من تحليل الآليات الفسيولوجية الباثولوجية التي تقود إعادة الاستراحة ، وتوفر الفرصة لاختبار الاستراتيجيات العلاجية الجديدة. نماذج مورين هي أرخص وأسهل للعمل على من نماذج الحيوانات الكبيرة. بالون أو الأسلاك إصابة هما أسلوبي الإصابة المقبولة شيوعا المستخدمة في نماذج مورين. نماذج إصابة بالون على وجه الخصوص تحاكي إجراء رأب الأوعية السريرية وتسبب ضررا كافيا للشريان لتطوير ريسينسيس. هنا نحن وصف التفاصيل الجراحية لأداء وتحليل هباتية في النسيج المعدلة، والضغط التي تسيطر عليها الفئران نموذج إصابة بالون الشريان السباتي. بالإضافة إلى ذلك، يسلط هذا البروتوكول الضوء على كيفية استخدام التطبيق المحلي للحساسية للمعالجة لمنع تضخم التنسج النوبى. وأخيرا، نقدم المجهر الفلوري ورقة ضوء كمقاربة جديدة لتصوير وتصور إصابة الشرايين في ثلاثة أبعاد.
Introduction
أمراض القلب والأوعية الدموية (القلب والأوعية الدموية) لا يزال السبب الرئيسي للوفاة في جميع أنحاء العالم1. تصلب الشرايين هو السبب الكامن وراء معظم الأمراض والوفيات المرتبطة بالداء القلبي الوعائي. تصلب الشرايين هو تراكم البلاك داخل الشرايين التي تؤدي إلى ضيق تجويف، مما يعوق ضخ الدم السليم للأعضاء والأنسجة البعيدة2. تشمل التدخلات السريرية لعلاج تصلب الشرايين الشديد رأب الأوعية بالون مع وضع الدعامات أو بدونه. ينطوي هذا التدخل على تقدم قسطرة بالون إلى موقع البلاك ، وتضخيم البالون لضغط البلاك على جدار الشريان ، وتوسيع منطقة الإنارة. هذا الإجراء يضر الشريان, ومع ذلك, بدء استجابة إصابة الشرايين3. يؤدي التنشيط المطول لهذه الاستجابة للإصابة إلى إعادة تمدد الشرايين ، أو إعادة التضييق ، الثانوي إلى تضخم التنسج النيوئ وإعادة عرض الوعاء. خلال عملية رأب الأوعية يتم اغفال طبقة من الخلايا البطانية مما يؤدي إلى تجنيد الصفائح الدموية الفورية والتهاب المحلية. الإشارات المحلية تحفز التغيرات الظاهرية في خلايا العضلات السلسة الوعائية (VSMC) والضوباء الليفية السبتية. وهذا يؤدي إلى الهجرة وانتشار VSMC واللوائية الليفية إلى الداخل إلى تجويف، مما يؤدي إلى تضخم التنسج النيوبيبي4،5. الخلايا السلف المتداولة والخلايا المناعية تسهم أيضا في الحجم الكلي لالتيزان6. حيثما ينطبق ذلك، الدعامات المخدرات eluting (DES) هي المعيار الحاليلتثبيط إعادة 7. DES تثبيط الشرايين إعادة endothelialization, ومع ذلك, خلق بالتالي بيئة برو جلطة التي يمكن أن يؤدي في وقت متأخر في الدعاماتثرة 8. ولذلك، نماذج الحيوان هي جزء لا يتجزأ من فهم كل من الفيزيولوجيا المرضية من إعادة تمدد الأوعية الدموية، وتطوير استراتيجيات علاجية أفضل لإطالة فعالية إجراءات إعادة التجمّع.
وتستخدم عدة نماذج الحيوانات الكبيرة والصغيرة9 لدراسة هذا علم الأمراض. وتشمل هذه بالون إصابة3,10 أو الأسلاك إصابة11 من الجانب الإنارة من الشريان, فضلا عن الربط الجزئي12 أو وضع الكفة13 حول الشريان. إصابة البالون والأسلاك على حد سواء denude طبقة البطانية من الشريان، وتقليد ما يحدث سريريا بعد رأب الأوعية. وعلى وجه الخصوص، تستخدم نماذج إصابة البالون أدوات مماثلة كما في الإعداد السريري (أي قسطرة البالون). يتم تنفيذ إصابة البالون على أفضل نحو في نماذج الفئران، حيث أن شرايين الفئران هي الحجم المناسب لقسط البالون المتاحة تجاريا. هنا نحن وصف إصابة الشريانية المجزأة التي تسيطر عليها الضغط، وهي نسخة راسخة معدلة من إصابة بالون الشريان السباتي الفئران. هذا النهج الذي تسيطر عليه الضغوط يحاكي عن كثب إجراء رأب الأوعية السريرية، ويسمح لإعادة إنتاج تشكيل فرط التنسج النيوية الجديدة بعد أسبوعين من الإصابة14,15. بالإضافة إلى ذلك، هذه الإصابة الشريانية التي تسيطر عليها الضغط يؤدي إلى استعادة طبقة البطانية الكاملة من قبل 2 أسابيع بعد الجراحة16. هذا يتناقض بشكل مباشر نموذج إصابة البالون الأصلي ، الذي وصفه كلويس ، حيث لا تعود طبقة البطانية أبدًا إلى التغطية الكاملة3.
بعد الجراحة، يمكن تطبيق العلاجات على الشريان المصاب أو توجيهه نحوه من خلال عدة طرق. تستخدم الطريقة الموضحة هنا تطبيق periadventitial لجزيء صغير مدمج في محلول جل بلوروني. على وجه التحديد، ونحن تطبيق حل من 100 μM الألدهيد سينيناميكا في 25٪ هلام Pluronic-F127 إلى الشريان مباشرة بعد الإصابة لمنع تشكيل فرط15نيوينيمي. Pluronic-F127 هو غير سامة، هلام عكس الحرارة قادرة على تسليم المخدرات محليا بطريقة خاضعة للرقابة17. وفي الوقت نفسه، فإن الإصابة الشريانية محلية، ومن ثم فإن الإدارة المحلية تسمح باختبار مبدأ نشط مع تقليل الآثار خارج الهدف. ومع ذلك، فإن التسليم الفعال للعلاجية باستخدام هذه الطريقة تعتمد على كيمياء الجزيء الصغير أو البيولوجي المستخدم.
Protocol
وقد تمت الموافقة على جميع الأساليب المذكورة هنا من قبل لجنة رعاية الحيوانات واستخدامها المؤسسية (IACUC) من جامعة نورث كارولينا في تشابل هيل.
1. إجراءات ما قبل الجراحة
- تعقيم الأدوات الجراحية. أوتوكلاف جميع الأدوات الجراحية قبل الجراحة. إذا كان إجراء عمليات جراحية متعددة في نفس اليوم، تعقيم الأدوات بين العمليات الجراحية باستخدام معقمة حبة جافة.
- إعداد العلاجية في 25٪ بلورونيكس-127 هلام (المخفف في الماء المقطر العقيم).
- قم بإعداد قسطرة بالون Fogarty 2F إلى insufflator ووضع نهاية البالون من القسطرة في حقنة 1 مل مليئة بالمحلول الملحي.
- حث التخدير عن طريق وضع الفئران في غرفة مع isoflurane 5٪.
- إزالة الفئران من الغرفة وتسجيل وزن الجرذ. استخدام مقصات الشعر لحلاقة الفراء على منطقة الرقبة البطنية.
- ضع الجرذ مرة أخرى في الغرفة مع isoflurane 5٪ لضمان تحريض التخدير.
- ضع الجرذ على منصة جراحية ، وأدخل الوجه في مخروط الأنف بحيث يكون وجه الفئران نحو الجراح.
- تقليل التخدير الاستنشاقي إلى 1.5٪ ايزوفلوران. تحقق من عمق التخدير من خلال رد فعل إصبع القدم قرصة على جميع الأقدام الأربعة.
- الشريط جميع الأرجل الأربعة وصولا الى منصة الجراحية.
- بدوره على مصباح الحرارة.
- حقن الأتروبين (0.01 ملغ / كغ) تحت الجلد للحد من إفرازات مجرى الهواء.
- حقن الكاربروفين (5 ملغم / كغ) تحت الجلد لإدارة الألم الوقائي. إذا كانت العقاقير المضادة للالتهابات غير مقبولة للتجربة، فالرجوع إلى الخطوتين 3-2-2 و3-2-3.
- تطبيق مرهم العين زيوت التشحيم لكلا العينين باستخدام مسحة القطن العقيمة لمنع القرنيات من التجفيف أثناء الجراحة.
- مسحة الرقبة ثلاث مرات في حركة دائرية بالتناوب بين الكحول الإيثيلي 70٪ تليها بيتادين من وسط المنطقة حليق إلى الخارج لتعقيم موقع شق.
- التسلل إلى خط شق .c مع 0.25٪ bupivacaine.
- وضع قفازات جراحية معقمة قبل التعامل مع الأدوات الجراحية المعقمة واللوازم.
- وضع جميع الأدوات الجراحية autoclaved على ورقة جراحية معقمة.
- قطع ثلاثة مستقل 1 بوصة خيوط من خياطة معقمة 7-0 برولين.
- ضع مسحات القطن والشاش على ورقة جراحية.
- ثني الجرذ مع ورقة جراحية معقمة التي تكشف فقط منطقة الرقبة تعقيم.
- قطع فتحة صغيرة إضافية في ورقة التي تعرض جزءا من مخروط الأنف. سيكون هذا الموقع ل تسجيل أسفل القسطرة البالون أثناء الإصابة.
2- الإجراءات التشغيلية
- خلال العملية الجراحية بأكملها، تقييم عمق التخدير عن طريق مراقبة معدل الجهاز التنفسي (يجب أن يكون معدل متسقة وتعتبر طبيعية) وكذلك من قبل إصبع إصبع كل 15 دقيقة. إذا زاد معدل التنفس أو كان هناك استجابة لقرصة إصبع إصبع، ثم وقفة التلاعب الجراحي وزيادة isoflurane تصل إلى 2.5٪.
- كشف الشريان السباتي المشترك (CCA).
- جعل سطحية، مستقيمة، شق خط العنق الطولي بين عظام الفك من الفئران. الشق سيكون حوالي 1.5-2 سم في الطول.
- إجراء شق من خلال النسيج الضام تحت الجلد حتى يتم كشف طبقة العضلات. ازاح الغدد اللعابية تحت الجلد للوصول إلى الأنسجة العضلية.
- فصل بصراحة النسيج الضام من العضلات عن طريق إدراج مقص مغلق بين طبقة العضلات والأنسجة الضامة وفتح بلطف مقص في حين سحب الجلد إلى أعلى.
- تشريح اثنين من العضلات المرئية (sternohyoid و sternomastoid) طوليا على طول الجانب الأيسر من القصبة الهوائية حتى يتم ملاحظة عضلة ثالثة (omohyoid) أن يمتد عمودي على عضلات سطحية اثنين.
- استخدام ملقط لإنشاء نافذة تفصل هذه العضلات عمودي (omohyoid) من العضلات الطولية (sternohyoid) تشغيل فوق القصبة الهوائية. قم بإجراء هذا الفصل بلطف لمنع الصدمة الحادة إلى القصبة الهوائية.
- تصل إلى ملقط تحت العضلات عمودي وقطع لفصل اثنين من العضلات الطولية وفضح CCA.
- تشريح CCA.
- تشريح CCA بالقرب من التشعب حتى يتعرض الشريان السباتي الداخلي (ICA) والشريان السباتي الخارجي (ECA).
- تشريح الشريان الغدة الدرقية متفوقة (STA)، التي فروع من اللجنة الاقتصادية لأفريقيا.
- باستخدام خياطة برولين قبل قطع، ligate STA واللجنة الاقتصادية لأفريقيا بالقرب من التشعب كل منهما. اترك معظم الغرزة إلى جانب واحد من العقدة وامسك بكل خياطة مع هيموستات منحنية.
- الانتهاء من تشريح حول ICA، والوصول إلى ملقط تحت وحول ICA، واستخدام المشبك الأوعية الدموية غير سحق لتحقيق السيطرة البعيدة. المشبك الشريان القذالي جنبا إلى جنب مع ICA.
- تشريح CCA قريبة إلى التشعب، وضمان فصل العصب المبهم من CCA.
- الوصول إلى ملقط تحت وحول CCA واستخدام المشبك الأوعية الدموية غير سحق لتحقيق السيطرة القريبة. مكان المشبك على الأقل 5 مم من التشعب.
- أداء إصابة البالون.
- مناورة الهيموستات المنحنية عقد كل فرع الشريان الرباط لكشف التشعب بين اللجنة الاقتصادية لأفريقيا وفرع متفوقة.
- تشريح بلطف الأنسجة في التشعب ومن ثم جعل شق استئصال الشرايين بين اللجنة الاقتصادية لأفريقيا وفرع متفوقة باستخدام مقص microdissection.
- استخدام مسحة القطن لدفع كل الدم من CCA وتنظيف موقع استئصال الشرايين.
- أدخل قسطرة البالون غير المفككة من خلال استئصال الشرايين وتقدم إلى CCA حتى النهاية القريبة للبالون هو الماضي التشعب.
- قسطرة الشريط إلى مخروط الأنف حتى لا تنزلق البالون من الشريان أثناء التضخم.
- تضخيم ببطء البالون إلى 5 أجواء من الضغط وترك في CCA لمدة 5 دقائق للحث على إصابة الشرايين. تأكد من أن الضغط يبقى ثابتًا لمدة 5 دقائق كاملة.
- بعد 5 دقائق، فرغ البالون وإزالة بلطف من CCA من خلال استئصال الشرايين.
- دافق CCA عن طريق الضغط بلطف على المشبك في CCA. لا تقم بإزالة المشبك.
- Ligate في اللجنة الاقتصادية لأفريقيا في مكان قريب من استئصال الشرايين ومن ثم إزالة المشابك من CCA وICA لاستعادة تدفق الدم من خلال CCA إلى ICA. تأكد من عدم وجود نزيف مرئي حول استئصال الشرايين وأن CCA ينبض.
- تطبيق 100 μL من العلاجية أو مركبات هلام Pluronic وحدها periadventitially على طول CCA المصابين. القيام بذلك عن طريق تطبيق 50 ميكرولتر على الجانب الأيسر من CCA ثم 50 ميكرولتر إلى الجانب الأيمن من CCA لضمان طلاء حتى من الشريان المصاب.
- أغلق موقع الجرح
- خفض خياطة برولين الزائدة.
- إغلاق الجرح باستخدام توقف 4-0 أو 6-0 طبقات فيكريل على طول النسيج الضام.
- الانتهاء من إغلاق الجرح باستخدام تشغيل 4-0 خياطة النايلون على طول الجلد.
3- الإجراءات اللاحقة للجراحية
- وضع الفئران وحدها في قفص نظيف مع نصف القفص تحت مصباح التدفئة ورصد حتى الفئران يستعيد الوعي الكافي للحفاظ على الرقبية. إبقاء الفئران في قفص منفصل حتى الحيوان هو في حالة تأهب تام ومتحرك قبل نقله مرة أخرى إلى قفص الأصلي.
- مراقبة الفئران يوميا للأيام الثلاثة المقبلة ثم ثلاث مرات في الأسبوع حتى القتل الرحيم. القتل الرحيم باستخدام جرعة زائدة من ايزوفلوران تليها ثنائية الصدرية على النحو المبين أدناه.
- استخدام المركز الوطني لاستبدال الصقل والحد من الحيوانات في البحوث (NC3Rs) مقياس غريمس لتحديد مستويات الألم بعد الجراحة. إذا كان أي يبدو أن تعاني من الألم أو تطوير أي حل وسط عصبي، والتضحية على الفور.
- للحيوانات التي لا تتلقى carprofen, إدارة اسيتامينوفين 6 ملغ / مل في مياه الشرب 24 ح قبل الجراحة من خلال 48 ساعة بعد الجراحة. يوفر الأسيتامينوفين المسكنات مع الحد الأدنى من الآثار المضادة للالتهابات.
- بدلا من ذلك، يمكن استخدام استراتيجيات مسكن أخرى مع الحد الأدنى من الآثار المضادة للالتهابات، مثل البوبرينورفين أو بوبرينورفين تمديد الإفراج. استشر فريق الطب البيطري في مؤسستك.
4. حصاد الأنسجة والتصوير
- بعد أسبوعين من الجراحة ، قتل الجرذ عن طريق جرعة زائدة من التخدير (5٪ isoflurane). بدلا من ذلك ، قتل الفئران في وقت سابق من الوقت لتحليل الجوانب المختلفة للاستجابة للإصابة الشريانية.
- مرة واحدة يتوقف التنفس أداء الصدر الثنائية كوسيلة ثانوية للقتل الرحيم.
- إجراء شق الجانبي من خلال البطن، ثم قطع صعودا، من خلال الحجاب الحاجز والأضلاع، وفضح تجويف الصدر.
- اثقبوا الشرايين وأصلحواها
- أدخل قنية 18 G متصلة بنظام تثبيت الجاذبية من خلال البطين الأيسر. الحفاظ على الضغط المكافئ بين الفئران عن طريق وضع علامة على ارتفاع نظام الضخ نسبة إلى سطح المقعد (ارتفاع 120 سم، أي ما يعادل 91 ± 3 مم زئبق).
- المشبك كانولا جنبا إلى جنب مع البطين باستخدام الهيموستات المنحنية.
- جعل قطع في الأذين الأيمن، وفتح الدائرة الوعائية، وتبدأ في الضخ مع برنامج تلفزيوني تليها 2-4٪ شبهformaldehyde (حوالي 250 مل لكل منهما).
- إعداد شبهformaldehyde المخفف في برنامج تلفزيوني يوم التضحية، أو على الأكثر في الليلة السابقة للتضحية. إذا كان يستعد في يوم التضحية، وضمان شبه شكلي قد بردت إلى درجة حرارة الغرفة قبل البدء في الضخ. تخزين ما قبل شكلي في 4 درجة مئوية.
- بعد التثبيت، واستخراج الشرايين السباتية اليمنى والأيسر وتخزينها عند 4 °C لمدة 2 ساعة في 2-4٪ شبهformaldehyde.
- نقل الشرايين إلى 30٪ السكروز وتخزينها بين عشية وضحاها في 4 درجة مئوية.
- بعد 16-24 ساعة، تضمين الشرايين في درجة حرارة القطع المثلى (OCT) مركب وتجميد كتل الشريان أكتوبر جزءا لا يتجزأ.
- شرياني الشرط في أكتوبر في درجة حرارة الغرفة لمدة 10 دقيقة. وضع الشريان بالتوازي مع الطائرة من cryomold مليئة أكتوبر، ووضع علامة على جانب من cryomold التي تواجه تشعب الشرايين. التجمّد المفاجئ في النيتروجين السائل.
- تخزين كتل مجمدة على المدى الطويل عند -80 درجة مئوية.
- مقطع كتل مجمدة باستخدام قاعدة التبريد.
- جمع ستة 5 μm سميكة الشرايين مقطع عرضية لكل شريحة، مع الشريحة 1 بدءا من التشعب.
- مقطع كتل مجمدة حتى تضخم لم يعد مرئيا (حوالي 100 الشرائح).
- الهماتوسلين و إيوسين (H & E) الشرائحالبقعة 18
- أوجد منطقة الإصابة عن طريق تلطيخ شريحة من كل عشر شرائح على طول الشريان بأكمله بدءًا من التشعب (على سبيل المثال، الشرائح 1، 10، 20، 30، 40، 50، 60، 70، 80، 90، 100).
- بقع الشرائح الإضافية حول موقع الإصابة للعثور على الشريحة مع انسداد الذروة (على سبيل المثال، الشرائح 20، 30، و 40 كان تضخم مرئية، وبالتالي وصمة عار الشرائح 15، 25، 35، و 45).
- وصمة وكمية الشريحة مع ذروة الانسداد والشرائح متساوية البعد قبل وبعد ذروة الانسداد الشريحة (على سبيل المثال ، ذروة انسداد وجدت في الشريحة 35 ، ثم وصمة عار والشرائح 25 ، 45 ، الخ) ما مجموعه 3-10 الشرائح لكل فئران.
- بالنسبة للتصوير المجهري للوراء المضاء، قم بتخزين الشرايين بين عشية وضحاها عند 4 درجات مئوية بعد التثبيت في الخطوة 4.4.
- الشريان التحقيق مع 1:500 تخفيف من الأرانب المضادة للأجسام المضادة لـ CD31 الأولية في diluent (pH 7.4) لمدة 3 أيام. ثم مكافحة الشريان مع 1:500 تخفيف المضادة للأرانب اليكسا فلور 647 الأجسام المضادة الثانوية لمدة 2 أيام19.
- اخلي الشريان باستخدام iDISCO+20.
- صورة الشريان باستخدام ورقة ضوء المجهر الفلورانس21. تقديم الصور باستخدام البرمجيات (على سبيل المثال، Imaris)19.
- كمي تضخم التنسج النيوبيني. تنفيذ القياس الكمي بطريقة عمياء إذا كان ذلك ممكناً.
- استخدام برنامج ImageJ لتتبع محيط intima، اللامينا مرنة داخلية (IEL)، وlamina مرنة خارجية (EEL) من الشريان على كل من الشرائح 3-10 المحددة أعلاه (الخطوة 4.8.3).
- كمي مساحة كل منطقة تتبع في ImageJ وتصدير هذه القيم. وأسفرت آثار الإنتيما عن منطقة تجويف التجويف، وينال أثر IEL منطقة IEL، واترّق EEL يعطي منطقة EEL.
- متوسط القيم التي تم الحصول عليها من الشرائح 3-10 للحصول على متوسط الإصابة (٪ انسداد, intima:media(I:M) نسبة, فرط التنسج النيوبيبي) لكل شريان السباتي الفئران.
فرط التنسج النيوى = منطقة IEL - منطقة التجويف
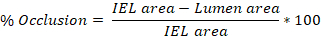
النتائج
ويبين الشكل 1 جميع المواد والأدوات الجراحية المستخدمة لإجراء هذه الجراحة. Hematoxylin & eosin (H & E) تلطيخ من مقطعين الشرياني المصابين لمدة أسبوعين يسمح لتصور واضح من فرط التنسج النيوئي. يظهر الشكل 2 صور تمثيلية لـ H&E-مقاطع عرضية شريانية ملونة من شريان صحي ومصاب ومعالج. كما يحدد الشكل 2 كيفية قياس مستوى تضخم التنسج الحديث في شريان مصاب باستخدام ImageJ، وهو برنامج لمعالجة الصور يستخدم على نطاق واسع. وباستخدام هذا النهج، يتم تتبع محيط النيوينسيما، وكذلك الصفيحة المرنة الداخلية والخارجية لتحديد المساحات الخاصة بها. طريقة الإصابة المجزأة التي يتم التحكم فيها بالضغط تصف النتائج في نسبة intima إلى الوسائط من 0.80 مع انحراف معياري من 0.29 (2 جراحين مختلفين و n = 11 الفئران). العلاج مع تطبيق periadventitial من كاليفورنيا في النتائج Pluronic في تثبيط تضخم التنسج النيوئ ، كما أظهرنا من قبل (61 ٪ في انخفاض في نسبة انسداد)15.
الشكل 3 يقدم توضيحا لخلق استئصال الشرايين الأمثل في تشعب من اللجنة الاقتصادية لأفريقيا وSTA. وأخيرا، يظهر الشكل 4 كيف يمكن استخدام المجهر المفلور ورقة ضوء لتصور المنطقة بأكملها من إصابة على طول طول الشريان. يمكن إجراء تلطيخ CD31 لتصور الخلايا البطانية التي تبطن الطبقة الوامِن على الشرايين الثابتة. يمكن بعد ذلك أن تكون جزءا لا يتجزأ من الشرايين في agarose 1٪ وتطهيرها باستخدام طريقة iDISCO + لتجانس معامل الانكسار للعينة20. ثم يمكن تصوير الشرايين في ضوء ورقة المجهر fluorescence والصور يمكن تقديمها باستخدام برنامج لتحديد كمية نسبة I:M. وباستخدام هذا النهج، حصلنا على نسبة I:M قدرها 0.86، وهو ما يتفق مع نتائج H&E.
| رقم المقطع | مرجع |
| 10 أقسام | 27 |
| 8 أقسام | 28 |
| 6-10 أقسام | 29 |
| 6 أقسام | 30 |
| 5 أقسام | 31 |
| 3 أقسام | 32 |
الجدول 1- الانبعاثات 1000 عادة ما تستخدم عدد من المقاطع العرضية الشريانية لتحليل تضخم.
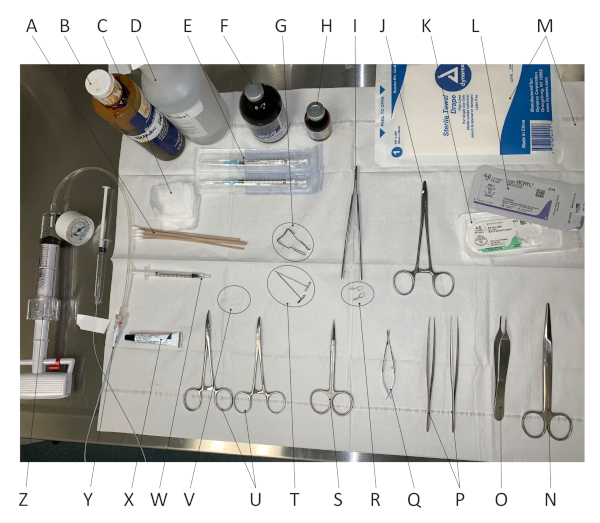
الشكل 1- الـ 1 الأدوات والأدوات الجراحية. في ترتيب عقارب الساعة ابتداء من الزاوية اليسرى العليا من الصورة: (أ) مسحات القطن؛ (ب)حل بيتادين؛ (ج) الشاش؛ (D) 70٪ حل الكحول الإيثيلي؛ (E) 1cc الحقن مع إبرة؛ (واو) الأتروبين؛ (G) الداونات؛ قصاصات الورق عازمة المستخدمة هنا؛ (H) ريماديل؛ (ط) المشبك micro-serrefine تطبيق ملقط; (ي) حامل إبرة؛ (K) 4-0 خياطة النايلون؛ (L) 4-0 خياطة فيكريل؛ (M) الستائر المعقمة؛ (N) مقص مايو؛ (س) الوَلَب القياسية؛ (P) ملقط منحنية ناعم؛ (Q) مقصات ميكروديستيكشن؛ (R)المشابك السرريفين الصغرى; (S) مقص غرامة؛ (T) T-pins; (U) الهيموستات المنحنية؛ (V) ثلاثة خياطة برولين 7-0 قطع إلى ما يقرب من 1 بوصة; (W) 100 ميكرولتر من 25٪ من هلام pluronic-127؛ (X) مرهم العين التشحيم؛ (Y) 2 قسطرة embolectomy بالون فرنسي في محلول ملحي معقمة؛ (Z) Insufflator. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2- الانبعاثات 2 من 100 هيماتيوكسيلين وOsin (H & E) تلطيخ وتحليل الشرايين الفئران المقطعات العرضية. (أ)مقطع عرضية من الشريان السباتي الأيمن السليم غير المصاب. IEL = لامينا مرنة داخلية، EEL = لامينا مرنة خارجية. (B) مقطع عرضي من الشريان السباتي الأيسر المصاب لمدة أسبوعين المعالج بسيارة Pluronic-F127. (C) مقطع عرضي من الشريان السباتي الأيسر المصاب لمدة أسبوعين المعالج بـ 100 ميكرومتر سينيناميكا ألدهيد. شريط مقياس = 100 ميكرومتر (D) تقسيم تخطيطي للشرايين المجمدة لتحديد الضرر. الشريحة 1 يبدأ عند التشعب وستة أقسام الشرايين 5 μm في العرض تؤخذ في كل شريحة. يستمر القسم عادةً في الشريحة 70 كما يحدث عادةً الإصابة قبل هذه الشريحة. (E) المقطع المقطع المقطعي من الشريان السباتي الأيسر المصاب المعالج بمركبة بلورويك(B). يتتبع الخط الأسود الأعمق النيوينسيما ويُحدد المنطقة البارزة. خط صفراء الأوسط يحدد منطقة لامينا مرنة الداخلية، أو tunica intima. الخط الأزرق الخارجي يحدد مساحة اللامينا المرنة الخارجية، أو tunica adventitia. شريط مقياس = 100 ميكرومتر (F) الحسابات المستخدمة لقياس نسبة انسداد الأوعية ونسبة intima: الوسائط (I:M) استناداً إلى القياسات التي تم الحصول عليها من (E). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3- الانبعاثات 100-11 إنشاء استئصال الشرايين. توضيح للخطوات لإنشاء عملية استئصال الشرايين المناسبة، وتجنب الجهاز الخاطِب. CCA = الشريان السباتي المشترك، ECA = الشريان السباتي الخارجي، ICA = الشريان السباتي الداخلي، OA = الشريان الأنفي، STA = الشريان الدرقية الفائق. عزل التشعب بين فروع ايكا وSSTA. تشريح هذا التشعب حتى المنطقة يتغير إلى لون أكثر إشراقا، مما يدل على ترقق جدار الشرايين، ومن ثم إنشاء عملية استئصال الشرايين باستخدام مقص microdissection. ارفع استئصال الشرايين باستخدام ملقط ناعم للمساعدة في إدخال البالون. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4- الانبعاثات 100 المجهر الفلوري ورقة ضوء لتصور إصابة الشرايين. المقاطع العرضية الطولية على طول الشريان السباتي المشترك من فأر سبراغ داولي البالغ من العمر 14 أسبوعًا مع قسم عرضي تمثيلي أدناه. الشرايين ملطخة CD31 ومضادة مع AF647. (أ)المقاطع العرضية من الشريان السباتي الأيمن السليم غير المصاب. أبيض = CD31، أخضر = لامينا مرنة، لام = لومن، شريط مقياس = 200-500 ميكرومتر.(ب)المقاطع العرضية من المصابين، الشريان السباتي الأيسر تعامل مع Pluronic-F127 مركبة. تشير رؤوس الأسهم إلى مناطق من فرط التنسج الحديث. (C)Intima إلى وسائل الإعلام (I:M) نسبة الشرايين السباتية غير المصابة والمصابة، مع القيمة الدقيقة المذكورة لكل مجموعة (n = 1). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
إصابة بالون الشريان السباتي الفئران هي واحدة من أكثر النماذج الحيوانية ريسينسيسس المستخدمة على نطاق واسع ودراسة. وقد أبلغت كل من الأصلي نموذج إصابة البالون3 وتعديل الضغط التي تسيطر عليها الفرق10 الاختلافات إصابة العديد من جوانب استجابة إصابة الشرايين التي تحدث أيضا في البشر، مع القيود القليلة التي هي أن ثركمبوس الغنية الفيبرين نادرا ما يتطور والالتهاب المحلي هو الحد الأدنى بالمقارنة مع نماذج الإصابات الأخرى مثل في الأرنب فرط الكوليسترول أو نماذج porcine9،22. ويمكن أيضا أن الفئران التضحية في نقاط زمنية مختلفة لتحديد وتحليل الجوانب المختلفة من الاستجابة للإصابة الشريانية. على سبيل المثال، يمكن استخدام نقاط زمنية سابقة لدراسة جوانب الاستجابة المبكرة للإصابة مثل انتشار الخلايا، والتبديل الظاهري للخلايا العضلية السلسة الوعائية، والاستجابة المناعية المبكرة. لقد أظهرنا سابقا أن تسلل الكريات البيض وانتشار الخلايا هي القصوى بين 3 أيام و 1 أسبوع16. ويمكن استخدام نقاط زمنية متوسطة لتقييم معدل إعادة التسهيل. نقطة أسبوعين الوقت هو أقرب نقطة زمنية مقترحة لقياس تضخم التنسج النيوئي حيث أن الشريان هو في الغالب إعادة endothelialized في هذه النقطة16. أحد القيود الرئيسية لترجمة هذا النموذج هو أن يتم تنفيذ الإصابة في شريان صحي ، في حين أن هذا الإجراء يحدث في المرضى الذين يعانون من مرض تصلب الشرايين. هذا القيد موجود جزئيا بسبب عدم وجود سابق من الفئران المتاحة23،24. ومع ذلك، سمح التقدم في تقنيات تحرير الجينات لتطوير نماذج الفئران تصلب الشرايين موثوقة24، والتي قد تسفر عن رؤى جديدة في دراسة الفيزيولوجيا المرضية من إعادة تناضح.
نسبيا, الفئران الذكور تسفر عن إصابة أقوى من الفئران الإناث, التي عادة ما تتطور أقل تضخم في التنسج النيومي ربما بسبب تأثير وقائي من هرمون الاستروجين25. ومع ذلك، فإن النموذج الموصوف لا يزال مناسبا لدراسة الشفاء الشرياني في الإناث. الفئران الذكور الشيخوخة 12-16 أسابيع, بين 300-400 غرام تسفر عن تشكيل أقوى وتكهين neointimal. ويمكن استخدام الفئران التي تقل عن 12 أسبوعا من العمر; ومع ذلك، قد تكون شرايين هذه الفئران الأصغر سنا صغيرة جدا بالنسبة للبالون 2F لدخول الشريان بسهولة اعتمادا على سلالة الفئران. الفئران التي تزن أقل من 200 غرام لا ينبغي أن تعمل على هذا النموذج كما لا يصلح بسهولة البالون من خلال استئصال الشرايين ويمكن فعلا المسيل للدموع الشريان إذا القسري. بالإضافة إلى ذلك، قد يؤدي استخدام الفئران التي تزيد أعمارهم عن 16 أسبوعاً إلى استجابة متغيرة في تكوين نيوينتيكال. يمكن استخدام سلالات الفئران المختلفة لأداء هذا النموذج الإصابة، مع الفئران داولي Sprague يجري الأكثر استخداما في جميع أنحاء الأدب26. لبدء الجراحة، أولا الحصول على المحاذاة السليمة والتوجه من موقع شق في الرقبة عن طريق الشعور لعظام الفك واستخدام الأنف الفئران للعثور على خط الوسط. بعد الشق الأولي، تشريح الأنسجة حتى اثنين من العضلات الطولية (sternohyoid وs sternomastoid) تشغيل موازية لبعضها البعض وتصور. استخدام عضلة الرقبة (المدلك) كحد أدنى من نافذة العملية، نحو الرأس. فصل العضلات الموازية، التي تعمل نحو الجسم، من بعضها البعض حتى يتم تصور العضلات التي تعمل عمودي على هذين. قطع العضلات المتعامد سوف تسمح لسهولة التراجع من اثنين من العضلات المتوازية, تعريض الشريان السباتي. كما التشريح قد تختلف قليلا عن كل, جنبا إلى جنب مع تحديد المواقع, قد يكون هناك فرع الشرياني الثانوية التي تقع على رأس ICA. ويمكن تثبيت هذا الفرع الثانوي مع ICA؛ ومع ذلك، عندما لا يتم فرض هذا الفرع الصغير يجب أن يكون هناك أية مشاكل مع تنفيذ الإجراء. بالإضافة إلى ذلك، تأكد من تشريح بعيدا العصب المبهم من كل من ICA وCCA قبل أي لقط وخياطة يحدث. من المهم أن تكون لطيف وتجنب تلف الأعصاب في هذه المرحلة. إذا ارتعاش الحيوان بعد وضع على المشبك التي قد تكون استجابة من العصب المبهم القادمة في اتصال مع المشبك المعدني; النظر في إعادة تعديل المشبك.
يمكن القول إن أصعب خطوة من الإجراء بأكمله هو إجراء استئصال الشرايين. وذلك لأنه من الممكن إجراء عملية استئصال شرايين "كاذبة"، وإدخال بالون من خلال هذا استئصال الشرايين "الزائف" سوف يتسبب في تشغيل البالون فعليًا فوق الشريان، بدلاً من داخل الشريان. إذا حدث هذا، ثم إجراء عملية استئصال الشريان الجديدة أقرب إلى التشعب في CCA هو حل ممكن، ولكن إذا اضطر البالون في الشريان، ثم الجراحة قد لا تكون قابلة للإنقاذ. لمنع استئصال الشرايين 'كاذبة'(الشكل 3), تشريح الطبقة المغامرة في ايكا وS STA التشعب باستخدام ملقط غرامة حتى مظهر هو أكثر احمرارا بشكل ملحوظ من المناطق المجاورة, ويبدو أن هذا الجزء من الشريان لبرز. بعد ذلك ، استخدم المقص الصغير لإنشاء استئصال الشرايين عن طريق إدخال أحد شوكة المقص بسرعة في المنطقة التي تم مسحها عند التشعب ثم التقطيع. بعد إجراء عملية استئصال الشرايين، استخدم ملقط غرامة لرفع فتح الشريان ودفع البالون في تجويف. يجب أن ينزلق البالون بسهولة من خلال استئصال الشرايين وإلى CCA. اعتمادا على وضع الفئران قد يكون من المفيد لتوجيه البالون في CCA باستخدام ملقط غرامة لسحب بلطف صعودا على السطح الخارجي من CCA أثناء توجيه القسطرة البالون في CCA. بعد إدخال البالون في CCA، الشريط القسطرة إلى أسفل حتى لا يخرج البالون من الشريان كما يجري تضخم.
تطبيق periadventitial من العلاجية يسمح لتوصيل الأدوية المحلية والموجهة فقط في موقع الإصابة. ويحد هذا النهج من الآثار المحتملة خارج الهدف، فضلا عن القيود على التناول بالدَنَع مقارنةً بما يتم تقديمه بشكل منهجي من الإدارات الشفوية أو داخل الصفاقية أو الوريدية. Pluronic-F127 هو عكس الحرارة، وهذا يعني أنه سائل في درجة الحرارة الباردة والمواد الهلامية في درجة حرارة الغرفة. وهذا يسمح للعلاجية لتكون مستعدة بسهولة في محلول السائل قبل المواد الهلامية Pluronic، في حين يمكن تطبيق هلام بالتساوي على الشريان مباشرة بعد الإصابة. في حين أن الجزء العلوي من CCA يمكن الوصول إليها بسهولة لتغطية فعالة للمنطقة بأكملها من الإصابة ينبغي رفع CCA بلطف لمعطف الجزء السفلي من CCA. ومع ذلك، يحتاج الباحثون إلى ضمان تشغيل الدراسة بشكل مناسب لمراعاة التقلبات المحتملة بين الحيوانات المعالجة. من المهم أن يكون هناك تقدير لحجم التأثير المتوقع والانحراف المعياري للنتيجة لتشغيل الدراسة بشكل مناسب. إن الحد من طريقة الولادة في الغدد عناء الولادة هو أنه ليس نهجًا ذي صلة سريريًا نظرًا لأن شريان المريض لا يتعرض أثناء عملية رأب الأوعية الدموية ، والتي يتم إجراؤها كإجراء عن طريق الجلد. ومع ذلك، يسمح التطبيق periadventitial للاختبار الأولي للجزيئات والبيولوجيا تسليمها محليا إلى موقع الإصابة15،27،28،29،30.
ويستند الأسلوب القياسي الحالي لقياس تضخم التنسج الحديث على تحليل مورفوميتري من الشرائح الملوّقة H & E. يتم تقسيم الشريان السباتي المصاب فعليًا على الشرائح في شرائح 5 ميكرومتر. ثم تلطخ هذه الشرائح باستخدام H & E ويتم التقاط الصور باستخدام مجهر خفيف. ثم يتم استخدام برنامج ImageJ لقياس المناطق والمحيطات التي يحددها intima ، اللامينا الداخلية ، واللمينا الخارجية. على الرغم من أننا قد أبلغنا زيادة الدقة باستخدام 10 الشرائح لتحديد حجم تضخم19، لا يوجد توافق في الآراء في المؤلفات حول كيفية العديد من الشرائح لقياس ، مع منهجية المبلغ عنها تختلف من 3 إلى 10 أقسام متباعدة بالتساوي (الجدول 1)، 31،32،33،34،35،36. ويمكن توقع نسبة I:M قدرها 0.8 مع انحراف معياري 0.29 (n = 11) باستخدام هذه المنهجية (النطاق: 0.54-1.51). نحن وآخرون قد ذكرت سابقا ضوء ورقة المجهر الفلورس (LSFM) يوفر نهجا جديدا لتصور إصابة الشرايين19,37. LSFM يسمح لتصوير الشريان السباتي بأكمله في x، ص، وz الطائرة. LSFM يسمح لتشريح البصرية لتوليد الشرايين المقطعين العرضية للتحليل، مما أسفر عن تقديرات أكثر دقة من تضخم (معامل التباين: 28٪ من قبل LSFM مقابل 41٪ من الأنسجة) من النهج النسيجية التقليدية19،37. كما رأينا في الشكل 4، فإن نسبة I:M التي حصل عليها LSFM (0.86 ، n = 1) مماثلة للنتائج التي حصلنا عليها من خلال التحليل النسيجي الكلاسيكي (0.8 ± 0.29).
في الختام، فإن الإصابة المجزأة التي تسيطر عليها الضغوط تتلخص في استجابة إصابة الشرايين التي تحدث بعد إجراءات إعادة التقييم السريرية، مما يجعلها نموذجًا مثاليًا لدراسة الفيزيولوجيا المرضية لإعادة التقييم. تطبيق الأدوية في المدى العمري هو وسيلة مفيدة لإثبات المفهوم في التسليم من أجل اختبار الفعالية العلاجية للتسليم الدوائي المحلي ، ويمكن أن يُنير تطوير نُهج تسليم الأدوية المنهجية المستهدفة.
Disclosures
يعلن المؤلفون أنه لا يوجد تضارب في المصالح فيما يتعلق بنشر هذه المخطوطة.
Acknowledgements
تم دعم N.E.B بمنحة تدريبية من المعهد الوطني لعلوم الصحة البيئية (5T32ES007126-35، 2018)، ورابطة القلب الأمريكية زمالة ما قبل الدكتوراه (20PRE35120321). E.S.M.B كان باحثا KL2 بدعم جزئي من قبل مركز قيادة الأمم المتحدة للعلوم السريرية والعلوم المترجمة برنامج العلماء K12 (KL2TR002490، 2018)، والمعهد الوطني للقلب والرئة والدم (K01HL145354). يشكر المؤلفون الدكتور بابلو أرييل من مختبر خدمات المجهر التابع لقيادة الأمم المتحدة لمساعدته في LSFM. تم إجراء الفحص المجهري للوراء الفلوري في مختبر خدمات المجهر. ويدعم مختبر خدمات المجهر، قسم علم الأمراض والطب المختبري، جزئيا من قبل P30 CA016086 مركز السرطان منحة الدعم الأساسية لمركز مكافحة السرطان خطبرجر مركز شامل للسرطان.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | Fisher | 14955450 | |
| 1 mL Syringe with needle | BD | 309626 | |
| 2 French Fogarty Balloon Embolectomy Catheter | Edwards LifeSciences | 120602F | |
| 4-0 Ethilon (Nylon) Suture | Ethicon Inc | 662H | |
| 4-0 Vicryl Suture | Ethicon Inc | J214H | |
| 7-0 Prolene Suture | Ethicon Inc | 8800H | |
| 70% ethyl alcohol | |||
| Anti-Rabbit Alexa Fluor 647 | Thermo Fisher Scientific | A21245 | |
| Atropine Sulfate | Vedco Inc | for veterinary use | |
| Cotton Swabs | Puritan | 806-WC | |
| Curved Hemostats | Fine Science Tools | 13009-12 | |
| Fine Curved Forceps | Fine Science Tools | 11203-25 | |
| Fine Scissors | Fine Science Tools | 14090-11 | |
| Gauze | Covidien | 2252 | |
| IHC-Tek Diluent (pH 7.4) | IHC World | IW-1000 | |
| Insufflator | Merit Medical | IN4130 | |
| Iodine solution | |||
| Lubricating Eye Ointment | Dechra | for veterinary use | |
| Mayo Scissors | Fine Science Tools | 14010-15 | |
| Micro Serrefines | Fine Science Tools | 18055-05 | |
| Microdissection Scissors | Fine Science Tools | 15004-08 | |
| Micro-Serrefine Clamp Applying Forceps | Fine Science Tools | 18057-14 | |
| Needle Holder | Fine Science Tools | 12003-15 | |
| Pluronic-127 (diluted in sterile water) | Sigma-Aldrich | P2443 | 25% prepared |
| Rabbit Anti-CD31 | Abcam | ab28364 | |
| Retractor | Bent paper clips work well | ||
| Rimadyl (Carprofen) | Zoetis Inc | for veterinary use | |
| Saline solution | |||
| Standard Forceps | Fine Science Tools | 11006-12 | |
| Sterile Drape | Dynarex | 4410 | |
| T-Pins |
References
- American Heart Association. Cardiovascular Disease: A Costly Burden for America, Projections Through 2035. American Heart Association CVD Burden Report. , (2017).
- Singh, R. B., Mengi, S. A., Xu, Y. J., Arneja, A. S., Dhalla, N. S. Pathogenesis of atherosclerosis: A multifactorial process. Experimental and Clinical Cardiology. 7 (1), 40-53 (2002).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Mechanisms of stenosis after arterial injury. Laboratory Investigation. 49 (2), 208-215 (1983).
- Clowes, A. W., Reidy, M. A., Clowes, M. M. Kinetics of cellular proliferation after arterial injury. I. Smooth muscle growth in the absence of endothelium. Laboratory Investigation. 49 (3), 327-333 (1983).
- Sartore, S., et al. Contribution of adventitial fibroblasts to neointima formation and vascular remodeling: from innocent bystander to active participant. Circulation Research. 89 (12), 1111-1121 (2001).
- Tanaka, K., et al. Circulating progenitor cells contribute to neointimal formation in nonirradiated chimeric mice. The FASEB Journal. 22 (2), 428-436 (2008).
- Henry, M., et al. Carotid angioplasty and stenting under protection. Techniques, results and limitations. The Journal of Cardiovascular Surgery. 47 (5), Torino. 519-546 (2006).
- Kounis, N. G., et al. Thrombotic responses to coronary stents, bioresorbable scaffolds and the Kounis hypersensitivity-associated acute thrombotic syndrome. Journal of Thoracic Disease. 9 (4), 1155-1164 (2017).
- Jackson, C. L. Animal models of restenosis. Trends in Cardiovascular Medicine. 4 (3), 122-130 (1994).
- Shears, L. L., et al. Efficient inhibition of intimal hyperplasia by adenovirus-mediated inducible nitric oxide synthase gene transfer to rats and pigs in vivo. Journal of the American College of Surgeons. 187 (3), 295-306 (1998).
- Takayama, T., et al. A murine model of arterial restenosis: technical aspects of femoral wire injury. Journal of Visualized Experiments. (97), (2015).
- Zhang, L. N., Parkinson, J. F., Haskell, C., Wang, Y. X. Mechanisms of intimal hyperplasia learned from a murine carotid artery ligation model. Current Vascular Pharmacology. 6 (1), 37-43 (2008).
- Jahnke, T., et al. Characterization of a new double-injury restenosis model in the rat aorta. Journal of Endovascular Therapy. 12 (3), 318-331 (2005).
- Gregory, E. K., et al. Periadventitial atRA citrate-based polyester membranes reduce neointimal hyperplasia and restenosis after carotid injury in rats. American Journal of Physiology-Heart and Circulatory Physiology. 307 (10), 1419-1429 (2014).
- Buglak, N. E., Jiang, W., Bahnson, E. S. M. Cinnamic aldehyde inhibits vascular smooth muscle cell proliferation and neointimal hyperplasia in Zucker Diabetic Fatty rats. Redox Biology. 19, 166-178 (2018).
- Bahnson, E. S., et al. Long-term effect of PROLI/NO on cellular proliferation and phenotype after arterial injury. Free Radical Biology and Medicine. 90, 272-286 (2016).
- Gilbert, J. C. W., Davies, M. C., Hadgraft, J. The behaviour of Pluronic F127 in aqueous solution studied using fluorescent probes. International Journal of Pharmaceutics. 40 (1-2), 93-99 (1987).
- Tulis, D. A. Histological and morphometric analyses for rat carotid balloon injury model. Methods in Molecular Medicine. 139, 31-66 (2007).
- Buglak, N. E., et al. Light Sheet Fluorescence Microscopy as a New Method for Unbiased Three-Dimensional Analysis of Vascular Injury. Cardiovascular Research. , (2020).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Ariel, P. UltraMicroscope II - A User Guide. , (2018).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Xiangdong, L., et al. Animal models for the atherosclerosis research: a review. Protein Cell. 2 (3), 189-201 (2011).
- Chen, H., Li, D., Liu, M. Novel Rat Models for Atherosclerosis. Journal of Cardiology and Cardiovascular Sceinces. 2 (2), 29-33 (2018).
- Xing, D., Nozell, S., Chen, Y. F., Hage, F., Oparil, S. Estrogen and mechanisms of vascular protection. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (3), 289-295 (2009).
- Tulis, D. A. Rat carotid artery balloon injury model. Methods in Molecular Medicine. 139, 1-30 (2007).
- Pellet-Many, C., et al. Neuropilins 1 and 2 mediate neointimal hyperplasia and re-endothelialization following arterial injury. Cardiovascular Research. 108 (2), 288-298 (2015).
- Wu, B., et al. Perivascular delivery of resolvin D1 inhibits neointimal hyperplasia in a rat model of arterial injury. Journal of Vascular Surgery. 65 (1), 207-217 (2017).
- Tan, J., Yang, L., Liu, C., Yan, Z. MicroRNA-26a targets MAPK6 to inhibit smooth muscle cell proliferation and vein graft neointimal hyperplasia. Scientific Reports. 7, 46602(2017).
- Pearce, C. G., et al. Beneficial effect of a short-acting NO donor for the prevention of neointimal hyperplasia. Free Radical Biology and Medicine. 44 (1), 73-81 (2008).
- Cao, T., et al. S100B promotes injury-induced vascular remodeling through modulating smooth muscle phenotype. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1863 (11), 2772-2782 (2017).
- Madigan, M., Entabi, F., Zuckerbraun, B., Loughran, P., Tzeng, E. Delayed inhaled carbon monoxide mediates the regression of established neointimal lesions. Journal of Vascular Surgery. 61 (4), 1026-1033 (2015).
- Khurana, R., et al. Angiogenesis-dependent and independent phases of intimal hyperplasia. Circulation. 110 (16), 2436-2443 (2004).
- Tsihlis, N. D., Vavra, A. K., Martinez, J., Lee, V. R., Kibbe, M. R. Nitric oxide is less effective at inhibiting neointimal hyperplasia in spontaneously hypertensive rats. Nitric Oxide. 35, 165-174 (2013).
- Chen, J., et al. Inhibition of neointimal hyperplasia in the rat carotid artery injury model by a HMGB1 inhibitor. Atherosclerosis. 224 (2), 332-339 (2012).
- Mano, T., Luo, Z., Malendowicz, S. L., Evans, T., Walsh, K. Reversal of GATA-6 downregulation promotes smooth muscle differentiation and inhibits intimal hyperplasia in balloon-injured rat carotid artery. Circulation Research. 84 (6), 647-654 (1999).
- Becher, T., et al. Three-Dimensional Imaging Provides Detailed Atherosclerotic Plaque Morphology and Reveals Angiogenesis after Carotid Artery Ligation. Circulation Research. 126 (5), 619-632 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved