Method Article
反復性びまん性外傷性脳損傷のマウスモデルにおける心的外傷後てんかんの誘導
要約
この体系的なプロトコルは、反復的な軽度の外傷性脳損傷後の心的外傷後てんかんの新しい動物モデルを記述する。最初の部分は、変更された体重減少モデルを使用して外傷性脳損傷誘導のためのステップを詳述する。第2部では、単一および多チャンネルの脳波データ集録システムの外科的アプローチについて説明します。
要約
外傷性脳損傷(TBI)は、後天性てんかんの主な原因である。TBI は、焦点またはびまん性脳損傷を引き起こす可能性があります。焦点損傷は、時には頭蓋骨を貫通する直接的な機械的力の結果であり、脳組織に直接病変を引き起こした。これらは、脳イメージング中に、連続、裂傷、出血を伴う領域として見られます。焦点病変は神経死およびグリア瘢痕形成を誘発し、TBIを発生させる全ての人々の20%−25%に存在する。しかし、TBIの大部分の場合、傷害は加速減速力とその後の組織剪断によって引き起こされ、非焦点的、拡散性損傷をもたらす。TBI患者の亜集団は、数ヶ月または数年の待ち時間の後に心的外傷後てんかん(PTE)を発症し続けている。現在、どの患者がPTEを発症するかを予測することは不可能であり、PTE患者の発作は制御に困難であり、さらなる研究が必要です。最近まで、この分野は、検証された自発的な心的外傷後発作を有する2つの動物/げっ歯類モデルに限定され、両方とも皮質および時には皮質下構造における大規模な組織喪失を有する大きな焦点病変を呈した。これらのアプローチとは対照的に、変性体重減少モデルを用いて誘導されたびまん性TBIは、焦点性病変または組織喪失がない場合でも、自発的痙攣性および非けいれん発作の発症を開始するのに十分であると判断された。後天性心的外傷後てんかんを有するヒト患者と同様に、このモデルは発作発症前の傷害後の待ち時間を呈する。このプロトコルでは、コミュニティに心的外傷後てんかんの新しいモデルが提供され、数ヶ月の間に拡散性非病変TBIを誘導し、続いて数ヶ月にわたって継続的な長期的なビデオ脳波動物モニタリングを誘導する方法を詳述する。このプロトコルは、動物の取り扱い、重量低下手順、2つの集録システムの電極配置、および手術、術後モニタリング、およびデータ取得の各ステップで頻繁に遭遇する課題について詳述します。
概要
TBIは毎年、世界中で推定6,000万人に影響を与えています。影響を受けた個人はてんかんを発症するリスクが高く、最初の怪我の数年後に現れる可能性があります。重篤なTBIはてんかんのリスクが高いと関連していますが、軽度のTBIでさえ、てんかん1、2、3、4を発症する可能性が高くなります。すべての TBE は、フォーカル、ディフューズ、またはその両方の組み合わせに分類できます。びまん性脳損傷は、多くのTbIではないにしても多くの中に存在し、加速減速および回転力のために互いに異なる密度の脳組織の結果である。定義上、びまん性傷害は軽度/脳震盪性非貫通性脳損傷において孤立してしか起こらず、コンピュータ断層撮影スキャン5では脳病変は見えない。
現在、心的外傷後てんかん(PTE)を発症している患者の管理には2つの重大な問題があります。1つ目は、PTEが現れると、発作は利用可能な抗てんかん薬(AED)6に耐性があることです。第二に、AEはてんかんの予防に等しく効果がなく、効果的な代替治療アプローチはありません。この赤字に対処し、より良い治療標的と治療の候補を見つけるためには、PTE6の根本にある新しい細胞および分子メカニズムを探求する必要があります。
心的外傷後てんかんの顕著な特徴の1つは、最初の外傷性事象と自発的で挑発的な再発発作の発症との間の潜伏期間である。この時間枠はPTEの治療と予防を完全に可能にする可能性があるため、この時間ウィンドウ内で発生するイベントは、研究者にとって自然な焦点です。動物モデルは、いくつかの明確な利点を提供するため、この研究に最も一般的に使用されています, 少なくとも、人間の患者の継続的な監視は、このような潜在的に長い時間をかけて非現実的かつ高価であろうということです.さらに、てんかんの根本にある細胞および分子のメカニズムは、動物モデルでのみ探索することができます。
自発的な心的外傷後発作およびてんかんを有する動物モデルは、ケモコンブチル剤または電気刺激などによってTBIの後に発作が誘発されるモデルよりも好ましい。例えば、ケモコンブルサンスまたは電気刺激によって、急性、慢性、または親切によって。自発的な心的外傷後発作モデルは、TBIがてんかんを引き起こす健康な脳ネットワークをどのように変更するかをテストする。TBI後の追加刺激を用いた研究は、TBIへの暴露が発作閾値を減少させ、発作に対する感受性に影響を与える方法を評価する。化学的または電気刺激によって誘発された発作を伴う動物モデルの利点は、AEDに対する屈折性の特定のメカニズムと既存および新規のAEDの有効性をテストすることである。しかし、これらのデータのヒトへの関連性および翻訳の程度は、以下の理由で7があいまいであり得る:1)発作機構はTBI単独で誘発されるものとは異なり得る。2)これらのモデルのすべてが自発的な発作につながるわけではありません7;3)痙攣剤自体によって生じる病変は、その送達に必要なカニューレを有する、または深層構造(例えば、海馬または扁桃体)での電極配置を刺激することによって、すでに発作感受性の増加を引き起こし得る可能性があり、さらには海馬てんかん場電位7。さらに、いくつかの痙攣剤(すなわち、カイエン酸)は、直接海馬病変および硬化性を産生し、これは拡散TBI後に典型的ではない。
最近まで、心的外傷後てんかんの2つの動物モデルのみが存在していた:制御された皮質衝撃(CCI、焦点)または流体打楽器損傷(FPI、焦点およびびまん性)8。両方のモデルは、げっ歯類8の組織損失、出血、およびグリオシスと並んで大きな焦点病変をもたらす。これらのモデルは、大きな焦点病変によって誘発される心的外傷後てんかんを模倣する。最近の研究では、繰り返し(3x)びまん性TBIが、マウスに対する自発的発作およびてんかんの発症に十分であることを示した9は、自発再発性発作が確認された第3のげっ歯類PTEモデルを加える。この新しいモデルは、拡散TBIによって引き起こされる細胞および分子の変化を模倣し、軽度の脳震盪性TBIを有するヒト集団をよりよく表す。このモデルでは、発作発症前3週間以上の潜伏期間と後期の自発的な再発発作の出現は、心的外傷後てんかん発生の根本的な原因を調査し、発作発症後の予防アプローチおよび新しい治療候補の有効性をテストすることを可能にし、約半数の動物が心的外傷後てんかんを発症するため、心的外傷後てんかんのバイオマーカーの発症の可能性を有する。
心的外傷後てんかんの研究のための動物モデルの選択は、科学的な質問、調査された脳損傷の種類、および基礎となる細胞および分子メカニズムを決定するためにどのようなツールを使用するかに依存する。最終的には、心的外傷後てんかんのモデルは、TBI後の自発的発作の出現とTBI動物のサブセットにおける初期遅延期間の両方を実証しなければならない。これを行うために、このプロトコルでは、同時ビデオ集録を伴う脳波(EEG)が使用されます。データ収集ハードウェアとアプローチの背後にある技術的側面を理解することは、正確なデータ解釈のために重要です。重要なハードウェアの側面には、記録システムの種類、電極の種類(ねじまたはワイヤリード)と材料、同期ビデオ集録(EEGシステムまたはサードパーティの一部として)、およびコンピュータシステムの特性が含まれます。研究目標、対象のEEGイベント、さらなる分析方法、データストレージの持続可能性に応じて、あらゆるタイプのシステムに適切な取得パラメータを設定することが不可欠です。最後に、電極構成(モンタージュ)の方法は、それぞれ長所と短所があり、データ解釈に影響を与えるので、考慮する必要があります。
このプロトコルは、変更されたMarmarou重量降下モデル10、11を使用して、マウスにおける自発的、挑発されない再発性発作をもたらすびまん性傷害を誘発する方法を詳述し、単一および多チャンネル連続、および単一級、バイポーラ、または混合モンタージュを使用してビデオEEGを同期させる外科的アプローチを記述する。
プロトコル
このプロトコルに記載されているすべての動物手順は、バージニア工科大学の施設動物管理および使用委員会(IACUC)に従い、国立衛生研究所の「実験動物のケアと使用のためのガイド」に準拠して行われました。.
1. 動物の取り扱いプロトコル
注:このプロトコルは、到着後にベンダーから施設に注文した動物を習慣化し、実験者によって処理されることを条件とすることを目的としています。これは、ストレスや不安を軽減することにより、動物の幸福を向上させ、TBIを誘導する、術後の監視、および取得システムに動物を接続するなど、動物を処理する必要がある特定の手順を簡素化します。
- 多くの動物がベンダーから受け取られ、2〜5匹の動物のケージでそれらを組み合わせながら、実験グループ(TBI)または対照群(シャム手術)にランダムに割り当てます。シャムマウスは時折TBIを受けたマウスに対して積極的に行動するので、ハウスTBI動物は偽の動物とは別に。
- 取り扱い日1(耳タグの後24-48時間):動物の耳のタグ、生年月日、取扱日、取り扱い日の動物の体重、取り扱いの期間、コメントと観察のためのセクションを記録するためのチャートを準備します。
- 両手を使って動物をやさしくカップに入れ。防御機構やストレス応答を誘発するので、尾で動物をつかまないでください。
- 動物の耳札を確認し、記録します。
- 重量スケールの容器に動物を置き、重量を記録します。
- もう一度両手で動物をそっとカップし、1分間扱い、手の中を動かして探索できるようにします。手順室のベンチでこれを実行し、床に動物を落とさなくなるように注意してください。
- 取り扱いの1分後、動物をケージに戻します。
- ケージ内の他の動物に対して、ステップ 1.3-1.7 を繰り返します。
- 処理日 2 日目(翌日): 手順 1.2-1.5 を繰り返します。
- もう一度両手で動物をそっとカップし、2分間扱い、手の中を動かして探索できるようにします。手順室のベンチでこれを実行し、床に動物を落とさなくなるように注意してください。
- 取り扱いの2分後、動物をケージに戻します。
- ケージ内の他の動物に対して、ステップ 1.10-1.11 を繰り返します。
- 処理日 3 日目(翌日): 手順 1.2-1.5 を繰り返します。
- もう一度両手で動物をそっとカップし、それを4分間扱い、手の中で動いて探検できるようにします。手順室のベンチでこれを実行し、床に動物を落とさなくなるように注意してください。
- 取り扱いの4分後、そのケージに戻って動物を配置します。
- ケージ内の他の動物に対して、ステップ 1.14-1.15 を繰り返します。
- 4 日目の処理(制御日、1 日目から 1 週間):手順 1.2-1.5 を繰り返します。
- もう一度両手で動物をそっとカップし、それを4分間扱い、手の中で動いて探検できるようにします。手順室のベンチでこれを実行し、床に動物を落とさなくなるように注意してください。
- 4分の取り扱いの後、そのケージに戻って動物を配置します。
- ケージ内の他の動物に対して、ステップ 1.18-1.19 を繰り返します。
注: コントロール処理日は、3 日間の処理プロトコルの後に、落ち着いた動作の保持をテストします。
2. 重量の減少手順
- マウスを誘導室に置きます。酸素と真空の流れを1 L/分に、イソフルランガスのレベルを3%~5%に設定します。マウスを5分間麻酔します。
- 誘導室からマウスを取り出し、泡パッドの上に置きます。つま先または尾のピンチに対する応答がないかどうかテストします。
- 皮下に鎮痛薬(0.1mg/kgブプレノルフィン)を投与する。脳体手術が同じ日に行われる場合は、非ステロイド性抗炎症カルプロフェン(5mg/kg)と組み合わせてブプレノルフィンを皮下投与する。
- 最後の衝撃の前後に皮下に乳酸ナトリウム溶液(動物の体重のグラム当たり3μL)を投与する。乳酸ナトリウム溶液は、単一の注射で迅速な投与のために鎮痛薬と混合することができる。
注:乳酸ナトリウム溶液には、塩化ナトリウム、塩化カリウム、塩化カルシウム、および乳酸ナトリウムの混合物が含まれています。このステップは、回復を助ける流体および電解質を交換するのに役立ちます。 - マウスの頭部をウェイトドロップチューブ(図1A)の下に置き、眼と耳の線の間の頭の中央に平らなステンレス製のディスク(直径1.3cm、厚さ1mm、880mgの重量)を置きます。
注: このディスクは、頭蓋骨の表面に衝撃を拡散します(図1B)。 - 重量滴下チューブのピンを取り外し、高さ50cmから100gの重量ロッドを放します。コントロールマウスの恥の傷害を誘発するために、ピンの誤って放出および重量低下を防ぐためにチューブから重量ロッドを取り外す。
メモ:ロッドがディスクの表面全体に自由に落ちるように、動物の頭は平らに配置する必要があります。 - 無菌ポリライン吸収タオルで覆われたヒーターパッドの上に回復のために背中に無意識の動物を置きます。右反射回復時間(つまり、マウスが背中から右にかかる時間)は、無意識に費やされた時間の読み出しとして測定することができます。
- 動物が意識を取り戻したら、ヒーティングパッドに温めたきれいなケージに入れ、回復ゲルといくつかの湿ったチャウピースを45分間回復させます。動物を過熱させることは、マウスが寒くなりすぎるのと同じくらい回復の大きな障害であることが証明できます。
- 45分後、ステップ2.1-2.8を2回繰り返し、ステップ2.3(すなわち、鎮痛薬および抗炎症薬の投与)を省略します。
- 脳電電極注入手術が同じ日に行われる場合、動物が1〜2時間回復できるようにします。
3. 脳電電極の移植のための外科場の準備
メモ:手術前に、手術用の工具とネジをオートクレーブします。動物に触れる前と触れた後、70%エタノールでスプレーしてこすり、動物を取り扱う間に外科用手袋をきれいにしてください。動物間のビーズ滅菌装置(資料表を参照)で2-3分間の外科用具を殺菌します。新しい動物を立体装置に入れる前に、滅菌ドレープを交換してください。手術フィールドに手術に必要なすべてのコンポーネントが含まれていることを確認します (図 2)。このモデルでTBIを誘導する侵襲的な外科的処置の欠如は、いくつかの利点を有する:1)電極の移植は柔軟であり、TBIと同じ日または定義された期間後に行うことができる。2)動物の回復時間が速い;3)頭蓋骨はそのまま残り、電極を埋め込むためより多くの表面積と柔軟性を可能にする。
- マウスを3%-5%イソフルランガスで5分間誘導室に麻酔します。
- マウスを誘導室から定位装置に移し、鼻コーンに接続されたイソフルランガスと真空管を備えた加熱パッド上の無菌ドレープの上に置きます。
- 手術の間、体温を37°Cに保ちます。マウスの胸壁や腹壁に接触するように温度センサーを設置します。
- 耳棒を使って動物の頭を所定の位置に固定します。
- 麻酔を1.5%~3.5%のイソファフルランまたは外科手術面で60回/分程度に保つ(つま先や尾のピンチに反応しない)。
- 動物の目に目の軟膏を塗り、手術中に潤滑状態を保ちます。
- 鎮痛薬(0.1 mg/kgブプレノルフィン)と非ステロイド性抗炎症薬(5 mg/kg carprofen)の混合物を、TBIが日中早く行われない限り、皮下注射で投与し、その場合、動物はすでに鎮痛薬および抗炎症薬を受けている。
注:ブプレノルフィンは、最初のTBIと脳腺配置手術の間の時間が8時間を超える場合、または動物が最初の投与後に8時間の痛みの兆候を表示する場合は再び投与する必要がありますが、カルプロフェンを添加せずに与えられるべきです。 - 乳酸ナトリウム溶液(動物の体重のグラム当たり3μL)を皮下に投与し、動物の液体および電解質を置換する。
注: TBI の直後に手術を行う場合、このステップは適切にタイミングを合う必要があります。乳酸ナトリウム溶液は、動物が処置を受けている間、2時間ごとに投与されるべきであり、手術後に1回、前の注射から2時間投与されるべきである。 - 脱毛クリームを使用して頭皮から毛髪を取り除きます。
- 切開を行う前に、ポリドンヨウ素外科用消毒液と70%エタノールを回りの動き3倍(1回につき20秒)の滅菌ガーゼパッドで交互に頭皮の皮膚を消毒する。
- メスを使用して、目のすぐ上から頭の後ろまで、頭皮の正中線にロストラル・コーダル切開を行います。頭皮の開口部のこの方法は、皮膚のフラップがより安定性を提供するEEGキャップの上または周りに密封することができるので、頭皮を切断するよりも好ましいです。
注:3-EEGヘッドマウントの埋め込み用に頭蓋骨を準備する場合、ヘッドマウントのサイズはヘッドマウント上の皮膚フラップの閉鎖を可能にしませんので、頭皮を切断する必要があります。 - 開いた皮膚の境界に小さな止まり紙を適用することにより切開の領域を拡大します。切開後に出血が起こった場合は、無菌綿ガーゼまたは綿棒で洗浄する。
- 頭皮の刃で骨膜(すなわち、頭蓋骨の上の薄い膜)を静かに取り除きます。このステップで出血が起こった場合は、止まるまで無菌綿棒で出血部位を押してください。
- 滅菌綿棒を使用して過酸化水素で頭蓋骨をきれいにしますが、露出した頭蓋骨領域を取り巻く軟部組織に触れないようにしてください。このステップを繰り返して、任意の軟部組織から頭蓋骨を洗浄し、白っぽい外観を持つ。
- 頭蓋骨を滅菌ガーゼまたは綿棒で乾燥させます。
注:ステップ3.12-3.15は電極および歯科セメントの適切な固定のために重要である。軟部組織、非焼灼出血、および破片は、手術後数日または数週間以内に感染、不安定なヘッドマウント固定、歪んだまたは不在の信号、およびインプラントの喪失を引き起こす可能性がある。
4. 電極の配置
- 単一のEEG(1EEG)チャネルのヘッドマウントを埋め込む。
注: 定位座標の略語は空間的な関係を表し、動物の頭部の所定の方向(前-後方(AP)および内側側方(ML)におけるブレグマからのターゲットの距離をミリメートル単位で指定します。すべての電極は脳内の特定の構造ではなく硬膜外空間に配置されるため、このプロトコルでは下側腹側は適用できません(図 3).Vin+はアクティブな電極であり、Vin-はその参照電極です。- スチールビット(0.5 mm、ラウンド、1/4インチ)を1分あたり約5,000~6,000ラウンド(rpm)で高速ドリルで使用し、付属の定位座標12を使用して6つのバリ穴(安定性ネジ用3個、電極用3個)を作成します。2 本の前ねじの場合:AP = +1.5 mm、ML = ±1.5 mm;1 つの後ねじの場合: AP = -5.2 mm、ML = -1.5 mm;接地電極の場合:AP = -5.2 mm、ML = +1.5 mm;記録電極の場合:AP = -2.3 mm、ML = ±2.7 mm、Vin+を右に、Vin-を左にします。
- ヘッドステージの安定性を高めるには、3本のねじを追加します。ドライバーを使用して、ネジを1-1.5 xずつ回して、クラニウムに安定して固定します。
注意:ねじを深く配置すると、脳に損傷を与えます。 - 1EEGヘッドマウントを定位ホルダーアームに挿入し、3つの電極が頭蓋正線に沿って配置されるようにヘッドマウントを配置します。この構成では、ヘッドマウントの上部にある接地電極とそれぞれの開口部が背面にあり、中央にVin+電極、前面にVin-電極が配置されています。ヘッドマウントには、永久的なマーカーでマークを付けることができます。
- 各電極を90°曲げて、各線の端部が下方に曲げ、対応するバリ穴の上に位置するようにする。次に、バー穴に垂直になったワイヤの部分の長さ1mmを測定し、余分な部分をトリムします(図3)。これにより、電極の硬膜外配置が保証されます。電極は、硬膜表面にほとんど触れる必要があります。
- ヘッドマウントを下げ、3つの電極すべてを調整してそれぞれのバリ穴に合わせます。硬膜外記録のために、電極は、上に置くか、またはかろうじて硬膜に触れる必要があります。
- 数滴の溶剤と粉末の1/2スクープを混合することにより、適用のための歯科セメントを準備します。混合ヘラを使用し、最後の混合物がパテ状、粘着性が可鍛性であり、動物の頭蓋骨に置かれたときに適切に凝縮されるほど硬くなるまでかき混ぜます。
- すべてのネジと電極を覆う歯科用セメント混合物を適用し、それが固化するために〜3-5分待ちます。それはテザーで通勤者に動物を接続することが不可能になりますので、歯科セメントでプラスチックの台座をカバーしないようにしてください。
- 皮膚のフラップを保持している止血を解除し、プラスチック台座の周りの皮膚フラップを接続することにより切開を閉じます。皮膚のフラップを密封するために組織接着剤(材料の表を参照)の数滴を適用します。
- 感染を避けるために、インプラントの周りにクロルヘキシジンの消毒剤を塗布します。TBI誘導の間に与えられた乳酸ナトリウム溶液の前の注入後に2時間以上麻酔下にある場合、動物は皮下に別の注射を投与する。動物の適切な水分補給を維持するために、動物が麻酔下で過ごす2時間ごとに注射を繰り返す。
- 手術後、前の注射後2時間の乳酸ナトリウム溶液の最終注射を与える。手術が2時間未満の場合、最初の注射から2時間の乳酸ナトリウム溶液の最終回収用量を投与する。
- 定位装置から動物を取り出し、脳機能手術後の動物の体重を将来のモニタリングの基準として測定する。インプラントのため、動物の体重は手術前よりも大きくなります。
- 回復のために暖かい加熱パッドの上にきれいなケージに動物を置きます。
- 2つのEEGおよび1つのEMG(2EEG/1EMG)チャネルのヘッドマウントを埋め込む。
- ブレグマをヘッドマウントの配置のランドマークとして使用します。2EEG/1EMG ヘッドマウントの下部に少量のティッシュ接着剤(材料表を参照)を適用し、4 つのねじ穴を避け、2EEG/1EMG ヘッドマウントを頭蓋骨の表面に置きます。
注: このヘッドマウントの配置に特定の座標はありません。ヘッドマウントは長さ8mm、幅5mmで、頭蓋面の大部分をカバーしています。ヘッドマウントのフロントエッジを持つ位置は、ブレグマに対して3.0 mm前部に最適であり、良好な信号品質を提供します。組織接着剤の治療のドロップ前に迅速な手動配置が必要です。完全に治すために組織の接着剤のために約5分を与えます。 - 無菌の23 G針を使用して、ヘッドマウントの4つの開口部を通してねじのパイロット穴を作成します。これを達成するには、針を軽く押し、針の先端が脳を傷つけることなく頭蓋骨に突き刺さるまでゆっくりと回転させる。無菌綿棒を使用してパイロット穴から出血を除去します。
- パイロット穴に0.10をネジで挿入し、それぞれが頭蓋骨に固定されるまで回転させます。これは、デュラマーと皮質を損傷するので、ネジ長の半分までですが、完全な長さではありません。ヘッドマウントが位置付けられている場合は、後部のネジで 2 つの 0.12 を使用して、頭蓋の表面とヘッドマウントの後端の間にギャップがあります。
- 2成分エポキシ(銀エポキシ)ツインパックポーチの側面に小さな開口部を作ります。両面ヘラを取り、ポーチから各成分の小さくて等しい量をすくい、それらを一緒に混ぜるために両側を使用します。混合物が20分以内に固まるので、単一の手術のために十分な少量を使用してください。
メモ:銀エポキシはねじとヘッドマウント間の適切な電気接触を可能にし、ねじの安定性を高める。 - スクリューヘッドとスクリューホールの間に少量のこの混合物を適用し、その頭がインプラントのベースに置かれるまで各ネジを締めます。各ねじが個々の電極として機能するため、2つのネジの間に銀エポキシが接触していないことを確認し、正確な信号を確保するために、他のネジと接触しないようにしてください。
- 銀エポキシ混合物が見当違いであった場合、接続を分離するために余分なものを慎重にすくい取るためにいくつかの第二の時間枠があります。慎重に両方のEMGリードをヘッドマウントの後縁から曲げて、動物の頭と首の輪郭に従い、それらをヌーカルの筋肉に挿入します。
- 数滴の溶剤と粉末の1/2スクープを混合することにより、適用のための歯科セメントを準備します。混合ヘラを使用し、最後の混合物がパテ状、粘着性が可鍛性であり、動物の頭蓋骨に置かれたときに適切に凝縮されるほど硬くなるまでかき混ぜます。
- これはプリアンプを接続することが不可能になりますように、6ピン穴をカバーすることを避けながら、ヘッドマウント全体をカバーする歯科セメント混合物を適用します。セメントが固化するまで~3~5分待ちます。歯科用セメントで皮膚がヘッドマウントに密封されていないか確認してください。
- 皮膚のフラップを保持している止血を解除し、プラスチック台座の周りの皮膚フラップを接続することにより切開を閉じます。皮膚のフラップを密封するためにティッシュ接着剤の数滴を適用します。
注:EMG線の導線の矯正を可能にするために皮膚切開が長くなった場合、皮膚は組織接着剤で密封されるか、または縫合することができる。組織接着剤で皮膚を密封することは、通常十分である。しかし、手術後のモニタリング中に切開口が観察される場合は、代わりに縫合が推奨される。 - 感染を避けるために、インプラントの周りにクロルヘキシジンの消毒剤を塗布します。前の注射後2時間より長く麻酔下にある場合は、液体および電解質を置換するために皮下に乳酸ナトリウム溶液(動物の体重のグラム当たり3μL)を投与する。
- 定位装置から動物を取り出し、脳機能手術後の動物の体重を将来のモニタリングの基準として測定する。インプラントのため、動物の体重は手術前よりも大きくなります。
- 回復ジェルといくつかの湿ったチャウピースで、暖かい加熱パッドの上にきれいなケージに動物を置きます。
- ブレグマをヘッドマウントの配置のランドマークとして使用します。2EEG/1EMG ヘッドマウントの下部に少量のティッシュ接着剤(材料表を参照)を適用し、4 つのねじ穴を避け、2EEG/1EMG ヘッドマウントを頭蓋骨の表面に置きます。
- 3つのEEGチャネル(3EEG)ヘッドマウントを埋め込みます。
- 5,000~6,000 rpmの約5,000~6,000 rpmのスチールビット(0.5mm、ラウンド、1/4)の高速ドリルを使用して、指定された定位座標12を使用して6つのバリ穴(安定性ネジ用3つ、電極用に3つ)を作成します。EEG1 および EEG2 のグラウンドおよび共通のリファレンスの場合: AP = 5.2 mm、ML = ±1.5 mm;EEG1 および EEG2 の場合: AP = -3.0 mm、ML = ±3.0 mm;独立した EEG3 の場合: AP =-1.4 mm、ML = ±1.5 mm。
- 6本のネジ電極をバリ穴に入れる。
注:ねじを深く配置すると、脳に大きなダメージを与えます。スクリュー電極はヘッドマウントの安定性を向上させます。 - 数滴の溶剤と粉末の1/2スクープを混合することにより、適用のための歯科セメントを準備します。混合ヘラを使用し、最後の混合物がパテ状、粘着性が可鍛性であり、動物の頭蓋骨に置かれたときに適切に凝縮されるほど硬くなるまでかき混ぜます。
- 頭蓋骨の表面全体と各スクリュー電極を覆う歯科用セメント混合物を適用します。歯科用セメントでヘッドマウントに皮膚が密封されないようにしてください。セメントが弱く固化するまで~1~2分待ちます。次のステップに進む前に、完全に固化するまで待つ必要はありません。
- はんだ付けアイロンを入して加熱します。3EEGヘッドマウントを定位ホルダーアームに装着します。
メモ:6本のリード位置が各スクリュー電極のワイヤリードの位置と一致するようにヘッドマウントを配置します。 - 腹側部分が歯科用セメントの上に置かるようにヘッドマウントを下げます。
- 各ねじ電極から各リードのワイヤを、ヘッドマウントの対応するワイヤリードでねじります。
注: 間違った配線リードをツイストすると、データの解釈が複雑になるか不可能になります。 - ハサミを使用して余分なワイヤーを慎重にトリミングします。適切な信号伝導のためにワイヤーの各ねじれたペアをはんだ付け。
注: 各ワイヤペアは別のペアと接触する必要があり、それ以外の場合は信号の品質とデータの解釈が損なわれます。 - ヘッドマウントの周りにワイヤーリードの各はんだ付けされたペアを曲げ、各ペア間の接触を避けます。
注: ワイヤのリード線が短くトリムされていない場合は、別のワイヤに触れずにヘッドマウントの周りでワイヤを曲げることが困難な場合があります。この場合は、最初に1組を曲げ、歯科用セメント混合物で覆い、〜1〜2分待って固めてから、次のペアを同じ方法で進めます。 - ヘッドマウントの黒い部分だけを露出したまま、歯科用セメントですべてのワイヤーを覆い仕上げ。
注:ヘッドマウントの露出部分の上部に歯科用セメント粉末または混合物を塗布しないように注意してください。 - 皮膚のフラップを保持している止まっている人を解放します。感染を避けるために、インプラントの周りにクロルヘキシジンの消毒剤を塗布します。
- 前の注射後2時間より長く麻酔を受けている場合は、乳酸ナトリウム溶液(動物の体重のグラム当たり3μL)を皮下に投与し、液体および電解質を置換する。
- 定位装置から動物を取り出し、脳機能手術後の動物の体重を将来のモニタリングの基準として測定する。インプラントのため、動物の体重は手術前よりも大きくなります。
- 回復ジェルといくつかの湿ったチャウピースで、暖かい加熱パッドの上にきれいなケージに動物を置きます。
注:過酸化水素は、残りの軟部組織を頭蓋骨から取り除くのに役立ちます。
5. 動物を取得システムに接続する
- 両手で動物をカップに入れて取得ケージから取り出し、動物移動ステーション(ATS)のような平らな表面を持つ清潔な領域に移します。
- 背中の皮でマウスを軽くつかみます。これは苦痛を引き起こすので、尾で動物をつかむなないでください。
- 接地電極に対応するEEGヘッドマウントの開口部を特定し、適切な接続のためにテザーのそれぞれのピンと一致させます。
メモ:インターマターから動物のヘッドマウントへのテザーの逆接続は、電極とは異なる読み取りおよび潜在的に歪んだ波形になります。 - 動物を集録ケージに戻し、テザー(EEGシステム1)またはプリアンプ(EEGシステム2)の他端を通勤器に接続します。
メモ:プリアンプ(EEGシステム2)をコンミュータからテザーに接続する場合は、両方のテザーの端にある白いマークと一致させます。リバース接続は、アンプの永久的な損傷をもたらし、高価であるメーカーによる修理が必要になります。 - 動物を通勤器に接続するテザーをそっと回転させて、機構が正しく機能し、動物が自由に動くことができるようにします。
6. EEG データ取得設定
- EEG システム 1 の取得パラメータを設定します。
- サンプリングレートを500 Hzに設定します。5,000を得る。モードノルム35 Hz;LPN オフ。0.5 Hzにハイパスフィルタを設定します。
メモ:100Hz(ローパス)は内蔵されており、手動入力は必要ありません。
- サンプリングレートを500 Hzに設定します。5,000を得る。モードノルム35 Hz;LPN オフ。0.5 Hzにハイパスフィルタを設定します。
- EEG システム 2 の取得パラメータを設定します。
- サンプリングレートを600 Hzに設定します。プリアンプゲイン100。ゲイン 1 (EEG1,2)ローパスフィルタを100Hzに設定します。
メモ:1Hz(ハイパス)は内蔵されており、手動入力は必要ありません。
- サンプリングレートを600 Hzに設定します。プリアンプゲイン100。ゲイン 1 (EEG1,2)ローパスフィルタを100Hzに設定します。
7. ビデオデータ取得設定
- EEG システム 1 の取得パラメータを設定します。
メモ:同時ビデオデータを取得するには、サードパーティのビデオ収集システムが必要です。- 適切なビデオ品質を得る場合は、フレーム レートを 15 (最小推奨) から 30 (最大使用可能) に設定します。解像度を 640 x 640 ピクセルに設定します。圧縮の種類を H.264H に設定します。
- EEG システム 2 の取得パラメータを設定します。
注:このEEGシステムは、ビデオシステムとビデオとEEGデータを一緒に4匹までの動物のための単一のファイルに同期するソフトウェアを提供しています(資料の表を参照)。- 適切なビデオ品質を得る場合は、フレーム レートを 15 (最小推奨) から 30 (最大使用可能) に設定します。解像度を 640 x 480 ピクセルに設定します。圧縮の種類を WebM ファイル形式に設定します。
結果
ここで概説するプロトコルは、反復拡散TBIのマウスモデルを用いて、単独で拡散傷害を誘導する方法(例えば、焦点病変がない場合)を説明する(図1)。図 1Aは、このモデルで TBI の誘導に使用されるウェイト ドロップ デバイスとそのコンポーネント (図 1A、 a1-a5)と、手順中の重要なステップ (図 1B、b1-b5)を示しています。
このモデルの特徴は、TBIの結果としての脳への焦点病変の欠如、意識喪失、高生存率、後期発作発症の出現(TBIの1週間)、およびのサブセットにおける自発的な、いわれのない再発発作を含む。TBIマウスは、TBIの後に少なくとも3週間の待ち時間の後に.
このプロトコルは、クリーンな手術場を設定するための詳細な手順を示しています (図 2)、異なる電極アレイを埋め込む方法 (図 3)、およびこのモデルの発作を検出するための 2 つの異なる EEG 集録システム (資料表を参照) の使用に関する詳細なガイドが含まれています (図 4および図 5)。典型的な発作のスペクトルパワーは、15Hzのピークを持つ10〜40Hzの周波数範囲で最も高い密度を示します(図4)。マウスの発作の大半は痙攣性であり、平均持続時間は12〜15sである。発作のごく一部だけが非痙攣性である。どちらのシステムを使用する場合の利点と欠点を詳細に比較するかは、説明のセクションで説明されています。さらに、このプロトコルは、反復体重減少TBIの後の動物における発作発症のタイムラインを示し、断続的な記録ではなく連続的な記録を獲得することの重要性を強調するいくつかの動物(図6)における発作クラスタリングを示し、TBI後に自発的な発作を発症する動物の正確な階層化を保証する。重要なことに、このプロトコルはまた、PTEのげっ歯類モデルの長所と短所とTBIの後に人間の特定の集団を表す能力について議論する。

図1:反復拡散TBIのマウスモデル。(A) 重量ドロップデバイス。(a1)重量の低下の管。(a2)100gの重量棒。(a3)ロッドを保持するピン。(a4)高さを変えたり、重量滴管からロッドを取り外した場合にロッドを上げる文字列。(a5) をクリックします。重量滴下チューブの下に動物を配置するためのフォームパッド。(B) ウェイトドロップ手順。(b1)ステンレス鋼ディスクは目と耳の線の間の頭の中心に置かれる。(b2およびb3)動物の頭部が平らな位置にあり、泡パッドが動くことを視覚確認した後、動物の頭部を重量降下管の下に置く。(b4)重量棒を握るピンの解放、ステンレス鋼ディスクの中心を打つ。(b5)マウスは、影響の直後に無菌タオルの上に置かれ、意識の喪失は、動物が回復し、それ自体を正しくするためにかかる時間を測定することによって評価される。この図の大きなバージョンを表示するには、ここをクリックしてください。
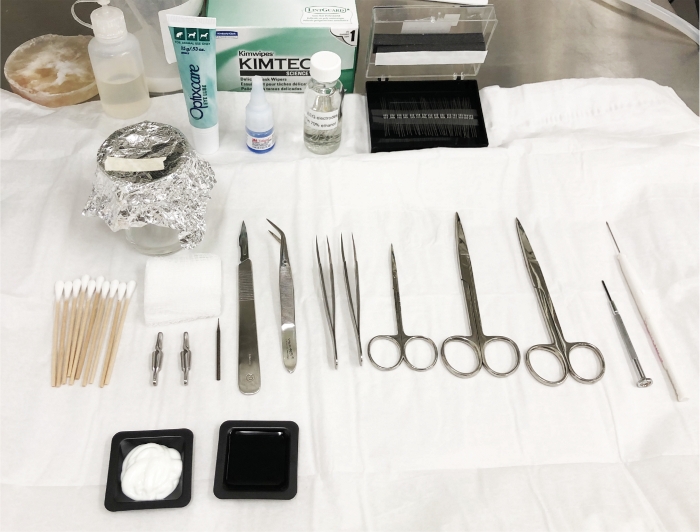
図2:手術場準備と脳電電極配置スキーム。手術や電極の移植に必要なオートクレーブツールと材料は、すべての必要な部品の可用性を確保するために動物を麻酔する前に調製されます。これは滅菌ゾーンであり、無菌材料でこのゾーンを汚染しないことが不可欠です。この図の大きなバージョンを表示するには、ここをクリックしてください。
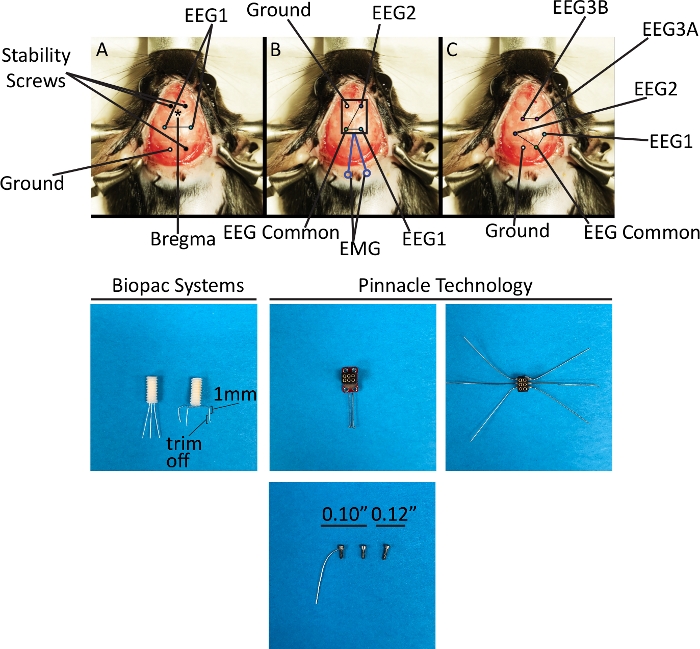
図3:EEGシステム1および2を用いた電極配置の定位図表と回路図トップパネルは、このプロトコルで説明されている3つの異なるヘッドマウントを埋め込む方法を示しています。(A)単一のEEGチャネル、バイポーラモンタージュ。(B) 共通の参照を持つ 2 つの EEG チャネル、バイポーラ モンタージュと 1 つの EMG チャネル。(C)3 つの EEG チャネル、モノポーラ(チャネル 1-2)およびバイポーラ(チャネル 3)モンタージュを使用します。下部パネルは、上部パネルに埋め込まれたヘッドマウントとネジを示しています。このプロトコルで使用される 3 種類のネジは、安定性ネジ (EEG システム 1) または両方の安定性と電極 (EEG システム 2) の 2 つの目的のために使用されます。この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:EEGシステム1を用いて獲得した自然発作トップパネルは、1EEGヘッドマウントを使用して取得したデータを使用してTBIを重ね、23日後にマウスで自発的な発作を描いている。(A) 前の氷結(発作前)活性。(B) イクタール(発作)活性。(C) 発作後うつ病。ボトムパネル: パワースペクトル密度はカスタムスクリプトとソフトウェアを使用して計算されます(資料の表を参照)。平均電力 = エポック内のパワースペクトルの平均パワー(単位: V2/Hz)。中央値周波数 = エポック内の総電力の 50% に達する周波数 (単位: Hz)。平均周波数 = エポック内の平均電力に達する周波数(単位: Hz)。スペクトル エッジ = エポック内の総電力のユーザー指定の割合に達する周波数 (単位: Hz) です。ピーク周波数 = エポック中に最大電力が発生する周波数。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:EEGシステム2を用いて獲得した自然発作(A) 体重降下TBIを繰り返した65日後にマウスでの自発的非痙攣(電気画像)発作。2EEG/1EMGヘッドマウントを使用して取得したデータ。(B) 体重降下TBIの97日後にマウスでの自発的痙攣発作。3EEGヘッドマウントを使用して取得したデータ。この図の大きなバージョンを表示するには、ここをクリックしてください。

図6:重み低下TBIを繰り返した後のマウスにおける発作発生タイムライン。最も早い発作は、傷害後3週間観察された。一部の動物は、同じ日内に発作のクラスターを発症し、その後、発作なしで数週間が続きます。動物はTBIの4ヶ月後まで記録した。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
焦点と拡散傷害のどちらを誘発するCCIおよびFPIモデルとは対照的に、このプロトコルで説明されている反復的な拡散TBIのモデルは、焦点脳損傷の不在時にびまん性傷害の誘発を可能にし、頭皮または頭蓋の開口部および関連する炎症を必要としない。このモデルにおける難解切除がないことの付加的な利点は、慢性的な連続脳波記録のための電極を埋め込むだけでなく、ShandraとRobel 20191に記載されているように、動物のビボ内2光子イメージングの慢性の間引き頭蓋骨頭蓋窓の作成を可能にすることである。
どの動物モデルが選択されているかに関わらず、採用されるデータ収集アプローチは、成功した包括的な研究の重要な要素です。心的外傷後てんかんのげっ歯類モデルでは、発作の頻度は14、9日あたり0.3〜0.4の発作の範囲で低く、最初の発作の前の潜伏期間は、最初のTBI処置の後に数日または数週間から数ヶ月までどこでも続くことができる。最後に、より短期間で発作の発生率が一般的に高い非外傷性モデルとは対照的に、TBIを有する動物の平均9%−50%だけが、最大6ヶ月間の間に自発的な発作を起こす8、16.これは、意味のある研究が継続的な長期的なビデオ-EEG記録を必要とすることを示唆しています。
TBIの各動物モデルの包括的な目標は、PTEの基礎となる細胞および分子メカニズムをよりよく調査するために、ヒト患者に見られるTBIの異なる形態を可能な限り密接に再現することです。このプロトコルの技術は、治療標的の発見、新しい予防および治療候補の有効性および許容性の試験、および以下のてんかんの信頼性の高いバイオマーカーまたは予測変数の開発を容易にするのに役立ちますTbi。
重量低下手順中の潜在的な課題
頭部は定位フレームに固定されていないので、ヘッドと金属板の平坦な位置を確保するために特別な注意を払う必要があります。重み付けされたロッドが金属板または頭部に斜度で当たる場合、または体重がマウスの頭部の側面に滑り落ちる場合、傷害バイオメカニクスが異なり、軽度または全くけがを起こし得る可能性があります。以前は、金属板を頭蓋骨に接着して変動を最小限に抑えました。しかし、体重低下後にマウスの頭蓋骨から金属板および接着剤を除去し、注意して行っても、髄腔に損傷を与え、その後、偽動物においても脳組織に血管損傷およびそれに続く損傷を生じる。さらに、切開には治癒が必要であり、潜在的に末梢免疫応答を伴い、ばらつきを引き起こす可能性がある。これらの理由から、金属板を頭蓋骨に接着することを省略することが選択された。動物は、このプロトコルで3倍の傷害を繰り返して死ぬ可能性がある。体重が25g未満のマウスは、繰り返しの衝撃を許容しない可能性があります。単一の傷害はほとんど死亡率をもたらすことはありませんが、C57BL /6動物の最大7%は、9を繰り返し衝撃した後に死亡します。一部の動物では、運動障害が見られます。これらの欠陥は、後肢麻生または歩行異常として現れる。これは通常、回復不良の予後因子であり、動物を犠牲にすることをお勧めします。痛みや苦痛の兆候には、減量、不十分なグルーミング、脱水症状、不安の増加、低または不在の探索的活動(ヒドロゲル/回復、チャウおよび/またはネスレットは手つかずのまま)が含まれる。レスキュー鎮痛(0.1 mg/kgのブプレノルフィン)は、TBIから3日間、皮下に8時間ごとに投与して痛みを軽減し、動物が人道的エンドポイントに到達するのを防ぐことができます。皮下ナトリウム乳酸溶液(動物の体重の1グラム当たり3μL)は、水分補給のために1日2回投与することができる。動物は通常、TBIの3日以内に回復する。実験手順の後に動物モニタリングのための5段階の体の状態スコア(BCS)の使用が推奨される。ステージには、(1)Emaciated (骨格構造は非常に顕著である、椎骨は非常にセグメント化) が含まれます。(2) 条件が不整合 (椎骨柱のセグメンテーションが明らかで、骨盤底の骨の部分は容易に触知可能です);(3)よく調整(椎骨および背骨盤はわずかな圧力で顕著な触診可能ではない)。(4) 過剰に調整 (脊椎は連続列であり、椎骨は強い圧力でのみ触知可能);(5)肥満(マウスは滑らかでかさばり、骨の構造は肉と皮下脂肪の下で消える)。ヒトのエンドポイントは、BCSがTBI以前の体重と比較して成人マウスで1-2、20%以上の体重減少、鎮痛薬、自己突然変異の徴候、脱水症状、低体温症、神経障害の症状(異常なゲイトまたは運動麻児)によって緩和されない場合に到達する。物質投与のいくつかの可能な結果を考慮する必要があります。.皮下注射されたブプレノルフィンは、注射後10分でその鎮痛効果の第1ピークに達する。最初の衝撃は、ブプレノルフィンが投与された数秒後に起こり、右の時間の最初の測定が影響を受ける可能性が低いことを示唆している。ただし、これは変数として完全に除外することはできません。したがって、実験者は自分の判断を行使することをお勧めします。体重減少の手順に続いて定位手術が行われ、カープロフェンが投与される場合、カープロフェンは発作発生率に影響を与える抗炎症剤であるため、実験者はその使用を慎重に検討することをお勧めします。
手術中の潜在的な課題
70%エタノールを使用すると汚染や感染のリスクが低下しますが、滅菌状態にはなりません。あるいは、滅菌手術用手袋が使用されてもよい。しかし、定位装置自体は無菌ではないので、手動操作は手袋の無菌状態の損失をもたらす。従って、70%エタノールによる噴霧は外科の間に無菌材料と接触した後に要求される。頭蓋骨を脳に穿孔すると、脳組織に損傷を与え、多量の出血を引き起こす可能性があります。バリ穴を作成するには細心の注意が必要です。立体腕にハンドドリルを固定し、徐々に下げるのは、ドリルを手動で保持しながら穴を開けるよりも好ましい。電極と固定ネジは、硬膜(硬膜下配置)または皮質(皮質配置)を傷つけて、計画よりも深く沈む可能性があります。これは、多量の出血や焦点病変を引き起こす可能性があります.実験者は、手術中に動物の過熱を避ける必要があります。温度センサーが正しく固定されていない場合、それは、過熱、火傷、および場合によっては動物の死を引き起こす、必要な37°Cの温度を維持しません。動物の目は、動物が定位装置に入れられるとすぐに潤滑しなければ、手術中に乾燥、刺激、または損傷を受ける。
術後のモニタリング
術後のモニタリングは、処置または手術が終了した直後に開始する。麻酔から目を覚ますまで動物を観察し、出血や麻生を含む手術関連の合併症の有無を調べてください。不完全な切開閉鎖から出血が観察された場合、動物を麻酔し、クロルヘキシジンで出血部位をきれいにし、上述したように創傷閉鎖を行い、動物を回復ケージに戻す。手術後約1〜2時間、動物は麻酔から完全に目を覚まし、麻傷や痛みの兆候なしでケージ内を自由に移動する必要があります。動物は、動物がグルーミング中にそれを開くことを防ぐために切開を密封する必要がある理由である、それ自体のグルーミングを開始します。動物が回復したら、EEGデータ収集に使用されるケージ/チャンバーに転送します。これにより、動物は新しい環境に慣れることができます。これは、長期記録(月)に特に重要です。動物のケージには、回収ジェル(材料の表を参照)、湿らせたチャウ、ネスレット、および水筒が必要です。これは適切な回復を可能にし、動物に栄養素と水へのアクセスを与えます。動物の監視を毎日続けます。評価には、(a)減量、不十分なグルーミング、不安の増加、低または不在の探索的活動(ヒドロゲル/回復、チャウおよび/またはネスレットは手つかずのまま)およびEEGインプラント周辺の切開領域の適切な治癒を含む、痛みや苦痛の兆候に対する動物の行動の目視検査を含む必要があります。(b) 脱水症状と栄養失調の兆候に対するBCSの評価(c) 動物の重量。動物が脱水の徴候を示す場合、皮下に乳酸ナトリウム溶液(動物の体重の1グラム当たり3μL)を投与する(材料表参照)。動物が痛みや苦痛の徴候を示す場合は、皮下にブプレノルフィン(0.1 mg/kg)を投与する。痛みの兆候が持続するブプレノルフィンが8時間ごとに投与できる場合、動物が痛みや苦痛の徴候を示している場合、モニタリングを1日2回に増やす必要があります。動物がテザーを介して取得システムに接続する前に脳電解手術後少なくとも3日間回復することを許可します。人道的なエンドポイントの基準は、上記の重量減少手順での潜在的な課題と同じです。
取得システムとヘッドマウントのメリットとデメリット
単一の EEG チャネル・ヘッドマウントを備えた EEG システム 1 の主な利点は、ハードウェア、コンポーネント、およびサービスのコストが比較的低い点です。シンプルでわかりやすい構成により、ユーザーはシステムを自分の好みに合わせてカスタマイズすることもできます。各差動増幅器は、単一のEEGチャンネルを提供しますが、複数の差動アンプを互いに接続でき、各動物のチャンネル数を増やすことができます。このシステムでは、1匹の動物につき1つのチャネル構成を使用して、20匹の動物の慢性長期EEG記録を同時に取得した。心的外傷後発作は一般化され、電極の両側双極性モンタージュでは、このタイプのてんかん活性を検出することは容易である。しかし、このアプローチの欠点は、いくつかのチャネルを必要とするため、焦点、横化、またはてんかん活性の伝播を確実に検出することができないということです。もう一つの潜在的な課題は、時間の経過とともに単一のチャネルのノイズ汚染であり、動物から有用なデータを取得することができない。これは、動物ごとのチャンネル数を2倍にする2つ以上の差動アンプを組み合わせることによって克服することができます。最後に、単一のチャネルから取得したデータは潜在的なアーティファクトと区別するのが難しく、てんかんの活動は動物の行動のビデオ録画によって最もよくサポートされます。このため、すべての記録は、EEG集録と同期連続ビデオモニタリングを組み合わせた。このシステムとそのソフトウェアの制限は、ビデオ集録システムが含まれていないため、同期ビデオを取得するためのカスタムサードパーティ製システムが必要です。
マルチチャンネルヘッドマウントを備えたEEGシステム2の主な利点は、アンプに通勤器を通過する前に、プリアンプ(材料の表を参照)によって取得した信号のプリフィルタリングによる信号の高品質です。このシステムのアンプは、次の構成で3つのチャンネルのデータを取得することができます:2 EEG +1 EMGチャンネルまたは3つのEEGチャンネル(材料の表を参照)。これにより、一般化された活性だけでなく、潜在的に焦点性てんかんの活性も検出できます。もう一つの大きな利点は、このシステムは動物の研究のために特別に設計されており、したがって、EEGシステムとEEGシステム1よりも簡単かつ便利な分析を行う1つのファイルで最大4匹の動物のためのビデオ録画システムとビデオチャンネルを同期させることができるソフトウェアを提供しています。このシステムは、使用するヘッドマウントの種類以外のシステムに変更を加えることなく、発作や睡眠解析のためのデータの取得に使いやすいです。2EEG/1EMGヘッドマウントは、回路基板のサイズと構成により、固定位置にのみ電極を埋め込めます。3EEGヘッドマウントのワイヤリードを備えたスクリュー電極は、参照電極が配置されている場所に応じて、単極またはバイポーラ集録を行う可能性のある所望の場所に柔軟に移植することができます。しかし、3EEGヘッドマウントの埋め込みにははんだ付けが必要で、手術に多くのステップが追加され、特別な注意と精度が必要です。接続テザーとプリアンプは、マウスや未熟なラットのような小さなげっ歯類のために特別に設計されており、動物の頭部にほとんど圧力を与える薄くて低重量のケーブルです。システムの欠点は、ハードウェア、ソフトウェア、ビデオ ライセンス、およびコンポーネント (プリアンプとヘッドマウント) のコストが比較的高い点です。
EEGデータ取得における重要なステップ
このコンミュータは回転機構を備えており、動物の動きの方向に応じてテザーを回転させることができます。このメカニズムが失敗した場合、動物の動きが制限され、EEGキャップが除去される可能性があります。新しい電極を配置する繰り返し手術を試みることができます。しかし、以前の脳腫瘍の除去が頭蓋骨および脳に損傷を与えた場合、これは困難または不可能である可能性があります。EEG データ取得のサンプリング レートは、関心の最高周波数を 2 ~2.5 倍以上にする必要があります。サンプリングレートが高いと、ファイルサイズの増加の価格でデータの分解能が高くなり、複数の動物の連続記録を取得すると保存や処理が困難になる可能性があります。したがって、ファイル サイズを最小限に抑えながら、品質を損なうことなく必要なデータを取得できるレベルにサンプリング レートを最適化する必要があります。
ビデオデータの取得における重要なステップ
げっ歯類では、ヒトと同様に、PTEは関連する症状と電気的相関に大きなばらつきを示し、観察された脳波事象を適切に解釈および分類するために脳波獲得中に同時にビデオを得る必要がある。同期されたビデオがない場合の EEG データの解釈は、単一の EEG チャネルを使用する場合に特に困難です。この場合、他の証拠(ビデオ)が発作として分類をサポートしていない限り、EEG波形がアーティファクトであるかどうかを判断することは困難です。モーションアーチファクトは、発作の電気的パターンに似たように見えます。したがって、EMG確認の有無にかかわらずビデオが必要です。ビデオ録画は、光と暗の両方のサイクルの間に実行されますが、ビデオの品質は、常に満足できるし、暗い時間帯に明確な場合があります。さらに、動物がictalのようなEEGイベント中にカメラから離れた場合、その挙動を評価することは困難である可能性があります。これらの場合、EEGとビデオに加えて筋電図(EMG)信号を取得すると、軽度の行動発作時の筋肉活動に関する情報を提供したり(低運動成分を有する)、またはEEG上の不在のようなスパイク波放電時の動物の動きの欠如を確認することで、課題を解決することができます。EMG チャネルの潜在的な課題は、ノイズ汚染、電極の不適切な配置、または記録の長時間にわたって緩む(または表面接触を失う)電極など、EEG チャネルの課題と似ています。EEG分析と共にビデオを使用することは、EEGイベントが動物の動き(探索的行動、飲酒、咀嚼、引っ掻き、ストレッチ、グルーミング、または迅速/労働呼吸)によって引き起こされるアーティファクトではないことを確認し、痙攣性および非けいれん発作を区別する2つの目的を有する。痙攣発作または非けいれん発作を特徴付けるために変更されたラシーンスケールの使用が推奨される。段階は、(0)任意の識別可能なモーターの症状のない純粋な電気差し押さえを含みます。(1) 口腔上の自己化と頭のうなずき;(2) 前肢のクロニックジャーク;(3) 両側前肢クローヌス;(4) 前肢のクローヌスと飼育;(5)飼育と落下を伴う前肢のクローヌス。各ビデオチャンネルは、ケージ内の動物との表面全体、動物識別番号、水筒先端、食物、およびダイエット/回復ゲルを含むラベルを明確に示す必要があります。暗い時間帯にビデオを確実に取得するには、赤外線ナイトソースを使用します。(カメラによっては、デバイスが内蔵されている場合や、追加のパーツが必要な場合があります。資料の表を参照してください。1 秒あたりのフレームレートと画像解像度を調整します。フレーム レートと解像度が高いほど、ファイル サイズが大きくなります。長期にわたる連続実験の間にビデオを取得することの主な欠点は、非常に大量のデータを格納する必要性と大きなファイルの処理に伴う技術的な困難です。また、行動データをEEGと共に効果的に解釈する実験者の習熟度も考慮されなければならない。
開示事項
著者たちは開示するものは何もない。
謝辞
この研究は、賞No.の下で心理的健康と外傷性脳損傷研究プログラムを通じて、米国陸軍医学研究とマテリエル司令部(DoD)から受け取った助成金CUREに基づいて、R01 NS105807/ NS /NINDS NIH HHS / 米国とCUREによってサポートされました。W81XWH-15-2-0069.イワン・ザイトフックは、原稿を校正するために非常に高く評価されています。
資料
| Name | Company | Catalog Number | Comments |
| 0.10" screw | Pinnacle Technology Inc., KS, USA | 8209 | 0.10 inch long stainless steel |
| 0.10" screw | Pinnacle Technology Inc., KS, USA | 8403 | 0.10 inch long with pre-soldered wire lead |
| 0.12" screw | Pinnacle Technology Inc., KS, USA | 8212 | 0.12 inch long stainless steel |
| 1EEG headmount | Invitro1 (subsidiary of Plastics One), VA, USA | MS333/8-A/SPC | 3 individually Teflon-insulated platinum iridium wire electrodes (twisted or untwisted, 0.005 inch diameter) extending below threaded plastic pedestal |
| 2EEG/1EMG headmount | Pinnacle Technology Inc., KS, USA | 8201 | 2EEG/1EMG channels |
| 3% hydrogen peroxide | Pharmacy | ||
| 3EEG headmount | Pinnacle Technology Inc., KS, USA | 8235-SM-C | custom 6-Pin Connector for 3EEG channels |
| Buprenorphine | Par Pharmaceuticals, Cos. Inc., Spring Valley, NY, USA | 060969 | |
| Buprenorphine | Par Pharmaceuticals, Cos. Inc., Spring Valley, NY, USA | 060969 | |
| C57BL/6 mice | Harlan/Envigo Laboratories Inc | male, 12-16 weeks old | |
| C57BL/6 mice | The Jackson Laboratory | male, 12-16 weeks old | |
| Carprofen | Zoetis Services LLC, Parsippany, NJ, USA | 026357 | NOTE: this drug is added during weight drop only if stereotactic electrode implantation will be performed on the same day |
| Chlorhexidine antiseptic | Pharmacy | ||
| Dental cement and solvent kit | Stoelting Co., USA | 51459 | |
| Drill | Foredom | HP4-917 | |
| Drill bit | Meisinger USA, LLC, USA | HM1-005-HP | 0.5 mm, Round, 1/4, Steel |
| Dry sterilizer | Cellpoint Scientific, USA | Germinator 500 | |
| EEG System 1 | Biopac Systems, CA, USA | ||
| EEG System 2 | Pinnacle Technology Inc., KS, USA | ||
| Ethanol ≥70% | VWR, USA | 71001-652 | KOPTEC USP, Biotechnology Grade (140 Proof) |
| Eye ointment | Pro Labs Ltd, USA | Puralube Vet Ointment Sterile Ocular Lubricant available in general online stores and pharmacies | |
| Fluriso liquid for inhalation anesthesia | MWI Veterinary Supply Co., USA | 502017 | |
| Hair removal product | Church & Dwight Co., Inc., USA | Nair cream | |
| Isoflurane | MWI Veterinary Supply Co., USA | 502017 | |
| Povidone-iodine surgical solution | Purdue Products, USA | 004677 | Betadine |
| Rimadyl/Carprofen | Zoetis Services LLC, Parsippany, NJ, USA | 026357 | |
| Solder | Harware store | ||
| Soldering iron | Weller, USA | WP35 | ST7 tip, 0.8mm |
| Stainless steel disc | Custom made | ||
| Sterile cotton swabs | |||
| Sterile gauze pads | Fisher Scientific, USA | 22362178 | |
| Sterile poly-lined absorbent towels pads | Cardinal Health, USA | 3520 | |
| Tissue adhesive | 3M Animal Care Products, USA | 1469SB |
参考文献
- Christensen, J., et al. Long-term risk of epilepsy after traumatic brain injury in children and young adults: a population-based cohort study. Lancet. 373 (9669), 1105-1110 (2009).
- Lowenstein, D. H. Epilepsy after head injury: an overview. Epilepsia. 50, Suppl 2 4-9 (2009).
- Ferguson, P. L., et al. A population-based study of risk of epilepsy after hospitalization for traumatic brain injury. Epilepsia. 51 (5), 891-898 (2010).
- Abou-Abbass, H., et al. Epidemiology and clinical characteristics of traumatic brain injury in Lebanon: A systematic review. Medicine (Baltimore). 95 (47), 5342(2016).
- Management of Concussion/mTBI Working Group. VA/DoD Clinical Practice Guideline for Management of Concussion/Mild Traumatic Brain Injury. The Journal of Rehabilitation Research and Development. 46 (6), 1-68 (2009).
- Piccenna, L., Shears, G., O'Brien, T. J. Management of post-traumatic epilepsy: An evidence review over the last 5 years and future directions. Epilepsia Open. 2 (2), 123-144 (2017).
- Loscher, W., Brandt, C. Prevention or modification of epileptogenesis after brain insults: experimental approaches and translational research. Pharmacological Reviews. 62 (4), 668-700 (2010).
- Ostergard, T., Sweet, J., Kusyk, D., Herring, E., Miller, J. Animal models of post-traumatic epilepsy. Journal of Neuroscience Methods. 272, 50-55 (2016).
- Shandra, O., et al. Repetitive Diffuse Mild Traumatic Brain Injury Causes an Atypical Astrocyte Response and Spontaneous Recurrent Seizures. Journal of Neuroscience. 39 (10), 1944-1963 (2019).
- Foda, M. A., Marmarou, A. A new model of diffuse brain injury in rats. Part II: Morphological characterization. Journal of Neurosurgery. 80 (2), 301-313 (1994).
- Marmarou, A., et al. A new model of diffuse brain injury in rats. Part I: Pathophysiology and biomechanics. Journal of Neurosurgery. 80 (2), 291-300 (1994).
- Paxinos, G., Keith, B. J., Franklin, M. The Mouse Brain in Stereotaxic Coordinates. , Elsevier Science. (2007).
- Shandra, O., Robel, S. Imaging and Manipulating Astrocyte Function In Vivo in the Context of CNS Injury. Methods in Molecular Biology. 1938, 233-246 (2019).
- Pitkanen, A., Immonen, R. Epilepsy related to traumatic brain injury. Neurotherapeutics. 11 (2), 286-296 (2014).
- Kharatishvili, I., Nissinen, J. P., McIntosh, T. K., Pitkanen, A. A model of posttraumatic epilepsy induced by lateral fluid-percussion brain injury in rats. Neuroscience. 140 (2), 685-697 (2006).
- Pitkanen, A., Bolkvadze, T., Immonen, R. Anti-epileptogenesis in rodent post-traumatic epilepsy models. Neuroscience Letters. 497 (3), 163-171 (2011).
- Gades, N. M., Danneman, P. J., Wixson, S. K., Tolley, E. A. The magnitude and duration of the analgesic effect of morphine, butorphanol, and buprenorphine in rats and mice. Journal of the American Association for Laboratory Animal Science. 39 (2), 8-13 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved