Method Article
Inducir la epilepsia postraumática en un modelo de ratón de lesión cerebral traumática difusa repetitiva
En este artículo
Resumen
Este protocolo sistemático describe un nuevo modelo animal de epilepsia postraumática después de una lesión cerebral traumática leve repetitiva. La primera parte detalla los pasos para la inducción de lesiones cerebrales traumáticas usando un modelo de caída de peso modificado. La segunda parte proporciona instrucciones sobre el enfoque quirúrgico para sistemas de adquisición de datos electroencefalográficos monocanal y multicanal.
Resumen
La lesión cerebral traumática (TBI) es una de las principales causas de epilepsia adquirida. La TBI puede resultar en una lesión cerebral focal o difusa. La lesión focal es el resultado de fuerzas mecánicas directas, a veces penetrando a través del cráneo, creando una lesión directa en el tejido cerebral. Estos son visibles durante las imágenes cerebrales como áreas con contusión, laceración y hemorragia. Las lesiones focales inducen la muerte neuronal y la formación de cicatrices gliales y están presentes en el 20% a 25% de todas las personas que incurren en un TBI. Sin embargo, en la mayoría de los casos de TBI, las lesiones son causadas por fuerzas de aceleración-desaceleración y posterior cizallamiento tisular, lo que resulta en daño difuso no focal. Una subpoblación de pacientes con TBI continúa desarrollando epilepsia postraumática (TEP) después de un período de latencia de meses o años. Actualmente, es imposible predecir qué pacientes desarrollarán TEP, y las convulsiones en pacientes con TEP son difíciles de controlar, lo que requiere más investigación. Hasta hace poco, el campo se limitaba a sólo dos modelos animales/roedores con convulsiones post-traumáticas espontáneas validadas, ambos presentando grandes lesiones focales con pérdida masiva de tejido en la corteza y a veces estructuras subcorticales. A diferencia de estos enfoques, se determinó que la TBI difusa inducida mediante un modelo de caída de peso modificado es suficiente para iniciar el desarrollo de convulsiones convulsivas y no convulsivas espontáneas, incluso en ausencia de lesiones focales o pérdida de tejido. Al igual que los pacientes humanos con epilepsia postraumática adquirida, este modelo presenta un período de latencia después de la lesión antes de la aparición de la convulsión. En este protocolo, la comunidad recibirá un nuevo modelo de epilepsia postraumática, detallando cómo inducir TBI difuso no lesional seguido de monitoreo continuo de animales videoelectroencefalográficos a largo plazo en el transcurso de varios meses. Este protocolo detallará el manejo de animales, el procedimiento de caída de peso, la colocación de electrodos para dos sistemas de adquisición y los desafíos frecuentes encontrados durante cada uno de los pasos de la cirugía, el monitoreo postoperatorio y la adquisición de datos.
Introducción
Cada año, TBI afecta a unos 60 millones de personas en todo el mundo. Las personas afectadas tienen un mayor riesgo de desarrollar epilepsia, que puede manifestarse años después de la lesión inicial. Aunque los TBI graves se asocian con un mayor riesgo de epilepsia, incluso la TBI leve aumenta la probabilidad de que un individuo desarrolle epilepsia1,2,3,4. Todos los TBI se pueden clasificar como focales, difusos o una combinación de ambos. La lesión cerebral difusa, presente en muchos TMI, si no en todos, es el resultado de tejidos cerebrales de diferentes densidades que se cortan entre sí debido a la desaceleración de la aceleración y las fuerzas de rotación. Por definición, la lesión difusa sólo se produce de forma aislada en lesiones cerebrales leves/concusivas no penetrantes, en las que no se pueden ver lesiones cerebrales en las exploraciones por tomografía computarizada5.
Actualmente hay dos problemas críticos en el manejo de pacientes que tienen, o están en riesgo de, desarrollar epilepsia post-traumática (TEP). La primera es que una vez que la ETE se ha manifestado, las convulsiones son resistentes a los medicamentos antiepilépticos disponibles (DeA)6. En segundo lugar, los DEA son igualmente ineficaces para prevenir la epileptogénesis, y no existen enfoques terapéuticos alternativos eficaces. Para hacer frente a este déficit y encontrar mejores dianas terapéuticas y candidatos para el tratamiento, será necesario explorar nuevos mecanismos celulares y moleculares en la raíz de PTE6.
Una de las características destacadas de la epilepsia postraumática es el período latente entre el evento traumático inicial y la aparición de convulsiones espontáneas, no provocadas y recurrentes. Los eventos que ocurren dentro de esta ventana temporal son un foco natural para los investigadores, ya que esta ventana de tiempo podría permitir el tratamiento y la prevención de la ETE por completo. Los modelos animales se utilizan más comúnmente para esta investigación porque ofrecen varios beneficios distintos, no menos importante de los cuales es que el monitoreo continuo de pacientes humanos sería a la vez poco práctico y costoso en tales períodos potencialmente largos de tiempo. Además, los mecanismos celulares y moleculares en la raíz de la epileptogénesis sólo se pueden explorar en modelos animales.
Se prefieren modelos animales con convulsiones postraumáticas espontáneas y epilepsia sobre los modelos en los que las convulsiones son inducidas después de TBI por medios menos relevantes fisiológicamente, como por chemoconvulsantes o estimulación eléctrica aguda, crónica o por leña. Los modelos espontáneos de convulsiones postraummáticas prueban cómo TBI modifica la red cerebral saludable que conduce a la epileptogénesis. Los estudios con estimulación adicional después de tAT evalúan cómo la exposición a TBI reduce el umbral de convulsiones y afecta la susceptibilidad a las convulsiones. Las ventajas de los modelos animales con convulsiones inducidas químicamente o con estimulación eléctrica están en el ensayo de los mecanismos específicos de refractoridad a los DEA y la eficacia de los DEA existentes y nuevos. Sin embargo, el grado de pertinencia y traducción de estos datos a los seres humanos puede ser ambiguo7 debido a lo siguiente: 1) los mecanismos de incautación pueden ser diferentes de los inducidos por TBI por sí solo; 2) no todos estos modelos conducen a convulsiones espontáneas7; 3) las lesiones creadas por el propio agente convulsivo, con la cánula necesaria para su parto, o estimulando la colocación de electrodos en estructuras de profundidad (por ejemplo, el hipocampo o la amígdala) ya pueden causar un aumento de la susceptibilidad a las convulsiones e incluso potenciales de campo epilepciforme del hipocampo7. Además, algunos agentes convulsivos (es decir, ácido kainic) producen lesiones y esclerosis directas del hipocampo, que no es típica después de la TBI difusa.
Hasta hace poco, sólo existían dos modelos animales de epilepsia postraumática: impacto cortical controlado (CCI, focal) o lesión por percusión fluida (FPI, focal y difusa)8. Ambos modelos resultan en lesiones focales grandes junto con pérdida de tejido, hemorragia y gliosis en roedores8. Estos modelos imitan la epilepsia postraumática inducida por lesiones focales grandes. Un estudio reciente demostró que el TBI difuso repetido (3x) es suficiente para el desarrollo de convulsiones espontáneas y epilepsia en ratones, incluso en ausencia de lesiones focales9,añadiendo un tercer modelo de ETE de roedores con convulsiones recurrentes espontáneas confirmadas. Este nuevo modelo imita los cambios celulares y moleculares inducidos por la TBI difusa, representando mejor a la población humana con TMI leves y conmovedores. En este modelo, el período latente de tres semanas o más antes de la aparición de la convulsión y la aparición de convulsiones tardías, espontáneas y recurrentes permite investigar las causas profundas de la epileptogénesis postraumática, probar la eficacia de los enfoques preventivos y los nuevos candidatos terapéuticos después de la aparición de la convulsión, y tiene potencial para el desarrollo de biomarcadores de epileptogénesis postraumática porque aproximadamente la mitad de los animales desarrollan epilepsia postraumática.
La elección del modelo animal para el estudio de la epilepsia postraumática depende de la cuestión científica, el tipo de lesión cerebral investigada y qué herramientas se utilizarán para determinar los mecanismos celulares y moleculares subyacentes. En última instancia, cualquier modelo de epilepsia postraumática debe demostrar tanto la aparición de convulsiones espontáneas después de TBI como un período de latencia inicial en un subconjunto de animales TBI, porque no todos los pacientes que incurren en un TBI van a desarrollar epilepsia. Para ello, en este protocolo se utiliza la electroencefalografía (EEG) con adquisición simultánea de vídeo. Comprender los aspectos técnicos detrás del hardware y los enfoques de adquisición de datos es fundamental para una interpretación precisa de los datos. Los aspectos críticos del hardware incluyen el tipo de sistema de grabación, el tipo de electrodos (tornillo o cable de alambre) y el material del que están hechos, la adquisición de vídeo sincronizado (como parte del sistema EEG o de terceros) y las propiedades del sistema informático. Es imperativo establecer los parámetros de adquisición adecuados en cualquier tipo de sistema dependiendo del objetivo del estudio, eventos EEG de interés, método de análisis adicional y sostenibilidad del almacenamiento de datos. Por último, debe tenerse en cuenta el método de configuración de electrodos (montaje), ya que cada uno tiene ventajas y desventajas y afectará a la interpretación de los datos.
Este protocolo detalla cómo utilizar el modelo de caída de peso Marmarou modificado10,11 para inducir lesiones difusas que resultan en convulsiones espontáneas, no provocadas y recurrentes en ratones, describe enfoques quirúrgicos para adquirir un EEG de vídeo continuo y multicanal y multicanal mediante montaje monopolar, bipolar o mixto.
Protocolo
Todos los procedimientos animales descritos en este protocolo se realizaron de acuerdo con el Comité Institucional de Cuidado y Uso de Animales (IACUC) de Virginia Tech y de conformidad con la "Guía para el Cuidado y Uso de Animales de Laboratorio" de los Institutos Nacionales de Salud .
1. Protocolo de manipulación de animales
NOTA: Este protocolo está destinado a habituar los animales ordenados de un vendedor a la instalación después de la llegada y condicionarlos a ser manejados por el experimentador. Esto mejora el bienestar animal al reducir el estrés y la ansiedad y simplifica ciertos procedimientos que requieren el manejo de animales, incluyendo la inducción del TBI, la supervisión postoperatoria y la conexión del animal al sistema de adquisición.
- Cuando muchos animales son recibidos del vendedor, etiqueta de oído y asignarlos al azar a un grupo experimental (TBI) o grupo de control (cirugía falsa) mientras los combina en jaulas de 2 a 5 animales. Los animales de la casa TBI por separado de los animales falsos porque los ratones falsos ocasionalmente actúan agresivamente hacia los ratones que se sometieron a TBI.
- Manejo del día 1 (24-48 h después del etiquetado del oído): Prepare un gráfico para registrar las etiquetas del oído de los animales, la fecha de nacimiento, las fechas de manipulación, el peso del animal en los días de manipulación, la duración de la manipulación y una sección para comentarios y observaciones.
- Póntelo suavemente con ambas manos. No agarre al animal por la cola, ya que induce mecanismos de defensa y una respuesta de tensión.
- Compruebe y registre la etiqueta del animal.
- Coloque el animal en el recipiente en la báscula de pesas y registre el peso.
- Póntelo suavemente con ambas manos de nuevo y manéjalo durante 1 min, lo que le permite moverse y explorar dentro de las manos. Realice esto sobre un banco en la sala de procedimientos y tenga cuidado de no dejar caer al animal en el suelo.
- Después de 1 minuto de manipulación, coloque el animal de nuevo en su jaula.
- Repita los pasos 1.3-1.7 para los demás animales de la jaula.
- Manejo del día 2 (al día siguiente): Repita los pasos 1.2-1.5.
- Póntelo suavemente con ambas manos de nuevo y manéjalo durante 2 minutos, lo que le permite moverse y explorar dentro de las manos. Realice esto sobre un banco en la sala de procedimientos y tenga cuidado de no dejar caer al animal en el suelo.
- Después de 2 minutos de manejo, coloque el animal de nuevo en su jaula.
- Repita los pasos 1.10-1.11 para los demás animales de la jaula.
- Manejo del día 3 (al día siguiente): Repita los pasos 1.2-1.5.
- Póntelo suavemente con ambas manos de nuevo y manéjalo durante 4 minutos, lo que le permite moverse y explorar dentro de las manos. Realice esto sobre un banco en la sala de procedimientos y tenga cuidado de no dejar caer al animal en el suelo.
- Después de 4 minutos de manejo, coloque el animal de nuevo en su jaula.
- Repita los pasos 1.14-1.15 para los demás animales de la jaula.
- Manejo del día 4 (día de control, 1 semana desde el día de manipulación 1): Repita los pasos 1.2-1.5.
- Póntelo suavemente con ambas manos de nuevo y manéjalo durante 4 minutos, lo que le permite moverse y explorar dentro de las manos. Realice esto sobre un banco en la sala de procedimientos y tenga cuidado de no dejar caer al animal en el suelo.
- Después de 4 minutos de manejo, coloque el animal de nuevo en su jaula.
- Repita los pasos 1.18-1.19 para los otros animales de la jaula.
NOTA: El día de manejo del control prueba la retención del comportamiento tranquilo después de un protocolo de manejo de tres días.
2. Procedimiento de caída de peso
- Coloque el ratón en una cámara de inducción. Fije el flujo de oxígeno y vacío tanto a 1 L/min como al nivel de gas isoflurano en 3%-5%. Anestetizar el ratón durante 5 min.
- Retire el ratón de la cámara de inducción y colóquelo en una almohadilla de espuma. Pruebe la ausencia de una respuesta a un pellizco de dedo del dedo del dedo del dodel o de la cola.
- Administrar un analgésico (0,1 mg/kg de buprenorfina) por vía subcutánea. Si la cirugía de EEG se realiza ese mismo día, administre la buprenorfina por vía subcutánea en combinación con el carprofeno antiinflamatorio no esteroideo (5 mg/kg).
- Administrar la solución de lactato de sodio (3 ml por gramo del peso del animal) por vía subcutánea antes o después del último impacto. La solución de lactato de sodio se puede mezclar con los analgésicos para una administración rápida en una sola inyección.
NOTA: La solución de lactato de sodio contiene una mezcla de cloruro de sodio, cloruro de potasio, cloruro de calcio y lactato de sodio en agua. Este paso ayuda a reemplazar fluidos y electrolitos, ayudando a la recuperación. - Coloque la cabeza del ratón debajo del tubo de caída de peso(Figura 1A)y coloque un disco plano de acero inoxidable (1,3 cm de diámetro, 1 mm de espesor y 880 mg de peso) en el centro de la cabeza, entre la línea de los ojos y las orejas.
NOTA: Este disco difunde el impacto a través de la superficie del cráneo(Figura 1B). - Retire el pasador en el tubo de caída de peso para liberar la varilla de peso de 100 g de una altura de 50 cm. Para inducir la lesión falsa para los ratones de control, retire la varilla de peso del tubo para evitar la liberación accidental del pasador y la caída de peso.
NOTA: La cabeza del animal debe colocarse plana, de modo que la varilla caiga en toda la superficie del disco. - Coloque al animal inconsciente en su espalda para su recuperación en una almohadilla de calentamiento cubierta con una toalla absorbente poliforada estéril. El tiempo de recuperación del reflejo correcto (es decir, el tiempo que tarda el ratón en enderedarse desde su espalda) se puede medir como una lectura del tiempo que pasa inconsciente.
- Cuando el animal recupere la conciencia, colóquelo en una jaula limpia que haya sido calentada en una almohadilla de calentamiento, con gel de recuperación y algunas piezas de comida humedecida para recuperarse durante 45 minutos. Asegúrese de que haya suficiente basura para que la jaula no se sobrecaliente. Sobrecalentamiento del animal puede resultar un obstáculo tan grande para la recuperación como permitir que el ratón se enfríe demasiado.
- Después de 45 min, repita los pasos 2.1-2.8 dos veces, omitiendo el paso 2.3 (es decir, la administración de analgésicos y antiinflamatorios).
- Permita que los animales se recuperen durante 1 x 2 h si se realiza una cirugía de implantación de electrodos EEG el mismo día.
3. Preparación quirúrgica de campo para la implantación de electrodos EEG
NOTA: Autoclave las herramientas quirúrgicas y tornillos antes de la cirugía. Limpie los guantes quirúrgicos rociando y frotando con 70% de etanol antes y después de tocar al animal, materiales no estériles, y entre el manejo de los animales. Esterilice las herramientas quirúrgicas durante 2 x 3 minutos en el esterilizador de cuentas (ver Tabla de Materiales)entre animales. Cambie la cortina estéril antes de colocar un nuevo animal en el aparato estereotáctico. Asegúrese de que el campo quirúrgico contiene todos los componentes necesarios para la cirugía(Figura 2). La ausencia de un procedimiento quirúrgico invasivo para inducir el TBI en este modelo tiene varias ventajas: 1) la implantación de los electrodos es flexible y se puede realizar el mismo día que TBI o después de un período de tiempo definido; 2) el tiempo de recuperación del animal es más rápido; 3) el cráneo permanece intacto, lo que permite una mayor superficie y flexibilidad para implantar electrodos.
- Anestetizar el ratón en 3% - 5% de gas isoflurano en una cámara de inducción durante 5 min.
- Transfiera el ratón de la cámara de inducción al aparato estereotáctico y colóquelo en una cortina estéril en una almohadilla de calentamiento con gas isoflurano y tubos de vacío conectados al cono de la nariz.
- Mantener la temperatura corporal a 37 oC en el transcurso de la cirugía. Coloque el sensor de temperatura para que entre en contacto con el pecho o la pared abdominal del ratón.
- Fije la cabeza del animal en su lugar usando las barras de la oreja.
- Mantener la anestesia en 1.5%-3.5% isoflurano o en 60 respiraciones/min en el plano quirúrgico (sin respuesta al pellizco de la dedo del día o la cola).
- Aplique una pomada en los ojos del animal para mantenerlos lubricados durante toda la cirugía.
- Administrar una mezcla de analgésicos (0,1 mg/kg de buprenorfina) y el fármaco antiinflamatorio no esteroideo (5 mg/kg de carprofeno) en una sola inyección por vía subcutánea a menos que el TBI se haya realizado antes durante el día, en cuyo caso el animal ya recibió analgésicos y antiinflamatorios.
NOTA: La buprenorfina debe administrarse de nuevo si el tiempo entre la primera cirugía de colocación de TBI y EEG supera los 8 h o si el animal presenta signos de dolor 8 h después de la primera administración, pero debe administrarse sin la adición de carprofeno. - Administrar la solución de lactato sódico (3 ml por gramo del peso del animal) por vía subcutánea para reemplazar líquidos y electrolitos en el animal.
NOTA: Si la cirugía se realiza inmediatamente después del TBI, este paso tiene que ser cronometrado correctamente. La solución de lactato de sodio se debe administrar cada 2 h mientras el animal se somete a los procedimientos y una vez después de la cirugía, 2 h de la inyección previa. - Retire el cabello del cuero cabelludo con una crema para depilación.
- Antes de hacer la incisión, desinfectar la piel del cuero cabelludo con solución antiséptica quirúrgica de povidona-yodo y 70% de etanol en hisopos alternos con gasas estériles en un movimiento circular 3x (20 s por solución cada vez).
- Usando un bisturí, haz una incisión rostral-caudal en la línea media del cuero cabelludo desde justo por encima de los ojos hasta la parte posterior de la cabeza. Este método de apertura del cuero cabelludo se prefiere sobre cortar el cuero cabelludo, ya que las aletas de la piel se pueden sellar sobre o alrededor de la tapa EEG proporcionando más estabilidad.
NOTA: Al preparar el cráneo para la implantación de la culata 3-EEG, se requiere cortar el cuero cabelludo, ya que el tamaño del soporte para la cabeza no permitirá el cierre de las aletas de la piel sobre el soporte para la cabeza. - Expanda el área de incisión aplicando pequeños hemostats en los bordes abiertos de la piel. Si se produce algún sangrado después de la incisión, límpielo con una gasa o hisopo de algodón estéril.
- Retire suavemente el periosteo (es decir, la membrana delgada sobre el hueso craneal) con una cuchilla de bisturí. Si se produce algún sangrado durante este paso, presione en el sitio de sangrado con un hisopo de algodón estéril hasta que se detenga.
- Use hisopos de algodón estériles para limpiar el cráneo con peróxido de hidrógeno, pero evite tocar el tejido blando que rodea el área craneal expuesta. Repita este paso hasta que el cráneo se limpie de cualquier tejido blando y tenga un aspecto blanquecino.
- Seque el cráneo con una gasa estéril o un hisopo de algodón.
NOTA: Los pasos 3.12 a 3.15 son importantes para la fijación adecuada de los electrodos y el cemento dental. Cualquier tejido blando, sangrado no cauterizado y escombros pueden causar infección, fijación inestable de la suma de la cabeza, señal distorsionada o ausente, y pérdida del implante dentro de varios días o semanas después de la cirugía.
4. Colocación de electrodos
- Implante el único soporte para la cabeza del canal EEG (1EEG).
NOTA: Las abreviaturas en las coordenadas estereotácticas representan relaciones espaciales y especifican la distancia en milímetros del objetivo desde el bregma en una orientación dada en la cabeza del animal: anterior-posterior (AP) y medial-lateral (ML). Dorsal-ventral no es aplicable en este protocolo porque todos los electrodos se colocan en el espacio epidural en lugar de en una cierta estructura dentro del cerebro (Figura 3). Vin+ es un electrodo activo y Vin- es su electrodo de referencia.- Utilice un taladro de alta velocidad con una broca de acero (0,5 mm, redondo, 1/4 pulg.) a 5.000 a 6.000 cartuchos por minuto (rpm) para crear seis orificios de rebaba (tres para tornillos de estabilidad y tres para electrodos) utilizando las coordenadas estereotácticas proporcionadas12. Para los dos tornillos anteriores: AP + 1,5 mm, ML a 1,5 mm; para el tornillo posterior: AP -5,2 mm, ML -1,5 mm; para el electrodo de tierra: AP -5,2 mm, ML a +1,5 mm; para los electrodos de grabación: AP -2,3 mm, ML a 2,7 mm, con Vin+ a la derecha y Vin- a la izquierda.
- Añadir tres tornillos para una mayor estabilidad de la etapa de la cabeza. Con un destornillador, gire los tornillos de 1 x 1,5 x cada uno para que se fijen de forma estable en el cráneo.
NOTA: Colocar los tornillos más profundo dañará el cerebro. - Inserte el soporte de cabeza 1EEG en un brazo de soporte estereotáctico y coloque el soporte para la cabeza de modo que los tres electrodos se encuentren a lo largo de la línea media craneal. En esta configuración, el electrodo de tierra y su respectiva abertura en la parte superior del soporte de cabeza está en la parte posterior, el electrodo Vin+ en el centro y el electrodo Vin- en la parte delantera. Se puede hacer una marca en el soporte para la cabeza con un marcador permanente.
- Doble cada electrodo 90o de modo que el extremo de cada cable se incline hacia abajo y se coloque por encima del orificio de rebaba correspondiente. A continuación, mida la longitud de 1 mm de la parte del cable que ahora es perpendicular al orificio de rebaba y recorte el exceso(Figura 3). Esto asegurará la colocación epidural de los electrodos. Los electrodos apenas deben tocar la superficie de la dura mater.
- Baje el soporte para la cabeza y ajuste los tres electrodos para que coincidan con el orificio de rebaba respectivo. Para la grabación epidural, los electrodos deben colocarse por encima o apenas tocar la dura mater.
- Preparar cemento dental para su aplicación mezclando una cucharada de polvo con varias gotas de disolvente. Use una espátula de mezcla y revuelva hasta que la mezcla final sea similar a una, pegajosa pero maleable, y lo suficientemente rígida como para condensarse adecuadamente cuando se coloque sobre el cráneo del animal.
- Aplique la mezcla de cemento dental cubriendo todos los tornillos y electrodos y espere 3 x 5 minutos para que se solidifique. Asegúrese de no cubrir el pedestal de plástico con cemento dental, ya que hará imposible conectar al animal con el conmutador con una atada.
- Suelte los hemostats que sostienen las aletas de la piel y cierre la incisión conectando las aletas de la piel alrededor del pedestal de plástico. Aplique varias gotas de adhesivo tisular (ver Tabla de Materiales)para sellar las aletas de la piel.
- Aplique antiséptico de clorhexidina en el área alrededor del implante para evitar la infección. Si el animal está bajo anestesia durante más de 2 horas después de la inyección previa de solución de lactato sódico, administrada durante la inducción de TBI, administre otra inyección por vía subcutánea. Para mantener una hidratación adecuada del animal, repita la inyección cada 2 h que el animal pasa bajo anestesia.
- Después de la cirugía, administrar una inyección final de solución de lactato sódico 2 h después de la inyección anterior. Si la cirugía es inferior a 2 h de largo, administre la dosis final de recuperación de la solución de lactato de sodio 2 h de la primera inyección.
- Retire al animal del aparato estereotáctico y mida el peso del animal después de la cirugía de EEG como referencia para el monitoreo futuro. Debido al implante, el peso del animal será mayor que antes de la cirugía.
- Coloque el animal en una jaula limpia en una almohadilla de calentamiento caliente para su recuperación.
- Implante los dos canales EEG y uno EMG (2EEG/1EMG) para el montaje en cabeza.
- Utilice el bregma como punto de referencia para la colocación del soporte para la cabeza. Aplique una pequeña cantidad de adhesivo tisú (ver Tabla de materiales)en la parte inferior del soporte para cabeza 2EEG/1EMG, evitando los cuatro orificios de tornillo y coloque el soporte para cabeza 2EEG/1EMG en la superficie del cráneo.
NOTA: No hay coordenadas específicas para la colocación de este soporte para la cabeza. El soporte para cabeza es de 8 mm de largo y 5 mm de ancho, que cubre la mayor parte de la superficie craneal. La colocación del soporte de la cabeza con su borde frontal de 3,0 mm antes del bregma es óptima y proporciona una buena calidad de la señal. La colocación manual rápida es necesaria antes de que se cure la gota de adhesivo tisular. Deje esperar aproximadamente 5 minutos para que el pegamento tisular se cure por completo. - Utilice una aguja estéril de 23 G para crear orificios piloto para los tornillos a través de las cuatro aberturas en el soporte para la cabeza. Para lograr esto, empuje suavemente la aguja y gire lentamente hasta que la punta de la aguja penetre en el cráneo sin dañar el cerebro. Retire cualquier sangrado de los orificios piloto con un hisopo de algodón estéril.
- Inserte el 0,10 en los tornillos de los orificios piloto y gírelos hasta que cada uno esté fijado en el cráneo. Esto puede ser hasta la mitad de la longitud del tornillo, pero no la longitud completa, ya que esto dañaría la dura mater y la corteza. Si el soporte de cabeza está colocado de modo que haya un espacio entre la superficie del cráneo y el extremo posterior del soporte para la cabeza, utilice dos tornillos 0,12 en la parte posterior.
- Haga una pequeña abertura en los lados de la bolsa de doble paquete epoxi de dos componentes (plata-epoxi). Toma una espátula de doble cara y usa cada lado para sacar una cantidad pequeña e igual de cada componente de la bolsa y mezclarlos. Utilice sólo una pequeña cantidad suficiente para una sola cirugía, ya que la mezcla se solidifica dentro de 20 min. Selle los lados de la bolsa para evitar el secado.
NOTA: El epoxi plateado permite un contacto eléctrico adecuado entre el tornillo y el soporte para la cabeza y mejora la estabilidad de los tornillos. - Aplique una pequeña cantidad de esta mezcla entre el cabezal de tornillo y el orificio del tornillo, luego apriete cada tornillo hasta que su cabeza se apoye en la base del implante. Asegúrese de que no haya plata-epoxi haciendo contacto entre los dos tornillos porque cada tornillo sirve como un electrodo individual y, para asegurar una señal precisa, no debe hacer contacto con el otro tornillo.
- Si la mezcla de plata y epoxi se extravío, hay una ventana de tiempo de un segundo para sacar cuidadosamente el exceso para separar la conexión. Dobla cuidadosamente ambos cables EMG desde el borde posterior del soporte para la cabeza para seguir el contorno de la cabeza y el cuello del animal, y luego insertarlos en los músculos nucales.
- Preparar cemento dental para su aplicación mezclando una cucharada de polvo con varias gotas de disolvente. Use una espátula de mezcla y revuelva hasta que la mezcla final sea similar a una, pegajosa pero maleable, y lo suficientemente rígida como para condensarse adecuadamente cuando se coloque sobre el cráneo del animal.
- Aplique la mezcla de cemento dental que cubra todo el soporte para la cabeza evitando cubrir los seis orificios de los pines, ya que esto hará imposible conectar el preamplificador. Espere 3 x 5 minutos para que el cemento se solidifique. Asegúrese de que la piel no esté sellada al soporte para la cabeza con cemento dental.
- Suelte los hemostats que sostienen las aletas de la piel y cierre la incisión conectando las aletas de la piel alrededor del pedestal de plástico. Aplique varias gotas de adhesivo tisular para sellar las aletas de la piel.
NOTA: Si la incisión cutánea se hizo más tiempo para permitir el enderezamiento de los cables EMG, la piel se puede sellar con adhesivo tisular o suturar. Por lo general, es suficiente sellar la piel con adhesivo tisular. Sin embargo, si durante la supervisión postoperatoria se observa la apertura de la incisión, se recomiendan suturas en su lugar. - Aplique antiséptico de clorhexidina en el área alrededor del implante para evitar la infección. Administrar la solución de lactato sódico (3 ml por gramo del peso del animal) por vía subcutánea para reemplazar líquidos y electrolitos si el animal está bajo anestesia durante más de 2 horas después de la inyección anterior.
- Retire al animal del aparato estereotáctico y mida el peso del animal después de la cirugía de EEG como referencia para el monitoreo futuro. Debido al implante, el peso del animal será mayor que antes de la cirugía.
- Coloque el animal en una jaula limpia sobre una almohadilla de calentamiento caliente, con gel de recuperación y algunas piezas de comida humedecida para su recuperación.
- Utilice el bregma como punto de referencia para la colocación del soporte para la cabeza. Aplique una pequeña cantidad de adhesivo tisú (ver Tabla de materiales)en la parte inferior del soporte para cabeza 2EEG/1EMG, evitando los cuatro orificios de tornillo y coloque el soporte para cabeza 2EEG/1EMG en la superficie del cráneo.
- Implante un soporte para la cabeza de tres canales EEG (3EEG).
- Utilice taladro de alta velocidad con una broca de acero (0,5 mm, redondo, 1/4) a 5.000 a 6.000 rpm para crear seis orificios de rebaba (tres para tornillos de estabilidad y tres para electrodos) utilizando las coordenadas estereotácticas proporcionadas12. Para la referencia en tierra y común para EEG1 y EEG2: AP a 5,2 mm, ML a 1,5 mm; para EEG1 y EEG2: AP -3,0 mm, ML a 3,0 mm; para EEG3 independiente: AP -1,4 mm, ML a 1,5 mm.
- Coloque los seis electrodos de tornillo en los orificios de la rebaba.
NOTA: Colocar los tornillos más profundos creará un daño significativo al cerebro. Los electrodos de tornillo proporcionan una mejor estabilidad del soporte para la cabeza. - Preparar cemento dental para su aplicación mezclando una cucharada de polvo con varias gotas de disolvente. Use una espátula de mezcla y revuelva hasta que la mezcla final sea similar a una, pegajosa pero maleable, y lo suficientemente rígida como para condensarse adecuadamente cuando se coloque sobre el cráneo del animal.
- Aplique la mezcla de cemento dental que cubra toda la superficie expuesta del cráneo y cada electrodo de tornillo. Asegúrese de que la piel no esté sellada al soporte para la cabeza con cemento dental. Espere 1 x 2 minutos para que el cemento se solidifique ligeramente. No hay necesidad de esperar hasta la plena solidificación antes de continuar con el siguiente paso.
- Encienda el soldador para calentarlo. Coloque el soporte de cabeza 3EEG en un brazo de soporte estereotáctico.
NOTA: Coloque el soporte para la cabeza de modo que las seis posiciones del cable de alambre coincidan con la posición de los cables de cada electrodo de tornillo. - Baje el soporte para la cabeza para que su parte ventral se apoye en la parte superior del cemento dental.
- Gire el cable de cada cable de cada uno de los electrodos de tornillo con el cable de alambre correspondiente del soporte para cabeza.
NOTA: La torsión de los cables incorrectos hará que la interpretación de datos sea complicada o imposible. - Recorte cuidadosamente el exceso de alambre con tijeras. Soldar cada par de cable retorcido para una conducción de señal adecuada.
NOTA: Cada par de cables debe hacer contacto con otro par, de lo contrario la calidad de la señal y la interpretación de los datos se verán comprometidas. - Doblar cada par de cables soldados alrededor del soporte para la cabeza, evitando el contacto entre cada par.
NOTA: Si los cables no se recortan lo suficientemente corto puede ser difícil doblarlos alrededor del soporte de cabeza sin tocar otro cable. En este caso, doblar un par primero, cubrirlo con la mezcla de cemento dental, esperar 1 s 2 minutos para solidificar, a continuación, proceder con el siguiente par de la misma manera. - Termine de cubrir todo el alambre con cemento dental dejando sólo la parte negra de la montura de la cabeza expuesta.
NOTA: Tenga cuidado de no aplicar ningún polvo o mezcla de cemento dental en la parte superior de la parte expuesta del soporte para la cabeza, ya que cualquier residuo o cemento en los agujeros bloqueará el contacto y conducirá a la ausencia de señal o al ruido. - Suelte los hemostats sosteniendo las aletas de la piel. Aplique antiséptico de clorhexidina en el área alrededor del implante para evitar la infección.
- Administrar la solución de lactato sódico (3 ml por gramo del peso del animal) por vía subcutánea para reemplazar líquidos y electrolitos si el animal ha estado bajo anestesia durante más de 2 horas después de la inyección anterior.
- Retire al animal del aparato estereotáctico y mida el peso del animal después de la cirugía de EEG como referencia para el monitoreo futuro. Debido al implante, el peso del animal será mayor que antes de la cirugía.
- Coloque el animal en una jaula limpia sobre una almohadilla de calentamiento caliente, con gel de recuperación y algunas piezas de comida humedecida para su recuperación.
NOTA: El peróxido de hidrógeno ayuda a eliminar el tejido blando restante del cráneo.
5. Conectar animales al sistema de adquisición
- Covasos al animal con ambas manos para retirarlo de la jaula de adquisición y transferirlo a un área limpia con una superficie plana, como una Estación de Transferencia de Animales (ATS).
- Agarre suavemente el ratón por la piel de su espalda. No agarre sin el animal por la cola, ya que esto causa angustia.
- Identifique la abertura en el soporte de cabeza EEG correspondiente al electrodo de tierra y haga coincidir el pasador respectivo de la amarre para una conexión adecuada.
NOTA: La conexión inversa de la atada desde el conmutador con el reposacabezas del animal dará como resultado una lectura diferente de los electrodos y las formas de onda potencialmente distorsionadas. - Devuelva el animal a la jaula de adquisición y conecte el otro extremo de la amarre (Sistema EEG 1) o preamplificador (Sistema EEG 2) al conmutador.
NOTA: Cuando conecte el preamplificador (EEG System 2) a la amarre del conmutador, haga coincidir las marcas blancas en los extremos de ambas ataduras. La conexión inversa resultará en daños permanentes del amplificador y requiere reparaciones por parte del fabricante, que son costosas. - Gire suavemente la atela que conecta el animal al conmutador para asegurarse de que el mecanismo funciona correctamente y el animal puede moverse libremente.
6. Ajustes de adquisición de datos EEG
- Establezca los parámetros de adquisición de EEG System 1.
- Ajuste la frecuencia de muestreo a 500 Hz; 5.000 dólares; modo Norma 35 Hz; LPN apagado. Ajuste el filtro de paso alto a 0,5 Hz.
NOTA: 100 Hz (paso bajo) está incorporado y no requiere entrada manual.
- Ajuste la frecuencia de muestreo a 500 Hz; 5.000 dólares; modo Norma 35 Hz; LPN apagado. Ajuste el filtro de paso alto a 0,5 Hz.
- Establezca los parámetros de adquisición de EEG System 2.
- Ajuste la frecuencia de muestreo a 600 Hz; ganancia de preamplificador 100; ganancia 1 (EEG1,2). Ajuste el filtro de paso bajo a 100 Hz.
NOTA: 1 Hz (paso alto) está incorporado y no requiere entrada manual.
- Ajuste la frecuencia de muestreo a 600 Hz; ganancia de preamplificador 100; ganancia 1 (EEG1,2). Ajuste el filtro de paso bajo a 100 Hz.
7. Configuración de adquisición de datos de vídeo
- Establezca los parámetros de adquisición para eEG System 1.
NOTA: Se necesita un sistema de adquisición de vídeo de terceros para obtener datos de vídeo simultáneos.- Establezca la velocidad de fotogramas entre 15 (mínimo recomendado) y 30 (máximo disponible) para obtener una calidad de vídeo adecuada. Establezca la resolución en 640 x 640 píxeles. Establezca el tipo de compresión en H.264H.
- Establezca los parámetros de adquisición para EEG System 2.
NOTA: Este sistema EEG ofrece un sistema de vídeo y un software que sincronizan los datos de vídeo y EEG en un solo archivo para un máximo de cuatro animales (consulte La Tabla de materiales).- Establezca la velocidad de fotogramas entre 15 (mínimo recomendado) y 30 (máximo disponible) para obtener una calidad de vídeo adecuada. Establezca la resolución en 640 x 480 píxeles. Establezca el tipo de compresión en el formato de archivo WebM.
Resultados
El protocolo descrito aquí describe el método de inducción de una lesión difusa de forma aislada (por ejemplo, en ausencia de una lesión focal) utilizando un modelo de ratón de TBI difuso repetitivo(Figura 1). La Figura 1A representa el dispositivo de caída de peso y sus componentes(Figura 1A, a1-a5) utilizados para la inducción de TBI en este modelo y pasos cruciales durante el procedimiento(Figura 1B, b1-b5).
Las características de este modelo incluyen la falta de una lesión focal en el cerebro como resultado de la TBI, pérdida de conciencia, una alta tasa de supervivencia, la aparición de la aparición tardía de convulsiones (>1 semana del TBI), y convulsiones espontáneas, no provocadas, recurrentes en un subconjunto de Ratones TBI después de un período de latencia de al menos tres semanas después de TBI.
Este protocolo muestra procedimientos detallados para configurar un campo quirúrgico limpio(Figura 2), proporciona un enfoque paso a paso para implantar diferentes matrices de electrodos(Figura 3),e incluye una guía detallada sobre el uso de dos sistemas de adquisición EEG diferentes (ver la Tabla de Materiales)para detectar convulsiones(Figura 4 y Figura 5)en este modelo. La potencia espectral de una convulsión típica indica la densidad más alta en el rango de frecuencia de 10 a 40 Hz con un pico a 15 Hz(Figura 4). La mayoría de las convulsiones en ratones son convulsivas, con una duración media de 12 a 15 s. Sólo una pequeña fracción de las convulsiones no es convulsiva. En la sección Discusión se detalla una comparación exhaustiva de las ventajas y desventajas del uso de cualquiera de los sistemas. Además, este protocolo demuestra los plazos de aparición de incautaciones en animales después de la caída repetitiva de peso TBI, mostrando la agrupación en algunos animales(Figura 6) que hace hincapié en la importancia de adquirir grabaciones continuas en lugar de intermitentes, ya que esto garantizará una estratificación precisa de los animales que desarrollan convulsiones espontáneas después de TBI de aquellos que no lo hacen. Es importante destacar que este protocolo también analiza las ventajas y desventajas de los modelos de roedores de PTE y su capacidad para representar a una población específica de seres humanos después de TBI.

Figura 1: El modelo de ratón de TBI difuso repetitivo. (A) Dispositivo de caída de peso. (a1) Tubo de caída de peso. (a2) Una barra de 100 g de peso. (a3) Pin sosteniendo la varilla. (a4) Cuerda para elevar la varilla hacia arriba si cambia la altura o retira la varilla del tubo de caída de peso. (a5). Almohadilla de espuma para colocar al animal debajo del tubo de caída de peso. (B) Procedimiento de caída de peso. (b1) El disco de acero inoxidable se coloca en el centro de la cabeza entre la línea de los ojos y las orejas. (b2 y b3) Después de la confirmación visual de que la cabeza del animal está en la posición plana y la almohadilla de espuma se mueve, colocando la cabeza del animal debajo del tubo de caída de peso. (b4) Suelte el pasador sosteniendo la varilla de peso, golpeando el centro del disco de acero inoxidable. (b5) El ratón se coloca en una toalla estéril inmediatamente después de que el impacto y la pérdida de conciencia se evalúa midiendo el tiempo que tarda el animal en recuperarse y se enderece. Haga clic aquí para ver una versión más grande de esta figura.
Figura 2: Preparación quirúrgica de campo y esquema de colocación de electrodos EEG. Las herramientas autoclavedas y los materiales necesarios para la cirugía y la implantación de electrodos se preparan antes de anestesiar al animal para garantizar la disponibilidad de todas las piezas requeridas. Esta es una zona estéril y es imperativo no contaminar esta zona con materiales no estériles. Haga clic aquí para ver una versión más grande de esta figura.
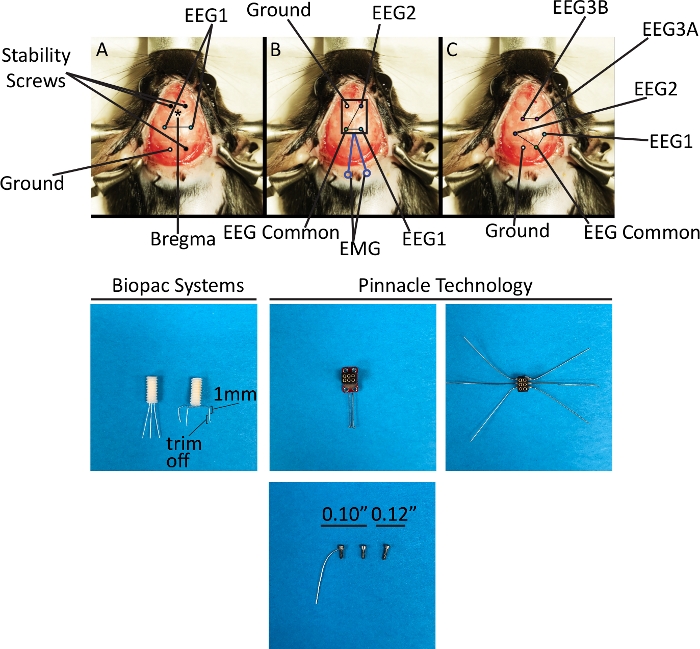
Figura 3: Puntos de referencia estereotácticos y representación esquemática de la colocación de electrodos utilizando eEG System 1 y 2. El panel superior representa los métodos de implantación de los tres soportes para cabeza diferentes descritos en este protocolo. (A) Canal EEG único, montaje bipolar. (B) Dos canales EEG con referencia común, montaje bipolar y un canal EMG. (C) Tres canales EEG, utilizando monopolar (canal 1-2) y montaje bipolar (canal 3). El panel inferior representa los soportes para la cabeza y los tornillos implantados como en el panel superior. Los tres tipos de tornillos utilizados en este protocolo para dos propósitos: como tornillos de estabilidad (Sistema EEG 1) o ambos de estabilidad y como electrodo (Sistema EEG 2). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Convulsiones espontáneas adquiridas con el Sistema EEG 1. El panel superior representa una convulsión espontánea en un ratón 23 días después de la caída de peso repetida TBI utilizando datos adquiridos con el montaje en cabeza 1EEG. (A) Actividad pre-ictal (preconvulsiva). (B) Actividad ictal (convulsiones). (C) Depresión post-ictal (postconvulsión). Panel inferior: La densidad del espectro de potencia se calcula utilizando un script y un software personalizados (consulte Tabla de materiales). Potencia media: potencia media del espectro de potencia dentro de la época (unidades: V2/Hz). Frecuencia mediana: frecuencia a la que se alcanza el 50% de la potencia total dentro de la época (unidades: Hz). Frecuencia media: frecuencia a la que se alcanza la potencia media dentro de la época (unidades: Hz). Borde espectral: frecuencia por debajo de la cual se alcanza un porcentaje especificado por el usuario de la potencia total dentro de la época (unidades: Hz). Frecuencia máxima: frecuencia a la que se produce la potencia máxima durante la época. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Convulsiones espontáneas adquiridas con el Sistema EEG 2. (A) Convulsiones espontáneas no convulsivas (electrográficas) en un ratón 65 días después de la caída de peso repetida TBI. Datos adquiridos con montaje en cabeza 2EEG/1EMG. (B) Convulsión espontánea en un ratón 97 días después de la caída de peso TBI. Datos adquiridos con montaje en cabeza 3EEG. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Cronología de la incidencia de convulsiones en ratones después de la caída de peso repetida TBI. La primera convulsión se observó tres semanas después de la lesión. Algunos animales desarrollan grupos de convulsiones en el mismo día seguidos de varias semanas sin convulsiones. Los animales fueron registrados hasta cuatro meses después de TBI. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
A diferencia de los modelos CCI y FPI que inducen lesiones focales o difusas, el modelo de TBI difuso repetitivo descrito en este protocolo permite la inducción de lesiones difusas en ausencia de lesión cerebral focal y no requiere aberturas del cuero cabelludo o craneal y la inflamación asociada. Un beneficio adicional de la ausencia de craneectomía en este modelo es que permite no sólo implantar los electrodos para la grabación crónica continua del EEG, sino también la creación de una ventana craneal adelgazada del cráneo para la imagen crónica in vivo 2-fotones de los animales antes, inmediatamente después, y repetidamente durante días, semanas, e incluso meses después de TBI como se describe en Shandra y Robel 201913.
Independientemente del modelo animal elegido, el enfoque de adquisición de datos adoptado es un elemento crucial de cualquier estudio exitoso y completo. En los modelos de roedores de epilepsia postraumática, la frecuencia de las convulsiones es bajade 14,que oscila entre 0,3 x 0,4 convulsiones por día9,15,y el período latente antes de la primera convulsión puede durar desde días o semanas hasta incluso meses después del procedimiento inicial de TBI. Por último, a diferencia de los modelos no traumáticos, que tienen una incidencia generalmente mayor de convulsiones durante un período de tiempo más corto, en promedio sólo el 9% y el 50% de los animales con TBI tendrán convulsiones espontáneas durante un período de hasta seis meses8,16. Esto sugiere que los estudios significativos requieren una grabación continua de video-EEG a largo plazo.
El objetivo general de cada modelo animal de TBI es reproducir lo más estrechamente posible las diferentes formas de TBI que se encuentran en pacientes humanos, con el fin de investigar mejor los mecanismos celulares y moleculares subyacentes a la ETE. Las técnicas de este protocolo ayudarán a facilitar el descubrimiento de dianas terapéuticas, el ensayo de la eficacia y tolerabilidad de los nuevos candidatos preventivos y terapéuticos, y el desarrollo de biomarcadores fiables o predictores de epilepsia TBI.
Posibles desafíos durante el procedimiento de caída de peso
Debido a que la cabeza no está fijada en un marco estereotáctico, se debe tener especial cuidado para asegurar una posición plana de la cabeza y la placa de metal. Si la varilla ponderada golpea la placa o la cabeza de metal en un ángulo o si el peso se desliza hacia el lado de la cabeza del ratón, la biomecánica de lesiones diferirá, lo que posiblemente resultará en una lesión más leve o ninguna. En el pasado, la placa de metal estaba pegada al cráneo para minimizar la variabilidad. Sin embargo, la eliminación de la placa de metal y pegamento del cráneo del ratón después de la caída de peso, incluso si se realiza con cuidado, indujo daño a las meninges, lo que resulta en daño vascular y daño posterior al tejido cerebral incluso en animales falsos. Además, la incisión requiere curación, potencialmente implicando una respuesta inmune periférica, que podría introducir variabilidad. Por estas razones fue elegido para omitir pegar la placa de metal al cráneo. Los animales pueden morir con lesiones repetidas (es decir, 3 veces en este protocolo). Los ratones con un peso corporal inferior a 25 g pueden no tolerar impactos repetidos. Mientras que las lesiones individuales casi nunca resultan en mortalidad, hasta el 7% de los animales C57BL/6 mueren después de impactos repetidos9. Se pueden observar déficits motores en algunos animales. Estos déficits se manifiestan como paresia de las extremidades posteriores o anomalías de la marcha. Esto es generalmente un factor de pronóstico para la recuperación deficiente y se recomienda que el animal sea sacrificado. Los signos de dolor o angustia incluyen pérdida de peso, mal acicalamiento, deshidratación, aumento de la ansiedad, actividad exploratoria baja o ausente (hidrogel/recuperación, comida y/o nido permanecen intactos). La analgesia de rescate (0,1 mg/kg de buprenorfina) se puede administrar por vía subcutánea cada 8 h durante tres días desde TBI para aliviar el dolor y evitar que el animal llegue a la variable humana. La solución subcutánea de lactato sódico (3 ml por gramo del peso del animal) se puede administrar dos veces al día para la hidratación. Los animales suelen recuperarse dentro de los tres días después de TBI. Se recomienda el uso de una puntuación de condición corporal de cinco etapas (BCS) para el monitoreo de animales después de procedimientos experimentales. Las etapas incluyen (1) Emaciated (estructuras esqueléticas son extremadamente prominentes, vértebras extremadamente segmentadas); (2) Infraacondicionado (la segmentación de la columna vertebral es evidente, los huesos pélvicos dorsales son fácilmente palpables); (3) Bien acondicionado (las vértebras y la pelvis dorsal no son prominentes palpables con una ligera presión); (4) Sobre-acondicionado (la columna vertebral es una columna continua, las vértebras palpable sólo con presión firme); (5) Obeso (el ratón es liso y voluminoso, la estructura ósea desaparece bajo la carne y la grasa subcutánea). El punto final humano se alcanza cuando bcS es 1-2, 20% o más pérdida de peso en un ratón adulto en comparación con su peso pre-TBI, los síntomas de dolor o angustia no se alivian por analgésicos, signos de automutilación, síntomas de deshidratación, hipotermia, presencia de déficits neurológicos (marcha anormal o paresia motora). Deben tenerse en cuenta varios resultados posibles de la administración de sustancias. La buprenorfina inyectada por vía subcutánea alcanza por vía subcutánea el primer pico de su efecto analgésico a los 10 minutos después de la inyección17. El primer impacto se produce segundos después de administrar buprenorfina, lo que sugiere que es poco probable que la primera medición del tiempo de righting se vea afectada. Sin embargo, esto no se puede excluir completamente como una variable. Por lo tanto, se aconseja a los experimentadores que ejerzan su propio juicio. Si el procedimiento de caída de peso es seguido por cirugía estereotáctica y se administra carprofeno es importante tener en cuenta que el carprofeno es un agente antiinflamatorio que puede afectar la incidencia de convulsiones, por lo tanto se recomienda a los experimentadores considerar su uso cuidadosamente.
Posibles desafíos durante la cirugía
El riesgo de contaminación o infección se reducirá con el uso de 70% de etanol, pero no resultará en condiciones estériles. Alternativamente, se pueden usar guantes quirúrgicos estériles. Sin embargo, el aparato estereotáctico no es en sí mismo estéril, por lo que cualquier manipulación manual resultará en la pérdida de la condición estéril de los guantes. Por lo tanto, se requiere pulverización con 70% de etanol después del contacto con cualquier material no estéril durante la cirugía. Perforar a través del cráneo en el cerebro crea daño al tejido cerebral y puede causar sangrado profuso. La creación de los agujeros de rebaba tiene mucho cuidado. Fijar el taladro manual en el brazo estereotáctico y bajarlo gradualmente se prefiere sobre la perforación de los agujeros mientras sostiene el taladro manualmente. Los electrodos y tornillos de fijación pueden hundirse más profundo de lo previsto, lesionando la dura mater (colocación subdural) o la corteza (colocación cortical). Esto puede causar sangrado profuso y una lesión focal. El experimentador debe evitar el sobrecalentamiento del animal durante la cirugía. Si el sensor de temperatura no se fija correctamente, no mantendrá la temperatura requerida de 37 oC, causando sobrecalentamiento, quemaduras y, a veces, la muerte del animal como resultado. Los ojos del animal se secan, irritan o se dañan durante la cirugía si no se lubrican tan pronto como el animal se coloca en el aparato estereotáctico.
Monitoreo postoperatorio
El monitoreo postoperatorio comienza inmediatamente después de que el procedimiento o cirugía concluye. Observa al animal hasta que se despierte de la anestesia y busca la presencia o ausencia de cualquier complicación relacionada con la cirugía, incluyendo sangrado o paresia. Si se observa sangrado por el cierre incompleto de la incisión, anestesia rinde al animal, limpia el lugar de sangrado con clorhexidina, realiza el cierre de la herida como se ha descrito anteriormente y devuelve al animal a la jaula de recuperación. Aproximadamente 1 x 2 h después de la cirugía, el animal debe estar completamente despierto de la anestesia, moviéndose libremente en la jaula sin signos de paresia o dolor. El animal comenzará a acicalarse, por lo que es necesario sellar la incisión para evitar que el animal lo abra durante el aseo. Una vez que el animal se haya recuperado, transfiéralo a la jaula/cámara que se utilizará para la adquisición de datos EEG. Esto permitirá que el animal se habitue al nuevo entorno. Esto es especialmente importante para la grabación a largo plazo (meses). La jaula de animales debe tener un gel de recuperación (ver Tabla de Materiales),comida humedecida, un nido y una botella de agua. Esto permitirá una recuperación adecuada y le dará al animal acceso a nutrientes y agua. Continúe monitoreando al animal diariamente. La evaluación debe incluir (a) Inspección visual del comportamiento del animal en busca de signos de dolor o angustia, incluyendo pérdida de peso, acicalamiento deficiente, aumento de la ansiedad, actividad exploratoria baja o ausente (hidrogel/recuperación, comida y/o nestlet permanecer intacto) y la curación adecuada del área de incisión alrededor del implante EEG; (b) Evaluación del BCS en busca de signos de deshidratación y desnutrición; (c) Peso del animal. Administrar la solución de lactato sódico (3 ml por gramo del peso del animal) por vía subcutánea si el animal muestra signos de deshidratación (ver Tabla de Materiales). Administrar buprenorfina (0,1 mg/kg) por vía subcutánea si el animal muestra signos de dolor o angustia. Si los signos de dolor persisten buprenorfina se pueden administrar cada 8 h. La monitorización debe aumentarse a dos veces al día si un animal está mostrando signos de dolor y/o angustia. Permita que el animal se recupere durante al menos tres días después de la cirugía de EEG antes de conectarse al sistema de adquisición a través de una atea. Los criterios de punto final humano son los mismos que en los desafíos potenciales durante el procedimiento de caída de peso anterior.
Ventajas y desventajas de los sistemas de adquisición y las monturas de cabeza
La principal ventaja del Sistema EEG 1 con un solo soporte de canal EEG es el costo relativamente bajo del hardware, los componentes y el servicio. La configuración simple y directa también permite a los usuarios personalizar el sistema a sus preferencias. Cada amplificador diferencial proporciona un solo canal EEG, aunque se pueden conectar varios amplificadores diferenciales entre sí, aumentando el número de canales para cada animal. En este sistema, se utilizó una configuración de un solo canal por animal para adquirir grabaciones crónicas de EEG a largo plazo de 20 animales simultáneamente. Las convulsiones postraumáticas suelen generalizarse, y con un montaje bipolar bilateral de los electrodos es fácil detectar este tipo de actividad epileptiforme. La desventaja de este enfoque, sin embargo, es que es imposible detectar de forma fiable la focalidad, la lateralización o la propagación de la actividad epileptiforme, ya que esto requeriría varios canales. Otro desafío potencial puede ser la contaminación acústica del canal único a lo largo del tiempo, lo que lo hace incapaz de adquirir datos útiles del animal. Esto se puede superar combinando dos o más amplificadores diferenciales, lo que duplica el número de canales por animal. Por último, los datos adquiridos de un solo canal son más difíciles de distinguir de los artefactos potenciales, y la actividad epileptiforme está mejor respaldada por grabaciones de vídeo del comportamiento del animal. Por esta razón, todas las grabaciones combinaron la monitorización continua de vídeo sincronizada con la adquisición de EEG. Una limitación de este sistema y su software es que no incluye el sistema de adquisición de vídeo, y por lo tanto requiere un sistema de terceros personalizado para la adquisición de vídeo síncrono.
La principal ventaja del Sistema EEG 2 con soportes de cabeza multicanal es la alta calidad de la señal debido a su prefiltrado de la señal adquirida por el preamplificador (ver Tabla de Materiales)antes de pasar a través del conmutador al amplificador. Los amplificadores de este sistema permiten la adquisición de datos en tres canales en las siguientes configuraciones: 2 canales EEG+1 EMG o tres canales EEG (ver Tabla de Materiales). Esto permite la detección no sólo de la actividad generalizada, sino también, potencialmente, la actividad epileptiforme focal. Otra ventaja importante es que este sistema fue diseñado específicamente para la investigación animal y por lo tanto ofrece un sistema de grabación de vídeo y software capaz de sincronizar el EEG y los canales de vídeo para hasta cuatro animales en un solo archivo, lo que hace que el análisis sea más fácil y conveniente que el sistema EEG 1. Este sistema es fácil de usar para la adquisición de datos para el análisis de convulsiones y sueño sin ninguna modificación en el sistema que no sea el tipo de soporte para la cabeza utilizado. El reposacabezas 2EEG/1EMG permite implantar los electrodos solo en ubicaciones fijas, debido al tamaño y la configuración de la placa de circuito. Los electrodos de tornillo con cables en soportes para cabeza 3EEG permiten flexibilidad en la implantación en el lugar deseado con la posibilidad de realizar adquisición monopolar o bipolar dependiendo de dónde se coloque el electrodo de referencia. Sin embargo, la implantación del soporte para la cabeza 3EEG requiere soldadura, lo que añade más pasos a la cirugía y requiere más precaución y precisión. Las atañeres y preamplificadores de conexión fueron diseñados específicamente para pequeños roedores como ratones y ratas inmaduras, y son cables delgados y de bajo peso que causan poca presión en la cabeza del animal. Una desventaja del sistema es el costo relativamente alto del hardware, software, licencia de vídeo y componentes (es decir, preamplificadores y soportes para cabeza).
Importancia y pasos críticos en la adquisición de datos EEG
El conmutador tiene un mecanismo giratorio, lo que permite que la atraque gire dependiendo de la dirección del movimiento animal. Si este mecanismo falla, el movimiento del animal será restringido, lo que puede resultar en la eliminación de la tapa del EEG. Se puede intentar una cirugía repetida para colocar nuevos electrodos. Sin embargo, esto puede ser difícil o imposible si la extracción de la tapa eEG anterior causó daño en el cráneo y el cerebro. La frecuencia de muestreo para la adquisición de datos EEG debe ser de al menos 2 a 2,5 x la frecuencia de interés más alta. Las tasas de muestreo más altas dan como resultado una mayor resolución de los datos al precio de un aumento en el tamaño del archivo, que puede llegar a ser difícil de almacenar y procesar cuando se adquieren grabaciones continuas de múltiples animales. Por lo tanto, es necesario optimizar la frecuencia de muestreo a un nivel que permita obtener los datos necesarios sin pérdida de calidad al tiempo que se minimizan los tamaños de archivo.
Importancia y pasos críticos en la adquisición de datos de vídeo
En roedores, como en humanos, PTE puede manifestarse con una amplia variabilidad en la sintomatología asociada y correlatos electrográficos, por lo que es necesario obtener un vídeo simultáneo durante la adquisición del EEG con el fin de interpretar y clasificar adecuadamente los eventos eEG observados. La interpretación de los datos EEG en ausencia de vídeo sincronizado es particularmente difícil cuando se utiliza un único canal EEG. En este caso, puede ser difícil determinar si la forma de onda EEG es un artefacto, a menos que otras pruebas (vídeo) apoyen la clasificación como una convulsión. Los artefactos de movimiento pueden parecer similares al patrón electrográfico de la convulsión. Por lo tanto, el vídeo con o sin confirmación de EMG es un requisito. Mientras que la grabación de vídeo se realiza durante los ciclos de luz y oscuridad, la calidad del vídeo puede no ser siempre satisfactoria y clara durante las horas oscuras. Además, si el animal es alejado de la cámara durante el evento de EEG similar al ictal, puede ser difícil evaluar su comportamiento. En esos casos, adquirir una señal de electromiografía (EMG) además de EEG y video puede resolver el desafío proporcionando información sobre la actividad muscular durante las convulsiones conductuales más leves (con componentes motores bajos) o para confirmar la falta de movimiento animal durante las descargas de pico y onda lenta similares a la ausencia en el EEG. Los desafíos potenciales con el canal EMG son similares a los desafíos con los canales EEG, como la contaminación por ruido, la colocación incorrecta de electrodos o la pérdida de contacto con la superficie de los electrodos durante el tiempo prolongado de la grabación. El uso de vídeo junto con el análisis de EEG tiene dos propósitos: confirmar que un evento de EEG no es un artefacto causado por el movimiento del animal (comportamiento exploratorio, beber, masticar, rascarse, estirar, acicalar o respirar rápida/trabajada) y diferenciar entre convulsiones convulsivas y no convulsivas. Se recomienda el uso de una escala Racine modificada para caracterizar las convulsiones convulsivas o no convulsivas. Las etapas incluyen (0) convulsiones electrográficas puras sin ninguna manifestación motora identificable; (1) Automatismos orofaciales y asintió con la cabeza; (2) tirón clónico de las extremidades delanteras; (3) Clonus bilateral de las extremidades anteriores; (4) Clonus y cría de las extremidades delanteras; (5) Clonus de las extremidades delanteras con la cría y caída. Cada canal de video debe mostrar claramente toda la superficie con el animal en la jaula, una etiqueta con un número de identificación animal, punta de botella de agua, alimentos y gel de dieta/recuperación. Para garantizar la adquisición de vídeo durante las horas oscuras, utilice una fuente nocturna infrarroja. (Algunas cámaras tienen dispositivos integrados o pueden requerir piezas adicionales. Consulte la Tabla de materiales). Ajuste la velocidad de fotogramas por segundo y la resolución de la imagen. La mayor velocidad de fotogramas y la resolución tienen el costo de un tamaño de archivo más grande. Las principales desventajas de adquirir vídeo durante experimentos continuos crónicos prolongados incluyen la necesidad de almacenar grandes cantidades de datos y las dificultades técnicas que implica el procesamiento de los archivos de gran tamaño. También se debe considerar la competencia del experimentador para interpretar eficazmente los datos de comportamiento junto con el EEG.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por R01 NS105807/NS/NINDS NIH HHS/Estados Unidos y CURE basado en una subvención CURE recibida del Comando de Investigación Médica y Materialdel del Ejército de los Estados Unidos, Departamento de Defensa (DoD), a través del Programa de Investigación de Salud Psicológica y Lesiones Cerebrales Traumáticas bajo el Premio No. W81XWH-15-2-0069. Ivan Zuidhoek es muy apreciado por la corrección del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.10" screw | Pinnacle Technology Inc., KS, USA | 8209 | 0.10 inch long stainless steel |
| 0.10" screw | Pinnacle Technology Inc., KS, USA | 8403 | 0.10 inch long with pre-soldered wire lead |
| 0.12" screw | Pinnacle Technology Inc., KS, USA | 8212 | 0.12 inch long stainless steel |
| 1EEG headmount | Invitro1 (subsidiary of Plastics One), VA, USA | MS333/8-A/SPC | 3 individually Teflon-insulated platinum iridium wire electrodes (twisted or untwisted, 0.005 inch diameter) extending below threaded plastic pedestal |
| 2EEG/1EMG headmount | Pinnacle Technology Inc., KS, USA | 8201 | 2EEG/1EMG channels |
| 3% hydrogen peroxide | Pharmacy | ||
| 3EEG headmount | Pinnacle Technology Inc., KS, USA | 8235-SM-C | custom 6-Pin Connector for 3EEG channels |
| Buprenorphine | Par Pharmaceuticals, Cos. Inc., Spring Valley, NY, USA | 060969 | |
| Buprenorphine | Par Pharmaceuticals, Cos. Inc., Spring Valley, NY, USA | 060969 | |
| C57BL/6 mice | Harlan/Envigo Laboratories Inc | male, 12-16 weeks old | |
| C57BL/6 mice | The Jackson Laboratory | male, 12-16 weeks old | |
| Carprofen | Zoetis Services LLC, Parsippany, NJ, USA | 026357 | NOTE: this drug is added during weight drop only if stereotactic electrode implantation will be performed on the same day |
| Chlorhexidine antiseptic | Pharmacy | ||
| Dental cement and solvent kit | Stoelting Co., USA | 51459 | |
| Drill | Foredom | HP4-917 | |
| Drill bit | Meisinger USA, LLC, USA | HM1-005-HP | 0.5 mm, Round, 1/4, Steel |
| Dry sterilizer | Cellpoint Scientific, USA | Germinator 500 | |
| EEG System 1 | Biopac Systems, CA, USA | ||
| EEG System 2 | Pinnacle Technology Inc., KS, USA | ||
| Ethanol ≥70% | VWR, USA | 71001-652 | KOPTEC USP, Biotechnology Grade (140 Proof) |
| Eye ointment | Pro Labs Ltd, USA | Puralube Vet Ointment Sterile Ocular Lubricant available in general online stores and pharmacies | |
| Fluriso liquid for inhalation anesthesia | MWI Veterinary Supply Co., USA | 502017 | |
| Hair removal product | Church & Dwight Co., Inc., USA | Nair cream | |
| Isoflurane | MWI Veterinary Supply Co., USA | 502017 | |
| Povidone-iodine surgical solution | Purdue Products, USA | 004677 | Betadine |
| Rimadyl/Carprofen | Zoetis Services LLC, Parsippany, NJ, USA | 026357 | |
| Solder | Harware store | ||
| Soldering iron | Weller, USA | WP35 | ST7 tip, 0.8mm |
| Stainless steel disc | Custom made | ||
| Sterile cotton swabs | |||
| Sterile gauze pads | Fisher Scientific, USA | 22362178 | |
| Sterile poly-lined absorbent towels pads | Cardinal Health, USA | 3520 | |
| Tissue adhesive | 3M Animal Care Products, USA | 1469SB |
Referencias
- Christensen, J., et al. Long-term risk of epilepsy after traumatic brain injury in children and young adults: a population-based cohort study. Lancet. 373 (9669), 1105-1110 (2009).
- Lowenstein, D. H. Epilepsy after head injury: an overview. Epilepsia. 50, Suppl 2 4-9 (2009).
- Ferguson, P. L., et al. A population-based study of risk of epilepsy after hospitalization for traumatic brain injury. Epilepsia. 51 (5), 891-898 (2010).
- Abou-Abbass, H., et al. Epidemiology and clinical characteristics of traumatic brain injury in Lebanon: A systematic review. Medicine (Baltimore). 95 (47), 5342(2016).
- Management of Concussion/mTBI Working Group. VA/DoD Clinical Practice Guideline for Management of Concussion/Mild Traumatic Brain Injury. The Journal of Rehabilitation Research and Development. 46 (6), 1-68 (2009).
- Piccenna, L., Shears, G., O'Brien, T. J. Management of post-traumatic epilepsy: An evidence review over the last 5 years and future directions. Epilepsia Open. 2 (2), 123-144 (2017).
- Loscher, W., Brandt, C. Prevention or modification of epileptogenesis after brain insults: experimental approaches and translational research. Pharmacological Reviews. 62 (4), 668-700 (2010).
- Ostergard, T., Sweet, J., Kusyk, D., Herring, E., Miller, J. Animal models of post-traumatic epilepsy. Journal of Neuroscience Methods. 272, 50-55 (2016).
- Shandra, O., et al. Repetitive Diffuse Mild Traumatic Brain Injury Causes an Atypical Astrocyte Response and Spontaneous Recurrent Seizures. Journal of Neuroscience. 39 (10), 1944-1963 (2019).
- Foda, M. A., Marmarou, A. A new model of diffuse brain injury in rats. Part II: Morphological characterization. Journal of Neurosurgery. 80 (2), 301-313 (1994).
- Marmarou, A., et al. A new model of diffuse brain injury in rats. Part I: Pathophysiology and biomechanics. Journal of Neurosurgery. 80 (2), 291-300 (1994).
- Paxinos, G., Keith, B. J., Franklin, M. The Mouse Brain in Stereotaxic Coordinates. , Elsevier Science. (2007).
- Shandra, O., Robel, S. Imaging and Manipulating Astrocyte Function In Vivo in the Context of CNS Injury. Methods in Molecular Biology. 1938, 233-246 (2019).
- Pitkanen, A., Immonen, R. Epilepsy related to traumatic brain injury. Neurotherapeutics. 11 (2), 286-296 (2014).
- Kharatishvili, I., Nissinen, J. P., McIntosh, T. K., Pitkanen, A. A model of posttraumatic epilepsy induced by lateral fluid-percussion brain injury in rats. Neuroscience. 140 (2), 685-697 (2006).
- Pitkanen, A., Bolkvadze, T., Immonen, R. Anti-epileptogenesis in rodent post-traumatic epilepsy models. Neuroscience Letters. 497 (3), 163-171 (2011).
- Gades, N. M., Danneman, P. J., Wixson, S. K., Tolley, E. A. The magnitude and duration of the analgesic effect of morphine, butorphanol, and buprenorphine in rats and mice. Journal of the American Association for Laboratory Animal Science. 39 (2), 8-13 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados