Method Article
Induzieren posttraumatische Epilepsie in einem Mausmodell von sich wiederholenden diffusen traumatischen Hirnverletzungen
In diesem Artikel
Zusammenfassung
Dieses systematische Protokoll beschreibt ein neues Tiermodell der posttraumatischen Epilepsie nach wiederholten leichten Schädel-Hirn-Verletzungen. Der erste Teil beschreibt die Schritte zur traumatischen Hirnverletzungsinduktion mit einem modifizierten Gewichtsabnahmemodell. Der zweite Teil enthält Anweisungen zum chirurgischen Ansatz für ein- und mehrkanalige elektroenzephalographische Datenerfassungssysteme.
Zusammenfassung
Traumatische Hirnverletzungen (TBI) sind eine der Hauptursachen für erworbene Epilepsie. TBI kann zu einer fokalen oder diffusen Hirnverletzung führen. Fokale Verletzungen sind das Ergebnis direkter mechanischer Kräfte, die manchmal durch den Schädel eindringen und eine direkte Läsion im Hirngewebe verursachen. Diese sind während der Bildgebung des Gehirns als Bereiche mit Kontusion, Zerrung und Blutungen sichtbar. Fokale Läsionen induzieren neuronale Todesfälle und gliale Narbenbildung und sind bei 20% bis 25% aller Menschen, die ein TBI ereignen, vorhanden. In den meisten TBI-Fällen wird die Verletzung jedoch durch Beschleunigungsverzögerungskräfte und anschließende Gewebescherungen verursacht, was zu nicht fokalen, diffusen Schäden führt. Eine Subpopulation von TBI-Patienten entwickelt nach einer Latenzzeit von Monaten oder Jahren weiterhin eine posttraumatische Epilepsie (PTE). Derzeit ist es unmöglich vorherzusagen, welche Patienten PTE entwickeln werden, und Anfälle bei PTE-Patienten sind eine Herausforderung zu kontrollieren, was weitere Forschung erfordert. Bis vor kurzem beschränkte sich das Feld auf nur zwei Tier-/Nagetiermodelle mit validierten spontanen posttraumatischen Anfällen, die beide mit großen fokalen Läsionen mit massivem Gewebeverlust im Kortex und manchmal subkortikalen Strukturen aufwiesen. Im Gegensatz zu diesen Ansätzen wurde festgestellt, dass diffuses TBI, das mit einem modifizierten Gewichtsabfallmodell induziert wird, ausreicht, um die Entwicklung spontaner krampfhatiger und nicht krampfhaniger Anfälle zu initiieren, selbst wenn es keine fokalen Läsionen oder Gewebeverlust gibt. Ähnlich wie bei menschlichen Patienten mit erworbener posttraumatischer Epilepsie bietet dieses Modell eine Latenzzeit nach einer Verletzung vor dem Anfall. In diesem Protokoll wird der Gemeinschaft ein neues Modell der posttraumatischen Epilepsie zur Verfügung gestellt, in dem detailliert beschrieben wird, wie diffuses nicht-lesionales TBI induziert werden kann, gefolgt von einer kontinuierlichen Video-Elektroenzephalografischen Tierüberwachung über mehrere Monate hinweg. Dieses Protokoll wird die Handhabung von Tieren, das Gewichtfallverfahren, die Elektrodenplatzierung für zwei Erfassungssysteme und die häufigen Herausforderungen in jedem der Schritte der Operation, der postoperativen Überwachung und der Datenerfassung beschreiben.
Einleitung
Jedes Jahr sind weltweit schätzungsweise 60 Millionen Menschen von TBI betroffen. Betroffene Personen haben ein höheres Risiko, epilepsie zu entwickeln, die sich Jahre nach der anfänglichen Verletzung manifestieren kann. Obwohl schwere TBIs mit einem höheren Risiko für Epilepsie verbunden sind, erhöht selbstmildes TBI die Wahrscheinlichkeit, epilepsie nanzuentwickeln 1,2,3,4. Alle TBIs können als fokal, diffus oder als Kombination aus beidem klassifiziert werden. Diffuse Hirnverletzungen, die in vielen, wenn nicht allen TBIs vorhanden sind, sind das Ergebnis von Hirngeweben unterschiedlicher Dichte, die durch Beschleunigungsverzögerung und Rotationskräfte gegeneinander scheren. Per Definition tritt diffuse Verletzung nur isoliert bei leichten/konkussiven nicht durchdringenden Hirnverletzungen auf, bei denen keine Hirnläsionen auf Computertomographie-Scans sichtbar sind5.
Derzeit gibt es zwei kritische Probleme beim Management von Patienten, die an posttraumatischen Epilepsien (PTE) leiden oder einem Risiko ausgesetzt sind. Die erste ist, dass, sobald PTE manifestiert hat, Anfälle resistent gegen verfügbare Antiepileptika (AEDs)6sind. Zweitens sind AEDs ebenso wirkungslos bei der Verhinderung der Epileptogenese, und es gibt keine wirksamen alternativen therapeutischen Ansätze. Um dieses Defizit anzugehen und bessere therapeutische Ziele und Behandlungskandidaten zu finden, wird es notwendig sein, neue zelluläre und molekulare Mechanismen an der Wurzel von PTE6zu erforschen.
Eines der herausragenden Merkmale der posttraumatischen Epilepsie ist die latente Periode zwischen dem anfänglichen traumatischen Ereignis und dem Beginn spontaner, unprovozierter, wiederkehrender Anfälle. Die Ereignisse, die in diesem zeitlichen Fenster auftreten, sind ein natürlicher Fokus für Forscher, da dieses Zeitfenster die Behandlung und Prävention von PTE insgesamt ermöglichen könnte. Tiermodelle werden am häufigsten für diese Forschung verwendet, weil sie mehrere verschiedene Vorteile bieten, nicht zuletzt, dass eine kontinuierliche Überwachung menschlicher Patienten sowohl unpraktisch als auch kostspielig über solche potenziell langen Zeiträume wäre. Darüber hinaus können zelluläre und molekulare Mechanismen an der Wurzel der Epileptogenese nur in Tiermodellen erforscht werden.
Tiermodelle mit spontanen posttraumatischen Anfällen und Epilepsie werden gegenüber Modellen bevorzugt, bei denen Krampfanfälle nach TBI durch weniger physiologisch relevante Mittel induziert werden, z. B. durch Chemokonvulsiva oder elektrische Stimulation akut, chronisch oder durch Entmundung. Spontane posttraumatische Anfallsmodelle testen, wie TBI das gesunde Gehirnnetzwerk verändert, was zu epilektiöser Genese führt. Studien mit zusätzlicher Stimulation nach TBI bewerten, wie die Exposition gegenüber TBI die Anfallsschwelle verringert und die Anfälligkeit für Anfälle beeinflusst. Die Vorteile von Tiermodellen mit chemisch induzierten Anfällen oder mit elektrischer Stimulation liegen darin, die spezifischen Mechanismen der Refraktorik auf AEDs und die Wirksamkeit bestehender und neuartiger AEDs zu testen. Der Grad der Relevanz und Übersetzung dieser Daten für den Menschen kann jedochaufgrund der folgenden Aspekte mehrdeutig sein 7: 1) Die Anfallsmechanismen können sich von denen unterscheiden, die nur durch TBI induziert werden; 2) nicht alle diese Modelle führen zu spontanen Anfällen7; 3) Läsionen, die durch das Krampmittel selbst, mit der für seine Entbindung erforderlichen Kanüle oder durch stimulierte Elektrodenplatzierung in Tiefenstrukturen (z.B. Hippocampus oder Amygdala) erzeugt werden, können bereits eine erhöhte Anfallsanfälligkeit und sogar hippocampale epiptiforme Feldpotentialeverursachen 7. Darüber hinaus produzieren einige Krampfmittel (d.h. Kainsäure) direkte Hippocampusläsionen und Sklerose, die nach diffusem TBI nicht typisch ist.
Bis vor kurzem gab es nur zwei Tiermodelle der posttraumatischen Epilepsie: kontrollierte kortikale Einschlage (CCI, fokal) oder Flüssigkeitspercussion-Verletzung (FPI, fokal und diffus)8. Beide Modelle führen zu großen fokalen Läsionen neben Gewebeverlust, Blutungen und Gliose bei Nagetieren8. Diese Modelle imitieren posttraumatische Epilepsie, die durch große fokale Läsionen induziert wird. Eine kürzlich durchgeführte Studie zeigte, dass wiederholtes (3x) diffuses TBI für die Entwicklung von spontanen Anfällen und Epilepsie bei Mäusen auch ohne fokale Läsionen9ausreicht, wobei ein drittes Nagetier-PTE-Modell mit bestätigten spontanen wiederkehrenden Anfällen hinzugefügt wird. Dieses neue Modell imitiert zelluläre und molekulare Veränderungen, die durch diffuses TBI induziert werden, und repräsentiert die menschliche Bevölkerung besser mit milden, konkussiven TBIs. In diesem Modell ermöglicht die latente Periode von drei Wochen oder mehr vor dem Anfall des Anfalls und das Auftreten von späten, spontanen, wiederkehrenden Anfällen die Untersuchung der Ursachen der posttraumatischen Epileptogenese, die Erprobung der Wirksamkeit präventiver Ansätze und neuer therapeutischer Kandidaten nach dem Anfall und hat Potenzial für die Entwicklung von Biomarkern der posttraumatischen Epileptogenese, da etwa die Hälfte der Tiere eine posttraumatische Epilepsie entwickeln.
Die Wahl des Tiermodells für die Untersuchung der posttraumatischen Epilepsie hängt von der wissenschaftlichen Frage, der Art der untersuchten Hirnverletzung und der Frage ab, mit welchen Werkzeugen die zugrunde liegenden zellulären und molekularen Mechanismen bestimmt werden. Letztlich muss jedes Modell der posttraumatischen Epilepsie sowohl das Auftreten spontaner Anfälle nach TBI als auch eine anfängliche Latenzzeit bei einer Teilmenge von TBI-Tieren nachweisen, da nicht alle Patienten, die ein TBI erkranken, Epilepsie entwickeln. Dazu wird in diesem Protokoll die Elektroenzephalographie (EEG) bei gleichzeitiger Videoerfassung verwendet. Das Verständnis der technischen Aspekte hinter Hardware und Ansätzen zur Datenerfassung ist für eine genaue Dateninterpretation von entscheidender Bedeutung. Zu den entscheidenden Hardwareaspekten gehören die Art des Aufzeichnungssystems, die Art der Elektroden (Schraube oder Drahtleitung) und das Material, aus dem sie bestehen, die synchronisierte Videoerfassung (als Teil des EEG-Systems oder Eines Drittanbieters) und die Eigenschaften des Computersystems. Je nach Studienziel, EEG-Ereignissen von Interesse, weiterer Analysemethode und Nachhaltigkeit der Datenspeicherung müssen in jedem System typisiert die entsprechenden Erfassungsparameter festgelegt werden. Schließlich ist die Methode der Elektrodenkonfiguration (Montage) zu berücksichtigen, da jede vor- und nachteile hat und die Dateninterpretation beeinflusst.
Dieses Protokoll beschreibt, wie man das modifizierte Marmarou-Gewichtsabfallmodell10,11 verwendet, um diffuse Verletzungen zu induzieren, die zu spontanen, unprovozierten, wiederkehrenden Anfällen bei Mäusen führen, beschreibt chirurgische Ansätze zur Erfassung eines ein- und mehrkanaligen kontinuierlichen und synchronisierten Video-EEG mit monopolarer, bipolarer oder gemischter Montage.
Protokoll
Alle in diesem Protokoll beschriebenen tierischen Verfahren wurden in Übereinstimmung mit dem Institutional Animal Care and Use Committee (IACUC) von Virginia Tech und in Übereinstimmung mit dem "Leitfaden für die Pflege und Verwendung von Labortieren" der National Institutes of Health durchgeführt. .
1. Tierhandhabungsprotokoll
HINWEIS: Dieses Protokoll soll Tiere, die von einem Verkäufer nach der Ankunft bestellt wurden, in die Anlage eingewöhnen und sie so konditionieren, dass sie vom Experimentator behandelt werden. Dies verbessert das Wohlbefinden der Tiere, indem Stress und Angst reduziert werden, und vereinfacht bestimmte Verfahren, die den Umgang mit Tieren erfordern, einschließlich der Induktion des TBI, der postoperativen Überwachung und der Anbindung des Tieres an das Erfassungssystem.
- Wenn viele Tiere vom Verkäufer empfangen werden, ohrmarken und nach dem Zufallsprinzip einer experimentellen Gruppe (TBI) oder Kontrollgruppe (Scheinchirurgie) zuweisen, während sie sie in Käfigen von 2-5 Tieren kombinieren. Haus TBI Tiere getrennt von Scheintieren, weil Scheinmäuse gelegentlich aggressiv gegenüber Mäusen handeln, die TBI unterzogen wurden.
- Tag 1 (24-48 h nach Ohrmarken): Bereiten Sie ein Diagramm für die Erfassung von Tierohrmarken, Geburtsdatum, Datum der Handhabung, Tiergewicht an den Handhabungstage, Dauer der Handhabung und einen Abschnitt für Kommentare und Beobachtungen vor.
- Das Tier vorsichtig mit beiden Händen bebechern. Greifen Sie das Tier nicht am Schwanz, da es Abwehrmechanismen und eine Stressreaktion induziert.
- Überprüfen und notieren Sie die Ohrmarke des Tieres.
- Legen Sie das Tier in den Behälter auf der Gewichtsskala und erfassen Sie das Gewicht.
- Bechern Sie das Tier vorsichtig mit beiden Händen wieder und behandeln Sie es für 1 min, so dass es sich bewegen und innerhalb der Hände erkunden kann. Führen Sie dies über eine Bank im Prozedurraum und achten Sie darauf, das Tier nicht auf den Boden fallen zu lassen.
- Nach 1 min Der Handhabung, legen Sie das Tier wieder in seinen Käfig.
- Wiederholen Sie die Schritte 1.3-1.7 für die anderen Tiere im Käfig.
- Behandlung Tag 2 (am folgenden Tag): Wiederholen Sie die Schritte 1.2-1.5.
- Bechern Sie das Tier vorsichtig mit beiden Händen wieder und behandeln Sie es für 2 min, so dass es sich bewegen und innerhalb der Hände erkunden. Führen Sie dies über eine Bank im Prozedurraum und achten Sie darauf, das Tier nicht auf den Boden fallen zu lassen.
- Nach 2 min Der Handhabung, legen Sie das Tier wieder in seinen Käfig.
- Wiederholen Sie die Schritte 1.10-1.11 für die anderen Tiere im Käfig.
- Behandlung von Tag 3 (am folgenden Tag): Wiederholen Sie die Schritte 1.2-1.5.
- Bechern Sie das Tier vorsichtig mit beiden Händen wieder und behandeln Sie es für 4 min, so dass es sich bewegen und innerhalb der Hände erkunden. Führen Sie dies über eine Bank im Prozedurraum und achten Sie darauf, das Tier nicht auf den Boden fallen zu lassen.
- Nach 4 min der Handhabung, legen Sie das Tier wieder in seinen Käfig.
- Wiederholen Sie die Schritte 1.14-1.15 für die anderen Tiere im Käfig.
- Handhabungstag 4 (Kontrolltag, 1 Woche ab Behandlungstag 1): Wiederholen Sie die Schritte 1.2-1.5.
- Bechern Sie das Tier vorsichtig mit beiden Händen wieder und behandeln Sie es für 4 min, so dass es sich bewegen und innerhalb der Hände erkunden. Führen Sie dies über eine Bank im Prozedurraum und achten Sie darauf, das Tier nicht auf den Boden fallen zu lassen.
- Nach 4 min Handhabung, legen Sie das Tier wieder in seinen Käfig.
- Wiederholen Sie die Schritte 1.18-1.19 für die anderen Tiere im Käfig.
HINWEIS: Der Tag der Kontrolle wird getestet, ob das ruhige Verhalten nach einem dreitägigen Handling-Protokoll beibehalten wird.
2. Gewichtsabnahme-Verfahren
- Legen Sie die Maus in eine Induktionskammer. Stellen Sie den Sauerstoff- und Vakuumstrom sowohl auf 1 l/min als auch den Gehalt an Isoflurangas auf 3 % bis 5 % ein. Anästhetisieren Sie die Maus für 5 min.
- Entfernen Sie die Maus aus der Induktionskammer und legen Sie sie auf ein Schaumstoffpad. Testen Sie, ob keine Reaktion auf eine Zeh oder Schwanzklemme besteht.
- Ein Schmerzmittel (0,1 mg/kg Buprenorphin) subkutan verabreichen. Wenn die EEG-Operation am selben Tag durchgeführt wird, verabreichen Sie das Buprenorphin subkutan in Kombination mit dem nichtsteroidalen entzündungshemmenden Karprofen (5 mg/kg).
- Verabreichen Sie die Natriumlaktatlösung (3 l pro Gramm des Gewichts des Tieres) vor oder nach dem letzten Aufprall subkutan. Die Natriumlaktatlösung kann mit den Analgetika zur schnellen Verabreichung in einer einzigen Injektion gemischt werden.
HINWEIS: Die Natriumlactatlösung enthält eine Mischung aus Natriumchlorid, Kaliumchlorid, Calciumchlorid und Natriumlactat in Wasser. Dieser Schritt hilft, Flüssigkeiten und Elektrolyte zu ersetzen und hilft bei der Rückgewinnung. - Positionieren Sie den Mauskopf unter dem Gewichtstropfenrohr (Abbildung 1A) und platzieren Sie eine flache Edelstahlscheibe (1,3 cm Durchmesser, 1 mm Dicke und 880 mg Gewicht) in der Mitte des Kopfes, zwischen der Linie der Augen und Ohren.
HINWEIS: Diese Scheibe diffundiert den Aufprall über die Schädeloberfläche (Abbildung 1B). - Entfernen Sie den Stift im Gewichtstropfenrohr, um die 100 g-Gewichtsstange aus einer Höhe von 50 cm zu lösen. Um die Scheinverletzung für die Kontrollmäuse zu induzieren, entfernen Sie die Gewichtsstange aus dem Rohr, um eine versehentliche Freisetzung des Stifts und Gewichtsabnahme zu verhindern.
HINWEIS: Der Kopf des Tieres muss flach positioniert werden, damit die Stange frei auf die gesamte Oberfläche der Scheibe fällt. - Legen Sie das bewusstlose Tier auf den Rücken, um es auf einem Heizkissen zu erholen, das mit einem sterilen polyleinen saugfähigen Handtuch bedeckt ist. Die richtige Reflex-Wiederherstellungszeit (d.h. die Zeit, die die Maus braucht, um sich von hinten zu recht zu bewegen) kann als Auslesung für die unbewusste Zeit gemessen werden.
- Wenn das Tier das Bewusstsein wiedererlangt, legen Sie es in einen sauberen Käfig, der auf einem Heizkissen erwärmt wurde, mit Erholungsgel und ein paar befeuchteten Chow-Stücken, um sich für 45 min zu erholen. Stellen Sie sicher, dass es genügend Müll gibt, damit der Käfig nicht überhitzt wird. Eine Überhitzung des Tieres kann sich als ebenso großes Hindernis für die Genesung erweisen, wie die Maus zu kalt werden lässt.
- Wiederholen Sie nach 45 min zweimal die Schritte 2.1 x 2.8, bei dem Schritt 2.3 weggelassen wird (d. h. Verabreichung von Analgetika und entzündungshemmenden Medikamenten).
- Lassen Sie die Tiere sich für 1 x 2 h erholen, wenn am selben Tag eine EEG-Elektrodenimplantationsoperation durchgeführt wird.
3. Chirurgische Feldvorbereitung zur Implantation von EEG-Elektroden
HINWEIS: Autoklavieren Sie die chirurgischen Werkzeuge und Schrauben vor der Operation. Reinigen Sie die chirurgischen Handschuhe, indem Sie vor und nach dem Berühren des Tieres und zwischen durch den Umgang mit den Tieren 70 % Ethanol besprühen und reiben. Sterilisieren Sie die chirurgischen Werkzeuge für 2 x 3 min im Perlensterilisator (siehe Tabelle der Materialien) zwischen Tieren. Ändern Sie den sterilen Vorhang, bevor Sie ein neues Tier in den stereotaktischen Apparat legen. Stellen Sie sicher, dass das Operationsfeld alle notwendigen Komponenten für die Operation enthält (Abbildung 2). Das Fehlen eines invasiven chirurgischen Eingriffs zur Induzieren des TBI in diesem Modell hat mehrere Vorteile: 1) Die Implantation der Elektroden ist flexibel und kann am selben Tag wie TBI oder nach einem definierten Zeitraum durchgeführt werden; 2) die Erholungszeit des Tieres ist schneller; 3) der Schädel bleibt intakt, was mehr Oberfläche und Flexibilität für die Implantation von Elektroden ermöglicht.
- Anästhetisieren Sie die Maus in 3%-5% Isoflurangas in einer Induktionskammer für 5 min.
- Übertragen Sie die Maus von der Induktionskammer auf das stereotaktische Gerät und legen Sie sie auf einen sterilen Vorhang auf einem Heizkissen mit Isoflurangas und Vakuumröhren, die mit dem Nasenkegel verbunden sind.
- Halten Sie die Körpertemperatur bei 37 °C während der Operation. Platzieren Sie den Temperatursensor so, dass er mit der Brust oder Der Bauchwand der Maus in Kontakt tritt.
- Fixieren Sie den Kopf des Tieres mit den Ohrbügeln an Ort und Stelle.
- Halten Sie die Anästhesie bei 1,5 % 3,5 % Isofluran oder bei 60 Atemzügen/min in der chirurgischen Ebene (ohne Reaktion auf Zehen- oder Schwanzkneifen).
- Tragen Sie eine Augensalbe auf die Augen des Tieres auf, um sie während der gesamten Operation geschmiert zu halten.
- Verabreichen Sie eine Mischung aus Analgetika (0,1 mg/kg Buprenorphin) und dem nichtsteroidalen entzündungshemmenden Medikament (5 mg/kg Carprofen) in einer einzigen Injektion subkutan, es sei denn, das TBI wurde früher im Laufe des Tages durchgeführt, in diesem Fall erhielt das Tier bereits Analgetika und Entzündungshemmer.
HINWEIS: Buprenorphin sollte erneut verabreicht werden, wenn die Zeit zwischen der ersten TBI- und EEG-Platzierungsoperation 8 h überschreitet oder wenn das Tier nach der ersten Verabreichung Anzeichen von Schmerzen 8 h zeigt, es aber ohne Zugabe von Carprofen verabreicht werden sollte. - Verabreichen Sie natriumlactatlösung (3 l pro Gramm des Gewichts des Tieres) subkutan, um Flüssigkeiten und Elektrolyte im Tier zu ersetzen.
HINWEIS: Wenn eine Operation unmittelbar nach dem TBI durchgeführt wird, muss dieser Schritt ordnungsgemäß getimt werden. Natriumlaktat-Lösung sollte alle 2 h verabreicht werden, während das Tier die Verfahren durchläuft und einmal nach der Operation 2 h von der vorherigen Injektion. - Entfernen Sie das Haar von der Kopfhaut mit einer Haarentfernungscreme.
- Vor dem Schnitt, desinfizieren Sie die Haut der Kopfhaut mit Povidon-Jod chirurgische antiseptische Lösung und 70% Ethanol in abwechselnden Tupfern mit sterilen Gaze Pads in einer kreisförmigen Bewegung 3x (20 s pro Lösung jedes Mal).
- Mit einem Skalpell, machen Sie einen rostral-kaudalen Schnitt auf der Kopfhaut Mittellinie von knapp über den Augen bis zum Hinterkopf. Diese Methode der Kopfhautöffnung wird dem Abschneiden der Kopfhaut vorgezogen, da Hautklappen über oder um die EEG-Kappe versiegelt werden können, um mehr Stabilität zu gewährleisten.
HINWEIS: Bei der Vorbereitung des Schädels für die Implantation des 3-EEG-Kopfteils ist ein Abschneiden der Kopfhaut erforderlich, da die Größe des Kopfteils keine Verschlussart der Hautklappen über dem Kopfteil zulässt. - Erweitern Sie den Einschnittbereich, indem Sie kleine Hämostate auf die geöffneten Hautränder auftragen. Wenn nach dem Schnitt Blutungen auftreten, mit einer sterilen Watte oder einem Tupfer reinigen.
- Entfernen Sie das Periost (d.h. die dünne Membran über dem Schädelknochen) vorsichtig mit einer Skalpellklinge. Wenn während dieses Schritts Blutungen auftreten, drücken Sie auf der Blutungsstelle mit einem sterilen Wattestäbchen, bis er aufhört.
- Verwenden Sie sterile Wattestäbchen, um den Schädel mit Wasserstoffperoxid zu reinigen, aber vermeiden Sie es, das Weichgewebe zu berühren, das den exponierten Schädelbereich umgibt. Wiederholen Sie diesen Schritt, bis der Schädel von einem Weichgewebe gereinigt wird und ein weißliches Aussehen hat.
- Den Schädel mit einem sterilen Gaze oder Wattestäbchen trocknen.
HINWEIS: Die Schritte 3.12-3.15 sind wichtig für die richtige Fixierung der Elektroden und des Zahnzements. Weichgewebe, nicht-kauterisierte Blutungen und Ablagerungen können Infektionen, instabile Kopfbefestigung, verzerrtes oder fehlendes Signal und Verlust des Implantats innerhalb von mehreren Tagen oder Wochen nach der Operation verursachen.
4. Elektrodenplatzierung
- Implantieren Sie den einzelnen EEG (1EEG) Kanalkopfhalter.
HINWEIS: Abkürzungen in den stereotaktischen Koordinaten stellen räumliche Beziehungen dar und geben den Abstand des Ziels vom Bregma in Millimetern bei einer bestimmten Ausrichtung auf dem Kopf des Tieres an: vorder-posterior (AP) und medial-lateral (ML). Dorsal-ventral ist in diesem Protokoll nicht anwendbar, da alle Elektroden in den Epiduralraum und nicht in eine bestimmte Struktur innerhalb des Gehirns (Abbildung 3). Vin+ ist eine aktive Elektrode und Vin- ist seine Referenzelektrode.- Verwenden Sie einen Hochgeschwindigkeitsbohrer mit einem Stahlbit (0,5 mm, rund, 1/4 In.) bei 5.000 bis 6.000 Runden pro Min. (Rpm), um sechs Gratlöcher (drei für Stabilitätsschrauben und drei für Elektroden) mit den mitgelieferten stereotaktischen Koordinaten12zu erstellen. Für die beiden vorderen Schrauben: AP = +1,5 mm, ML = 1,5 mm; für die eine hintere Schraube: AP = -5,2 mm, ML = -1,5 mm; für die Masseelektrode: AP = -5,2 mm, ML = +1,5 mm; für die Aufnahmeelektroden: AP = -2,3 mm, ML = 2,7 mm, mit Vin+ rechts und Vin- links.
- Fügen Sie drei Schrauben für eine verbesserte Stabilität der Kopfstufe hinzu. Drehen Sie mit einem Schraubendreher jeweils 1,5 x Schrauben, die stabil im Schädel befestigt werden.
HINWEIS: Das Tieferlegen der Schrauben wird das Gehirn schädigen. - Setzen Sie den 1EEG-Kopfhalter in einen stereotaktischen Halterarm ein und positionieren Sie den Kopfhalter so, dass sich die drei Elektroden entlang der Schädelmittellinie befinden. Bei dieser Konfiguration befindet sich die Bodenelektrode und ihre entsprechende Öffnung auf der Oberseite des Kopfteils im Rücken, die Vin+-Elektrode in der Mitte und die Vin-Elektrode vorne. Eine Markierung kann auf dem Kopfteil mit einem permanenten Marker gemacht werden.
- Biegen Sie jede Elektrode um 90° so, dass das Ende jedes Drahtes nach unten gebogen und über dem entsprechenden Gratloch positioniert wird. Messen Sie dann 1 mm Länge des Teils des Drahtes, der jetzt senkrecht zum Gratloch ist, und trimmen Sie den Überschuss ab (Abbildung 3). Dadurch wird die epidurale Platzierung der Elektroden sichergestellt. Die Elektroden sollten die Dura-Mater-Oberfläche kaum berühren.
- Senken Sie die Kopfhalterung und stellen Sie alle drei Elektroden so ein, dass sie dem jeweiligen Gratloch entsprechen. Für die Epiduralaufnahme müssen die Elektroden über oder kaum berühren die Dura mater platziert werden.
- Bereiten Sie Zahnzement für die Anwendung vor, indem Sie einen 1/2-Löffel Pulver mit mehreren Tropfen Lösungsmittel mischen. Verwenden Sie einen Mischspachtel und rühren Sie, bis die endgültige Mischung putty-like, klebrig, aber formbar und steif genug ist, um richtig kondensiert zu werden, wenn sie auf den Schädel des Tieres gelegt werden.
- Tragen Sie das Zahnzementgemisch auf, das alle Schrauben und Elektroden abdeckt, und warten Sie 3 bis 5 min, bis sie erstarrt ist. Achten Sie darauf, den Kunststoffsockel nicht mit Zahnzement zu bedecken, da es unmöglich ist, das Tier mit einem Tether an den Kommutator zu verbinden.
- Lassen Sie die Hämostate, die die Hautklappen halten, los und schließen Sie den Schnitt, indem Sie die Hautklappen um den Kunststoffsockel verbinden. Tragen Sie mehrere Tropfen Gewebekleber auf (siehe Tabelle der Materialien), um die Hautklappen zu versiegeln.
- Chlorhexidin antiseptisch auf den Bereich um das Implantat anwenden, um eine Infektion zu vermeiden. Wenn das Tier länger als 2 h nach der vorherigen Injektion der Natriumlaktatlösung, die während der TBI-Induktion verabreicht wurde, länger als 2 h unter Anästhesie ist, eine weitere Injektion subkutan verabreichen. Um die richtige Hydratation des Tieres aufrechtzuerhalten, wiederholen Sie die Injektion alle 2 h, die das Tier unter Anästhesie verbringt.
- Nach der Operation, geben Sie eine endgültige Injektion von Natriumlaktat-Lösung 2 h nach der vorherigen Injektion. Wenn die Operation weniger als 2 h lang ist, verabreichen Sie die endgültige Erholungsdosis der Natriumlaktatlösung 2 h ab der ersten Injektion.
- Entfernen Sie das Tier aus dem stereotaktischen Apparat und messen Sie das Gewicht des Tieres nach der EEG-Operation als Referenz für die zukünftige Überwachung. Durch das Implantat ist das Gewicht des Tieres größer als vor der Operation.
- Legen Sie das Tier in einen sauberen Käfig auf einem warmen Heizkissen für die Erholung.
- Implantieren Sie die beiden EEG- und eine EMG(2EEG/1EMG) Kanalmontage.
- Verwenden Sie das Bregma als Landmark für die Platzierung des Kopfteils. Tragen Sie eine kleine Menge Gewebekleber (siehe Materialtabelle)auf die Unterseite des 2EEG/1EMG Kopfteils auf, um die vier Schraubenlöcher zu vermeiden und den 2EEG/1EMG Kopfhalter auf die Oberfläche des Schädels zu legen.
HINWEIS: Es gibt keine spezifischen Koordinaten für die Platzierung dieses Kopfteils. Die Kopfhalterung ist 8 mm lang und 5 mm breit, die den größten Teil der Schädeloberfläche bedeckt. Die Positionierung des Kopfteils mit seiner Vorderkante von 3,0 mm vor dem Bregma ist optimal und sorgt für eine gute Signalqualität. Schnelle manuelle Platzierung ist notwendig, bevor der Tropfen der Gewebeklebstoff aushärtet. Lassen Sie ca. 5 min für Gewebekleber vollständig zu heilen. - Verwenden Sie eine sterile 23 G Nadel, um Pilotbohrungen für die Schrauben durch die vier Öffnungen im Kopfhalter zu erstellen. Um dies zu erreichen, drücken Sie vorsichtig die Nadel und drehen Sie langsam, bis die Spitze der Nadel in den Schädel eindringt, ohne das Gehirn zu beschädigen. Entfernen Sie alle Blutungen aus den Pilotlöchern mit einem sterilen Wattestäbchen.
- Setzen Sie die 0,10 in Schrauben in die Pilotlöcher ein und drehen Sie sie, bis sie jeweils im Schädel fixiert sind. Dies kann bis zur Hälfte der Schneckenlänge sein, aber nicht die volle Länge, da dies die Dura mater und Cortex beschädigen würde. Wenn der Kopfhalter so positioniert ist, dass es einen Spalt zwischen der Schädeloberfläche und dem hinteren Ende des Kopfteils gibt, verwenden Sie zwei 0,12 in Schrauben im hinteren Teil.
- Machen Sie eine kleine Öffnung an den Seiten des Zweikomponenten-Epoxidbeutels (Silber-Epoxy). Nehmen Sie einen doppelseitigen Spachtel und verwenden Sie jede Seite, um eine kleine und gleiche Menge jeder Komponente aus dem Beutel zu schöpfen und sie zusammen zu mischen. Verwenden Sie nur eine kleine Menge ausreichend für eine einzelne Operation, da die Mischung verfestigt sich innerhalb von 20 min. Versiegeln Sie die Seiten des Beutels, um eine Trocknung zu verhindern.
HINWEIS: Das Silber-Epoxid ermöglicht einen richtigen elektrischen Kontakt zwischen Schraube und Kopfhalterung und verbessert die Stabilität der Schrauben. - Tragen Sie eine kleine Menge dieser Mischung zwischen Schraubenkopf und Schraubloch auf, dann ziehen Sie jede Schraube fest, bis ihr Kopf auf der Basis des Implantats ruht. Stellen Sie sicher, dass kein Silber-Epoxid Kontakt zwischen den beiden Schrauben herstellt, da jede Schraube als individuelle Elektrode dient und, um ein genaues Signal zu gewährleisten, sollte sie keinen Kontakt mit der anderen Schraube herstellen.
- Wenn die Silber-Epoxy-Mischung verlegt wurde, gibt es ein paar Sekunden Zeitfenster, um vorsichtig den Überschuss auszuhöhlen, um die Verbindung zu trennen. Biegen Sie beide EMG-Leitungen vorsichtig von der hinteren Kante des Kopfteils, um der Kontur des Kopfes und des Halses des Tieres zu folgen, und legen Sie sie dann in die Nuchalmuskulatur ein.
- Bereiten Sie Zahnzement für die Anwendung vor, indem Sie einen 1/2-Löffel Pulver mit mehreren Tropfen Lösungsmittel mischen. Verwenden Sie einen Mischspachtel und rühren Sie, bis die endgültige Mischung putty-like, klebrig, aber formbar und steif genug ist, um richtig kondensiert zu werden, wenn sie auf den Schädel des Tieres gelegt werden.
- Tragen Sie zahnärztliche Zementmischung auf, die den gesamten Kopfhalter abdeckt, ohne die Abdeckung der sechs Stiftlöcher, da dies den Anschluss des Vorverstärkers unmöglich macht. Warten Sie 3 bis 5 min, bis der Zement verfestigt ist. Stellen Sie sicher, dass die Haut nicht mit Zahnzement am Kopfmontiert versiegelt ist.
- Lassen Sie die Hämostate, die die Hautklappen halten, los und schließen Sie den Schnitt, indem Sie die Hautklappen um den Kunststoffsockel verbinden. Tragen Sie mehrere Tropfen Gewebekleber auf, um die Hautklappen zu versiegeln.
HINWEIS: Wenn der Hautschnitt länger gemacht wurde, um eine Begradigung der EMG-Drahtleitungen zu ermöglichen, kann die Haut mit Gewebekleber versiegelt oder genäht werden. Die Haut mit Gewebekleber zu versiegeln ist in der Regel ausreichend. Wenn jedoch während der postoperativen Überwachung die Öffnung des Schnittes beobachtet wird, werden stattdessen Nähte empfohlen. - Chlorhexidin antiseptisch auf den Bereich um das Implantat anwenden, um eine Infektion zu vermeiden. Verabreichen Sie die Natriumlaktatlösung (3 l pro Gramm des Gewichts des Tieres) subkutan, um Flüssigkeiten und Elektrolyte zu ersetzen, wenn das Tier nach der vorherigen Injektion länger als 2 h unter Anästhesie ist.
- Entfernen Sie das Tier aus dem stereotaktischen Apparat und messen Sie das Gewicht des Tieres nach der EEG-Operation als Referenz für die zukünftige Überwachung. Durch das Implantat ist das Gewicht des Tieres größer als vor der Operation.
- Legen Sie das Tier in einen sauberen Käfig auf einem warmen Heizkissen, mit Erholungsgel und ein paar befeuchteten Chow-Stücken für die Genesung.
- Verwenden Sie das Bregma als Landmark für die Platzierung des Kopfteils. Tragen Sie eine kleine Menge Gewebekleber (siehe Materialtabelle)auf die Unterseite des 2EEG/1EMG Kopfteils auf, um die vier Schraubenlöcher zu vermeiden und den 2EEG/1EMG Kopfhalter auf die Oberfläche des Schädels zu legen.
- Implantieren Sie eine drei EEG-Kanäle (3EEG) Kopfhalterung.
- Verwenden Sie Hochgeschwindigkeitsbohrer mit einem Stahlbit (0,5 mm, rund, 1/4) bei 5.000 bis 6.000 Umdrehungen pro Minute, um sechs Gratlöcher (drei für Stabilitätsschrauben und drei für Elektroden) mit den mitgelieferten stereotaktischen Koordinaten12zu erzeugen. Für Boden- und gemeinsame Referenz für EEG1 und EEG2: AP = 5,2 mm, ML = 1,5 mm; für EEG1 und EEG2: AP = -3,0 mm, ML = 3,0 mm; für unabhängiges EEG3: AP =-1,4 mm, ML = 1,5 mm.
- Legen Sie die sechs Schneckenelektroden in die Gratlöcher.
HINWEIS: Das Tieferlegen der Schrauben verursacht erhebliche Schäden am Gehirn. Schraubenelektroden sorgen für eine bessere Stabilität der Kopfhalterung. - Bereiten Sie Zahnzement für die Anwendung vor, indem Sie einen 1/2-Löffel Pulver mit mehreren Tropfen Lösungsmittel mischen. Verwenden Sie einen Mischspachtel und rühren Sie, bis die endgültige Mischung putty-like, klebrig, aber formbar und steif genug ist, um richtig kondensiert zu werden, wenn sie auf den Schädel des Tieres gelegt werden.
- Tragen Sie zahnärztlichezementgemisch auf, das die gesamte exponierte Oberfläche des Schädels und jeder Schneckenelektrode abdeckt. Stellen Sie sicher, dass die Haut nicht mit Zahnzement am Kopfmontiert versiegelt ist. Warten Sie auf 1 bis 2 min, bis der Zement leicht erstarrt ist. Es ist nicht notwendig, bis zur vollständigen Erstarrung zu warten, bevor Sie mit dem nächsten Schritt fortfahren.
- Schalten Sie das Lötkolben ein, um es aufzuheizen. Legen Sie den 3EEG-Kopfhalter in einen stereotaktischen Halterarm.
HINWEIS: Positionieren Sie den Kopfhalter so, dass die sechs Drahtführungspositionen mit der Position der Drahtleitungen jeder Schneckenelektrode übereinstimmen. - Senken Sie den Kopfhalter, so dass sein ventraler Teil auf dem Zahnzement ruht.
- Drehen Sie den Draht jedes Kabels von jeder der Schneckenelektroden mit dem entsprechenden Drahtvorsprung des Kopfteils.
HINWEIS: Das Verdrehen der falschen Drahtleitungen macht die Dateninterpretation kompliziert oder unmöglich. - Schneiden Sie den überschüssigen Draht vorsichtig mit einer Schere ab. Löten Sie jedes verdrehte Drahtpaar für die richtige Signalleitung.
HINWEIS: Jedes Kabelpaar muss mit einem anderen Paar in Kontakt treten, da andernfalls die Signalqualität und die Dateninterpretation beeinträchtigt werden. - Biegen Sie jedes gelötete Paar Draht um den Kopfhalter, um den Kontakt zwischen den einzelnen Paaren zu vermeiden.
HINWEIS: Wenn die Drahtleitungen nicht kurz genug getrimmt sind, kann es schwierig sein, sie um den Kopfhalter zu biegen, ohne einen anderen Draht zu berühren. In diesem Fall, biegen Sie ein Paar zuerst, decken Sie es mit Zahnzement-Mischung, warten Sie 1 ,2 min zu erstarren, dann gehen Sie mit dem nächsten Paar in der gleichen Weise. - Beenden Sie den gesamten Draht mit Zahnzement, so dass nur der schwarze Teil des Kopfteils freigelegt wird.
HINWEIS: Achten Sie darauf, kein Zahnzementpulver oder -gemisch auf die Oberseite des exponierten Teils des Kopfteils aufzutragen, da Schmutz oder Zement in den Löchern den Kontakt blockieren und entweder zu Signalabwesenheit oder Lärm führen. - Lassen Sie die Hämostate, die die Hautklappen halten. Chlorhexidin antiseptisch auf den Bereich um das Implantat anwenden, um eine Infektion zu vermeiden.
- Verabreichen Sie die Natriumlaktatlösung (3 l pro Gramm des Gewichts des Tieres) subkutan, um Flüssigkeiten und Elektrolyte zu ersetzen, wenn das Tier nach der vorherigen Injektion länger als 2 h unter Anästhesie war.
- Entfernen Sie das Tier aus dem stereotaktischen Apparat und messen Sie das Gewicht des Tieres nach der EEG-Operation als Referenz für die zukünftige Überwachung. Durch das Implantat ist das Gewicht des Tieres größer als vor der Operation.
- Legen Sie das Tier in einen sauberen Käfig auf einem warmen Heizkissen, mit Erholungsgel und ein paar befeuchteten Chow-Stücken für die Genesung.
HINWEIS: Wasserstoffperoxid hilft bei der Entfernung des verbleibenden Weichgewebes aus dem Schädel.
5. Verbinden von Tieren mit dem Erfassungssystem
- Bechern Sie das Tier mit beiden Händen, um es aus dem Anschaffungskäfig zu entfernen und es in einen sauberen Bereich mit einer flachen Oberfläche zu übertragen, wie eine Animal Transfer Station (ATS).
- Greifen Sie vorsichtig die Maus an der Haut ihres Rückens. Greifen Sie das Tier nicht am Schwanz, da dies Not verursacht.
- Identifizieren Sie die Öffnung im EEG-Kopfhalter entsprechend der Masseelektrode und passen Sie den entsprechenden Pin des Tethers für eine ordnungsgemäße Verbindung an.
HINWEIS: Die umgedrehte Verbindung des Tethers vom Kommutator zum Kopfhalter des Tieres führt zu einer anderen Lesart als die Elektroden und potenziell verzerrte Wellenformen. - Bringen Sie das Tier in den Erfassungskäfig zurück und schließen Sie das andere Ende des Tethers (EEG-System 1) oder Vorverstärker (EEG-System 2) an den Kommutator an.
HINWEIS: Wenn Sie den Vorverstärker (EEG System 2) vom Kommutator an den Tether anschließen, stimmen Sie mit den weißen Markierungen an den Enden beider Tether überein. Der Rückanschluss führt zu dauerhaften Schäden am Verstärker und erfordert Reparaturen durch den Hersteller, die teuer sind. - Drehen Sie den Tether, der das Tier mit dem Kommutator verbindet, sanft, um sicherzustellen, dass der Mechanismus ordnungsgemäß funktioniert und sich das Tier frei bewegen kann.
6. EEG-Datenerfassungseinstellungen
- Stellen Sie die Erfassungsparameter des EEG-Systems 1 ein.
- Abtastrate auf 500 Hz einstellen; 5.000 zu gewinnen; Modus Norm 35 Hz; LPN aus. Hochpassfilter auf 0,5 Hz einstellen.
HINWEIS: 100 Hz (Tiefpass) ist eingebaut und erfordert keine manuelle Eingabe.
- Abtastrate auf 500 Hz einstellen; 5.000 zu gewinnen; Modus Norm 35 Hz; LPN aus. Hochpassfilter auf 0,5 Hz einstellen.
- Stellen Sie die Erfassungsparameter des EEG Systems 2 ein.
- Abtastrate auf 600 Hz einstellen; Vorverstärkerverstärkung 100; Gewinn 1 (EEG1,2). Stellen Sie den Tiefpassfilter auf 100 Hz ein.
HINWEIS: 1 Hz (High Pass) ist eingebaut und erfordert keine manuelle Eingabe.
- Abtastrate auf 600 Hz einstellen; Vorverstärkerverstärkung 100; Gewinn 1 (EEG1,2). Stellen Sie den Tiefpassfilter auf 100 Hz ein.
7. Einstellungen zur Videodatenerfassung
- Stellen Sie Erfassungsparameter für EEG System 1 ein.
HINWEIS: Für die gleichzeitige Videoverarbeitung wird ein Videoerfassungssystem von Drittanbietern benötigt.- Legen Sie die Bildrate zwischen 15 (minimum empfohlen) und 30 (maximal verfügbar) für eine entsprechende Videoqualität fest. Stellen Sie die Auflösung auf 640 x 640 Pixel ein. Stellen Sie den Komprimierungstyp auf H.264H ein.
- Stellen Sie Erfassungsparameter für EEG System 2 ein.
HINWEIS: Dieses EEG-System bietet ein Videosystem und eine Software, die Video- und EEG-Daten in einer einzigen Datei für bis zu vier Tiere synchronisieren (siehe Tabelle der Materialien).- Legen Sie die Bildrate zwischen 15 (minimum empfohlen) und 30 (maximal verfügbar) für eine entsprechende Videoqualität fest. Stellen Sie die Auflösung auf 640 x 480 Pixel ein. Legen Sie den Komprimierungstyp auf das WebM-Dateiformat fest.
Ergebnisse
Das hier skizzierte Protokoll beschreibt das Verfahren zur isolierten Induktion einer diffusen Verletzung (z. B. in Ermangelung einer fokalen Läsion) mit einem Mausmodell des sich wiederholenden diffusen TBI (Abbildung 1). Abbildung 1A zeigt die Gewichtsabnahmevorrichtung und ihre Komponenten ( Abbildung1A, a1-a5), die für die Induktion von TBI in diesem Modell verwendet wird, und entscheidende Schritte während des Verfahrens (Abbildung 1B, b1-b5).
Zu den Merkmalen dieses Modells gehören das Fehlen einer fokalen Läsion des Gehirns als Folge des TBI, Bewusstseinsverlust, eine hohe Überlebensrate, das Auftreten eines späten Anfallsbeginns (>1 Woche des TBI) und spontane, unprovozierte, rezidivierende Anfälle in einer TBI-Mäuse nach einer Latenzzeit von mindestens drei Wochen nach TBI.
Dieses Protokoll veranschaulicht detaillierte Verfahren für die Einrichtung eines sauberen Operationsfeldes (Abbildung 2), bietet einen schrittweisen Ansatz für die Implantation verschiedener Elektrodenarrays (Abbildung 3) und enthält eine detaillierte Anleitung zur Verwendung von zwei verschiedenen EEG-Erfassungssystemen (siehe Tabelle der Materialien ) zur Erkennung vonAnfällen (Abbildung 4 und Abbildung 5) in diesem Modell. Die Spektralleistung eines typischen Anfalls zeigt die höchste Dichte im Frequenzbereich von 10 bis 40 Hz mit einem Peak bei 15 Hz an (Abbildung 4). Die Mehrheit der Anfälle bei Mäusen sind krampfhaft, mit einer durchschnittlichen Dauer von 12 bis 15 s. Nur ein kleiner Bruchteil der Anfälle ist nicht krampfhaft. Ein gründlicher Vergleich der Vor- und Nachteile der Verwendung beider Anlagen wird im Abschnitt Diskussion ausführlich beschrieben. Darüber hinaus zeigt dieses Protokoll die Fristen für den Anfall bei Tieren nach wiederholtem Gewichtsabfall TBI und zeigt die Anfallsclusterbildung bei einigen Tieren(Abbildung 6), die die Bedeutung des Erwerbs kontinuierlicher statt intermittierender Aufnahmen hervorhebt, da dies eine genaue Schichtung von Tieren gewährleistet, die spontane Anfälle nach TBI von tieren entwickeln, die dies nicht tun. Wichtig ist, dass dieses Protokoll auch die Vor- und Nachteile von Nagetiermodellen von PTE und deren Fähigkeit, eine bestimmte Population von Menschen nach TBI darzustellen, diskutiert.

Abbildung 1: Das Mausmodell des sich wiederholenden diffusen TBI. (A) Gewicht-Drop-Gerät. (a1) Gewicht Tropfen Rohr. (a2) Eine 100 g Hantelstange. (a3) Pin, der die Stange hält. (a4) Schnur, um die Stange nach oben zu heben, wenn die Höhe geändert oder die Stange aus dem Gewichtsabfallrohr entfernt wird. (a5). Schaumstoffpad zum Platzieren des Tieres unter dem Gewichtstropfenrohr. (B) Gewicht-Drop-Verfahren. (b1) Die Edelstahlscheibe befindet sich in der Mitte des Kopfes zwischen der Linie der Augen und Ohren. (b2 und b3) Nach der visuellen Bestätigung, dass sich der Kopf des Tieres in der flachen Position befindet und das Schaumstoffpad bewegt wird, platziert sich der Kopf des Tieres unter dem Gewichtstropfenrohr. (b4) Lösen des Stifts, der die Gewichtsstange hält und die Mitte der Edelstahlscheibe trifft. (b5) Die Maus wird unmittelbar nach dem Aufprall und Bewusstseinsverlust auf ein steriles Handtuch gelegt, indem die Zeit gemessen wird, die das Tier braucht, um sich zu erholen und sich selbst zu rechtzurechten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
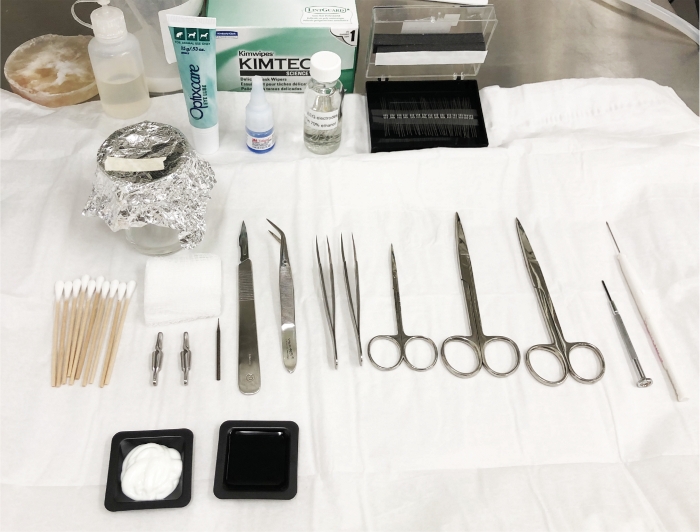
Abbildung 2: Chirurgische Feldvorbereitung und EEG-Elektrodenplatzierungsschema. Autoklavierte Werkzeuge und notwendige Materialien für die Operation und Elektrodenimplantation werden vor der Anästhesisierung des Tieres vorbereitet, um die Verfügbarkeit aller benötigten Teile zu gewährleisten. Dies ist eine sterile Zone und es ist zwingend erforderlich, diese Zone nicht mit nicht-sterilen Materialien zu kontaminieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
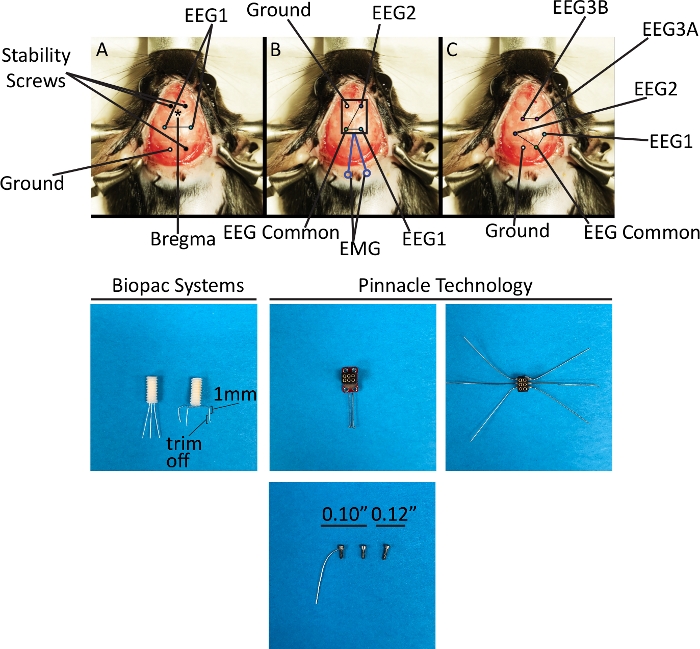
Abbildung 3: Stereotaktische Landmarken und schematische Darstellung der Elektrodenplatzierung mit EEG-System 1 und 2. Die obere Platte zeigt die Methoden zur Implantation der drei verschiedenen Kopfbefestigungen, die in diesem Protokoll beschrieben werden. (A) Einzelner EEG-Kanal, bipolare Montage. (B) Zwei EEG-Kanäle mit gemeinsamer Referenz, bipolare Montage und ein EMG-Kanal. (C) Drei EEG-Kanäle mit monopolarer (Kanal 1-2) und bipolarer (Kanal 3) Montage. Die untere Platte zeigt die Kopfbefestigungen und Schrauben, die wie in der oberen Platte implantiert werden. Die drei Arten von Schrauben, die in diesem Protokoll für zwei Zwecke verwendet werden: als Stabilitätsschrauben (EEG-System 1) oder sowohl Stabilität als auch als Elektrode (EEG-System 2). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Spontane Anfälle, die mit dem EEG-System 1 erworben wurden. Die obere Platte zeigt einen spontanen Anfall in einer Maus 23 Tage nach wiederholtem Gewichtsabfall TBI mit Daten, die mit 1EEG Headmount erfasst wurden. (A) Vor-eistische (Vorseizuree) Aktivität. (B) Ictal (Seizure) Aktivität. (C) Post-ictale (post-seizure) Depression. Untere Platte: Die Leistungsspektrumdichte wird mit benutzerdefinierten Skripts und Software berechnet (siehe Tabelle der Materialien). Mittelleistung = Durchschnittsleistung des Leistungsspektrums innerhalb der Epoche (Einheiten: V2/Hz). Medianfrequenz = Frequenz, bei der 50% der Gesamtleistung innerhalb der Epoche erreicht wird (Einheiten: Hz). Mittlere Frequenz = Frequenz, bei der die durchschnittliche Leistung innerhalb der Epoche erreicht wird (Einheiten: Hz). Spektralkante = Frequenz, unterhalb der ein benutzerdefinierter Prozentsatz der Gesamtleistung innerhalb der Epoche erreicht wird (Einheiten: Hz). Spitzenfrequenz = Frequenz, bei der die maximale Leistung während der Epoche auftritt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Spontane Anfälle, die mit DemEEG-System 2 erworben wurden. (A) Spontaner nicht krampfhafter (elektrografischer) Anfall in einer Maus 65 Tage nach wiederholtem Gewichtsabfall TBI. Daten, die mit 2EEG/1EMG Headmount erfasst wurden. (B) Spontaner Krampfanfall in einer Maus 97 Tage nach Gewichtsabnahme TBI. Daten, die mit 3EEG Headmount erfasst werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Zeitleiste der Anfallsinzidenz bei Mäusen nach wiederholtem Gewichtsabfall TBI. Der früheste Anfall wurde drei Wochen nach der Verletzung beobachtet. Einige Tiere entwickeln Cluster von Anfällen innerhalb des gleichen Tages gefolgt von mehreren Wochen ohne Anfälle. Tiere wurden bis zu vier Monate nach TBI registriert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Im Gegensatz zu CCI- und FPI-Modellen, die entweder fokale oder eine Kombination von fokalen und diffusen Verletzungen induzieren, ermöglicht das in diesem Protokoll beschriebene Modell des repetitiven diffusen TBI die Induktion diffuser Verletzungen ohne fokale Hirnverletzungen und erfordert keine Kopfhaut- oder Schädelöffnungen und die damit verbundene Entzündung. Ein zusätzlicher Vorteil des Fehlens von Kraniektomie in diesem Modell ist, dass es nicht nur erlaubt, die Elektroden für chronische kontinuierliche EEG-Aufnahme zu implantieren, sondern auch die Schaffung eines ausgedünnten Schädel Schädelfensters für chronische in vivo 2-Photonen-Bildgebung der Tiere vor, unmittelbar nach, und wiederholt für Tage, Wochen und sogar Monate nach TBI, wie in Shandra und Robel 2019beschrieben 13.
Unabhängig davon, welches Tiermodell gewählt wird, ist der gewählte Ansatz der Datenerfassung ein entscheidendes Element jeder erfolgreichen und umfassenden Studie. In Nagetiermodellen der posttraumatischen Epilepsie ist die Häufigkeit von Anfällen niedrig14, zwischen 0,3 bis 0,4 Anfällen pro Tag9,15, und die latente Periode vor dem ersten Anfall kann überall von Tagen oder Wochen bis sogar Monate nach dem ersten TBI-Verfahren dauern. Im Gegensatz zu nicht-traumatischen Modellen, bei denen die Zahl der Anfälle über einen kürzeren Zeitraum im Allgemeinen höher ist, werden im Durchschnitt nur 9 % der Tiere mit TBI über einen Zeitraum von bis zu sechs Monaten spontane Anfälle haben8,16. Dies deutet darauf hin, dass aussagekräftige Studien eine kontinuierliche Langzeit-Video-EEG-Aufzeichnung erfordern.
Das übergeordnete Ziel jedes Tiermodells von TBI ist es, die verschiedenen Formen von TBI bei menschlichen Patienten so genau wie möglich zu reproduzieren, um die zellulären und molekularen Mechanismen, die PTE zugrunde liegen, besser zu untersuchen. Die Techniken dieses Protokolls werden dazu beitragen, die Entdeckung therapeutischer Ziele, die Prüfung der Wirksamkeit und Verträglichkeit neuer präventiver und therapeutischer Kandidaten sowie die Entwicklung zuverlässiger Biomarker oder Prädiktoren von Epilepsie nach Tbi.
Potenzielle Herausforderungen während des Gewichtsabnahmeverfahrens
Da der Kopf nicht in einem stereotaktischen Rahmen fixiert ist, ist besonders darauf zu achten, dass kopf- und metallplatte flach positioniert ist. Wenn die gewichtete Stange die Metallplatte oder den Kopf in einem Winkel trifft oder wenn das Gewicht zur Seite des Mauskopfes abrutscht, unterscheidet sich die Verletzungsbiomechanik, was möglicherweise zu einer milderen oder gar keinen Verletzung führt. In der Vergangenheit wurde die Metallplatte an den Schädel geklebt, um die Variabilität zu minimieren. Jedoch, Entfernung der Metallplatte und Kleber aus der Maus Schädel nach Gewichtsabnahme, auch wenn mit Vorsicht durchgeführt, induzierte Schäden an den Hirninseln, was zu Gefäßschäden und anschließende Schäden am Gehirngewebe auch bei Scheintieren. Darüber hinaus erfordert der Schnitt Heilung, möglicherweise mit einer peripheren Immunantwort, die Variabilität führen könnte. Aus diesen Gründen wurde gewählt, die Verklebung der Metallplatte an den Schädel wegzulassen. Tiere können mit wiederholten (d. h. 3x in diesem Protokoll) Verletzungen sterben. Mäuse mit einem Körpergewicht unter 25 g vertragen möglicherweise keine wiederholten Stöße. Während einzelne Verletzungen fast nie zur Sterblichkeit führen, sterben bis zu 7% der C57BL/6-Tiere nach wiederholten Stößen9. Bei einigen Tieren sind motorische Defizite zu beobachten. Diese Defizite manifestieren sich als Hintergliedparese oder Ganganomalien. Dies ist in der Regel ein prognostischer Faktor für schlechte Erholung und es wird empfohlen, das Tier zu opfern. Anzeichen von Schmerzen oder Not sind Gewichtsverlust, schlechte Pflege, Dehydrierung, erhöhte Angst, niedrige oder fehlende explorative Aktivität (Hydrogel/ Erholung, Chow und/oder Nestlet bleiben unberührt). Rettungsanalgesie (0,1 mg/kg Buprenorphin) kann subkutan alle 8 h für drei Tage von TBI verabreicht werden, um die Schmerzen zu lindern und zu verhindern, dass das Tier den humanen Endpunkt erreicht. Subkutane Natriumlactatlösung (3 l pro Gramm des Gewichts des Tieres) kann zweimal täglich zur Hydratation verabreicht werden. Tiere erholen sich in der Regel innerhalb von drei Tagen nach TBI. Die Verwendung eines fünfstufigen Körperzustands-Scores (BCS) für die Tierüberwachung nach experimentellen Eingriffen wird empfohlen. Die Stadien umfassen (1) abgemagert (Skelettstrukturen sind extrem prominent, Wirbel extrem segmentiert); (2) Unterkonditioniert (Die Segmentierung der Wirbelsäule ist offensichtlich, dorsale Beckenknochen sind leicht spürbar); (3) Gut konditioniert (Wirbel und Rückenbecken sind nicht auffällig mit leichtem Druck spürbar); (4) Überkonditioniert (Die Wirbelsäule ist eine durchgehende Säule, Wirbel nur mit festem Druck spürbar); (5) Fettleibe (Maus ist glatt und sperrig, Knochenstruktur verschwindet unter Fleisch und subkutanem Fett). Der humane Endpunkt wird erreicht, wenn BCS 1-2, 20% oder mehr Gewichtsverlust in einer erwachsenen Maus im Vergleich zu seinem Pre-TBI Gewicht ist, Symptome von Schmerzen oder Bedrängnis werden nicht durch Analgetika gelindert, Anzeichen von Selbstverstümmelung, Symptome der Dehydrierung, Unterkühlung, Vorhandensein von neurologischen Defiziten (abnormaler Gang oder motorische Parese). Mehrere mögliche Ergebnisse der Verabreichung von Substanzen sollten berücksichtigt werden. Buprenorphin subkutan injiziert erreicht den ersten Höhepunkt seiner schmerzstillenden Wirkung bei 10 min nach Injektion17. Der erste Aufprall tritt Sekunden nach der Verabreichung von Buprenorphin auf, was darauf hindeutet, dass die erste Messung der Rechten wahrscheinlich nicht beeinträchtigt wird. Dies kann jedoch nicht vollständig als Variable ausgeschlossen werden. Daher wird Experimentiern empfohlen, ihr eigenes Urteil abzugeben. Wenn das Gewichtsabnahme-Verfahren durch stereotaktische Chirurgie gefolgt wird und Carprofen verabreicht wird, ist es wichtig zu beachten, dass Carprofen ein entzündungshemmendes Mittel ist, das die Anfallshäufigkeit beeinflussen kann, daher wird Experimentiern empfohlen, seine Verwendung sorgfältig zu prüfen.
Potenzielle Herausforderungen während der Operation
Das Risiko einer Kontamination oder Infektion wird mit der Verwendung von 70% Ethanol verringert, aber es führt nicht zu sterilen Bedingungen. Alternativ können sterile chirurgische Handschuhe verwendet werden. Allerdings ist der stereotaktische Apparat selbst nicht steril, so dass jede manuelle Manipulation zum Verlust des sterilen Zustands der Handschuhe führen wird. Daher ist das Sprühen mit 70% Ethanol nach Kontakt mit unsterilem Material während der Operation erforderlich. Das Bohren durch den Schädel in das Gehirn verursacht Schäden am Hirngewebe und kann zu stark blutenden Blutungen führen. Das Erstellen der Gratlöcher ist äußerst vorsichtig. Die Befestigung des Handbohrers im stereotaktischen Arm und das allmähliche Senken ist dem Bohren der Löcher vorgezogen, während der Bohrer manuell gehalten wird. Elektroden und Befestigungsschrauben können tiefer als geplant sinken und die Dura mater (subdurale Platzierung) oder den Kortex (kortikale Platzierung) verletzen. Dies kann zu stark blutenden Blutungen und einer fokalen Läsion führen. Der Experimentator muss eine Überhitzung des Tieres während der Operation vermeiden. Wenn der Temperatursensor nicht richtig fixiert ist, wird er die erforderliche Temperatur von 37 °C nicht beibehalten, was zu Überhitzung, Verbrennungen und manchmal zum Tod des Tieres führt. Die Augen des Tieres werden während der Operation trocken, gereizt oder beschädigt, wenn sie nicht geschmiert werden, sobald das Tier in den stereotaktischen Apparat gelegt wird.
Postoperative Überwachung
Die postoperative Überwachung beginnt unmittelbar nach Abschluss des Eingriffs oder der Operation. Beobachten Sie das Tier, bis es aus der Anästhesie erwacht und achten Sie auf das Vorhandensein oder Fehlen von chirurgischen Komplikationen, einschließlich Blutungen oder Parese. Wenn Blutungen aus dem unvollständigen Schnittverschluss beobachtet werden, befeuchten Sie das Tier, reinigen Sie die Blutungsstelle mit Chlorhexidin, führen Sie den Wundverschluss wie oben beschrieben durch und bringen Sie das Tier in den Erholungskäfig zurück. Etwa 1 x 2 h nach der Operation sollte das Tier vollständig aus der Anästhesie wach sein und sich frei im Käfig bewegen, ohne Anzeichen von Parese oder Schmerzen. Das Tier beginnt selbst zu pflegen, weshalb eine Versiegelung des Schnittes notwendig ist, um zu verhindern, dass das Tier ihn während der Pflege öffnet. Sobald sich das Tier erholt hat, überführen Sie es in den Käfig/die Kammer, die für die EEG-Datenerfassung verwendet wird. Dies wird es dem Tier ermöglichen, sich an die neue Umgebung zu gewöhnen. Dies ist besonders wichtig für die Langzeiterfassung (Monate). Der Tierkäfig muss ein Erholungsgel (siehe Tabelle der Materialien),befeuchtete Chow, ein Nestleund und eine Wasserflasche haben. Dies wird eine ordnungsgemäße Genesung ermöglichen und dem Tier Zugang zu Nährstoffen und Wasser verschaffen. Führen Sie die Überwachung des Tieres täglich fort. Die Bewertung muss a) eine sichtvisuelle Untersuchung des Verhaltens des Tieres auf Anzeichen von Schmerzen oder Ängsten, einschließlich Gewichtsverlust, schlechte Pflege, erhöhte Angst, geringe oder fehlende Explorativaktivität (Hydrogel/Recovery, Chow und/oder Nestlet bleiben unberührt) und eine ordnungsgemäße Heilung des Einschnittbereichs um das EEG-Implantat umfassen; b) Bewertung des BCS auf Anzeichen von Dehydrierung und Unterernährung; c) Gewicht des Tieres. Verabreichen Sie die Natriumlaktatlösung (3 l pro Gramm des Gewichts des Tieres) subkutan, wenn das Tier Anzeichen einer Dehydrierung aufweist (siehe Materialtabelle). Buprenorphin (0,1 mg/kg) subkutan verabreichen, wenn das Tier Anzeichen von Schmerzen oder Schmerzen zeigt. Wenn Anzeichen von Schmerzen anhalten, kann Buprenorphin alle 8 h verabreicht werden. Die Überwachung muss auf zweimal täglich erhöht werden, wenn ein Tier Anzeichen von Schmerzen und/oder Schmerzen zeigt. Lassen Sie das Tier nach einer EEG-Operation mindestens drei Tage lang erholen, bevor es über einen Tether an das Erfassungssystem angeschlossen wird. Die humanen Endpunktkriterien sind die gleichen wie bei potenziellen Herausforderungen während des oben genannten Gewichtsabnahmeverfahrens.
Vor- und Nachteile von Erfassungssystemen und Headmounts
Der Hauptvorteil des EEG-Systems 1 mit einem einzigen EEG-Kanalkopfist sind die relativ niedrigen Kosten für Hardware, Komponenten und Service. Die einfache und unkomplizierte Konfiguration ermöglicht es Benutzern auch, das System an ihre Vorlieben anzupassen. Jeder Differenzverstärker verfügt über einen einzigen EEG-Kanal, obwohl mehrere Differenzverstärker miteinander verbunden werden können, wodurch die Anzahl der Kanäle für jedes Tier erhöht wird. In diesem System wurde eine Einkanalkonfiguration pro Tier verwendet, um chronische Langzeit-EEG-Aufnahmen von 20 Tieren gleichzeitig zu erfassen. Posttraumatische Anfälle sind in der Regel verallgemeinert, und mit einer bilateralen bipolaren Montage der Elektroden ist es einfach, diese Art von epiptiformer Aktivität zu erkennen. Der Nachteil dieses Ansatzes besteht jedoch darin, dass es unmöglich ist, Fokalität, Lateralisierung oder die Ausbreitung von epiptiformer Aktivität zuverlässig zu erkennen, da dies mehrere Kanäle erfordern würde. Eine weitere potenzielle Herausforderung kann die Lärmkontamination des einzelnen Kanals im Laufe der Zeit sein, wodurch er nicht in der Lage ist, nützliche Daten vom Tier zu erhalten. Dies kann durch die Kombination von zwei oder mehr Differentialverstärkern überwunden werden, die die Anzahl der Kanäle pro Tier verdoppelt. Schließlich sind Daten, die von einem einzigen Kanal erfasst werden, schwieriger von potenziellen Artefakten zu unterscheiden, und epileptiforme Aktivität wird am besten durch Videoaufzeichnungen des Verhaltens des Tieres unterstützt. Aus diesem Grund kombinierten alle Aufnahmen eine synchronisierte kontinuierliche Videoüberwachung mit EEG-Erfassung. Eine Einschränkung dieses Systems und seiner Software ist, dass es das Videoerfassungssystem nicht enthält und daher ein benutzerdefiniertes Drittanbietersystem für den Erwerb von synchronem Video erfordert.
Der große Vorteil des EEG-Systems 2 mit Mehrkanal-Kopfhalterungen ist die hohe Qualität des Signals durch die Vorfilterung des aufgenommenen Signals durch den Vorverstärker (siehe Materialtabelle) vor der Überführung durch den Kommutator zum Verstärker. Die Verstärker in diesem System ermöglichen die Erfassung von Daten in drei Kanälen in den folgenden Konfigurationen: 2 EEG+1 EMG-Kanäle oder drei EEG-Kanäle (siehe Materialtabelle). Dies ermöglicht nicht nur die Detektion von generalisierter Aktivität, sondern potenziell auch fokale epileptiforme Aktivität. Ein weiterer großer Vorteil ist, dass dieses System speziell für die Tierforschung entwickelt wurde und somit ein Videoaufzeichnungssystem und eine Software bietet, die das EEG und Videokanäle für bis zu vier Tiere in einer einzigen Datei synchronisieren können, was die Analyse einfacher und bequemer macht als das EEG-System 1. Dieses System ist einfach für die Erfassung von Daten für die Anfalls- und Schlafanalyse ohne Änderungen am System zu verwenden, die nicht die Art der verwendeten Kopfhalterung sind. Der 2EEG/1EMG Kopfhalter erlaubt die Implantation der Elektroden aufgrund der Größe und Konfiguration der Leiterplatte nur an festen Stellen. Die Schneckenelektroden mit Drahtleitungen in 3EEG-Kopfhalterungen ermöglichen Flexibilität bei der Implantation an der gewünschten Stelle mit der Möglichkeit, je nach Ort der Referenzelektrode entweder monopolare oder bipolare Erfassung zu tätigen. Die Implantation des 3EEG-Kopfteils erfordert jedoch ein Löten, was der Operation mehr Schritte hinzufügt und zusätzliche Vorsicht und Präzision erfordert. Die Verbindungs- und Vorverstärker wurden speziell für kleine Nagetiere wie Mäuse und unreife Ratten entwickelt und sind dünne, gewichtsarme Kabel, die wenig Druck auf den Kopf des Tieres verursachen. Ein Nachteil des Systems sind die relativ hohen Kosten für Hardware, Software, Videolizenz und Komponenten (z. B. Vorverstärker und Headmounts).
Bedeutungunds- und kritische Schritte bei der EEG-Datenerfassung
Der Kommutator verfügt über einen rotierenden Mechanismus, der es dem Tether ermöglicht, sich je nach Bewegungsrichtung des Tieres zu drehen. Wenn dieser Mechanismus fehlschlägt, wird die Bewegung des Tieres eingeschränkt, was zur Entfernung der EEG-Kappe führen kann. Wiederholte Operationen, um neue Elektroden zu platzieren, können versucht werden. Dies kann jedoch eine Herausforderung oder unmöglich sein, wenn die Entfernung der vorherigen EEG-Kappe Schäden am Schädel und am Gehirn verursacht hat. Die Abtastrate bei der EEG-Datenerfassung muss mindestens 2 x 2,5 x die höchste Zinshäufigkeit betragen. Höhere Abtastraten führen zu einer höheren Auflösung der Daten zum Preis einer Vergrößerung der Dateigröße, die beim Erwerb kontinuierlicher Aufzeichnungen mehrerer Tiere schwer zu speichern und zu verarbeiten sein kann. Daher ist es notwendig, die Abtastrate auf ein Niveau zu optimieren, das es ermöglicht, die notwendigen Daten ohne Qualitätsverlust zu erhalten und gleichzeitig die Dateigrößen zu minimieren.
Bedeutung und kritische Schritte bei der Videodatenerfassung
Bei Nagetieren, wie beim Menschen, kann sich PTE mit einer großen Variabilität in der zugehörigen Symptomatologie und elektrographischen Korrelationen manifestieren, so dass es notwendig ist, während der EEG-Erfassung ein simultanes Video zu erhalten, um die beobachteten EEG-Ereignisse richtig zu interpretieren und zu klassifizieren. Die Interpretation von EEG-Daten ohne synchronisiertes Video ist besonders anspruchsvoll, wenn ein einzelner EEG-Kanal verwendet wird. In diesem Fall kann es schwierig sein, festzustellen, ob die EEG-Wellenform ein Artefakt ist, es sei denn, andere Beweise (Video) unterstützen die Klassifizierung als Anfall. Bewegungsartefakte können dem elektrografischen Muster des Anfalls ähneln. Daher ist Video mit oder ohne EMG-Bestätigung voraussetzung. Während Die Videoaufzeichnung sowohl während heller als auch dunkler Zyklen durchgeführt wird, ist die Videoqualität während der dunklen Stunden möglicherweise nicht immer zufriedenstellend und klar. Darüber hinaus kann es schwierig sein, sein Verhalten zu beurteilen, wenn das Tier während des ictalartigen EEG-Ereignisses von der Kamera abgewiesen wird. In diesen Fällen kann der Erwerb eines Elektromyographie-Signals (EMG) zusätzlich zu EEG und Video die Herausforderung lösen, indem Informationen über die Muskelaktivität bei milderen Verhaltensanfällen (mit niedrigen motorischen Komponenten) zur Verfügung gestellt werden oder um den Mangel an Tierbewegung bei abwesenheitsähnlichen Spike-and-Slow-Wave-Entladungen auf dem EEG zu bestätigen. Die potenziellen Herausforderungen mit dem EMG-Kanal ähneln den Herausforderungen mit den EEG-Kanälen, wie z. B. Lärmkontamination, falsche Platzierung von Elektroden oder die sich lösenden Elektroden (oder der Verlust des Oberflächenkontakts) über die längere Zeit der Aufnahme. Die Verwendung von Video zusammen mit der EEG-Analyse hat zwei Ziele: zu bestätigen, dass ein EEG-Ereignis kein Artefakt ist, das durch die Bewegung des Tieres verursacht wird (exploratives Verhalten, Trinken, Kauen, Kratzen, Dehnen, Pflegen oder schnelle/arbeitsfähige Atmung) und zwischen krampfhaften und nicht krampfhaften Krampfanfällen zu unterscheiden. Es wird empfohlen, eine modifizierte Racine-Skala zur Charakterisierung krampfhierender oder nicht krampfhatiger Anfälle zu verwenden. Die Stufen umfassen (0) Reine elektrografische Annahme ohne erkennbare motorische Manifestation; (1) Orofaziale Automatismen und Kopfnicken; (2) Forelimb-Kofon-Ruck; (3) Bilateraler Vorder-Klonus; (4) Vorderklinclonus und Aufzucht; (5) Vorhutklon mit Aufzucht und Fall. Jeder Videokanal muss die gesamte Oberfläche mit dem Tier im Käfig, einem Etikett mit einer Tieridentifikationsnummer, einer Wasserflaschenspitze, einem Futter und einem Diät-/Erholungsgel deutlich anzeigen. Verwenden Sie eine Infrarot-Nachtquelle, um die Videoaufnahme während der dunklen Stunden sicherzustellen. (Einige Kameras verfügen über integrierte Geräte oder benötigen möglicherweise zusätzliche Teile. Siehe Materialtabelle). Passen Sie den Frame pro Sekunde und die Bildauflösung an. Die höhere Bildrate und Auflösung werden auf Kosten größerer Dateigröße verursacht. Zu den Hauptnachteilen des Erwerbs von Videos bei längeren chronischen kontinuierlichen Experimenten gehören die Notwendigkeit, sehr große Datenmengen zu speichern, und die technischen Schwierigkeiten bei der Verarbeitung der großen Dateien. Auch die Fähigkeit des Experimentators, die Verhaltensdaten zusammen mit EEG effektiv zu interpretieren, muss berücksichtigt werden.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde von R01 NS105807/NS/NINDS NIH HHS/United States und CURE auf der Grundlage eines Stipendiums, das CURE vom United States Army Medical Research and Materiel Command, Department of Defense (DoD), im Rahmen des Forschungsprogramms für psychische Gesundheit und traumatische Hirnverletzungen unter dem Award No erhielt. W81XWH-15-2-0069. Ivan Zuidhoek wird sehr geschätzt für das Korrekturlesen des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.10" screw | Pinnacle Technology Inc., KS, USA | 8209 | 0.10 inch long stainless steel |
| 0.10" screw | Pinnacle Technology Inc., KS, USA | 8403 | 0.10 inch long with pre-soldered wire lead |
| 0.12" screw | Pinnacle Technology Inc., KS, USA | 8212 | 0.12 inch long stainless steel |
| 1EEG headmount | Invitro1 (subsidiary of Plastics One), VA, USA | MS333/8-A/SPC | 3 individually Teflon-insulated platinum iridium wire electrodes (twisted or untwisted, 0.005 inch diameter) extending below threaded plastic pedestal |
| 2EEG/1EMG headmount | Pinnacle Technology Inc., KS, USA | 8201 | 2EEG/1EMG channels |
| 3% hydrogen peroxide | Pharmacy | ||
| 3EEG headmount | Pinnacle Technology Inc., KS, USA | 8235-SM-C | custom 6-Pin Connector for 3EEG channels |
| Buprenorphine | Par Pharmaceuticals, Cos. Inc., Spring Valley, NY, USA | 060969 | |
| Buprenorphine | Par Pharmaceuticals, Cos. Inc., Spring Valley, NY, USA | 060969 | |
| C57BL/6 mice | Harlan/Envigo Laboratories Inc | male, 12-16 weeks old | |
| C57BL/6 mice | The Jackson Laboratory | male, 12-16 weeks old | |
| Carprofen | Zoetis Services LLC, Parsippany, NJ, USA | 026357 | NOTE: this drug is added during weight drop only if stereotactic electrode implantation will be performed on the same day |
| Chlorhexidine antiseptic | Pharmacy | ||
| Dental cement and solvent kit | Stoelting Co., USA | 51459 | |
| Drill | Foredom | HP4-917 | |
| Drill bit | Meisinger USA, LLC, USA | HM1-005-HP | 0.5 mm, Round, 1/4, Steel |
| Dry sterilizer | Cellpoint Scientific, USA | Germinator 500 | |
| EEG System 1 | Biopac Systems, CA, USA | ||
| EEG System 2 | Pinnacle Technology Inc., KS, USA | ||
| Ethanol ≥70% | VWR, USA | 71001-652 | KOPTEC USP, Biotechnology Grade (140 Proof) |
| Eye ointment | Pro Labs Ltd, USA | Puralube Vet Ointment Sterile Ocular Lubricant available in general online stores and pharmacies | |
| Fluriso liquid for inhalation anesthesia | MWI Veterinary Supply Co., USA | 502017 | |
| Hair removal product | Church & Dwight Co., Inc., USA | Nair cream | |
| Isoflurane | MWI Veterinary Supply Co., USA | 502017 | |
| Povidone-iodine surgical solution | Purdue Products, USA | 004677 | Betadine |
| Rimadyl/Carprofen | Zoetis Services LLC, Parsippany, NJ, USA | 026357 | |
| Solder | Harware store | ||
| Soldering iron | Weller, USA | WP35 | ST7 tip, 0.8mm |
| Stainless steel disc | Custom made | ||
| Sterile cotton swabs | |||
| Sterile gauze pads | Fisher Scientific, USA | 22362178 | |
| Sterile poly-lined absorbent towels pads | Cardinal Health, USA | 3520 | |
| Tissue adhesive | 3M Animal Care Products, USA | 1469SB |
Referenzen
- Christensen, J., et al. Long-term risk of epilepsy after traumatic brain injury in children and young adults: a population-based cohort study. Lancet. 373 (9669), 1105-1110 (2009).
- Lowenstein, D. H. Epilepsy after head injury: an overview. Epilepsia. 50, Suppl 2 4-9 (2009).
- Ferguson, P. L., et al. A population-based study of risk of epilepsy after hospitalization for traumatic brain injury. Epilepsia. 51 (5), 891-898 (2010).
- Abou-Abbass, H., et al. Epidemiology and clinical characteristics of traumatic brain injury in Lebanon: A systematic review. Medicine (Baltimore). 95 (47), 5342(2016).
- Management of Concussion/mTBI Working Group. VA/DoD Clinical Practice Guideline for Management of Concussion/Mild Traumatic Brain Injury. The Journal of Rehabilitation Research and Development. 46 (6), 1-68 (2009).
- Piccenna, L., Shears, G., O'Brien, T. J. Management of post-traumatic epilepsy: An evidence review over the last 5 years and future directions. Epilepsia Open. 2 (2), 123-144 (2017).
- Loscher, W., Brandt, C. Prevention or modification of epileptogenesis after brain insults: experimental approaches and translational research. Pharmacological Reviews. 62 (4), 668-700 (2010).
- Ostergard, T., Sweet, J., Kusyk, D., Herring, E., Miller, J. Animal models of post-traumatic epilepsy. Journal of Neuroscience Methods. 272, 50-55 (2016).
- Shandra, O., et al. Repetitive Diffuse Mild Traumatic Brain Injury Causes an Atypical Astrocyte Response and Spontaneous Recurrent Seizures. Journal of Neuroscience. 39 (10), 1944-1963 (2019).
- Foda, M. A., Marmarou, A. A new model of diffuse brain injury in rats. Part II: Morphological characterization. Journal of Neurosurgery. 80 (2), 301-313 (1994).
- Marmarou, A., et al. A new model of diffuse brain injury in rats. Part I: Pathophysiology and biomechanics. Journal of Neurosurgery. 80 (2), 291-300 (1994).
- Paxinos, G., Keith, B. J., Franklin, M. The Mouse Brain in Stereotaxic Coordinates. , Elsevier Science. (2007).
- Shandra, O., Robel, S. Imaging and Manipulating Astrocyte Function In Vivo in the Context of CNS Injury. Methods in Molecular Biology. 1938, 233-246 (2019).
- Pitkanen, A., Immonen, R. Epilepsy related to traumatic brain injury. Neurotherapeutics. 11 (2), 286-296 (2014).
- Kharatishvili, I., Nissinen, J. P., McIntosh, T. K., Pitkanen, A. A model of posttraumatic epilepsy induced by lateral fluid-percussion brain injury in rats. Neuroscience. 140 (2), 685-697 (2006).
- Pitkanen, A., Bolkvadze, T., Immonen, R. Anti-epileptogenesis in rodent post-traumatic epilepsy models. Neuroscience Letters. 497 (3), 163-171 (2011).
- Gades, N. M., Danneman, P. J., Wixson, S. K., Tolley, E. A. The magnitude and duration of the analgesic effect of morphine, butorphanol, and buprenorphine in rats and mice. Journal of the American Association for Laboratory Animal Science. 39 (2), 8-13 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten