Method Article
在重复性扩散创伤性脑损伤小鼠模型中诱导创伤后癫痫
摘要
此系统协议描述了重复性轻度创伤性脑损伤后创伤后癫痫的新动物模型。第一部分详细介绍了使用修改后的降重模型进行创伤性脑损伤诱导的步骤。第二部分对单通道和多通道脑电图数据采集系统的手术方法进行了说明。
摘要
创伤性脑损伤(TBI)是后天性癫痫的主要原因。TBI 可导致焦点或扩散性脑损伤。焦点损伤是直接机械力的结果,有时穿透颅骨,在脑组织中产生直接病变。这些在脑成像过程中可见,作为有挫伤、撕裂和出血的区域。焦点病变导致神经元死亡和胶质疤痕的形成,并且存在于所有发生 TBI 的 20% -25% 的人的中。然而,在大多数TBI病例中,损伤是由加速减速力和随后的组织剪切引起的,导致非焦、漫反射损伤。TBI患者的亚群在几个月或几年的潜伏期后继续发展创伤后癫痫(PTE)。目前,无法预测哪些患者会患上PTE,PTE患者的癫痫发作难以控制,需要进一步研究。直到最近,该领域仅限于两个经过验证的自发创伤后发作的动物/啮齿动物模型,两者都出现大的焦点病变,皮层和有时皮下结构组织大量丧失。与这些方法相反,确定使用改良的降重模型诱导的漫射TBI足以启动自发性惊厥和非抽搐发作的发展,即使在没有焦点病变或组织损失的情况下也是如此。与获得性创伤后癫痫的人类患者类似,该模型在发作前呈现损伤后的潜伏期。在该协议中,将为社区提供创伤后癫痫的新模型,详细说明如何诱导扩散性非病变TBI,然后持续进行持续的长期视脑动物监测,持续几个月。该协议将详细说明动物处理、重量下降程序、两个采集系统的电极放置,以及手术、术后监控和数据采集过程中遇到的频繁挑战。
引言
每年,TBI 影响全世界大约 6000 万人。受影响的个人患癫痫的风险较高,癫痫发作后数年可能显现出来。虽然严重的TBI与较高的癫痫风险有关,即使是轻微的TBI也会增加个人患癫痫的几率1,2,3,4。所有 TI 都可以分类为焦距、漫反射或两者的组合。扩散性脑损伤,存在于许多(如果不是全部)的TbIs中,是由于加速减速和旋转力导致不同密度的脑组织相互剪切的结果。根据定义,扩散损伤只发生在轻度/脑震荡非穿透性脑损伤中,其中在计算机断层扫描5中看不到脑损伤。
目前,在管理患有或有发生创伤后癫痫(PTE)风险的患者方面,存在两个关键问题。第一,一旦PTE出现,癫痫发作对现有的抗癫痫药物(AEDs)有抗药性6。其次,AED在预防癫痫发作方面同样无效,没有有效的替代治疗方法。为了解决这个缺陷,并找到更好的治疗目标和治疗候选,有必要在PTE6的根部探索新的细胞和分子机制。
创伤后癫痫的一个突出特征是初始创伤事件与自发、无端、复发性发作之间的潜伏期。在这个时间窗口内发生的事件是研究人员的自然焦点,因为这个时间窗口可能允许治疗和预防PTE完全。动物模型最常用于这项研究,因为它们提供了几个截然不同的好处,其中最重要的是,在如此长的时间跨度内,持续监测人类患者既不切实际又昂贵。此外,只有在动物模型中才能探索癫痫发生根源的细胞和分子机制。
与在TBI后通过不太相关的生理相关手段(如通过化学惊厥或急性、慢性或点燃引起电刺激)诱导癫痫发作的模型比较,具有自发创伤后癫痫的动物模型更可取。自发的创伤后癫痫发作模型测试TBI如何改变导致癫痫发作的健康大脑网络。在TBI后使用额外刺激的研究评估接触TBI如何降低癫痫发作阈值并影响癫痫发作的易感性。具有化学或电刺激诱导发作的动物模型的优点是测试耐火性对AED的具体机制以及现有和新型AED的功效。然而,这些数据对人类的相关性和翻译程度可能不明确7,原因如下:1) 癫痫发作机制可能与仅由TBI引起的发作机制不同;1) 癫痫发作机制可能不同于TBI单独诱发的机制。2) 并非所有这些模型导致自发性发作7;3) 由抽搐剂本身产生的病变,其传递所需的管状,或通过刺激电极放置在深度结构(例如,海马或杏仁核)已经可能导致增加的癫痫易感性,甚至海马癫痫表场电位7。此外,一些抽搐剂(即开酸)产生直接的海马病变和硬化症,这在扩散TBI后并不常见。
直到最近,只有两种创伤后癫痫的动物模型存在:受控皮质撞击(CCI,焦)或流体打击损伤(FPI,焦和扩散)8。这两种模型导致大的焦点病变,同时组织损失,出血,和胶质瘤在啮齿动物8。这些模型模仿由大焦点病变引起的创伤后癫痫。最近的一项研究表明,重复(3倍)扩散TBI足以在小鼠中发展自发性发作和癫痫,即使没有焦点病变9,增加了第三个啮齿动物PTE模型与确认的自发性复发性发作。这种新模型模仿由漫射TBI引起的细胞和分子变化,更好地代表轻度脑震荡TBI人群。在此模型中,癫痫发作前三周或以上的潜伏期以及晚期、自发性、复发性发作的出现,有助于调查创伤后癫痫发生的根本原因,测试预防方法的有效性和癫痫发作后的新治疗候选者,并有可能开发创伤后癫痫发生的生物标志物,因为大约一半的动物会发展成创伤后癫痫。
研究创伤后癫痫的动物模型的选择取决于科学问题、所调查的脑损伤类型以及将用什么工具来确定潜在的细胞和分子机制。最终,任何创伤后癫痫模型都必须证明TBI后自发性癫痫发作的出现和TBI动物的初期潜伏期,因为并非所有发生TBI的患者都会发展成癫痫。为此,该协议使用同时视频采集的脑电图(EEG)。了解数据采集硬件和方法背后的技术方面对于准确解释数据至关重要。关键硬件方面包括记录系统的类型、电极类型(螺钉或导线引线)及其材料、同步视频采集(作为 EEG 系统的一部分或第三方)以及计算机系统的属性。根据研究目标、感兴趣的脑电图事件、进一步分析方法和数据存储的可持续性,在任何类型的系统中设置适当的采集参数势在必行。最后,必须考虑电极配置(蒙太奇)的方法,因为每种方法都有优缺点,会影响数据解释。
该协议详细介绍了如何使用经过改进的Marmarou降压模型10,11诱导扩散损伤,导致小鼠自发的、无端的、复发性发作,描述了使用单极、双极或混合蒙太奇获得单通道和多通道连续和同步视频EEG的手术方法。
研究方案
本议定书中描述的所有动物程序均按照弗吉尼亚理工大学机构动物护理和使用委员会(IACUC)执行,并符合美国国家卫生研究院的《实验室动物护理和使用指南》。.
1. 动物处理协议
注:本协议旨在将从供应商订购的动物在抵达后安排到设施,并规定它们由实验者处理。这通过减少压力和焦虑来改善动物福祉,并简化某些需要处理动物的程序,包括诱导TBI、术后监测以及将动物连接到采集系统。
- 当从供应商那里接收到许多动物时,耳标并随机将它们分配给实验组 (TBI) 或对照组(沙姆手术),同时将它们组合在 2-5 只动物的笼子里。房子TBI动物与假动物分开,因为假老鼠偶尔会对接受TBI的老鼠采取积极行动。
- 处理第 1 天(耳挂后 24–48 小时):准备记录动物耳标、出生日期、处理日期、处理日期的动物重量、处理时间以及评论和观察部分的图表。
- 用双手轻轻杯住动物。不要抓住动物的尾巴,因为它诱导防御机制和压力反应。
- 检查并记录动物的耳标。
- 将动物放在容器中的重量秤上并记录重量。
- 再次用双手轻轻将动物杯起,并处理1分钟,让它在手中移动和探索。在手术室的长凳上执行,小心不要把动物扔到地板上。
- 处理1分钟后,将动物放回笼子里。
- 对笼子里的其他动物重复步骤1.3×1.7。
- 处理第 2 天(第二天):重复步骤 1.2_1.5。
- 再次用双手轻轻将动物杯起,并处理2分钟,让它在手中移动和探索。在手术室的长凳上执行,小心不要把动物扔到地板上。
- 处理2分钟后,将动物放回笼子里。
- 对笼子里的其他动物重复步骤1.10_1.11。
- 处理第 3 天(第二天):重复步骤 1.2_1.5。
- 再次用双手轻轻将动物杯起,并处理4分钟,让它在手中移动和探索。在手术室的长凳上执行,小心不要把动物扔到地板上。
- 处理4分钟后,将动物放回笼子里。
- 对笼子里的其他动物重复步骤1.14~1.15。
- 处理第 4 天(控制日,从处理第 1 天开始 1 周):重复步骤 1.2_1.5。
- 再次用双手轻轻将动物杯起,并处理4分钟,让它在手中移动和探索。在手术室的长凳上执行,小心不要把动物扔到地板上。
- 4分钟后处理后,将动物放回笼子里。
- 对笼子里的其他动物重复步骤1.18-1.19。
注: 控制处理日测试三天处理协议后平静行为的保留。
2. 重量下降程序
- 将鼠标放入感应室。将氧气和真空流量设置为 1 L/min,将氮气水平设置为 3%-5%。麻醉鼠标5分钟。
- 将鼠标从感应室中取出,并将其放在泡沫垫上。测试是否对脚趾或尾部捏合没有响应。
- 下皮授镇痛药(0.1毫克/千克丁丙诺啡)。如果同一天进行脑电图手术,则与非类固醇抗炎卡洛芬(5mg/kg)结合使用皮下布丙诺啡。
- 在上次撞击之前或之后,在皮下施用乳酸钠溶液(每克动物体重3微克)。乳酸钠溶液可与镇痛剂混合,可在单次注射中快速给药。
注:乳酸钠溶液含有氯化钠、氯化钾、氯化钙和乳酸钠的混合物。此步骤有助于更换液体和电解质,有助于恢复。 - 将鼠标头置于重量下降管下(图 1A),并将一个扁平不锈钢圆盘(直径 1.3 厘米、1 毫米厚、880 mg 重量)放在头部中心、眼睛和耳朵线之间。
注:此圆盘将冲击扩散到头骨表面(图1B)。 - 拆下重量下降管中的销,从 50 厘米的高度松开 100 g 重量杆。要引起对照鼠的假伤,请从管中取出重量棒,以防止销意外释放和重量下降。
注:动物的头部必须平放,以便杆自由落在圆盘的整个表面上。 - 将无意识的动物放在背部以恢复,放在用无菌多边形吸水毛巾覆盖的加热垫上。正确的反射恢复时间(即,鼠标从它的背部正确的时间)可以测量为无意识时间的读出。
- 当动物恢复知觉时,将其放在一个干净的笼子里,放在加热垫上,用回收凝胶和一些润湿的小块来恢复45分钟。动物过热可以证明是恢复的一大障碍,就像让老鼠变得太冷一样。
- 45分钟后,重复步骤2.1~2.8两次,省略步骤2.3(即服用镇痛药和消炎药)。
- 如果在同一天进行脑电图电极植入手术,允许动物恢复1⁄2小时。
3. 脑电图电极植入的手术现场准备
注:手术前对手术工具和螺钉进行高压灭菌。在接触动物、非无菌材料之前和之后,以及在处理动物之间,喷洒和摩擦70%乙醇,清洁手术手套。在动物之间的珠消毒器中消毒手术工具2~3分钟(见材料表)。在将新动物放入立体定向装置之前,先更换无菌窗帘。确保手术现场包含手术所需的所有组件(图2)。在此模型中,没有侵入性外科手术诱导TBI有几个优点:1) 电极的植入是灵活的,可以在TBI的同一天或一定时间之后进行;2)动物的恢复时间较快;3) 颅骨完好无损,允许更多的表面积和弹性植入电极。
- 在感应室中用3%~5%的等值气体麻醉小鼠5分钟。
- 将鼠标从感应室转移到立体定向装置,并将其放在加热垫上的无菌窗帘上,其异法气体和真空管连接到鼻锥。
- 在手术过程中,将体温保持在37°C。放置温度传感器,使其与鼠标的胸部或腹壁接触。
- 使用耳杆将动物的头部固定到位。
- 在手术平面中保持麻醉在1.5%~3.5%的异常或±60呼吸/分钟(对脚趾或尾部捏合无反应)。
- 在动物的眼睛上涂上眼膏,使其在整个手术过程中保持润滑。
- 在单次注射中混合服用镇痛药(0.1毫克/千克丁丙诺啡)和非类固醇消炎药(5mg/kg卡洛芬),除非TBI在一天早些时候进行,在这种情况下,动物已经接受了镇痛药和抗炎药。
注: 如果第一次TBI和EEG放置手术之间的时间超过8小时,或者如果动物在第一次施用后8小时出现疼痛迹象,则应再次施用布丙诺啡,但应不添加卡洛芬。 - 下皮下施用乳酸钠溶液(每克动物重量3微克),以取代动物体内的液体和电解质。
注:如果在 TBI 之后立即进行手术,此步骤必须正确定时。乳酸钠溶液应每2小时施用一次,而动物接受手术,手术后一次,从前一次注射2小时。 - 使用脱毛霜从头皮上去除头发。
- 在进行切口之前,用波维多-碘手术防腐剂和70%乙醇在交替拭子中用无菌纱布垫在圆周运动3x(每次20s)对头皮的皮肤进行消毒。
- 使用手术刀,使头皮中线从眼睛上方到头部后部进行玫瑰色切口。这种头皮开口的方法比切断头皮更可取,因为皮肤皮瓣可以密封在EEG帽上或周围,提供更大的稳定性。
注:在准备头骨植入 3-EEG 头座时,需要切断头皮,因为头部安装的大小不允许在头部上关闭皮瓣。 - 通过在打开的皮肤边界上应用小的切口来扩展切口区域。如果切口后出现出血,请使用无菌棉纱布或棉签清洁。
- 用手术刀轻轻去除颅骨上的膜膜。如果在此步骤中发生任何出血,用无菌棉签按出血部位,直到停止。
- 使用无菌棉签用过氧化氢清洁颅骨,但避免接触裸露的颅区周围的软组织。重复此步骤,直到从任何软组织中清除颅骨,并具有白色外观。
- 用无菌纱布或棉签干燥颅骨。
注:步骤 3.12_3.15 对于正确固定电极和牙科水泥非常重要。任何软组织、非烧焦性出血和碎屑都可能导致感染、头部固定不稳定、信号失真或缺失,以及手术后几天或几周内植入物丢失。
4. 电极放置
- 植入单个 EEG (1EEG) 通道头座。
注:立体定向坐标中的缩写表示空间关系,并指定目标与动物头部给定方向的bregma的距离(以毫米为单位):前后方(AP)和中侧(ML)。由于所有电极都放置在硬膜外空间,而不是大脑内的某种结构中, 因此,Dorsal-evental 在该协议中不适用(图 3).Vin® 是一个有源电极,Vin-是其参考电极。- 使用钢位(0.5 mm、圆形、1/4 英寸)的高速钻头,以 ±5,000~6,000 发/分钟 (rpm) 的速度创建六个毛刺孔(三个用于稳定螺钉,三个用于电极),使用提供的立体定向坐标12。对于两个前螺钉:AP = ±1.5 mm,ML = ±1.5 mm;对于一个后螺钉:AP = -5.2 mm,ML = -1.5 mm;用于接地电极:AP = -5.2 mm,ML = ±1.5 mm;用于记录电极:AP = -2.3 mm,ML = [2.7 mm,右侧为 Vin],Vin- 向左。
- 添加三个螺钉,以提高头部阶段的稳定性。使用螺丝刀,将螺钉转动 1⁄1.5 x,每个螺钉在颅骨中固定。
注:将螺钉放置得更深会损害大脑。 - 将 1EEG 头端插入立体定向支架臂中,并定位头端,以便三个电极位于颅中线。在此配置中,接地电极及其在头座顶部各自的开口位于背面,Vin+ 电极位于中间,Vin-电极位于前部。可以在头部安装上用永久标记做标记。
- 将每个电极弯曲 90°,使每根导线的末端向下弯曲,并位于相应的毛刺孔上方。然后,测量现在垂直于毛刺孔的导线部分的 1 mm 长度,并修剪多余的部分(图 3)。这将确保电极的硬膜外放置。电极应勉强接触杜拉母体表面。
- 降低头部安装并调整所有三个电极以匹配相应的毛刺孔。对于硬膜外记录,电极必须放置在上方或几乎不接触 dura 母体。
- 将 1/2 勺粉末与几滴溶剂混合,准备牙科水泥用于应用。使用混合铲子和搅拌,直到最后的混合物是腻子状,俗气,但可塑性,和足够硬,足以正确浓缩时,放置在动物的颅骨。
- 涂抹覆盖所有螺钉和电极的牙科水泥混合物,等待 ±3⁄5 分钟,使其凝固。确保不要用牙科水泥盖住塑料底座,因为用绳子将动物连接到交换器是不可能的。
- 通过连接塑料底座周围的皮瓣,释放固定皮肤皮瓣并关闭切口。应用几滴组织胶(见材料表)来密封皮瓣。
- 在植入物周围区域涂抹氯西丁防腐剂,以避免感染。如果动物在上次注射乳酸钠溶液后麻醉超过2小时,在TBI诱导期间给予,则进行另一次皮下注射。为了保持动物的适当水化,每2小时重复一次注射,使动物在麻醉下花费。
- 手术后,在上次注射后2h给予乳酸钠溶液的最后注射。如果手术时间少于2小时,从第一次注射开始,使用乳酸钠溶液的最终恢复剂量为2小时。
- 将动物从立体定向装置中取出,并在脑电图手术后测量动物的重量,作为未来监测的参考。由于植入物,动物的重量将比手术前大。
- 将动物放在一个干净的笼子里,放在一个温暖的加热垫上进行恢复。
- 植入两个 EEG 和一个 EMG (2EEG/1EMG) 通道头座。
- 使用布雷格玛作为放置头座的地标。在 2EEG/1EMG 头座的底部涂抹少量组织粘合剂(见材料表),避免四个螺钉孔,并将 2EEG/1EMG 头部安装在颅骨表面。
注: 没有用于放置此头盖的具体坐标。头部长8毫米,宽5毫米,覆盖了大部分颅面。将头座与前缘为 3.0 mm,使其具有最佳位置,并提供良好的信号质量。在组织粘胶固化剂滴落之前,需要快速手动放置。等待大约 5 分钟,使组织胶完全固化。 - 使用无菌 23 G 针在头部安装的四个开口上为螺钉创建先导孔。为此,轻轻推针,慢慢旋转,直到针尖穿透头骨,而不会损坏大脑。使用无菌棉签清除先导孔中的任何出血。
- 将 0.10 螺钉插入先导孔中,并旋转它们,直到每个螺钉固定在头骨中。这可以高达一半的螺丝长度,但不是全长,因为这将损害杜拉母体和皮层。如果头盖位置为颅面和头盖的后端之间有间隙,则使用后部中的两个 0.12 螺钉。
- 在双组分环氧(银-环氧)双包装袋的侧面进行小开口。采取双面铲子,并使用每侧从袋中铲出少量和相等数量的每个组件,并将其混合在一起。只使用少量足够一次的手术,因为混合物在20分钟内凝固。
注:银环氧树脂允许螺钉和头盖之间的电气接触,并增强螺钉的稳定性。 - 在螺钉头和螺钉孔之间涂抹少量这种混合物,然后拧紧每个螺钉,直到其头靠在植入物底部。确保两个螺钉之间没有银环氧树脂接触,因为每个螺钉都用作单独的电极,并且为了确保信号准确,它不应与其他螺钉接触。
- 如果银环氧树脂混合物放错地方,有几个第二个时间窗口仔细挖出多余的分离连接。小心地弯曲两个EMG引线从头山的后边缘,跟随动物的头部和颈部的轮廓,然后将它们插入到鼻管肌肉。
- 将 1/2 勺粉末与几滴溶剂混合,准备牙科水泥用于应用。使用混合铲子和搅拌,直到最后的混合物是腻子状,俗气,但可塑性,和足够硬,足以正确浓缩时,放置在动物的颅骨。
- 应用覆盖整个头座的牙科水泥混合物,同时避免覆盖六个引脚孔,因为这将使得无法连接前置放大器。等待 ±3⁄5 分钟,使水泥凝固。确保皮肤没有用牙科水泥密封到头山。
- 通过连接塑料底座周围的皮瓣,释放固定皮肤皮瓣并关闭切口。应用几滴组织胶封住皮瓣。
注:如果皮肤切口变长以允许矫直 EMG 导线,则可以使用组织粘合剂或缝合皮肤进行密封。用纸巾密封皮肤通常就足够了。但是,如果在术后监测切口打开期间观察到缝合,则建议改口。 - 在植入物周围区域涂抹氯西丁防腐剂,以避免感染。如果动物在前一次注射后麻醉超过2小时,则用皮下方式施用乳酸钠溶液(每克动物重量3微克)以更换液体和电解质。
- 将动物从立体定向装置中取出,并在脑电图手术后测量动物的重量,作为未来监测的参考。由于植入物,动物的重量将比手术前大。
- 将动物放在一个干净的笼子里,放在一个温暖的加热垫上,用回收凝胶和一些润湿的小块进行回收。
- 使用布雷格玛作为放置头座的地标。在 2EEG/1EMG 头座的底部涂抹少量组织粘合剂(见材料表),避免四个螺钉孔,并将 2EEG/1EMG 头部安装在颅骨表面。
- 植入三个 EEG 通道 (3EEG) 头座。
- 使用钢位(0.5 mm、圆形、1/4)的高速钻头,在 ±5,000~6,000 rpm 时使用提供的立体定向坐标12创建六个毛刺孔(三个用于稳定螺钉,三个用于电极)。用于 EEG1 和 EEG2 的接地和通用参考:AP = 5.2 mm,ML = ±1.5 mm;用于脑电图1和脑电图2:AP = -3.0 mm,ML = ±3.0 mm;用于独立 EEG3:AP =-1.4 mm,ML = ±1.5 mm。
- 将六个螺钉电极放入毛刺孔中。
注意:将螺钉放在更深的位置将对大脑造成重大损害。螺钉电极可提高头座的稳定性。 - 将 1/2 勺粉末与几滴溶剂混合,准备牙科水泥用于应用。使用混合铲子和搅拌,直到最后的混合物是腻子状,俗气,但可塑性,和足够硬,足以正确浓缩时,放置在动物的颅骨。
- 涂抹覆盖颅骨的整个外露表面和每个螺钉电极的牙科水泥混合物。确保皮肤没有用牙科水泥密封到头山。等待 ±1⁄2 分钟,使水泥温和凝固。无需等到完全凝固后再继续下一步。
- 打开焊料熨斗加热。将 3EEG 头座放在立体定向支架臂中。
注:定位头座,使六根导线引线位置与每个螺钉电极的导线位置相匹配。 - 降低头部,使其腹腔部分位于牙科水泥顶部。
- 使用头座的相应导线导线将每个导线的导线从每个螺钉电极中扭曲。
注: 扭曲错误的导线会使数据解释变得复杂或不可能。 - 用剪刀小心地修剪多余的电线。焊接每对双绞线,以进行正确的信号传导。
注:每对电线必须与另一对导线接触,否则信号质量和数据解释将受到影响。 - 将每对焊接的导线弯曲到头部周围,避免每对之间的接触。
注:如果导线修剪得不够短,则在不接触另一根导线的情况下,很难将其弯曲到头部周围。在这种情况下,先弯曲一对,用牙科水泥混合物盖住它,等待+1⁄2分钟凝固,然后以同样的方式继续下一对。 - 用牙科水泥覆盖所有电线后,只露出头山的黑色部分。
注意:小心不要将任何牙科水泥粉或混合物涂抹在头部暴露部分的顶部,因为孔中的任何碎屑或水泥会阻塞接触,并导致信号缺失或噪音。 - 释放保持皮瓣的塞住。在植入物周围区域涂抹氯西丁防腐剂,以避免感染。
- 如果动物在前一次注射后麻醉超过2小时,则用皮下方式施用乳酸钠溶液(每克动物体重3微克)以代替液体和电解质。
- 将动物从立体定向装置中取出,并在脑电图手术后测量动物的重量,作为未来监测的参考。由于植入物,动物的重量将比手术前大。
- 将动物放在一个干净的笼子里,放在一个温暖的加热垫上,用回收凝胶和一些润湿的小块进行回收。
注:过氧化氢有助于从颅骨中取出任何剩余的软组织。
5. 将动物连接到采集系统
- 用双手将动物从采集笼中取出,并将其转移到具有平坦表面的干净区域,如动物转运站 (ATS)。
- 轻轻抓住鼠标的背部皮肤。不要抓住动物的尾巴,因为这样会引起痛苦。
- 识别与接地电极对应的 EEG 头座中的开口,并匹配系绳的相应销以进行正确连接。
注: 从换向器反向连接系绳到动物头山将导致与电极不同的读数和可能失真的波形。 - 将动物返回到采集保持架,并将系绳的另一端(EEG 系统 1)或前置放大器(EEG 系统 2)连接到换向器。
注: 从换向器将前置放大器(EEG System 2)连接到系绳时,匹配两个系绳末端的白色标记。反向连接将导致放大器永久损坏,需要制造商进行维修,这非常昂贵。 - 轻轻地旋转将动物连接到换向器的系绳,以确保机构正常工作,动物可以自由移动。
6. 脑电图数据采集设置
- 设置 EEG 系统 1 采集参数。
- 将采样速率设置为 500 Hz;获得5,000;模式规范 35 Hz;LPN 关闭。将高通滤波器设置为 0.5 Hz。
注:100 Hz(低通)是内置的,不需要手动输入。
- 将采样速率设置为 500 Hz;获得5,000;模式规范 35 Hz;LPN 关闭。将高通滤波器设置为 0.5 Hz。
- 设置 EEG 系统 2 采集参数。
- 将采样速率设置为 600 Hz;前置增益100;增益 1 (EEG1,2)。将低通滤波器设置为 100 Hz。
注:1 Hz(高通)是内置的,不需要手动输入。
- 将采样速率设置为 600 Hz;前置增益100;增益 1 (EEG1,2)。将低通滤波器设置为 100 Hz。
7. 视频数据采集设置
- 为 EEG 系统 1 设置采集参数。
注:需要第三方视频采集系统来获取同步视频数据。- 将帧速率设置为 15(建议最低)和 30(最大可用)之间,以实现适当的视频质量。将分辨率设置为 640 x 640 像素。将压缩类型设置为 H.264H。
- 为 EEG 系统 2 设置采集参数。
注:此 EEG 系统提供视频系统和软件,用于将视频和 EEG 数据同步到一个最多四个动物的单个文件中(参见材料表)。- 将帧速率设置为 15(建议最低)和 30(最大可用)之间,以实现适当的视频质量。将分辨率设置为 640 x 480 像素。将压缩类型设置为 WebM 文件格式。
结果
此处概述的协议描述了使用重复扩散 TBI 的小鼠模型(图 1)隔离诱导漫射损伤的方法(例如,在没有焦点病变的情况下)。图 1A描述了用于在此模型中诱导 TBI 的降重装置及其组件(图1A、a1_a5)以及过程中的关键步骤(图 1B,b1_b5)。
该模型的特点包括缺乏由于TBI对大脑的焦点病变,意识丧失,高存活率,出现晚期发作(>1周的TBI),以及自发的,无端的,复发性发作的子集TBI 小鼠在 TBI 之后的延迟期至少三周后。
该协议演示了设置干净外科场的详细程序(图2),提供了植入不同电极阵列的分步方法(图3),并包括有关使用两种不同的脑电图采集系统(参见材料表)来检测癫痫发作的详细指南(图4和图5)。典型捕捉的频谱功率表示频率范围为 10 到 40 Hz 的最高密度,峰值为 15 Hz(图 4)。小鼠的癫痫发作大多数是抽搐,平均持续时间为12-15s。只有一小部分的癫痫发作是无抽搐的。"讨论"部分详细介绍了使用任一系统的优点和缺点。此外,该协议演示了重复减重TBI后动物发作的时限,显示了某些动物的癫痫发作聚集(图6),强调获取连续记录而不是间歇性记录的重要性,因为这将确保在TBI之后从没有的动物身上准确分层,从而形成自发性发作。重要的是,该协议还讨论了PTE啮齿动物模型的优缺点,以及它们在TBI之后代表特定人类种群的能力。

图1:重复漫反射TBI的鼠标模型。(A) 重量下降装置.(a1)重量下降管。(a2)100 克重量的杆。(a3)固定杆。(a4)如果更改高度或将杆从重量下降管中取出,则将杆向上抬起。(a5)用于将动物置于重量下降管下的泡沫垫。(B) 降重程序.(b1)不锈钢圆盘位于头部中心,位于眼睛和耳朵线之间。(b2和b3)目视确认动物的头部处于平放位置,泡沫垫被移动后,将动物的头部置于重量下降管下。(b4)松开固定重量杆的销,击中不锈钢盘的中心。(b5)老鼠在撞击后立即放在无菌毛巾上,通过测量动物恢复和自我恢复所需的时间来评估意识丧失。请点击此处查看此图的较大版本。
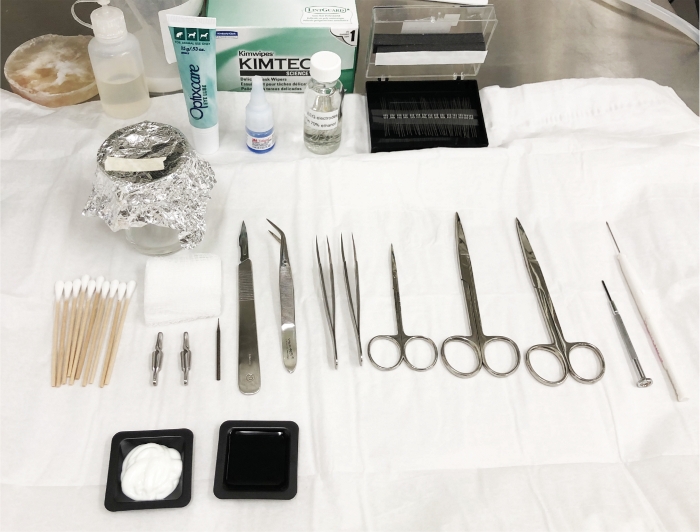
图2:手术现场制备和脑电图电极放置方案。在给动物麻醉之前,准备用于手术和电极植入的高压灭菌工具和必要材料,以确保所有必需部件的可用性。这是一个无菌区,必须避免用非无菌材料污染该区域。请点击此处查看此图的较大版本。
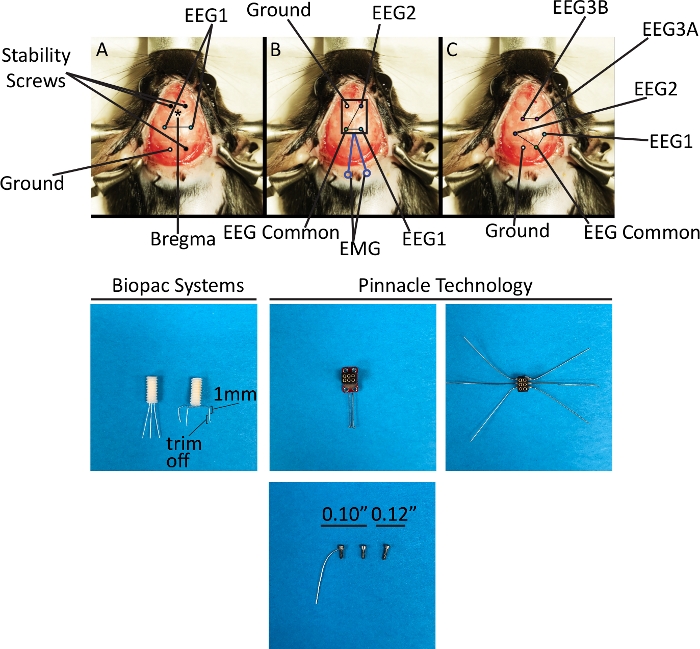
图3:使用EEG系统1和2对电极放置的立体定向参数和原理图表示。顶部面板描述了在该协议中描述的三个不同的头端的植入方法。(A) 单 EEG 通道,双极蒙太奇.(B) 两个具有共同参考的 EEG 通道、双极蒙太奇和一个 EMG 通道。(C) 三个 EEG 通道,使用单极(通道 1+2)和双极(通道 3)蒙太奇。底部面板描绘了顶部面板中植入的头部和螺钉。本协议中使用的三种螺钉有两种用途:作为稳定螺钉(EEG 系统 1)或同时的稳定性和电极(EEG 系统 2)。请点击此处查看此图的较大版本。

图4:使用脑电图系统1获得的自发性癫痫发作。顶部面板使用使用 1EEG 头座获得的数据,在反复减重 TBI 23 天后,在小鼠中描述自发性发作。(A) 前(发作前)活动.(B) Ictal(扣押)活动。(C) 癫痫后(癫痫发作后)抑郁症。底部面板:使用自定义脚本和软件计算功率频谱密度(参见材料表)。平均功率 = 时代内功率频谱的平均功率(单位:V2/Hz)。中位频率 = 达到时代内总功率 50% 的频率(单位:Hz)。平均频率 = 达到纪元内平均功率的频率(单位:Hz)。光谱边缘 = 低于用户指定的总功率百分比的频率(单位:Hz)。峰值频率 = 在纪战期间出现最大功率的频率。请点击此处查看此图的较大版本。

图5:使用脑电图系统2获得的自发性癫痫发作。a) 小鼠在反复减重TBI65天后,自发性非抽搐(电图)发作。使用 2EEG/1EMG 头座获取的数据。(B) 在体重下降TBI97天后小鼠自发性惊厥发作。使用 3EEG 头座获取的数据。请点击此处查看此图的较大版本。

图6:小鼠重复降重TBI后的发作发生率。在受伤后三周观察到最早的癫痫发作。有些动物在同一天内出现癫痫发作,随后数周没有发作。动物在TBI后被记录到四个月。请点击此处查看此图的较大版本。
讨论
与 CCI 和 FPI 模型诱导焦力或焦点和漫反射损伤的组合不同,本协议中描述的重复扩散 TBI 模型允许在没有焦点脑损伤的情况下诱导扩散损伤,并且不需要头皮或颅开口和相关炎症。该模型中没有颅切除术的一个附加好处是,它不仅允许植入用于慢性连续脑电图记录的电极,而且还可以创建一个薄颅骨窗口,用于在动物之前、紧接之后、之后、再重复几天、几周甚至几个月,如Sandra和Robel 201913中所述的TBI之后进行慢性活体2光子成像。
无论选择哪种动物模型,采用的数据采集方法是任何成功和全面研究的关键要素。在创伤后癫痫的啮齿动物模型中,癫痫发作频率低14,每天0.3-0.4次发作,第9、15次发作之前,潜伏期可以在最初的TBI手术后几天或几周甚至几个月之间持续。最后,与非创伤模型相比,在较短的时间内发作的发生率普遍较高,平均只有9%-50%患有TBI的动物在长达6个月、8、16年期间有自发性发作。这表明有意义的研究需要持续的长期视频-EEG记录。
TBI的每个动物模型的首要目标是尽可能密切地复制在人类患者中发现的不同形式的TBI,以便更好地研究PTE背后的细胞和分子机制。该协议中的技术将有助于促进发现治疗靶点,测试新的预防和治疗候选药物的疗效和耐性,以及开发可靠的生物标志物或癫痫预测器。照射。
降重过程中的潜在挑战
由于头部未固定在立体定向框架中,因此必须格外小心,以确保头部和金属板处于平坦位置。如果加权杆以一定角度击中金属板或头部,或者重量滑落到鼠标头的一侧,则伤害生物力学会有所不同,可能导致较轻微或没有损伤。过去,金属板粘在头骨上,以尽量减少变异性。然而,在重量下降后从小鼠头骨中取出金属板和胶水,即使小心操作,也会对脑筋损伤,导致血管损伤,甚至假动物的脑组织随之受损。此外,切口需要愈合,可能涉及外周免疫反应,这可能会导致变异性。由于这些原因,它选择省略胶着金属板到头骨。动物可能会因反复(即本协议中的3倍)伤害而死亡。体重低于25克的小鼠不能承受反复撞击。虽然单次伤害几乎永远不会导致死亡,但高达7%的C57BL/6动物在反复撞击9后死亡。在一些动物中可以观察到马达缺陷。这些缺陷表现为后肢性障碍或步态异常。这通常是恢复不良的预后因素,建议牺牲动物。疼痛或痛苦的迹象包括体重减轻、梳理不良、脱水、焦虑加剧、低或缺席探索性活动(水凝胶/恢复、口吃和/或巢穴保持不变)。从TBI开始,每8小时分一次地施用一次麻醉室(0.1毫克/千克丁丙诺啡),以减轻疼痛,防止动物到达人道终点。皮下乳酸钠溶液(每克动物体重3微克)每天可施用两次水化。动物通常在TBI后三天内恢复。建议在实验程序后使用五级身体状况评分(BCS)进行动物监测。阶段包括(1)消瘦(骨骼结构极其突出,椎骨极分);(2)条件不足(椎骨柱分割明显,背骨盆骨容易明显;(3) 条件良好(椎骨和背骨盆不突出明显明显,压力轻微);(4) 过度条件(脊柱是连续柱,脊椎仅具有强压;(5)肥胖(小鼠光滑笨重,骨骼结构在肉和皮下脂肪下消失)。当成年小鼠的BCS为1⁄2,20%或更多,与TBI前体重相比,疼痛或痛苦的症状不会通过镇痛药、自残症状、脱水症状、体温过低、存在神经缺陷(异常步态或运动性)来缓解,达到人道终点。应考虑物质管理的几种可能的结果。注射后17分10分钟,布丙诺啡注射皮下达到其镇痛作用的第一个峰值。第一次撞击发生在布丙诺啡施用后几秒钟,表明第一次测量正确的时间不太可能受到影响。但是,不能完全排除这作为变量。因此,实验者应自行判断。如果按照降重程序进行立体定向手术,并施用卡洛芬,请务必注意,卡洛芬是一种可能影响癫痫发作发生率的抗炎剂,因此建议实验者仔细考虑其使用。
手术过程中的潜在挑战
使用 70% 乙醇可降低污染或感染的风险,但不会导致无菌条件。或者,可以使用无菌手术手套。然而,立体定向装置本身并不是无菌的,因此任何手动操作都会导致手套的无菌状态丧失。因此,在手术期间接触任何未消毒材料后,需要用70%乙醇喷洒。钻入脑中颅骨会损坏脑组织,并可能导致大量出血。创建毛刺孔需要格外小心。将手钻固定在立体定向臂中并逐渐降低,比手动握住钻头时钻孔更可取。电极和固定螺钉可能比计划下沉更深,从而伤害杜拉母体(下部放置)或皮层(皮质放置)。这可能导致大量出血和焦点病变。实验者在手术中必须避免动物过热。如果温度传感器未正确固定,则温度传感器不会保持所需的 37°C 温度,从而导致过热、灼伤,有时还会导致动物死亡。动物的眼睛在手术过程中干燥、发炎或受损,如果动物被放置在立体定向装置中时,如果不立即润滑。
术后监测
手术后监测在手术或手术结束后立即开始。观察动物,直到它从麻醉中醒来,并寻找是否存在任何与手术相关的并发症,包括出血或闭塞。如果从不完全切口闭合中观察到出血,麻醉动物,用氯西丁清洁出血部位,按照上述方法进行伤口闭合,并将动物送回恢复笼。手术后约1~2小时,动物应完全从麻醉中清醒,在笼子里自由移动,没有疼痛或疼痛的迹象。动物将开始梳理自己,这就是为什么密封切口是必要的,以防止动物在梳理期间打开它。动物恢复后,将其转移到笼子/室,用于脑电图数据采集。这将使动物适应新的环境。这对长期录音(月)尤其重要。动物笼子必须有一个回收凝胶(见材料表),润湿的奶圈,一个窝窝,和一个水瓶。这将允许适当的恢复,并将使动物获得营养和水。继续每天监测动物。评估必须包括:(a) 目视检查动物的行为,了解疼痛或痛苦的迹象,包括体重减轻、梳理不良、焦虑加剧、低或缺席探索活动(水凝胶/恢复、周和/或巢穴保持不变)和适当愈合脑电图植入物周围的切口区域;(b) 评估BCS是否有脱水和营养不良的迹象;(c) 动物的重量。如果动物有脱水迹象,在皮下施用乳酸钠溶液(每克动物体重3微克)(见材料表)。如果动物出现疼痛或痛苦迹象,则下皮服用丁丙诺啡(0.1毫克/千克)。如果疼痛的迹象持续存在,丁丙诺啡可以每8小时施用一次,如果动物有疼痛和/或痛苦的迹象,监测必须增加到每天两次。在通过系绳连接到采集系统之前,让动物在脑电图手术后至少三天恢复。人道的终点标准与上述降重过程中的潜在挑战相同。
采集系统和头安装的优点和缺点
具有单个 EEG 通道头座的 EEG 系统 1 的主要优点是硬件、组件和服务成本相对较低。简单明了的配置还允许用户根据自己的喜好自定义系统。每个差分放大器提供一个EEG通道,尽管多个差分放大器可以相互连接,从而增加了每个动物的通道数。在这个系统中,每个动物的单通道配置用于同时获取20只动物的长期脑电图记录。创伤后发作通常是广义的,与电极的双边双极蒙太奇,很容易检测这种类型的癫痫活动。然而,这种方法的缺点是,不可能可靠地检测对焦、横向化或癫痫形态活动的传播,因为这需要几个通道。另一个潜在的挑战可能是随着时间的推移,单通道的噪音污染,使其无法从动物获取有用的数据。这可以通过组合两个或多个差分放大器来克服,这种放大器使每个动物的通道数翻倍。最后,从单个通道获取的数据更难与潜在的伪影区分开来,并且对动物行为的视频记录最好支持癫痫形成活动。因此,所有录像将同步连续视频监控与 EEG 采集相结合。该系统及其软件的一个限制是,它不包括视频采集系统,因此需要一个自定义的第三方系统来获取同步视频。
具有多通道头端的 EEG 系统 2 的主要优点是信号质量高,因为在前置放大器(参见材料表)通过换向器传递到放大器之前,它预先过滤了采集的信号。该系统中的放大器允许在以下配置中采集三个通道的数据:2 个 EEG+1 EMG 通道或三个 EEG 通道(参见材料表)。这不仅可以检测广义活动,而且可能检测焦点癫痫体活动。另一个主要优点是,该系统是专为动物研究设计的,因此提供了一个视频录制系统和软件,能够在一个文件中同步最多四个动物的EEG和视频通道,这使得分析比EEG系统1更容易和更方便。该系统易于获取用于癫痫发作和睡眠分析的数据,无需对系统进行任何修改,但使用头座类型外。2EEG/1EMG 头座允许将电极植入固定位置,因为电路板的尺寸和配置。3EEG 头部带导线的螺钉电极允许在所需位置灵活植入,并可根据参考电极的放置位置进行单极或双极采集。然而,植入3EEG头山需要焊接,这增加了手术的步骤,需要额外的谨慎和精度。连接系绳和前置放大器是专门为小啮齿动物,如老鼠和不成熟的老鼠设计的,是薄,低重量的电缆,对动物的头部造成很少的压力。该系统的缺点是硬件、软件、视频许可证和组件(即前置放大器和头盖)的成本相对较高。
脑电图数据采集的重要性和关键步骤
换向器具有旋转机构,允许系绳根据动物运动的方向旋转。如果此机制失败,动物的运动将受到限制,这可能导致取消脑电图上限。可以尝试重复手术放置新电极。然而,如果去除以前的脑电图帽对头骨和大脑造成损伤,这可能具有挑战性或不可能。EEG 数据采集的采样率必须至少为最高兴趣频率的 2~2.5 x。采样率越高,数据分辨率越高,文件大小越大,当获取多个动物的连续记录时,这些数据就难以存储和处理。因此,有必要将采样率优化到允许在不损失质量的情况下获取必要数据,同时最小化文件大小的水平。
视频数据采集中的重要性和关键步骤
在啮齿类动物中,与人类一样,PTE在相关症状学和电学相关方面可能表现出广泛的变异性,因此有必要在EEG采集期间同时获取视频,以便正确解释和分类观测到的脑电图事件。在没有同步视频的情况下解释 EEG 数据在使用单个 EEG 通道时尤其具有挑战性。在这种情况下,很难确定 EEG 波形是否为伪影,除非其他证据(视频)支持将分类为扣押。运动伪影可以类似于癫痫发作的电图模式。因此,视频与或没有EMG确认是必需的。虽然视频录制在明暗周期中执行,但视频质量在黑暗时段并不总是令人满意且清晰。此外,如果动物在类似 EEG 的事件中被转离相机,则评估其行为可能具有挑战性。在这些情况下,除了脑电图和视频之外,获取肌电图 (EMG) 信号可以解决挑战,通过提供有关轻度行为发作期间肌肉活动的信息(具有低运动成分),或确认在脑电图上出现类似峰值和慢波放电时动物缺乏运动。EMG 通道的潜在挑战与 EEG 通道的挑战类似,例如噪声污染、电极放置不正确或电极在长时间录制期间松动(或失去表面接触)。使用视频和脑电图分析有两个目的:确认脑电图事件不是动物运动(探索行为、饮酒、咀嚼、抓痒、拉伸、梳理或快速/人工呼吸)引起的伪影,以及区分抽搐和非抽搐发作。建议使用经过修饰的拉辛鳞称抽搐或非抽搐发作。阶段包括 (0) 纯电图性发作,没有任何可识别的马达表现;(1) 面自动和头部点头;(2) 前肢克隆抽搐;(3) 双边前肢;(4) 前肢和饲养;(5) 前肢克隆带饲养和下降。每个视频通道必须清楚地显示整个表面与动物在笼子里,一个标签与动物识别号,水瓶提示,食品和饮食/恢复凝胶。为确保在黑暗时间获取视频,请使用红外夜源。(某些摄像机具有内置设备或可能需要其他部件。请参阅材料表)。调整帧每秒速率和图像分辨率。帧速率和分辨率越高,文件大小越大。在长期持续实验中获取视频的主要缺点是需要存储大量数据,以及处理大型文件时涉及的技术困难。还必须考虑到实验者与 EEG 一起有效解释行为数据的能力。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了R01 NS105807/NS/NINDS NIH HHS/美国和CURE的支持,其依据是美国陆军医学研究和物资司令部(国防部)通过"心理健康和创伤性脑损伤研究计划"获得的第1号奖励。W81XWH-15-2-0069。伊万·祖伊德霍克对手稿进行校对,非常感谢他。
材料
| Name | Company | Catalog Number | Comments |
| 0.10" screw | Pinnacle Technology Inc., KS, USA | 8209 | 0.10 inch long stainless steel |
| 0.10" screw | Pinnacle Technology Inc., KS, USA | 8403 | 0.10 inch long with pre-soldered wire lead |
| 0.12" screw | Pinnacle Technology Inc., KS, USA | 8212 | 0.12 inch long stainless steel |
| 1EEG headmount | Invitro1 (subsidiary of Plastics One), VA, USA | MS333/8-A/SPC | 3 individually Teflon-insulated platinum iridium wire electrodes (twisted or untwisted, 0.005 inch diameter) extending below threaded plastic pedestal |
| 2EEG/1EMG headmount | Pinnacle Technology Inc., KS, USA | 8201 | 2EEG/1EMG channels |
| 3% hydrogen peroxide | Pharmacy | ||
| 3EEG headmount | Pinnacle Technology Inc., KS, USA | 8235-SM-C | custom 6-Pin Connector for 3EEG channels |
| Buprenorphine | Par Pharmaceuticals, Cos. Inc., Spring Valley, NY, USA | 060969 | |
| Buprenorphine | Par Pharmaceuticals, Cos. Inc., Spring Valley, NY, USA | 060969 | |
| C57BL/6 mice | Harlan/Envigo Laboratories Inc | male, 12-16 weeks old | |
| C57BL/6 mice | The Jackson Laboratory | male, 12-16 weeks old | |
| Carprofen | Zoetis Services LLC, Parsippany, NJ, USA | 026357 | NOTE: this drug is added during weight drop only if stereotactic electrode implantation will be performed on the same day |
| Chlorhexidine antiseptic | Pharmacy | ||
| Dental cement and solvent kit | Stoelting Co., USA | 51459 | |
| Drill | Foredom | HP4-917 | |
| Drill bit | Meisinger USA, LLC, USA | HM1-005-HP | 0.5 mm, Round, 1/4, Steel |
| Dry sterilizer | Cellpoint Scientific, USA | Germinator 500 | |
| EEG System 1 | Biopac Systems, CA, USA | ||
| EEG System 2 | Pinnacle Technology Inc., KS, USA | ||
| Ethanol ≥70% | VWR, USA | 71001-652 | KOPTEC USP, Biotechnology Grade (140 Proof) |
| Eye ointment | Pro Labs Ltd, USA | Puralube Vet Ointment Sterile Ocular Lubricant available in general online stores and pharmacies | |
| Fluriso liquid for inhalation anesthesia | MWI Veterinary Supply Co., USA | 502017 | |
| Hair removal product | Church & Dwight Co., Inc., USA | Nair cream | |
| Isoflurane | MWI Veterinary Supply Co., USA | 502017 | |
| Povidone-iodine surgical solution | Purdue Products, USA | 004677 | Betadine |
| Rimadyl/Carprofen | Zoetis Services LLC, Parsippany, NJ, USA | 026357 | |
| Solder | Harware store | ||
| Soldering iron | Weller, USA | WP35 | ST7 tip, 0.8mm |
| Stainless steel disc | Custom made | ||
| Sterile cotton swabs | |||
| Sterile gauze pads | Fisher Scientific, USA | 22362178 | |
| Sterile poly-lined absorbent towels pads | Cardinal Health, USA | 3520 | |
| Tissue adhesive | 3M Animal Care Products, USA | 1469SB |
参考文献
- Christensen, J., et al. Long-term risk of epilepsy after traumatic brain injury in children and young adults: a population-based cohort study. Lancet. 373 (9669), 1105-1110 (2009).
- Lowenstein, D. H. Epilepsy after head injury: an overview. Epilepsia. 50, Suppl 2 4-9 (2009).
- Ferguson, P. L., et al. A population-based study of risk of epilepsy after hospitalization for traumatic brain injury. Epilepsia. 51 (5), 891-898 (2010).
- Abou-Abbass, H., et al. Epidemiology and clinical characteristics of traumatic brain injury in Lebanon: A systematic review. Medicine (Baltimore). 95 (47), 5342(2016).
- Management of Concussion/mTBI Working Group. VA/DoD Clinical Practice Guideline for Management of Concussion/Mild Traumatic Brain Injury. The Journal of Rehabilitation Research and Development. 46 (6), 1-68 (2009).
- Piccenna, L., Shears, G., O'Brien, T. J. Management of post-traumatic epilepsy: An evidence review over the last 5 years and future directions. Epilepsia Open. 2 (2), 123-144 (2017).
- Loscher, W., Brandt, C. Prevention or modification of epileptogenesis after brain insults: experimental approaches and translational research. Pharmacological Reviews. 62 (4), 668-700 (2010).
- Ostergard, T., Sweet, J., Kusyk, D., Herring, E., Miller, J. Animal models of post-traumatic epilepsy. Journal of Neuroscience Methods. 272, 50-55 (2016).
- Shandra, O., et al. Repetitive Diffuse Mild Traumatic Brain Injury Causes an Atypical Astrocyte Response and Spontaneous Recurrent Seizures. Journal of Neuroscience. 39 (10), 1944-1963 (2019).
- Foda, M. A., Marmarou, A. A new model of diffuse brain injury in rats. Part II: Morphological characterization. Journal of Neurosurgery. 80 (2), 301-313 (1994).
- Marmarou, A., et al. A new model of diffuse brain injury in rats. Part I: Pathophysiology and biomechanics. Journal of Neurosurgery. 80 (2), 291-300 (1994).
- Paxinos, G., Keith, B. J., Franklin, M. The Mouse Brain in Stereotaxic Coordinates. , Elsevier Science. (2007).
- Shandra, O., Robel, S. Imaging and Manipulating Astrocyte Function In Vivo in the Context of CNS Injury. Methods in Molecular Biology. 1938, 233-246 (2019).
- Pitkanen, A., Immonen, R. Epilepsy related to traumatic brain injury. Neurotherapeutics. 11 (2), 286-296 (2014).
- Kharatishvili, I., Nissinen, J. P., McIntosh, T. K., Pitkanen, A. A model of posttraumatic epilepsy induced by lateral fluid-percussion brain injury in rats. Neuroscience. 140 (2), 685-697 (2006).
- Pitkanen, A., Bolkvadze, T., Immonen, R. Anti-epileptogenesis in rodent post-traumatic epilepsy models. Neuroscience Letters. 497 (3), 163-171 (2011).
- Gades, N. M., Danneman, P. J., Wixson, S. K., Tolley, E. A. The magnitude and duration of the analgesic effect of morphine, butorphanol, and buprenorphine in rats and mice. Journal of the American Association for Laboratory Animal Science. 39 (2), 8-13 (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。