Method Article
マウスにおけるイソカロリック2:1間欠的断食の代謝効果評価
* これらの著者は同等に貢献しました
要約
現在の記事では、野生型およびob/obマウスにおける肥満および糖代謝障害を保護し、治療するためのアイソカロリック2:1断続的断食の詳細なプロトコルについて説明しています。
要約
断続的な断食(IF)は、周期的なエネルギー制限を伴う食事介入であり、多くの利点を提供し、代謝異常を打ち消すと考えられてきた。これまでのところ、断食期間と給餌期間が異なるさまざまなタイプのIFモデルが文書化されています。しかし、これらのモデルの多くは、時間制限戦略とカロリー制限戦略の両方からの多因子貢献を伴うため、結果を解釈することは困難です。例えば、げっ歯類IFレジメンとしてしばしば使用される代替日断食モデルは、栄養不足をもたらし、この介入による健康上の利益がカロリー制限と断食再供給サイクルの両方を介して媒介される可能性が高いことを示唆している。最近では、2:1 IFが1日間の断食とそれに続く摂食の2日間を含み、全体的なカロリー摂取量を減少させることなく、食事誘発性肥満および代謝改善に対する保護を提供できることが実証されています。ここで提示する、マウスにおけるこの等角2:1 IF介入のプロトコルである。また、高呼吸などの食行動を変化させたマウスモデルを調べるために必要なペアフィード(PF)プロトコルについても説明する。2:1 IFレジメンを使用して、イソカロリーIFは、体重増加の減少、グルコース恒常性の改善、およびエネルギー支出の上昇につながることが実証されています。したがって、このレジメンは、様々な疾患状態に対するIFの健康への影響を調べるのに有用であり得る。
概要
現代のライフスタイルは、より長い毎日の食物摂取時間と短い断食期間1に関連付けられています。これは、人間に見られる代謝の欠点と、現在の世界的な肥満の流行に貢献します。断食は人類の歴史を通じて実践されており、その多様な健康上の利点は、寿命の延長、酸化的損傷の減少、および最適化されたエネルギー恒常性2、3を含みます。断食を実践するいくつかの方法の中で、周期的なエネルギー剥奪は、断続的な断食(IF)と呼ばれ、その容易で単純なレジメンのために一般集団によって広く実践されている一般的な食事法である。前臨床および臨床モデルの最近の研究は、IFが長時間の断食およびカロリー制限に匹敵する健康上の利点を提供できることを実証し、IFが肥満および代謝性疾患2、3、4、5の潜在的な治療戦略となり得ることを示唆している。
IF レジメンは、断食時間と周波数の点で異なります。代替日断食(すなわち、1日の摂食/1日の断食;1:1 IF)は、肥満、心血管疾患、神経変性疾患などに対する有益な健康影響を研究するためにげっ歯類で最も一般的に使用されているIFレジメンである。しかし、以前の研究6、7に示すように、エネルギー摂取量分析でさらに機械的に確認された8、1:1IFは摂食不足をもたらす(〜80%)エネルギー損失を補うために十分な給餌時間の欠如のため。これは、1:1 IFによって与えられる健康上の利点がカロリー制限または摂食パターンの変更によって媒介されるかどうかは不明である。したがって、新しいIFレジメンが開発され、ここで示されている、食物摂取量を補うために十分な時間をマウスに提供する2日間の給餌/1日断食(2:1 IF)パターンで構成されています(〜99%)そして体重。これらのマウスは、次いでアドリビタム(AL)群と比較される。このレジメンは、野生型マウスのカロリー低下がない場合のイソカロリックIFの効果の検査を可能にする。
対照的に、変化した摂食行動を示すマウスモデルでは、AL供給は2:1 IFの効果を比較および調べるための適切な制御条件ではない場合があります。例えば、ob/obマウス(肥満に対して一般的に使用される遺伝モデル)は、食欲および満腹を調節するレプチンの欠如による過呼吸を示すので、2:1 IFを有するものはAL摂食を有するob/obマウスと比較して約20%減少したカロリー摂取量を示す。したがって、ob/obマウスにおけるIFの効果を適切に調べ、比較するためには、適切な対摂食群を適切な対照として用いる必要がある。
全体として、ペア供給制御の使用を含む等角2:1 IFを実行するための包括的なプロトコルが提供される。さらに、アイソカロリック2:1 IFは、野生型およびob/obマウスの両方で高脂肪食誘発肥満および/または代謝機能障害からマウスを保護することが実証される。このプロトコルは、神経疾患、心血管疾患、および癌を含む様々な病理学的状態に対する2:1 IFの有益な健康影響を調べるために使用することができる。
プロトコル
ここでのすべての方法とプロトコルは、オタワ大学の動物ケアと獣医サービス(ACVS)の動物ケア委員会とフェノゲノミクスセンター(TCP)によって承認され、カナダ動物ケア評議会の基準に準拠しています。ここで説明するすべての手順は、制度的および政府的な承認の下で、また技術的に熟練したスタッフによって行われるべきである。すべてのマウスは、12時間/12時間の光/暗いサイクル(通常のハウジングでは21~22°C、湿度は30%~60%)、水への自由なアクセスを備えた、温度と湿度に制御された部屋の標準的な通気ケージに収容されました。男性C57BL/6Jおよびob/obマウスは、ジャクソン研究所から得られた。
1. 2:1 アイソカロリックIFレジメン
- 無駄のない肥満マウスモデルの場合は、通常の食事(脂肪、ND17%)または高脂肪食(脂肪45%、HFD)のいずれかを準備します。
注:60%HFDは、重度の食事誘発性肥満を誘発するために使用することができます。しかし、食品ペレットの柔らかさのために、毎日の食物摂取量を正確に測定することは比較的困難である。自動化された連続測定システムは食事の複数のタイプのための多様性を改善できる。 - スケールとEchoMRIを使用して、7週齢の各マウスのベースライン体重と体組成を測定します。
注:体組成測定については、セクション3を参照してください。 - 体重と体組成の結果に基づいて、7週齢の男性C57BL/6Jマウスをアドリビタム(AL)と断続的な断食(IF)群の2つのグループにランダムかつ均等に分割します。
- ケージごとに2~3匹のマウスを置き、飲料水への無料アクセスを確保します。
注:ケージあたりのマウスの数は食物摂取行動に影響を与える可能性があります。研究中にすべてのグループでケージあたり同じ数のマウスを維持することをお勧めします。 - IFレジメンを開始する前に、新しいケージ環境と食事に順応の1週間を提供します。
- 断食期間:午後12時に新鮮な寝具を持つきれいなケージにマウスを移動します。AL群に重量を量る食物を与えながら、IF群に食品を加えないでください。
注:断食サイクルごとに、AL グループと IF グループの両方のケージを変更して、両方のグループが同じ処理時間にさらされるようにすることが重要です。 - 24時間後、ALケージ内のグループと残りの食べ物の両方でマウスの体重を測定する。
注:特にHFDを使用する場合は、マウスがホッパーから小さなペレットや食べ物の断片を取り除き、巣の近くに保管することが多いため、食物ホッパーとケージの底に食品パン粉の重量を含めつしてください。各2:1サイクル(3日)の終わりにマウスあたりの平均エネルギー摂取量は約35キロカロリーで、通常の食事(3.3キロカロリー/g)の場合は〜10g、HFD(4.73 kcal/g)の場合は~7gに相当します。 - 給餌期間:AL群とIF群の両方に対して、午後12時に計量量の食物を提供する。
- 48時間後に食品を提供し、残った食品およびマウスの重量を測定する。
- スタディの期間中(例:16週間)に対して手順1.6~1.10を繰り返します。
2. ペアフィード(PF)制御グループ
注:マウスモデル(例えば、ob/obマウスにおける高熱障害)で変化した摂食行動が観察されるIF実験では、IFとの適切なカロリー非依存比較のためのコントロールとして対給餌群を有することが必要である。
- PF制御グループの場合、IFグループによって消費される同量の食物がPFグループに提供されるように実験スケジュールをずらす(図2)。
- 2日間の給餌期間におけるIF群の消費量を測定します。
- IFグループ内の消費食品のこの量を均等に3つの割合に分割し、午後12時にPFグループに毎日提供します。
注:毎日同じ量の食料を提供することは非常に重要です。高熱痛を伴うマウスの場合、ペア供給マウスが自発的な消費よりも少ない量の食物を一度に提供された場合、それらはすべての提供された食物を消費し、効果的に絶食する可能性が高い。これは、IF処理されたマウスとの適切な比較を妨げ、結果を混乱させる可能性があります。 - スタディの実行中に手順 2.1 ~ 2.3 を繰り返します。
3. 体組成分析
注:長期IFはマウスの体重に影響を与えるので、体組成分析装置を使用して適切なサイクル(例えば、3~4サイクル毎)で体組成を測定し、生きた非麻酔マウスの脂肪と無駄のない質量を定量することができます。
- ボディコンポジションアナライザをオンにします。
注:プログラムを開始する前に、マシンのオンを少なくとも 2 ~ 3 時間残してウォームアップします。 - 体組成アナライザでシステムテストを実行し、測定精度をテストします。必要に応じて、キャノーラオイルと水サンプルを使用してシステムを校正します。
- 各マウスの体重を測定します。
- マウスを小動物のシリンドリックホルダーに入れ。
- 測定中にマウスの物理的な動きを制限する区切り文字を挿入し、ホルダーをボディコンポジションアナライザに配置します。
- スキャン プログラムを実行します。
注:分析には約90~120sかかります。 - 測定後、装置からホルダーを取り外し、マウスをケージに戻します。
注:より詳細なプロトコルは、前の出版物9で見つけることができます。
4. グルコースとインスリン耐性試験
- グルコース耐性試験(GTT)では、断食を受ける前に各マウスの体重と体重を測定し、尾部を永久マーカーでマークして簡単かつ迅速にインデックス作成します。
- 一晩の断食のために午後7時に食べ物なしで新しいケージにマウスを置きます。
注:一晩の絶食は標準的なプロトコルであり、しかもマウス生理学(例えば、長時間絶食10、11後のグルコース使用率の増加)に起因して、より短い空腹(〜6時間)をITTに記載するように使用することができる。 - 14~16時間(翌朝午前9時)の絶食後、各マウスの体重と体組成を測定し、体重に基づいてグルコース投与量を算出します。
注:肥満マウスにおけるグルコース不耐性の過大評価を避けるために、体組成分析から得られた無駄のない質量を用いて、グルコース投与量12、13を算出することができる。 - マウスごとに、きれいな手術用ハサミを使用して尾の先端(0.5~1.0 mm)を切ります。血液の最初の滴を拭き取った後、尾から血液の新鮮な滴を引き出し、グルコメーターでベースライン空腹時血糖値を測定します。
注:GTTまたはITT中のすべての血糖値測定に追加のテール切断は必要ありません。傷は、血液の滴を引くためにガーゼでそれを磨くことによって新鮮にすることができます。 - 被験者マウスは、グルコースの腹腔内(すなわち)注射(体重1mg/g)を行う。
注:実験の目的に基づいて(例えば、インクレチン効果を調べる)、グルコースの経口投与は、経口ガバゲージによって行うことができる。経口GTT(OGTT)のためのプロトコルは、別の研究14で見つけることができます。 - 0、5、15、30、60、および120分の後グルコース注射で尾から血糖値を測定します。
- GTTを終了した後、十分な量の食品を提供する。
- インスリン耐性試験(ITT)の場合は、午前9時に食品を取り除きます。
注:GTTとITTはどちらも血糖値を上げ、生理学を変えることができるマウスのストレス誘発経験であるため、GTT実験後に少なくとも2~3日の回復を行うことをお勧めします。 - 6時間(午後3時)の絶食後、ステップ4.4に記載されているように尾からのベースライン血糖値を測定する。
- 被験者マウスをインスリンのi.p.注射(体重0.65mU/g)に投与した。
- 0、15、30、60、90、および120分のポストインスリン注射で尾から血糖値を測定します。
- ITTを終了した後、十分な量の食品を提供します。
5. 間接カロリメトリー
注:IF処理マウスのエネルギー代謝は、IFの単一サイクルにわたる間接熱量測定を通じてさらに評価することができる。これは酸素消費量(VO2)、二酸化炭素生産(VCO2)、呼吸交換比(RER)、および熱(kcal/h)を測定します。
- 実験を実行する前に、間接熱量計システムの電源を少なくとも2時間オンにしてください。
注:このシステムのウォームアップは正確な測定のために重要である。 - 清潔な寝具でケージを準備し、水のボトルを充填し、食品ホッパーにチョウの事前計量量を追加します。
- ドリエライトとライムソーダの状態を確認してください。ドリライトのカラーインジケータがピンク色で表示される場合は、ドリライトが大量の水分を吸収したことを示します。
- 特定の組成(0.5%CO2、20.5%O2)を使用してシステムをキャリブレーションします。
- VO2および VCO2データの正規化に使用される各マウスの体重と体組成を測定します。
- ケージごとにマウスを 1 つそっと置きます。
- 代謝ケージを組み立て、温度管理された環境室に置き、ガスラインと活動センサーケーブルに接続します。
- ソフトウェアを使用して適切な実験パラメータを追加して実験プロファイルを設定した後、測定用のプログラムを実行します。最初の日の測定の目的は、順応の期間を提供し、ベースラインエネルギー代謝を測定することです。
- 翌日の午後12時に、マウスをホッパーと底部から食べ物とパン粉を取り除いて24時間の絶食を行う。必要に応じて、清潔な寝具に交換してください。
- 24時間後、再供給期間のフードホッパーに予め計量したチョウ量を加える。
- 次の 48 時間の測定を続けます。
- 測定が完了したら、プログラムを終了し、マウスを元のケージに戻します。食べ物の摂取量を調べるために残りの食べ物の量を測定します。
- 間接熱量測定のための詳細なプロトコルは、以前の研究9で見つけることができます。
結果
図1は、24時間断食後の摂食解析と1:1と2:1の断続的な断食の比較を示しています。24時間の絶食期間は体重を約10%減少させ、2日間の再摂食後に完全に回復した(図1A)。24時間の絶食期間は、その後の2日間の再供給の間に過剰呼吸を誘発した(図1B)。それにもかかわらず、1:1代替日断食と2:1断続的断食の間のエネルギー摂取量の比較は、1:1 IFの再供給期間の1日が十分でないことを明らかにした(〜80%)AL条件と比較して、断食によるカロリー損失を補償するために(図1C)。一方、エネルギー摂取量の99%は、2:1 IFで2日間の給餌中に完全に補償されました。このレジメンは、カロリー摂取量の差に依存しない等カロリーIFの効果の検査を可能にする。
図 2は、アイソカロリック 2:1 IF および PF レジメンの概略タイムラインを示しています。カロリー摂取量の違いを最小限に抑えるために、交互の日断食6、7で行われた観察は、このプロトコルは、野生型マウスにおけるアイソカロリックIFの健康影響の検査を可能にした2日間の摂食および1日間の断食期間(2:1IF)8からなる新しいIFレジメンを確立した。しかしながら、高phagic行動を示したob/obマウスでは、2:1 IF処理ob/obマウスは、ob/ob ALマウス15と比較して21%カロリー摂取量減少を示した。これにより適切なカロリー非依存比較が防止されるため、IF処理ob/obマウスと同じカロリー摂取量を維持したPF対照群が使用された。簡単に言えば、2:1 IFマウスにおける2日間の摂食中に消費される食物の総量を1日3回の量に均等に分割し、次いでPF群に提供した。
2:1 IFの代謝結果に関する包括的な概要については、体重におけるAL、IF、PFの効果、野生型マウスおよびob/obマウスにおける食物摂取量と体組成の効果を、通常の食事(ND)およびHFDで比較した。ALと比較して、IF治療は、食物摂取量に有意な差なくND供給およびHFD供給WTマウスの体重増加を引き起こし得た(図3A,B)。体組成解析は、IFが野生型マウスにおける無駄のない質量の変化なしに脂肪質量を特異的に減少させることを明らかにした(図3C)。わずかに、有意ではないが、IFプログラムの16週間にわたって蓄積されたエネルギー摂取量が低いと、IF動物の体重増加が減少する可能性がある。しかし、対給餌レジメンを用いたIF実験では、IFによる体重増加の減少はエネルギー摂取量の変化によるものではないことを確認した(図3D,E)。野生型動物とは異なり、IF(Ob-IF)を施したob/obマウスの体重はOb-ALマウスの体重よりも低かった(図3G)。これは、ob/obマウスの過敏症(過度の食べ物)によるもので、軽度に高い(21%)ALマウスにおける食物摂取は、IF処理動物と比較して(図3H)。そこで、IFの代謝効果をカロリー非依存的に具体的に調べるために、対給餌制御群を採用した。しかしながら、野生型マウス8とは異なり、Ob-PFマウスは体重及び体組成15においてOb-IFマウスと比較して区別がついなかった(図3I)。これらの結果は、レプチンがマウスにおけるイソカロリックIF媒介性体重減少に関与する可能性が高いことを示唆している。
イソカロリックIFによって与えられる主な代謝上の利点は、改善されたグルコース恒常性である。図4に示すように、A,B,C,D,HFD-IFマウスはグルコース恒常性に有意な改善を示した。GTTは、IF処理マウスにおいて血糖値がより速くクリアされることを示し、ITTはHFD-ALまたはHFD-PFマウスと比較してHFD-IFマウスにおいてより高いインスリン感受性を明らかにした。予想外に、IF媒介性体重減少の失敗にもかかわらず、Ob-IF動物は、OB-PFマウスと比較して、GTTにおけるより小さなグルコース遠足によるグルコースハンドリングを有意に改善し、一方、インスリン感受性はOb-IFおよびOb-PFマウスとの間で区別できなかった(図4F)。Ob-IFマウスにおけるこの改善されたグルコース恒常性は、グルカゴン様ペプチド-1(GLP-1)およびグルコース刺激インスリン分泌の血漿レベルの増加によって媒介される可能性が高い(データは示されていない)15。全体として、この2:1 IFプロトコルと適切なカロリー非依存PF制御を用いて、野生型およびob/obマウスにおけるアイソカロリックIFの代謝上の利点を示した。
野生型マウスにおけるIFの代謝効果の1つは、総O2消費量が高く、エネルギー支出を推定するために用いられる(図5A,B)。O2消費量におけるこの上昇は、IFマウスにおける摂食期間中にのみ見られたが、ALマウスと比較して断食期間は見つからなかった。増加したエネルギー支出は、白色脂肪組織の褐変および褐色脂肪組織の活性化(データは示されていない)8、16などの脂肪熱発生によって主に媒介された。IF媒介性脂肪熱発生は、IFを受けた野生型マウスが、ALマウスと比較して食物摂取量に差なく体重増加を減少させた方法を説明すると考えられる。一方、IFはob/obマウスにおけるO2消費量の増加に失敗し(図5C-D)、さらには断食期間中のエネルギー支出の減少につながった。一貫して、IF誘発脂肪熱発生はob/obマウスにおいて完全に廃止された(データは示されていない)。これらのデータは、遺伝的および環境的背景が異なる個人に対して異なる働きをする可能性があるため、IFの可能な制限を示唆しています。

図1:24時間断食後の給餌分析と1:1と2:1 IFの比較(A)24時間絶食前後のマウスの毎日の体重変化(n=10)。(B)24時間断食前後の毎日のエネルギー摂取量(n=5ケージ;ケージあたり2匹)。(C) 代替日断食(1日の給餌/1日断食、1:1 IF)と2:1の断続的な断食(すなわち、2日の給餌/1日断食)の間のエネルギー摂取量の比較。1:1 IFレジメンでは、食物摂取の2日間にわたる食物摂取と比較して、その後の1日間の再摂食の間に食物摂取量の約80%しか補償されなかった。一方、2日間の給餌が行われた場合、エネルギー摂取量の99%は、3日間の給餌と比較して達成された。データは平均±SEMとして表される。この図はKimらから8.この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:アイソカロリック2:1 IFレジメンの概略図PF制御の場合、IF処理マウスによる摂食の2日間の間に消費される食物の量は3つの等しい部分に分けられ、次のサイクル中にPFマウスに毎日提供される。AL = アドリビタム;PF = ペアフィード。この図の一部はKim et al.8の許可を得て再現した。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:野生型マウスとob/obマウスの体重、食物摂取量、体組成に対するAL、IF、PF効果の比較(A,B,C)体重、食物摂取、およびIFレジメンの16週間の間に正常な食事(ND)または高脂肪食(HFD)下でALまたはIF処理野生型マウスにおける体組成。データは平均 ± SEM として表されます (ND-AL: n = 7;ND-IF: n = 8;HFD-AL: n = 7;および HFD-IF: n = 8);学生ニューマン・キールスポストホック分析を伴う一方向または双方向のANOVA;**p < 0.01対.HFD-AL. (D,E,F) 体重、食物摂取量、およびPFにおける体組成とIFマウスは、IFレジメンの12週間の間に高脂肪食(HFD)を与えた。(PF: n = 6 および IF: n = 6)ペアになっていない両側のスチューデントのt-テスト。*p < 0.05対.HFD-PF;NS = 有意ではありません。(G,H,I)体重、食物摂取量、およびAL、PF、またはIF処理ob/obマウスの体組成に通常のチョウを与える(Ob-AL: n = 4;Ob-PF: n = 7;Ob-IF: n = 6);Ob-AL vs.Ob-PF: *p < 0.05;Ob-AL vs.Ob-IF: *p < 0.05;Ob-PFと.Ob-IF です。パネルA-FはKim et al.8の許可を得て再現した。パネルG-IはKim et al.15の許可を得て再現した。この図の大きなバージョンを表示するには、ここをクリックしてください。
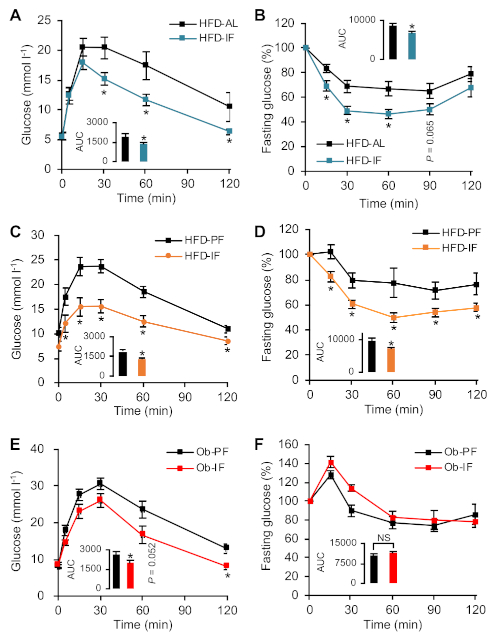
図4:野生型マウスとob/obマウスの両方におけるIFによるグルコース恒常性の改善(A,B)IFレジメンの16週間後のHFD-ALおよびHFD-IF野生型マウスにおける腹腔内GTTおよびITT。差し込みはカーブ(AUC)の下の領域を示します。*p < 0.05対HFD-AL. (C,D)GTT および ITT HFD-PF IF レジメンの 12 週間後の HFD-IF 野生型マウスと比較して.差し込みは AUC を示します。*p < 0.05対HFD-PF. (E,F)GTT および ITT IN OB-IF IF 16 週間後の Ob-PF マウスと比較して.差し込みは AUC (*p < 0.05対を示します) を示します。Ob-PF)。パネルA-DはKim et al.8の許可を得て再現した。パネルE及びFはKimら15の許可を得て再現した。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:IF処理野生型およびob/obマウスにおけるエネルギー支出分析(A)野生型マウスにおける2:1 IFの1サイクル中のO2消費の痕跡(すなわち、1日の断食の後に2日間の摂食)。(B) 断食、給餌中の1時間当たりのO2消費量、および2:1 IFの1サイクル。データは平均 ± SEM (HFD-AL: n = 6; および HFD-IF: n = 12) として表されます。*p < 0.05対.HFD-AL. (C) O2 2:1 IFの1サイクル中のob/obマウスの消費痕跡。(D) 断食、給餌中の1時間当たりのO2消費量の平均、および2:1 IFの1サイクル(Ob-PF: n = 7;Ob-IF: n = 6);*p < 0.05対.Ob-PF. パネルBはKimら8の許可を得て再現した。パネルC及びDはKimら15の許可を得て再現した。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
IFは、ヒトおよび動物の両方の様々な疾患に有益な健康影響を提供することが十分に文書化されている8,15, 16,17,18,19.オートファジーや腸内微生物叢などのその根底にあるメカニズムが最近解明されている。提示されたプロトコルは、食事誘発性肥満および関連する代謝機能障害に対するIFのカロリー非依存性代謝利益を調査するためのマウスにおけるアイソカロリック2:1 IFレジメンを記述する。全体的なカロリー摂取量6、7の減少をもたらす代替日断食(1:1 IF)プロトコルとは異なり、2:1 IFレジメンでさらに1日間の再供給を提供することにより、野生型マウスにおける等カロリー状態の維持を可能にする。
さらに、1:1 IFと比較して、2:1 IFレジメンはマウス20における断食媒介性ストレスまたは魚雷を減少させ得るし、また、一般的な食事法に匹敵する、5:2ダイエット2。その効果はテストされていませんが、レジメンは再供給の追加の日数(例えば、3:1または4:1 IF)を提供することによって変更することができます。さらに、提示されるこのプロトコルは、イソカロリックダイエットレジメンを達成し、HFD誘発性肥満および糖尿病19、21、22に対する代謝上の利点を提供することが知られている活性相21の間に食物へのアクセスが1日あたり8時間に制限される時間制限摂食(TRF)と呼ばれる時間単位に容易に調整することができる。
摂食解析(図1B)に示すように、24時間の断食直後の高羽動は野生型マウスでは徐々に減少し、等カロリーIFを可能にする。しかしながら、この等角化状態は、レプチンシグナル伝達媒介性満腹およびエネルギー代謝を欠くため、ob/obマウスでは達成できず、連続的な高化表現型23、24につながる。したがって、IF実験を行う前に、目的のマウスモデルの摂食挙動を調べることをお勧めします。高phagicマウスモデル(例えば、ob/ob、db/db、Sim1 +/-、MC4R -/-)24、25、26を用いたIFの効果を調べるには、このプロトコルで説明されているように、適切な比較を行うためには、対給餌群をアイソカリック実験制御として採用することが重要である。 また、低血圧表現型(例えば、メラニン含有ホルモンKOマウス)27を用いたマウスモデルを試験する際には、慎重な計画が必要である。
IF研究のために考慮すべき重要な要因は、マウスの様々な生理学的および行動パラメータに影響を与えるハウジング温度である。特に、低温暴露(4~6°C)は、コア体温28を維持するためのエネルギー摂取量を有意に増加させる。これに対し、熱利得が熱損失によってバランスが取れている耐熱性条件(30°)では、食品消費量の減少が著しく減少する8.代謝の結果に関しては、冷間暴露は、熱中性状態によって妨げられる脂肪熱発生を誘発する。従って、収容温度がIFの代謝表現型及び適切な摂食:断食比に影響を及ぼし、等カロリーIFを達成することが期待される。
実際、イソカロリック2:1IFは熱中性条件下で達成できることが以前から実証されており、IFとAL群8との食物摂取に差なく、食事誘発性肥満および代謝機能障害における代謝健康の改善につながる。しかし、低温暴露下のマウスは高羽動圧型を示し、IF群の栄養不足につながるため、等角IFは寒い温度で2:1の比率で達成できない場合があります。冷間暴露およびIFは、肥満との闘いに役立つ同等の代謝結果とメカニズム(すなわち、脂肪熱発生および改善されたグルコース恒常性)を表示するので、代謝への影響を最大化するためにこれら2つの介入を組み合わせることに関心がある。そこで、これを適切に試験するには、IF実験を行う前に摂食分析を行い、冷間暴露下でペア供給制御群を利用することが推奨される。
IF研究の結果に影響を与える可能性のある他の要因には、住宅密度が含まれます。以前の研究と同様に、より密に収容されたマウス29で食物消費量が減少したことを示し、5匹のケージからマウスは2つのケージからのものよりも有意に少ない食物を消費した(未発表の結果)。また、5匹のマウスを収容するケージ内の温度が1〜2匹のマウス30を収容するものよりも1〜2°C高いため、収容密度が周囲温度に大きく影響することが実証されている。この研究は、住宅密度が食物摂取量に大きな影響を与えなかったと結論付けたが(5週間調べられた)、12~16週間続くIF試験では、住宅密度の影響を受けるケージ内の温度が依然として食物摂取量とエネルギー代謝に影響を及ぼす可能性がある。一緒に、ケージに収容されたマウスの同じ数を維持し、研究の過程でケージあたりの数の変更を最小限に抑えることは重要です。
要約すると、このレポートは、マウスにおけるアイソカロリック2:1 IFをテストするためのシンプルで再現可能なプロトコルを示しています。現在の研究は、食事誘発性肥満および代謝機能障害におけるIFの代謝上の利点に焦点を当てているが、心血管などの他の条件に対するアイソカロリックIFの保護および治療効果を調査するために容易に適応することができると神経疾患。
開示事項
著者たちは何も開示する必要はない。
謝辞
K.H.Kはカナダグラント・イン・エイド心臓・脳卒中財団(G-18-0022213)、J.P.ビッケル財団、オタワ大学ハートインスティテュートスタートアップファンドの支援を受けています。H.-K.S.は、カナダ保健研究所(PJT-162083)、ルーベンとヘレン・デニス・スカラーとサンライフ・ファイナンシャル・ファイナンシャル・ニュー・リサーチ・アワード(バンティング&ベスト糖尿病センター(BBDC)と自然科学の糖尿病研究に対する助成金を受けています。カナダのエンジニアリング研究評議会(NSERC)(RGPIN-2016-06610)。R.Y.K.は、オタワ大学心臓病研究基金のフェローシップによって支援されました。J.H.L.はNSERC博士奨学金とオンタリオ大学大学院奨学金の支援を受けました。Y.O.は、UOHI寄付大学院賞、エリザベス2世大学院科学技術大学院奨学金の支援を受けています。
資料
| Name | Company | Catalog Number | Comments |
| Comprehensive Lab Animal Monitoring System (CLAMS) | Columbus Instruments | Indirect calorimeter | |
| D-(+)-Glucose solution | Sigma-Aldrich | G8769 | For GTT |
| EchoMRI 3-in-1 | EchoMRI | EchoMRI 3-in-1 | Body composition analysis |
| Glucometer and strips | Bayer | Contour NEXT | These are for GTT and ITT experiments |
| High Fat Diet (45% Kcal% fat) | Research Diets Inc. | #D12451 | 3.3 Kcal/g |
| High Fat Diet (60% Kcal% fat) | Research Diets Inc. | #D12452 | 4.73 Kcal/g |
| Insulin | El Lilly | Humulin R | For ITT |
| Mouse Strain: B6.Cg-Lepob/J | The Jackson Laboratory | #000632 | Ob/Ob mouse |
| Mouse Strain: C57BL/6J | The Jackson Laboratory | #000664 | |
| Normal chow (17% Kcal% fat) | Harlan | #2918 | |
| Scale | Mettler Toledo | Body weight and food intake measurement |
参考文献
- Gill, S., Panda, S. A Smartphone App Reveals Erratic Diurnal Eating Patterns in Humans that Can Be Modulated for Health Benefits. Cell Metabolism. 22 (5), 789-798 (2015).
- Longo, V. D., Panda, S. Fasting, Circadian Rhythms, and Time-Restricted Feeding in Healthy Lifespan. Cell Metabolism. 23 (6), 1048-1059 (2016).
- Longo, V. D., Mattson, M. P. Fasting: molecular mechanisms and clinical applications. Cell Metabolism. 19 (2), 181-192 (2014).
- Patterson, R. E., et al. Intermittent Fasting and Human Metabolic Health. Journal of the Academy of Nutrition and Dietetics. 115 (8), 1203-1212 (2015).
- Fontana, L., Partridge, L. Promoting health and longevity through diet: from model organisms to humans. Cell. 161 (1), 106-118 (2015).
- Boutant, M., et al. SIRT1 Gain of Function Does Not Mimic or Enhance the Adaptations to Intermittent Fasting. Cell Reports. 14 (9), 2068-2075 (2016).
- Gotthardt, J. D., et al. Intermittent Fasting Promotes Fat Loss With Lean Mass Retention, Increased Hypothalamic Norepinephrine Content, and Increased Neuropeptide Y Gene Expression in Diet-Induced Obese Male Mice. Endocrinology. 157 (2), 679-691 (2016).
- Kim, K. H., et al. Intermittent fasting promotes adipose thermogenesis and metabolic homeostasis via VEGF-mediated alternative activation of macrophage. Cell Research. 27 (11), 1309-1326 (2017).
- Lancaster, G. I., Henstridge, D. C. Body Composition and Metabolic Caging Analysis in High Fat Fed Mice. Journal of Visualized Experiments. (135), (2018).
- Ayala, J. E., et al. Standard operating procedures for describing and performing metabolic tests of glucose homeostasis in mice. Disease Models & Mechanisms. 3 (9-10), 525-534 (2010).
- Heijboer, A. C., et al. Sixteen h of fasting differentially affects hepatic and muscle insulin sensitivity in mice. Journal of Lipid Research. 46 (3), 582-588 (2005).
- McGuinness, O. P., Ayala, J. E., Laughlin, M. R., Wasserman, D. H. NIH experiment in centralized mouse phenotyping: the Vanderbilt experience and recommendations for evaluating glucose homeostasis in the mouse. American Journal of Physiology: Endocrinology and Metabolism. 297 (4), 849-855 (2009).
- Jorgensen, M. S., Tornqvist, K. S., Hvid, H. Calculation of Glucose Dose for Intraperitoneal Glucose Tolerance Tests in Lean and Obese Mice. Journal of the American Association for Laboratory Animal Science. 56 (1), 95-97 (2017).
- Nagy, C., Einwallner, E. Study of In Vivo Glucose Metabolism in High-fat Diet-fed Mice Using Oral Glucose Tolerance Test (OGTT) and Insulin Tolerance Test (ITT). Journal of Visualized Experiments. (131), 56672 (2018).
- Kim, Y. H., et al. Thermogenesis-independent metabolic benefits conferred by isocaloric intermittent fasting in ob/ob mice. Scientific Reports. 9 (1), 2479 (2019).
- Li, G., et al. Intermittent Fasting Promotes White Adipose Browning and Decreases Obesity by Shaping the Gut Microbiota. Cell Metabolism. 26 (4), 672-685 (2017).
- Mitchell, S. J., et al. Daily Fasting Improves Health and Survival in Male Mice Independent of Diet Composition and Calories. Cell Metabolism. 29 (1), 221-228 (2019).
- Cignarella, F., et al. Intermittent Fasting Confers Protection in CNS Autoimmunity by Altering the Gut Microbiota. Cell Metabolism. 27 (6), 1222-1235 (2018).
- Martinez-Lopez, N., et al. System-wide Benefits of Intermeal Fasting by Autophagy. Cell Metabolism. 26 (6), 856-871 (2017).
- Lo Martire, V., et al. Changes in blood glucose as a function of body temperature in laboratory mice: implications for daily torpor. American Journal of Physiology: Endocrinology and Metabolism. 315 (4), 662-670 (2018).
- Chaix, A., Zarrinpar, A., Miu, P., Panda, S. Time-restricted feeding is a preventative and therapeutic intervention against diverse nutritional challenges. Cell Metabolism. 20 (6), 991-1005 (2014).
- Chaix, A., Lin, T., Le, H. D., Chang, M. W., Panda, S. Time-Restricted Feeding Prevents Obesity and Metabolic Syndrome in Mice Lacking a Circadian Clock. Cell Metabolism. 29 (2), 303-319 (2019).
- Wang, B., Chandrasekera, P. C., Pippin, J. J. Leptin- and leptin receptor-deficient rodent models: relevance for human type 2 diabetes. Current Diabetes Reviews. 10 (2), 131-145 (2014).
- Pan, W. W., Myers, M. G. Leptin and the maintenance of elevated body weight. Nature Reviews: Neuroscience. 19 (2), 95-105 (2018).
- Jackson, D. S., Ramachandrappa, S., Clark, A. J., Chan, L. F. Melanocortin receptor accessory proteins in adrenal disease and obesity. Frontiers in Neuroscience. 9, 213 (2015).
- Tolson, K. P., et al. Postnatal Sim1 deficiency causes hyperphagic obesity and reduced Mc4r and oxytocin expression. Journal of Neuroscience. 30 (10), 3803-3812 (2010).
- Shimada, M., Tritos, N. A., Lowell, B. B., Flier, J. S., Maratos-Flier, E. Mice lacking melanin-concentrating hormone are hypophagic and lean. Nature. 396 (6712), 670-674 (1998).
- Reitman, M. L. Of mice and men - environmental temperature, body temperature, and treatment of obesity. FEBS Letters. 592 (12), 2098-2107 (2018).
- Chvedoff, M., Clarke, M. R., Irisarri, E., Faccini, J. M., Monro, A. M. Effects of housing conditions on food intake, body weight and spontaneous lesions in mice. A review of the literature and results of an 18-month study. Food and Cosmetics Toxicology. 18 (5), 517-522 (1980).
- Toth, L. A., Trammell, R. A., Ilsley-Woods, M. Interactions Between Housing Density and Ambient Temperature in the Cage Environment: Effects on Mouse Physiology and Behavior. Journal of the American Association for Laboratory Animal Science. 54 (6), 708-717 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved