Method Article
CAS9タンパク質-gRNA複合体のエレクトロポレーションによるアクソロトル脊髄神経幹細胞の直接遺伝子ノックアウト
要約
ここに提示されるプロトコルは、CAS9-gRNA複合体を脊髄中央管に注入し、続いてエレクトロポレーションを行うことによって、軸総便脊髄の時間および空間制限遺伝子ノックアウトを行うプロトコルである。
要約
軸次は脊髄を完全に再生する独特な機能を有する。これは主に、生涯を通じて神経幹細胞(NSC)として残存するエペンディマル細胞が、エペンディマルチューブを改変し、脊髄損傷後に失われたニューロンに分化するために増殖するためである。これらのNSCが発達後に多能性を維持し、脊髄損傷時に増殖する方法を解読し、正確な損傷前の構造を改革することで、哺乳類の脊髄がどのように再生できるか、また潜在的な治療選択肢に関する貴重な洞察を提供することができます。限られた期間内にNSCの特定のサブセットで遺伝子ノックアウトを行うことで、開発摂動効果に惑わされることなく、これらの再生プロセスの背後にある分子機構の研究が可能になります。ここで説明するCRISPR-Cas9システムを用いて軸次脊髄NSCで遺伝子ノックアウトを行う方法である。CAS9-gRNA複合体を脊髄中央管路に注入し、その後エレクトロポレーションを行うことで、標的遺伝子は所望の時点で脊髄の特定の領域内のNSCでノックアウトされ、期間中に脊髄NSCの分子研究が可能になります。再生。
概要
ほとんどの脊椎動物の脊髄は、損傷後に再生することができず、永久的な障害につながる。アクソロトルのようないくつかのサラマンダーは、顕著な例外です。アクソロtlは構造的に同一の脊髄を完全に再生し、脊髄機能を完全に回復させることができる。軸次脊髄の再生能力の多くは、エペンディマル細胞によるものです。これらの細胞は中央運河に並び、哺乳類とは異なり、軸三ロットエペンディマル細胞は胚発生後の神経幹細胞(NSC)として残ります。脊髄損傷(例えば、尾切断から)の後、これらのNSCは、エペンディマルチューブを再成長させ、失われたニューロン1、2、3を置き換えるために分化するために増殖する。アクソロtl脊髄NSCが多能性であり、損傷後に活性化される方法を明らかにすると、ヒト患者の新しい治療戦略の開発に関する貴重な情報を提供することができます。
CRISPR-Cas9遺伝子ノックアウト技術の進歩により、遺伝子機能を解読するためのノックアウトを行うことが容易になり、アキセロチル4、5を含む様々な種で幅広い適用性を有することが示されている。6,7,8.完全なアクソロトルゲノムとトランスクリプトームの最近のリリースは、現在、任意のゲノム遺伝子座を標的にし、より良いオフターゲット効果9、10、11、12を評価することができます,13歳,14.CRISPR-Cas9システム15を使用してアクセオロチルのノックアウトおよびノックイン用に最適化されたプロトコルが開発されました。CAS9タンパク質-gRNAリボヌクレオタンパク質(RNP)の形態でのCRISPR-Cas9機械の送達は、Cas9およびgRNAコードプラスミド4を使用するよりも効率的であることが示された。これは、RNPがプラスミドベクターよりもサイズが小さく、DNA切断をすぐに作成する能力、およびRNA分解からgRNAを保護するためである可能性があります。さらに、RMP を使用すると、転写と変換をバイパスします。したがって、プラスミド要素が異なる種から派生した場合、プロモーター強度や最適なコドン使用量などの問題を回避します。
機能喪失研究は、対象遺伝子の潜在的な機能を調査するための一般的なアプローチの一つです。再生中の遺伝子機能を研究するためには、発達への影響を避けるために、損傷の直前にノックアウトを行うのが理想的です。さらに、ノックアウトは NSC と再生領域の両方に制限する必要があります。すべてのNSC(Cre-LoxPシステムの場合)における標的遺伝子のノックアウトは、結果の解釈を混乱させる可能性のある再生に関連しない効果を生み出す可能性があります。幸いなことに、軸総進脊髄の構造はNSCの時間およびスペース制限されたノックアウトのための独特な機会を提供する。脊髄NSCのほとんどは中央管と接触し、中央運河16、17と接触する細胞の大部分を構成する。したがって、CAS9-gRNA複合体を中央運河に注入し、続いてエレクトロポレーションを行い、特定の時間4、18、19における所望の領域における脊髄NSCへの送達を可能にする。このプロトコルは、これがどのように行われるかを示し、標的脊髄NSCのノックアウトを高度に浸透させ、その後の分析を行い、再生およびNSC行動への影響を研究する。
プロトコル
すべての動物実験は、動物実験に関する地域および国の規制に従い、関連する機関審査委員会の承認を得て行われる必要があります。
1. CAS9-gRNA RNP ミックスの準備
- gRNAの設計と合成を行います。
注: gRNA の設計および合成に関する他の出版物を参照してください。 - 社内で準備するか、商業的に購入することにより、CAS9-NLSタンパク質を取得します。
- CAS9-NLSタンパク質の5 μg、gRNAの4 μg、10x CAS9バッファーの0.9 μLを混合してCAS9-gRNA混合物を調製し、ヌクレアーレスフリーH2O.アリコートで10μLにボリュームを充填し、すぐに使用しない場合は-80°Cで保存します。
2. エレクトロポレーション用のアガロースプレートの準備
- 1x DPBSで2%(wt/vol)アガロース溶液の200mLを準備します。溶液を電子レンジで加熱して溶かし、約10mm(動物全体を覆うのに十分な深さ)に10cmペトリ皿に注ぎます。
- プレートが室温で固色するようにします。すぐに使用しない場合は、プレートを4°Cで保管してください。
- 外科用メスを用いて、アガロースプレートを切断して尾をまっすぐに保持するためのスリットを作り、動物の体内にフィットするためのウェル、および電極を配置するための2つの余分な井戸(図1E)。
- プレートを氷の上に置き、氷冷1x DPBSでつばまで満たします。同じDPBSソリューションを使用してプレートを作成し、セットアップで一貫した電気伝導性を確保します。
3. エレクトロポレータの設定
- エレクトロポレータを設定します。ポリングパルスを設定し、70Vのバイポーラパルスを1回、持続時間5ms、50ミリ秒の間隔、電圧減衰なしで構成します。転送パルスを設定して、40 V のバイポーラ パルスを 4 つ、持続時間が 50 ミリ秒、間隔が 999 ミリ秒、電圧減衰が 10% になります。
- 電極をエレクトロポレーターに接続し、ピンセットを7mm離して調整します。電ポレーションの前と間にDPBSのビーカーに電極を浸します。
4. マイクロインジェクションガラス毛細血管の準備と積み込み
- 発熱値を決定するために、製造元の指示に従って、燃焼/茶色のマイクロピペットプーラーでランプテストを実行します。
- 次のパラメータを使用してテーパーエンドを持つプルインジェクションキャピラリー:熱=ランプ試験値、プル=100、速度=100、時間=100。
- 立体顕微鏡下で針を観察します。細かい鉗子を使用して、それが傾斜した先端を持っているように、斜めの毛細血管を壊します。皮膚を突き刺すのに十分な強さながら、中央運河を標的にするのに十分な薄い位置で壊れます。
注:直径が約20μmまたは脊髄の直径の約50%である点は良い出発点です。最適な破壊を得るためには、複数の試行が必要な場合があります。 - 1:30の比率でRNPミックスに高速グリーンFCF溶液を追加し、マイクロローダーピペットチップで毛細血管に注入ミックスの約5 μLをロードします。
- 傾斜した先端を下向きにして、空気ポンプに毛細血管を取り付けます。
5. 空気圧ポンプの設定
- 空気ポンプを構成します。ホールドを平方インチ(psi)あたり0.5ポンドに設定し、2 psiホールドにイジェクトし、ゲートまでの持続時間を設定します。
- キャピラリーを水滴に浸し、フットペダルを押して注入することで、毛細血管と空気ポンプの設定をテストします。インジェクションミックスがゆっくりと安定した流れで出てくることを確認します。
- 注入ミックスが自発的に漏れ出し始めたり、毛細血管に水が吸い上げたりする場合は、ホールド圧力を調整します。射出圧力を上げるか、注射ミックスがあまりにも遅く出てくる場合は、毛細血管の多くを破る.注射が速すぎる場合は、吐出圧力を下げなさい。
6. 脊髄にRNPミックスを注入する
- 0.03%ベンゾカイン溶液でアネソメチルを少なくとも10分間麻酔する。
- リング鉗子を持つ動物をピックアップし、シリコンのベッドの上に置き、動物の左側を上向きにし、尾が右に向かって向いています。噴射部位を立体顕微鏡の視野の中央に配置する(図1A)。
- 視野の右側から毛細血管が60°で入ってくるようにマイクロマニピュレータを調整します(図1B)。
- 脊髄と中央管を同定する(図1C)。
注:脊髄は、ノトコードの上の管状構造です。 - 中央の運河を目指して、毛細血管を前方に動かして、皮膚と筋肉を脊髄の中央管にそっと突き刺します。脊髄が尾筋のすぐ下にあるので、毛細血管の動きを小さなステップに制限します。
- フットペダルを長押しして、ミックスを中央運河に注入します。RNP ミックスが中央運河に沿って両方向の青い線として広がっているかどうかを観察し、毛細血管が正しく配置されていることを示します(図 1D)。
- これが発生しない場合は、RNPミックスが入り始めるまで、キャピラリーを少し出入りしながらフットペダルを押したままにしておきます。毛細血管が組織によって詰まった場合は、より高い圧力で水に排出することによってそれをクリアします。
- RNP ミックスが中央運河に広がるのに十分なように、吐出圧力を調整しますが、構造を吹き飛ばすほどではありません。
- インジェクションミックスが中央管に沿ってさらに広がるように足のペダルを押し続け、脊髄の末端と脳の心室の端部に達するまで。
注:これは、動物のサイズに応じて最大2分かかる場合があります。RNPミックスが脳心室に入るようにしばらくすると、圧力を上げる必要があるかもしれません。 - 注射に成功した後、できるだけ早くエレクトロポレーションに進みます。
7. エレクトロポレーション
- リング鉗子を使って動物を氷上の準備されたアガロースエレクトロポレーションプレート(図1E)に移します。尾をスリットの中に入れ、アガロースに挟み込みます(図1F)。
- 尾の両側の井戸に電極を配置します。動物と電極全体が氷冷PBSで覆われていることを確認します。
- フットスイッチを押してエレクトロポレーションを開始します。
- エレクトロポレーションが完了したら、動物を水に戻します。
- 必要に応じて、より多くの動物を注入するために進みます。
- 麻酔がすり減った後に電気で送電された動物が健康であること、および尾部に損傷がないことを確認してください。
8. ノックアウト効率の評価
- 電気ポレート動物の尾を修正します。尾の断面を作り、続いて免疫組織化学染色を行い、タンパク質レベルでノックアウトの効率を評価します。
注:電気ポレーション後に尾切断を行う場合は、カットオフテールがこの目的のために使用することができます。Gfpまたはチロシナーゼに対してgRNAで電解した動物は、例えば、陰性対照4として用いることができる。 - あるいは、電ポレートされた脊髄を抽出し、DNAのためにlysedすることができる。ジェノタイピング PCR の後にサンガーシーケンシングまたは次世代シーケンシングを実行して、編集された遺伝的遺伝子座15のパーセンテージを評価する。
注:結果として得られる編集効率は、中央ルーメンに頂点的な接触を欠く非電解細胞およびニューロンが含まれているため、NSCの実際の編集効率を過小評価し、RNPミックスを受け取らない。
結果
軸次脊髄中央管へのSox2に対するCAS9-gRNA複合体の注入とエレクトロポレーションは、脊柱NSCの大部分でSOX2免疫反応性の大規模な損失を引き起こし、コントロールとしてチロシナーゼ(Tyr)に対するgRNAを用いた(図2)。A)B3-チューブリン(TUJ1で染色された)はニューロンのマーカーであり、NSCでは発現しなかったが、中央管を取り囲むSOX2-TUJ1-細胞はSox2欠損を有する細胞であると考えられていた。定量化は、CAS9-Sox2-gRNAエレクトロポレーション(図2B)によるかなりの数のNSCにおけるSox2ノックアウトを示し、この方法が脊髄NSCにおける効率的かつ高度に貫通した遺伝子ノックアウトにつながったことを示した。
同時注射とエレクトロポレーションの後、Sox2およびGfpに対する2つのCAS9-gRNA複合体をそれぞれ、ユビキタスGFP発現(CAGGS-GFP)を持つトランスジェニック軸軸に混合し、ダブルノックアウトNSCの高い割合を占めています。観察された(図2C,D)、プロトコルが複数の遺伝子を柔軟にノックアウトするために使用できることを示す。
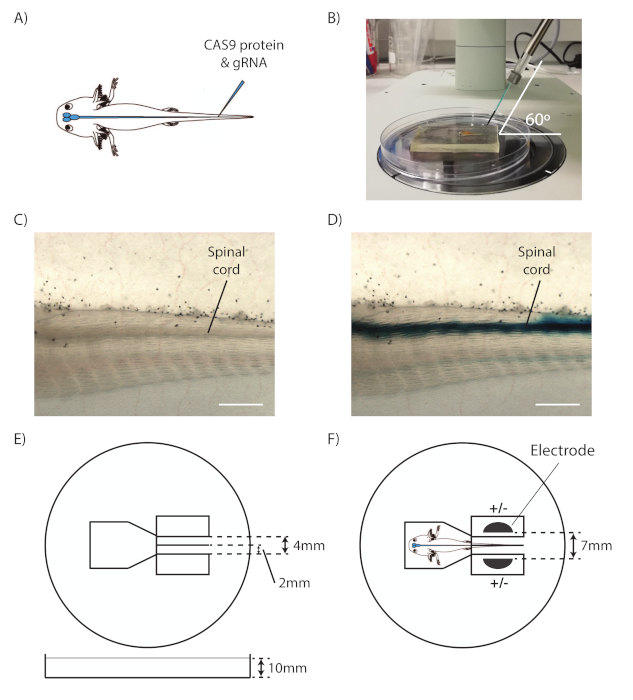
図 1: アクソロトル脊髄注射とエレクトロポレーション。(A) 軸次脊柱脊髄中央管へのCAS9-gRNA RNPの注射を示す概略図。(B)注射用マイクロマニピュレータセットアップ。(C) 軸次尾の立体顕微鏡を通して、脊髄が示されている。(D) 注入された脊髄を持つ軸切り尾の立体顕微鏡を通して見る。(E) エレクトロポレーションプレートの回路図。(F)エレクトロポレーションプレート内に配置された動物および電極の概略図、エレクトロポレーションの準備ができている。スケールバー = 1 mm。この図は、アルボルスと田中18から適応されています.この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 2: 代表的なノックアウト結果は、軸次脊椎NSCで行います。(A) CAS9-Sox2-gRNA(n=21)の脊髄注入およびエレクトロポレーションは、免疫組織化学染色による15日後のNSCの大部分でSOX2の喪失をもたらした。CAS9-Tyr-gRNA(n=21)は陰性対照として機能した。スケールバー = 100 μm。(B) 定量化は、SOX2+NSC(p<0.001、学生のt検定による)の有意な減少を示し、SOX2-TUJ1-中央運河を取り囲むSPCをSOX2欠失を保有するNSCとしてカウントした。 誤差バー = SD. (C) Sox2-gRNAとGfp -gRNAをCAS9(n=6)に結合した同時注入とエレクトロポレーションは、免疫組織化学染色によるNSCの大部分におけるSOX2およびGFPの喪失につながった。 CAS9-Tyr-gRNA(n=6)は負の対照として機能する。スケールバー = 100 μm。(D) 定量化は、削除を有するすべての標的NSCの中で、過半数(94%)であることを示した二重欠失(GFP−SOX2−)、わずかな割合(6%)単一の削除(GFP+ SOX-またはGFP-SOX2+)を持っています。この図は、Fei et al.4から適応されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
記載されたプロトコルは、軸総部脊髄のNSCにおける時間および空間制限遺伝子ノックアウトを可能にする。現在のプロトコルでは、NSC を定義された時間と場所で特定のターゲティングを可能にします。Cre-LoxPシステムを使用する際に発生する脳などの他の領域のNSCの遺伝子ノックアウトに起因する潜在的な望ましくない影響を回避します。また、持続的なノックアウトに起因する発達効果を回避し、再生に焦点を当てた遺伝子機能の研究を可能にします。さらに、このプロトコルは野生動物で行うことができ、Cre-LoxPシステムに必要なトランスジェニック軸細を生成するのに必要な長い待ち時間を回避できます。また、複数の遺伝子を同時にノックアウトする汎用性を提供し、浸透性が高く、F0動物に対して実験を行うことを可能にします。重要なことに、この手順は、尾および脊髄再生4に観察可能な影響を及ぼさないことが示されている。
CAS9タンパク質-gRNA RNP複合体の使用はまた、Cas9およびgRNA発現プラスミド4を使用するシステムよりもはるかに高い効率を示す。これは、プラスミドに比べてRNP複合体のサイズが小さく、哺乳類系由来のプラスミドからのCAS9タンパク質の発現に影響を与える差動コドンの使用が原因である可能性が高い。さらに、CAS9タンパク質-gRNA RNP複合体は直ちに破断を誘発することができるので、ノックアウトは迅速に起こる。修飾されたゲノム遺伝子座の60%-70%は、エレクトロポレーションの24時間以内にPCRをジェノタイピングすることによって観察されている(データは示されていない)。修復テンプレートを共同電解することにより、この戦略を使用してノックインを実行する可能性もあります。ノックイン戦略の数は、詳細と考慮事項は、このパブリケーションの範囲外であるが、それらは別の出版物15で詳細に説明されています。
一方、このプロトコルにはいくつかの制限があります。染色またはジェノタイピングPCRは、一般的に、面倒な可能性がある各実験動物におけるノックアウトの程度を評価するために必要とされる。この方法からの遺伝子ノックアウトは、主に中央運河を取り巻くNSCに限定されていますが、1)それらも中央運河と接触している、または2)RNPミックスがcenから漏出しているため、他の細胞タイプも標的にされる可能性があることを否定することはできません。エレクトロポレーションの前にトラル運河。結果を解釈する際には、これらの要因を考慮する必要があります。
gRNA設計
最近発表されたアクソロトルゲノムおよびトランスクリプトームにより、アクソロトル遺伝子とその配列の同定は、9、10、11、12、13の方がはるかに容易になった。gRNAの設計に関する詳細なガイドは、軸次15を独占的に扱うものも含め、他の場所で説明されています。事前に編集効率を高めるために少なくとも3つのgRNAを設計し、テストし、実際の実験に最適な設計を選択することをお勧めします。gRNAの効率は、1細胞段階23で新たに敷設されたアクソロトル卵にCAS9-gRNAミックスを注入することによって試験することができる。編集効率は、孵化した幼虫をジェノタイズすることによって評価することができます。
インジェクションに関する考慮事項
脊髄の注射部位は、針による物理的損傷に苦しんでおり、中央管外の組織へのRNPミックスの広がりを受けるので、分析する目的の領域から離れた位置で注射を行うことが重要である。例えば、脊髄再生における標的遺伝子の効果を調べるために電気ポレーション後に尾切断を行う場合、切断によって部位が除去される場所に注射を行う必要がある。
注射毛細血管で中央運河に入ることは、このプロトコルの最も重要なステップであり、新しいユーザーは実際の実験の前に練習することをお勧めします。注射は、脊髄の後端にある小動物(長さ2.5cm未満)に対して行われるのが最も良く、毛細血管の先端を中央管に配置するのが最も簡単である。青色のRNPミックスの初期広がりを注意深く観察することをお勧めします。RNPミックスが脊髄の周りの髄膜空間に注入される可能性がある。脊髄の中央に沿ってラインとして鋭く、速い広がりは中央管18への注入が成功した示す。何も出ない場合やスプレッドが途中で停止した場合は、毛細血管を少し出入りしながらフットペダルを押したままにしておくことをお勧めします。これが失敗した場合は、毛細血管を再配置するか、開口部が詰まっているかどうかを確認する必要があります。RNPミックスが脳心室に広がるためには、末端に向かって吐出圧力を高める必要が生じることが多い。脳心室を満たしてもらうことは、脊髄の電気ポレーションには必要ないが、RNPミックスが中央管に注入されたことを示す最良の指標である。
エレクトロポレーションに関する考慮事項
他の組織に大きな損傷を与えたり、動物を殺すことなく、大部分のNSCにRNPを十分に送達するために、あらかじめエレクトロポレーションパラメータを最適化することをお勧めします。このプロトコルは、サイズ18の長さ2.0〜2.5センチメートルの動物のために最適化されています。これより小さい動物を扱う場合は、35Vへの移動パルス電圧の低減が必要になる可能性が高い。一方、大型動物は、より高い電圧および/またはより多くのパルスを必要とします。さらに、電極間の距離は効率に影響を与える。大型動物には6mmまでの距離の短縮が必要な場合があります。
開示事項
著者は利益相反を宣言しない。
謝辞
継続的かつ長期的な支援を賜り、ありがとうございます。この研究は、中国国立自然科学財団(NSFC)助成金(317716)、南中国師範大学(S82111および8S0109)からの研究開始助成金、および中国ポストドクター科学財団助成金(2018M633067)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | A9539 | |
| Benzocaine | Sigma-Aldrich | E1501-100G | |
| Benzocaine 0.03 % (wt/vol) | Mix 500 ml of 10× TBS, 500 ml of 400% (wt/vol) Holtfreter’s solution and 30 ml of 10% (wt/vol) benzocaine stock solution. Fill up the volume to 10 L with dH2O. The solution can be stored at room temperature for up to 6 months. | ||
| Benzocaine 10 % (wt/vol) | Mix 50 g of benzocaine in 500 ml of 100% (vol/vol) ethanol. The solution can be stored at room temperature for up to 12 months. | ||
| Borosilicate glass capillaries 1.2 mm O.D., 0.94 mm I.D. | Stutter Instrument | BF120-94-8 | |
| CaCl2·2H2O | Merck | 102382 | |
| CAS9 buffer, 10x | Mix 200 mM HEPES and 1.5 M KCl in RNase-free water. Adjust pH to 7.5. Filter sterilize, aliquot and store at −20 °C for up to 24 months | ||
| CAS9-NLS protein | PNA Bio | CP03 | |
| Cell culture dishes, 10cm | Falcon | 351029 | |
| Dumont #5 - Fine Forceps | Fine Scientific Instruments | 11254-20 | |
| Electroporator | Nepa Gene | NEPA21 | |
| BEX | Pulse Generator CUY21EDIT II | ||
| Fast Green FCF | Sigma-Aldrich | F7252-5G | |
| Fast Green FCF Solution, 5x | Dissolve 12.5 mg of Fast Green FCF powder in 10 mL of 1× PBS. | ||
| Flaming/Brown Micropipette Puller | Stutter Instrument | P-97 | |
| Holtfreter’s solution 400% (wt/vol) | Dissolve 11.125 g of MgSO4·7H2O, 5.36 g of CaCl2·2H2O, 158.4 g of NaCl and 2.875 g of KCl in 10 L of dH2O. The solution can be stored at room temperature for up to 6 months. | ||
| KCl | Merck | 104936 | |
| MgSO4·7H2O | Merck | 105886 | |
| Microloader pipette tips | Eppendorf | 5242956003 | |
| Micromanipulator | Narishige | MN-153 | |
| NaCl | Merck | 106404 | |
| Pneumatic PicoPump | World Precision Instruments | SYS-PV830 | |
| Ring Forceps | Fine Scientific Instruments | 11103-09 | |
| Stereomicroscope | Olympus | SZX10 | |
| Tris base | Sigma-Aldrich | T6066 | |
| Tris-buffered saline, 10x | Dissolve 24.2 g of Tris base and 90 g of NaCl in 990 ml of dH2O. Adjust pH to 8.0 by adding 10 ml of 37% (vol/vol) HCl. The solution can be stored at room temperature for up to 6 months. | ||
| Tweezers w/Variable Gap 2 Round Platinum Plate Electrode, 10mm diameter | Nepa Gene | CUY650P10 |
参考文献
- O'Hara, C. M., Egar, M. W., Chernoff, E. A. G. Reorganization of the ependyma during axolotl spinal cord regeneration: Changes in intermediate filament and fibronectin expression. Developmental Dynamics. 193 (2), 103-115 (1992).
- Mchedlishvili, L., Mazurov, V., Tanaka, E. M. Reconstitution of the Central Nervous System During Salamander Tail Regeneration from the Implanted Neurospheres. Plant, Soil and Environment. 916 (8), 197-202 (2012).
- Nordlander, R. H., Singer, M. The role of ependyma in regeneration of the spinal cord in the urodele amphibian tail. Journal of Comparative Neurology. 180 (2), 349-373 (1978).
- Fei, J. F., et al. Tissue- and time-directed electroporation of CAS9 protein–gRNA complexes in vivo yields efficient multigene knock-out for studying gene function in regeneration. npj Regenerative Medicine. 1 (1), 16002 (2016).
- Fei, J. F., et al. CRISPR-mediated genomic deletion of Sox2 in the axolotl shows a requirement in spinal cord neural stem cell amplification during tail regeneration. Stem Cell Reports. 3 (3), 444-459 (2014).
- Flowers, G. P., Timberlake, A. T., McLean, K. C., Monaghan, J. R., Crews, C. M. Highly efficient targeted mutagenesis in axolotl using Cas9 RNA-guided nuclease. Development. 141 (10), 2165-2171 (2014).
- Flowers, G. P., Sanor, L. D., Crews, C. M. Lineage tracing of genome-edited alleles reveals high fidelity axolotl limb regeneration. eLife. 6, (2017).
- Fei, J. -. F., et al. Efficient gene knockin in axolotl and its use to test the role of satellite cells in limb regeneration. Proceedings of the National Academy of Sciences. 201706855. , (2017).
- Nowoshilow, S., et al. The axolotl genome and the evolution of key tissue formation regulators. Nature. 554 (7690), 50-55 (2018).
- Bryant, D. M., et al. A Tissue-Mapped Axolotl De Novo Transcriptome Enables Identification of Limb Regeneration Factors. Cell Reports. 18 (3), 762-776 (2017).
- Smith, J. J., et al. A chromosome-scale assembly of the axolotl genome. Genome Research. 373548, (2019).
- Smith, J. J., et al. Sal-Site: Integrating new and existing ambystomatid salamander research and informational resources. BMC Genomics. 6, 1-6 (2005).
- Campbell, L. J., et al. et al Gene expression profile of the regeneration epithelium during axolotl limb regeneration. Developmental Dynamics. 240 (7), 1826-1840 (2011).
- Stewart, R., et al. Comparative RNA-seq Analysis in the Unsequenced Axolotl: The Oncogene Burst Highlights Early Gene Expression in. the Blastema. PLoS Computational Biology. 9 (3), (2013).
- Fei, J. -. F., et al. Application and optimization of CRISPR–Cas9-mediated genome engineering in axolotl (Ambystoma mexicanum). Nature Protocols. 13 (12), 2908-2943 (2018).
- Holder, N., et al. Continuous growth of the motor system in the axolotl. Journal of Comparative Neurology. 303 (4), 534-550 (1991).
- Tazaki, A., Tanaka, E. M., Fei, J. F. Salamander spinal cord regeneration: The ultimate positive control in vertebrate spinal cord regeneration. Developmental Biology. 432 (1), 63-71 (2017).
- Albors, A. R., Tanaka, E. M. High-Efficiency Electroporation of the Spinal Cord in Larval Axolotl. Salamanders in Regeneration Research: Methods and Protocols. 1290, 115-125 (2015).
- Albors, A. R., et al. et al Planar cell polarity-mediated induction of neural stem cell expansion during axolotl spinal cord regeneration. eLife. 4, 1-29 (2015).
- Cong, L., et al. Multiplex Genome Engineering Using CRISPR/Cas Systems. Science. 339 (6121), 819-823 (2013).
- Doench, J. G., et al. Optimized sgRNA design to maximize activity and minimize off-target effects of CRISPR-Cas9. Nature Biotechnology. 34 (2), 184-191 (2016).
- Graham, D. B., Root, D. E. Resources for the design of CRISPR gene editing experiments. Genome Biology. 16 (1), 260 (2015).
- Khattak, S., et al. Optimized axolotl (Ambystoma mexicanum) husbandry, breeding, metamorphosis, transgenesis and tamoxifen-mediated recombination. Nature Protocols. 9 (3), 529-540 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved