Method Article
الجينات المباشرة ضرب من Axolotl الحبل الشوكي الخلايا الجذعية العصبية عن طريق الكهربائي من المجمعات CAS9 البروتين-gRNA
In This Article
Summary
يقدم هنا بروتوكول لتنفيذ الوقت والفضاء مقيدة الجينات ضرب الخروج في الحبال الشوكي ة عن طريق حقن مجمع CAS9-gRNA في القناة المركزية الحبل الشوكي تليها الكهربائي.
Abstract
الساكسوتول لديه القدرة الفريدة على تجديد الحبل الشوكي بالكامل. ويرجع ذلك إلى حد كبير إلى الخلايا الاستئصالية المتبقية كخلايا جذعية عصبية (NSCs) طوال الحياة، والتي تنتشر لإصلاح الأنبوب الاستئصالي والتفريق في الخلايا العصبية المفقودة بعد إصابة الحبل الشوكي. يمكن أن يؤدي فك رموز كيفية احتفاظ هذه الشركات الوطنية للضمان ة بتعدد القوى بعد التنمية والتكاثر عند إصابة الحبل الشوكي لإصلاح الهيكل الدقيق لما قبل الإصابة، إلى توفير رؤية قيمة حول كيفية تجديد الحبال الشوكية للثدييات وكذلك خيارات العلاج المحتملة. ومن خلال إجراء عمليات خروج الجين في مجموعات فرعية محددة من الشركات غير الحكومية في غضون فترة زمنية محدودة، سيسمح بدراسة الآليات الجزيئية الكامنة وراء هذه العمليات التجديدية، دون أن تُحيرها آثار اضطراب التنمية. يوصف هنا هو وسيلة لأداء الجينات خروج المغلوب في NSCs الحبل الشوكي axolotl باستخدام نظام CRISPR-Cas9. عن طريق حقن مجمع CAS9-gRNA في القناة المركزية للحبل الشوكي تليها الكهربائي، يتم ضرب الجينات المستهدفة في NSCs داخل مناطق محددة من الحبل الشوكي في نقطة زمنية مرغوب فيها، مما يسمح للدراسات الجزيئية من NSCs الحبل الشوكي خلال التجديد.
Introduction
الحبل الشوكي لمعظم الفقاريات غير قادر على التجدد بعد الإصابة، مما يؤدي إلى إعاقة دائمة. العديد من السلاماندرز، مثل axolotl، هي استثناءات ملحوظة. يمكن للaxolotl تجديد كامل الحبل الشوكي متطابقة هيكليا واستعادة تماما وظيفة الحبل الشوكي. الكثير من القدرة التجديدية للحبل الشوكي axolotl يرجع إلى الخلايا ependymal. هذه الخلايا خط القناة المركزية، وعلى عكس تلك الموجودة في الثدييات، والخلايا الأيبنديمال axolotl لا تزال الخلايا الجذعية العصبية (NSCs) التنمية ما بعد الجنين. بعد إصابة الحبل الشوكي (على سبيل المثال، من بتر الذيل)، تنتشر هذه NSCs لإعادة زراعة الأنبوب ependymal والتفريق لتحل محل الخلايا العصبية المفقودة1،2،3. الكشف عن كيفية النفثالينات الحبل الشوكي axolotl لا تزال متعددة القوى وتصبح نشطة بعد الإصابة يمكن أن توفر معلومات قيمة عن وضع استراتيجيات علاجية جديدة للمرضى البشر.
بسبب التقدم المحرز في تقنية الخروج من الخروج الجينات CRISPR-Cas9، أصبح أداء خروج المغلوب لفك وظيفة الجينات أسهل، وقد ثبت أن لها إمكانية تطبيق واسعة في مختلف الأنواع، بما في ذلك axolotls4،5، 6 , 7 , 8. الإصدارات الأخيرة من الجينوم الأكسولوت الكامل والنسخ يسمح الآن أي موضع الجينوم أنتكون مستهدفة ولتقييم أفضل للآثار خارج الهدف 9،10،11،12 , 13 , 14.وقد وضعت بروتوكولات الأمثل لضرب والخروج في axolotls باستخدام نظام CRISPR-Cas915. وقد ثبت تسليم الآلات كريسبر-Cas9 في شكل CAS9 البروتين-gRNA ريبونوكليوبروتين (RNP) أن تكون أكثر كفاءة من استخدام Cas9 وgRNA ترميز بلازميدات4. ومن المرجح أن يرجع ذلك إلى أن RNP أصغر في الحجم من ناقلات البلازميد، وقدرته على إنشاء فواصل الحمض النووي على الفور، وحماية الحمض النووي الريبي من تدهور الحمض النووي الريبي. وبالإضافة إلى ذلك، فإن استخدام الـ RNPs يتجاوز النسخ والترجمة؛ وبالتالي، فإنه يتجنب قضايا مثل قوة المروج والاستخدام الأمثل codon عندما تستمد عناصر بلازميد من نوع مختلف.
دراسات فقدان الوظيفة هي واحدة من النهج العامة للتحقيق في الوظائف المحتملة للجينات ذات الأهمية. من أجل دراسة وظيفة الجينات أثناء التجديد، ينبغي أن يتم تنفيذ خروج المغلوب بشكل مثالي قبل الإصابة مباشرة لتجنب الآثار على التنمية. وبالإضافة إلى ذلك، ينبغي أن يقتصر الخروج على كل من المراكز الوطنية للتحقق ومنطقة التجديد. قد يؤدي خروج الجين المستهدف في جميع النفثالينات غير صحيح (بما في ذلك تلك الموجودة في الدماغ، وهو الحال في أنظمة Cre-LoxP)، إلى آثار لا علاقة لها بالتجدد التي يمكن أن تشوش تفسير النتائج. لحسن الحظ، يوفر هيكل الحبل الشوكي axolotl فرصة فريدة من نوعها للخروج من الخروج مقيدة بالوقت والفضاء في NSCs. معظم الـ NSCs الحبل الشوكي على اتصال مع القناة المركزية وتشكل الغالبية العظمى من الخلايا في اتصال مع القناة المركزية16،17. لذلك، حقن مجمع CAS9-gRNA في القناة المركزية، تليها الكهربائي، يسمح بالتسليم إلى NSCs الحبل الشوكيفي المنطقة المطلوبة في وقت محدد 4،18،19. ويبين هذا البروتوكول كيفية تنفيذ ذلك، مما يؤدي إلى اختراق شديد في المراكز الوطنية للنشح في الحبل الشوكي المستهدف، ثم يجري تحليل لاحق لدراسة الآثار على التجدد وسلوك مجلس الأمن القومي.
Protocol
ويجب إجراء جميع التجارب الحيوانية وفقاً للوائح المحلية والوطنية المتعلقة بتجارب الحيوانات وبموافقة مجلس الاستعراض المؤسسي ذي الصلة.
1. إعداد مزيج CAS9-gRNA RNP
- تصميم وتوليف gRNAs.
ملاحظة: يرجى الرجوع إلى منشورات أخرى لتصميم وتوليف الـ gRNAs، بما في ذلك منشور يتعلق حصراً بالساكسولوت15و20و21و22. - الحصول على بروتين CAS9-NLS عن طريق إعداد في المنزل أو شرائه تجاريا.
- إعداد مزيج CAS9-gRNA عن طريق خلط 5 ميكروغرام من البروتين CAS9-NLS، 4 ميكروغرام من gRNA، 0.9 ميكرولتر من 10X CAS9 العازلة، وملء حجم إلى 10 ميكرولتر مع خالية من nuclease H2O. Aliquot الخليط وتخزينها في -80 درجة مئوية إذا لم تستخدم على الفور.
2. إعداد لوحات أغاروز للكهرباء
- إعداد 200 مل من 2٪ (الوزن / المجلد) حل أجاروز في 1X DPBS. حل عن طريق تسخين الحل في الميكروويف وتصب على أطباق بيتري 10 سم إلى عمق حوالي 10 ملم (عميق بما فيه الكفاية لتغطية الحيوان كله).
- السماح لوحات لتترسخ في درجة حرارة الغرفة. تخزين لوحات في 4 درجة مئوية إذا لم تستخدم على الفور.
- باستخدام المشرط الجراحية، وقطع لوحة أجاروز لجعل شق لعقد الذيل على التوالي، وبئر لتركيب في جسم الحيوان، وبئرين إضافيين لوضع الأقطاب الكهربائية (الشكل1E).
- ضع اللوحة على الجليد واملأها حتى حافة مع الجليد البارد 1X DPBS. استخدم نفس الحل DPBS لصنع الأطباق لضمان التوصيل الكهربائي المتسق في الإعداد.
3. تكوين الكهربائي
- تكوين الكهربائي. إعداد نبض poring تتكون من نبض ة ثنائي القطب واحد من 70 V، مع مدة 5 مللي ثانية، فاصل زمني من 50 مللي ثانية، وليس تسوس الجهد. إعداد نبض نقل أن يكون أربعة نبضات ثنائية القطب من 40 V، مع مدة 50 مللي ثانية، الفاصل الزمني من 999 مللي ثانية، و10٪ تسوس الجهد.
- قم بتوصيل الأقطاب الكهربائية بالكهرباء واضبط الملقط ليكون على بعد 7 مم. غمر الأقطاب الكهربائية في كوب من DPBS قبل وفيما بين الكهربائي.
4. إعداد وتحميل الشعيرات الدموية الزجاج الحقن الدقيق
- إجراء اختبار منحدر على الساحبة micropipette المشتعلة / البني وفقا لتعليمات الشركة المصنعة لتحديد قيمة الحرارة.
- سحب الشعيرات الدموية حقن مع نهايات مدبب باستخدام المعلمات التالية: الحرارة = قيمة اختبار المنحدر، وسحب = 100، السرعة = 100، الوقت = 100.
- مراقبة الإبرة تحت مجهر مجسم. باستخدام ملقط غرامة، كسر الشعرية في زاوية بحيث يكون لها طرف مائل. كسر في موقف حيث أنها رقيقة بما فيه الكفاية لاستهداف القناة المركزية، في حين يجري قوية بما فيه الكفاية لاختراق الجلد.
ملاحظة: النقطة التي يبلغ قطرها حوالي 20 درجة مئوية أو حوالي 50٪ من قطر الحبل الشوكي هي نقطة انطلاق جيدة. قد تكون هناك حاجة إلى محاولات متعددة للحصول على كسر الأمثل. - إضافة حل FCF الأخضر السريع إلى مزيج RNP بنسبة 1:30 وتحميل حوالي 5 ميكرولتر من مزيج الحقن في الشعرية مع طرف ماصة Microloader.
- جبل الشعرية على مضخة تعمل بالهواء المضغوط، مع طرف مائل ة تواجه إلى أسفل.
5. تكوين مضخة تعمل بالهواء المضغوط
- تكوين مضخة تعمل بالهواء المضغوط. تعيين عقد إلى 0.5 جنيه لكل بوصة مربعة (رطل مربع)، وإخراج إلى 2 رطل لكل بوصة مربعة، والمدة إلى بوابات.
- اختبار إعدادات المضخة الشعرية والهوائية عن طريق غمس الشعرية في قطرة من الماء والضغط على دواسة القدم لحقن. تأكد من أن مزيج الحقن يخرج في تيار بطيء ولكن ثابت.
- ضبط ضغط عقد إذا كان مزيج حقن تبدأ تسرب تلقائيا أو يتم امتصاص الماء حتى الشعرية. زيادة ضغط الإخراج أو كسر أكثر من الشعرية إذا كان مزيج الحقن يخرج بطيئة جدا. تقليل ضغط الإخراج إذا كان الحقن يخرج بسرعة كبيرة.
6. حقن مزيج RNP في الحبل الشوكي
- التخدير axolotls في 0.03٪ محلول البنزوكاين لمدة 10 دقيقة على الأقل.
- التقاط الحيوان مع ملقط حلقة ووضعها على سرير من السيليكون، مع الجانب الأيسر من الحيوان التي تواجه صعودا والذيل يشير نحو اليمين. وضع موقع الحقن في منتصف مجال عرض مجهر مجسم (الشكل1A).
- ضبط micromanipulator بحيث الشعرية تأتي في 60 درجة من الجانب الأيمن من مجال الرؤية (الشكل1B).
- تحديد الحبل الشوكي والقناة المركزية (الشكل1ج).
ملاحظة: الحبل الشوكي هو الهيكل الأنبوبي فوق الوتر. - تهدف إلى القناة المركزية، نقل الشعرية إلى الأمام لاختراق بلطف الجلد والعضلات في القناة المركزية للحبل الشوكي. الحد من حركة الشعرية إلى خطوات صغيرة، كما الحبل الشوكي هو الحق تحت عضلات الذيل.
- اضغط مع الاستمرار على دواسة القدم لحقن المزيج في القناة المركزية. لاحظ ما إذا كان مزيج RNP ينتشر على طول القناة المركزية كخط أزرق في كلا الاتجاهين، مما يدل على أن الشعرية قد تم وضعها بشكل صحيح (الشكل1D).
- إذا لم يحدث هذا، والحفاظ على دواسة القدم الضغط أثناء تحريك الشعرية قليلا في والخروج حتى يبدأ مزيج RNP في الذهاب. إذا أصبحت الشعيرات الدموية مسدودة بواسطة الأنسجة، قم بتطهيرها عن طريق إخراجها في الماء عند ضغط أعلى.
- ضبط ضغط الإخراج بحيث يكون كافيا فقط للتسبب في مزيج RNP لنشر في القناة المركزية، ولكن ليس كثيرا أنه يفجر الهيكل.
- الاستمرار في الضغط على دواسة القدم حتى ينتشر مزيج الحقن أكثر على طول القناة المركزية، حتى تصل إلى الحويصلة الطرفية في نهاية الحبل الشوكي والبطينين في الدماغ.
ملاحظة: قد يستغرق هذا ما يصل إلى 2 دقيقة اعتماداً على حجم الحيوان. قد يكون من الضروري زيادة الضغط بعد بعض الوقت للتسبب في مزيج RNP لدخول البطينين الدماغ. - المضي قدما في أقرب وقت ممكن إلى الكهربائي بعد الحقن الناجح.
7. الكهربائي
- نقل الحيوان مع ملقط حلقة على لوحة الكهربائي agarose أعدت (الشكل1E) على الجليد. وضع الذيل داخل الشق بحيث يتم وضعها من قبل agarose (الشكل1F).
- وضع الأقطاب الكهربائية في الآبار على جانبي الذيل. تأكد من أن كامل الحيوانات والأقطاب الكهربائية مغطاة بـ PBS الباردة.
- اضغط على مفتاح القدم لبدء الكهربائي.
- بعد اكتمال الكهرباء، أعد الحيوان إلى الماء.
- المضي قدما لحقن المزيد من الحيوانات إذا لزم الأمر.
- تأكد من أن الحيوانات الكهربائية صحية بعد التخدير يزول وأنه لا يوجد ضرر يلحق بالذيل.
8- تقييم كفاءة الخروج
- إصلاح ذيل الحيوان الكهربائي. جعل المقاطع العرضية من الذيل تليها تلطيخ المناعية الكيميائية لتقييم كفاءة خروج المغلوب على مستوى البروتين.
ملاحظة: إذا كان بتر الذيل أن يتم بعد الكهربائي، يمكن استخدام الذيل قطع لهذا الغرض. الحيوانات الكهربائي مع gRNAs ضد Gfp أو التيروزينا، على سبيل المثال ، يمكن استخدامها كسيطرة سلبية4. - وبدلاً من ذلك، يمكن استخراج الحبل الشوكي الكهربائي وتسلّد الحمض النووي. إجراء كتابة جينية PCR متبوعة بتسلسل Sanger أو تسلسل الجيل التالي لتقييم النسبة المئوية للموضع الوراثي المحرر15.
ملاحظة: كفاءة التحرير الناتجة سوف تقلل من كفاءة التحرير الفعلية لNSCs، وذلك بسبب إدراج الخلايا غير الكهربائية والخلايا العصبية التي تفتقر إلى الاتصال apical إلى التجويف المركزي، وبالتالي لن تتلقى مزيج RNP.
النتائج
حقن والكهربائي من مجمع CAS9-gRNA ضد Sox2 في القناة المركزية الحبل الشوكي axolotl أدى إلى خسارة هائلة من النشاط المناعي SOX2 في غالبية NSCs الحبل الشوكي، مع GRNA ضد التيروزينا (تاير) كعنصر تحكم (الشكل2 A).B3-tubulin (ملطخة TUJ1) هو علامة للخلايا العصبية ولم يتم التعبير عنها في NSCs، وSOX2- TUJ1- اعتبرت الخلايا المحيطة القناة المركزية لتكون الخلايا التي تأوي حذف Sox2. وأظهرت القياس الكمي Sox2 بالضربة القاضية في عدد كبير من NSCs من قبل CAS9-Sox2-gRNA الكهربائي (الشكل2B)، مما يشير إلى أن هذه الطريقة أدت إلى كفاءة واختراق عالية الجينات بالضربة القاضية في الحبل الشوكي NSCs.
بعد الحقن المتزامن والكهرباء، خليط من اثنين من المجمعات CAS9-gRNA ضد Sox2 وGfp، على التوالي، إلى axolotls المعدلة وراثيا مع التعبير GFP في كل مكان (CAGGS-GFP)، وهي نسبة عالية من NSCs ضرب مزدوجة وقد لوحظ (الشكل2C,D)،مما يشير إلى أن البروتوكول يمكن أن تستخدم لبمرونة ضرب خارج الجينات متعددة.
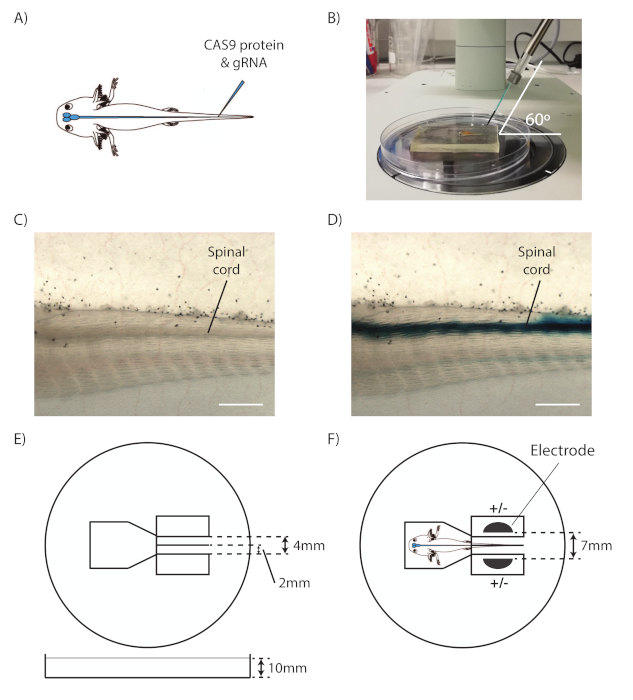
الشكل 1 حقن الحبل الشوكي Axolotl والكهربائي. (أ) مخطط يظهر حقن CAS9-gRNA RNP في القناة المركزية الحبل الشوكي axolotl. (ب) مجموعة ميكرومنبولاتور للحقن. (C) عرض من خلال مجهر مجسم من ذيل axolotl، مع وأشار الحبل الشوكي. (D) عرض من خلال مجهر مجسم من ذيل axolotl مع الحبل الشوكي حقن. (E) التخطيطي من لوحة الكهربائي. (F) التخطيطي للحيواني والأقطاب الكهربائية الموضوعة داخل لوحة الكهرباء، وعلى استعداد للكهرباء. قضبان مقياس = 1 مم. هذا الرقم مقتبس من Albors وTanaka18. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2 نتائج خروج المغلوب التمثيلية في NSCs الحبل الشوكي axolotl. (أ) أدى حقن الحبل الشوكي والكهرباء من CAS9-Sox2-gRNA(ن = 21) إلى فقدان SOX2 في غالبية NSCs في 15 يوما بعد الكهرباء (dpE) عن طريق تلطيخ المناعية الكيميائية. CAS9-Tyr-gRNA (n = 21) بمثابة عنصر تحكم سلبي. قضبان مقياس = 100 درجة مئوية. (ب) أظهر القياس الكمي انخفاضا كبيرا في SOX2 + NSCs (p < 0.001 بواسطة الطالب t-test)، عد SOX2- TUJ1- الخلايا المحيطة بالقناة المركزية كما NSCs التي تأوي حذف Sox2. أشرطة الخطأ = SD. (C) الحقن المتزامن والكهرباء من Sox2-gRNA وGfp-gRNA إلى جانب CAS9 (ن = 6) أدى إلى فقدان SOX2 وGFP في غالبية NSCs عن طريق تلطيخ المناعية الكيميائية. CAS9-Tyr-gRNA (n = 6) بمثابة تحكم سلبي. قضبان مقياس = 100 درجة مئوية. (د) أظهر التحديد الكمي أنه من بين جميع الشركات غير الوطنية المستهدفة التي لديها أي حذف، فإن الأغلبية (94 في المائة) الحذف المزدوج (GFP− SOX2−)، مع نسبة صغيرة فقط (6٪) وجود حذف واحد (GFP + SOX- أو GFP- SOX2 +). هذا الرقم مقتبس من فاي وآخرون4. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يسمح البروتوكول الموصوف بضيق الوقت والمكان في الجين المقيد في NSCs في الحبل الشوكي axolotl. يسمح البروتوكول الحالي باستهداف محدد للشبكات الوطنية القومية في وقت وموقع محددين مع وجود نسبة عالية. فإنه يتجنب الآثار غير المرغوب فيها المحتملة الناشئة عن الجينات خروج المغلوب في NSCs في مناطق أخرى مثل الدماغ التي تحدث عند استخدام نظام Cre-LoxP. كما أنه يتجنب الآثار التنموية الناشئة عن خروج المغلوب المستمر، مما يسمح بدراسة وظيفة الجينات التي تركز على التجدد. وبالإضافة إلى ذلك، يمكن تنفيذ هذا البروتوكول في الحيوانات البرية، وتجنب وقت الانتظار الطويل اللازم لتوليد axolotls المعدلة وراثيا إضافية، وهو مطلوب لنظام Cre-LoxP. كما أنه يوفر براعة لضرب الجينات متعددة في وقت واحد، واختراق للغاية، مما يسمح بإجراء التجارب على الحيوانات F0. الأهم من ذلك، يظهر أن الإجراء ليس له تأثير ملحوظ على الذيل وتجديد الحبل الشوكي4.
كما أن استخدام مجمعات CAS9 للبروتين-gRNA RNP يعرض كفاءة أعلى بكثير من الأنظمة التي تستخدم Cas9 وgRNA-expressing plasmids4. ومن المرجح أن يرجع ذلك إلى صغر حجم مركب RNP مقارنة بالبلازميدات، فضلاً عن استخدام الكودون التفاضلي الذي يؤثر على التعبير عن بروتين CAS9 من البلازميدات المستمدة من نظم الثدييات. وبالإضافة إلى ذلك، منذ المجمعات CAS9 البروتين-gRNA RNP يمكن أن تحفز فواصل على الفور، خروج المغلوب يحدث بسرعة. وقد لوحظ تفي بـ 60 في المائة إلى 70 في المائة من الموضع الجيني المعدل عن طريق كتابة الـ PCR في غضون 24 ساعة من الكهرباء (لم تظهر البيانات). وهناك أيضا إمكانية لأداء طرق في استخدام هذه الاستراتيجية عن طريق المشاركة في الكهربائيقالب إصلاح. وهناك عدد من الاستراتيجيات التي يمكن تنفيذها، والتي لا توجد تفاصيلها واعتباراتها خارج نطاق هذا المنشور، ولكنها ترد وصفها بالتفصيل في منشور آخرهو 15.
ومن ناحية أخرى، فإن هذا البروتوكول له بعض القيود. وهناك حاجة عامة إلى تلطيخ أو كتابة الـ PCR لتحديد مدى الخروج في كل حيواني تجريبي، وهو ما يمكن أن يكون شاقاً. في حين أن الجينات خروج المغلوب من هذه الطريقة يقتصر إلى حد كبير على NSCs المحيطة القناة المركزية، فإنه لا يمكن استبعاد أن أنواع الخلايا الأخرى يمكن أيضا أن تستهدف، لأن 1) هم أيضا على اتصال مع القناة المركزية، أو 2) وقد تسربت مزيج RNP من cen قناة ترال قبل الكهربائي. وينبغي مراعاة هذه العوامل عند تفسير النتائج.
تصميم gRNA
مع الجينوم axolotl نشرت مؤخرا والنسخ، وتحديد الجينات axolotl وتسلسلها أصبح أسهل بكثير9،10،11،12،13. وقد تم وصف أدلة مفصلة في تصميم gRNAs في مكان آخر، بما في ذلك واحد الذي يتعامل حصرا مع axolotls15. ينصح بتصميم واختبار ما لا يقل عن ثلاثة gRNAs لتحرير الكفاءة مسبقا واختيار التصميم الأمثل للتجربة الفعلية. ويمكن اختبار كفاءة gRNA عن طريق حقن مزيج CAS9-gRNA في بيض axolotl وضعت حديثا في مرحلة خلية واحدة23. ويمكن بعد ذلك تقييم كفاءة التحرير عن طريق الكتابة الجينية لليرقات المفقسة.
اعتبارات الحقن
وبما أن موقع حقن الحبل الشوكي يعاني من أضرار مادية ناجمة عن الإبرة وانتشار مزيج RNP إلى أنسجة خارج القناة المركزية، فمن المهم إجراء الحقن في مواقع بعيدة عن المنطقة ذات الأهمية لتحليلها. على سبيل المثال، إذا تم إجراء بتر الذيل بعد الكهربة لدراسة آثار الجين المستهدف في تجديد الحبل الشوكي، فمن الضروري إجراء الحقن حيث سيتم إزالة الموقع عن طريق البتر.
دخول القناة المركزية مع الشعرية حقن هو الخطوة الأكثر أهمية من هذا البروتوكول، وينصح المستخدمين الجدد لممارسة قبل التجربة الفعلية. يتم إجراء الحقن على أفضل وجه على الحيوانات الصغيرة (أقل من 2.5 سم طويلة) في الطرف الخلفي من الحبل الشوكي، حيث يكون من الأسهل وضع طرف الشعرية في القناة المركزية. ينصح بمراقبة الانتشار الأولي لمزيج RNP ذو اللون الأزرق عن كثب. هناك احتمال أن مزيج RNP يمكن حقنها في الفضاء السحائي حول الحبل الشوكي. انتشار حاد وسريع كخط على طول منتصف الحبل الشوكي يشير إلى حقن ناجحة في القناة المركزية18. إذا لم يخرج أي شيء أو توقف انتشار قبل الأوان، فمن المستحسن للحفاظ على دواسة القدم الضغط أثناء تحريك الشعرية قليلا في والخروج. إذا فشل ذلك، قد يكون من الضروري إعادة وضع الشعرية أو التحقق من وجود فتحة مسدودة. لمزيج RNP لنشر في البطينين الدماغ، وغالبا ما يكون من الضروري زيادة ضغط الإخراج نحو النهاية. وجود البطينين الدماغ شغل ليس من الضروري لالكهربائي من الحبل الشوكي، ولكن هذا هو أفضل مؤشر على أن مزيج RNP قد تم حقنها في القناة المركزية.
اعتبارات الكهرباء
وينصح لتحسين المعلمات الكهربائي مسبقا لتحقيق تسليم كاف من RNP إلى غالبية NSCs دون التسبب في أضرار واسعة النطاق للأنسجة الأخرى أو قتل الحيوان. وقد تم تحسين هذا البروتوكول للالحيوانات 2.0-2.5 سم طويلة في حجم18. ومن المرجح أن يكون من الضروري إجراء تخفيض في الجهد النبضي إلى 35 فولت عند العمل مع الحيوانات الأصغر من ذلك. من ناحية أخرى، سوف تتطلب الحيوانات الأكبر حجما الجهد العالي و / أو أكثر البقول. وبالإضافة إلى ذلك، فإن المسافة بين الأقطاب الكهربائية تؤثر على الكفاءة. قد يكون من الضروري تقليل المسافة إلى 6 مم للالحيوانات الأكبر حجماً.
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
نشكر الأستاذة إيلي م. تاناكا على دعمها المستمر والطويل الأجل. وقد تم دعم هذا العمل من قبل مؤسسة العلوم الطبيعية الوطنية الصينية (NSFC) منحة (317716)، ومنح بدء البحوث من جامعة جنوب الصين العادية (S82111 و 8S0109)، ومنحة مؤسسة علوم ما بعد الدكتوراه الصينية (2018M633067).
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | A9539 | |
| Benzocaine | Sigma-Aldrich | E1501-100G | |
| Benzocaine 0.03 % (wt/vol) | Mix 500 ml of 10× TBS, 500 ml of 400% (wt/vol) Holtfreter’s solution and 30 ml of 10% (wt/vol) benzocaine stock solution. Fill up the volume to 10 L with dH2O. The solution can be stored at room temperature for up to 6 months. | ||
| Benzocaine 10 % (wt/vol) | Mix 50 g of benzocaine in 500 ml of 100% (vol/vol) ethanol. The solution can be stored at room temperature for up to 12 months. | ||
| Borosilicate glass capillaries 1.2 mm O.D., 0.94 mm I.D. | Stutter Instrument | BF120-94-8 | |
| CaCl2·2H2O | Merck | 102382 | |
| CAS9 buffer, 10x | Mix 200 mM HEPES and 1.5 M KCl in RNase-free water. Adjust pH to 7.5. Filter sterilize, aliquot and store at −20 °C for up to 24 months | ||
| CAS9-NLS protein | PNA Bio | CP03 | |
| Cell culture dishes, 10cm | Falcon | 351029 | |
| Dumont #5 - Fine Forceps | Fine Scientific Instruments | 11254-20 | |
| Electroporator | Nepa Gene | NEPA21 | |
| BEX | Pulse Generator CUY21EDIT II | ||
| Fast Green FCF | Sigma-Aldrich | F7252-5G | |
| Fast Green FCF Solution, 5x | Dissolve 12.5 mg of Fast Green FCF powder in 10 mL of 1× PBS. | ||
| Flaming/Brown Micropipette Puller | Stutter Instrument | P-97 | |
| Holtfreter’s solution 400% (wt/vol) | Dissolve 11.125 g of MgSO4·7H2O, 5.36 g of CaCl2·2H2O, 158.4 g of NaCl and 2.875 g of KCl in 10 L of dH2O. The solution can be stored at room temperature for up to 6 months. | ||
| KCl | Merck | 104936 | |
| MgSO4·7H2O | Merck | 105886 | |
| Microloader pipette tips | Eppendorf | 5242956003 | |
| Micromanipulator | Narishige | MN-153 | |
| NaCl | Merck | 106404 | |
| Pneumatic PicoPump | World Precision Instruments | SYS-PV830 | |
| Ring Forceps | Fine Scientific Instruments | 11103-09 | |
| Stereomicroscope | Olympus | SZX10 | |
| Tris base | Sigma-Aldrich | T6066 | |
| Tris-buffered saline, 10x | Dissolve 24.2 g of Tris base and 90 g of NaCl in 990 ml of dH2O. Adjust pH to 8.0 by adding 10 ml of 37% (vol/vol) HCl. The solution can be stored at room temperature for up to 6 months. | ||
| Tweezers w/Variable Gap 2 Round Platinum Plate Electrode, 10mm diameter | Nepa Gene | CUY650P10 |
References
- O'Hara, C. M., Egar, M. W., Chernoff, E. A. G. Reorganization of the ependyma during axolotl spinal cord regeneration: Changes in intermediate filament and fibronectin expression. Developmental Dynamics. 193 (2), 103-115 (1992).
- Mchedlishvili, L., Mazurov, V., Tanaka, E. M. Reconstitution of the Central Nervous System During Salamander Tail Regeneration from the Implanted Neurospheres. Plant, Soil and Environment. 916 (8), 197-202 (2012).
- Nordlander, R. H., Singer, M. The role of ependyma in regeneration of the spinal cord in the urodele amphibian tail. Journal of Comparative Neurology. 180 (2), 349-373 (1978).
- Fei, J. F., et al. Tissue- and time-directed electroporation of CAS9 protein–gRNA complexes in vivo yields efficient multigene knock-out for studying gene function in regeneration. npj Regenerative Medicine. 1 (1), 16002 (2016).
- Fei, J. F., et al. CRISPR-mediated genomic deletion of Sox2 in the axolotl shows a requirement in spinal cord neural stem cell amplification during tail regeneration. Stem Cell Reports. 3 (3), 444-459 (2014).
- Flowers, G. P., Timberlake, A. T., McLean, K. C., Monaghan, J. R., Crews, C. M. Highly efficient targeted mutagenesis in axolotl using Cas9 RNA-guided nuclease. Development. 141 (10), 2165-2171 (2014).
- Flowers, G. P., Sanor, L. D., Crews, C. M. Lineage tracing of genome-edited alleles reveals high fidelity axolotl limb regeneration. eLife. 6, (2017).
- Fei, J. -. F., et al. Efficient gene knockin in axolotl and its use to test the role of satellite cells in limb regeneration. Proceedings of the National Academy of Sciences. 201706855. , (2017).
- Nowoshilow, S., et al. The axolotl genome and the evolution of key tissue formation regulators. Nature. 554 (7690), 50-55 (2018).
- Bryant, D. M., et al. A Tissue-Mapped Axolotl De Novo Transcriptome Enables Identification of Limb Regeneration Factors. Cell Reports. 18 (3), 762-776 (2017).
- Smith, J. J., et al. A chromosome-scale assembly of the axolotl genome. Genome Research. 373548, (2019).
- Smith, J. J., et al. Sal-Site: Integrating new and existing ambystomatid salamander research and informational resources. BMC Genomics. 6, 1-6 (2005).
- Campbell, L. J., et al. et al Gene expression profile of the regeneration epithelium during axolotl limb regeneration. Developmental Dynamics. 240 (7), 1826-1840 (2011).
- Stewart, R., et al. Comparative RNA-seq Analysis in the Unsequenced Axolotl: The Oncogene Burst Highlights Early Gene Expression in. the Blastema. PLoS Computational Biology. 9 (3), (2013).
- Fei, J. -. F., et al. Application and optimization of CRISPR–Cas9-mediated genome engineering in axolotl (Ambystoma mexicanum). Nature Protocols. 13 (12), 2908-2943 (2018).
- Holder, N., et al. Continuous growth of the motor system in the axolotl. Journal of Comparative Neurology. 303 (4), 534-550 (1991).
- Tazaki, A., Tanaka, E. M., Fei, J. F. Salamander spinal cord regeneration: The ultimate positive control in vertebrate spinal cord regeneration. Developmental Biology. 432 (1), 63-71 (2017).
- Albors, A. R., Tanaka, E. M. High-Efficiency Electroporation of the Spinal Cord in Larval Axolotl. Salamanders in Regeneration Research: Methods and Protocols. 1290, 115-125 (2015).
- Albors, A. R., et al. et al Planar cell polarity-mediated induction of neural stem cell expansion during axolotl spinal cord regeneration. eLife. 4, 1-29 (2015).
- Cong, L., et al. Multiplex Genome Engineering Using CRISPR/Cas Systems. Science. 339 (6121), 819-823 (2013).
- Doench, J. G., et al. Optimized sgRNA design to maximize activity and minimize off-target effects of CRISPR-Cas9. Nature Biotechnology. 34 (2), 184-191 (2016).
- Graham, D. B., Root, D. E. Resources for the design of CRISPR gene editing experiments. Genome Biology. 16 (1), 260 (2015).
- Khattak, S., et al. Optimized axolotl (Ambystoma mexicanum) husbandry, breeding, metamorphosis, transgenesis and tamoxifen-mediated recombination. Nature Protocols. 9 (3), 529-540 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved