Method Article
Knock-out gene diretto delle cellule staminali neurali del midollo spinale ad axolotl tramite elettroporazione dei complessi CAS9 Protein-gRNA
In questo articolo
Riepilogo
Presentato qui è un protocollo per eseguire il knock-out genico limitato nel tempo e nello spazio nei midollo spinale axolotl iniettando il complesso CAS9-gRNA nel canale centrale del midollo spinale seguito dall'elettroporazione.
Abstract
L'axolotl ha la capacità unica di rigenerare completamente il suo midollo spinale. Ciò è in gran parte dovuto alle cellule ependymal rimaste come cellule staminali neurali (NSC) per tutta la vita, che proliferano per riformare il tubo ependymal e si differenziano in neuroni persi dopo la lesione del midollo spinale. Decifrare come queste NSC mantengono la pluripotenza post-sviluppo e proliferano sulla lesione del midollo spinale per riformare l'esatta struttura pre-infortunio può fornire preziose informazioni su come i midollo spinale dei mammiferi possono rigenerarsi e sulle potenziali opzioni di trattamento. L'esecuzione di eliminazioni genetiche in sottoinsiemi specifici di NSC in un periodo di tempo limitato consentirà di studiare i meccanismi molecolari alla base di questi processi rigenerativi, senza essere confusi dagli effetti perturbanti dallo sviluppo. Qui è descritto un metodo per eseguire il knock-out genico negli NSC axolotl del midollo spinale utilizzando il sistema CRISPR-Cas9. Iniettando il complesso CAS9-gRNA nel canale centrale del midollo spinale seguito dall'elettroporazione, i geni bersaglio vengono eliminati nelle NSC all'interno di specifiche regioni del midollo spinale in un momento desiderato, consentendo studi molecolari delle NSC del midollo spinale durante Rigenerazione.
Introduzione
Il midollo spinale della maggior parte dei vertebrati non è in grado di rigenerarsi dopo lesioni, portando a disabilità permanente. Diverse salamandre, come l'axolotl, sono eccezioni degne di nota. L'axolotl può rigenerare completamente un midollo spinale strutturalmente identico e ripristinare completamente la funzione del midollo spinale. Gran parte della capacità rigenerativa del midollo spinale axolotl è dovuta alle cellule ependymal. Queste cellule allineano il canale centrale, e a differenza di quelle nei mammiferi, le cellule ependymal axolotli rimangono come cellule staminali neurali (NSC) sviluppo post-embrionale. Dopo la lesione del midollo spinale (ad esempio, da un'amputazione della coda), queste NSC proliferano per far ricrescere il tubo ependymal e differenziarsi per sostituire i neuroni perduti1,2,3. Scoprire come le NSC axolotl spinal cord rimangono pluripotenti e si attivano dopo la lesione può fornire preziose informazioni sullo sviluppo di nuove strategie terapeutiche per i pazienti umani.
A causa dei progressi nella tecnica di knock-out del gene CRISPR-Cas9, l'esecuzione di knock-out per decifrare la funzione genica è diventata più facile ed è stato dimostrato di avere un'ampia applicabilità in varie specie, tra cui axolotls4,5, 6 È possibile: , 7 (in questo stato , 8. Il recente rilascio dell'intero genoma axolotl e del trascrittoma consente ora di prendere di mira qualsiasi locus genomico e di valutare meglio gli effetti fuori target9,10,11,12 , 13 del sistema , 14.Sono stati sviluppati protocolli ottimizzati per knock-out e knock-in in axolotls utilizzando il sistema CRISPR-Cas915. La consegna del macchinario CRISPR-Cas9 sotto forma di proteina-gRNA ribonucleoproteina CAS9 (RNP) ha dimostrato di essere più efficiente rispetto all'utilizzo di Cas9 e plasmidi di codifica gRNA4. Ciò è probabilmente dovuto al fatto che il RNP è di dimensioni inferiori rispetto ai vettori plasmici, alla sua capacità di creare immediatamente le rotture del DNA e alla protezione del gRNA dalla degradazione dell'RNA. Inoltre, l'utilizzo di RNP bypassa la trascrizione e la traduzione; così, evita problemi come la forza promotrice e l'uso ottimale di codone quando gli elementi plasmidi sono derivati da una specie diversa.
Gli studi sulla perdita di funzione sono uno degli approcci generali allo studio delle potenziali funzioni dei geni di interesse. Per studiare la funzione genica durante la rigenerazione, un knock-out dovrebbe idealmente essere eseguito appena prima di una lesione per evitare effetti sullo sviluppo. Inoltre, l'eliminazione dovrebbe essere limitata sia alle NSC che alla regione di rigenerazione. Un knock-out del gene bersaglio in tutte le NSC (comprese quelle nel cervello, come nel caso dei sistemi Cre-LoxP), può produrre effetti non correlati alla rigenerazione che possono confondere l'interpretazione dei risultati. Fortunatamente, la struttura del midollo spinale axolotl offre un'opportunità unica per l'eliminazione limitata di tempo e spazio nelle NSC. La maggior parte delle NSC del midollo spinale sono in contatto con il canale centrale e costituiscono la stragrande maggioranza delle cellule a contatto con il canale centrale16,17. Pertanto, un'iniezione del complesso CAS9-gRNA nel canale centrale, seguita da elettroporazione, consente la consegna agli NSC del midollo spinale in una regione desiderata in un momento specifico4,18,19. Questo protocollo dimostra come questo viene eseguito, portando ad altamente penetrante knock-out nelle NSC midollo del midollo spinale.
Protocollo
Tutti gli esperimenti sugli animali devono essere effettuati in conformità con le normative locali e nazionali in materia di sperimentazione animale e con l'approvazione del comitato di revisione istituzionale competente.
1. Preparazione del mix DI RNP CAS9-gRNA
- Progettare e sintetizzare gRNA.
NOTA: fare riferimento ad altre pubblicazioni per la progettazione e la sintesi di gRNA, inclusa una esclusivamente relativa agli axolotl15,20,21,22. - Ottieni la proteina CAS9-NLS preparandola internamente o acquistandola commercialmente.
- Preparate la miscela di CAS9-gRNA mescolando 5 g di proteine CAS9-NLS, 4 g di gRNA, 0,9 l di 10x buffer CAS9, e riempite il volume fino a 10 gradi con la miscela priva di nuclesione H2O. Aliquota e conservate la miscela a -80 gradi centigradi se non utilizzate immediatamente.
2. Preparazione delle piastre di agarose per l'elettroporazione
- Preparare 200 mL del 2% (wt/vol) soluzione agarose in 1x DPBS. Sciogliere riscaldando la soluzione in un forno a microonde e versarla su piatti DiPetri di 10 cm ad una profondità di circa 10 mm (abbastanza profonda da coprire l'intero animale).
- Lasciare solidificare le piastre a temperatura ambiente. Conservare le piastre a 4 gradi centigradi se non utilizzate immediatamente.
- Utilizzando bisturi chirurgici, tagliare la piastra di agarose per fare una scollatura per tenere la coda dritta, un pozzo per il montaggio nel corpo dell'animale, e due pozzi in più per il posizionamento degli elettrodi (Figura 1E).
- Mettere la piastra sul ghiaccio e riempirla fino all'orlo con 1x DPBS ghiacciato. Utilizzare la stessa soluzione DPBS per realizzare le piastre per garantire una conducibilità elettrica coerente nel set-up.
3. Configurazione dell'elettroporatore
- Configurare l'elettroporatore. Impostare l'impulso di poring in modo che sia costituito da un impulso bipolare di 70 V, con una durata di 5 ms, un intervallo di 50 ms e nessun decadimento della tensione. Impostare l'impulso di trasferimento per avere quattro impulsi bipolari di 40 V, con una durata di 50 ms, intervallo di 999 ms e 10% decadimento della tensione.
- Collegare gli elettrodi all'elettroporatore e regolare le pinzette in modo che siano distanti 7 mm. Sommergi gli elettrodi in un becher di DPBS prima e tra l'elettroporazione.
4. Preparazione e caricamento dei capillari di vetro per microiniezione
- Eseguire un test di rampa su un tiratore di micropipette fiammeggiante/marrone secondo le istruzioni del produttore per determinare il valore di calore.
- Capillari di iniezione di trazione con estremità conicate utilizzando i seguenti parametri: calore e valore di prova della rampa, trazione : 100, velocità : 100, tempo e 100.
- Osservare l'ago sotto uno stereomicroscopio. Utilizzando pinze sottili, rompere il capillare ad angolo in modo che abbia una punta inclinata. Rompere in una posizione in cui è abbastanza sottile per indirizzare il canale centrale, pur essendo abbastanza forte per perforare la pelle.
NOTA: Il punto in cui il diametro è di circa 20 m o circa il 50% del diametro del midollo spinale è un buon punto di partenza. Potrebbero essere necessari più tentativi per ottenere un'interruzione ottimale. - Aggiungere la soluzione Fast Green FCF alla miscela di RNP a un rapporto di 1:30 e caricare circa 5 .L di miscela di iniezione nel capillare con una punta di pipetta Microloader.
- Montare il capillare sulla pompa pneumatica, con la punta inclinata rivolta verso il basso.
5. Configurazione della pompa pneumatica
- Configurare la pompa pneumatica. Impostare la presa a 0,5 libbre per pollice quadrato (psi), espellere a 2 psi tenere, e la durata a gated.
- Testare le impostazioni della pompa capillare e pneumatica immergendo il capillare in una goccia d'acqua e premendo il pedale del piede per iniettare. Assicurarsi che la miscela di iniezione esca in un flusso lento ma costante.
- Regolare la pressione di presa se la miscela di iniezione inizia a fuoriuscire spontaneamente o l'acqua viene aspirata il capillare. Aumentare la pressione di espulsione o rompere più del capillare se la miscela di iniezione sta escono troppo lento. Diminuire la pressione di espulsione se l'iniezione esce troppo velocemente.
6. Iniezione di miscela di RNP nel midollo spinale
- Anestesizzare gli assilotl nella soluzione di benzocaina 0,03% per almeno 10 min. Verificare che gli animali non siano reattivi capovolgendoli in basso nell'acqua.
- Prendi un animale con pinze ad anello e appoggialo su un letto di silicio, con il lato sinistro dell'animale rivolto verso l'alto e la coda rivolta verso destra. Posizionare il sito di iniezione al centro del campo visivo dello stereomicroscopio (Figura 1A).
- Regolare il micromanipolatore in modo che il capillare entri a 60 gradi dal lato destro del campo visivo (Figura 1B).
- Identificare il midollo spinale e il canale centrale (Figura 1C).
NOTA: Il midollo spinale è la struttura tubolare sopra il notocordo. - Puntando al canale centrale, spostare il capillare in avanti per perforare delicatamente la pelle e il muscolo nel canale centrale del midollo spinale. Limitare il movimento del capillare a piccoli passi, come il midollo spinale è proprio sotto i muscoli della coda.
- Premere e tenere premuto il pedale per iniettare il mix nel canale centrale. Osservare se la miscela RNP si diffonde lungo il canale centrale come una linea blu in entrambe le direzioni, il che mostra che il capillare è stato posizionato correttamente (Figura 1D).
- Se questo non si verifica, tenere premuto il pedale del piede mentre si sposta leggermente dentro e fuori fino a quando il mix RNP inizia ad entrare. Se il capillare diventa intasato dal tessuto, cancellarlo espellendo in acqua a pressioni più elevate.
- Regolare la pressione di espulsione in modo che sia sufficiente a far sì che il mix di RNP si diffonda nel canale centrale, ma non tanto da far saltare in aria la struttura.
- Continuare a tenere premuto il pedale del piede in modo che il mix di iniezione si diffonde ulteriormente lungo il canale centrale, fino a raggiungere la vescica terminale alla fine del midollo spinale e ventricoli nel cervello.
NOTA: Questo può richiedere fino a 2 min a seconda delle dimensioni dell'animale. Potrebbe essere necessario aumentare la pressione dopo qualche tempo per causare la miscela di RNP per entrare nei ventricoli cerebrali. - Procedere il prima possibile all'elettroporazione dopo un'iniezione riuscita.
7. Elettroporazione
- Trasferire l'animale con pinze ad anello sulla piastra di elettroporazione agarose preparata (Figura 1E) sul ghiaccio. Posizionare la coda all'interno della fessura in modo che sia inserita da agarose (Figura 1F).
- Posizionare gli elettrodi nei pozzi su entrambi i lati della coda. Assicurarsi che l'intero animale e gli elettrodi siano coperti da PBS ghiacciato.
- Premere l'interruttore del piede per avviare l'elettroporazione.
- Una volta completata l'elettroporazione, riportare l'animale in acqua.
- Procedere con l'iniezione di più animali, se necessario.
- Verificare che gli animali elettroponati siano sani dopo che l'anestesia svanisce e che non vi siano danni alla coda.
8. Valutazione dell'efficienza da eliminazione diretta
- Fissare la coda dell'animale elettroporate. Fare sezioni trasversali della coda seguite da colorazione immunoistochimica per valutare l'efficienza del knock-out a livello di proteina.
NOTA: Se un'amputazione della coda deve essere eseguita dopo l'elettroporazione, la coda tagliata potrebbe essere utilizzata a questo scopo. Gli animali elettropoturati con gRNA contro Gfp o tirosinasi, ad esempio, possono essere utilizzati come controllo negativo4. - In alternativa, il midollo spinale elettroporate potrebbe essere estratto e lisciviato per il DNA. Eseguire la genotipizzazione PCR seguita da Sanger sequenziamento o sequenziamento di nuova generazione per valutare la percentuale di loci genetici modificati15.
NOTA: L'efficienza di editing risultante sottovaluterà l'effettiva efficienza di editing per le NSC, a causa dell'inclusione di cellule e neuroni non elettropotorati che non hanno contatto apicale con il lume centrale e quindi non riceveranno il mix RNP.
Risultati
L'iniezione e l'elettroporazione del complesso DI CAS9-gRNA contro Sox2 nel canale centrale del midollo spinale axolotl hanno portato a una massiccia perdita di immunoreattività SOX2 nella maggior parte delle NSC del midollo spinale, con gRNA contro la tirosinasi (Tyr) come controllo (Figura 2) come controllo(Figura 2) A). B3-tubulina (macchiata con TUJ1) è un marcatore per i neuroni e non è stato espresso nelle NSC, e le cellule SOX2- TUJ1- che circondano il canale centrale sono state considerate cellule che ospitano delezioni Sox2. La quantificazione ha mostrato l'eliminazione di Sox2 in un numero significativo di NSC da parte dell'elettroporazione CAS9-Sox2-gRNA (Figura 2B), indicando che questo metodo ha portato a un'efficace e altamente penetrante eliminazione genica nelle NSC del midollo spinale.
Dopo l'iniezione contemporanea e l'elettroporazione, la miscela di due complessi CAS9-gRNA contro Sox2 e Gfp, rispettivamente, in axolotl transgenici con espressione GFP onnipresente (CAGGS-GFP), un'alta percentuale di NSC a doppio knock-out sono stati osservati (Figura 2C,D), indicando che il protocollo può essere utilizzato per eliminare in modo flessibile più geni.
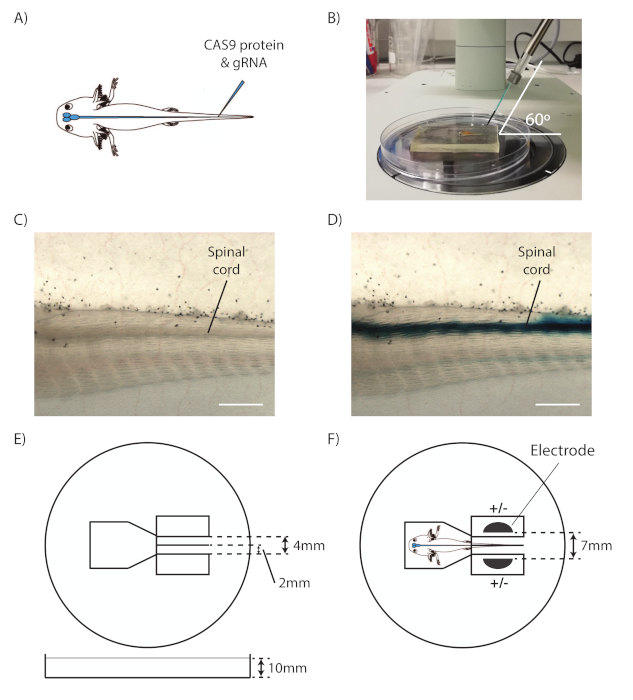
Figura 1 : Iniezione ed elettroporazione aolotl. (A) Schematico che mostra l'iniezione di CAS9-gRNA RNP nel canale centrale del midollo spinale axolotl. (B) Micromanipolatore set-up per l'iniezione. (C) Vista attraverso uno stereomicroscopio della coda axolotl, con il midollo spinale indicato. (D) Vista attraverso uno stereomicroscopio della coda axolotl con un midollo spinale iniettato. (E) Schematico della piastra di elettroporazione. (F) Schematico dell'animale e elettrodi posizionati all'interno della piastra di elettroporazione, pronti per l'elettroporazione. Barre di scala: 1 mm. Questa cifra è adattata da Albors e Tanaka18. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2 : Risultati di eliminazione dei risultati positivi nelle NSC axolotl per il midollo spinale. (A) L'iniezione del midollo spinale e l'elettroporazione di CAS9-Sox2-gRNA (n - 21) hanno portato alla perdita di SOX2 nella maggior parte delle NSC a 15 giorni dopo l'elettroporazione (dpE) per colorazione immunoistochimica. CAS9-Tyr-gRNA (n - 21) ha servito come controllo negativo. Barre della scala: 100 m. (B) La quantificazione ha mostrato una significativa riduzione delle NSC SOX2 (p < 0,001 dal test t di Student), contando le celle SOX2- TUJ1 che circondano il canale centrale come NSC che ospitano una cancellazione Sox2. Barre di errore - SD. (C) L'iniezione simultanea e l'elettroporazione di Sox2-gRNA e Gfp-gRNA accoppiate a CAS9 (n ) hanno portato alla perdita di SOX2 e GFP nella maggior parte delle NSC da colorazione immunoistochimica. CAS9-Tyr-gRNA (n - 6) funge da controllo negativo. Barre della scala: 100 m. (D) La quantificazione ha dimostrato che tra tutte le NSC interessate che hanno una cancellazione, la maggioranza (94%) doppia delezione (GFP SOX2), con solo una piccola percentuale (6%) con una singola delezioni (GFP SOX o GFP- SOX2) Questa cifra è adattata da Fei et al. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il protocollo descritto consente l'abbattimento del gene limitato di tempo e spazio nelle NSC nel midollo spinale axolotl. Il protocollo corrente consente il targeting specifico delle NSC a un'ora e una posizione definite con elevata penetrazione. Evita potenziali effetti indesiderati derivanti dall'eliminazione genica nelle NSC in altre regioni come il cervello che si verificano quando si utilizza il sistema Cre-LoxP. Evita inoltre effetti di sviluppo derivanti da un knock-out persistente, consentendo lo studio della funzione genica incentrato sulla rigenerazione. Inoltre, questo protocollo può essere eseguito in animali selvatici, evitando il lungo tempo di attesa necessario per generare ulteriori axolotl transgenici, necessari per il sistema Cre-LoxP. Offre anche la versatilità per eliminare più geni contemporaneamente ed è altamente penetrante, consentendo di effettuare esperimenti su animali F0. È importante sottolineare che la procedura non ha alcun effetto osservabile sulla rigenerazione della coda e del midollo spinale4.
L'uso di complessi RNP proteina proteina CAS9 proteina-gRNA mostra anche un'efficienza molto più elevata rispetto ai sistemi che utilizzano cas9 e plasmidi che esprimono gRNA4. Ciò è probabilmente dovuto alle dimensioni più piccole del complesso RNP rispetto ai plasmidi, così come all'uso differenziale del codone che influenza l'espressione della proteina CAS9 da plasmidi derivati da sistemi di mammiferi. Inoltre, poiché i complessi RNP proteina-gRNA CAS9 possono indurre immediatamente rotture, il knock-out si verifica rapidamente. Il 60%-70% dei loci genomici modificati è stato osservato genotipizzazione PCR entro 24 ore dall'elettroporazione (dati non mostrati). C'è anche la possibilità di eseguire knock-in utilizzando questa strategia co-elettropolando un modello di riparazione. Sono disponibili diverse strategie di acatena, i cui dettagli e le cui considerazioni non rientrano nell'ambito della presente pubblicazione, ma sono descritti in dettaglio in un'altra pubblicazione15.
D'altra parte, questo protocollo ha alcune limitazioni. La colorazione o la genotipizzazione della PCR è generalmente necessaria per valutare l'entità dell'eliminazione in ogni animale sperimentale, che può essere laborioso. Mentre l'abbattimenti genici da questo metodo è in gran parte limitato alle NSC che circondano il canale centrale, non si può escludere che altri tipi di cellule potrebbero essere presi di mira, perché 1) sono anche in contatto con il canale centrale, o 2) il mix RNP è fuoriuscito dal cen tral canale prima dell'elettroporrazione. Questi fattori devono essere presi in considerazione quando si interpretano i risultati.
design gRNA
Con il genoma axolotl e il trascrittoma assilota pubblicati di recente, identificando i geni axolotl e le loro sequenze è diventato molto più facile9,10,11,12,13. Le guide dettagliate nella progettazione di gRNA sono state descritte altrove, inclusa una che si occupa esclusivamente di axolotls15. Si consiglia di progettare e testare almeno tre gRNA per modificare in anticipo l'efficienza e di scegliere il design ottimale per l'esperimento vero e proprio. L'efficienza del gRNA può essere testata iniettando la miscela CAS9-gRNA in uova di axolotlo appena posate nello stadio a un cellula23. L'efficienza di modifica può quindi essere valutata genotipando le larve schiuse.
Considerazioni sull'iniezione
Poiché il sito di iniezione del midollo spinale soffre di danni fisici causati dall'ago e dalla diffusione della miscela RNP ai tessuti al di fuori del canale centrale, è importante eseguire l'iniezione in posizioni lontane dalla regione di interesse per essere analizzato. Ad esempio, se un'amputazione della coda viene eseguita dopo l'elettroporazione per studiare gli effetti di un gene mirato nella rigenerazione del midollo spinale, è necessario eseguire l'iniezione in cui il sito verrà rimosso da amputazione.
Entrare nel canale centrale con un capillare a iniezione è la fase più critica di questo protocollo, e si consiglia ai nuovi utenti di praticare prima dell'esperimento vero e proprio. L'iniezione è meglio eseguita su animali più piccoli (meno di 2,5 cm di lunghezza) all'estremità posteriore del midollo spinale, dove è più facile posizionare la punta capillare nel canale centrale. Si consiglia di osservare da vicino la diffusione iniziale del mix RNP di colore blu. C'è la possibilità che la miscela RNP possa essere iniettata nello spazio meningeo intorno al midollo spinale. Una diffusione rapida e tagliente come una linea lungo il centro del midollo spinale indica un'iniezione riuscita nel canale centrale18. Se nulla esce o la diffusione si ferma prematuramente, si consiglia di tenere premuto il pedale del piede mentre si muove leggermente il capillare dentro e fuori. Se questo non riesce, potrebbe essere necessario riposizionare il capillare o verificare la presenza di un'apertura intasata. Affinché la miscela RNP si diffonda nei ventricoli cerebrali, è spesso necessario aumentare la pressione di espulsione verso la fine. Avere i ventricoli cerebrali riempiti non è necessario per l'elettroporazione del midollo spinale, ma è la migliore indicazione che la miscela RNP è stata iniettata nel canale centrale.
Considerazioni sull'elettroporazione
Si consiglia di ottimizzare i parametri di elettroporazione in anticipo per ottenere una consegna sufficiente del RNP alla maggior parte delle NSC senza causare danni estesi ad altri tessuti o uccidere l'animale. Questo protocollo è stato ottimizzato per gli animali di 2,0-2,5 cm di lunghezza nella dimensione18. È probabile che sia necessaria una riduzione della tensione dell'impulso di trasferimento a 35 V quando si lavora con animali più piccoli di questo. D'altra parte, gli animali più grandi richiederanno una tensione più elevata e/o più impulsi. Inoltre, la distanza tra gli elettrodi influisce sull'efficienza. Per gli animali più grandi può essere necessaria una riduzione della distanza a 6 mm.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Ringraziamo la prof.ssa Elly M. Tanaka per il suo continuo e lungo supporto. Questo lavoro è stato sostenuto da una National Natural Science Foundation of China (NSFC) Grant (317716), Research Starting Grants della South China Normal University (S82111 e 8S0109), e un China Postdoctoral Science Foundation Grant (2018M633067).
Materiali
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | A9539 | |
| Benzocaine | Sigma-Aldrich | E1501-100G | |
| Benzocaine 0.03 % (wt/vol) | Mix 500 ml of 10× TBS, 500 ml of 400% (wt/vol) Holtfreter’s solution and 30 ml of 10% (wt/vol) benzocaine stock solution. Fill up the volume to 10 L with dH2O. The solution can be stored at room temperature for up to 6 months. | ||
| Benzocaine 10 % (wt/vol) | Mix 50 g of benzocaine in 500 ml of 100% (vol/vol) ethanol. The solution can be stored at room temperature for up to 12 months. | ||
| Borosilicate glass capillaries 1.2 mm O.D., 0.94 mm I.D. | Stutter Instrument | BF120-94-8 | |
| CaCl2·2H2O | Merck | 102382 | |
| CAS9 buffer, 10x | Mix 200 mM HEPES and 1.5 M KCl in RNase-free water. Adjust pH to 7.5. Filter sterilize, aliquot and store at −20 °C for up to 24 months | ||
| CAS9-NLS protein | PNA Bio | CP03 | |
| Cell culture dishes, 10cm | Falcon | 351029 | |
| Dumont #5 - Fine Forceps | Fine Scientific Instruments | 11254-20 | |
| Electroporator | Nepa Gene | NEPA21 | |
| BEX | Pulse Generator CUY21EDIT II | ||
| Fast Green FCF | Sigma-Aldrich | F7252-5G | |
| Fast Green FCF Solution, 5x | Dissolve 12.5 mg of Fast Green FCF powder in 10 mL of 1× PBS. | ||
| Flaming/Brown Micropipette Puller | Stutter Instrument | P-97 | |
| Holtfreter’s solution 400% (wt/vol) | Dissolve 11.125 g of MgSO4·7H2O, 5.36 g of CaCl2·2H2O, 158.4 g of NaCl and 2.875 g of KCl in 10 L of dH2O. The solution can be stored at room temperature for up to 6 months. | ||
| KCl | Merck | 104936 | |
| MgSO4·7H2O | Merck | 105886 | |
| Microloader pipette tips | Eppendorf | 5242956003 | |
| Micromanipulator | Narishige | MN-153 | |
| NaCl | Merck | 106404 | |
| Pneumatic PicoPump | World Precision Instruments | SYS-PV830 | |
| Ring Forceps | Fine Scientific Instruments | 11103-09 | |
| Stereomicroscope | Olympus | SZX10 | |
| Tris base | Sigma-Aldrich | T6066 | |
| Tris-buffered saline, 10x | Dissolve 24.2 g of Tris base and 90 g of NaCl in 990 ml of dH2O. Adjust pH to 8.0 by adding 10 ml of 37% (vol/vol) HCl. The solution can be stored at room temperature for up to 6 months. | ||
| Tweezers w/Variable Gap 2 Round Platinum Plate Electrode, 10mm diameter | Nepa Gene | CUY650P10 |
Riferimenti
- O'Hara, C. M., Egar, M. W., Chernoff, E. A. G. Reorganization of the ependyma during axolotl spinal cord regeneration: Changes in intermediate filament and fibronectin expression. Developmental Dynamics. 193 (2), 103-115 (1992).
- Mchedlishvili, L., Mazurov, V., Tanaka, E. M. Reconstitution of the Central Nervous System During Salamander Tail Regeneration from the Implanted Neurospheres. Plant, Soil and Environment. 916 (8), 197-202 (2012).
- Nordlander, R. H., Singer, M. The role of ependyma in regeneration of the spinal cord in the urodele amphibian tail. Journal of Comparative Neurology. 180 (2), 349-373 (1978).
- Fei, J. F., et al. Tissue- and time-directed electroporation of CAS9 protein–gRNA complexes in vivo yields efficient multigene knock-out for studying gene function in regeneration. npj Regenerative Medicine. 1 (1), 16002 (2016).
- Fei, J. F., et al. CRISPR-mediated genomic deletion of Sox2 in the axolotl shows a requirement in spinal cord neural stem cell amplification during tail regeneration. Stem Cell Reports. 3 (3), 444-459 (2014).
- Flowers, G. P., Timberlake, A. T., McLean, K. C., Monaghan, J. R., Crews, C. M. Highly efficient targeted mutagenesis in axolotl using Cas9 RNA-guided nuclease. Development. 141 (10), 2165-2171 (2014).
- Flowers, G. P., Sanor, L. D., Crews, C. M. Lineage tracing of genome-edited alleles reveals high fidelity axolotl limb regeneration. eLife. 6, (2017).
- Fei, J. -. F., et al. Efficient gene knockin in axolotl and its use to test the role of satellite cells in limb regeneration. Proceedings of the National Academy of Sciences. 201706855. , (2017).
- Nowoshilow, S., et al. The axolotl genome and the evolution of key tissue formation regulators. Nature. 554 (7690), 50-55 (2018).
- Bryant, D. M., et al. A Tissue-Mapped Axolotl De Novo Transcriptome Enables Identification of Limb Regeneration Factors. Cell Reports. 18 (3), 762-776 (2017).
- Smith, J. J., et al. A chromosome-scale assembly of the axolotl genome. Genome Research. 373548, (2019).
- Smith, J. J., et al. Sal-Site: Integrating new and existing ambystomatid salamander research and informational resources. BMC Genomics. 6, 1-6 (2005).
- Campbell, L. J., et al. et al Gene expression profile of the regeneration epithelium during axolotl limb regeneration. Developmental Dynamics. 240 (7), 1826-1840 (2011).
- Stewart, R., et al. Comparative RNA-seq Analysis in the Unsequenced Axolotl: The Oncogene Burst Highlights Early Gene Expression in. the Blastema. PLoS Computational Biology. 9 (3), (2013).
- Fei, J. -. F., et al. Application and optimization of CRISPR–Cas9-mediated genome engineering in axolotl (Ambystoma mexicanum). Nature Protocols. 13 (12), 2908-2943 (2018).
- Holder, N., et al. Continuous growth of the motor system in the axolotl. Journal of Comparative Neurology. 303 (4), 534-550 (1991).
- Tazaki, A., Tanaka, E. M., Fei, J. F. Salamander spinal cord regeneration: The ultimate positive control in vertebrate spinal cord regeneration. Developmental Biology. 432 (1), 63-71 (2017).
- Albors, A. R., Tanaka, E. M. High-Efficiency Electroporation of the Spinal Cord in Larval Axolotl. Salamanders in Regeneration Research: Methods and Protocols. 1290, 115-125 (2015).
- Albors, A. R., et al. et al Planar cell polarity-mediated induction of neural stem cell expansion during axolotl spinal cord regeneration. eLife. 4, 1-29 (2015).
- Cong, L., et al. Multiplex Genome Engineering Using CRISPR/Cas Systems. Science. 339 (6121), 819-823 (2013).
- Doench, J. G., et al. Optimized sgRNA design to maximize activity and minimize off-target effects of CRISPR-Cas9. Nature Biotechnology. 34 (2), 184-191 (2016).
- Graham, D. B., Root, D. E. Resources for the design of CRISPR gene editing experiments. Genome Biology. 16 (1), 260 (2015).
- Khattak, S., et al. Optimized axolotl (Ambystoma mexicanum) husbandry, breeding, metamorphosis, transgenesis and tamoxifen-mediated recombination. Nature Protocols. 9 (3), 529-540 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon