Method Article
Direct Gene Knock-out of Axolotl Spinal Cord Neural Stem Cells via Electroporation of CAS9 Protein-gRNA Complexes
Dans cet article
Résumé
Présenté ici est un protocole pour effectuer le temps et l'espace-limité gène knock-out dans les moelles épinières axolotl en injectant CAS9-gRNA complexe dans le canal central de la moelle épinière suivie d'électroporation.
Résumé
L'axolotl a la capacité unique de régénérer complètement sa moelle épinière. Ceci est en grande partie dû aux cellules éparméymales restant en tant que cellules souches neurales (NSCs) tout au long de la vie, qui prolifèrent pour réformer le tube éparmeymal et différencier en neurones perdus après des dommages de moelle épinière. Déchiffrer comment ces CNS conservent la pluripotence après le développement et prolifèrent sur les lésions de la moelle épinière pour réformer la structure exacte avant les blessures peut fournir un aperçu précieux sur la façon dont les moelles épinières mammifères peuvent se régénérer ainsi que les options de traitement potentielles. L'exécution de knock-outs génétiques dans des sous-ensembles spécifiques de NSC dans un délai limité permettra d'étudier les mécanismes moléculaires derrière ces processus régénérateurs, sans être confondus par le développement des effets perturbateurs. Décrit ici est une méthode pour effectuer le gène knock-out dans les NSC de moelle épinière d'axolotl utilisant le système CRISPR-Cas9. En injectant le complexe CAS9-gRNA dans le canal central de la moelle épinière suivi d'électroporation, les gènes cibles sont éliminés dans les CNS dans des régions spécifiques de la moelle épinière à un moment souhaité, ce qui permet des études moléculaires des CNS de la moelle épinière pendant régénération.
Introduction
La moelle épinière de la plupart des vertébrés est incapable de se régénérer à la suite d'une blessure, ce qui entraîne une invalidité permanente. Plusieurs salamandres, comme l'axolotl, sont des exceptions notables. L'axolotl peut régénérer complètement une moelle épinière structurellement identique et restaurer complètement la fonction de la moelle épinière. Une grande partie de la capacité régénératrice de la moelle épinière axolotl est due aux cellules éparméymales. Ces cellules tapissent le canal central, et contrairement à celles des mammifères, les cellules épargymales de l'axolotl restent en tant que cellules souches neurales (NSC) développement post-embryonnaire. Après une lésion de la moelle épinière (p. ex., à partir d'une amputation de la queue), ces CNS prolifèrent pour repousser le tube éparmeymalet et se différencier pour remplacer les neurones perdus1,2,3. Découvrir comment les CNS de la moelle épinière axolotl restent pluripotents et s'activent après une blessure peut fournir des informations précieuses sur l'élaboration de nouvelles stratégies thérapeutiques pour les patients humains.
En raison des progrès de la technique DE knock-out du gène CRISPR-Cas9, l'exécution des knock-outs pour déchiffrer la fonction du gène est devenue plus facile et a été montrée pour avoir une large applicabilité dans diverses espèces, y compris les axolotls4,5, 6 Annonces , 7 Annonces , 8. La publication récente du génome complet de l'axolotl et du transcriptome permet maintenant de cibler tout locus génomique et de mieux évaluer les effets hors cible9,10,11,12 , 13 (en) , 14. Des protocoles optimisés ont été développés pour les knock-out et knock-in en axolotls à l'aide du système CRISPR-Cas915. La livraison de la machinerie CRISPR-Cas9 sous forme de ribonucleoprotéine protéine-gRNA CAS9 (RNP) s'est avérée plus efficace que l'utilisation de Plasmides Cas9 et gRNA-encodage4. Ceci est probablement dû au RNP étant plus petit dans la taille que les vecteurs de plasmide, sa capacité à créer des ruptures d'ADN immédiatement, et protégeant de l'ARNc de la dégradation d'ARN. En outre, l'utilisation de rIN contourne la transcription et la traduction; ainsi, il évite des questions telles que la force de promoteur et l'utilisation optimale de codon quand les éléments de plasmide sont dérivés d'une espèce différente.
Les études sur la perte de fonction sont l'une des approches générales pour étudier les fonctions potentielles des gènes d'intérêt. Afin d'étudier la fonction génique pendant la régénération, un knock-out devrait idéalement être effectué juste avant une blessure pour éviter les effets sur le développement. En outre, le knock-out devrait être limité à la fois aux CNS et à la région de régénération. Un knock-out du gène cible dans tous les CNS (y compris ceux dans le cerveau, ce qui est le cas dans les systèmes Cre-LoxP), peut produire des effets non liés à la régénération qui peuvent confondre l'interprétation des résultats. Heureusement, la structure de la moelle épinière axolotl offre une occasion unique pour le temps et l'espace restreint knock-out dans les CNS. La plupart des NSC de la moelle épinière sont en contact avec le canal central et constituent la grande majorité des cellules en contact avec le canal central16,17. Par conséquent, une injection du complexe CAS9-gRNA dans le canal central, suivie de l'électroporation, permet l'administration aux CNS de la moelle épinière dans une région désirée à un moment précis4,18,19. Ce protocole démontre comment cela est effectué, menant à l'élimination très pénétrante dans les NSC ciblés de moelle épinière. L'analyse suivante est exécutée pour étudier les effets sur la régénération et le comportement de NSC.
Protocole
Toutes les expériences sur les animaux doivent être menées conformément aux réglementations locales et nationales sur l'expérimentation animale et avec l'approbation de la commission d'examen institutionnelle compétente.
1. Préparation du mix RNP CAS9-gRNA
- Concevoir et synthétiser les gARN.
REMARQUE: Se référer à d'autres publications pour la conception et la synthèse des gARN, y compris un exclusivement concernant les axolotls15,20,21,22. - Obtenir la protéine CAS9-NLS en la préparant à l'interne ou en l'achetant commercialement.
- Préparer le mélange CAS9-gRNA en mélangeant 5 g de protéines CAS9-NLS, 4 g de gRNA, 0,9 l de tampon CAS9 10x CAS9, et remplir le volume à 10 OL avec H2O. Aliquot sans nucléane le mélange et stocker à -80 oC s'il n'est pas utilisé immédiatement.
2. Préparation des plaques d'agarose pour l'électroporation
- Préparer 200 ml de 2 % (wt/vol) solution d'agarose en 1x DPBS. Dissoudre en chauffant la solution au micro-ondes et la verser sur des plats Petri de 10 cm à une profondeur d'environ 10 mm (assez profond pour couvrir l'animal entier).
- Laisser les plaques se solidifier à température ambiante. Conserver les assiettes à 4 oC si elles ne sont pas utilisées immédiatement.
- À l'aide de scalpels chirurgicaux, couper la plaque d'agarose pour faire une éboulement pour tenir la queue droite, un puits pour l'ajustement dans le corps de l'animal, et deux puits supplémentaires pour placer les électrodes (Figure 1E).
- Placez la plaque sur la glace et remplissez-la jusqu'à ras bord avec de la glace 1x DPBS. Utilisez la même solution DPBS pour fabriquer les plaques afin d'assurer une conductibilité électrique cohérente dans la configuration.
3. Configuration de l'électroporateur
- Configurer l'électroporateur. Mettre en place le pouls de poring pour se composer d'une impulsion bipolaire de 70 V, avec une durée de 5 ms, intervalle de 50 ms, et aucune carie de tension. Configurez l'impulsion de transfert pour avoir quatre impulsions bipolaires de 40 V, d'une durée de 50 ms, d'un intervalle de 999 ms et d'une carie de tension de 10 %.
- Connectez les électrodes à l'électroporateur et ajustez les pinces à 7 mm l'une de l'autre. Immerger les électrodes dans un bécher de DPBS avant et entre l'électroporation.
4. Préparation et chargement des capillaires en verre microinjection
- Effectuez un essai de rampe sur un puller de micropipette flamboyant/brun selon les instructions du fabricant pour déterminer la valeur de chaleur.
- Tirez les capillaires d'injection avec des extrémités effilées en utilisant les paramètres suivants : chaleur et valeur d'essai de rampe, traction 100, vitesse de 100, temps 100.
- Observez l'aiguille sous un stéréomicroscope. À l'aide de fines forceps, casser le capillaire à un angle de sorte qu'il a une pointe inclinée. Casser à une position où il est assez mince pour cibler le canal central, tout en étant assez fort pour percer la peau.
REMARQUE : Le point où le diamètre est d'environ 20 m ou environ 50 % du diamètre de la moelle épinière est un bon point de départ. Plusieurs essais peuvent être nécessaires pour obtenir une rupture optimale. - Ajoutez la solution Fast Green FCF au mélange RNP à un rapport de 1:30 et chargez environ 5 livres de mélange d'injection dans le capillaire avec une pointe de pipette Microloader.
- Montez le capillaire sur la pompe pneumatique, avec la pointe inclinée vers le bas.
5. Configuration de la pompe pneumatique
- Configurer la pompe pneumatique. Placez la cale à 0,5 livres par pouce carré (psi), éjecter à 2 psi tenir, et la durée à fermée.
- Testez les réglages capillaires et pneumatiques de la pompe en trempant le capillaire dans une goutte d'eau et en appuyant sur la pédale pour l'injecter. Assurez-vous que le mélange d'injection sort dans un flux lent mais régulier.
- Ajustez la pression de retenue si le mélange d'injection commence à s'écouler spontanément ou si l'eau est aspirée vers le capillaire. Augmenter la pression d'éjection ou casser plus du capillaire si le mélange d'injection sort trop lentement. Diminuez la pression d'éjection si l'injection sort trop vite.
6. Injecter le mélange de RNP dans la moelle épinière
- Anesthésiez les axolotls dans une solution de benzocaïne de 0,03 % pendant au moins 10 min. Vérifiez que les animaux ne sont pas réactifs en les renversant à l'envers dans l'eau.
- Ramassez un animal avec des forceps d'anneau et déposez-le sur un lit de silicium, avec le côté gauche de l'animal tourné vers le haut et la queue pointant vers la droite. Placez le site d'injection au milieu du champ de vision du stéréomicroscope (figure 1A).
- Ajustez le micromanipulateur de manière à ce que le capillaire arrive à 60 degrés du côté droit du champ de vision (Figure 1B).
- Identifier la moelle épinière et le canal central (figure 1C).
REMARQUE: La moelle épinière est la structure tubulaire au-dessus du notochord. - En visant le canal central, déplacez le capillaire vers l'avant pour percer doucement la peau et le muscle dans le canal central de la moelle épinière. Limitez le mouvement du capillaire à de petits pas, car la moelle épinière est juste sous les muscles de la queue.
- Appuyez et maintenez la pédale pour injecter le mélange dans le canal central. Observez si le mélange RNP se propage le long du canal central comme une ligne bleue dans les deux directions, ce qui montre que le capillaire a été correctement positionné (Figure 1D).
- Si cela ne se produit pas, maintenez la pédale du pied pressée tout en déplaçant le capillaire légèrement dans et hors jusqu'à ce que le mélange RNP commence à entrer. Si le capillaire est obstrué par les tissus, effacez-le en s'éjectant dans l'eau à des pressions plus élevées.
- Ajustez la pression d'éjection de sorte qu'il soit juste assez pour causer le mélange RNP à se propager dans le canal central, mais pas tellement qu'il fait sauter la structure.
- Continuer à maintenir la pédale de pied afin que le mélange d'injection se propage plus loin le long du canal central, jusqu'à ce qu'il atteigne la vésicule terminale à l'extrémité de la moelle épinière et ventricules dans le cerveau.
REMARQUE: Cela peut prendre jusqu'à 2 min selon la taille de l'animal. Il peut être nécessaire d'augmenter la pression après un certain temps pour provoquer le mélange RNP d'entrer dans les ventricules du cerveau. - Procéder dès que possible à l'électroporation après injection réussie.
7. Électroporation
- Transférer l'animal avec des forceps d'anneau sur la plaque d'électroporation d'agarose préparée (figure 1E) sur la glace. Placez la queue à l'intérieur de la fendue afin qu'elle soit prise en sandwich par l'agarose (Figure 1F).
- Placez les électrodes dans les puits des deux côtés de la queue. Assurez-vous que l'animal entier et les électrodes sont recouverts de PBS glacé.
- Appuyez sur l'interrupteur du pied pour démarrer l'électroporation.
- Une fois l'électroporation terminée, remettre l'animal à l'eau.
- Procéder à l'injection d'autres animaux si nécessaire.
- Vérifiez que les animaux électroporated sont en bonne santé après l'anesthésie s'estompe et qu'il n'y a aucun dommage fait à la queue.
8. Évaluer l'efficacité des koqueurs
- Fixer la queue de l'animal électroporated. Faire des coupes transversales de la queue suivies d'une coloration immunohistochimique pour évaluer l'efficacité du knock-out au niveau des protéines.
REMARQUE : Si une amputation de la queue doit être effectuée après l'électroporation, la queue coupée pourrait être utilisée à cette fin. Les animaux électroporated avec des gRNAs contre Gfp ou Tyrosinase, par exemple, peuvent être utilisés comme un contrôle négatif4. - Alternativement, la moelle épinière électroporated pourrait être extraite et lysée pour l'ADN. Effectuer le génotypage PCR suivi du séquençage De Sanger ou du séquençage de la prochaine génération pour évaluer le pourcentage de loci génétique édité15.
REMARQUE : L'efficacité d'édition résultante sous-estimera l'efficacité réelle d'édition pour les NSC, en raison de l'inclusion de cellules et de neurones non électroporated qui manquent de contact apaical au lumen central et ne recevront donc pas le mélange de RNP.
Résultats
L'injection et l'électroporation du complexe CAS9-gRNA contre Sox2 dans le canal central de la moelle épinière axolotl ont conduit à une perte massive d'immunoréactivité SOX2 dans la majorité des NSC de la moelle épinière, avec gRNA contre Tyrosinase (Tyr) comme un contrôle (Figure 2 A) B3-tubulin (stained with TUJ1) is a marker for neurons and was not expressed in NSCs, and SOX2- TUJ1- cells surrounding the central canal were considered to be cells harboring Sox2 deletions. Quantification a montré Sox2 knock-out dans un nombre important de NSCpar par CAS9- Sox2-gRNA électroporation (Figure 2B), indiquant que cette méthode a conduit à efficace et très pénétrant gène knock-out dans la moelle épinière NSCs.
Après injection et électroporation simultanées, le mélange de deux complexes CAS9-gRNA contre Sox2 et Gfp, respectivement, en axolotls transgéniques avec l'expression gFP omniprésente (CAGGS-GFP), un pourcentage élevé de NSC double knock-out ont été observés (figure 2C,D), indiquant que le protocole peut être utilisé pour assommer avec souplesse plusieurs gènes.
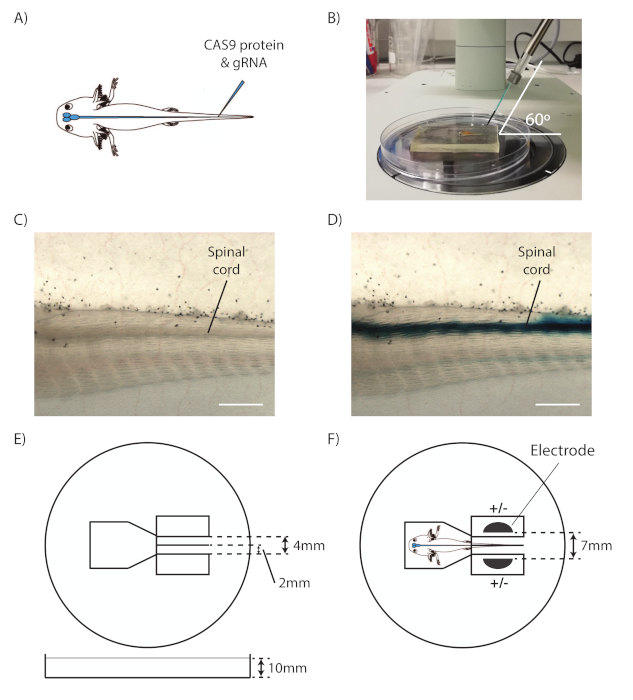
Figure 1 : Injection et électroporation de la moelle épinière d'Axolotl. (A) Injection schématique de RNP CAS9-gRNA dans le canal central de la moelle épinière axolotl. (B) Mise en place de micromanipulateur pour l'injection. (C) Voir à travers un stéréomicroscope de la queue d'axolotl, avec la moelle épinière indiquée. (D) Voir à travers un stéréomicroscope de la queue d'axolotl avec une moelle épinière injectée. (E) Schéma de la plaque d'électroporation. (F) Schéma de l'animal et électrodes placées à l'intérieur de la plaque d'électroporation, prête pour l'électroporation. Barres d'échelle de 1 mm. Ce chiffre est adapté d'Albors et Tanaka18. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Résultats knock-out représentatifs dans les NSC de la moelle épinière axolotl. (A) L'injection de moelle épinière et l'électroporation de CAS9- Sox2-gRNA (n - 21) ont mené à la perte de SOX2 dans la majorité des NSCs à 15 jours après l'électroporation (dpE) par coloration immunohistochemical. CAS9-Tyr-gRNA (n ' 21) a servi de contrôle négatif. Barres d'échelle de 100 m. (B) Quantification a montré une réduction significative des CNS SOX2 (p lt; 0,001 par l'étudiant t-test), en comptant SOX2- TUJ1- cellules entourant le canal central que les CNS hébergeant une suppression Sox2. Les barres d'erreur - SD. (C) Injection simultanée et électroporation de Sox2-gRNA et Gfp-gRNA couplé à CAS9 (n - 6) ont mené à la perte de SOX2 et de GFP dans la majorité des NSC par coloration immunohistochemical. CAS9-Tyr-gRNA (n - 6) sert de contrôle négatif. Barres d'échelle de 100 m. (D) La quantification a montré que parmi tous les CNS ciblés ayant une suppression, une majorité (94 %) a été doublée (GFPMD SOX2MD), avec seulement une faible proportion (6 %) suppression unique (GFPMD SOX- ou GFP- SOX2). Ce chiffre est adapté de Fei et coll.4. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Le protocole décrit permet le temps et l'espace restreint gène knock-out dans les CNS dans la moelle épinière axolotl. Le protocole actuel permet un ciblage spécifique des CNS à un moment et à un endroit définis avec une forte pénétration. Il évite les effets indésirables potentiels provenant de l'élimination des gènes dans les CNS dans d'autres régions telles que le cerveau qui se produisent lors de l'utilisation du système Cre-LoxP. Il évite également les effets sur le développement provenant d'un knock-out persistant, permettant l'étude de la fonction génique axée sur la régénération. En outre, ce protocole peut être exécuté chez les animaux de type sauvage, en évitant le long temps d'attente nécessaire pour générer des axolotls transgéniques supplémentaires, qui est nécessaire pour le système Cre-LoxP. Il offre également la polyvalence de knock-out plusieurs gènes simultanément et est très pénétrant, permettant des expériences à effectuer sur les animaux F0. Fait important, la procédure n'a pas d'effet observable sur la régénération de la queue et de la moelle épinière4.
L'utilisation de complexes RNP protéine-gRNA CAS9 affiche également une efficacité beaucoup plus élevéeque les systèmes utilisant Cas9 et les plasmides exprimant l'ARNc4. Cela est probablement dû à la taille plus petite du complexe RNP par rapport aux plasmides, ainsi que l'utilisation différentielle de codon affectant l'expression de la protéine CAS9 à partir de plasmides dérivés de systèmes mammifères. En outre, puisque les complexes RNP protéine-gRNA CAS9 peuvent induire des ruptures immédiatement, knock-out se produit rapidement. 60%-70% des loci génomiques modifiés ont été observés en génotypage PCR dans les 24 h de l'électroporation (données non montrées). Il est également possible d'effectuer des knock-ins en utilisant cette stratégie en co-électroporating un modèle de réparation. Un certain nombre de stratégies knock-in sont disponibles, dont les détails et les considérations sont hors de portée pour cette publication, mais ils sont décrits en détail dans une autre publication15.
D'autre part, ce protocole a quelques limites. La coloration ou le génotypage PCR est généralement nécessaire pour évaluer l'étendue de knock-out dans chaque animal expérimental, qui peut être laborieux. Bien que le gène knock-out de cette méthode est largement limitée aux CNS entourant le canal central, il ne peut pas être exclu que d'autres types de cellules pourraient également être ciblées, parce que 1) ils sont également en contact avec le canal central, ou 2) le mélange RNP a fui hors du cen canal tral avant l'électroporation. Ces facteurs doivent être pris en considération lors de l'interprétation des résultats.
gRNA design
Avec le génome axolotl récemment publié et transcriptome, l'identification des gènes axolotl et de leurs séquences est devenu beaucoup plus facile9,10,11,12,13. Des guides détaillés dans la conception des GARN ont été décrits ailleurs, y compris un qui traite exclusivement des axolotls15. Il est conseillé de concevoir et de tester au moins trois gARN pour l'efficacité d'édition à l'avance et de choisir la conception optimale pour l'expérience réelle. L'efficacité de l'ARNc peut être testée en injectant le mélange CAS9-gRNA dans des œufs d'axolotl fraîchement pondus au stade23d'une cellule. L'efficacité de l'édition peut ensuite être évaluée en génotypage des larves écloses.
Considérations liées à l'injection
Étant donné que le site d'injection de la moelle épinière souffre de dommages physiques causés par l'aiguille et la propagation du mélange RNP aux tissus à l'extérieur du canal central, il est important d'effectuer l'injection à des positions loin de la région d'intérêt à analyser. Par exemple, si une amputation de la queue est effectuée après l'électroporation pour étudier les effets d'un gène ciblé dans la régénération de la moelle épinière, il est nécessaire d'effectuer l'injection où le site sera enlevé par amputation.
Entrer dans le canal central avec un capillaire d'injection est l'étape la plus critique de ce protocole, et les nouveaux utilisateurs sont invités à pratiquer avant l'expérience réelle. L'injection est mieux effectuée sur les petits animaux (moins de 2,5 cm de long) à l'extrémité postérieure de la moelle épinière, où il est plus facile de positionner la pointe capillaire dans le canal central. Il est conseillé d'observer de près la propagation initiale du mélange RNP de couleur bleue. Il est possible que le mélange RNP peut être injecté dans l'espace méningéautour de la moelle épinière. Une propagation nette et rapide comme une ligne le long du milieu de la moelle épinière indique une injection réussie dans le canal central18. Si rien ne sort ou que la propagation s'arrête prématurément, il est recommandé de garder la pédale du pied pressée tout en déplaçant légèrement le capillaire à l'intérieur et à l'extérieur. Si cela échoue, il peut être nécessaire de repositionner le capillaire ou de vérifier s'il y a une ouverture obstruée. Pour que le mélange DE RNP se propage dans les ventricules de cerveau, il est souvent nécessaire d'augmenter la pression d'éjection vers la fin. Avoir les ventricules du cerveau remplis n'est pas nécessaire pour l'électroporation de la moelle épinière, mais c'est la meilleure indication que le mélange RNP a été injecté dans le canal central.
Considérations d'électroporation
Il est conseillé d'optimiser les paramètres d'électroporation à l'avance pour obtenir une livraison suffisante du RNP à la majorité des NSC sans causer de dommages importants à d'autres tissus ou tuer l'animal. Ce protocole a été optimisé pour les animaux de 2,0 à 2,5 cm de long en taille18. Une réduction de la tension d'impulsion de transfert à 35 V est probablement nécessaire en travaillant avec des animaux plus petits que celui-ci. D'autre part, les animaux plus grands auront besoin d'une tension plus élevée et / ou plus d'impulsions. En outre, la distance entre les électrodes affecte l'efficacité. Une réduction de la distance à 6 mm peut être nécessaire pour les animaux plus grands.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d'intérêts.
Remerciements
Nous remercions le professeur Elly M. Tanaka pour son soutien continu et à long terme. Ce travail a été soutenu par une subvention de la National Natural Science Foundation of China (NSFC) (317716), des subventions de recherche de départ de l'Université normale de Chine du Sud (S82111 et 8S0109), et une subvention de la China Postdoctoral Science Foundation (2018M633067).
matériels
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | A9539 | |
| Benzocaine | Sigma-Aldrich | E1501-100G | |
| Benzocaine 0.03 % (wt/vol) | Mix 500 ml of 10× TBS, 500 ml of 400% (wt/vol) Holtfreter’s solution and 30 ml of 10% (wt/vol) benzocaine stock solution. Fill up the volume to 10 L with dH2O. The solution can be stored at room temperature for up to 6 months. | ||
| Benzocaine 10 % (wt/vol) | Mix 50 g of benzocaine in 500 ml of 100% (vol/vol) ethanol. The solution can be stored at room temperature for up to 12 months. | ||
| Borosilicate glass capillaries 1.2 mm O.D., 0.94 mm I.D. | Stutter Instrument | BF120-94-8 | |
| CaCl2·2H2O | Merck | 102382 | |
| CAS9 buffer, 10x | Mix 200 mM HEPES and 1.5 M KCl in RNase-free water. Adjust pH to 7.5. Filter sterilize, aliquot and store at −20 °C for up to 24 months | ||
| CAS9-NLS protein | PNA Bio | CP03 | |
| Cell culture dishes, 10cm | Falcon | 351029 | |
| Dumont #5 - Fine Forceps | Fine Scientific Instruments | 11254-20 | |
| Electroporator | Nepa Gene | NEPA21 | |
| BEX | Pulse Generator CUY21EDIT II | ||
| Fast Green FCF | Sigma-Aldrich | F7252-5G | |
| Fast Green FCF Solution, 5x | Dissolve 12.5 mg of Fast Green FCF powder in 10 mL of 1× PBS. | ||
| Flaming/Brown Micropipette Puller | Stutter Instrument | P-97 | |
| Holtfreter’s solution 400% (wt/vol) | Dissolve 11.125 g of MgSO4·7H2O, 5.36 g of CaCl2·2H2O, 158.4 g of NaCl and 2.875 g of KCl in 10 L of dH2O. The solution can be stored at room temperature for up to 6 months. | ||
| KCl | Merck | 104936 | |
| MgSO4·7H2O | Merck | 105886 | |
| Microloader pipette tips | Eppendorf | 5242956003 | |
| Micromanipulator | Narishige | MN-153 | |
| NaCl | Merck | 106404 | |
| Pneumatic PicoPump | World Precision Instruments | SYS-PV830 | |
| Ring Forceps | Fine Scientific Instruments | 11103-09 | |
| Stereomicroscope | Olympus | SZX10 | |
| Tris base | Sigma-Aldrich | T6066 | |
| Tris-buffered saline, 10x | Dissolve 24.2 g of Tris base and 90 g of NaCl in 990 ml of dH2O. Adjust pH to 8.0 by adding 10 ml of 37% (vol/vol) HCl. The solution can be stored at room temperature for up to 6 months. | ||
| Tweezers w/Variable Gap 2 Round Platinum Plate Electrode, 10mm diameter | Nepa Gene | CUY650P10 |
Références
- O'Hara, C. M., Egar, M. W., Chernoff, E. A. G. Reorganization of the ependyma during axolotl spinal cord regeneration: Changes in intermediate filament and fibronectin expression. Developmental Dynamics. 193 (2), 103-115 (1992).
- Mchedlishvili, L., Mazurov, V., Tanaka, E. M. Reconstitution of the Central Nervous System During Salamander Tail Regeneration from the Implanted Neurospheres. Plant, Soil and Environment. 916 (8), 197-202 (2012).
- Nordlander, R. H., Singer, M. The role of ependyma in regeneration of the spinal cord in the urodele amphibian tail. Journal of Comparative Neurology. 180 (2), 349-373 (1978).
- Fei, J. F., et al. Tissue- and time-directed electroporation of CAS9 protein–gRNA complexes in vivo yields efficient multigene knock-out for studying gene function in regeneration. npj Regenerative Medicine. 1 (1), 16002 (2016).
- Fei, J. F., et al. CRISPR-mediated genomic deletion of Sox2 in the axolotl shows a requirement in spinal cord neural stem cell amplification during tail regeneration. Stem Cell Reports. 3 (3), 444-459 (2014).
- Flowers, G. P., Timberlake, A. T., McLean, K. C., Monaghan, J. R., Crews, C. M. Highly efficient targeted mutagenesis in axolotl using Cas9 RNA-guided nuclease. Development. 141 (10), 2165-2171 (2014).
- Flowers, G. P., Sanor, L. D., Crews, C. M. Lineage tracing of genome-edited alleles reveals high fidelity axolotl limb regeneration. eLife. 6, (2017).
- Fei, J. -. F., et al. Efficient gene knockin in axolotl and its use to test the role of satellite cells in limb regeneration. Proceedings of the National Academy of Sciences. 201706855. , (2017).
- Nowoshilow, S., et al. The axolotl genome and the evolution of key tissue formation regulators. Nature. 554 (7690), 50-55 (2018).
- Bryant, D. M., et al. A Tissue-Mapped Axolotl De Novo Transcriptome Enables Identification of Limb Regeneration Factors. Cell Reports. 18 (3), 762-776 (2017).
- Smith, J. J., et al. A chromosome-scale assembly of the axolotl genome. Genome Research. 373548, (2019).
- Smith, J. J., et al. Sal-Site: Integrating new and existing ambystomatid salamander research and informational resources. BMC Genomics. 6, 1-6 (2005).
- Campbell, L. J., et al. et al Gene expression profile of the regeneration epithelium during axolotl limb regeneration. Developmental Dynamics. 240 (7), 1826-1840 (2011).
- Stewart, R., et al. Comparative RNA-seq Analysis in the Unsequenced Axolotl: The Oncogene Burst Highlights Early Gene Expression in. the Blastema. PLoS Computational Biology. 9 (3), (2013).
- Fei, J. -. F., et al. Application and optimization of CRISPR–Cas9-mediated genome engineering in axolotl (Ambystoma mexicanum). Nature Protocols. 13 (12), 2908-2943 (2018).
- Holder, N., et al. Continuous growth of the motor system in the axolotl. Journal of Comparative Neurology. 303 (4), 534-550 (1991).
- Tazaki, A., Tanaka, E. M., Fei, J. F. Salamander spinal cord regeneration: The ultimate positive control in vertebrate spinal cord regeneration. Developmental Biology. 432 (1), 63-71 (2017).
- Albors, A. R., Tanaka, E. M. High-Efficiency Electroporation of the Spinal Cord in Larval Axolotl. Salamanders in Regeneration Research: Methods and Protocols. 1290, 115-125 (2015).
- Albors, A. R., et al. et al Planar cell polarity-mediated induction of neural stem cell expansion during axolotl spinal cord regeneration. eLife. 4, 1-29 (2015).
- Cong, L., et al. Multiplex Genome Engineering Using CRISPR/Cas Systems. Science. 339 (6121), 819-823 (2013).
- Doench, J. G., et al. Optimized sgRNA design to maximize activity and minimize off-target effects of CRISPR-Cas9. Nature Biotechnology. 34 (2), 184-191 (2016).
- Graham, D. B., Root, D. E. Resources for the design of CRISPR gene editing experiments. Genome Biology. 16 (1), 260 (2015).
- Khattak, S., et al. Optimized axolotl (Ambystoma mexicanum) husbandry, breeding, metamorphosis, transgenesis and tamoxifen-mediated recombination. Nature Protocols. 9 (3), 529-540 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon