Method Article
カエノラブディティス ・ エレガンスにおけるドーパミン伝達を評価するスイミング麻痺
要約
スイミングによる麻痺 (SWIP) は確立された行動アッセイ ドーパミン線虫(C. elegans) におけるシグナル伝達の基本的なメカニズムを研究するために使用します。しかし、分析を実行する詳細な方法が欠けています。ここでは、SWIP のステップバイ ステップのプロトコルについて述べる。
要約
このプロトコルで記述されているスイミング アッセイは、シナプスのドーパミンを調整する蛋白質を識別するために有効なツールです。哺乳類と同様に、ドーパミン (DA) はc. の elegans学習や運動の活動を含むいくつかの機能を制御します。DA リリース (アンフェタミン (AMPH) 治療など) を刺激するまたは DA クリアランスを防止する条件 (DA トランスポータを欠けている動物など (dat 1)をニューロンに DA を reaccumulating ことができません) 細胞外 DA の過剰生成最終的に抑制した歩行運動の結果。この動作は、動物は、水中で泳ぐときに特に顕著です。実際には、野生の種類の動物は、長時間泳ぎ続ける、 dat 1 null 変異体と野生型 AMPH で扱われてまたは DA トランスポーターの阻害剤は井戸の底に沈むし、移動しないでください。この現象は、「スイミングによる麻痺」(SWIP) と呼ばれます。SWIP アッセイは十分に確立されたが、法の詳細な説明が欠けています。ここでは、我々 は SWIP を実行するステップバイ ステップ ガイドをについて説明します。アッセイを行う後期幼生段階 4 動物はコントロール ショ糖液 AMPH の有無を含むガラス スポットに配置されます。動物は、株分け業の堅実で可視化によって手動でまたは自動的にカメラで記録することによってマウントの遊泳行動を獲得しています。動画では、スラッシング周波数とヒート マップの形で麻痺の視覚的表現を生成の追跡ソフトウェアを使用しては分析しています。手動および自動の両方のシステムは動物の遊泳能力の簡単に定量化可能な読み出しを保証し、したがってベアリング ドパミン神経系内の変異動物または補助遺伝子スクリーニングを促進します。また、SWIP は AMPH など乱用薬物の作用の機構を解明する使用ことができます。
概要
動物は、さまざまな複雑なシグナリング プロセスによって調整される別の神経伝達物質によって仲介される生得的で複雑な動作を実行します。神経伝達物質ドーパミン (DA) は、学習、運動機能と報酬の処理を含む種を渡って非常に節約された行動を仲介します。
交尾、学習、採餌、運動、産卵など DA によって規制されている多くを含む著しく複雑な動作を示しますのみ 302 ニューロンから成る比較的シンプルでもマップされた神経系と土壌線虫C. elegans、1。 その他の機能、短いライフ サイクルと扱いやすさ、シグナル分子の保全、の中で保存された行動の神経基盤を研究するためのモデルとして線虫を使用する利点を強調表示します。
両性具有者c. の elegansを含む 8 つのドーパミン作動性ニューロン。これらに加えて、雄には交尾目的の六つの追加のペアが含まれます。これらのニューロンは、哺乳類のように DA を合成し、DA トランスポーター (DAT 1)、DA ドーパミン作動性ニューロンにシナプス間隙で解放を輸送するドーパミン作動性ニューロン、排他的に見られる膜蛋白質を表現します。また、合成、包装と DA のリリースの各ステップに関与するタンパク質のほとんどはワームと人間の非常に節約されるのような哺乳類で、DA を調節する給餌行動と線虫2歩行。
線虫は、固体表面上をクロールし、水中における特徴的なスラッシング挙動で泳ぐ。興味深いことに、DAT 1 (dat 1) の表現に欠けている突然変異体は通常固体表面上のクロールが水に漬してスイミングを維持するために失敗します。この現象は、スイミングによる麻痺、あるいは SWIP に名付けられました。前の実験は SWIP が一部では、最終的に overstimulates D2 のようなシナプス後受容体 (DOP 3) シナプス間隙に DA の過剰によって引き起こされることを示した。もともと、 dat 1ノックアウト動物3で同定されたが SWIP で DAT (例えば、イミプラミン4) の妨害活動する薬と扱われる野生型動物観察もや DA リリース (例えば、アンフェタミン5) を誘発します。その一方で、薬理学的または遺伝的操作ダの合成と放出を回避と DOP 3 受容体機能のブロックは SWIP6を防止します。一緒に取られて、これらの既にパブリッシュされたデータがドーパミン作動性シナプス3,4,7内変異蛋白質によって引き起こされる行動への影響を検討し、採用の信頼性の高いツールとして SWIP を確立しています。DA7,8,9,10、11,12をシグナル伝達に関与する新規規制経路を識別するための遺伝的画面に転送します。さらに、生きている動物の行動の薬剤誘発性の容易に定量化可能な読み出しを提供することにより SWIP アンフェタミン (AMPH) のような薬剤の作用機序の解明できアザペロン、ドーパミン作動性のシナプス5,6,13,14,15。
SWIP の試金を実行するプロトコルは、16の前に記載されています。ここでは、方法論と SWIP を効果的に実行するc. の elegansのコミュニティのための視覚的なガイドを提供することを目標に分析を実行するセットアップ詳細に述べる。
プロトコル
1. ソリューションとメディアの準備
- KH2PO4 3.0 g (22.05 mM)、Na2HPO4 6.0 g (42.2 mM) を溶解することにより M9 バッファーを準備と 1 l の脱イオン水をオートクレーブ塩化ナトリウム 5.0 g (85.5 mM)。オートクレーブ滅菌後 1 M MgSO4 (オートクレーブ脱イオン水 100 mL の最終巻で 12 g) の 1.0 mL を追加します。結果 10 x のミックス 100 mL 900 ml のオートクレーブの M9 は 1 x の解決をするため、純水。
- 卵バッファーをするためには、1 l の脱イオン水をオートクレーブ HEPES 6.896 g 塩化ナトリウム (118 mM)、KCl (48 mM)、CaCl2-2 H2O (2 mM)、MgCl2-6 H2O (2 mM) の 0.406 g 0.294 g の 3.578 g と 5.958 g (25 mM) の解散します。7.3 NaOH を使用して pH を調整します。
- 3.8 mL の脱イオン水に 1 mL の 5-6% 亜塩素酸ナトリウム (漂白剤)、10 N NaOH の 180 μ L を追加することによって新鮮な次亜塩素酸ナトリウム/NaOH 溶液を準備します。
- 重さ 60 g ショ糖と 60% ショ糖溶液を作るために 100 mL の最終巻にオートクレーブの脱イオン水に溶解します。
- 200 mM ショ糖を作るためにオートクレーブ脱イオン水 10 mL 中のスクロースの 0.684 g を溶解します。確認し、同じ osmometer を使用して、浸透圧を調整します。遠心チューブ 1.5 mL に 1 ml を作るし、-20 ° C で凍結
- AMPH (分子量 184.75 g/mol) の 0.184 グラムの重量を量るし、100 mM の原液を作るために脱イオン水 10 mL に溶かします。0.5 mM 実用的なソリューションを作るために水の 400 μ L で原液のミックス 2 μ L。
-
栄養成長メディア (NGM) プレートを準備します。
- 塩化ナトリウム (52.65 mM)、ペプトン、バクト寒天、脱イオン水 2 L の三角フラスコに 975 mL 25 g の 20 g のミックス 3 g。液体のサイクルを使用して 1 時間電磁攪拌棒及びオートクレーブ (121 ° C、15 PSI) が含まれます。
- 冷却し、攪拌しながらヒーターにフラスコを置くことによって約 50 ° C に温度を維持します。コレステロール (5 mg/mL のエタノール)、0.5 mL 1 M MgSO4、1 M CaCl2と 1 M カリウム リン酸バッファー、pH 7.4 (KH2PO4108.3 g、K2HPO4 35.6 g 25 mL に 1 mL の 1 mL を追加します。、脱イオン水を 1 L)。
- 100 x 15 mm ペトリ板に 25 mL のピペットし、固めるためメディアを許可します。ボックスに最大 4 週間の 4 ° C で逆さまプレートを格納します。
-
ホストゲノム スープ (LB) スープの準備
- 200 mL 三角フラスコに脱イオン水に LB 粉ミックスの 5 g を溶かします。液体の滅菌を利用した 30 分間オートクレーブ サイクルします。クールダウンにスープを許可します。1-2 週間常温で保存します。
-
NA22 細菌プレートの準備
- グリセロール ストックから NA22エシェリヒア属大腸菌細菌の体積が小さく、LB プレートを連勝し、インキュベート プレート逆さま 37 ° C のインキュベーターで一晩隔離されたコロニーを成長する滅菌ピペット チップまたは滅菌細菌ループを使用します。ピックアップ流体培養基 LB の 1.8 の手順で準備の 200 mL に単一コロニーを紹介し、37 ° C で動揺のプラットホームの一晩成長しましょう。
- プレートをシードするには、ステップ 1.7 前の準備、滅菌ガラス アイス ホッケー用スティックによって広げ NGM プレートの上に細菌培養の 200 μ L を分配します。フードの下で一晩以上を乾燥し、逆さまに 4 ° C で、気密ボックス格納プレートを聞かせてください。
- まつげ/プラチナ ツール ワームをピックアップするために、パスツール ピペットのスーパー接着剤を使用してガラスに厚いまつげやプラチナ フィラメントを接着します。かみそりの刃を使用して角度でまつげの先端をカットします。また、白金フィラメント周りガラス ピペットの先端を溶融するブンゼン バーナーを使用できます。
2. c. の elegansの飼育
注:文化N2C。 線虫の野生型大腸菌NA22 プレートのひずみ。詳細な培養方法は次のとおりです。
-
ワーム文化の準備
- ワームのスターター培養をするためには、栄養の十分な動物を含むプレートから寒天の小片をカットし、1.9 滅菌へらを使用して準備した NA22エシェリヒア属大腸菌細菌プレートに転送。20 ° c のプレートを 3-4 日にインキュベートします。ステレオの顕微鏡の下で視覚的に妊娠の大人の存在を確認します。
-
ワームの同期された人口の準備
- ホヤの瓶を用いた平板周りすべて脱イオン水をオートクレーブに入れることによって、少なくとも 2 プレートから妊娠大人を収集します。そっとワームを取り除くし、使い捨てプラスチック ピペットを使用して 15 mL スチロール円錐管にワームを収集するプレートを旋回します。
- ペレットのワームは、真空ポンプを使用して上清を吸引して 2 分 140 × gで遠心分離の管でスピンダウンまたは実験室の真空を内蔵します。
- 再懸濁します、洗ってオートクレーブ脱イオン水とミックス 140 x gで 2 分間遠心管を記入することによってワーム、上清を吸引、この最後を繰り返すステップ 2 回以上または細菌 (水は、混合すると明確な表示されますからワームがクリアになるまでワーム)。
- ワームのペレットにたてナトリウム次亜塩素酸/水酸化ナトリウム溶液 (手順 1.3) 5 mL を追加し、急速に渦を使用してミックスします。約 4-8 分のロッカーにチューブを孵化させなさい。次亜塩素酸ナトリウム ・水酸化ナトリウム溶液で培養時間ストック ナトリウム次亜塩素酸溶液 (漂白剤) の品質に基づく 4-8 分の間で変動します。
- ガラス顕微鏡スライド上でワームを含む溶液のドロップ (2-50 μ L) を入れて、ワームの換散のための顕微鏡下で 2 分ごとにチェックします。ワームの約 70% が分離すると卵子が放出される、塗り卵バッファー管はステップ 1.2 に用意され、すぐに胚をペレットとワームの死骸 140 × gで 1 分間遠心します。
- 上清を吸引し、チューブを卵のバッファーを持つたびに記入ペレット 3 回以上を洗ってください。1 分 140 x gでスピン ・ ダウンとたびに上澄みを除去します。洗浄の最後には、ペレットが白くなります。
- 最終的な洗浄の後に、30% ショ糖液で死んだ死体から胚を区切ります。ペレットに 5 mL の脱イオン水をオートクレーブ、再懸濁します、1.4 の手順で準備 60% ショ糖 5 mL を追加します。徹底的にミックスし、6 分間 160 × gで遠心分離機します。
- 新鮮な 15 mL の円錐管に上部のメニスカスに浮いている胚を転送するのにガラス パスツール ピペットを使用します。3-4 mL 以上になりません。任意の残りのショ糖を取り外すには、胚を洗って 3 回 3 分間 140 × gで遠心分離によってオートクレーブ水で清とペレットを再 (取り外してチューブを充填) たびに。
- 1 x M9 バッファーで洗浄を繰り返します。最終的な洗浄の後に、M9 の 10 mL にペレットを再懸濁します。L1 幼虫に孵化する卵シェーカー一晩 (以上 14 h) にチューブを残します。ワームは食糧不足するため L1 幼虫に残ります。
- 2 分の 140 × gで遠心分離によっての幼虫によってリリースされた任意のフェロモンを削除するオートクレーブ水で 3 回洗浄 L1 幼虫は、水 1 mL で幼虫を再懸濁します。1:10 を作る水にワームの希釈ピペットのスライド ガラスに 10 μ L ドロップ、観察を履くし、堅実でワームの数をカウントします。2 回これを繰り返し、結果を平均します。
- ピペットは、プレート上の小さなを置くことによって (つまり、以前部屋の温度に持って来られた) NA22 プレート約 1,000 のワームに対応するワームのボリュームを削除します。ドロップが乾くまでハーフ オープン プレートを残してください。プレートをカバーし、上下約 44 48 h またはワームが、顕微鏡下で視覚的に確認として L4 後期までの 20 ° C インキュベーターで孵化させなさい。今、ワームは SWIP をテストする準備ができています。
3. SWIP
注:AMPH と扱われる野生型ワームで SWIP を評価する手動の方法について述べる。また、簡単にワームの追跡とさらに自動化されたワーム トラッカーとハーダウェイら10によって記述されていた以前のトラッキング ソフトウェアを使用してワームの動態解析について述べる.
-
SWIP をテストするための手動の方法
- 分注 40 μ L 200 mOsm/L ショ糖液 0.5 mM AMPH にスポット ガラスの有無。万国実体写真、下まつげやプラチナとワームの 8-10 後半 L4 ステージ選択を選択し、ワーム選択を移動し、解決策に泳ぐまでソリューションを含む板のピックが水没します。井戸の中に拾ったワームの数に注意してください、タイマーを開始、観察、ワーム各分マークの SWIP の出展数を記録します。
- Raw データをスプレッドシートにコピーし、ワーム ワーム試金テストの合計数によって各分で麻痺ワームの数を割ることによって麻痺のパーセントを計算 100 を掛けます。任意のグラフにパーセントの値をコピーし、統計ソフトウェアとプロット パーセント値を Y 軸と X 軸の XY グラフを用いた時間データ フォーマットします。
- 二元続いてコントロール、AMPH グループおよび治療の時間の間で統計的な有意性テストへの事後分析 (例えば、ボンフェローニ事後テスト) を実行します。
-
SWIP の自動分析
- 一度に 1 つのワームの自動解析を実行します。プロトコルを設定するカメラ、ワーム トラッカー ソフトウェアおよび追跡ソフトウェアを実行するためのスクリプトを解析・ ハーダウェイら16の詳細については。
- 簡単に言えば、セクション 3.1.2 で手動の方法で説明したようにまつげを選ぶを利用したガラス スポットに単一後半 L4 段階の両性具有を配置します。時 1 つのワームのスイミング動画を記録し、体曲がりの周波数を計算するワームの追跡ソフトウェアを使用します。
- ワーム スラッシング周波数を取得し、ワーム スラッシング データからヒート マップを生成するトラッキング ソフトウェアで提供されるスクリプトに従います。
結果
AMPH 処理による SWIP アッセイの例を提示します。図 1は、前述のアッセイ セットアップの概略図を示します。マニュアル測定、同期遅延 L4 虫がまつげやプラチナで収集した約 8-10 年齢を選ぶし、ガラス スポット プレート 200 mOsm/L ショ糖 (コントロール ソリューション) の 0.5 mm AMPH ショ糖 40 μ L でいっぱい、SWIP のテストに配置されます。
動物が水泳を停止するとき (すなわち、SWIP を展示)、彼らはすぐに井戸の底に沈むし、移動しないでください。したがって、まだ井戸の底で安定したものと水の水面を泳ぐ動物との間の差別は非常に簡単です。AMPH 治療中 SWIP を徐々 に展示動物数を増加させる一方、ワームのほとんどは少なくとも 10 分間継続的に制御ソリューション泳ぐでテスト。SWIP を展示動物の最大の割合は AMPH 使用1,5,13の濃度に比例します。DAT 1 ノックアウト (dat 1) ワームは、コントロール ソリューションでテストするとき、40-70% ワームは 10 分4,13内 SWIP を展示します。この結果は 0.5 mM AMPH (図 2) で処理された野生型動物で測定麻痺の動物の割合に匹敵します。
蔗糖あるいは AMPH を含むショ糖にさらされた線虫は、観測 (図 2) の最初の分の SWIP を表示されません。ただし、ワームとスクロース処理は 10 分間泳ぎ続ける、間 AMPH と扱われるワームは 66 ± 3% 動物ショー SWIP (図 2) の治療の 2 分後と 10 分後 SWIP を展示する開始します。
コントロールまたは AMPH 治療下でワームのビデオの記録自動解析のためのビデオ録画ソフトウェアを使用して、一度に 1 つのワーム。ワーム スラッシングを追跡するコンピューター追跡ソフトウェアが使用され、結果のデータにインポートし解析ソフトウェアのスーツ。コントロールまたは AMPH に暴露された動物の熱マップのサンプルは、図 3に示す、積極的に緑、赤と麻痺のワームに動物を移動を表示します。
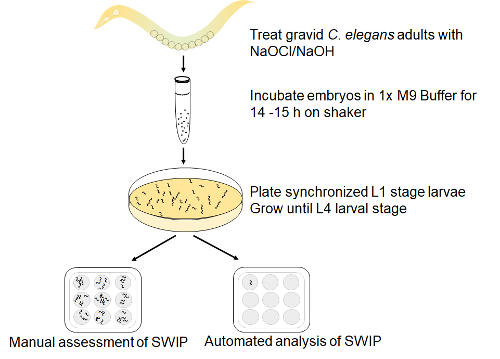
図 1: アッセイ SWIP 設定します。妊娠野生型 (N2) 成虫を胚を解放する次亜塩素酸ナトリウム ・水酸化ナトリウム処理溶解し。胚孵化し、シェーカーで 14 h の M9 バッファーの同期の L1 幼虫に開発許可し、NA22 細菌とシード NGM プレートにメッキし。42-48 時間後後半 L4 期幼虫視覚的に識別での株分け業スポット プレート コントロール ショ糖液でアンフェタミンの有無にまつげを選ぶと選んだし、手動または自動解析により SWIP の得点します。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 手動アッセイを用いたアンフェタミン誘発 SWIP 。蔗糖あるいは 0.5 mM アンフェタミン (AMPH), スクロースのワームが堅実を使用して毎分 SWIP 動作は得点視覚的に。動物展示 SWIP の数で除して計算した割合は、ワームの各時点と掛けて 100 の結果の合計数でワームを麻痺させた。未処理のワーム (赤丸) は、10 分のウィンドウの中に泳ぎ続ける一方 SWIP 増加超過を示す AMPH (青い四角) にさらされるワームの割合。N は、各グループのテスト動物の数を表します。誤差範囲は、手段 (SEM) の標準誤差を示します。統計的有意性を二元ボンフェローニの多重比較検定 (p < 0.0001) を実行することによって評価しました。この図の拡大版を表示するのにはここをクリックしてください。

図 3: 自動解析を介してアンフェタミン誘発 SWIP 。蔗糖あるいは 0.5 mM AMPH とショ糖のワームのビデオは、堅実に取り付けられたカメラを使用して記録しました。個々 のワームのスイミング動画追跡ソフトウェアで追跡され、を用いてソフトウェアのスーツを追跡します。ヒート マップは、赤のエリア表示が積極的に動いているワーム緑豊かなエリアが麻痺したワームを示すデータから生成されました。各実験群は、6 動物の代表です。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
ここでは、線虫の行動分析、SWIP を実行するステップバイ ステップ プロトコルについて述べる。このプロトコルはないの主要な技術的なハードルがこの試金非常にユーザーがフレンドリーなこと、シンプルでわかりやすいです。それにもかかわらず、分析を効果的に実行するために考慮すべきいくつかの重要な側面があります。
食餌療法の制限に影響を与える SWIP17アッセイ用ワームをも供給できるように注意する必要があります。穏やかな換散の中にも、タイミングの次亜塩素酸ナトリウム ・水酸化ナトリウム治療が重要なステップとして、ピッキング (より一般的なプラチナのピックを使用する場合) またはナトリウム次亜塩素酸/水酸化ナトリウム溶液に胚の長時間露光中に外傷はできるだけピッキングしながらワームの処理ワーム18に永久的な損傷を引き起こすし、泳ぐ能力を妥協します。
生殖不能の技術は、汚染を避けるために従う必要があります。寒天版の汚染は動物の健康を危険にさらすし、泳ぐ能力をこのように変更します。SWIP の展示動物の割合のわずかな違いは、異なる系統 (NA22、OP50)エシェリヒア属大腸菌細菌のシード寒天を使用して観察できます。我々 のプロトコル NA22 を使用して、ワームの数が多いを生成します。
SWIP アッセイ中使用されるガラス スポット プレート プラスチック板にので彼らが徹底的に洗浄、オートクレーブでは、薬の種類をテストするときに再使用します。
SWIP アッセイに考慮すべきもう一つの重要な要因は動物にテスト19液体メディアの浸透圧です。プロトコル、以前動物 (ブレイクリー路個人的なコミュニケーション) のための最適な条件を示した 200 mOsm/L までの水の浸透圧をもたらすにショ糖を使用します。それは別の日、週または月単位で実行される複数のアッセイで水質の違いを排除するため、制御された浸透圧で水をお勧めします。特に、 dat 1と AMPH と扱われる野生動物を示さない SWIP メディア コントロールとして塩分を含んだ溶液 (M9 ソリューションなど) を使用する場合。
SWIP を展示する動物のほとんどに必要な時間は少し別のワームの段階 (L1 L4) の間で変更できます。たとえば後 5 分 80% のdat 1 L1 動物はまだ泳ぐ、従って動物の 20% だけを示すこと SWIP Masoudi ら (2014 年) を報告しました。その一方で、L4 dat 1動物の 50% だけはまだ 5 分20後泳ぐ。したがって、動物 SWIP のテストが同じ年齢で試金されることが重要です。我々 は常に後半上演 L4 動物を使用して我々 の分析を最適化してきました。L4 の遅い幼虫ので、この段階で動物、大人のサイズに達しているし、後で自分の体の中央に白い点を分ける特徴的な細い線を表わす他の幼虫の段階の間で容易に認識できるという利点があります。成熟した外陰部に分化します。アッセイの期間も重要です。たとえば、15 分後 L4 dat 1突然変異体の 90% は SWIP を展示、後時間 (30 分)、それらの 60% だけ展示 SWIP20。
自動 SWIP アッセイはヒューマン エラーを排除し、手動の試金に関して高スループット スクリーニングを改善します。ただし、トラッキング ソフトウェア プログラムは、一度に 1 つのワームを追跡するだけすることができますので時間がかかる。
他の線虫DA 依存行動に関して SWIP は少ない時間のかかるタイプの試金は。たとえば、基底減速応答2は即時-タイプの試金ではありません。実際には、ワームが慢性的に薬を供給する必要があり、浸透、オフターゲット効果のおそれがあります。したがって、それは薬の画面に効果的でかもしれない。
SWIP の主要なアプリケーションの 1 つは様々 な薬物を対象とするドーパミン作動性経路の画面です。薬は水溶性 (mazindol など) ではない場合、適切な希釈行わなければならない濃度を達成するためにキャリア ソリューションがワームに有害ではないです。また、同じ薬の濃度は使用5,13,14用量反応曲線には分析がもことができます。たとえば、(動物毎分、図 2の曲線の傾き) の進行の率を濃度の関数として報告し、異なる薬 (例えば、AMPH 対コカイン) の効果を比較するために使用できます。
SWIP をドーパミン作動性シナプスで薬の作用のメカニズムを調査する際、注目される結果は、他の動物に拡張されている場合。例えば、イミプラミン、哺乳類のノルエピネフリントランスポーター (NET) の特異的阻害剤は、N2 動物4DA 仲介 SWIP を誘導するために使用されています。線虫はないエレメンタリー ノルエピネフリンとその結果ネットを表現していません。ただし、線虫DA トランスポーターは哺乳類ネット21と相同性を共有します。このため、哺乳類ネットの特異的阻害剤を哺乳類の DAT (例えば、イミプラミン) の影響が限られた薬はc. の elegansダットに高選択性を表示します。したがって、魚種選択性は、線虫から人間に調査結果を外挿法で推定する当社の能力を制限可能性があります。
SWIP はドパミン神経系により媒介されることを証明する実験の包含 SWIP アッセイの設計が考慮すべき最も重要な要因です。実際には、障害者の水泳は DA システム (例えば、筋肉収縮の欠陥全般) に関連する遺伝子以外の要因によって生成でした。SWIP は確かに DA によって調停されるよう確保するため、プロトコルは、DA を枯渇されている動物実験を含める必要があります。これは、いずれかによって達成することができます猫 2レセルピンと治療前の野生型動物、DA 合成レート制限酵素であるチロシン水酸化酵素の線虫ホモログの発現を欠けてノックアウト動物を使用して、小胞3から DA 枯渇の原因になる薬。例えば、マクドナルドら3はこれらの動物がレセルピンと前処理にdat 1突然変異体にみられる基底 SWIP が回収されたことを示した。SWIP は DA を介することが示唆されました。その一方で、Safratowich et al. (2014)猫 2 dat 1ドーパミン受容体のそれぞれの表現に欠けている突然変異体を使用して、トレース アミン β-フェニルエチルアミン (βPEA) が治療の 1 分以内 SWIP を誘導することを実証独立してリガンド作動性イオンを直接アクティブ化が DA からチャンネルない LGC 5514です。ΒPEA と DA 誘起 SWIP は機械論的に異なる、彼らは簡単に実験的差別されることが明らかとなった。実は、βPEA 誘起 SWIP はダ ・ dop 3-独立した、1 分以内の最大値に到達し、急速に 2 分14後減少、DA を介した SWIP は猫 2とdop 3依存し、本質的にゼロ 1分 (図 2)。したがって、最大の影響に到達するために必要な時間に大きな差があるし、こうとすぐに 2 つの現象を区別する: LGC 55 チャンネルを直接アクティブ化によって得られる 1) の高速 βPEA 誘起 SWIP 1 分以内と 2)、遅い3は過剰に刺激される細胞外 DA の余剰時間をかけてビルド (10-15 分)、DOP 3 DA 受容体と DA を介した SWIP。
結論としては、DA ストレージ (レセルピン) を破壊する薬の使用 ( dop 3 dat 1猫 2) ドパミン神経系の重要なプレーヤー遺伝子ノックアウト動物の用を含む実験の右のセットと SWIP をされています。正常に AMPH5,13のような薬剤の作用機序を解明するために使用 βPEA14,15とアザペロン6。
開示事項
著者が明らかに何もありません。
謝辞
著者は、SWIP の自動分析と指導の博士ランディ ブレイクリー ラボから博士オサマ Refai を感謝したいです。この作品は、LC に NIH R01 DA042156 からの資金によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Aluminum foil | Reynolds wrap | 1091835 | |
| Amphetamine | Sigma | 51-63-8 | |
| Autoclave | |||
| Bacterial Incubator | New Brunswick scientific | M1352-0000 | |
| Bacteriological grade, Agar | Lab Scientific, Inc | A466 | |
| Bacto (TM) Peptone | BD | REF 211677 | |
| Calcium Chloride (dihydrate) | Sigma-Aldrich | C3881 | |
| Camera | Thorlabs | U-CMAD3 | |
| Centrifuge | Eppendorf 5810R 15amp | E215059 | |
| Cholesterol | Sigma-Aldrich | 57-88-5 | |
| Deionized water | Millipore | Z00QSV0WW | Milli-Q |
| Depression glass spot plate | Corning | Corning, Inc. 722085 | |
| Erlenmeyer flask | ThermoFisher | 4103-0250PK | |
| Eye lash | |||
| Glass slide | Fisherbrand | 12-550-15 | |
| Graphing and statistical software | Prism | Graphpad 5 | |
| HEPES | Sigma-Aldrich | RB=H3375 & H7006 | |
| Hypochlorite | Hawkins | Sodium Hypochlorite 4-6%, USP" 1 gal | |
| LB Broth, Miller | Fisher | BP1426 | |
| Magnesium Chloride (Hexahydrate) | Sigma-Aldrich | RB=M0250 | 500 g |
| Magnesium sulfate (heptahydrate) | Sigma-Aldrich | M1880 | |
| Magnetic stir bar | Fisherbrand | 16-800-510 | |
| Microcentrifuge tubes | ThermoFisher | 69715 | |
| NA 22 bacteria | CGC | ||
| Nystatin | Sigma | 1400-61-9 | |
| Osmometer | Advanced Instruments, Inc | Model 3320 | |
| Pasteur Pipettes | Fisherbrand | 13-678-20A | |
| Petriplates | Falcon | 351007 | |
| pH Meter | Orion VersaStar Pro | IS-68X591202-B 0514 | |
| Polystrine conical tubes | Falcon | 352095 | |
| Potassium Chloride | Sigma-Aldrich | P9541 | |
| Potassium dihydrogen phosphate | Sigma-Aldrich | 7778-77-0 | |
| Potassium Phosphate - DIBASIC | Sigma-Aldrich | P-8281 | |
| Potassium Phosphate - MONOBASIC | Sigma-Aldrich | P0662 | |
| Serological pipettes | VWR | 10ml=89130-898 | |
| Shaker | Reliable Scientific | 55S 12x16 | |
| Sodium Chloride | Fisher | RB=BP358-1 | |
| Sodium dihydrogen Phosphate | Fisher | RB=S381 | |
| Spreadsheet | MS office | Microsoft Excel | |
| Stereo Microscope | Zeiss | Model tlb3. 1 stemi2000 | |
| Sterile Pipette tips | Various | 02-707-400 | |
| Sucrose | Sigma-Aldrich | RB=S5016 | |
| Superglue | Loctite | 1647358 .14 oz. | |
| SwimR sofware | 10.18129/B9.bioc.SwimR | ||
| Tracker 2 | Worm Tracker 2.0 | www.mrc-lmb.cam.ac.uk/wormtracker/ | |
| Video recording software | Virtualdub | http://www.virtualdub.org/ |
参考文献
- de Bono, M., Villu Maricq, A. Neuronal Substrates of Complex Behaviors in C. elegans. Annual Review of Neuroscience. 28 (1), 451-501 (2005).
- Sawin, E. R., Ranganathan, R., Horvitz, H. R. C. elegans Locomotory Rate Is Modulated by the Environment through a Dopaminergic Pathway and by Experience through a Serotonergic Pathway. Neuron. 26 (3), 619-631 (2000).
- McDonald, P. W., et al. Vigorous Motor Activity in Caenorhabditis elegans Requires Efficient Clearance of Dopamine Mediated by Synaptic Localization of the Dopamine Transporter DAT-1. Journal of Neuroscience. 27 (51), 14216-14227 (2007).
- Carvelli, L., Blakely, R. D., DeFelice, L. J. Dopamine Transporter/Syntaxin 1A Interactions Regulate Transporter Channel Activity and Dopaminergic Synaptic Transmission. Proceedings of the National Academy of Sciences of the United States of America. 105 (37), 14192(2008).
- Carvelli, L., Matthies, D. S., Galli, A. Molecular mechanisms of amphetamine actions in Caenorhabditis elegans. Molecular Pharmacology. 78 (1), 151-156 (2010).
- Refai, O., Blakely, R. D. Blockade and reversal of swimming-induced paralysis in C. elegans by the antipsychotic and D2-type dopamine receptor antagonist azaperone. Neurochemistry International. , (2018).
- Bermingham, D. P., et al. The Atypical MAP Kinase SWIP-13/ERK8 Regulates Dopamine Transporters through a Rho-Dependent Mechanism. The Journal of Neuroscience. 37 (38), 9288-9304 (2017).
- Nass, R., et al. A genetic screen in Caenorhabditis elegans for dopamine neuron insensitivity to 6-hydroxydopamine identifies dopamine transporter mutants impacting transporter biosynthesis and trafficking. Journal of Neurochemistry. 94 (3), 774-785 (2005).
- Hardaway, J. A., et al. Forward genetic analysis to identify determinants of dopamine signaling in Caenorhabditis elegans using swimming-induced paralysis. G3. 2 (8), Bethesda, Md. 961-975 (2012).
- Hardaway, J. A., et al. Glial Expression of the Caenorhabditis elegans Gene swip-10 Supports Glutamate Dependent Control of Extrasynaptic Dopamine Signaling. Journal of Neuroscience. 35 (25), 9409-9423 (2015).
- Felton, C. M., Johnson, C. M. Dopamine signaling in C. elegans is mediated in part by HLH-17-dependent regulation of extracellular dopamine levels. G3. 4 (6), Bethesda, Md. 1081-1089 (2014).
- Lanzo, A., et al. Silencing of Syntaxin 1A in the Dopaminergic Neurons Decreases the Activity of the Dopamine Transporter and Prevents Amphetamine-Induced Behaviors in C. elegans. Frontiers in Physiology. 9 (576), (2018).
- Safratowich, B. D., Lor, C., Bianchi, L., Carvelli, L. Amphetamine activates an amine-gated chloride channel to generate behavioral effects in Caenorhabditis elegans. The Journal of Biological Chemistry. 288 (30), 21630-21637 (2013).
- Safratowich, B. D., Hossain, M., Bianchi, L., Carvelli, L. Amphetamine Potentiates the Effects of -Phenylethylamine through Activation of an Amine-Gated Chloride Channel. Journal of Neuroscience. 34 (13), 4686-4691 (2014).
- Carvelli, L. Amphetamine activates / potentiates a ligand-gated ion channel. Channels (Austin). 8 (4), 294-295 (2014).
- Hardaway, J. A., et al. et al.An open-source analytical platform for analysis of C. elegans swimming-induced paralysis. Journal of Neuroscience Methods. 232, 58-62 (2014).
- Lüersen, K., Faust, U., Gottschling, D. -C., Döring, F. Gait-specific adaptation of locomotor activity in response to dietary restriction in Caenorhabditis elegans. The Journal of Experimental Biology. 217, Pt 14 2480-2488 (2014).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019(2012).
- Lamitina, S. T., Morrison, R., Moeckel, G. W., Strange, K. Adaptation of the nematode Caenorhabditis elegans. to extreme osmotic stress. American Journal of Physiology-Cell Physiology. 286 (4), 785-791 (2004).
- Masoudi, N., Ibanez-Cruceyra, P., Offenburger, S. -L., Holmes, A., Gartner, A. Tetraspanin (TSP-17) Protects Dopaminergic Neurons against 6-OHDA-Induced Neurodegeneration in C. elegans. PLoS Genetics. 10 (12), 1004767(2014).
- Jayanthi, L. D., et al. The Caenorhabditis elegans gene T23G5.5 encodes an antidepressant- and cocaine-sensitive dopamine transporter. Molecular Pharmacology. 54 (4), 601-609 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved