Method Article
游泳诱导麻痹对线虫多巴胺信号的评价
摘要
游泳诱导麻痹 (SWIP) 是一种成熟的行为检测方法, 用于研究线虫中多巴胺信号的潜在机制.然而, 缺乏一个详细的方法来执行该检测。在这里, 我们描述了 SWIP 的分步协议。
摘要
该方案中描述的游泳检测方法是识别调节多巴胺能突触的蛋白质的有效工具。与哺乳动物类似, 多巴胺 (DA) 控制着线虫的多种功能, 包括学习和运动活动。刺激 DA 释放 (例如, 安非他明 (AMPH) 处理) 或阻止 DA 清除的条件 (例如, 缺乏 DA 转运体 (dat-1)的动物无法将 da 重新积累到神经元中) 会产生过量的细胞外 da最终导致抑制运动。当动物在水中游泳时, 这种行为尤其明显。事实上, 虽然野生类型的动物继续游泳很长一段时间, dat-1空突变体和野生类型处理的 amph 或 da 转运体抑制剂下沉到井底, 不移动。这种行为被称为 "游泳诱发麻痹" (SWIP)。虽然 SWIP 检测已经建立, 但缺乏对该方法的详细描述。在这里, 我们介绍了执行 SWIP 的分步指南。为了进行检测, 将幼虫后期阶段-4 动物放置在含有控制蔗糖溶液的玻璃光板中, 无论是否有 AMPH。动物的游泳行为得分, 或者通过立体镜下的可视化, 或者通过使用安装在立体镜上的相机自动录制。然后使用跟踪软件对视频进行分析, 该软件以热图的形式直观地表示了撞击频率和瘫痪。手动和自动化系统都保证了动物游泳能力的容易量化读数, 从而便于筛选多巴胺能系统内带有突变的动物或辅助基因。此外, 社会福利和儿童保护方案可用于阐明 AMPH 等滥用药物的行动机制。
引言
动物执行各种先天和复杂的行为, 这些行为由复杂的信号转导过程协调的不同神经递质介导。神经递质多巴胺 (DA) 介导不同物种高度保守的行为, 包括学习、运动功能和奖励处理。
土壤线虫的神经系统相对简单, 只有302个神经元, 表现出明显复杂的行为, 包括许多由 da 调节的行为, 如交配、学习、觅食、运动和产蛋1. 除其他特点外, 寿命周期短、处理方便和信号分子的守恒, 突出了使用线虫作为研究保守行为的神经基础的模型的优势。
雌雄同体线虫含有8个多巴胺能神经元;除此之外, 雄性还为交配目的多了六个对。与哺乳动物一样, 这些神经元合成 DA 并表达 da 转运体 (DAT-1), 这是一种单不在多巴胺能神经元中的膜蛋白, 它将突触裂隙中释放的 DA 转运回多巴胺能神经元。此外, 在 DDA 的合成、包装和释放的每一步中, 大多数蛋白质都是高度保守的, 在蠕虫和人类之间, 与哺乳动物一样, da 调节线虫2 中的喂养行为和运动。
线虫在固体表面上爬行, 并在水中游泳, 具有特有的撞击行为。有趣的是, 缺乏 dat-1 (dat-1) 表情的突变体在固体表面上正常爬行, 但在水中浸泡时无法维持游泳。这种行为被称为游泳引起的麻痹, 或 SWIP。先前的实验表明, SWIP 在一定程度上是由突触裂隙中的 DA 过多引起的, 最终过度刺激 D2 样突触后受体 (DOP-3)。虽然最初是在dat-1型淘汰赛动物 3中发现的, 但在使用阻止 dat 活性的药物 (例如, imipamine4) 和/或诱导 da 释放 (例如苯丙胺5) 的药物治疗的野生类型动物中也观察到了 swip。另一方面, 避免 da 的合成和释放以及阻断 DOP-3 受体功能的药理或遗传操作可以防止 SWIP6。总之, 这些已经公布的数据已经确定了 swip 作为一个可靠的工具, 研究突变蛋白在多巴胺能突触 3,4,7和用于前基因屏幕, 用于识别涉及 da 信号7、8、9、10、11、12 的新调控途径。此外, 通过提供药物诱导的活体动物行为的易于量化的读数, swip 可以阐明药物 (如安非他明 (AMPH) 和偶酮类药物在多巴胺能突触5的作用机制,6,13,14,15岁
执行 SWIP 检测的协议已在16之前描述过。在这里, 我们详细介绍了执行检测的方法和设置, 目的是为线虫社区提供一个视觉指南, 以有效地执行 swip。
研究方案
1. 解决方案和媒体的准备
- 在1升蒸压去离子水中溶解 kh 2 po 4 3.0 g (22.05 mm)、na 2 hpo4 6.0 g (42.2 mm) 和 nacl 5.0 g (85.5 mm) 制备 mM 缓冲液.高压灭菌后加入 1 M MgSO4 1.0 ml (1 毫升, 最终体积为100毫升蒸压去离子水)。将产生的 10x ML 的100毫升与蒸压去离子水的900毫升混合, 制成1x 溶液。
- 要做鸡蛋缓冲液, 溶解6.896 克氯化钠 (118 mM), 3.5 78 克 KCl (48 mM), 0.294 克 Ccl-2H 2o (2 毫米),0.294 克 mgcl 2-6h2o (2 毫米) 和 5.958 g Gpes 的 hes 在 1 l 的蒸压去离子水.使用 NaOH 将 pH 值调整为7.3。
- 加入5-6 次氯酸钠 (漂白剂) 和 180μl 10 n naoh 至3.8 毫升去离子水, 制备新鲜的次氯酸钠/NaOH 溶液。
- 称量60克蔗糖, 溶于蒸压去离子水, 最终体积为100毫升, 使60% 的蔗糖溶液。
- 将0.684 克蔗糖溶解在蒸压脱离子水的10毫升中, 制成 200 mM 蔗糖。使用温度计检查并调整到相同的渗透率。在 1.5 mL 微离心管中制造1毫升的, 并在-20°c 下冷冻。
- 称量0.184 克 AMPH (分子量 184.75 g/mol), 溶于10毫升的去离子水, 制成 100 mM 的库存溶液。将库存溶液的2Μl 混合在400Μl 的水中, 制成 0.5 mM 的工作溶液。
-
准备营养生长介质 (NGM) 板
- 将3克氯化钠 (52.65 mM)、20克肽、25克巴氏琼脂和975毫升的去离子水混合在一个2升的 Erlenmeyer 烧瓶中。包括磁搅拌杆和高压灭菌器 (121°c, 15 PSI), 使用液体循环1小时。
- 搅拌时将烧瓶放在加热器上, 将温度冷却至50°c 左右并保持在50°c 左右。加入 0.5 mL 胆固醇 (乙醇中的 5 Mg/2)、1 m MgSO4的 1 ml、1 m Ccl2的 1 ml 和 1 m 磷酸钾缓冲液的 25 ml, ph 值 7.4 (kh 2 po4的108.3 克, K2hpo4的35.6 克, 去离子水到1升)。
- 移液器25毫升, 分别进入100毫米 x 15 毫米 Petri 板, 并允许介质凝固。将盘子倒置在4°c 的盒子里, 最长可存放4周。
-
溶菌液汤 (LB) 汤的制备
- 在 Erlenmeyer 烧瓶中的去离子水中溶解5克 LB 粉末混合物。利用液体灭菌循环进行30分钟的高压灭菌。让肉汤冷却下来。在室温下存放1-2周。
-
NAV 细菌板的制备
- 使用无菌移液器尖端或无菌细菌循环, 从甘油库存中使用少量 N22 e. k感冒细菌的 lb 板, 并在37°c 的孵化器中倒置, 在37°c 的孵化器中过夜, 以生长孤立的菌落。选择并引入一个单一的菌落到步骤1.8 中准备的200毫升的 lb 肉汤中, 让它在37°c 的晃动平台上连夜生长。
- 为了给盘子播种, 将200μl 的细菌培养物分配到步骤1.7 中先前准备的 NGM 板上, 并用无菌玻璃曲棍球棒进行传播。让盘子在引擎盖下连夜或更长时间干燥, 并在4°C 的密闭箱中倒置存放。
- 要使睫毛白金工具拾取蠕虫, 用超级胶水将厚厚的睫毛或铂金长丝粘入玻璃巴斯德移液器中。用剃须刀片以一定角度切割睫毛的尖端。此外, 本森燃烧器也可用于在铂金灯丝周围熔化玻璃移液器的尖端。
2.线虫畜牧业
请注意:培养野生N2c.线虫对大肠杆菌n22 板的应变。详细的培养方法如下所述。
-
蠕虫培养的准备
- 为了使蠕虫的发酵剂培养, 从含有良好喂养动物的盘子中切下一小块琼脂, 然后将其转移到步骤1.9 中使用无菌铲子制备的 N22大肠杆菌板上。在20°c 下将板材孵化3-4天。在立体显微镜下, 视觉上确认妊娠成年人的存在。
-
蠕虫同步种群的制备
- 收集妊娠成人从至少2个盘子通过分配高压水的除离子水周围的板使用一个喷瓶。用一次性塑料移液器轻轻旋转盘子, 将蠕虫移出, 并将蠕虫收集到15毫升的聚苯乙烯锥形管中。
- 在 140 x g 的离心机中旋转管 2分钟, 使蠕虫产生颗粒, 然后使用真空泵或在实验室真空中吸气。
- 用高压灭菌的去离子水灌满试管, 然后在 140 x g的情况下混合和离心剂 2分钟, 吸吸上清液, 再重复两次最后一步, 或者直到蠕虫从细菌中清除 (混合时, 水看起来很清澈)与蠕虫)。
- 在蜗杆颗粒中加入5毫升新鲜制成的次氯酸钠/naoh 溶液 (步骤 1.3), 利用涡流快速混合。将管子在摇杆上加氢约4-8。根据次氯酸钠溶液 (漂白剂) 的质量, 用次氯酸钠/naoh 溶液孵育的时间在4-8 之间波动。
- 在玻璃显微镜幻灯片上放置一滴含有蠕虫的溶液 (2-50μl), 并在显微镜下每2分钟检查一次蠕虫裂解。当大约70% 的蠕虫被裂解并释放卵子时, 在管中加入步骤1.2 中准备的鸡蛋缓冲液, 并立即离心 1分钟, 在 140 x克的情况下, 以颗粒的胚胎和蠕虫尸体。
- 每次在试管中灌满鸡蛋缓冲液, 再吸上清液, 并再清洗3次颗粒。以 140 x g的速度向下旋转 1分钟, 每次取出上清液。小球在洗完的时候变白了。
- 最后清洗后, 将胚胎与已死亡的尸体分离在30% 的蔗糖溶液中。在颗粒中加入5毫升蒸压去离子水, 重新悬浮并加入步骤1.4 中制备的60% 蔗糖5毫升。以 160 x g的速度彻底混合离心, 每次6分钟。
- 使用玻璃巴斯德移液器将漂浮在上半月板上的胚胎转移到一个新鲜的15毫升锥形管中。不要服用超过3-4 毫升。要去除任何剩余的蔗糖, 请用蒸压水清洗胚胎 3次, 每次以 140 x g 离心 3分钟, 取出上清液并重新悬浮颗粒 (并填充管)。
- 使用 1x M9 缓冲区重复清洗。最后清洗后, 重新悬浮 mL 10 毫升的颗粒。将试管放在摇床上过夜 (不超过 1 4小时), 让鸡蛋孵化成 l 1 幼虫。由于缺乏食物, 蠕虫仍将停留在 L1 幼虫阶段。
- 用蒸压水清洗 L1 幼虫 3次, 以清除幼虫释放的任何信息素, 在 140 x g 的时间内离心 2分钟. 在1毫升的水中重新移植幼虫。对水中的蠕虫进行1:10 稀释, 将移液器滴在玻璃滑梯上 10Μl, 在立体镜下放置覆盖物并计算蠕虫的数量。重复这一遍, 并平均结果。
- 将相当于大约 1, 000只蠕虫的蠕虫体积移到 NAV 板上 (以前被带到室温下), 方法是在板上放置小滴。把盘子开半开, 直到水滴干涸。然后将板材覆盖, 倒置在20°c 的孵化器中, 约44-48 或直到蠕虫达到后期 L4 阶段, 在立体显微镜下直观地证实了这一点。现在蠕虫已准备好进行 SWIP 测试。
3. SWIP
请注意:我们描述了人工评估使用 AMPH 处理的野生蠕虫中的 SWIP 的方法。我们还简要讨论了蠕虫的跟踪和蠕虫动力学的进一步分析使用自动蠕虫跟踪器和跟踪软件, 以前描述的 Hardaway 等人。
-
用于 SHIP 测试的手动方法
- 将具有或不具有 0.5 mm AMPH 的 200 msml 蔗糖溶液的40Μl 的液体进入玻璃光斑板。在立体镜下, 选取带有睫毛或铂金的8-10 后期蠕虫, 并将含有溶液的拾取物淹没在盘子中, 直到蠕虫离开拾取物并游入溶液中。注意进入井中的蠕虫数量, 启动计时器, 观察并记录每分钟显示 SWIP 的蠕虫数量。
- 将原始数据复制到电子表格中, 并通过将每分钟瘫痪的蠕虫数量除以在整个检测过程中测试的蠕虫总数计算瘫痪的蠕虫百分比, 并乘以100。将百分比值复制到任何图形和统计软件中, 并使用 XY 图形格式在 Y 轴上绘制具有百分比值的数据和 X 轴上的时间。
- 进行双向方差分析, 然后进行事后分析 (例如, 邦费罗尼测试后), 以测试控制、AMPH 组和治疗时间之间的统计意义。
-
SWIP 的自动化分析
- 一次对单个蠕虫执行自动分析。《 Hardaway 》等对摄像机的设置协议、蠕虫跟踪器软件和运行跟踪软件分析的脚本进行了详细的描述.
- 简单地说, 将单个后期 L4 级雌雄同体放入玻璃光斑板中, 使用睫毛拾取, 如3.1.2 部分中的手动方法所述。记录一个蠕虫的游泳视频的时间, 并使用蠕虫跟踪器软件来计算身体弯曲的频率。
- 按照跟踪软件提供的脚本获取蠕虫跟踪频率, 并从蠕虫冲击数据生成热图。
结果
我们提供了一个由 AMPH 治疗诱导的 SWIP 检测的例子。图 1显示了上述检测设置的示意图。对于手动检测, 约8-10 同步的后期 L4 级蠕虫收集睫毛或铂素拾取, 并放置在玻璃光斑板中, 其中装有40μl 的 200 MOMSML 蔗糖 (控制溶液) 或蔗糖, 并进行了甜甜量测试。
当动物停止游泳 (即, 表现出 SWIP) 时, 它们会迅速沉入井底, 不动。因此, 仍然在水面上游泳的动物与在井底稳定游泳的动物之间的歧视是非常直接的。在控制溶液中测试的蠕虫大多连续游泳至少 10分钟, 而在 AMPH 处理下, 显示 SWIP 的动物数量逐渐增加。显示 swip 的动物的最大百分比与使用的 amph 浓度成正比, 使用的是1,5,13。当 dat-1 敲除 (dat-1) 蠕虫在控制溶液中进行测试时, 40-70% 的蠕虫在 10分钟4,13内表现出 swip。这一结果与使用 0.5 mM AMPH 处理的野生动物中测量的瘫痪动物的百分比相当 (图 2)。
在观察的第一分钟, 暴露在含有 AMPH 的蔗糖或蔗糖中的蠕虫不会显示 SWIP (图 2)。然而, 当经过蔗糖处理的蠕虫继续游泳10分钟时, 使用 AMPH 处理的蠕虫在经过2分钟的治疗后开始显示 SWIP, 10分钟后, 66±3% 的动物显示 SWIP (图 2)。
对于自动分析, 控制下蠕虫或 AMPH 处理的视频使用视频录制软件一次录制一个蠕虫。计算机跟踪软件用于跟踪蠕虫跟踪, 并将生成的数据导入到软件套件中并进行分析。图 3显示了暴露在对照或 amph 中的动物的热图样本, 显示了红色和瘫痪蠕虫中的主动移动动物。
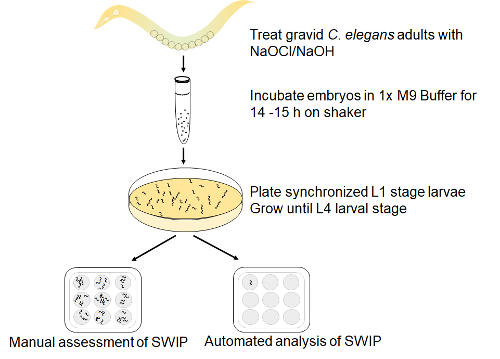
图 1: 为 SWIP 设置的检测.用次氯酸钠/naoh 法裂解妊娠成虫 (N2) 蠕虫, 释放胚胎。胚胎被允许在振动台上的 M9 缓冲液中孵化并发育成同步的 L1 幼虫, 时间为 14小时, 然后镀在用 NA22 细菌播种的 NGM 板上。42-48 后, 在立体镜下观察后, 对 L4 期幼虫进行了视觉鉴定, 并在控制蔗糖溶液中, 用睫毛采摘到有苯丙胺或没有苯丙胺的明板中, 并通过手动或通过自动分析为 SWIP 打分。请点击这里查看此图的较大版本.

图 2: 安非他明诱导的 swip 使用人工检测.用立体镜对 0.5 mM 安非他明 (AMPH) 的蔗糖或蔗糖中的蠕虫进行每分钟的 SWIP 行为的视觉评分。显示 SWIP 的动物百分比是通过将瘫痪蠕虫的数量除以每个时间点检测的蠕虫总数, 然后将结果乘以100来计算的。暴露在显示 SWIP 的 AMPH (蓝色方块) 中的蠕虫所占百分比会增加加班时间, 而未经处理的蠕虫 (红色圆圈) 则在10分钟的窗口中继续游泳。N 表示每个组中测试的动物数量。错误条表示手段的标准错误 (SEM)。采用邦费罗尼多重对比试验 (p < 0.0001) 进行双向方差分析, 对统计意义进行了评价。请点击这里查看此图的较大版本.

图 3: 通过自动分析, 由苯丙胺引起的社会经济政策.使用安装在立体显微镜上的相机记录了含有 0.5 mM AMPH 的蔗糖或蔗糖蠕虫的视频。使用跟踪软件对单个蠕虫的游泳视频进行跟踪, 并使用跟踪软件程序进行分析。从红色区域显示正在积极移动的蠕虫的数据中生成了热图, 绿色区域显示蠕虫瘫痪。每个实验组代表6只动物。请点击这里查看此图的较大版本.
讨论
在这里, 我们描述了一个分步的协议, 以执行行为分析, swip, 在c. elegans。这个协议简单而直接, 没有重大的技术障碍, 使这种检测非常方便用户。然而, 为了有效地进行检测, 还需要考虑一些关键的方面。
应注意确保用于检测的蠕虫吃得很好, 因为饮食限制会影响 SWIP17。在采摘过程中对蠕虫进行温和处理, 以及在裂解过程中及时处理次氯酸钠/naoh 治疗是关键的步骤, 因为采摘过程中的创伤 (使用铂采摘时更常见) 或胚胎长时间接触次氯酸钠对18岁的蠕虫造成永久性损害, 从而损害它们的游泳能力。
应遵循无菌技术, 以避免污染。琼脂板的污染损害了动物的健康, 从而改变了它们的游泳能力。使用不同菌株的大肠杆菌 (NA22、OP50 等) 播种的琼脂板可以观察到显示 SWIP 的动物比例略有差异。在我们的协议中, 我们使用 N22 产生大量的蠕虫。
在 SWIP 检测过程中使用的玻璃光斑板比塑料板更受欢迎, 因为在测试不同类型的药物时, 可以彻底清洗、高压灭菌和再使用。
在 SWIP 检测中需要考虑的另一个重要因素是对动物进行测试的液体介质的渗透性19。在我们的协议中, 我们使用蔗糖使水的渗透性达到 200 momsmel, 这以前被证明是动物的最佳条件 (Blakely RD. 个人通信)。有控制渗透性的水是首选, 因为它消除了在不同的日子、几周或几个月内进行的多次检测中水质可能存在的差异。值得注意的是, 如果使用盐溶液 (例如 M9 溶液) 作为控制介质, 使用 AMPH 处理的dat-1和野生类型动物不会显示 swip。
大多数动物展示 SWIP 所需的时间在不同的蠕虫阶段 (L1-l4) 之间可能略有变化。例如, Masoudi 等人 (2014年) 报告说, 5分钟后, 80% 的dat-1 l1 动物仍在游泳, 因此只有20% 的动物表现出 swip。另一方面, 只有50% 的 L4 dat-1动物在5分20秒后仍在游泳.因此, 重要的是在同一年龄对接受 SWIP 测试的动物进行检测。我们已经优化了我们的检测使用总是晚 L4 阶段的动物。晚 L4 幼虫的优点是在其他幼虫阶段中很容易辨认, 因为在这个阶段, 动物已经达到了它们的成虫大小, 并表现出一条独特的细线, 将在他们的身体中心的白斑, 以后会分化为成熟的外阴。该分析的时间跨度也是至关重要的。例如, 在15分钟后, 90% 的 l4 dat-1 突变体表现出 swip, 但在稍后 (30分钟), 只有60% 的突变体显示 swip20。
自动化的 SWIP 检测消除了人为错误, 并改进了与手动检测有关的高通量筛选。但是, 跟踪软件程序非常耗时, 因为它们一次只能跟踪单个蠕虫。
对于其他与线虫da 相关的行为, swip 是一种耗时较少的检测类型。例如, 基底减速反应 2不是一种即时类型的检测。事实上, 蠕虫需要长期用这些药物喂养, 这可能会产生穿透性和非目标效应。因此, 筛查药物可能没有那么有效。
SWIP 的主要应用之一是筛选针对多巴胺能途径的各种药物。在药物不溶于水的情况下 (例如, mazindol), 应进行适当的稀释, 以达到载体溶液对蠕虫没有毒性的浓度。此外, 如果使用不同浓度的同一药物 5,13,14, 剂量-反应曲线也可以分析。例如, 进展率 (动物曲线的斜率,图 2) 可以报告为浓度的函数, 并用于比较不同药物 (例如, amph 与可卡因) 的影响。
当 SWIP 被用来研究药物在多巴胺能突触中的作用机制时, 如果结果扩大到其他动物, 则应注意。例如, 伊米帕明, 一种特定的抑制剂的哺乳动物去甲肾上腺素转运体 (NET) 已被用来诱导 Da-中间 SWIP 在 N2 动物4。线虫不合成去甲肾上腺素, 因此不表示 net。然而,线虫da 运输机与哺乳动物网21共享同源。因此, 作为哺乳动物 net 的特异性抑制剂并对哺乳动物 DAT (例如, 伊米普拉明) 的影响有限的药物对线虫dat 具有很高的选择性。因此, 物种选择性可能会限制我们将研究结果从线虫推断给人类的能力。
在设计 SWIP 检测时需要考虑的最重要因素是纳入了证明 SWIP 是由多巴胺能系统介导的实验。事实上, 游泳障碍可能是由与 DA 系统相关的基因以外的其他因素产生的 (例如, 肌肉收缩的一般缺陷)。为确保 SWIP 确实由 DA 介导, 协议应包括对 DA 已耗尽的动物进行的实验。这可以通过使用缺乏猫-2 表达的敲除动物、酪氨酸羟化酶的线虫同源物 (用于da 合成的限速酶), 或者通过用利血平对野生动物进行预处理,导致囊泡3产生的 da 消耗的药物。例如, McDonald 等人3日表示, 在使用利血平对 dat-1突变体进行预处理时, 可以找到观察到的基部 swip。这一结果表明, SWIP 是 DA 介导的。另一方面, 使用cat-2、 dat-1和缺乏每一种多巴胺能受体表达的突变体, safratowich 等人 (2014年) 证明, 微量胺β-苯乙胺 (β pea) 在治疗后1分钟内诱导 swip独立于 DA, 但通过直接激活的配口离子通道 LGC-5514。作者表明, Β-pea 和 da 诱导的 SWIP 在机械上是不同的, 它们很容易在实验上受到区分。事实上, 虽然Β-pea 诱导的 SWIP 是da-d-3 无关的, 但它在1分钟内达到最大值, 在 2分钟14分钟后迅速下降, DA 介导的 swip 是cat-2和dop-3依赖, 在1分钟后基本上为零分钟 (图 2)。因此, 达到最大效果所需的时间差别很大, 这使得可以快速区分这两种现象: 1) 快速β诱导的 SWIP 在1分钟内通过直接激活 LGC-55 通道获得和 2) 慢速Da 介导的 SWIP, 当细胞外 DA 的剩余积累随着时间的推移 (10-15) 和 DA 受体 DOP-3 被过度刺激3时发生。
总之, 通过正确的实验, 包括多巴胺能系统的关键参与者基因 (cat-2, dat-1, cat-2) 的敲除动物的使用, 以及药物消耗 da 存储 (利血平) 的使用, swip 已被成功地用于阐明 amph5、13、βpea14、15和偶氮酮6等药物的作用机制。
披露声明
作者没有什么可透露的。
致谢
作者要感谢兰迪·布莱克利博士实验室的 Osama Refai 博士对 SWIP 的自动化分析提供的指导。这项工作得到了国家卫生研究院 R01 DA042156 到 LC 的资助。
材料
| Name | Company | Catalog Number | Comments |
| Aluminum foil | Reynolds wrap | 1091835 | |
| Amphetamine | Sigma | 51-63-8 | |
| Autoclave | |||
| Bacterial Incubator | New Brunswick scientific | M1352-0000 | |
| Bacteriological grade, Agar | Lab Scientific, Inc | A466 | |
| Bacto (TM) Peptone | BD | REF 211677 | |
| Calcium Chloride (dihydrate) | Sigma-Aldrich | C3881 | |
| Camera | Thorlabs | U-CMAD3 | |
| Centrifuge | Eppendorf 5810R 15amp | E215059 | |
| Cholesterol | Sigma-Aldrich | 57-88-5 | |
| Deionized water | Millipore | Z00QSV0WW | Milli-Q |
| Depression glass spot plate | Corning | Corning, Inc. 722085 | |
| Erlenmeyer flask | ThermoFisher | 4103-0250PK | |
| Eye lash | |||
| Glass slide | Fisherbrand | 12-550-15 | |
| Graphing and statistical software | Prism | Graphpad 5 | |
| HEPES | Sigma-Aldrich | RB=H3375 & H7006 | |
| Hypochlorite | Hawkins | Sodium Hypochlorite 4-6%, USP" 1 gal | |
| LB Broth, Miller | Fisher | BP1426 | |
| Magnesium Chloride (Hexahydrate) | Sigma-Aldrich | RB=M0250 | 500 g |
| Magnesium sulfate (heptahydrate) | Sigma-Aldrich | M1880 | |
| Magnetic stir bar | Fisherbrand | 16-800-510 | |
| Microcentrifuge tubes | ThermoFisher | 69715 | |
| NA 22 bacteria | CGC | ||
| Nystatin | Sigma | 1400-61-9 | |
| Osmometer | Advanced Instruments, Inc | Model 3320 | |
| Pasteur Pipettes | Fisherbrand | 13-678-20A | |
| Petriplates | Falcon | 351007 | |
| pH Meter | Orion VersaStar Pro | IS-68X591202-B 0514 | |
| Polystrine conical tubes | Falcon | 352095 | |
| Potassium Chloride | Sigma-Aldrich | P9541 | |
| Potassium dihydrogen phosphate | Sigma-Aldrich | 7778-77-0 | |
| Potassium Phosphate - DIBASIC | Sigma-Aldrich | P-8281 | |
| Potassium Phosphate - MONOBASIC | Sigma-Aldrich | P0662 | |
| Serological pipettes | VWR | 10ml=89130-898 | |
| Shaker | Reliable Scientific | 55S 12x16 | |
| Sodium Chloride | Fisher | RB=BP358-1 | |
| Sodium dihydrogen Phosphate | Fisher | RB=S381 | |
| Spreadsheet | MS office | Microsoft Excel | |
| Stereo Microscope | Zeiss | Model tlb3. 1 stemi2000 | |
| Sterile Pipette tips | Various | 02-707-400 | |
| Sucrose | Sigma-Aldrich | RB=S5016 | |
| Superglue | Loctite | 1647358 .14 oz. | |
| SwimR sofware | 10.18129/B9.bioc.SwimR | ||
| Tracker 2 | Worm Tracker 2.0 | www.mrc-lmb.cam.ac.uk/wormtracker/ | |
| Video recording software | Virtualdub | http://www.virtualdub.org/ |
参考文献
- de Bono, M., Villu Maricq, A. Neuronal Substrates of Complex Behaviors in C. elegans. Annual Review of Neuroscience. 28 (1), 451-501 (2005).
- Sawin, E. R., Ranganathan, R., Horvitz, H. R. C. elegans Locomotory Rate Is Modulated by the Environment through a Dopaminergic Pathway and by Experience through a Serotonergic Pathway. Neuron. 26 (3), 619-631 (2000).
- McDonald, P. W., et al. Vigorous Motor Activity in Caenorhabditis elegans Requires Efficient Clearance of Dopamine Mediated by Synaptic Localization of the Dopamine Transporter DAT-1. Journal of Neuroscience. 27 (51), 14216-14227 (2007).
- Carvelli, L., Blakely, R. D., DeFelice, L. J. Dopamine Transporter/Syntaxin 1A Interactions Regulate Transporter Channel Activity and Dopaminergic Synaptic Transmission. Proceedings of the National Academy of Sciences of the United States of America. 105 (37), 14192(2008).
- Carvelli, L., Matthies, D. S., Galli, A. Molecular mechanisms of amphetamine actions in Caenorhabditis elegans. Molecular Pharmacology. 78 (1), 151-156 (2010).
- Refai, O., Blakely, R. D. Blockade and reversal of swimming-induced paralysis in C. elegans by the antipsychotic and D2-type dopamine receptor antagonist azaperone. Neurochemistry International. , (2018).
- Bermingham, D. P., et al. The Atypical MAP Kinase SWIP-13/ERK8 Regulates Dopamine Transporters through a Rho-Dependent Mechanism. The Journal of Neuroscience. 37 (38), 9288-9304 (2017).
- Nass, R., et al. A genetic screen in Caenorhabditis elegans for dopamine neuron insensitivity to 6-hydroxydopamine identifies dopamine transporter mutants impacting transporter biosynthesis and trafficking. Journal of Neurochemistry. 94 (3), 774-785 (2005).
- Hardaway, J. A., et al. Forward genetic analysis to identify determinants of dopamine signaling in Caenorhabditis elegans using swimming-induced paralysis. G3. 2 (8), Bethesda, Md. 961-975 (2012).
- Hardaway, J. A., et al. Glial Expression of the Caenorhabditis elegans Gene swip-10 Supports Glutamate Dependent Control of Extrasynaptic Dopamine Signaling. Journal of Neuroscience. 35 (25), 9409-9423 (2015).
- Felton, C. M., Johnson, C. M. Dopamine signaling in C. elegans is mediated in part by HLH-17-dependent regulation of extracellular dopamine levels. G3. 4 (6), Bethesda, Md. 1081-1089 (2014).
- Lanzo, A., et al. Silencing of Syntaxin 1A in the Dopaminergic Neurons Decreases the Activity of the Dopamine Transporter and Prevents Amphetamine-Induced Behaviors in C. elegans. Frontiers in Physiology. 9 (576), (2018).
- Safratowich, B. D., Lor, C., Bianchi, L., Carvelli, L. Amphetamine activates an amine-gated chloride channel to generate behavioral effects in Caenorhabditis elegans. The Journal of Biological Chemistry. 288 (30), 21630-21637 (2013).
- Safratowich, B. D., Hossain, M., Bianchi, L., Carvelli, L. Amphetamine Potentiates the Effects of -Phenylethylamine through Activation of an Amine-Gated Chloride Channel. Journal of Neuroscience. 34 (13), 4686-4691 (2014).
- Carvelli, L. Amphetamine activates / potentiates a ligand-gated ion channel. Channels (Austin). 8 (4), 294-295 (2014).
- Hardaway, J. A., et al. et al.An open-source analytical platform for analysis of C. elegans swimming-induced paralysis. Journal of Neuroscience Methods. 232, 58-62 (2014).
- Lüersen, K., Faust, U., Gottschling, D. -C., Döring, F. Gait-specific adaptation of locomotor activity in response to dietary restriction in Caenorhabditis elegans. The Journal of Experimental Biology. 217, Pt 14 2480-2488 (2014).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019(2012).
- Lamitina, S. T., Morrison, R., Moeckel, G. W., Strange, K. Adaptation of the nematode Caenorhabditis elegans. to extreme osmotic stress. American Journal of Physiology-Cell Physiology. 286 (4), 785-791 (2004).
- Masoudi, N., Ibanez-Cruceyra, P., Offenburger, S. -L., Holmes, A., Gartner, A. Tetraspanin (TSP-17) Protects Dopaminergic Neurons against 6-OHDA-Induced Neurodegeneration in C. elegans. PLoS Genetics. 10 (12), 1004767(2014).
- Jayanthi, L. D., et al. The Caenorhabditis elegans gene T23G5.5 encodes an antidepressant- and cocaine-sensitive dopamine transporter. Molecular Pharmacology. 54 (4), 601-609 (1998).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。